Zyvox 600mg Linezolid Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Zyvox 600mg och hur används det?
Zyvox är ett receptbelagt läkemedel som används för att behandla symtom på bakteriella infektioner som lunginflammation, hudinfektioner och infektioner som är resistenta mot andra antibiotika. Zyvox 600mg kan användas ensamt eller tillsammans med andra läkemedel.
Zyvox tillhör en klass av läkemedel som kallas antibiotika, andra; Oxazolidinoner.
Det är inte känt om Zyvox är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Zyvox?
Zyvox kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad i ansiktet eller halsen,
- allvarlig hudreaktion,
- feber,
- öm hals,
- brännande ögon,
- smärta i huden,
- röda eller lila hudutslag med blåsor och fjällning,
- synproblem,
- förändringar i din syn,
- svåra magsmärtor,
- diarré som är vattnig eller blodig,
- anfall,
- svettas,
- känner oro eller skakar,
- agitation,
- hallucinationer,
- feber,
- huttrar,
- snabb puls,
- muskelstelhet,
- ryckningar,
- förlust av koordination,
- illamående,
- kräkningar,
- diarre,
- ovanlig muskelsmärta,
- problem att andas,
- magont,
- oregelbunden hjärtfrekvens,
- yrsel,
- känns kallt,
- känner mig väldigt svag eller trött,
- förvirring,
- munsår,
- hudsår,
- lätt att få blåmärken,
- ovanlig blödning,
- blek hud,
- kalla händer och fötter,
- yrsel, och
- andnöd
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Zyvox inkluderar:
- illamående,
- kräkningar,
- diarre,
- milda hudutslag,
- anemi (få röda blodkroppar),
- huvudvärk och
- yrsel
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Zyvox. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
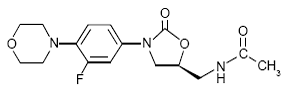
BESKRIVNING
ZYVOX 600mg IV injektion, ZYVOX tabletter och ZYVOX för oral suspension innehåller linezolid, som är ett syntetiskt antibakteriellt medel av oxazolidinonklassen. Det kemiska namnet för linezolid är (S)-N-[[3-[3-Fluoro-4-(4morfolinyl)fenyl]-2-oxo-5-oxazolidinyl]metyl]-acetamid.
Den empiriska formeln är C16H20FN3O4. Dess molekylvikt är 337,35, och dess kemiska struktur representeras nedan:
ZYVOX 600mg IV Injection levereras som en steril isotonisk lösning färdig att använda för intravenös infusion. Varje ml innehåller 2 mg linezolid. Inaktiva ingredienser är natriumcitrat, citronsyra och dextros i en vattenhaltig vehikel för intravenös administrering. Natriumhalten (Na+) är 0,38 mg/ml (5 mekv/300 ml påse och 1,7 mekv/100 ml påse).
ZYVOX tablett för oral administrering innehåller 600 mg linezolid som en filmdragerad komprimerad tablett. Inaktiva ingredienser är majsstärkelse, mikrokristallin cellulosa, hydroxipropylcellulosa, natriumstärkelseglykolat, magnesiumstearat, hypromellos, polyetylenglykol, titandioxid och karnaubavax. Natriumhalten (Na+) är 2,92 mg per 600 mg tablett (0,1 mekv/tablett).
ZYVOX 600 mg för oral suspension tillhandahålls som ett granulat/pulver med apelsinsmak för sammansättning till en suspension för oral administrering. Efter konstitution innehåller varje 5 ml 100 mg linezolid. Inaktiva ingredienser är sackaros, citronsyra, natriumcitrat, mikrokristallin cellulosa och karboximetylcellulosa natrium, aspartam, xantangummi, mannitol, natriumbensoat, kolloidal kiseldioxid, natriumklorid och smakämnen [se PATIENTINFORMATION ]. Natriumhalten (Na+) är 8,52 mg/5 ml (0,4 mekv/5 ml).
INDIKATIONER
Nosokomial lunginflammation
ZYVOX är indicerat för behandling av nosokomial lunginflammation orsakad av Staphylococcus aureus (meticillinkänsliga och -resistenta isolat) eller Streptococcus pneumoniae [se Kliniska studier ].
Samhällsförvärvad lunginflammation
ZYVOX 600mg är indicerat för behandling av samhällsförvärvad lunginflammation orsakad av Streptococcus pneumoniae, inklusive fall med samtidig bakteriemi, eller Staphylococcus aureus (endast meticillinkänsliga isolat) [se Kliniska studier ].
Komplicerade hud- och hudstrukturinfektioner
ZYVOX 600mg är indicerat för behandling av komplicerade hud- och hudstrukturinfektioner, inklusive diabetiska fotinfektioner, utan samtidig osteomyelit, orsakad av Staphylococcus aureus (meticillinkänsliga och -resistenta isolat), Streptococcus pyogenes eller Streptococcus agalactiae. ZYVOX har inte studerats vid behandling av decubitussår [se Kliniska studier ].
Okomplicerade hud- och hudstrukturinfektioner
ZYVOX 600mg är indicerat för behandling av okomplicerade hud- och hudstrukturinfektioner orsakade av Staphylococcus aureus (endast meticillinkänsliga isolat) eller Streptococcus pyogenes [se Kliniska studier ].
Vancomycin-resistenta Enterococcus faecium-infektioner
ZYVOX 600mg är indicerat för behandling av vankomycinresistenta Enterococcus faecium-infektioner, inklusive fall med samtidig bakteriemi [se Kliniska studier ].
Användningsbegränsningar
- ZYVOX 600mg är inte indicerat för behandling av gramnegativa infektioner. Det är avgörande att specifik Gram-negativ behandling inleds omedelbart om en samtidig Gram-negativ patogen dokumenteras eller misstänks [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Säkerheten och effekten av ZYVOX 600 mg formuleringar som ges under längre tid än 28 dagar har inte utvärderats i kontrollerade kliniska prövningar [se Kliniska studier ].
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten av ZYVOX 600mg och andra antibakteriella läkemedel, ska ZYVOX endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
Allmän dosering och administrering
Den rekommenderade dosen för ZYVOX 600 mg formuleringar för behandling av infektioner beskrivs i Tabell 1.
Ingen dosjustering är nödvändig vid byte från intravenös till oral administrering.
Intravenös administrering
ZYVOX 600mg IV Injection levereras i endos, färdiga att använda infusionspåsar. Parenterala läkemedelsprodukter bör inspekteras visuellt med avseende på partiklar före administrering. Kontrollera om det finns några små läckor genom att klämma ordentligt på påsen. Om läckor upptäcks, kassera lösningen, eftersom steriliteten kan försämras. Förvara infusionspåsarna i omslaget tills de ska användas. Förvara i rumstemperatur. Skydda mot frysning. ZYVOX 600mg IV Injection kan uppvisa en gul färg som kan intensifieras med tiden utan att påverka styrkan negativt.
ZYVOX IV-injektion ska administreras som intravenös infusion under en period av 30 till 120 minuter. Använd inte denna intravenösa infusionspåse i seriekopplingar. Tillsatser bör inte införas i denna lösning. Om ZYVOX 600mg IV-injektion ska ges samtidigt med ett annat läkemedel, ska varje läkemedel ges separat i enlighet med rekommenderad dosering och administreringssätt för varje produkt. Kassera oanvänd del.
Om samma intravenösa slang används för sekventiell infusion av flera läkemedel, ska slangen spolas före och efter infusion av ZYVOX IV Injection med en infusionslösning kompatibel med ZYVOX 600mg IV Injection och med andra läkemedel som administreras via denna gemensamma linje. .
Kompatibiliteter
Kompatibla intravenösa lösningar inkluderar 0,9 % natriumkloridinjektion, USP, 5 % dextrosinjektion, USP och Lactated Ringer's Injection, USP.
Inkompatibiliteter
Fysiska inkompatibiliteter resulterade när ZYVOX 600 mg IV-injektion kombinerades med följande läkemedel under simulerad administrering på Y-stället: amfotericin B, klorpromazin-HCl, diazepam, pentamidinisotionat, erytromycinlaktobionat, fenytoinnatrium och trimetoprimazolsulfametazol. Dessutom resulterade kemisk inkompatibilitet när ZYVOX IV Injection kombinerades med ceftriaxonnatrium.
Konstitution av oral suspension
ZYVOX för oral suspension tillhandahålls som ett pulver/granulat för konstitution. Knacka försiktigt på flaskan för att lossa pulvret. Tillsätt totalt 123 ml destillerat vatten i två portioner. Efter att ha tillsatt den första hälften, skaka kraftigt för att blöta allt pulvret. Tillsätt sedan den andra hälften av vattnet och skaka kraftigt för att få en enhetlig suspension. Efter konstituering innehåller varje 5 ml av suspensionen 100 mg linezolid. Före användning, blanda försiktigt genom att vända flaskan 3 till 5 gånger. Skaka inte. Förvara sammansatt suspension i rumstemperatur. Använd inom 21 dagar efter sammansättning.
HUR LEVERERAS
Doseringsformer och styrkor
ZYVOX 600mg IV-injektion: 200 mg/100 ml (2 mg/ml) och 600 mg/300 ml (2 mg/ml) linezolid endos, färdiga att använda flexibla infusionspåsar av plast i en folielaminatöverdrag.
ZYVOX 600 mg tablett:
vit, kapselformad, filmdragerad tablett präglad med ”ZYV” på ena sidan och ”600” på den andra. ZYVOX 600 mg för oral suspension: torr, vit till benvit granulat/pulver med apelsinsmak. När den är sammansatt enligt anvisningarna kommer varje flaska att innehålla 150 ml av en suspension som motsvarar 100 mg linezolid per 5 ml.
Förvaring Och Hantering
Injektion
ZYVOX 600mg IV Injektion finns tillgänglig i endos, färdiga att använda flexibla infusionspåsar av plast i en folielaminatöverdrag. Infusionspåsarna och portarna är inte gjorda av naturgummilatex. Infusionspåsarna finns i följande förpackningsstorlekar:
200 mg/100 ml (2 mg/ml) linezolid x 10 - NDC 0009-5137-04 600 mg/300 ml (2 mg/ml) linezolid x 10 - NDC 0009-5140-04
Tabletter
ZYVOX 600mg tabletter finns tillgängliga enligt följande:
600 mg (vita, kapselformade, filmdragerade tabletter präglade med "ZYV" på ena sidan och "600" på den andra)
20 tabletter i HDPE-flaska - NDC 0009-5138-02 Endosförpackningar med 30 tabletter - NDC 0009-5138-03
Oral suspension
ZYVOX för oral suspension finns som ett torrt, vitt till benvitt granulat/pulver med apelsinsmak. När den är sammansatt enligt anvisningarna kommer varje flaska att innehålla 150 ml av en suspension som motsvarar 100 mg linezolid per 5 ml. ZYVOX för oral suspension tillhandahålls enligt följande:
100 mg/5 ml i 240 ml glasflaskor - NDC 0009-5136-01
Förvaring Och Hantering
Förvara vid 25°C (77°F). Skydda från ljus. Förvara flaskorna väl tillslutna för att skydda mot fukt. Det rekommenderas att infusionspåsarna förvaras i omslaget tills de ska användas. Skydda infusionspåsar från frysning.
Distribueras av Pharmacia & Upjohn Co Division av Pfizer Inc, NY, NY 10017. Reviderad: nov 2021.
BIEFFEKTER
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Vuxna
Säkerheten för ZYVOX 600 mg formuleringar utvärderades hos 2 046 vuxna patienter som inkluderades i sju fas 3-jämförande kontrollerade kliniska prövningar, som behandlades i upp till 28 dagar.
Av patienterna som behandlades för okomplicerade hud- och hudstrukturinfektioner (uSSSI) upplevde 25,4 % av de ZYVOX-behandlade och 19,6 % av de komparatorbehandlade patienterna minst en läkemedelsrelaterad biverkning. För alla andra indikationer upplevde 20,4 % av ZYVOX-behandlade och 14,3 % av jämförelsebehandlade patienter minst en läkemedelsrelaterad biverkning.
Tabell 2 visar incidensen av alla orsakssamband, behandlingsuppkomna biverkningar rapporterade hos minst 1 % av vuxna patienter i dessa prövningar efter dos av ZYVOX.
Av patienterna som behandlades för uSSSI avbröt 3,5 % av ZYVOX-behandlade och 2,4 % av jämförelsebehandlade patienter behandlingen på grund av läkemedelsrelaterade biverkningar. För alla andra indikationer inträffade utsättningar på grund av läkemedelsrelaterade biverkningar hos 2,1 % av ZYVOX-behandlade och 1,7 % av patienter behandlade med jämförelseläkemedel. De vanligaste rapporterade läkemedelsrelaterade biverkningarna som ledde till att behandlingen avbröts var illamående, huvudvärk, diarré och kräkningar.
Pediatriska patienter
Säkerheten för ZYVOX-formuleringar utvärderades hos 215 pediatriska patienter i åldern från födseln till 11 år, och hos 248 pediatriska patienter i åldern 5 till 17 år (146 av dessa 248 var i åldern 5 till 11 och 102 var i åldern 12 till 17). Dessa patienter inkluderades i två komparatorkontrollerade fas 3-studier och behandlades i upp till 28 dagar. I studien av inlagda pediatriska patienter (födelse till och med 11 år) med grampositiva infektioner, som randomiserades 2 till 1 (linezolid: vankomycin), var mortaliteten 6,0 % (13/215) i linezolidarmen och 3,0 % (3/101) i vankomycinarmen. Men med tanke på den allvarliga underliggande sjukdomen i patientpopulationen kunde ingen orsakssamband fastställas.
Av de pediatriska patienterna som behandlades för uSSSI upplevde 19,2 % av ZYVOX-behandlade och 14,1 % av jämförelsebehandlade patienter minst en läkemedelsrelaterad biverkning. För alla andra indikationer upplevde 18,8 % av ZYVOX-behandlade och 34,3 % av jämförelsebehandlade patienter minst en läkemedelsrelaterad biverkning.
Tabell 3 visar incidensen av behandlingsuppkomna biverkningar av alla orsaker som rapporterats hos mer än 1 % av pediatriska patienter (och fler än 1 patient) i båda behandlingsgrupperna i de komparatorkontrollerade fas 3-studierna.
Av de pediatriska patienter som behandlades för uSSSI avbröt 1,6 % av ZYVOX-behandlade och 2,4 % av jämförelsebehandlade patienter behandlingen på grund av läkemedelsrelaterade biverkningar. För alla andra indikationer inträffade avbrott på grund av läkemedelsrelaterade biverkningar hos 0,9 % av ZYVOX-behandlade och 6,1 % av patienter behandlade med jämförelseläkemedel.
Laboratorieavvikelser
ZYVOX har associerats med trombocytopeni när det används i doser upp till och inklusive 600 mg var 12:e timme i upp till 28 dagar. I komparatorkontrollerade fas 3-studier var andelen vuxna patienter som utvecklade ett väsentligt lågt antal blodplättar (definierat som mindre än 75 % av den nedre normalgränsen och/eller baslinjen) 2,4 % (intervall mellan studier: 0,3 till 10,0 %) med ZYVOX 600 mg och 1,5 % (intervall mellan studier: 0,4 till 7,0 %) med en komparator. I en studie av inlagda pediatriska patienter som sträckte sig i ålder från födsel till 11 år, var andelen patienter som utvecklade ett väsentligt lågt antal trombocyter (definierat som mindre än 75 % av den nedre normalgränsen och/eller baslinjen) 12,9 % med ZYVOX 600 mg och 13,4 % med vankomycin. I en poliklinisk studie av pediatriska patienter i åldern 5 till 17 år var andelen patienter som utvecklade ett väsentligt lågt antal trombocyter 0 % med ZYVOX och 0,4 % med cefadroxil. Trombocytopeni i samband med användning av ZYVOX verkar vara beroende av behandlingens varaktighet (vanligtvis mer än 2 veckors behandling). Trombocyttalet för de flesta patienter återgick till det normala intervallet/baslinjen under uppföljningsperioden. Inga relaterade kliniska biverkningar identifierades i kliniska fas 3-prövningar på patienter som utvecklade trombocytopeni. Blödningshändelser identifierades hos trombocytopenipatienter i ett program för compassionate use för ZYVOX; Linezolids roll i dessa händelser kan inte fastställas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Förändringar som sågs i andra laboratorieparametrar, utan hänsyn till läkemedelsförhållande, visade inga väsentliga skillnader mellan ZYVOX 600 mg och jämförelsepreparaten. Dessa förändringar var i allmänhet inte kliniskt signifikanta, ledde inte till att behandlingen avbröts och var reversibla. Förekomsten av vuxna och pediatriska patienter med minst ett väsentligt onormalt hematologiskt eller serumkemiskt värde presenteras i tabellerna 4, 5, 6 och 7.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av ZYVOX efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering:
- Myelosuppression (inklusive anemi, leukopeni, pancytopeni och trombocytopeni) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]; sideroblastisk anemi.
- Perifer neuropati och optisk neuropati som ibland utvecklas till förlust av synen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Laktatacidos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Även om dessa rapporter främst har varit hos patienter som behandlats längre än den maximala rekommenderade varaktigheten på 28 dagar, har dessa händelser även rapporterats hos patienter som fått kortare behandlingskurer.
- Serotonergt syndrom har rapporterats hos patienter som samtidigt får serotonerga medel, inklusive antidepressiva medel som selektiva serotoninåterupptagshämmare (SSRI) och opioider, och ZYVOX [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Anafylaxi, angioödem, bullösa hudsjukdomar inklusive allvarliga kutana biverkningar (SCAR) såsom toxisk epidermal nekrolys och Stevens-Johnsons syndrom och överkänslighetsvaskulit.
- Ytlig missfärgning av tänder och missfärgning av tungan har rapporterats vid användning av linezolid. Tandmissfärgningen gick att avlägsna med professionell tandrengöring (manuell avkalkning) i fall med känt utfall.
- Hypoglykemi, inklusive symtomatiska episoder [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Hyponatremi och/eller syndrom av olämplig antidiuretisk hormonsekretion (SIADH) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
LÄKEMEDELSINTERAKTIONER
Monoaminoxidashämmare
Linezolid är en reversibel, icke-selektiv hämmare av monoaminoxidas [se KONTRAINDIKATIONER och KLINISK FARMAKOLOGI ].
Adrenerga och serotonerga medel
Linezolid har potential för interaktion med adrenerga och serotonerga medel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Myelosuppression
Myelosuppression (inklusive anemi, leukopeni, pancytopeni och trombocytopeni) har rapporterats hos patienter som får linezolid. I de fall där resultatet är känt, när behandlingen med linezolid avbröts, har de påverkade hematologiska parametrarna stigit mot nivåer före behandling. Fullständiga blodvärden bör övervakas varje vecka hos patienter som får linezolid, särskilt hos de som får linezolid under längre tid än två veckor, de med redan existerande myelosuppression, de som samtidigt får läkemedel som ger benmärgsdämpning eller de med en kronisk infektion som har fått tidigare eller samtidig antibakteriell läkemedelsbehandling. Avbrytande av behandling med linezolid bör övervägas hos patienter som utvecklar eller har försämrad myelosuppression.
Perifer och optisk neuropati
Perifer och optisk neuropati har rapporterats hos patienter som behandlats med ZYVOX 600 mg, främst hos patienter som behandlats längre än den maximala rekommenderade varaktigheten på 28 dagar. I fall av optisk neuropati som utvecklades till förlust av synen, behandlades patienterna under längre perioder utöver den maximala rekommenderade varaktigheten. Synsudd har rapporterats hos vissa patienter som behandlats med ZYVOX under mindre än 28 dagar. Perifer och optisk neuropati har också rapporterats hos barn.
Om patienter upplever symtom på synnedsättning, såsom förändringar i synskärpa, förändringar i färgseende, suddig syn eller synfältsdefekt, rekommenderas omedelbar oftalmisk utvärdering. Synfunktionen ska övervakas hos alla patienter som tar ZYVOX under längre perioder (≥ 3 månader) och hos alla patienter som rapporterar nya synsymptom oavsett behandlingslängd med ZYVOX. Om perifer neuropati eller optikusneuropati inträffar, bör fortsatt användning av ZYVOX 600 mg hos dessa patienter vägas mot de potentiella riskerna.
Serotonin syndrom
Spontana rapporter om serotonergt syndrom inklusive dödsfall i samband med samtidig administrering av ZYVOX och serotonerga medel, inklusive antidepressiva medel som selektiva serotoninåterupptagshämmare (SSRI), har rapporterats.
Såvida det inte är kliniskt lämpligt och patienterna noggrant observeras med avseende på tecken och/eller symtom på serotonergt syndrom eller malignt neuroleptikasyndrom (NMS-liknande) reaktioner, bör linezolid inte administreras till patienter med karcinoid syndrom och/eller patienter som tar någon av följande mediciner : serotoninåterupptagshämmare, tricykliska antidepressiva medel, bupropion, buspiron, serotonin 5-HT1-receptoragonister (triptaner) och opioider, inklusive meperidin [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
vissa fall kan en patient som redan får ett serotonergt antidepressivt medel eller buspiron behöva akut behandling med linezolid. Om alternativ till linezolid inte finns tillgängliga och de potentiella fördelarna med linezolid överväger riskerna för serotonergt syndrom eller NMS-liknande reaktioner, ska det serotonerga antidepressiva medlet avbrytas omedelbart och linezolid administreras. Patienten ska övervakas i två veckor (fem veckor om fluoxetin togs) eller till 24 timmar efter den sista dosen av linezolid, beroende på vilket som inträffar först. Symtom på serotonergt syndrom eller NMS-liknande reaktioner inkluderar hypertermi, stelhet, myoklonus, autonom instabilitet och mentala statusförändringar som inkluderar extrem agitation som utvecklas till delirium och koma. Patienten bör också övervakas med avseende på utsättningssymtom för antidepressivt läkemedel (se bipacksedeln för det eller de angivna läkemedlen för en beskrivning av de associerade utsättningssymtomen).
Obalans i dödligheten i en undersökningsstudie hos patienter med kateterrelaterade blodomloppsinfektioner, inklusive de med kateterinfektioner
En obalans i mortalitet sågs hos patienter behandlade med linezolid i förhållande till vankomycin/dikloxacillin/oxacillin i en öppen studie på allvarligt sjuka patienter med intravaskulära kateterrelaterade infektioner [78/363 (21,5%) vs. 58/363 (16,0% ); oddskvot 1,426, 95 % CI 0,970, 2,098]. Även om kausalitet inte har fastställts, inträffade denna observerade obalans främst hos linezolidbehandlade patienter hos vilka antingen gramnegativa patogener, blandade gramnegativa och grampositiva patogener eller ingen patogen identifierades vid baslinjen, men som inte sågs hos patienter med Endast grampositiva infektioner.
Linezolid är inte godkänt och ska inte användas för behandling av patienter med kateterrelaterade blodomloppsinfektioner eller kateterinfektioner.
Linezolid har ingen klinisk aktivitet mot gramnegativa patogener och är inte indicerat för behandling av gramnegativa infektioner. Det är avgörande att specifik Gram-negativ behandling inleds omedelbart om en samtidig Gram-negativ patogen dokumenteras eller misstänks [se INDIKATIONER ].
Clostridioides Difficile-associerad diarré
Clostridioides difficile-associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive ZYVOX 600 mg, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter användning av antibakteriella läkemedel.
Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibakteriella läkemedelsanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibakteriell läkemedelsbehandling av C. difficile och kirurgisk utvärdering bör inledas som kliniskt indicerat.
Potentiella interaktioner som producerar förhöjt blodtryck
Såvida inte patienter övervakas med avseende på potentiella ökningar av blodtrycket, ska linezolid inte ges till patienter med okontrollerad hypertoni, feokromocytom, tyreotoxikos och/eller patienter som tar någon av följande typer av mediciner: direkt och indirekt verkande sympatomimetiska medel (t.ex. pseudoefedrin), vasopressiva medel (t.ex. epinefrin, noradrenalin), dopaminerga medel (t.ex. dopamin, dobutamin) [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Mjölksyra
Laktacidos har rapporterats vid användning av ZYVOX. I rapporterade fall upplevde patienterna upprepade episoder av illamående och kräkningar. Patienter som utvecklar återkommande illamående eller kräkningar, oförklarlig acidos eller låga bikarbonatnivåer under behandling med ZYVOX bör få omedelbar medicinsk utvärdering.
Kramper
Kramper har rapporterats hos patienter som behandlats med linezolid. I några av dessa fall rapporterades en historia av anfall eller riskfaktorer för anfall.
Hypoglykemi
Fall av symptomatisk hypoglykemi efter marknadsföring har rapporterats hos patienter med diabetes mellitus som får insulin eller orala hypoglykemiska medel när de behandlats med linezolid, en reversibel, icke-selektiv MAO-hämmare. Vissa MAO-hämmare har associerats med hypoglykemiska episoder hos diabetespatienter som får insulin eller hypoglykemiska medel. Även om ett orsakssamband mellan linezolid och hypoglykemi inte har fastställts, bör diabetespatienter varnas för potentiella hypoglykemiska reaktioner när de behandlas med linezolid.
Om hypoglykemi inträffar kan en minskning av dosen av insulin eller oralt hypoglykemiskt medel, eller utsättande av oralt hypoglykemiskt medel, insulin eller linezolid behövas.
Hyponatremi och/eller syndrom av olämplig antidiuretisk hormonsekretion (SIADH)
Fall av hyponatremi och/eller syndrom av olämplig antidiuretisk hormonsekretion (SIADH) efter marknadsföring har observerats hos patienter som behandlats med linezolid. I rapporterade fall inkluderade tecknen och symtomen förvirring, somnolens, generaliserad svaghet och ledde i allvarliga fall till andningssvikt och till och med död. Övervaka serumnatriumnivåer regelbundet hos äldre, hos patienter som tar diuretika och hos andra patienter med risk för hyponatremi och/eller SIADH när de tar ZYVOX. Om tecken och symtom på hyponatremi och/eller SIADH uppträder, avbryt behandlingen med ZYVOX 600 mg och vidta lämpliga stödåtgärder.
Risker hos patienter med fenylketonuri
Fenylalanin kan vara skadligt för patienter med fenylketonuri (PKU). ZYVOX för oral suspension innehåller fenylalanin, en komponent i aspartam. Varje 5 ml av 100 mg/5 ml oral suspension innehåller 20 mg fenylalanin. Innan du förskriver ZYVOX 600 mg för oral suspension till en patient med PKU, överväg den kombinerade dagliga mängden fenylalanin från alla källor, inklusive ZYVOX för oral suspension.
De andra ZYVOX-formuleringarna innehåller inte fenylalanin.
Utveckling av läkemedelsresistenta bakterier
Att förskriva ZYVOX i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation är osannolikt att ge patienten nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Livstidsstudier på djur har inte utförts för att utvärdera den karcinogena potentialen hos linezolid. Varken mutagen eller klastogen potential hittades i ett antal tester inklusive: analyser för mutagenicitet (Ames bakteriell reversion och CHO-cellmutation), en in vitro analys av oplanerad DNA-syntes (UDS), en in vitro-analys av kromosomavvikelser i humana lymfocyter, och en in vivo mus mikronukleusanalys.
Linezolid påverkade inte fertiliteten eller reproduktionsförmågan hos vuxna honråttor som fick orala doser på upp till 100 mg/kg/dag under 14 dagar före parning till och med dräktighetsdag 7. Det minskade reversibelt fertiliteten och reproduktionsförmågan hos vuxna hanråttor när det gavs kl. doser ≥ 50 mg/kg/dag, med exponeringar som är ungefär lika med eller större än den förväntade humana exponeringsnivån (exponeringsjämförelser baseras på AUC). De reversibla fertilitetseffekterna förmedlades genom förändrad spermatogenes. Påverkade spermatider innehöll onormalt bildade och orienterade mitokondrier och var icke-livsdugliga. Epitelcellshypertrofi och hyperplasi i epididymis observerades i samband med minskad fertilitet. Liknande epididymala förändringar sågs inte hos hundar.
Hos könsmogna råttor av hankön som exponerats för läkemedel som unga observerades lätt minskad fertilitet efter behandling med linezolid under större delen av deras sexuella utvecklingsperiod (50 mg/kg/dag från dagarna 7 till 36 år och 100 mg/kg/dag). från dag 37 till 55 år), med exponeringar upp till 1,7 gånger högre än genomsnittliga AUC som observerats hos pediatriska patienter i åldern 3 månader till 11 år. Minskad fertilitet observerades inte med kortare behandlingsperioder, motsvarande exponering in utero genom den tidiga neonatala perioden (dräktighetsdag 6 till postnatal dag 5), neonatal exponering (postnatal dag 5 till 21) eller till ungdomsexponering (postnatal dag 22 till 35) ). Reversibla minskningar av spermiers rörlighet och förändrad spermiemorfologi observerades hos råttor som behandlades från postnatal dag 22 till 35.
Användning i specifika populationer
Graviditet
Risksammanfattning
Tillgängliga data från publicerade fall och fallrapporter efter marknadsföring med användning av linezolid hos gravida kvinnor har inte identifierat en läkemedelsrelaterad risk för allvarliga fosterskador, missfall eller ogynnsamma resultat hos modern eller foster. Vid administrering under organogenes orsakade linezolid inga missbildningar hos möss, råttor eller kaniner vid maternal exponeringsnivåer på cirka 6,5 gånger (möss), motsvarande (råttor) eller 0,06 gånger (kaniner) den kliniska terapeutiska exponeringen, baserat på AUC. Embryo-fosterdödlighet observerades dock hos möss vid 6,5 gånger den uppskattade mänskliga exponeringen. När honråttor doserades under organogenes genom laktation, minskade den postnatala överlevnaden för ungar vid doser som ungefär motsvarar den uppskattade humana exponeringen baserat på AUC (se Data ).
Bakgrundsrisken för stora fosterskador och missfall för de angivna populationerna är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2-4% respektive 15-20%.
Data
Djurdata
Hos möss observerades embryo-fetal toxicitet endast vid doser som orsakade maternell toxicitet (kliniska tecken och minskad kroppsviktsökning). En oral dos på 450 mg/kg/dag givet från Gestation Day (GD) 6-16 (6,5 gånger den uppskattade humana exponeringen baserat på AUC) korrelerade med ökad postimplantationell embryodöd, inklusive total förlust av kull, minskad fosterkroppsvikt och en ökad förekomst av kustbroskfusion. Varken maternell eller embryo-fetal toxicitet observerades vid doser upp till 150 mg/kg/dag. Fetala missbildningar observerades inte.
Hos råttor observerades fostertoxicitet vid 15 respektive 50 mg/kg/dag administrerat oralt från GD 6-17 (exponeringar 0,22 gånger till ungefär motsvarande den uppskattade humana exponeringen, respektive baserat på AUC). Effekterna bestod av minskad fosterkroppsvikt och minskad förbening av bröstbenen, ett fynd som ofta ses i samband med minskad fostrets kroppsvikt. Fetala missbildningar observerades inte. Maternell toxicitet, i form av minskad kroppsviktsökning, sågs vid 50 mg/kg/dag.
Hos kaniner inträffade minskad fosterkroppsvikt endast i närvaro av maternell toxicitet (kliniska tecken, minskad kroppsviktsökning och födokonsumtion) när den administrerades i en oral dos på 15 mg/kg/dag givet från GD 6-20 (0,06 gånger uppskattad human exponering baserat på AUC). Fetala missbildningar observerades inte.
När honråttor behandlades med 50 mg/kg/dag (ungefär ekvivalent med den uppskattade humana exponeringen baserat på AUC) av linezolid under dräktighet och laktation (GD 6 till och med laktationsdag 20), minskade överlevnaden för valpar på dagarna 1 till 4 efter födseln Han- och honungar som tilläts mogna till fortplantningsåldern, när de parades, visade en ökning i preimplantationsförlust.
Laktation
Risksammanfattning
Linezolid finns i bröstmjölk. Baserat på data från tillgängliga publicerade fallrapporter skulle den dagliga dosen av linezolid som barnet skulle få från bröstmjölk vara cirka 6 % till 9 % av den rekommenderade terapeutiska spädbarnsdosen (10 mg/kg var 8:e timme). Det finns ingen information om effekterna av linezolid på det ammade barnet; diarré och kräkningar var dock de vanligaste biverkningarna som rapporterats i kliniska prövningar hos spädbarn som fick linezolid terapeutiskt [se NEGATIVA REAKTIONER och (se Kliniska överväganden). Det finns ingen information om effekterna av linezolid på mjölkproduktionen. Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av linezolid och eventuella negativa effekter på det ammade barnet från linezolid eller från det underliggande moderns tillståndet.
Kliniska överväganden
Rekommendera ammande kvinnor att övervaka ett ammat spädbarn för diarré och kräkningar.
Kvinnor Och Hanar Av Reproduktionspotential
Infertilitet
Män
Baserat på fynd från studier på råttor kan ZYVOX reversibelt försämra fertiliteten hos manliga patienter [se Icke-klinisk toxikologi )].
Pediatrisk användning
Säkerheten och effektiviteten av ZYVOX 600 mg för behandling av pediatriska patienter med följande infektioner stöds av bevis från adekvata och välkontrollerade studier på vuxna, farmakokinetiska data på pediatriska patienter och ytterligare data från en jämförelsekontrollerad studie av grampositiva infektioner hos pediatriska patienter som sträcker sig i ålder från födsel till 11 år [se INDIKATIONER , KLINISK FARMAKOLOGI och Kliniska studier ]:
- nosokomial lunginflammation
- komplicerade hud- och hudstrukturinfektioner
- samhällsförvärvad lunginflammation (också med stöd av bevis från en okontrollerad studie på patienter i åldern från 8 månader till 12 år)
- vankomycinresistenta Enterococcus faecium-infektioner
Säkerheten och effekten av ZYVOX 600 mg för behandling av pediatriska patienter med följande infektion har fastställts i en jämförelsekontrollerad studie på pediatriska patienter i åldern 5 till 17 år [se Kliniska studier ]:
- okomplicerade hud- och hudstrukturinfektioner orsakade av Staphylococcus aureus (endast meticillinkänsliga stammar) eller Streptococcus pyogenes
Farmakokinetisk information genererad hos pediatriska patienter med ventrikuloperitoneala shuntar visade varierande linezolidkoncentrationer i cerebrospinalvätskan (CSF) efter engångs- och multipeldosering av linezolid; terapeutiska koncentrationer uppnåddes eller bibehölls inte konsekvent i CSF. Därför rekommenderas inte användning av linezolid för empirisk behandling av pediatriska patienter med infektioner i centrala nervsystemet.
Farmakokinetiken för linezolid har utvärderats hos pediatriska patienter från födseln till 17 års ålder. I allmänhet minskar viktbaserad clearance av linezolid gradvis med stigande ålder hos pediatriska patienter. Men hos prematura (gestationsålder DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
begränsad klinisk erfarenhet hade 5 av 6 (83 %) pediatriska patienter med infektioner på grund av grampositiva patogener med lägsta hämmande koncentrationer (MIC) på 4 mcg/ml behandlade med ZYVOX 600 mg kliniska botemedel. Pediatriska patienter uppvisar dock större variation i linezolidclearance och systemisk exponering (AUC) jämfört med vuxna. Hos pediatriska patienter med ett suboptimalt kliniskt svar, särskilt de med patogener med MIC på 4 mcg/ml, bör lägre systemisk exponering, infektionsställe och svårighetsgrad samt det underliggande medicinska tillståndet beaktas vid bedömning av kliniskt svar [se KLINISK FARMAKOLOGI och DOSERING OCH ADMINISTRERING ].
Geriatrisk användning
Av de 2 046 patienter som behandlades med ZYVOX 600 mg i komparatorkontrollerade kliniska studier i fas 3 var 589 (29 %) 65 år eller äldre och 253 (12 %) var 75 år eller äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa patienter och yngre patienter, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
ÖVERDOS
händelse av överdosering rekommenderas stödbehandling, med upprätthållande av glomerulär filtration. Hemodialys kan underlätta snabbare eliminering av linezolid. I en klinisk fas 1-prövning avlägsnades cirka 30 % av en dos linezolid under en 3-timmars hemodialyssession som började 3 timmar efter att dosen linezolid administrerades. Data finns inte tillgängliga för avlägsnande av linezolid med peritonealdialys eller hemoperfusion. Kliniska tecken på akut toxicitet hos djur var minskad aktivitet och ataxi hos råttor och kräkningar och skakningar hos hundar som behandlats med 3 000 mg/kg/dag respektive 2 000 mg/kg/dag.
KONTRAINDIKATIONER
Överkänslighet
ZYVOX-formuleringar är kontraindicerade för användning till patienter som har känd överkänslighet mot linezolid eller någon av de andra produktkomponenterna.
Monoaminoxidashämmare
Linezolid ska inte användas till patienter som tar något läkemedel som hämmar monoaminoxidas A eller B (t.ex. fenelzin, isokarboxazid) eller inom två veckor efter att ha tagit något sådant läkemedel.
KLINISK FARMAKOLOGI
Handlingsmekanism
ZYVOX är ett antibakteriellt läkemedel [se Mikrobiologi ].
Farmakodynamik
en randomiserad, positiv och placebokontrollerad genomkorsad QT-studie, fick 40 friska försökspersoner en engångsdos av ZYVOX 600 mg via en 1 timmes IV-infusion, en engångsdos av ZYVOX 1 200 mg via en 1-timmes IV-infusion, placebo och en engångsdos av positiv kontroll. Vid både 600 mg och 1 200 mg ZYVOX 600 mg doserna upptäcktes ingen signifikant effekt på QTc-intervallet vid maximal plasmakoncentration eller vid någon annan tidpunkt.
Farmakokinetik
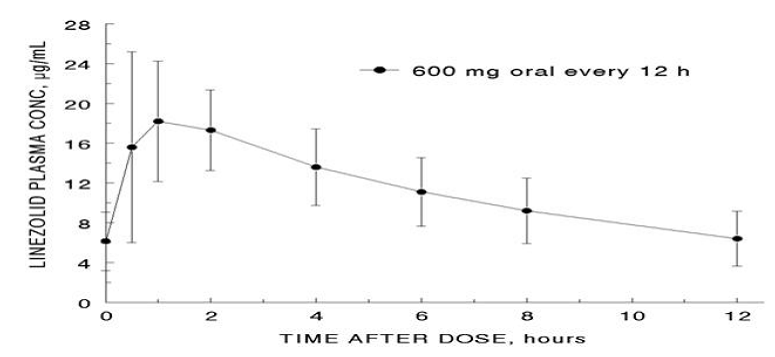
De genomsnittliga farmakokinetiska parametrarna för linezolid hos vuxna efter enstaka och flera orala och intravenösa doser sammanfattas i tabell 8. Plasmakoncentrationer av linezolid vid steady-state efter orala doser på 600 mg som ges var 12:e timme visas i figur 1.
Figur 1. Plasmakoncentrationer av linezolid hos vuxna vid steady-state efter oral dosering var 12:e timme (medelvärde ± standardavvikelse, n=16)
Absorption
Linezolid absorberas i hög grad efter oral dosering. Maximala plasmakoncentrationer uppnås cirka 1 till 2 timmar efter dosering, och den absoluta biotillgängligheten är cirka 100 %. Linezolid kan därför ges oralt eller intravenöst utan dosjustering.
Linezolid kan administreras utan hänsyn till tidpunkten för måltider. Tiden för att nå maximal koncentration fördröjs från 1,5 timmar till 2,2 timmar och Cmax minskar med cirka 17 % när fettrik mat ges med linezolid. Den totala exponeringen mätt som AUC0-∞ är dock likartad under båda förhållandena.
Distribution
Farmakokinetiska studier på djur och människor har visat att linezolid lätt distribueras till välperfunderade vävnader. Plasmaproteinbindningen av linezolid är cirka 31 % och är koncentrationsoberoende. Distributionsvolymen av linezolid vid steady-state var i genomsnitt 40 till 50 liter hos friska vuxna frivilliga.
Linezolidkoncentrationer har bestämts i olika vätskor från ett begränsat antal försökspersoner i fas 1 frivilliga studier efter upprepad dosering av linezolid. Förhållandet linezolid i saliv i förhållande till plasma var 1,2 till 1 och förhållandet mellan linezolid i svett i förhållande till plasma var 0,55 till 1.
Ämnesomsättning
Linezolid metaboliseras primärt genom oxidation av morfolinringen, vilket resulterar i två inaktiva ringöppnade karboxylsyrametaboliter: aminoetoxiättiksyrametaboliten (A) och hydroxietylglycinmetaboliten (B). Bildning av metabolit A antas bildas via en enzymatisk väg medan metabolit B medieras av en icke-enzymatisk kemisk oxidationsmekanism in vitro. In vitro-studier har visat att linezolid metaboliseras minimalt och kan medieras av humant cytokrom P450. Den metaboliska vägen för linezolid är dock inte helt klarlagd.
Exkretion
Icke-renalt clearance står för cirka 65 % av det totala clearance av linezolid. Under steady-state visas cirka 30 % av dosen i urinen som linezolid, 40 % som metabolit B och 10 % som metabolit A. Det genomsnittliga renala clearance av linezolid är 40 ml/min, vilket tyder på netto tubulär reabsorption. Praktiskt taget inget linezolid förekommer i avföringen, medan cirka 6 % av dosen förekommer i avföringen som metabolit B och 3 % som metabolit A.
En liten grad av olinjäritet i clearance observerades med ökande doser av linezolid, vilket verkar bero på lägre renalt och icke-renalt clearance av linezolid vid högre koncentrationer. Skillnaden i clearance var dock liten och återspeglades inte i den skenbara eliminationshalveringstiden.
Specifika populationer
Geriatriska patienter
Farmakokinetiken för linezolid är inte signifikant förändrad hos äldre patienter (65 år eller äldre). Därför är dosjustering för geriatriska patienter inte nödvändig.
Pediatriska patienter
Farmakokinetiken för linezolid efter en intravenös engångsdos undersöktes hos pediatriska patienter i åldern från födseln till 17 år (inklusive för tidigt födda och fullgångna nyfödda), hos friska ungdomar i åldern 12 till 17 år och hos pediatriska patienter i intervallet i ålder från 1 vecka till 12 år. De farmakokinetiska parametrarna för linezolid sammanfattas i Tabell 9 för de studerade pediatriska populationerna och friska vuxna försökspersoner efter administrering av enstaka intravenösa doser.
Cmax och distributionsvolymen (Vss) för linezolid är likartade oavsett ålder hos pediatriska patienter. Plasmaclearance av linezolid varierar dock beroende på ålder. Med undantag för prematura nyfödda under en veckas ålder är viktbaserad clearance snabbast i de yngsta åldersgrupperna från
Liknande genomsnittliga dagliga AUC-värden observerades hos pediatriska patienter från födseln till 11 års ålder doserade var 8:e timme jämfört med ungdomar eller vuxna som doserades var 12:e timme. Därför bör dosen för pediatriska patienter upp till 11 års ålder vara 10 mg/kg var 8:e timme. Pediatriska patienter 12 år och äldre ska få 600 mg var 12:e timme [se DOSERING OCH ADMINISTRERING ].
Kön
Honor har en något lägre distributionsvolym av linezolid än män. Plasmakoncentrationerna är högre hos kvinnor än hos män, vilket delvis beror på skillnader i kroppsvikt. Efter en dos på 600 mg är det genomsnittliga orala clearance cirka 38 % lägre hos kvinnor än hos män. Det finns dock inga signifikanta könsskillnader i genomsnittlig skenbar eliminationshastighetskonstant eller halveringstid. Läkemedelsexponering hos kvinnor förväntas således inte öka väsentligt utöver nivåer som är kända för att tolereras väl. Därför verkar dosjustering efter kön inte vara nödvändig.
Nedsatt njurfunktion
Farmakokinetiken för moderläkemedlet, linezolid, förändras inte hos patienter med någon grad av nedsatt njurfunktion; dock ackumuleras de två primära metaboliterna av linezolid hos patienter med nedsatt njurfunktion, varvid mängden ackumulering ökar med svårighetsgraden av nedsatt njurfunktion (se tabell 10). Farmakokinetiken för linezolid och dess två metaboliter har också studerats hos patienter med njursjukdom i slutstadiet (ESRD) som får hemodialys. I ESRD-studien doserades 14 patienter med linezolid 600 mg var 12:e timme i 14,5 dagar (se tabell 11). Eftersom liknande plasmakoncentrationer av linezolid uppnås oavsett njurfunktion, rekommenderas ingen dosjustering för patienter med nedsatt njurfunktion. Men med tanke på avsaknaden av information om den kliniska betydelsen av ackumulering av de primära metaboliterna, bör användning av linezolid hos patienter med nedsatt njurfunktion vägas mot de potentiella riskerna för ackumulering av dessa metaboliter. Både linezolid och de två metaboliterna elimineras genom hemodialys. Ingen information finns tillgänglig om effekten av peritonealdialys på farmakokinetiken för linezolid. Cirka 30 % av en dos eliminerades i en 3-timmars hemodialyssession som började 3 timmar efter att dosen av linezolid administrerades; därför bör linezolid ges efter hemodialys.
Nedsatt leverfunktion
Farmakokinetiken för linezolid förändras inte hos patienter (n=7) med lätt till måttligt nedsatt leverfunktion (Child-Pugh klass A eller B). Baserat på tillgänglig information rekommenderas ingen dosjustering för patienter med lätt till måttligt nedsatt leverfunktion. Farmakokinetiken för linezolid hos patienter med gravt nedsatt leverfunktion har inte utvärderats.
Läkemedelsinteraktioner
Läkemedel som metaboliseras av Cytokrom P450
Linezolid är inte en inducerare av cytokrom P450 (CYP450) hos råttor. Dessutom hämmar linezolid inte aktiviteten hos kliniskt signifikanta humana CYP-isoformer (t.ex. 1A2, 2C9, 2C19, 2D6, 2E1, 3A4). Linezolid förväntas därför inte påverka farmakokinetiken för andra läkemedel som metaboliseras av dessa viktiga enzymer. Samtidig administrering av linezolid förändrar inte väsentligt de farmakokinetiska egenskaperna hos (S)-warfarin, som i stor utsträckning metaboliseras av CYP2C9. Läkemedel som warfarin och fenytoin, som är CYP2C9-substrat, kan ges tillsammans med linezolid utan förändringar i doseringsregimen.
Antibakteriella läkemedel
Aztreonam: Farmakokinetiken för linezolid eller aztreonam förändras inte när de administreras tillsammans.
Gentamicin: Farmakokinetiken för linezolid eller gentamicin förändras inte när de administreras tillsammans.
Antioxidanter
Potentialen för läkemedelsinteraktioner med linezolid och antioxidanterna vitamin C och vitamin E studerades hos friska frivilliga. Försökspersonerna fick en oral dos på 600 mg linezolid på dag 1 och ytterligare en dos på 600 mg linezolid på dag 8. På dagarna 2-9 fick försökspersonerna antingen vitamin C (1 000 mg/dag) eller vitamin E (800 IE/dag). dag). AUC0-∞ för linezolid ökade med 2,3 % vid samtidig administrering med vitamin C och 10,9 % vid samtidig administrering med vitamin E. Ingen dosjustering av linezolid rekommenderas vid samtidig administrering med vitamin C eller vitamin E.
Starka CYP 3A4-inducerare
Rifampin
Effekten av rifampin på farmakokinetiken för linezolid utvärderades i en studie med 16 friska vuxna män. Frivilliga gavs oral linezolid 600 mg två gånger dagligen i 5 doser med och utan rifampin 600 mg en gång dagligen i 8 dagar. Samtidig administrering av rifampin och linezolid resulterade i en 21% minskning av linezolid Cmax [90% CI, 15% - 27%] och en 32% minskning av linezolid AUC0-12 [90% CI, 27% - 37%]. Den kliniska betydelsen av denna interaktion är okänd. Mekanismen för denna interaktion är inte helt klarlagd och kan vara relaterad till induktionen av leverenzymer. Andra starka inducerare av leverenzymer (t.ex. karbamazepin, fenytoin, fenobarbital) kan orsaka en liknande eller mindre minskning av exponeringen för linezolid.
Monoaminoxidashämning
Linezolid är en reversibel, icke-selektiv hämmare av monoaminoxidas. Linezolid har därför potential för interaktion med adrenerga och serotonerga medel.
Adrenerga medel
Vissa individer som får ZYVOX 600 mg kan uppleva en reversibel förstärkning av pressorsvaret på indirektverkande sympatomimetiska medel, vasopressorer eller dopaminerga medel. Vanligt använda läkemedel som fenylpropanolamin och pseudoefedrin har studerats specifikt. Initiala doser av adrenerga medel, såsom dopamin eller epinefrin, bör reduceras och titreras för att uppnå önskat svar.
Tyramin
Ett signifikant pressorsvar har observerats hos normala vuxna försökspersoner som fått linezolid- och tyramindoser på mer än 100 mg. Därför måste patienter som får linezolid undvika att konsumera stora mängder livsmedel eller drycker med hög tyraminhalt [se PATIENTINFORMATION ].
Pseudoefedrin HCl eller fenylpropanolamin HCl
En reversibel förstärkning av pressorsvaret av antingen pseudoefedrin HCl (PSE) eller fenylpropanolamin HCl (PPA) observeras när linezolid administreras till friska normotensiva försökspersoner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ]. En liknande studie har inte utförts på hypertonipatienter. Interaktionsstudierna som utfördes på normotensiva försökspersoner utvärderade blodtrycks- och hjärtfrekvenseffekterna av placebo, PPA eller PSE enbart, linezolid enbart och kombinationen av steady-state linezolid (600 mg var 12:e timme i 3 dagar) med två doser av PPA ( 25 mg) eller PSE (60 mg) ges med 4 timmars mellanrum. Hjärtfrekvensen påverkades inte av någon av behandlingarna. Blodtrycket ökade med båda kombinationsbehandlingarna. Maximala blodtrycksnivåer sågs 2 till 3 timmar efter den andra dosen av PPA eller PSE, och återgick till baslinjen 2 till 3 timmar efter topp. Resultaten av PPA-studien följer, som visar genomsnittligt (och intervall) maximalt systoliskt blodtryck i mm Hg: placebo = 121 (103 till 158); linezolid enbart = 120 (107 till 135); PPA enbart = 125 (106 till 139); PPA med linezolid = 147 (129 till 176). Resultaten från PSE-studien liknade de i PPA-studien. Den genomsnittliga maximala ökningen av systoliskt blodtryck över baslinjen var 32 mm Hg (intervall: 20-52 mm Hg) och 38 mm Hg (intervall: 18-79 mm Hg) under samtidig administrering av linezolid med pseudoefedrin respektive fenylpropanolamin.
Serotonerga medel
Dextrometorfan
Den potentiella läkemedelsinteraktionen med dextrometorfan studerades hos friska frivilliga. Försökspersonerna administrerades dextrometorfan (två 20 mg doser med 4 timmars mellanrum) med eller utan linezolid. Inga effekter av serotonergt syndrom (förvirring, delirium, rastlöshet, skakningar, rodnad, diafores, hyperpyrexi) har observerats hos normala patienter som fått linezolid och dextrometorfan.
Mikrobiologi
Handlingsmekanism
Linezolid är ett syntetiskt antibakteriellt medel av oxazolidinonklassen, som har klinisk användbarhet vid behandling av infektioner orsakade av aeroba grampositiva bakterier. Linezolids aktivitetsspektrum in vitro inkluderar även vissa gramnegativa bakterier och anaeroba bakterier. Linezolid binder till ett ställe på det bakteriella 23S-ribosomala RNA:t i 50S-subenheten och förhindrar bildandet av ett funktionellt 70S-initieringskomplex, vilket är väsentligt för bakteriell reproduktion. Resultaten av tidsdödande studier har visat att linezolid är bakteriostatiskt mot enterokocker och stafylokocker. För streptokocker visade sig linezolid vara bakteriedödande för majoriteten av isolaten.
Motstånd
In vitro-studier har visat att punktmutationer i 23S rRNA är associerade med linezolidresistens. Rapporter om vankomycinresistent Enterococcus faecium som blivit resistent mot linezolid under klinisk användning har publicerats. Det finns rapporter om Staphylococcus aureus (meticillinresistent) som utvecklar resistens mot linezolid under klinisk användning. Linezolidresistensen i dessa organismer är associerad med en punktmutation i organismens 23S rRNA (substitution av tymin mot guanin i position 2576). Organismer som är resistenta mot oxazolidinoner via mutationer i kromosomala gener som kodar för 23S rRNA eller ribosomala proteiner (L3 och L4) är i allmänhet korsresistenta mot linezolid. Även linezolidresistens hos stafylokocker medierad av enzymet metyltransferas har rapporterats. Denna resistens förmedlas av cfr-genen (kloramfenikol-florfenikol) belägen på en plasmid som är överförbar mellan stafylokocker.
Interaktion med andra antimikrobiella läkemedel
In vitro-studier har visat additivitet eller likgiltighet mellan linezolid och vankomycin, gentamicin, rifampin, imipenem-cilastatin, aztreonam, ampicillin eller streptomycin.
Linezolid har visat sig vara aktivt mot de flesta isolat av följande mikroorganismer, både in vitro och vid kliniska infektioner [se INDIKATIONER ].
Gram-positiva bakterier
Enterococcus faecium (endast vancomycin-resistenta isolat) Staphylococcus aureus (inklusive meticillin-resistenta isolat) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Mer än 90 % av följande bakterier uppvisar en MIC in vitro som är mindre än eller lika med den linezolidkänsliga brytpunkten för organismer av liknande släkte. Linezolids säkerhet och effektivitet vid behandling av kliniska infektioner på grund av dessa bakterier har inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Gram-positiva bakterier
Enterococcus faecalis (inklusive vancomycinresistenta isolat) Enterococcus faecium (vancomycinkänsliga isolat) Staphylococcus epidermidis (inklusive meticillinresistenta isolat) Staphylococcus haemolyticus Viridans gruppstreptokocker
Gram-negativa bakterier
Pasteurella multocida
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder som erkänns av FDA för detta läkemedel, se: https://www.fda.gov/STIC.
Djurtoxikologi och/eller farmakologi
Målorgan med linezolidtoxicitet var likartade hos juvenila och vuxna råttor och hundar. Dos- och tidsberoende myelosuppression, vilket framgår av benmärgshypocellularitet/minskad hematopoies, minskad extramedullär hematopoies i mjälte och lever och minskade nivåer av cirkulerande erytrocyter, leukocyter och trombocyter har setts i djurstudier. Lymfoidutarmning inträffade i tymus, lymfkörtlar och mjälte. I allmänhet var de lymfoida fynden associerade med anorexi, viktminskning och undertryckande av kroppsviktsökning, vilket kan ha bidragit till de observerade effekterna.
Hos råttor som administrerades linezolid oralt i 6 månader observerades icke-reversibel, minimal till mild axonal degeneration av ischiasnerver vid 80 mg/kg/dag; minimal degeneration av ischiasnerven observerades också hos 1 hane vid denna dosnivå vid en 3-månaders interimistisk obduktion. Känslig morfologisk utvärdering av perfusionsfixerade vävnader utfördes för att undersöka tecken på degeneration av synnerven. Minimal till måttlig degeneration av synnerven var uppenbar hos 2 hanråttor efter 6 månaders dosering, men det direkta förhållandet till läkemedlet var tvetydigt på grund av fyndets akuta karaktär och dess asymmetriska fördelning. Den observerade nervdegenerationen var mikroskopiskt jämförbar med spontan unilateral degeneration av synnerven som rapporterats hos åldrande råttor och kan vara en förvärring av vanlig bakgrundsförändring.
Dessa effekter observerades vid exponeringsnivåer som är jämförbara med de som observerades hos vissa människor. De hematopoetiska och lymfoida effekterna var reversibla, även om reverseringen i vissa studier var ofullständig under återhämtningsperioden.
Kliniska studier
Vuxna
Nosokomial lunginflammation
Vuxna patienter med kliniskt och radiologiskt dokumenterad nosokomial lunginflammation inkluderades i en randomiserad, dubbelblind studie med flera centra. Patienterna behandlades i 7 till 21 dagar. En grupp fick ZYVOX IV-injektion 600 mg var 12:e timme och den andra gruppen fick vankomycin 1 g var 12:e timme intravenöst. Båda grupperna fick samtidigt aztreonam (1 till 2 g var 8:e timme intravenöst), vilket kunde fortsätta om det var kliniskt indicerat. Det var 203 linezolidbehandlade och 193 vankomycinbehandlade patienter inkluderade i studien. Etthundratjugotvå (60 %) linezolidbehandlade patienter och 103 (53 %) vankomycinbehandlade patienter var kliniskt utvärderbara. Läkningsfrekvensen hos kliniskt utvärderbara patienter var 57 % för linezolidbehandlade patienter och 60 % för vankomycinbehandlade patienter. Läkningsfrekvensen hos kliniskt utvärderbara patienter med ventilatorrelaterad pneumoni var 47 % för linezolidbehandlade patienter och 40 % för vankomycinbehandlade patienter. En modifierad intent-to-treat-analys (MITT) av 94 linezolidbehandlade patienter och 83 vankomycinbehandlade patienter inkluderade försökspersoner som hade en patogen isolerad före behandling. Läkningsfrekvensen i MITT-analysen var 57 % hos linezolidbehandlade patienter och 46 % hos vankomycinbehandlade patienter. Läkningshastigheterna per patogen för mikrobiologiskt utvärderbara patienter presenteras i Tabell 12.
Komplicerade hud- och hudstrukturinfektioner
Vuxna patienter med kliniskt dokumenterade komplicerade hud- och hudstrukturinfektioner inkluderades i en randomiserad, multicenter, dubbelblind, dubbeldummy studie som jämförde studiemediciner administrerade intravenöst följt av mediciner som gavs oralt under totalt 10 till 21 dagars behandling. En grupp patienter fick ZYVOX IV injektion 600 mg var 12:e timme följt av ZYVOX 600 mg tabletter 600 mg var 12:e timme; den andra gruppen fick oxacillin 2 g var 6:e timme intravenöst följt av dikloxacillin 500 mg var 6:e timme oralt. Patienter kan få samtidig aztreonam om det är kliniskt indicerat. Det var 400 linezolidbehandlade och 419 oxacillinbehandlade patienter inkluderade i studien. Tvåhundrafyrtiofem (61 %) linezolidbehandlade patienter och 242 (58 %) oxacillinbehandlade patienter var kliniskt utvärderbara. Läkningsfrekvensen hos kliniskt utvärderbara patienter var 90 % hos linezolidbehandlade patienter och 85 % hos oxacillinbehandlade patienter. En modifierad intent-to-treat-analys (MITT) av 316 linezolidbehandlade patienter och 313 oxacillinbehandlade patienter inkluderade försökspersoner som uppfyllde alla kriterier för studiestart. Läkningsfrekvensen i MITT-analysen var 86 % hos linezolidbehandlade patienter och 82 % hos oxacillinbehandlade patienter. Läkningshastigheterna per patogen för mikrobiologiskt utvärderbara patienter presenteras i tabell 13.
En separat studie gav ytterligare erfarenhet av användningen av ZYVOX vid behandling av meticillinresistenta Staphylococcus aureus (MRSA)-infektioner. Detta var en randomiserad, öppen studie på sjukhusinlagda vuxna patienter med dokumenterad eller misstänkt MRSA-infektion.
En grupp patienter fick ZYVOX IV injektion 600 mg var 12:e timme följt av ZYVOX tabletter 600 mg var 12:e timme. Den andra gruppen patienter fick vankomycin 1 g var 12:e timme intravenöst. Båda grupperna behandlades i 7 till 28 dagar och kunde få samtidig aztreonam eller gentamicin om det var kliniskt indicerat. Läkningsfrekvensen hos mikrobiologiskt utvärderbara patienter med MRSA-hud- och hudstrukturinfektion var 26/33 (79 %) för linezolidbehandlade patienter och 24/33 (73 %) för vankomycinbehandlade patienter.
Diabetesfotinfektioner
Vuxna diabetespatienter med kliniskt dokumenterade komplicerade hud- och hudstrukturinfektioner ("diabetiska fotinfektioner") inkluderades i en randomiserad (förhållande 2:1), multicenter, öppen studie som jämförde studiemediciner administrerade intravenöst eller oralt för totalt 14 till 28 dagars behandling. En grupp patienter fick ZYVOX 600 mg var 12:e timme intravenöst eller oralt; den andra gruppen fick ampicillin/sulbaktam 1,5 till 3 g intravenöst eller amoxicillin/klavulanat 500 till 875 mg var 8:e till 12:e timme oralt. I länder där ampicillin/sulbaktam inte marknadsförs användes amoxicillin/klavulanat 500 mg till 2 g var 6:e timme för den intravenösa behandlingen. Patienter i jämförelsegruppen kunde också behandlas med vankomycin 1 g var 12:e timme intravenöst om MRSA isolerades från fotinfektionen. Patienter i båda behandlingsgrupperna som hade gramnegativa baciller isolerade från infektionsstället kunde också få aztreonam 1 till 2 g var 8-12:e timme intravenöst. Alla patienter var berättigade att få lämpliga kompletterande behandlingsmetoder, såsom debridering och avlastning, som vanligtvis krävs vid behandling av diabetiska fotinfektioner, och de flesta patienter fick dessa behandlingar. Det fanns 241 linezolidbehandlade och 120 komparatorbehandlade patienter i studiepopulationen avsikt att behandla (ITT). Tvåhundratolv (86 %) linezolidbehandlade patienter och 105 (85 %) jämförelsebehandlade patienter var kliniskt utvärderbara. I ITT-populationen var botningsfrekvensen 68,5 % (165/241) hos linezolidbehandlade patienter och 64 % (77/120) hos jämförelsebehandlade patienter, där de med obestämda och uteblivna resultat ansågs misslyckade. Läkningsfrekvensen hos de kliniskt utvärderbara patienterna (exklusive de med obestämda och uteblivna resultat) var 83 % (159/192) och 73 % (74/101) hos linezolid- respektive komparatorbehandlade patienter. En kritisk post-hoc-analys fokuserade på 121 linezolidbehandlade och 60 komparatorbehandlade patienter som hade en grampositiv patogen isolerad från infektionsplatsen eller från blod, som hade färre tecken på underliggande osteomyelit än den totala studiepopulationen, och som inte fått förbjudna antimikrobiella medel. Baserat på den analysen var botningsfrekvensen 71 % (86/121) hos de linezolidbehandlade patienterna och 63 % (38/60) hos de patienter som behandlades med jämförelseläkemedlet. Ingen av ovanstående analyser justerades för användning av tilläggsterapier. Läkningshastigheterna per patogen för mikrobiologiskt utvärderbara patienter presenteras i tabell 14.
Vankomycin-resistenta enterokockinfektioner
Vuxna patienter med dokumenterad eller misstänkt vankomycinresistent enterokockinfektion inkluderades i en randomiserad, multicenter, dubbelblind studie som jämförde en hög dos av ZYVOX (600 mg) med en låg dos av ZYVOX (200 mg) som gavs var 12:e timme antingen intravenöst (IV) eller oralt i 7 till 28 dagar. Patienter kan samtidigt få aztreonam eller aminoglykosider. Det fanns 79 patienter randomiserade till högdos linezolid och 66 till lågdos linezolid. Intent-to-treat-populationen (ITT) med dokumenterad vankomycinresistent enterokockinfektion vid baslinjen bestod av 65 patienter i högdosarmen och 52 i lågdosarmen.
Läkningsfrekvensen för ITT-populationen med dokumenterad vankomycinresistent enterokockinfektion vid baslinjen presenteras i tabell 15 efter infektionskälla. Dessa botningsfrekvenser inkluderar inte patienter med uteblivna eller obestämda resultat. Läkningshastigheten var högre i högdosarmen än i lågdosarmen, även om skillnaden inte var statistiskt signifikant vid 0,05-nivån.
Pediatriska patienter
Infektioner på grund av grampositiva bakterier
En säkerhets- och effektstudie gav erfarenhet av användningen av ZYVOX 600 mg hos pediatriska patienter för behandling av nosokomial lunginflammation, komplicerade hud- och hudstrukturinfektioner och andra infektioner på grund av grampositiva bakteriella patogener, inklusive meticillinresistenta och mottagliga Staphylococcus aureus och vankomycinresistent Enterococcus faecium. Pediatriska patienter i åldern från födseln till 11 år med infektioner orsakade av de dokumenterade eller misstänkta grampositiva bakterierna inkluderades i en randomiserad, openPage-etikett, jämförelsekontrollerad studie. En grupp patienter fick ZYVOX 600 mg IV-injektion 10 mg/kg var 8:e timme följt av ZYVOX 600 mg för oral suspension 10 mg/kg var 8:e timme. En andra grupp fick vankomycin 10 till 15 mg/kg intravenöst var 6:e till 24:e timme, beroende på ålder och renalt clearance. Patienter som hade bekräftat VRE-infektioner placerades i en tredje arm av studien och fick ZYVOX 10 mg/kg var 8:e timme intravenöst och/eller oralt. Alla patienter behandlades i totalt 10 till 28 dagar och kunde få samtidiga gramnegativa antibakteriella läkemedel om det var kliniskt indicerat. I Intent-to-treat-populationen (ITT) fanns 206 patienter randomiserade till linezolid och 102 patienter randomiserade till vankomycin. Läkningsfrekvensen för ITT, MITT och kliniskt utvärderbara patienter presenteras i Tabell 16. Efter att studien avslutats inkluderades ytterligare 13 patienter från 4 dagar till 16 års ålder i en öppen förlängning av VRE-armen i studie. Tabell 17 visar kliniska botningshastigheter per patogen för mikrobiologiskt utvärderbara patienter inklusive mikrobiologiskt utvärderbara patienter med vankomycinresistent Enterococcus faecium från förlängningen av denna studie.
PATIENTINFORMATION
Viktiga administrationsinstruktioner
Informera patienter om att ZYVOX kan tas med eller utan mat.
Perifer och optisk neuropati
Rekommendera patienter att informera sin läkare om de upplever förändringar i synen när de tar ZYVOX [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Serotonin syndrom
Rekommendera patienter att informera sin läkare om de tar serotonerga medel, inklusive serotoninåterupptagshämmare eller andra antidepressiva medel och opioider [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Potentiella interaktioner som producerar förhöjt blodtryck
- Rekommendera patienter att informera sin läkare om de har en historia av hypertoni.
- Rekommendera patienter att undvika stora mängder mat eller dryck med hög tyraminhalt när de tar ZYVOX. Livsmedel med hög tyraminhalt inkluderar de som kan ha genomgått proteinförändringar genom åldrande, jäsning, betning eller rökning för att förbättra smaken, såsom lagrade ostar, fermenterat eller lufttorkat kött, surkål, sojasås, knasöl och röda viner. Tyramininnehållet i alla proteinrika livsmedel kan öka om de förvaras under långa perioder eller felaktigt kylda.
- Rekommendera patienter att informera sin läkare om de tar mediciner som innehåller pseudoefedrin HCl eller fenylpropanolamin HCl, såsom förkylningsmedel och avsvällande medel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Mjölksyra
Rekommendera patienter att informera sin läkare om de upplever upprepade episoder av illamående eller kräkningar när de får ZYVOX [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kramper
Rekommendera patienter att informera sin läkare om de har en historia av anfall eller kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hypoglykemi
Rekommendera patienter att informera sin läkare om de har diabetes mellitus. Hypoglykemiska reaktioner, såsom diafores och skakningar, tillsammans med låga blodsockermätningar kan inträffa vid behandling med linezolid. Om sådana reaktioner uppstår bör patienter kontakta en läkare eller annan hälso- och sjukvårdspersonal för korrekt behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hyponatremi och/eller SIADH
Rekommendera patienter med risk för hyponatremi att informera sin läkare om de upplever tecken och symtom på hyponatremi och/eller SIADH, inklusive förvirring, somnolens, allmän svaghet och andnöd [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Fenylketonuri
Informera patienter med fenylketonuri (PKU) att varje 5 ml av 100 mg/5 ml ZYVOX för oral suspension innehåller 20 mg fenylalanin. De andra ZYVOX 600 mg formuleringarna innehåller inte fenylalanin. Fenylalanin kan vara skadligt för patienter med fenylketonuri. Kontakta din läkare eller apotekspersonal när du ordinerats med ZYVOX 600mg för oral suspension [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Antibakteriell resistens
Patienter bör informeras om att antibakteriella läkemedel inklusive ZYVOX endast bör användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När ZYVOX 600 mg ordineras för att behandla en bakteriell infektion, bör patienterna informeras om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan minska effektiviteten av den omedelbara behandlingen och öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med ZYVOX eller andra antibakteriella läkemedel i framtiden.
Diarre
Diarré är ett vanligt problem som orsakas av antibakteriella läkemedel, som vanligtvis upphör när det antibakteriella läkemedlet avbryts. Ibland kan patienter efter påbörjad behandling med antibakteriella läkemedel utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av det antibakteriella läkemedlet. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Infertilitet
Informera manliga patienter att ZYVOX reversibelt kan försämra fertiliteten [se Användning i specifika populationer ].
Denna produkts märkning kan ha uppdaterats. För den senaste förskrivningsinformationen, besök www.pfizer.com.
