Levaquin 250mg, 500mg, 750mg Levofloxacin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Levaquin 750mg och hur används det?
Levaquin är ett receptbelagt läkemedel som används för att behandla symptomen på olika bakterieinfektioner. Levaquin kan användas ensamt eller tillsammans med andra läkemedel.
Levaquin 500mg tillhör en klass av läkemedel som kallas fluorokinoloner.
Det är inte känt om Levaquin är säkert och effektivt för barn under behandlingstid över 14 dagar.
Vilka är de möjliga biverkningarna av Levaquin 500mg?
Levaquin 750mg kan orsaka allvarliga biverkningar inklusive:
- huvudvärk,
- hunger,
- svettas,
- irritabilitet,
- yrsel,
- illamående,
- snabb puls,
- känner sig orolig eller skakig,
- domningar eller stickningar i händer, armar, ben eller fötter,
- svaghet i dina armar, händer, ben eller fötter,
- brännande smärta i armar, händer, ben eller fötter,
- allvarliga humör- eller beteendeförändringar,
- nervositet,
- förvirring,
- agitation,
- paranoia,
- hallucinationer,
- minnesproblem,
- koncentrationssvårigheter,
- tankar på självmord,
- senor bristning,
- plötslig smärta,
- svullnad,
- blåmärken,
- ömhet,
- styvhet,
- rörelseproblem,
- ett knäppande eller knäppande ljud i någon av dina leder,
- svåra magsmärtor,
- diarré som är vattnig eller blodig,
- fladdrande i ditt bröst,
- andnöd,
- hudutslag,
- andningsproblem,
- kramper (kramper),
- svår huvudvärk,
- synproblem,
- smärta bakom dina ögon,
- ont i övre magen,
- aptitlöshet,
- mörk urin,
- lerfärgade pallar, och
- gulfärgning av huden eller ögonen (gulsot)
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Levaquin 250mg inkluderar:
- illamående,
- förstoppning,
- diarre,
- huvudvärk,
- yrsel och
- sömnproblem
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Levaquin. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
ALLVARLIGA BIVERKNINGAR INKLUSIVE TENDINIT, SENRUPTUR, PERIFER NEUROPATI, EFFEKTER AV CENTRALA NERVSYSTEMET OCH FÖRSVARNING AV MYASTHENIA GRAVIS
- Fluorokinoloner, inklusive LEVAQUIN®, har associerats med invalidiserande och potentiellt irreversibla allvarliga biverkningar som har inträffat tillsammans [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER], inklusive:
- Tendinit och senruptur [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- Perifer neuropati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- Effekter på centrala nervsystemet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
Avbryt LEVAQUIN® omedelbart och undvik användningen av fluorokinoloner, inklusive LEVAQUIN®, hos patienter som upplever någon av dessa allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- Fluorokinoloner, inklusive LEVAQUIN®, kan förvärra muskelsvaghet hos patienter med myasthenia gravis. Undvik LEVAQUIN® hos patienter med en känd historia av myasthenia gravis [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Eftersom fluorokinoloner, inklusive LEVAQUIN®, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], reservera LEVAQUIN® för användning till patienter som inte har några alternativa behandlingsalternativ för följande indikationer:
- Okomplicerad urinvägsinfektion [se INDIKATIONER ]
- Akut bakteriell exacerbation av kronisk bronkit [se INDIKATIONER ]
- Akut bakteriell bihåleinflammation [se INDIKATIONER ].
BESKRIVNING
LEVAQUIN® tabletter är syntetiska antibakteriella medel för oral administrering. Kemiskt sett är levofloxacin, en kiral fluorerad karboxikinolon, den rena (-)-(S)-enantiomeren av den racemiska läkemedelssubstansen ofloxacin. Det kemiska namnet är (-)-(S)-9-fluoro-2,3-dihydro-3-metyl-10-(4-metyl-1-piperazinyl)-7-oxo-7H-pyrido[1,2, 3-de]-1,4-bensoxazin-6-karboxylsyrahemihydrat.
Figur 1: Levofloxacins kemiska struktur
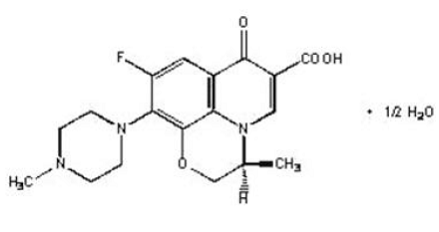
Den empiriska formeln är C18H20FN3O4 · ½ H2O och molekylvikten är 370,38. Levofloxacin är ett ljust gulvitt till gulvitt kristall eller kristallint pulver. Molekylen existerar som en zwitterjon vid pH-förhållandena i tunntarmen.
Data visar att från pH 0,6 till 5,8 är lösligheten av levofloxacin väsentligen konstant (ungefär 100 mg/ml). Levofloxacin anses lösligt till fritt lösligt i detta pH-intervall, enligt definitionen i USP-nomenklaturen. Över pH 5,8 ökar lösligheten snabbt till sitt maximum vid pH 6,7 (272 mg/ml) och anses vara fritt löslig i detta intervall. Över pH 6,7 minskar lösligheten och når ett minimivärde (ca 50 mg/ml) vid ett pH på ungefär 6,9.
Levofloxacin har potential att bilda stabila koordinationsföreningar med många metalljoner. Denna keleringspotential in vitro har följande bildningsordning: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
LEVAQUIN® tabletter finns tillgängliga som filmdragerade tabletter och innehåller följande inaktiva ingredienser:
- 250 mg (uttryckt i vattenfri form): krospovidon, hypromellos, magnesiumstearat, mikrokristallin cellulosa, polyetylenglykol, polysorbat 80, syntetisk röd järnoxid och titandioxid.
- 500 mg (uttryckt i vattenfri form): krospovidon, hypromellos, magnesiumstearat, mikrokristallin cellulosa, polyetylenglykol, polysorbat 80, syntetiska röda och gula järnoxider och titandioxid.
- 750 mg (uttryckt i vattenfri form): krospovidon, hypromellos, magnesiumstearat, mikrokristallin cellulosa, polyetylenglykol, polysorbat 80, titandioxid.
INDIKATIONER
Nosokomial lunginflammation
LEVAQUIN® är indicerat för vuxna patienter för behandling av nosokomial lunginflammation på grund av meticillinkänsliga Staphylococcus aureus, Pseudomonas aeruginosa, Serratia marcescens, Escherichia coli, Klebsiella pneumoniae, Haemophilus influenzae eller Streptococcus pneumoniae. Tilläggsbehandling bör användas som kliniskt indicerat. Där Pseudomonas aeruginosa är en dokumenterad eller presumtiv patogen, rekommenderas kombinationsbehandling med en anti-pseudomonal β-laktam [se Kliniska studier ].
Samhällsförvärvad lunginflammation
7 till 14 dagars behandlingsregimen
LEVAQUIN® är indicerat till vuxna patienter för behandling av samhällsförvärvad lunginflammation på grund av meticillinkänsliga Staphylococcus aureus, Streptococcus pneumoniae (inklusive multiresistenta Streptococcus pneumoniae [MDRSP]), Haemophilus influenza Morenzae, Haemophilus influenza Morenzae, Hafluenzae, Hafluenzae, Hafluenzae , Chlamydophila pneumoniae, Legionella pneumophila eller Mycoplasma pneumoniae [se DOSERING OCH ADMINISTRERING och Kliniska studier ].
MDRSP-isolat är isolat som är resistenta mot två eller flera av följande antibakteriella medel: penicillin (MIC ≥2 mcg/ml), 2:a generationens cefalosporiner, t.ex. cefuroxim, makrolider, tetracykliner och trimetoprim/sulfametoxazol.
Samhällsförvärvad lunginflammation
5-dagars behandling
LEVAQUIN® är indicerat till vuxna patienter för behandling av samhällsförvärvad lunginflammation orsakad av Streptococcus pneumoniae (exklusive multiresistenta isolat [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumyoniae, eller Chneumydophila DOSERING OCH ADMINISTRERING och Kliniska studier ].
Komplicerade hud- och hudstrukturinfektioner
LEVAQUIN® är indicerat till vuxna patienter för behandling av komplicerade hud- och hudstrukturinfektioner på grund av meticillinkänsliga Staphylococcus aureus, Enterococcus faecalis, Streptococcus pyogenes eller Proteus mirabilis [se Kliniska studier ].
Okomplicerade hud- och hudstrukturinfektioner
LEVAQUIN® är indicerat till vuxna patienter för behandling av okomplicerade hud- och hudstrukturinfektioner (lindriga till måttliga) inklusive abscesser, celluliter, furunkler, impetigo, pyodermi, sårinfektioner, på grund av meticillinkänsliga Staphylococcus aureus eller Streptococcus pyogenes.
Kronisk bakteriell prostatit
LEVAQUIN® är indicerat till vuxna patienter för behandling av kronisk bakteriell prostatit orsakad av Escherichia coli, Enterococcus faecalis eller meticillinkänslig Staphylococcus epidermidis [se Kliniska studier ].
Inhalationsmjältbrand (efter exponering)
LEVAQUIN® är indicerat för inhalationsmjältbrand (efter exponering) för att minska incidensen eller progressionen av sjukdom efter exponering för aerosoliserad Bacillus anthracis hos vuxna och pediatriska patienter, 6 månader och äldre [se DOSERING OCH ADMINISTRERING ]. Effektiviteten av LEVAQUIN® baseras på plasmakoncentrationer som uppnåtts hos människor, ett surrogateffektmått som rimligen kan förutsäga klinisk nytta.
LEVAQUIN® har inte testats på människor för att förebygga efter exponering av inhalationsmjältbrand. Säkerheten för LEVAQUIN® hos vuxna under behandlingsperioder längre än 28 dagar eller hos pediatriska patienter för behandlingslängder längre än 14 dagar har inte studerats. Långvarig LEVAQUIN®-behandling ska endast användas när nyttan överväger risken [se Kliniska studier ].
Plåga
LEVAQUIN® är indicerat för behandling av pest, inklusive pneumonisk och septikemisk pest, på grund av Yersinia pestis (Y. pestis) och profylax mot pest hos vuxna och pediatriska patienter, 6 månader och äldre [se DOSERING OCH ADMINISTRERING ].
Effektstudier av LEVAQUIN® kunde inte utföras på människor med pest av etiska och genomförbarhetsskäl. Därför baserades godkännandet av denna indikation på en effektstudie utförd på djur [se Kliniska studier ].
Komplicerade urinvägsinfektioner
5-dagars behandling
LEVAQUIN® är indicerat till vuxna patienter för behandling av komplicerade urinvägsinfektioner på grund av Escherichia coli, Klebsiella pneumoniae eller Proteus mirabilis [se Kliniska studier ].
Komplicerade urinvägsinfektioner
10-dagars behandling
LEVAQUIN® är indicerat för vuxna patienter för behandling av komplicerade urinvägsinfektioner (lindriga till måttliga) på grund av Enterococcus faecalis, Enterobacter cloacae, Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis eller Pseudomonas aeruginosa [se Kliniska studier ].
Akut pyelonefrit
5 eller 10-dagars behandling
LEVAQUIN® är indicerat till vuxna patienter för behandling av akut pyelonefrit orsakad av Escherichia coli, inklusive fall med samtidig bakteriemi [se Kliniska studier ].
Okomplicerade urinvägsinfektioner
LEVAQUIN® är indicerat till vuxna patienter för behandling av okomplicerade urinvägsinfektioner (lindriga till måttliga) på grund av Escherichia coli, Klebsiella pneumoniae eller Staphylococcus saprophyticus.
Eftersom fluorokinoloner, inklusive LEVAQUIN®, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och för vissa patienter är okomplicerad urinvägsinfektion självbegränsande, reservera LEVAQUIN® för behandling av okomplicerade urinvägsinfektioner hos patienter som inte har några alternativa behandlingsalternativ.
Akut bakteriell exacerbation av kronisk bronkit
LEVAQUIN® är indicerat till vuxna patienter för behandling av akut bakteriell exacerbation av kronisk bronkit (ABECB) på grund av meticillinkänsliga Staphylococcus aureus, Streptococcus pneumoniae, Haemophilus influenzae, Haemophilus parainfluenzae catarrhal eller Morisaxella.
Eftersom fluorokinoloner, inklusive LEVAQUIN®, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ] och för vissa patienter är ABECB självbegränsande, reservera LEVAQUIN® för behandling av ABECB hos patienter som inte har några alternativa behandlingsalternativ.
Akut bakteriell bihåleinflammation
5-dagars och 10–14 dagars behandlingsregimer
LEVAQUIN® är indicerat för vuxna patienter för behandling av akut bakteriell bihåleinflammation (ABS) orsakad av Streptococcus pneumoniae, Haemophilus influenzae eller Moraxella catarrhalis [se Kliniska studier ].
Eftersom fluorokinoloner, inklusive LEVAQUIN®, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och för vissa patienter är ABS självbegränsande, reservera LEVAQUIN® för behandling av ABS hos patienter som inte har några alternativa behandlingsalternativ.
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten av LEVAQUIN® och andra antibakteriella läkemedel, bör LEVAQUIN® endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta orsakas av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
Kultur och känslighetstestning
Lämpliga odlings- och känslighetstester bör utföras före behandling för att isolera och identifiera organismer som orsakar infektionen och för att fastställa deras känslighet för levofloxacin [se Mikrobiologi ]. Behandling med LEVAQUIN® kan påbörjas innan resultaten av dessa tester är kända; När resultaten blir tillgängliga bör lämplig terapi väljas.
Som med andra läkemedel i denna klass kan vissa isolat av Pseudomonas aeruginosa utveckla resistens ganska snabbt under behandling med LEVAQUIN®. Odlings- och känslighetstestning som utförs med jämna mellanrum under behandlingen kommer att ge information om patogenernas fortsatta känslighet för det antimikrobiella medlet och även den möjliga uppkomsten av bakteriell resistens.
DOSERING OCH ADMINISTRERING
Dosering av LEVAQUIN® tabletter hos vuxna patienter med kreatininclearance ≥ 50 ml/minut
Den vanliga dosen av LEVAQUIN® tabletter är 250 mg, 500 mg eller 750 mg administrerad oralt var 24:e timme, vilket indikeras av infektion och beskrivs i Tabell 1.
Dessa rekommendationer gäller patienter med kreatininclearance ≥ 50 ml/minut. För patienter med kreatininclearance mindre än 50 ml/min krävs justeringar av doseringsregimen [se Dosjustering hos vuxna med nedsatt njurfunktion ].
Dosering av LEVAQUIN® tabletter hos pediatriska patienter med inhalationsmjältbrand eller pest
Doseringen av LEVAQUIN® tabletter för inhalationsmjältbrand (efter exponering) och pest hos pediatriska patienter som väger 30 kg eller mer beskrivs nedan i tabell 2. LEVAQUIN® tabletter kan inte administreras till patienter som väger mindre än 30 kg på grund av begränsningarna av den tillgängliga styrkan. Alternativa formuleringar av levofloxacin kan övervägas för pediatriska patienter som väger mindre än 30 kg.
Dosjustering hos vuxna med nedsatt njurfunktion
Administrera LEVAQUIN® med försiktighet till patienter med nedsatt njurfunktion. Noggrann klinisk observation och lämpliga laboratoriestudier bör utföras före och under behandlingen eftersom elimineringen av levofloxacin kan vara reducerad hos dessa patienter.
Hos patienter med nedsatt njurfunktion (kreatininclearance mindre än 50 ml/min) är justering av dosregimen nödvändig för att undvika ackumulering av levofloxacin på grund av minskat clearance [se Användning i specifika populationer ]. Ingen justering är nödvändig för patienter med ett kreatininclearance större än eller lika med 50 ml/minut.
Tabell 3 visar hur dosen justeras baserat på kreatininclearance.
Läkemedelsinteraktion med kelationsmedel
Antacida, sukralfat, metallkatjoner, multivitaminer
LEVAQUIN® tabletter ska administreras minst två timmar före eller två timmar efter antacida innehållande magnesium, aluminium, samt sukralfat, metallkatjoner som järn och multivitaminpreparat med zink eller didanosin tuggbara/buffrade tabletter eller det pediatriska pulvret för oral lösning [ser LÄKEMEDELSINTERAKTIONER och PATIENTINFORMATION ].
Administrationsinstruktioner
LEVAQUIN® tabletter kan administreras utan hänsyn till mat.
Hydrering för patienter som får LEVAQUIN®-tabletter
Adekvat hydrering av patienter som får LEVAQUIN® bör upprätthållas för att förhindra bildandet av högkoncentrerad urin. Kristalluri och cylindruri har rapporterats med kinoloner [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
HUR LEVERERAS
Doseringsformer och styrkor
TABLETTER, filmdragerade, kapselformade
- 250 mg terrakotta rosa tabletter, märkta med "250" på ena sidan och "LEVAQUIN" på den andra sidan
- 500 mg persikotabletter, märkta med "500" på ena sidan och "LEVAQUIN" på andra sidan
- 750 mg vita tabletter, märkta med "750" på ena sidan och "LEVAQUIN" på den andra sidan
Förvaring Och Hantering
LEVAQUIN® tabletter levereras som 250, 500 och 750 mg kapselformade, dragerade tabletter.
LEVAQUIN® tabletter är förpackade i flaskor i följande konfigurationer:
- 250 mg tabletter är terrakotta rosa och är märkta: "LEVAQUIN®" på ena sidan och "250" på den andra sidan
- flaskor med 50 st ( NDC 50458-920-50)
- 500 mg tabletter är persika och är märkta: "LEVAQUIN®" på ena sidan och "500" på den andra sidan
- flaskor med 50 st ( NDC 50458-925-50)
- 750 mg tabletter är vita och är märkta "LEVAQUIN®" på ena sidan och "750" på den andra sidan
- flaskor med 20 ( NDC 50458-930-20)
LEVAQUIN® tabletter ska förvaras vid 15° till 30°C (59° till 86°F) i väl tillslutna behållare.
Tillverkad av: Active Ingredient Made in Japan. Reviderad: juli 2018
BIEFFEKTER
Allvarliga och annars viktiga biverkningar
Följande allvarliga och i övrigt viktiga biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Inaktiverande och potentiellt irreversibla allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Tendinit och senbristning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Perifer neuropati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Centrala nervsystemets effekter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Exacerbation av Myasthenia Gravis [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Andra allvarliga och ibland dödliga reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Clostridium difficile-associerad diarré [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Förlängning av QT-intervallet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Muskuloskeletala sjukdomar hos pediatriska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Blodsockerstörningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Fotosensitivitet/fototoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Utveckling av läkemedelsresistenta bakterier [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Kristalluri och cylindruri har rapporterats med kinoloner, inklusive LEVAQUIN®. Därför bör adekvat hydrering av patienter som får LEVAQUIN® upprätthållas för att förhindra bildandet av en högkoncentrerad urin [se DOSERING OCH ADMINISTRERING ].
Erfarenhet av klinisk prövning
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Data som beskrivs nedan återspeglar exponering för LEVAQUIN® hos 7537 patienter i 29 poolade fas 3 kliniska prövningar. Den studerade populationen hade en medelålder på 50 år (ungefär 74 % av befolkningen var INDIKATIONER ]. Patienterna fick LEVAQUIN® doser på 750 mg en gång dagligen, 250 mg en gång dagligen eller 500 mg en eller två gånger dagligen.
Behandlingstiden var vanligtvis 3–14 dagar och medelantalet behandlingsdagar var 10 dagar.
Den totala incidensen, typen och fördelningen av biverkningar var likartad hos patienter som fick LEVAQUIN® doser på 750 mg en gång dagligen, 250 mg en gång dagligen och 500 mg en eller två gånger dagligen.
Avbrytande av LEVAQUIN® på grund av biverkningar inträffade hos 4,3 % av patienterna totalt, 3,8 % av patienterna behandlade med 250 mg och 500 mg doserna och 5,4 % av patienterna behandlade med 750 mg dosen. De vanligaste biverkningarna som ledde till att behandlingen avbröts med 250 och 500 mg doserna var gastrointestinala (1,4 %), främst illamående (0,6 %). kräkningar (0,4%); yrsel (0,3%); och huvudvärk (0,2%). De vanligaste biverkningarna som ledde till att behandlingen avbröts med 750 mg-dosen var gastrointestinala (1,2 %), främst illamående (0,6 %), kräkningar (0,5 %). yrsel (0,3%); och huvudvärk (0,3%).
Biverkningar som förekommer hos ≥1 % av LEVAQUIN®-behandlade patienter och mindre vanliga biverkningar, som förekommer hos 0,1 till
kliniska prövningar med flerdosbehandling har oftalmologiska avvikelser, inklusive grå starr och multipla punktformade linsformade opaciteter, noterats hos patienter som genomgår behandling med kinoloner, inklusive LEVAQUIN®. Läkemedlens samband med dessa händelser är för närvarande inte fastställt.
Erfarenhet efter marknadsföring
Tabell 6 listar biverkningar som har identifierats efter användning av LEVAQUIN® efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
LÄKEMEDELSINTERAKTIONER
Kelationsmedel
Antacida, sukralfat, metallkatjoner, multivitaminer
Även om kelateringen av tvåvärda katjoner är mindre markerad än med andra fluorokinoloner, kan samtidig administrering av LEVAQUIN® tabletter med antacida innehållande magnesium eller aluminium, såväl som sukralfat, metallkatjoner som järn och multivitaminpreparat med zink störa den gastrointestinala absorptionen av levofloxacin, vilket resulterar i systemiska nivåer som är betydligt lägre än önskat. Tabletter med antacida innehållande magnesium, aluminium samt sukralfat, metallkatjoner såsom järn och multivitaminpreparat med zink eller didanosin kan avsevärt störa den gastrointestinala absorptionen av levofloxacin, vilket resulterar i systemiska nivåer som är betydligt lägre än önskat. Dessa medel bör tas minst två timmar före eller två timmar efter oral administrering av LEVAQUIN®.
Warfarin
Ingen signifikant effekt av LEVAQUIN® på maximala plasmakoncentrationer, AUC och andra dispositionsparametrar för R- och S-warfarin upptäcktes i en klinisk studie som involverade friska frivilliga. På liknande sätt observerades ingen tydlig effekt av warfarin på absorption och disposition av levofloxacin. Det har dock förekommit rapporter under erfarenheterna efter marknadsföringen av patienter att LEVAQUIN® förstärker effekterna av warfarin. Förhöjda protrombintider vid samtidig användning av warfarin och LEVAQUIN® har associerats med blödningsepisoder. Protrombintid, International Normalized Ratio (INR) eller andra lämpliga antikoaguleringstester bör övervakas noggrant om LEVAQUIN® administreras samtidigt med warfarin. Patienter bör också övervakas för tecken på blödning [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Antidiabetiska medel
Störningar i blodsocker, inklusive hyperglykemi och hypoglykemi, har rapporterats hos patienter som behandlats samtidigt med fluorokinoloner och ett antidiabetesmedel. Därför rekommenderas noggrann övervakning av blodsocker när dessa medel administreras samtidigt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER , och PATIENTINFORMATION ].
Icke-steroida antiinflammatoriska läkemedel
Samtidig administrering av ett icke-steroidalt antiinflammatoriskt läkemedel med en fluorokinolon, inklusive LEVAQUIN®, kan öka risken för CNS-stimulering och krampanfall [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Teofyllin
Ingen signifikant effekt av LEVAQUIN® på plasmakoncentrationer, AUC och andra dispositionsparametrar för teofyllin upptäcktes i en klinisk studie som involverade friska frivilliga. På liknande sätt observerades ingen tydlig effekt av teofyllin på absorption och disposition av levofloxacin. Samtidig administrering av andra fluorokinoloner med teofyllin har dock resulterat i förlängd eliminationshalveringstid, förhöjda serumnivåer av teofyllin och en efterföljande ökning av risken för teofyllinrelaterade biverkningar i patientpopulationen. Därför bör teofyllinnivåerna övervakas noggrant och lämpliga dosjusteringar göras när LEVAQUIN® ges samtidigt. Biverkningar, inklusive krampanfall, kan förekomma med eller utan förhöjda teofyllinnivåer i serum [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Cyklosporin
Ingen signifikant effekt av LEVAQUIN® på maximala plasmakoncentrationer, AUC och andra dispositionsparametrar för ciklosporin upptäcktes i en klinisk studie som involverade friska frivilliga. Emellertid har förhöjda serumnivåer av ciklosporin rapporterats i patientpopulationen vid samtidig administrering med vissa andra fluorokinoloner. Levofloxacins Cmax och ke var något lägre medan Tmax och t1/2 var något längre i närvaro av ciklosporin än de som observerats i andra studier utan samtidig medicinering. Skillnaderna anses dock inte vara kliniskt signifikanta. Därför krävs ingen dosjustering för LEVAQUIN® eller ciklosporin vid samtidig administrering.
Digoxin
Ingen signifikant effekt av LEVAQUIN® på maximala plasmakoncentrationer, AUC och andra dispositionsparametrar för digoxin upptäcktes i en klinisk studie som involverade friska frivilliga. Levofloxacins absorption och dispositionskinetik var liknande i närvaro eller frånvaro av digoxin. Därför krävs ingen dosjustering av LEVAQUIN® eller digoxin vid samtidig administrering.
Probenecid och Cimetidin
Ingen signifikant effekt av probenecid eller cimetidin på Cmax för levofloxacin observerades i en klinisk studie med friska frivilliga. AUC och t1/2 för levofloxacin var högre medan CL/F och CLR var lägre under samtidig behandling av LEVAQUIN® med probenecid eller cimetidin jämfört med enbart LEVAQUIN®. Dessa förändringar motiverar dock inte dosjustering av LEVAQUIN® när probenecid eller cimetidin ges samtidigt.
Interaktioner med laboratorie- eller diagnostiska tester
Vissa fluorokinoloner, inklusive LEVAQUIN®, kan ge falskt positiva urinscreeningsresultat för opiater med kommersiellt tillgängliga immunanalyssatser. Bekräftelse av positiva opiatscreeningar med mer specifika metoder kan vara nödvändig.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Invalidiserande och potentiellt irreversibla allvarliga biverkningar inklusive tendinit och senruptur, perifer neuropati och effekter på centrala nervsystemet
Fluorokinoloner, inklusive LEVAQUIN®, har associerats med invalidiserande och potentiellt irreversibla allvarliga biverkningar från olika kroppssystem som kan uppträda tillsammans hos samma patient. Vanliga biverkningar inkluderar tendinit, senruptur, artralgi, myalgi, perifer neuropati och effekter på centrala nervsystemet (hallucinationer, ångest, depression, sömnlöshet, svår huvudvärk och förvirring). Dessa reaktioner kan uppstå inom timmar till veckor efter start av LEVAQUIN®. Patienter i alla åldrar eller utan redan existerande riskfaktorer har upplevt dessa biverkningar [se Tendinit och senbristning, perifer neuropati, effekter på centrala nervsystemet ].
Avbryt LEVAQUIN® omedelbart vid de första tecknen eller symtomen på någon allvarlig biverkning. Undvik dessutom användningen av fluorokinoloner, inklusive LEVAQUIN®, hos patienter som har upplevt någon av dessa allvarliga biverkningar i samband med fluorokinoloner.
Tendinit Och Senruptur
Fluorokinoloner, inklusive LEVAQUIN®, har associerats med en ökad risk för tendinit och senruptur i alla åldrar [se Invalidiserande och potentiellt irreversibla allvarliga biverkningar inklusive tendinit och senruptur, perifer neuropati och effekter på centrala nervsystemet och NEGATIVA REAKTIONER ]. Denna biverkning involverar oftast akillessenan och har även rapporterats med rotatorkuffen (axeln), handen, bicepsen, tummen och andra senor. Tendinit eller senruptur kan inträffa inom timmar eller dagar efter start av LEVAQUIN® eller så länge som flera månader efter avslutad fluorokinolonbehandling. Tendinit och senruptur kan uppstå bilateralt.
Risken för att utveckla fluorokinolonrelaterad tendinit och senruptur är ökad hos patienter över 60 år, hos dem som tar kortikosteroidläkemedel och hos patienter med njur-, hjärt- eller lungtransplantationer. Andra faktorer som oberoende av varandra kan öka risken för senruptur inkluderar ansträngande fysisk aktivitet, njursvikt och tidigare sensjukdomar som reumatoid artrit. Tendinit och senruptur har rapporterats hos patienter som tar fluorokinoloner som inte har ovanstående riskfaktorer. Avbryt LEVAQUIN® omedelbart om patienten upplever smärta, svullnad, inflammation eller bristning av en sena. Patienter bör rådas att vila vid det första tecknet på tendinit eller senruptur och att kontakta sin vårdgivare angående byte till ett icke-kinolon antimikrobiellt läkemedel. Undvik LEVAQUIN® hos patienter som har en historia av senor eller senruptur [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Perifer neuropati
Fluorokinoloner, inklusive LEVAQUIN®, har associerats med en ökad risk för perifer neuropati. Fall av sensorisk eller sensorimotorisk axonal polyneuropati som påverkar små och/eller stora axoner som resulterar i parestesier, hypoestesier, dysestesier och svaghet har rapporterats hos patienter som får fluorokinoloner, inklusive LEVAQUIN®. Symtom kan uppträda kort efter påbörjad behandling med LEVAQUIN® och kan vara irreversibla hos vissa patienter [se Invalidiserande och potentiellt irreversibla allvarliga biverkningar inklusive tendinit och senruptur, perifer neuropati och effekter på centrala nervsystemet och NEGATIVA REAKTIONER ].
Avbryt LEVAQUIN® omedelbart om patienten upplever symtom på neuropati inklusive smärta, sveda, stickningar, domningar och/eller svaghet eller andra förändringar av känseln inklusive lätt beröring, smärta, temperatur, positionskänsla och vibrationskänsla. Undvik fluorokinoloner, inklusive LEVAQUIN®, hos patienter som tidigare har upplevt perifer neuropati [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Effekter på centrala nervsystemet
Fluorokinoloner, inklusive LEVAQUIN®, har associerats med en ökad risk för effekter på centrala nervsystemet (CNS), inklusive kramper, toxiska psykoser, ökat intrakraniellt tryck (inklusive pseudotumor cerebri). Fluorokinoloner kan också orsaka stimulering av centrala nervsystemet vilket kan leda till skakningar, rastlöshet, ångest, yrsel, förvirring, hallucinationer, paranoia, depression, mardrömmar och sömnlöshet. Självmordstankar och försök eller fullbordat självmord kan också förekomma, särskilt hos patienter med en medicinsk historia av depression eller en underliggande riskfaktor för depression. Dessa reaktioner kan inträffa efter den första dosen. Om dessa reaktioner uppstår hos patienter som får LEVAQUIN®, avbryt behandlingen med LEVAQUIN® och vidta lämpliga åtgärder. Liksom med andra fluorokinoloner ska LEVAQUIN® användas med försiktighet till patienter med en känd eller misstänkt störning i centrala nervsystemet (CNS) som kan predisponera dem för anfall eller sänka kramptröskeln (t.ex. svår cerebral arterioskleros, epilepsi) eller i närvaro av andra riskfaktorer som kan predisponera dem för anfall eller sänka kramptröskeln (t.ex. viss läkemedelsbehandling, njurdysfunktion). [ser NEGATIVA REAKTIONER , LÄKEMEDELSINTERAKTIONER , och PATIENTINFORMATION ].
Exacerbation av Myasthenia Gravis
Fluorokinoloner, inklusive LEVAQUIN®, har neuromuskulär blockerande aktivitet och kan förvärra muskelsvaghet hos patienter med myasthenia gravis. Allvarliga biverkningar efter marknadsföring inklusive dödsfall och behov av ventilationsstöd har associerats med användning av fluorokinolon hos patienter med myasthenia gravis. Undvik LEVAQUIN® hos patienter med en känd historia av myasthenia gravis [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Andra allvarliga och ibland dödliga biverkningar
Andra allvarliga och ibland dödliga biverkningar, vissa på grund av överkänslighet och några på grund av osäker etiologi, har rapporterats i sällsynta fall hos patienter som behandlas med fluorokinoloner, inklusive LEVAQUIN®. Dessa händelser kan vara allvarliga och uppträder vanligtvis efter administrering av flera doser. Kliniska manifestationer kan inkludera en eller flera av följande:
- feber, hudutslag eller allvarliga dermatologiska reaktioner (t.ex. toxisk epidermal nekrolys, Stevens-Johnsons syndrom);
- vaskulit; artralgi; muskelvärk; serumsjuka;
- allergisk pneumonit;
- interstitiell nefrit; akut njurinsufficiens eller -svikt;
- hepatit; gulsot; akut levernekros eller -svikt;
- anemi, inklusive hemolytisk och aplastisk; trombocytopeni, inklusive trombotisk trombocytopen purpura; leukopeni; agranulocytos; pancytopeni; och/eller andra hematologiska abnormiteter.
Avbryt LEVAQUIN® omedelbart vid första uppkomsten av hudutslag, gulsot eller andra tecken på överkänslighet och vidta stödjande åtgärder [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Överkänslighetsreaktioner
Allvarlig och ibland dödlig överkänslighet och/eller anafylaktiska reaktioner har rapporterats hos patienter som får behandling med fluorokinoloner, inklusive LEVAQUIN®. Dessa reaktioner inträffar ofta efter den första dosen. Vissa reaktioner har åtföljts av kardiovaskulär kollaps, hypotoni/chock, kramper, medvetslöshet, stickningar, angioödem (inklusive tunga, struphuvud, svalg eller ansiktsödem/svullnad), luftvägsobstruktion (inklusive bronkospasm, andnöd och akut andnöd). ångest), dyspné, urtikaria, klåda och andra allvarliga hudreaktioner. LEVAQUIN® ska avbrytas omedelbart vid första uppkomsten av hudutslag eller andra tecken på överkänslighet. Allvarliga akuta överkänslighetsreaktioner kan kräva behandling med epinefrin och andra återupplivningsåtgärder, inklusive syre, intravenösa vätskor, antihistaminer, kortikosteroider, pressoraminer och luftvägsbehandling, enligt klinisk indikation [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Hepatotoxicitet
Rapporter om allvarlig hepatotoxicitet (inklusive akut hepatit och dödliga händelser) efter marknadsföringen har mottagits för patienter som behandlats med LEVAQUIN®. Inga tecken på allvarlig läkemedelsassocierad levertoxicitet upptäcktes i kliniska prövningar med över 7 000 patienter. Allvarlig levertoxicitet inträffade vanligtvis inom 14 dagar efter påbörjad behandling och de flesta fall inträffade inom 6 dagar. De flesta fall av allvarlig levertoxicitet var inte associerade med överkänslighet [se Andra allvarliga och ibland dödliga biverkningar ].
Majoriteten av dödliga levertoxicitetsrapporter inträffade hos patienter 65 år eller äldre och de flesta var inte associerade med överkänslighet. LEVAQUIN® ska avbrytas omedelbart om patienten utvecklar tecken och symtom på hepatit [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Clostridium Difficile-associerad diarré
Clostridium difficile-associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive LEVAQUIN®, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör inledas som kliniskt indicerat [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Förlängning av QT-intervallet
Vissa fluorokinoloner, inklusive LEVAQUIN®, har associerats med förlängning av QT-intervallet på elektrokardiogrammet och sällsynta fall av arytmi. Sällsynta fall av torsade de pointes har spontant rapporterats under övervakning efter marknadsföring hos patienter som får fluorokinoloner, inklusive LEVAQUIN®. LEVAQUIN® bör undvikas hos patienter med känd förlängning av QT-intervallet, patienter med okorrigerad hypokalemi och patienter som får klass IA (kinidin, prokainamid) eller klass III (amiodaron, sotalol) antiarytmika. Äldre patienter kan vara mer mottagliga för läkemedelsrelaterade effekter på QT-intervallet [se NEGATIVA REAKTIONER , Användning i specifika populationer , och PATIENTINFORMATION ].
Muskuloskeletala sjukdomar hos pediatriska patienter och artropatiska effekter hos djur
LEVAQUIN® är indicerat till pediatriska patienter (6 månader och äldre) endast för att förebygga inhalationsmjältbrand (efter exponering) och för pest [se INDIKATIONER ]. En ökad förekomst av muskuloskeletala störningar (artralgi, artrit, tendinopati och gångavvikelse) jämfört med kontroller har observerats hos pediatriska patienter som får LEVAQUIN® [se Användning i specifika populationer ].
Hos omogna råttor och hundar resulterade oral och intravenös administrering av levofloxacin i ökad osteokondros. Histopatologisk undersökning av de viktbärande lederna hos omogna hundar doserade med levofloxacin avslöjade ihållande lesioner i brosket. Andra fluorokinoloner producerar också liknande erosioner i de viktbärande lederna och andra tecken på artropati hos omogna djur av olika arter [se Djurfarmakologi ].
Blodsockerstörningar
Liksom med andra fluorokinoloner, har störningar i blodsocker, inklusive symtomatisk hyper- och hypoglykemi, rapporterats med LEVAQUIN®, vanligtvis hos diabetespatienter som samtidigt behandlas med ett oralt hypoglykemiskt medel (t.ex. glyburid) eller med insulin. Hos dessa patienter rekommenderas noggrann övervakning av blodsockret. Om en hypoglykemisk reaktion inträffar hos en patient som behandlas med LEVAQUIN®, ska LEVAQUIN® avbrytas och lämplig behandling inledas omedelbart [se NEGATIVA REAKTIONER , LÄKEMEDELSINTERAKTIONER och PATIENTINFORMATION ].
Fotosensitivitet/fototoxicitet
Måttliga till svåra ljuskänslighets-/fototoxicitetsreaktioner, av vilka de senare kan visa sig som överdrivna solbränna reaktioner (t.ex. sveda, erytem, utsöndring, blåsor, blåsor, ödem) som involverar områden som exponeras för ljus (vanligtvis ansiktet, "V"-området på halsen , extensorytor på underarmarna, dorsa på händerna), kan associeras med användning av fluorokinoloner efter exponering för sol eller UV-ljus. Därför bör överdriven exponering för dessa ljuskällor undvikas. Läkemedelsbehandling bör avbrytas om ljuskänslighet/fototoxicitet uppstår [se NEGATIVA REAKTIONER och PATIENTINFORMATION ].
Utveckling av läkemedelsresistenta bakterier
Att förskriva LEVAQUIN® i avsaknad av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation kommer sannolikt inte att ge patienten någon nytta och ökar risken för utveckling av läkemedelsresistenta bakterier [se PATIENTINFORMATION ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ).
Allvarliga biverkningar
Råda patienter att sluta ta LEVAQUIN® om de upplever en biverkning och att ringa sin vårdgivare för att få råd om att slutföra hela behandlingen med ett annat antibakteriellt läkemedel.
Informera patienter om följande allvarliga biverkningar som har associerats med LEVAQUIN® eller annan användning av fluorokinolon:
- Inaktiverande och potentiellt irreversibla allvarliga biverkningar som kan uppstå tillsammans: Informera patienter om att invalidiserande och potentiellt irreversibla allvarliga biverkningar, inklusive tendinit och senorruptur, perifera neuropatier och effekter på centrala nervsystemet, har associerats med användning av LEVAQUIN® och kan förekomma samtidigt hos samma patient. Informera patienterna att sluta ta LEVAQUIN® omedelbart om de upplever en biverkning och att ringa sin vårdgivare.
- Tendinit och senruptur: Instruera patienter att kontakta sin vårdgivare om de upplever smärta, svullnad eller inflammation i en sena, eller svaghet eller oförmåga att använda en av sina leder; vila och avstå från träning; och avbryt behandlingen med LEVAQUIN®. Symtomen kan vara irreversibla. Risken för allvarlig sensjukdom med fluorokinoloner är högre hos äldre patienter, vanligtvis över 60 år, hos patienter som tar kortikosteroidläkemedel och hos patienter med njur-, hjärt- eller lungtransplantationer.
- Perifera neuropatier: Informera patienterna om att perifera neuropatier har associerats med användning av levofloxacin, symtom kan uppstå kort efter påbörjad behandling och kan vara irreversibla. Om symtom på perifer neuropati inklusive smärta, sveda, stickningar, domningar och/eller svaghet utvecklas ska du omedelbart avbryta behandlingen med LEVAQUIN® och tala om för dem att kontakta sin läkare.
- Effekter på centrala nervsystemet (till exempel kramper, yrsel, yrsel, ökat intrakraniellt tryck): Informera patienter om att kramper har rapporterats hos patienter som får fluorokinoloner, inklusive levofloxacin. Instruera patienterna att meddela sin läkare innan de tar detta läkemedel om de har en historia av kramper. Informera patienterna om att de bör veta hur de reagerar på LEVAQUIN® innan de använder en bil eller maskiner eller deltar i andra aktiviteter som kräver mental vakenhet och koordination. Instruera patienterna att meddela sin läkare om ihållande huvudvärk med eller utan dimsyn uppstår.
- Exacerbation av Myasthenia Gravis: Instruera patienterna att informera sin läkare om någon historia av myasthenia gravis. Instruera patienterna att meddela sin läkare om de upplever några symtom på muskelsvaghet, inklusive andningssvårigheter.
- Överkänslighetsreaktioner: Informera patienterna om att levofloxacin kan orsaka överkänslighetsreaktioner, även efter en engångsdos, och att avbryta behandlingen vid första tecken på hudutslag, nässelfeber eller andra hudreaktioner, snabba hjärtslag, svårigheter att svälja eller andas, svullnad som tyder på angioödem ( till exempel svullnad av läppar, tunga, ansikte, täthet i halsen, heshet) eller andra symptom på en allergisk reaktion.
- Hepatotoxicitet: Informera patienter om att allvarlig levertoxicitet (inklusive akut hepatit och dödliga händelser) har rapporterats hos patienter som tar LEVAQUIN®. Instruera patienterna att informera sin läkare om de upplever några tecken eller symtom på leverskada inklusive: aptitlöshet, illamående, kräkningar, feber, svaghet, trötthet, ömhet i den övre högra kvadranten, klåda, gulfärgning av hud och ögon, ljusa tarmrörelser eller mörkfärgad urin.
- Diarre: Diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar, instruera patienterna att kontakta sin läkare så snart som möjligt.
- Förlängning av QT-intervallet: Instruera patienterna att informera sin läkare om eventuell personlig eller familjehistoria av QT-förlängning eller proarytmiska tillstånd såsom hypokalemi, bradykardi eller nyligen genomförd myokardischemi; om de tar något klass IA (kinidin, prokainamid) eller klass III (amiodaron, sotalol) antiarytmika. Instruera patienterna att meddela sin läkare om de har några symtom på förlängning av QT-intervallet, inklusive långvarig hjärtklappning eller medvetslöshet.
- Muskuloskeletala sjukdomar hos pediatriska patienter: Instruera föräldrar att informera sitt barns läkare om barnet har en historia av ledrelaterade problem innan de tar detta läkemedel. Informera föräldrar till pediatriska patienter att meddela deras barns läkare om ledrelaterade problem som uppstår under eller efter levofloxacinbehandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
- Fotosensitivitet/fototoxicitet: Informera patienter om att ljuskänslighet/fototoxicitet har rapporterats hos patienter som får fluorokinoloner. Informera patienterna om att minimera eller undvika exponering för naturligt eller artificiellt solljus (solarier eller UVA/B-behandling) när de tar fluorokinoloner. Om patienter behöver vara utomhus medan de använder fluorokinoloner, instruera dem att bära löst sittande kläder som skyddar huden från solexponering och diskutera andra solskyddsåtgärder med sin läkare. Om en solbränna-liknande reaktion eller hudutslag inträffar, instruera patienterna att kontakta sin läkare.
Antibakteriell resistens
Antibakteriella läkemedel inklusive LEVAQUIN® bör endast användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När LEVAQUIN® ordineras för att behandla en bakteriell infektion, bör patienterna informeras om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela terapiförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med LEVAQUIN® eller andra antibakteriella läkemedel i framtiden.
Administrering med mat, vätskor och samtidig medicinering
Patienterna bör informeras om att LEVAQUIN® tabletter kan tas med eller utan mat. Tabletterna ska tas vid samma tidpunkt varje dag.
Patienter bör dricka rikligt med vätska medan de tar LEVAQUIN® för att undvika bildning av högkoncentrerad urin och kristallbildning i urinen.
Antacida innehållande magnesium, eller aluminium, samt sukralfat, metallkatjoner såsom järn och multivitaminpreparat med zink eller didanosin bör tas minst två timmar före eller två timmar efter oral administrering av LEVAQUIN®.
Läkemedelsinteraktioner med insulin, orala hypoglykemiska medel och warfarin
Patienter bör informeras om att om de är diabetiker och behandlas med insulin eller ett oralt hypoglykemiskt medel och en hypoglykemisk reaktion inträffar, ska de avbryta behandlingen med LEVAQUIN® och konsultera en läkare.
Patienterna bör informeras om att samtidig administrering av warfarin och LEVAQUIN® har associerats med ökningar av International Normalized Ratio (INR) eller protrombintid och kliniska episoder av blödning. Patienter bör meddela sin läkare om de tar warfarin, övervakas för tecken på blödning och även få sina antikoagulationstester noggrant övervakade när de tar warfarin samtidigt.
Studier av pest och mjältbrand
Patienter som får LEVAQUIN® för dessa tillstånd bör informeras om att effektstudier inte kunde utföras på människor av etiska och genomförbarhetsskäl. Därför baserades godkännandet för dessa tillstånd på effektstudier utförda på djur.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
en livslång bioanalys på råttor uppvisade levofloxacin ingen karcinogen potential efter daglig dietadministrering under 2 år; den högsta dosen (100 mg/kg/dag) var 1,4 gånger den högsta rekommenderade dosen för människor (750 mg) baserat på relativ kroppsyta. Levofloxacin förkortade inte tiden till tumörutveckling av UV-inducerade hudtumörer hos hårlösa albino (Skh-1) möss vid någon dosnivå av levofloxacin och var därför inte fotokarcinogent under förhållanden i denna studie. Dermala levofloxacinkoncentrationer hos de hårlösa mössen varierade från 25 till 42 mikrogram/g vid den högsta dosnivån för levofloxacin (300 mg/kg/dag) som användes i fotokarcinogenicitetsstudien. Som jämförelse var dermala levofloxacinkoncentrationer hos människor som fick 750 mg LEVAQUIN® i genomsnitt cirka 11,8 mcg/g vid Cmax.
Levofloxacin var inte mutagent i följande analyser: Ames bakteriell mutationsanalys (S. typhimurium och E. coli), CHO/HGPRT framåtmutationsanalys, mus-mikronukleustest, mus dominant dödligt test, oplanerad DNA-syntesanalys från råtta och systerkromatiden hos mus utbytesanalys. Den var positiv i in vitro-analyserna av kromosomavvikelser (CHL-cellinje) och systerkromatidutbyte (CHL/IU-cellinje).
Levofloxacin orsakade ingen försämring av fertiliteten eller reproduktionsförmågan hos råttor vid orala doser så höga som 360 mg/kg/dag, motsvarande 4,2 gånger den högsta rekommenderade humana dosen baserat på relativ kroppsyta och intravenösa doser så höga som 100 mg/kg/ dag, motsvarande 1,2 gånger den högsta rekommenderade dosen för människor baserat på relativ kroppsyta.
Användning i specifika populationer
Graviditet
Graviditetskategori C
Levofloxacin var inte teratogent hos råttor vid doser så höga som 810 mg/kg/dag, vilket motsvarar 9,4 gånger den högsta rekommenderade orala humana dosen baserat på relativ kroppsyta. Den orala dosen på 810 mg/kg/dag till råttor orsakade minskad fosterkroppsvikt och ökad fosterdödlighet. Ingen teratogenicitet observerades när kaniner gavs oralt så högt som 50 mg/kg/dag, vilket motsvarar 1,1 gånger den högsta rekommenderade orala humana dosen baserat på relativ kroppsyta.
Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. LEVAQUIN® ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Ammande mödrar
Baserat på data om andra fluorokinoloner och mycket begränsade data om LEVAQUIN®, kan det antas att levofloxacin kommer att utsöndras i modersmjölk. På grund av risken för allvarliga biverkningar från LEVAQUIN® hos ammande spädbarn, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern.
Pediatrisk användning
Kinoloner, inklusive levofloxacin, orsakar artropati och osteokondros hos juvenila djur av flera arter. [ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Djurfarmakologi ].
Inhalationsmjältbrand (efter exponering)
Levofloxacin är indicerat för pediatriska patienter 6 månader och äldre för inhalationsmjältbrand (efter exponering). Risk-nyttabedömningen indikerar att administrering av levofloxacin till pediatriska patienter är lämplig. Säkerheten för levofloxacin hos pediatriska patienter som behandlats i mer än 14 dagar har inte studerats [se INDIKATIONER , DOSERING OCH ADMINISTRERING och Kliniska studier ].
Plåga
Levofloxacin är indicerat för pediatriska patienter, 6 månader och äldre, för behandling av pest, inklusive pneumonisk och septikemisk pest på grund av Yersinia pestis (Y. pestis) och profylax mot pest. Effektstudier av LEVAQUIN® kunde inte utföras på människor med pneumonisk pest av etiska och genomförbarhetsskäl. Därför baserades godkännandet av denna indikation på en effektstudie utförd på djur. Risk-nyttabedömningen indikerar att administrering av levofloxacin till pediatriska patienter är lämplig [se INDIKATIONER , DOSERING OCH ADMINISTRERING och Kliniska studier ].
Säkerhet och effektivitet för LEVAQUIN® hos pediatriska patienter under sex månaders ålder har inte fastställts.
Farmakokinetik efter intravenös administrering
Farmakokinetiken för levofloxacin efter en intravenös engångsdos undersöktes hos pediatriska patienter i åldern från sex månader till 16 år. Pediatriska patienter eliminerade levofloxacin snabbare än vuxna patienter, vilket resulterade i lägre plasmaexponeringar än vuxna för en given mg/kg dos [se KLINISK FARMAKOLOGI och Kliniska studier ].
Dosering hos pediatriska patienter med inhalationsmjältbrand eller pest
För den rekommenderade LEVAQUIN®-tablettdosen till pediatriska patienter med inhalationsmjältbrand eller pest, se DOSERING OCH ADMINISTRERING . LEVAQUIN® tabletter kan inte administreras till pediatriska patienter som väger mindre än 30 kg på grund av begränsningarna i de tillgängliga styrkorna. Alternativa formuleringar av levofloxacin kan övervägas för pediatriska patienter som väger mindre än 30 kg.
Negativa reaktioner
kliniska prövningar behandlades 1534 pediatriska patienter (6 månader till 16 år gamla) med oral och intravenös LEVAQUIN®. Pediatriska patienter i åldern 6 månader till 5 år fick LEVAQUIN® 10 mg/kg två gånger om dagen och pediatriska patienter över 5 år fick 10 mg/kg en gång om dagen (max 500 mg per dag) i cirka 10 dagar. LEVAQUIN® tabletter kan endast administreras till pediatriska patienter med inhalationsmjältbrand (efter exponering) eller pest som väger 30 kg eller mer på grund av begränsningarna i de tillgängliga styrkorna [se DOSERING OCH ADMINISTRERING ].
En undergrupp av pediatriska patienter i de kliniska prövningarna (1 340 LEVAQUIN®-behandlade och 893 icke-fluorokinolonbehandlade) inkluderade i en prospektiv, långsiktig övervakningsstudie för att bedöma förekomsten av protokolldefinierade muskel- och skelettsjukdomar (artralgi, artrit, tendinopatier) ) under 60 dagar och 1 år efter den första dosen av studieläkemedlet. Pediatriska patienter som behandlats med LEVAQUIN® hade en signifikant högre förekomst av muskuloskeletala sjukdomar jämfört med de icke-fluorokinolonbehandlade barnen som illustreras i Tabell 7. LEVAQUIN® tabletter kan endast administreras till pediatriska patienter med inhalationsmjältbrand (efter exponering) eller pest som väger 30 kg eller mer på grund av begränsningarna i de tillgängliga styrkorna [se DOSERING OCH ADMINISTRERING ].
Artralgi var den vanligast förekommande muskuloskeletala sjukdomen i båda behandlingsgrupperna. De flesta av muskel- och skelettbesvären i båda grupperna involverade flera viktbärande leder. Störningarna var måttliga hos 8/46 (17 %) barn och lindriga hos 35/46 (76 %) LEVAQUIN®-behandlade pediatriska patienter och de flesta behandlades med analgetika. Mediantiden till upplösning var 7 dagar för LEVAQUIN®-behandlade pediatriska patienter och 9 för icke-fluorokinolonbehandlade barn (ungefär 80 % försvann inom 2 månader i båda grupperna). Ingen pediatrisk patient hade en allvarlig eller allvarlig störning och alla muskel- och skelettbesvär försvann utan följdsjukdomar.
Kräkningar och diarré var de vanligast rapporterade biverkningarna, som förekom i liknande frekvens hos LEVAQUIN®-behandlade och icke-fluorokinolonbehandlade pediatriska patienter.
Utöver de biverkningar som rapporterats hos pediatriska patienter i kliniska prövningar, biverkningar som rapporterats hos vuxna under kliniska prövningar eller erfarenhet efter marknadsföring [se NEGATIVA REAKTIONER ] kan också förväntas förekomma hos pediatriska patienter.
Geriatrisk användning
Geriatriska patienter löper ökad risk för att utveckla allvarliga sensjukdomar inklusive senruptur när de behandlas med en fluorokinolon som LEVAQUIN®. Denna risk ökar ytterligare hos patienter som samtidigt får kortikosteroidbehandling. Tendinit eller senruptur kan involvera akilles, hand, axel eller andra senor och kan uppstå under eller efter avslutad behandling; fall som inträffat upp till flera månader efter behandling med fluorokinolon har rapporterats. Försiktighet bör iakttas när LEVAQUIN® förskrivs till äldre patienter, särskilt de som tar kortikosteroider. Patienter bör informeras om denna potentiella biverkning och rådas att avbryta behandlingen med LEVAQUIN® och kontakta sin vårdgivare om några symtom på tendinit eller senruptur uppstår [se LÅDA VARNING ; VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ; och NEGATIVA REAKTIONER ].
kliniska fas 3-prövningar var 1 945 LEVAQUIN®-behandlade patienter (26%) ≥ 65 år gamla. Av dessa var 1 081 patienter (14 %) mellan 65 och 74 år och 864 patienter (12 %) var 75 år eller äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre försökspersoner, men större känslighet hos vissa äldre individer kan inte uteslutas.
Allvarliga, och ibland dödliga, fall av levertoxicitet har rapporterats efter marknadsföringen i samband med LEVAQUIN®. Majoriteten av dödliga levertoxicitetsrapporter inträffade hos patienter 65 år eller äldre och de flesta var inte associerade med överkänslighet. LEVAQUIN® ska avbrytas omedelbart om patienten utvecklar tecken och symtom på hepatit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Äldre patienter kan vara mer mottagliga för läkemedelsrelaterade effekter på QT-intervallet. Därför bör försiktighet vidtas vid användning av LEVAQUIN® med samtidiga läkemedel som kan resultera i förlängning av QT-intervallet (t.ex. klass IA eller klass III antiarytmika) eller hos patienter med riskfaktorer för torsade de pointes (t.ex. känd QT-förlängning, okorrigerad hypokalemi) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
De farmakokinetiska egenskaperna hos levofloxacin hos yngre vuxna och äldre vuxna skiljer sig inte signifikant när kreatininclearance beaktas. Men eftersom läkemedlet är känt för att väsentligt utsöndras via njurarna, kan risken för toxiska reaktioner på detta läkemedel vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen [se KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
Clearance av levofloxacin reduceras avsevärt och plasmaelimineringshalveringstiden är avsevärt förlängd hos patienter med nedsatt njurfunktion (kreatininclearance DOSERING OCH ADMINISTRERING ].
Nedsatt leverfunktion
Farmakokinetiska studier på patienter med nedsatt leverfunktion har inte utförts. På grund av den begränsade omfattningen av levofloxacins metabolism förväntas inte levofloxacins farmakokinetik påverkas av nedsatt leverfunktion.
ÖVERDOS
Vid akut överdosering ska magsäcken tömmas. Patienten bör observeras och lämplig hydrering upprätthållas. Levofloxacin avlägsnas inte effektivt genom hemodialys eller peritonealdialys.
LEVAQUIN® uppvisar en låg potential för akut toxicitet. Möss, råttor, hundar och apor uppvisade följande kliniska tecken efter att ha fått en enstaka hög dos av LEVAQUIN®: ataxi, ptos, minskad rörelseaktivitet, dyspné, utmattning, skakningar och kramper. Doser över 1500 mg/kg oralt och 250 mg/kg IV gav signifikant dödlighet hos gnagare.
KONTRAINDIKATIONER
LEVAQUIN® är kontraindicerat för personer med känd överkänslighet mot levofloxacin eller andra kinolonantibakteriella medel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Levofloxacin är en medlem av fluorokinolonklassen av antibakteriella medel [ se Mikrobiologi ].
Farmakokinetik
De farmakokinetiska medelvärdena ± SD för levofloxacin, bestämda under singel- och steady-state-förhållanden efter administrering av de orala tabletterna, sammanfattas i Tabell 8.
Levofloxacins farmakokinetik är linjär och förutsägbar efter enstaka och flera orala eller intravenösa doseringsregimer. Steady-state uppnås inom 48 timmar efter en doseringsregim på 500 mg eller 750 mg en gång dagligen. Medelvärdet ± SD topp- och dalplasmakoncentrationer som uppnåddes efter flera orala doseringsregimer en gång dagligen var cirka 5,7 ± 1,4 och 0,5 ± 0,2 mcg/ml efter 500 mg-doserna och 8,6 ± 1,9 och 1,1 ± 0,4 mcg/5 mL efter 7 mcg. mg doser, respektive. Medelvärdet ± SD topp- och dalplasmakoncentrationer som uppnåddes efter flera intravenösa kurer en gång dagligen var cirka 6,4 ± 0,8 och 0,6 ± 0,2 mcg/ml efter 500 mg doserna, och 12,1 ± 4,1 och 1,3 ± 0,71 mcg/50 ml. doser, respektive.
Absorption
Levofloxacin absorberas snabbt och i huvudsak fullständigt efter oral administrering. Maximala plasmakoncentrationer uppnås vanligtvis en till två timmar efter oral dosering. Den absoluta biotillgängligheten av levofloxacin från en 500 mg tablett och en 750 mg tablett av LEVAQUIN® är båda cirka 99 %, vilket visar fullständig oral absorption av levofloxacin. Efter en intravenös engångsdos av LEVAQUIN® till friska frivilliga, var medelvärdet ± SD toppplasmakoncentration som uppnåddes 6,2 ± 1,0 mcg/ml efter en 500 mg dos infunderad under 60 minuter och 11,5 ± 4,0 mcg/ml efter en 750 mg dos infunderad 90 minuter. Oral administrering av en 500 mg dos av LEVAQUIN® med mat förlänger tiden till maximal koncentration med cirka 1 timme och minskar maximal koncentration med cirka 14 % efter tablett och cirka 25 % efter oral lösning. Därför kan LEVAQUIN® tabletter administreras utan hänsyn till mat.
Plasmakoncentrationsprofilen för levofloxacin efter intravenös administrering är liknande och jämförbar i exponeringsgrad (AUC) med den som observeras för LEVAQUIN® tabletter när lika doser (mg/mg) administreras. Därför kan de orala och IV administreringssätten anses utbytbara.
Distribution
Den genomsnittliga distributionsvolymen för levofloxacin varierar i allmänhet från 74 till 112 L efter enstaka och multipla doser på 500 mg eller 750 mg, vilket indikerar utbredd distribution i kroppsvävnader. Levofloxacin når sina toppnivåer i hudvävnader och i blistervätska hos friska försökspersoner cirka 3 timmar efter dosering. Hudvävnadsbiopsi till plasma AUC-förhållandet är ungefär 2 och AUC-förhållandet för blistervätska till plasma är ungefär 1 efter upprepad oral administrering en gång dagligen av 750 mg respektive 500 mg doser av LEVAQUIN® till friska försökspersoner. Levofloxacin tränger också bra in i lungvävnaderna. Lungvävnadskoncentrationerna var i allmänhet 2 till 5 gånger högre än plasmakoncentrationerna och varierade från cirka 2,4 till 11,3 mikrogram/g under en 24-timmarsperiod efter en oral engångsdos på 500 mg.
In vitro, över ett kliniskt relevant intervall (1 till 10 mcg/ml) av serum/plasma levofloxacinkoncentrationer, är levofloxacin cirka 24 till 38 % bundet till serumproteiner för alla studerade arter, vilket bestäms med jämviktsdialysmetoden. Levofloxacin är huvudsakligen bundet till serumalbumin hos människor. Levofloxacins bindning till serumproteiner är oberoende av läkemedelskoncentrationen.
Eliminering
Ämnesomsättning
Levofloxacin är stereokemiskt stabilt i plasma och urin och inverterar inte metaboliskt till dess enantiomer, D-ofloxacin. Levofloxacin genomgår begränsad metabolism hos människor och utsöndras främst som oförändrat läkemedel i urinen. Efter oral administrering återfanns cirka 87 % av en administrerad dos som oförändrat läkemedel i urinen inom 48 timmar, medan mindre än 4 % av dosen återfanns i feces på 72 timmar. Mindre än 5 % av en administrerad dos återfanns i urinen som desmetyl- och N-oxidmetaboliterna, de enda metaboliter som identifierats hos människor. Dessa metaboliter har liten relevant farmakologisk aktivitet.
Exkretion
Levofloxacin utsöndras till stor del som oförändrat läkemedel i urinen. Den genomsnittliga terminala plasmaelimineringshalveringstiden för levofloxacin varierar från cirka 6 till 8 timmar efter enstaka eller flera doser av levofloxacin som ges oralt eller intravenöst. Det genomsnittliga skenbara totala kroppsclearance och renalt clearance varierar från cirka 144 till 226 ml/min respektive 96 till 142 ml/min. Renal clearance som överstiger den glomerulära filtrationshastigheten tyder på att tubulär sekretion av levofloxacin sker utöver dess glomerulära filtration. Samtidig administrering av antingen cimetidin eller probenecid resulterar i cirka 24 % respektive 35 % minskning av levofloxacins renala clearance, vilket indikerar att utsöndring av levofloxacin sker i den renala proximala tubuli. Inga levofloxacinkristaller hittades i något av de nyligen insamlade urinproverna från försökspersoner som fick LEVAQUIN®.
Specifika populationer
Geriatriska patienter
Det finns inga signifikanta skillnader i levofloxacins farmakokinetik mellan unga och äldre försökspersoner när försökspersonerna' skillnader i kreatininclearance beaktas. Efter en 500 mg oral dos av LEVAQUIN® till friska äldre försökspersoner (66–80 år) var den genomsnittliga terminala plasmaelimineringshalveringstiden för levofloxacin cirka 7,6 timmar, jämfört med cirka 6 timmar hos yngre vuxna. Skillnaden berodde på variationen i njurfunktionsstatus hos försökspersonerna och ansågs inte vara kliniskt signifikant. Läkemedelsabsorptionen verkar vara opåverkad av ålder. Dosjustering av LEVAQUIN® baserat på enbart ålder är inte nödvändig [se Användning i specifika populationer ].
Pediatriska patienter
Farmakokinetiken för levofloxacin efter en intravenös engångsdos på 7 mg/kg undersöktes hos pediatriska patienter i åldern 6 månader till 16 år. Pediatriska patienter eliminerade levofloxacin snabbare än vuxna patienter, vilket resulterade i lägre plasmaexponeringar än vuxna för en given mg/kg dos. Efterföljande farmakokinetiska analyser förutspådde att en dosregim på 8 mg/kg var 12:e timme (inte överstiga 250 mg per dos) för pediatriska patienter i åldern 6 månader till 17 år skulle uppnå jämförbara steady state plasmaexponeringar (AUC0-24 och Cmax ) till de som observerats hos vuxna patienter som administrerades 500 mg levofloxacin en gång var 24:e timme. LEVAQUIN® tabletter kan endast administreras till pediatriska patienter med inhalationsmjältbrand (efter exponering) eller pest som väger 30 kg eller mer på grund av begränsningarna i de tillgängliga styrkorna [se DOSERING OCH ADMINISTRERING ].
Manliga Och Kvinnliga Ämnen
Det finns inga signifikanta skillnader i levofloxacins farmakokinetik mellan manliga och kvinnliga försökspersoner när försökspersoner' skillnader i kreatininclearance beaktas. Efter en 500 mg oral dos av LEVAQUIN® till friska manliga försökspersoner var den genomsnittliga terminala plasmaelimineringshalveringstiden för levofloxacin cirka 7,5 timmar, jämfört med cirka 6,1 timmar hos kvinnliga försökspersoner. Denna skillnad berodde på variationen i njurfunktionsstatus hos manliga och kvinnliga försökspersoner och ansågs inte vara kliniskt signifikant. Läkemedelsabsorptionen verkar vara opåverkad av försökspersonernas kön. Dosjustering baserad på enbart kön är inte nödvändig.
Ras eller etniska grupper
Effekten av ras på levofloxacins farmakokinetik undersöktes genom en kovariatanalys utförd på data från 72 försökspersoner: 48 vita och 24 icke-vita. Det skenbara totala clearance och skenbara distributionsvolymen påverkades inte av försökspersonernas ras.
Patienter med nedsatt njurfunktion
Clearance av levofloxacin reduceras avsevärt och plasmaelimineringshalveringstiden är väsentligt förlängd hos vuxna patienter med nedsatt njurfunktion (kreatininclearance DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Patienter med nedsatt leverfunktion
Farmakokinetiska studier på patienter med nedsatt leverfunktion har inte utförts. På grund av den begränsade omfattningen av levofloxacinmetabolism förväntas inte levofloxacins farmakokinetik påverkas av nedsatt leverfunktion [se Användning i specifika populationer ].
Patienter med bakteriell infektion
Farmakokinetiken för levofloxacin hos patienter med allvarliga samhällsförvärvade bakterieinfektioner är jämförbar med den som observerats hos friska försökspersoner.
Läkemedelsinteraktionsstudier
Potentialen för farmakokinetiska läkemedelsinteraktioner mellan LEVAQUIN® och antacida, warfarin, teofyllin, ciklosporin, digoxin, probenecid och cimetidin har utvärderats [se LÄKEMEDELSINTERAKTIONER ].
Mikrobiologi
Handlingsmekanism
Levofloxacin är L-isomeren av racematet, ofloxacin, ett kinolonantimikrobiellt medel. Den antibakteriella aktiviteten hos ofloxacin finns främst i L-isomeren. Verkningsmekanismen för levofloxacin och andra fluorokinolonantimikrobiella medel involverar hämning av bakteriellt topoisomeras IV och DNA-gyras (som båda är typ II topoisomeraser), enzymer som krävs för DNA-replikation, transkription, reparation och rekombination.
Motstånd
Fluorokinolonresistens kan uppstå genom mutationer i definierade regioner av DNA-gyras eller topoisomeras IV, kallade Quinolon-Resistance Determining Regions (QRDRs), eller genom förändrad efflux.
Fluorokinoloner, inklusive levofloxacin, skiljer sig i kemisk struktur och verkningssätt från aminoglykosider, makrolider och β-laktamantibiotika, inklusive penicilliner. Fluorokinoloner kan därför vara aktiva mot bakterier som är resistenta mot dessa antimikrobiella medel.
Resistens mot levofloxacin på grund av spontan mutation in vitro är en sällsynt förekomst (intervall: 10-9 till 10-10). Korsresistens har observerats mellan levofloxacin och vissa andra fluorokinoloner, vissa mikroorganismer som är resistenta mot andra fluorokinoloner kan vara mottagliga för levofloxacin.
Antimikrobiell aktivitet
Levofloxacin har in vitro aktivitet mot gramnegativa och grampositiva bakterier.
Levofloxacin har visat sig vara aktivt mot de flesta isolat av följande bakterier både in vitro och vid kliniska infektioner som beskrivs i se INDIKATIONER :
Aeroba bakterier
Gram-positiva bakterier
Enterococcus faecalisStaphylococcus aureus (meticillinkänsliga isolat)Staphylococcus epidermidis (meticillinkänsliga isolat)Staphylococcus saprophyticusStreptococcus pneumoniae (inklusive multiläkemedelsresistenta isolat [MDROSP]1)
Gram-negativa bakterier
Enterobacter cloacaeEscherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilisPseudomonas aeruginosaSerratia marcescens
Andra mikroorganismer
Chlamydophila pneumoniae Mycoplasma pneumoniae
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd: Levofloxacin uppvisar in vitro lägsta hämmande koncentrationer (MIC-värden) på 2 mcg/ml eller mindre mot de flesta (≥90%) isolat av följande mikroorganismer; dock har säkerheten och effektiviteten för LEVAQUIN® vid behandling av kliniska infektioner på grund av dessa bakterier inte fastställts i adekvata och välkontrollerade kliniska prövningar.
MDRSP (Multi-drug resistant Streptococcus pneumoniae) isolat är isolat som är resistenta mot två eller flera av följande antibiotika: penicillin (MIC ≥2 mcg/ml), 2:a generationens cefalosporiner, t.ex. cefuroxim; makrolider, tetracykliner och trimetoprim/sulfametoxazol.
Aeroba bakterier
Gram-positiva bakterier
Staphylococcus haemolyticusβ-hemolytiska Streptococcus (Grupp C/F)β-hemolytiska Streptococcus (Grupp G) Streptococcus agalactiaeStreptococcus milleriViridans grupp streptokockerBacillus anthracis
Gram-negativa bakterier
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomeransProteus stuggerienProvidcia stugerien
Anaeroba bakterier
Gram-positiva bakterier
Clostridium perfringens
Känslighetstester
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder som erkänns av FDA för detta läkemedel, se: https://www.fda.gov/STIC.
Djurtoxikologi och/eller farmakologi
Levofloxacin och andra kinoloner har visat sig orsaka artropati hos omogna djur av de flesta arter som testats [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Hos omogna hundar (4–5 månader gamla) resulterade orala doser på 10 mg/kg/dag i 7 dagar och intravenösa doser på 4 mg/kg/dag i 14 dagar av levofloxacin i artropatiska lesioner. Administrering vid orala doser på 300 mg/kg/dag under 7 dagar och intravenösa doser på 60 mg/kg/dag under 4 veckor gav artropati hos unga råttor. Tre månader gamla beaglehundar som doserats oralt med levofloxacin i 40 mg/kg/dag uppvisade kliniskt allvarlig artrotoxicitet vilket resulterade i att doseringen avbröts på dag 8 av en 14-dagars doseringsrutin. Lätt muskuloskeletala kliniska effekter, i frånvaro av allvarliga patologiska eller histopatologiska effekter, resulterade från den lägsta dosnivån på 2,5 mg/kg/dag (ungefär 0,2 gånger den pediatriska dosen baserat på AUC-jämförelser). Synovit och ledbroskskador observerades vid dosnivåerna 10 och 40 mg/kg (ungefär 0,7-faldigt respektive 2,4-faldigt den pediatriska dosen, baserat på AUC-jämförelser). Ledbrosks bruttopatologi och histopatologi kvarstod till slutet av den 18 veckor långa återhämtningsperioden för de hundar från dosnivåerna 10 och 40 mg/kg/dag.
När det testades i en bioassay för svullnad i öron hos mus, uppvisade levofloxacin fototoxicitet liknande ofloxacins storlek, men mindre fototoxicitet än andra kinoloner.
Även om kristalluri har observerats i vissa intravenösa råttstudier, bildas inte urinkristaller i urinblåsan, de förekommer endast efter urinering och är inte associerade med nefrotoxicitet.
Hos möss förstärks den CNS-stimulerande effekten av kinoloner genom samtidig administrering av icke-steroida antiinflammatoriska läkemedel.
Hos hundar gav levofloxacin i doser på 6 mg/kg eller högre genom snabb intravenös injektion hypotensiva effekter. Dessa effekter ansågs vara relaterade till histaminfrisättning.
In vitro- och in vivo-studier på djur indikerar att levofloxacin varken är en enzyminducerare eller hämmare i det humana terapeutiska plasmakoncentrationsintervallet; därför förväntas inga läkemedelsmetaboliserande enzymrelaterade interaktioner med andra läkemedel eller medel.
Kliniska studier
Nosokomial lunginflammation
Vuxna patienter med kliniskt och radiologiskt dokumenterad nosokomial pneumoni inkluderades i en multicenter, randomiserad, öppen studie som jämförde intravenös LEVAQUIN® (750 mg en gång dagligen) följt av oral LEVAQUIN® (750 mg en gång dagligen) under totalt 7–15 dagar till intravenöst imipenem/cilastatin (500–1000 mg var 6–8:e timme dagligen) följt av oral ciprofloxacin (750 mg var 12:e timme dagligen) i totalt 7–15 dagar. LEVAQUIN®-behandlade patienter fick i genomsnitt 7 dagars intravenös behandling (intervall: 1–16 dagar); jämförelsebehandlade patienter fick i genomsnitt 8 dagars intravenös behandling (intervall: 1–19 dagar).
Totalt sett, i den kliniskt och mikrobiologiskt utvärderbara populationen, initierades tilläggsbehandling empiriskt vid studiestart hos 56 av 93 (60,2 %) patienter i LEVAQUIN®-armen och 53 av 94 (56,4 %) patienter i jämförelsegruppen. Den genomsnittliga varaktigheten av tilläggsbehandlingen var 7 dagar i LEVAQUIN®-armen och 7 dagar i jämförelseläkemedlet. Hos kliniskt och mikrobiologiskt utvärderbara patienter med dokumenterad Pseudomonas aeruginosa-infektion fick 15 av 17 (88,2 %) ceftazidim (N = 11) eller piperacillin/tazobactam (N = 4) i LEVAQUIN®-armen och 16 av 17 (94,1 %) fick en aminoglykosid i komparatorarmen. Totalt sett, hos kliniskt och mikrobiologiskt utvärderbara patienter, lades vankomycin till behandlingsregimen för 37 av 93 (39,8 %) patienter i LEVAQUIN®-armen och 28 av 94 (29,8 %) patienter i jämförelsearmen för misstänkt meticillinresistent S. aureusinfektion.
Den kliniska framgångsfrekvensen hos kliniskt och mikrobiologiskt utvärderbara patienter vid besöket efter behandling (primärstudiens slutpunkt bedömd dag 3–15 efter avslutad behandling) var 58,1 % för LEVAQUIN® och 60,6 % för jämförelseläkemedlet. 95 % KI för skillnaden i svarsfrekvens (LEVAQUIN® minus komparator) var [-17,2, 12,0]. De mikrobiologiska eradikeringsfrekvenserna vid besöket efter behandling var 66,7 % för LEVAQUIN® och 60,6 % för jämförelseläkemedlet. 95 % KI för skillnaden i eradikeringshastigheter (LEVAQUIN® minus komparator) var [-8,3, 20,3]. Klinisk framgång och mikrobiologiska utrotningshastigheter per patogen beskrivs i tabell 9.
Samhällsförvärvad lunginflammation
7–14 dagars behandling
Vuxna slutenvårdspatienter och öppenvårdspatienter med diagnosen samhällsförvärvad bakteriell lunginflammation utvärderades i 2 pivotala kliniska studier. I den första studien inkluderades 590 patienter i en prospektiv, multicenter, oblindad randomiserad studie som jämförde LEVAQUIN® 500 mg en gång dagligen oralt eller intravenöst i 7 till 14 dagar med ceftriaxon 1 till 2 gram intravenöst en gång eller i lika uppdelade doser två gånger dagligen följt av cefuroximaxetil 500 mg oralt två gånger dagligen i totalt 7 till 14 dagar. Patienter som tilldelats behandling med kontrollregimen fick erytromycin (eller doxycyklin om de var intoleranta mot erytromycin) om en infektion på grund av atypiska patogener misstänktes eller bevisades. Kliniska och mikrobiologiska utvärderingar utfördes under behandlingen, 5 till 7 dagar efter behandlingen och 3 till 4 veckor efter behandlingen. Klinisk framgång (bot plus förbättring) med LEVAQUIN® 5 till 7 dagar efter behandling, den primära effektvariabeln i denna studie, var överlägsen (95 %) jämfört med kontrollgruppen (83 %). 95 % KI för skillnaden i svarsfrekvens (LEVAQUIN® minus komparator) var [-6, 19]. I den andra studien inkluderades 264 patienter i en prospektiv, multicenter, icke-jämförande studie med 500 mg LEVAQUIN® administrerat oralt eller intravenöst en gång dagligen i 7 till 14 dagar. Klinisk framgång för kliniskt utvärderbara patienter var 93 %. För båda studierna var den kliniska framgångsfrekvensen hos patienter med atypisk pneumoni på grund av Chlamydophila pneumoniae, Mycoplasma pneumoniae och Legionella pneumophila 96 %, 96 % respektive 70 %. Mikrobiologiska utrotningshastigheter i båda studierna presenteras i Tabell 10.
Samhällsförvärvad lunginflammation på grund av multiresistent Streptococcus Pneumoniae
LEVAQUIN® var effektivt för behandling av samhällsförvärvad lunginflammation orsakad av multiresistent Streptococcus pneumoniae (MDRSP). MDRSP-isolat är isolat som är resistenta mot två eller flera av följande antibakteriella medel: penicillin (MIC ≥2 mcg/ml), 2:a generationens cefalosporiner (t.ex. cefuroxim, makrolider, tetracykliner och trimetoprim/sulfametoxazol). Av 40 mikrobiologiskt utvärderbara patienter med MDRSP-isolat uppnådde 38 patienter (95,0%) klinisk och bakteriologisk framgång efter behandlingen. De kliniska och bakteriella framgångarna visas i Tabell 11.
Inte alla isolat var resistenta mot alla testade antimikrobiella klasser. Framgångs- och utrotningsfrekvenser sammanfattas i Tabell 12.
Samhällsförvärvad lunginflammation
5-dagars behandling
För att utvärdera säkerheten och effekten av den högre dosen och kortare kuren av LEVAQUIN® utvärderades 528 polikliniska och sjukhusinlagda vuxna med kliniskt och radiologiskt bestämd mild till svår samhällsförvärvad lunginflammation i en dubbelblind, randomiserad, prospektiv, multicenterstudie som jämförde LEVAQUIN ® 750 mg, IV eller oralt, varje dag i fem dagar eller LEVAQUIN® 500 mg IV eller oralt, varje dag i 10 dagar.
Den kliniska framgångsfrekvensen (bot plus förbättring) i den kliniskt utvärderbara populationen var 90,9 % i LEVAQUIN® 750 mg-gruppen och 91,1 % i LEVAQUIN® 500 mg-gruppen. 95 % KI för skillnaden i svarsfrekvens (LEVAQUIN® 750 minus LEVAQUIN® 500) var [-5,9, 5,4]. I den kliniskt utvärderbara populationen (31–38 dagar efter inskrivning) observerades lunginflammation hos 7 av 151 patienter i LEVAQUIN® 750 mg-gruppen och 2 av 147 patienter i LEVAQUIN® 500 mg-gruppen. Med tanke på de små observerade siffrorna kan betydelsen av detta fynd inte fastställas statistiskt. Den mikrobiologiska effekten av 5-dagarsregimen dokumenterades för infektioner som anges i Tabell 13.
Akut bakteriell bihåleinflammation
5-dagars och 10–14 dagars behandlingsregimer
LEVAQUIN® är godkänd för behandling av akut bakteriell bihåleinflammation (ABS) med antingen 750 mg genom munnen × 5 dagar eller 500 mg genom munnen en gång dagligen × 10–14 dagar. För att utvärdera säkerheten och effekten av en högdos kort kur av LEVAQUIN®, utvärderades 780 polikliniska vuxna med kliniskt och radiologiskt bestämd akut bakteriell bihåleinflammation i en dubbelblind, randomiserad, prospektiv multicenterstudie som jämförde LEVAQUIN® 750 mg genom munnen en gång dagligen i fem dagar till LEVAQUIN® 500 mg genom munnen en gång dagligen i 10 dagar.
Den kliniska framgångsfrekvensen (definierad som fullständig eller partiell upplösning av tecknen och symtomen på ABS före behandlingen i en sådan utsträckning att ingen ytterligare antibiotikabehandling ansågs nödvändig) i den mikrobiologiskt utvärderbara populationen var 91,4 % (139/152) i LEVAQUIN® 750 mg-gruppen och 88,6 % (132/149) i LEVAQUIN® 500 mg-gruppen vid test-of-cure (TOC) besöket (95 % CI [-4,2, 10,0] för LEVAQUIN® 750 mg minus LEVAQUIN® 500 mg) .
Graden av klinisk framgång av patogen i den mikrobiologiskt utvärderbara populationen som hade prover erhållna genom antraltappning vid studiestart visade jämförbara resultat för fem- och tiodagarsregimerna vid test-of-cure-besöket 22 dagar efter behandling (se tabell 14) .
Komplicerade hud- och hudstrukturinfektioner
Trehundranittionio patienter inkluderades i en öppen, randomiserad, jämförande studie för komplicerade hud- och hudstrukturinfektioner. Patienterna randomiserades till att få antingen LEVAQUIN® 750 mg en gång dagligen (IV följt av oralt), eller en godkänd komparator för en median på 10 ± 4,7 dagar. Som förväntat vid komplicerade hud- och hudstrukturinfektioner utfördes kirurgiska ingrepp i LEVAQUIN®- och jämförelsegruppen. Kirurgi (snitt och dränering eller debridering) utfördes på 45 % av de LEVAQUIN®-behandlade patienterna och 44 % av de komparatorbehandlade patienterna, antingen kort före eller under antibiotikabehandling och utgjorde en integrerad del av behandlingen för denna indikation.
Bland dem som kunde utvärderas kliniskt 2–5 dagar efter avslutad studieläkemedel var den totala framgångsfrekvensen (förbättrad eller botad) 116/138 (84,1 %) för patienter som behandlades med LEVAQUIN® och 106/132 (80,3 %) för patienter som behandlades med komparatorn.
Framgångsfrekvensen varierade med typen av diagnos, från 68 % hos patienter med infekterade sår till 90 % hos patienter med infekterade sår och bölder. Dessa frekvenser var likvärdiga med de som sågs med jämförelseläkemedel.
Kronisk bakteriell prostatit
Vuxna patienter med en klinisk diagnos av prostatit och mikrobiologiska odlingsresultat från urinprov som tagits efter prostatamassage (VB3) eller uttryckt prostatisk sekretion (EPS) prover som erhållits via Meares-Stamey-proceduren inkluderades i en multicenter, randomiserad, dubbelblind studie som jämförde oral LEVAQUIN® 500 mg, en gång dagligen i totalt 28 dagar till oral ciprofloxacin 500 mg, två gånger dagligen i totalt 28 dagar. Det primära effektmåttet var mikrobiologisk effekt hos mikrobiologiskt utvärderbara patienter. Totalt 136 och 125 mikrobiologiskt utvärderbara patienter inkluderades i gruppen LEVAQUIN® respektive ciprofloxacin. Den mikrobiologiska utrotningsfrekvensen genom patientinfektion 5–18 dagar efter avslutad behandling var 75,0 % i LEVAQUIN®-gruppen och 76,8 % i ciprofloxacingruppen (95 % CI [-12,58, 8,98] för LEVAQUIN® minus ciprofloxacin). De totala utrotningshastigheterna för patogener av intresse presenteras i tabell 15.
Utrotningshastigheten för S. epidermidis när den hittas med andra ko-patogener överensstämmer med frekvensen som ses i rena isolat.
Graden av klinisk framgång (bot + förbättring utan behov av ytterligare antibiotikabehandling) i mikrobiologiskt utvärderbar population 5–18 dagar efter avslutad behandling var 75,0 % för LEVAQUIN®-behandlade patienter och 72,8 % för ciprofloxacinbehandlade patienter (95 % KI [- 8,87, 13,27] för LEVAQUIN® minus ciprofloxacin). Graden av klinisk långsiktig framgång (24–45 dagar efter avslutad behandling) var 66,7 % för de LEVAQUIN®-behandlade patienterna och 76,9 % för de ciprofloxacinbehandlade patienterna (95 % CI [-23,40, 2,89] för LEVAQUIN® minus ciprofloxacin).
Komplicerade urinvägsinfektioner och akut pyelonefrit
5-dagars behandling
För att utvärdera säkerheten och effekten av den högre dosen och kortare kuren av LEVAQUIN®, inkluderades 1109 patienter med cUTI och AP i en randomiserad, dubbelblind, multicenter klinisk prövning som genomfördes i USA från november 2004 till april 2006 där LEVAQUIN® 750 jämfördes mg IV eller oralt en gång dagligen i 5 dagar (546 patienter) med ciprofloxacin 400 mg IV eller 500 mg oralt två gånger dagligen i 10 dagar (563 patienter). Patienter med AP komplicerad av underliggande njursjukdomar eller tillstånd såsom fullständig obstruktion, operation, transplantation, samtidig infektion eller medfödd missbildning exkluderades. Effekten mättes genom bakteriologisk utrotning av baslinjeorganismen/organismerna vid efterbehandlingsbesöket hos patienter med en patogen identifierad vid baslinjen. Besöket efter behandling (test-of-cure) inträffade 10 till 14 dagar efter den sista aktiva dosen av LEVAQUIN® och 5 till 9 dagar efter den sista dosen av aktivt ciprofloxacin.
Den bakteriologiska botningsgraden totalt för LEVAQUIN® och kontroll vid test-of-cure-besöket (TOC) för gruppen av alla patienter med en dokumenterad patogen vid baslinjen (modifierad avsikt att behandla eller mITT) och gruppen av patienter i mITT-populationen som noga följt protokollet (Microbiologically Evaluable) sammanfattas i Tabell 16.
Mikrobiologiska utrotningshastigheter i den mikrobiologiskt utvärderbara populationen vid TOC för individuella patogener som återvunnits från patienter randomiserade till LEVAQUIN®-behandling presenteras i Tabell 17.
Komplicerade urinvägsinfektioner och akut pyelonefrit
10-dagars behandling
För att utvärdera säkerheten och effekten av 250 mg dosen, 10 dagars regim av LEVAQUIN®, inkluderades 567 patienter med okomplicerad UVI, mild till måttlig cUTI och mild till måttlig AP i en randomiserad, dubbelblind multicenter klinisk prövning utförd i USA från juni 1993 till januari 1995 och jämförde LEVAQUIN® 250 mg oralt en gång dagligen i 10 dagar (285 patienter) med ciprofloxacin 500 mg oralt två gånger dagligen i 10 dagar (282 patienter). Patienter med en resistent patogen, återkommande UVI, kvinnor över 55 år och med en inneboende kateter exkluderades initialt, innan protokolländringen ägde rum efter 30 % av inskrivningen. Mikrobiologisk effekt mättes genom bakteriologisk utrotning av baslinjeorganismen(-erna) 1–12 dagar efter behandling hos patienter med en patogen identifierad vid baslinjen.
Den bakteriologiska botningsgraden totalt för LEVAQUIN® och kontroll vid test-of-cure-besöket (TOC) för gruppen av alla patienter med en dokumenterad patogen vid baslinjen (modifierad avsikt att behandla eller mITT) och gruppen av patienter i mITT-populationen som noga följt protokollet (Microbiologically Evaluable) sammanfattas i Tabell 18.
Inhalationsmjältbrand (efter exponering)
Effektiviteten av LEVAQUIN® för denna indikation är baserad på plasmakoncentrationer som uppnåtts hos människor, ett surrogateffektmått som rimligen kan förutsäga klinisk nytta. LEVAQUIN® har inte testats på människor för att förebygga efter exponering av inhalationsmjältbrand. De genomsnittliga plasmakoncentrationerna av LEVAQUIN® associerade med en statistiskt signifikant förbättring av överlevnaden jämfört med placebo i rhesusapmodellen av inhalationsmjältbrand nås eller överskrids hos vuxna och pediatriska patienter som får de rekommenderade orala och intravenösa doseringsregimerna [se INDIKATIONER och DOSERING OCH ADMINISTRERING ].
Levofloxacins farmakokinetik har utvärderats hos vuxna och pediatriska patienter. Medelvärdet (± SD) steady state maximal plasmakoncentration hos vuxna människor som får 500 mg oralt eller intravenöst en gång dagligen är 5,7 ± 1,4 respektive 6,4 ± 0,8 mcg/ml; och motsvarande totala plasmaexponering (AUC ) är 47,5 ± 6,7 respektive 54,6 ± 11,1 mcg.h/ml. De förutsagda farmakokinetiska parametrarna vid steady-state hos pediatriska patienter i åldern 6 månader till 17 år som fick 8 mg/kg oralt var 12:e timme (inte överstiga 250 mg per dos) beräknades vara jämförbara med de som observerades hos vuxna som fick 500 mg oralt en gång dagligen [se KLINISK FARMAKOLOGI ].
LEVAQUIN® tabletter kan endast administreras till pediatriska patienter med inhalationsmjältbrand (efter exponering) eller pest som väger 30 kg eller mer på grund av begränsningarna i de tillgängliga styrkorna [se DOSERING OCH ADMINISTRERING ].
Hos vuxna är säkerheten för LEVAQUIN® under behandlingslängder på upp till 28 dagar väl karakteriserad. Information om långvarig användning vid 500 mg dagligen upp till 60 dagar är dock begränsad. Långvarig LEVAQUIN®-behandling hos vuxna ska endast användas när nyttan överväger risken.
Hos pediatriska patienter har säkerheten för levofloxacin under behandlingslängder på mer än 14 dagar inte studerats. En ökad incidens av muskuloskeletala biverkningar (artralgi, artrit, tendinopati, gångavvikelse) jämfört med kontroller har observerats i kliniska studier med behandlingslängd på upp till 14 dagar. Långtidssäkerhetsdata, inklusive effekter på brosk, efter administrering av levofloxacin till pediatriska patienter är begränsade [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
En placebokontrollerad djurstudie på rhesusapor som exponerats för en inhalerad medeldos av 49 LD50 (~2,7 × 106) sporer (intervall 17 – 118 LD50) av B. anthracis (Ames-stam) utfördes. Den minimala hämmande koncentrationen (MIC) av levofloxacin för mjältbrandsstammen som användes i denna studie var 0,125 mcg/ml. Hos de studerade djuren varierade medelplasmakoncentrationer av levofloxacin vid förväntat Tmax (1 timme efter dosering) efter oral dosering till steady state från 2,79 till 4,87 mcg/ml. Lägsta koncentrationer vid steady state 24 timmar efter dosering varierade från 0,107 till 0,164 mcg/ml. Genomsnittlig (SD) steady state AUC0-24 var 33,4 ± 3,2 mcg.h/ml (intervall 30,4 till 36,0 mcg.h/ml). Dödligheten på grund av mjältbrand för djur som fick en 30 dagars regim av oral LEVAQUIN® med början 24 timmar efter exponering var signifikant lägre (1/10), jämfört med placebogruppen (9/10) [P = 0,0011, 2-sidig Fisher 39;s Exakt Test]. Det ena levofloxacinbehandlade djuret som dog av mjältbrand gjorde det efter den 30 dagar långa administreringsperioden för läkemedel.
Plåga
Effektstudier av LEVAQUIN® kunde inte utföras på människor med pneumonisk pest av etiska och genomförbarhetsskäl. Därför baserades godkännandet av denna indikation på en effektstudie utförd på djur.
De genomsnittliga plasmakoncentrationerna av LEVAQUIN® associerade med en statistiskt signifikant förbättring av överlevnad jämfört med placebo i en afrikansk grön apamodell av lungpest nås eller överskrids hos vuxna och pediatriska patienter som får de rekommenderade orala och intravenösa doseringsregimerna [se INDIKATIONER och DOSERING OCH ADMINISTRERING ].
Levofloxacins farmakokinetik har utvärderats hos vuxna och pediatriska patienter. Medelvärdet (± SD) steady state maximal plasmakoncentration hos vuxna människor som får 500 mg oralt eller intravenöst en gång dagligen är 5,7 ± 1,4 respektive 6,4 ± 0,8 mcg/ml; och motsvarande totala plasmaexponering (AUC0-24) är 47,5 ± 6,7 respektive 54,6 ± 11,1 mcg.h/ml. De förutsagda farmakokinetiska parametrarna vid steady-state hos pediatriska patienter i åldern 6 månader till 17 år som fick 8 mg/kg oralt var 12:e timme (inte överstiga 250 mg per dos) beräknades vara jämförbara med de som observerades hos vuxna som fick 500 mg oralt en gång dagligen [se KLINISK FARMAKOLOGI ]. LEVAQUIN® tabletter kan endast administreras till pediatriska patienter med inhalationsmjältbrand (efter exponering) eller pest som väger 30 kg eller mer på grund av begränsningarna i de tillgängliga styrkorna [se DOSERING OCH ADMINISTRERING ].
En placebokontrollerad djurstudie på afrikanska gröna apor som exponerats för en inhalerad medeldos på 65 LD (intervall 3 till 145 LD50) av Yersinia pestis (CO92-stam) utfördes. Den minimala hämmande koncentrationen (MIC) av levofloxacin för Y. pestis-stammen som användes i denna studie var 0,03 mcg/ml. Genomsnittliga plasmakoncentrationer av levofloxacin som uppnåddes i slutet av en enstaka 30 minuters infusion varierade från 2,84 till 3,50 mcg/ml hos afrikanska gröna apor. Lägsta koncentrationer 24 timmar efter dosering varierade från
PATIENTINFORMATION
LEVAQUIN® (Leave ah kwin)(levofloxacin) tabletter
Vilken är den viktigaste informationen jag borde veta om LEVAQUIN 500mg?
LEVAQUIN 500mg, ett fluorokinolonantibiotikum, kan orsaka allvarliga biverkningar. Vissa av dessa allvarliga biverkningar kan inträffa samtidigt och kan leda till döden.
Om du får någon av följande allvarliga biverkningar när du tar LEVAQUIN 500 mg, du bör sluta ta LEVAQUIN omedelbart och få medicinsk hjälp omedelbart.
- Senproblem kan uppstå hos personer i alla åldrar som tar LEVAQUIN. Senor är hårda vävnadssträngar som förbinder muskler med ben. Några problem med senor inkluderar:
- smärta
- svullnad
- revor och svullnad av senor inklusive baksidan av fotleden (Achilles), axel, hand eller andra senor.
- Risken att få problem med senor medan du tar LEVAQUIN är högre om du:
- är över 60 år
- har genomgått en njur-, hjärt- eller lungtransplantation.
- Senproblem kan uppstå hos personer som inte har ovanstående riskfaktorer när de tar LEVAQUIN.
- Andra orsaker som kan öka risken för senproblem kan vara:
- fysisk aktivitet eller träning
- njursvikt
- senproblem i det förflutna, såsom hos personer med reumatoid artrit (RA)
- Sluta ta LEVAQUIN omedelbart och få medicinsk hjälp omedelbart vid första tecken på sensmärta, svullnad eller inflammation. Undvik träning och användning av det drabbade området.
- Det vanligaste området med smärta och svullnad är akillessenan på baksidan av din fotled. Detta kan även hända med andra senor. Du kan behöva ett annat antibiotikum som inte är en fluorokinolon för att behandla din infektion.
- Senruptur kan inträffa medan du tar eller efter att du har slutat ta LEVAQUIN. Senrupturer kan inträffa inom timmar eller dagar efter att ha tagit LEVAQUIN och har inträffat upp till flera månader efter att människor har slutat ta sin fluorokinolon.
- Sluta ta LEVAQUIN 750mg omedelbart och få medicinsk hjälp omedelbart om du får något av följande tecken eller symtom på en senoruptur:
- hör eller känner ett knäpp eller pop i ett senorområde
- blåmärken direkt efter en skada i ett senområde
- oförmögen att flytta det drabbade området eller bära vikt
- smärta
- brinnande
- stickningar
- domningar
- svaghet
Nervskadan kan vara permanent.
- anfall
- hör röster, se saker eller känna saker som inte finns där (hallucinationer)
- känna sig rastlös
- skakningar
- känna sig orolig eller nervös
- förvirring
- depression
- sömnproblem
- mardrömmar
- känna sig yr eller yr
- känna sig mer misstänksam (paranoia)
- självmordstankar eller handlingar
- huvudvärk som inte kommer att försvinna, med eller utan dimsyn
Vad är LEVAQUIN?
LEVAQUIN 500mg är ett fluorokinolonantibiotikum som används av vuxna 18 år eller äldre för att behandla vissa infektioner orsakade av vissa bakterier som kallas bakterier. Dessa bakteriella infektioner inkluderar:
- nosokomial lunginflammation
- samhällsförvärvad lunginflammation
- hudinfektioner, komplicerade och okomplicerade
- kronisk prostatainfektion
- inandning mjältbrand bakterier
- plåga
- urinvägsinfektioner, komplicerade och okomplicerade
- akut njurinfektion (pyelonefrit)
- akut sinusinfektion
- akut försämring eller kronisk bronkit
Studier av LEVAQUIN för användning vid behandling av pest och mjältbrand gjordes endast på djur, eftersom pest och mjältbrand inte kunde studeras hos människor.
LEVAQUIN ska inte användas till patienter med okomplicerade urinvägsinfektioner, akut bakteriell exacerbation av kronisk bronkit eller akut bakteriell bihåleinflammation om det finns andra tillgängliga behandlingsalternativ.
LEVAQUIN 750 mg tabletter används också för att behandla barn som väger minst 66 pund (eller minst 30 kg) och som kan ha andats in mjältbrandsbakterier, har pest eller exponerats för pestbakterier. Det är inte känt om LEVAQUIN är säkert och effektivt för barn under 6 månaders ålder.
Säkerheten och effektiviteten hos barn som behandlats med LEVAQUIN® i mer än 14 dagar är inte känd.
Vem bör inte ta LEVAQUIN 750mg?
Ta inte LEVAQUIN: om du någonsin har haft en allvarlig allergisk reaktion mot ett antibiotikum som kallas fluorokinolon, eller om du är allergisk mot levofloxacin eller något av innehållsämnena i LEVAQUIN. Se slutet av denna bipacksedel för en komplett lista över ingredienser i LEVAQUIN.
Innan du tar LEVAQUIN, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har problem med senor; LEVAQUIN 250mg ska inte användas till personer som har haft senproblem i anamnesen.
- har ett problem som orsakar muskelsvaghet (myasthenia gravis); LEVAQUIN ska inte användas till personer som har en känd historia av myasthenia gravis.
- har problem med centrala nervsystemet såsom kramper (epilepsi).
- har nervproblem; LEVAQUIN 250mg ska inte användas till patienter som har en historia av ett nervproblem som kallas perifer neuropati.
- har eller någon i din familj har oregelbundna hjärtslag, särskilt ett tillstånd som kallas "QT-förlängning".
- har lågt kalium i blodet (hypokalemi).
- har benproblem.
- har ledproblem inklusive reumatoid artrit (RA).
- har njurproblem. Du kan behöva en lägre dos av LEVAQUIN om dina njurar inte fungerar bra.
- har leverproblem.
- har diabetes eller problem med lågt blodsocker (hypoglykemi).
- är gravid eller planerar att bli gravid. Det är inte känt om LEVAQUIN 750mg kommer att skada ditt ofödda barn.
- ammar eller planerar att amma. Det är inte känt om LEVAQUIN passerar över i din bröstmjölk. Du och din vårdgivare bör bestämma om du ska ta LEVAQUIN 250mg eller amma. Du ska inte göra båda.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
LEVAQUIN och andra läkemedel kan påverka varandra och orsaka biverkningar.
Berätta särskilt för din vårdgivare om du tar:
- en steroidmedicin.
- ett antipsykotiskt läkemedel.
- ett tricykliskt antidepressivt medel.
- ett vattenpiller (vätskedrivande).
- vissa läkemedel kan hindra LEVAQUIN 750mg från att fungera korrekt. Ta LEVAQUIN® antingen 2 timmar före eller 2 timmar efter att du tagit dessa läkemedel eller kosttillskott:
- en antacida, multivitamin eller andra läkemedel eller kosttillskott som innehåller magnesium, aluminium, järn eller zink
- sukralfat (Carafate®)
- didanosin (Videx®, Videx® EC)
- ett blodförtunnande medel (warfarin, Coumadin, Jantoven).
- ett oralt läkemedel mot diabetes eller insulin.
- ett NSAID (icke-steroida antiinflammatoriska läkemedel). Många vanliga läkemedel för smärtlindring är NSAID. Att ta ett NSAID medan du tar LEVAQUIN 250 mg eller andra fluorokinoloner kan öka risken för effekter på centrala nervsystemet och kramper.
- teofyllin (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- ett läkemedel för att kontrollera din hjärtfrekvens eller rytm (antiarytmika).
Fråga din vårdgivare om du inte är säker på om något av dina läkemedel är listade ovan. Vet vilka mediciner du tar. Håll en lista över dina läkemedel och visa den för din vårdgivare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta LEVAQUIN 500mg?
- Ta LEVAQUIN exakt som din läkare säger åt dig att ta det.
- Ta LEVAQUIN 750 mg vid ungefär samma tidpunkt varje dag.
- Drick mycket vätska medan du tar LEVAQUIN.
- LEVAQUIN kan tas med eller utan mat.
- Om du missar en dos av LEVAQUIN 500 mg, ta den så snart du kommer ihåg det. Ta inte mer än 1 dos på 1 dag.
- Hoppa inte över några doser av LEVAQUIN 750 mg eller sluta ta det, även om du börjar må bättre, förrän du avslutat din ordinerade behandling om inte:
- du har problem med senor. Ser "Vad är den viktigaste informationen jag borde veta om LEVAQUIN 500mg?".
- du har ett nervproblem. Ser "Vilka är de möjliga biverkningarna av LEVAQUIN?".
- du har problem med centrala nervsystemet. Ser "Vilka är de möjliga biverkningarna av LEVAQUIN 750mg?".
- du har en allvarlig allergisk reaktion. Ser "Vilka är de möjliga biverkningarna av LEVAQUIN 250mg?".
- din vårdgivare säger åt dig att sluta ta LEVAQUIN.
Att ta alla dina LEVAQUIN 500 mg doser hjälper till att se till att alla bakterier dödas. Att ta alla dina LEVAQUIN 250 mg doser hjälper dig att minska risken för att bakterierna blir resistenta mot LEVAQUIN. Om din infektion inte blir bättre medan du tar LEVAQUIN 750mg, kan det betyda att bakterierna som orsakar din infektion kan vara resistenta mot LEVAQUIN. Om din infektion inte blir bättre, ring din vårdgivare. Om din infektion inte blir bättre kanske LEVAQUIN och andra liknande antibiotika inte fungerar för dig i framtiden.
- Om du tar för mycket LEVAQUIN, ring din vårdgivare eller få medicinsk hjälp omedelbart.
Vad ska jag undvika när jag tar LEVAQUIN 500mg?
- LEVAQUIN kan få dig att känna dig yr och yr. Låt bli köra bil, använda maskiner eller göra andra aktiviteter som kräver mental vakenhet eller koordination tills du vet hur LEVAQUIN påverkar dig.
- Undvik solljus, solarier och försök att begränsa din tid i solen. LEVAQUIN 750mg kan göra din hud känslig för solen (ljuskänslighet) och ljuset från sollampor och solarier. Du kan få allvarlig solbränna, blåsor eller svullnad av huden. Om du får något av dessa symtom när du tar LEVAQUIN, kontakta din vårdgivare omedelbart. Du bör använda en solkräm och bära en hatt och kläder som täcker din hud om du måste vara i solljus.
Vilka är de möjliga biverkningarna av LEVAQUIN 750mg?
LEVAQUIN 750mg kan orsaka allvarliga biverkningar, inklusive:
- Ser "Vad är den viktigaste informationen jag borde veta om LEVAQUIN 250mg?"
- Allvarliga allergiska reaktioner.
Allergiska reaktioner kan inträffa hos personer som tar fluorokinoloner, inklusive LEVAQUIN 500 mg, även efter endast 1 dos. Sluta ta LEVAQUIN 500mg och få akut medicinsk hjälp omedelbart om du har något av följande symtom på en allvarlig allergisk reaktion:
- nässelfeber
- svårt att andas eller svälja
- svullnad av läppar, tunga, ansikte
- trånghet i halsen, heshet
- snabba hjärtslag
- svag
- hudutslag
Hudutslag kan inträffa hos personer som tar LEVAQUIN 500 mg, även efter endast 1 dos. Sluta ta LEVAQUIN 250 mg vid första tecken på hudutslag och ring omedelbart din vårdgivare. Hudutslag kan vara ett tecken på en allvarligare reaktion på LEVAQUIN.
- Leverskada (hepatotoxicitet): Hepatotoxicitet kan inträffa hos personer som tar LEVAQUIN®. Ring din vårdgivare omedelbart om du har oförklarliga symtom som:
- illamående eller kräkningar
- magont
- feber
- svaghet
- buksmärtor eller ömhet
- klåda
- ovanlig trötthet
- aptitlöshet
- ljusa tarmrörelser
- mörkfärgad urin
- gulfärgning av din hud eller det vita i dina ögon
Sluta ta LEVAQUIN 750mg och berätta omedelbart för din läkare om du får gulfärgning på huden eller vita delen av ögonen eller om du har mörk urin. Dessa kan vara tecken på en allvarlig reaktion på LEVAQUIN (ett leverproblem).
- Tarminfektion (pseudomembranös kolit) Pseudomembranös kolit kan inträffa med många antibiotika, inklusive LEVAQUIN. Ring din vårdgivare direkt om du får vattnig diarré, diarré som inte försvinner eller blodig avföring. Du kan ha magkramper och feber. Pseudomembranös kolit kan inträffa 2 eller fler månader efter att du har avslutat din antibiotikabehandling.
- Allvarliga hjärtrytmförändringar (QT-förlängning och torsades depointes) Berätta omedelbart för din vårdgivare om du har en förändring i ditt hjärtslag (en snabb eller oregelbunden hjärtrytm) eller om du svimmar. LEVAQUIN 250 mg kan orsaka ett sällsynt hjärtproblem som kallas förlängning av QT-intervallet. Detta tillstånd kan orsaka onormalt hjärtslag och kan vara mycket farligt. Chansen att detta händer är högre hos människor:
- som är äldre
- med en familjehistoria med förlängt QT-intervall
- med lågt blodkalium (hypokalemi)
- som tar vissa läkemedel för att kontrollera hjärtrytmen (antiarytmika)
- Ledproblem Ökad risk för problem med leder och vävnader runt leder hos barn kan inträffa. Berätta för ditt barns vårdgivare om ditt barn har några ledproblem under eller efter behandling med LEVAQUIN.
- Förändringar i blodsockret Personer som tar LEVAQUIN och andra fluorokinolonläkemedel tillsammans med orala läkemedel mot diabetes eller med insulin kan få lågt blodsocker (hypoglykemi) och högt blodsocker (hyperglykemi). Följ din vårdgivares instruktioner för hur ofta du ska kontrollera ditt blodsocker. Om du har diabetes och du får lågt blodsocker när du tar LEVAQUIN, sluta ta LEVAQUIN 500mg och ring din vårdgivare omedelbart. Din antibiotikamedicin kan behöva ändras.
- Känslighet för solljus (ljuskänslighet) Ser "Vad ska jag undvika när jag tar LEVAQUIN?" De vanligaste biverkningarna av LEVAQUIN 250mg inkluderar:
- illamående
- huvudvärk
- diarre
- sömnlöshet
- förstoppning
- yrsel
Hos barn 6 månader och äldre som tar LEVAQUIN för att behandla mjältbrandssjukdom eller pest, är kräkningar också vanliga.
LEVAQUIN kan orsaka falskt positiva urinscreeningsresultat för opiater när testning görs med några kommersiellt tillgängliga kit. Ett positivt resultat bör bekräftas med ett mer specifikt test. Dessa är inte alla möjliga biverkningar av LEVAQUIN.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara LEVAQUIN 250mg?
- Förvara LEVAQUIN 500mg i rumstemperatur mellan 59°F till 86°F (15°C till 30°C).
- Förvara LEVAQUIN 500mg i en väl tillsluten behållare.
Allmän information om säker och effektiv användning av LEVAQUIN.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte LEVAQUIN för ett tillstånd som det inte är ordinerat för. Ge inte LEVAQUIN 500 mg till andra personer, även om de har samma symtom som du har. Det kan skada dem. Denna medicinguide sammanfattar den viktigaste informationen om LEVAQUIN. Om du vill ha mer information om LEVAQUIN 750mg, prata med din vårdgivare. Du kan fråga din vårdgivare eller apotekspersonal om information om LEVAQUIN 500mg som är skriven för vårdpersonal.
Vilka är ingredienserna i LEVAQUIN 500mg?
Aktiv beståndsdel: levofloxacin
Inaktiva Ingredienser : krospovidon, hypromellos, magnesiumstearat, mikrokristallin cellulosa, polyetylenglykol, polysorbat 80, titandioxid.
LEVAQUIN 250 mg tabletter innehåller också syntetisk röd järnoxid.
LEVAQUIN 500 mg tabletter innehåller också syntetisk röd järnoxid och syntetisk gul järnoxid.
Denna medicineringsguide har godkänts av US Food and Drug Administration
