Keflex 250mg, 500mg Cephalexin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Keflex 250mg och hur används det?
Keflex är ett receptbelagt läkemedel som används för att behandla symptomen på olika bakterieinfektioner genom att stoppa tillväxten av bakterier. Keflex 500mg kan användas ensamt eller tillsammans med andra läkemedel.
Keflex är känt som ett cefalosporinantibiotikum.
Vilka är biverkningarna av Keflex?
Keflex kan orsaka allvarliga biverkningar inklusive:
- svåra magsmärtor,
- diarré som är vattnig eller blodig,
- ovanlig trötthet,
- känna sig yr i huvudet eller andfådd,
- lätt att få blåmärken,
- ovanlig blödning,
- lila eller röda fläckar under huden,
- beslag,
- blek hud,
- kalla händer och fötter,
- gulnad hud, mörkfärgad urin,
- feber,
- svaghet ,
- smärta i sidan eller nedre delen av ryggen,
- smärtsam urinering,
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Keflex 500mg inkluderar:
- diarre,
- illamående,
- kräkningar,
- dålig matsmältning,
- magont,
- vaginal klåda eller flytningar,
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Keflex. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
KEFLEX® (cephalexin) Capsules, USP är ett semisyntetiskt cefalosporin antibakteriellt läkemedel avsett för oral administrering. Det är 7-(D-a-amino-a-fenylacetamido)-3-metyl-3-cefem-4-karboxylsyramonohydrat. Cephalexin har molekylformeln C16H17N3O4S•H2O och molekylvikten är 365,41.
Cephalexin har följande strukturformel:
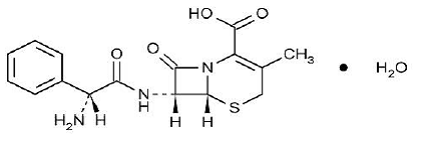
Varje kapsel innehåller cefalexinmonohydrat motsvarande 250 mg, 500 mg eller 750 mg cefalexin. Kapslarna innehåller även karboximetylcellulosanatrium, D&C Yellow No. 10, dimetikon, FD&C Blue No. 1, FD&C Yellow No. 6, gelatin, magnesiumstearat, mikrokristallin cellulosa och titandioxid.
INDIKATIONER
Luftvägsinfektioner
KEFLEX är indicerat för behandling av luftvägsinfektioner orsakade av känsliga isolat av Streptococcus pneumoniae och Streptococcus pyogenes.
Otitis media
KEFLEX är indicerat för behandling av otitis media orsakad av känsliga isolat av Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, Streptococcus pyogenes och Moraxella catarrhalis.
Hud Och Hudstruktur Infektioner
KEFLEX 250mg är indicerat för behandling av hud- och hudstrukturinfektioner orsakade av känsliga isolat av följande grampositiva bakterier: Staphylococcus aureus och Streptococcus pyogenes.
Beninfektioner
KEFLEX 250mg är indicerat för behandling av beninfektioner orsakade av känsliga isolat av Staphylococcus aureus och Proteus mirabilis.
Genitourinära infektioner
KEFLEX är indicerat för behandling av urinvägsinfektioner, inklusive akut prostatit, orsakad av känsliga isolat av Escherichia coli, Proteus mirabilis och Klebsiella pneumoniae.
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos KEFLEX 250mg och andra antibakteriella läkemedel, ska KEFLEX 500mg endast användas för att behandla infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör denna information beaktas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
Vuxna och pediatriska patienter som är minst 15 år gamla
Den vanliga dosen av oral KEFLEX 250 mg är 250 mg var 6:e timme, men en dos på 500 mg var 12:e timme kan administreras. Behandlingen administreras i 7 till 14 dagar.
För mer allvarliga infektioner kan större doser av oral KEFLEX behövas, upp till 4 gram dagligen i två till fyra lika uppdelade doser.
Pediatriska patienter (över 1 år)
Den rekommenderade totala dagliga dosen av oral KEFLEX 500 mg för pediatriska patienter är 25 till 50 mg/kg givet i lika uppdelade doser under 7 till 14 dagar. Vid behandling av β-hemolytiska streptokockinfektioner rekommenderas en varaktighet på minst 10 dagar. Vid svåra infektioner kan en total daglig dos på 50 till 100 mg/kg ges i lika uppdelade doser.
För behandling av öroninflammation är den rekommenderade dagliga dosen 75 till 100 mg/kg i lika uppdelade doser.
Dosjusteringar hos vuxna och pediatriska patienter som är minst 15 år gamla med nedsatt njurfunktion
Administrera följande doseringsregimer för KEFLEX till patienter med nedsatt njurfunktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
HUR LEVERERAS
Doseringsformer och styrkor
250 mg kapslar: ett vitt till ljusgult pulver fyllt i en ogenomskinlig vit och ogenomskinlig mörkgrön kapsel som är präglad med KEFLEX 250 mg i ätbart svart bläck på den vita kroppen.
500 mg kapslar: ett vitt till ljusgult pulver fyllt i en ogenomskinlig ljusgrön och ogenomskinlig mörkgrön kapsel som är präglad med KEFLEX 500 mg i ätbart svart bläck på den ljusgröna kroppen.
750 mg kapslar: ett vitt till ljusgult pulver fyllt i en långsträckt ogenomskinlig mörkgrön och ogenomskinlig mörkgrön kapsel som är präglad KEFLEX 750 mg i ätbart vitt bläck på den mörkgröna kroppen.
Förvaring Och Hantering
KEFLEX (cephalexin) kapslar , USP, levereras enligt följande:
250 mg kapslar, flaskor med 100 – NDC 59630-112-10 500 mg kapslar, flaskor med 100 – NDC 59630-113-10 750 mg kapslar, flaskor med 50 – NDC 59630-115-05
KEFLEX ska förvaras vid 25°C (77°F); utflykter tillåtna till 15° till 30°C (59° till 86°F) [se USP-kontrollerad rumstemperatur ].
Dispensera i en tät, ljusbeständig behållare.
Tillverkad för: Shionogi Inc. Florham Park, NJ 07932. Tillverkad av: Sandoz GmbH Kundl, Österrike. Reviderad: okt 2015.
BIEFFEKTER
Följande allvarliga händelser beskrivs mer i detalj i avsnittet Varningar och försiktighetsåtgärder:
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Clostridium difficile-associerad diarré [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Direct Coombs' Test Seroconversion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anfallspotential [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Effekt på protrombinaktivitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Utveckling av läkemedelsresistenta bakterier [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken
I kliniska prövningar var den vanligaste biverkningen diarré. Illamående och kräkningar, dyspepsi, gastrit och buksmärtor har också förekommit. Liksom för penicilliner och andra cefalosporiner har övergående hepatit och kolestatisk gulsot rapporterats.
Andra reaktioner har inkluderat överkänslighetsreaktioner, genital och anal pruritus, genital candidiasis, vaginit och flytningar, yrsel, trötthet, huvudvärk, agitation, förvirring, hallucinationer, artralgi, artrit och ledstörningar. Reversibel interstitiell nefrit har rapporterats. Eosinofili, neutropeni, trombocytopeni, hemolytisk anemi och lätta förhöjningar av aspartattransaminas (AST) och alanintransaminas (ALAT) har rapporterats.
Utöver de ovan listade biverkningarna som har observerats hos patienter som behandlats med KEFLEX 500 mg, har följande biverkningar och andra förändrade laboratorietester rapporterats för antibakteriella läkemedel av cefalosporinklassen:
Andra biverkningar
Feber, kolit, aplastisk anemi, blödning, nedsatt njurfunktion och toxisk nefropati.
Ändrade laboratorietester
Förlängd protrombintid, ökat blodureakväve (BUN), ökat kreatinin, förhöjt alkaliskt fosfatas, förhöjt bilirubin, förhöjt laktatdehydrogenas (LDH), pancytopeni, leukopeni och agranulocytos.
LÄKEMEDELSINTERAKTIONER
Metformin
Administrering av KEFLEX 250 mg med metformin resulterar i ökade plasmakoncentrationer av metformin och minskat renalt clearance av metformin.
Noggrann patientövervakning och dosjustering av metformin rekommenderas för patienter som samtidigt tar KEFLEX och metformin [se KLINISK FARMAKOLOGI ].
Probenecid
Den renala utsöndringen av KEFLEX hämmas av probenecid. Samtidig administrering av probenecid och KEFLEX 500 mg rekommenderas inte.
Interaktion med laboratorie- eller diagnostiska tester
En falsk-positiv reaktion kan uppstå när man testar förekomsten av glukos i urinen med Benedicts lösning eller Fehlings lösning.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Överkänslighetsreaktioner
Allergiska reaktioner i form av hudutslag, urtikaria, angioödem, anafylaxi, erythema multiforme, Stevens-Johnsons syndrom eller toxisk epidermal nekrolys har rapporterats vid användning av KEFLEX. Innan behandling med KEFLEX 500 mg påbörjas, fråga om patienten har en historia av överkänslighetsreaktioner mot cefalexin, cefalosporiner, penicilliner eller andra läkemedel. Korsöverkänslighet bland beta-laktamantibakteriella läkemedel kan förekomma hos upp till 10 % av patienterna med penicillinallergi i anamnesen.
Om en allergisk reaktion mot KEFLEX 500 mg inträffar, avbryt läkemedlet och inled lämplig behandling.
Clostridium Difficile-associerad diarré
Clostridium difficile-associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive KEFLEX 500 mg, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B, som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör sättas in efter klinisk indikation.
Direkt Coombs' Test Seroconversion
Positiva direkta Coombs tester har rapporterats under behandling med de antibakteriella cefalosporinläkemedlen inklusive cefalexin. Akut intravaskulär hemolys inducerad av cefalexinbehandling har rapporterats. Om anemi utvecklas under eller efter cefalexinbehandling, utför en diagnostisk upparbetning för läkemedelsinducerad hemolytisk anemi, avbryt cefalexin och sätt in lämplig behandling.
Potential för anfall
Flera cefalosporiner har varit inblandade i att utlösa anfall, särskilt hos patienter med nedsatt njurfunktion när dosen inte reducerats. Om anfall uppstår, avbryt behandlingen med KEFLEX. Antikonvulsiv behandling kan ges om det är kliniskt indicerat.
Förlängd protrombintid
Cefalosporiner kan vara associerade med förlängd protrombintid. De som är i riskzonen inkluderar patienter med nedsatt njur- eller leverfunktion, eller dåligt näringstillstånd, såväl som patienter som får en utdragen kur av antibakteriell terapi och patienter som får antikoagulantbehandling. Övervaka protrombintiden hos patienter i riskzonen och hantera enligt anvisningarna.
Utveckling av läkemedelsresistenta bakterier
Att förskriva KEFLEX i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion kommer sannolikt inte att ge patienten någon nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Långvarig användning av KEFLEX kan resultera i överväxt av okänsliga organismer. Noggrann observation av patienten är avgörande. Om superinfektion inträffar under behandlingen bör lämpliga åtgärder vidtas.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Livstidsstudier på djur har inte utförts för att utvärdera den karcinogena potentialen hos cefalexin. Tester för att fastställa den mutagena potentialen hos cefalexin har inte utförts. Hos han- och honråttor påverkades inte fertiliteten och reproduktionsförmågan av orala doser av cefalexin upp till 1,5 gånger den högsta rekommenderade dosen för människor baserat på kroppsyta.
Användning i specifika populationer
Graviditet
Graviditetskategori B
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Reproduktionsstudier har utförts på möss och råttor med orala doser av cefalexinmonohydrat 0,6 och 1,5 gånger den maximala dagliga dosen för människor (66 mg/kg/dag) baserat på kroppsyta, och har inte visat några tecken på nedsatt fertilitet eller skada på fostret.
Ammande mödrar
Cephalexin utsöndras i modersmjölk. Försiktighet bör iakttas när KEFLEX ges till en ammande kvinna.
Pediatrisk användning
Säkerheten och effektiviteten av KEFLEX 500 mg hos pediatriska patienter fastställdes i kliniska prövningar för de doser som beskrivs i avsnittet om dosering och administrering [se DOSERING OCH ADMINISTRERING ].
Geriatrisk användning
Av de 701 försökspersonerna i 3 publicerade kliniska studier av cefalexin var 433 (62%) 65 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre patienter, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter.
Detta läkemedel utsöndras till stor del via njurarna, och risken för toxiska reaktioner på detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör försiktighet iakttas vid val av dos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt njurfunktion
KEFLEX ska administreras med försiktighet i närvaro av nedsatt njurfunktion (kreatininclearance DOSERING OCH ADMINISTRERING ].
REFERENSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder för utspädning Antimikrobiella känslighetstester för bakterier som växer aerobt; Godkänd standard - tionde upplagan. CLSI-dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
2. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiella känslighetstest; Tjugofemte informationstillägget. CLSI-dokument M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiella diskkänslighetstest; Godkänd standard - tolfte upplagan. CLSI-dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
ÖVERDOS
Symtom på oral överdosering kan inkludera illamående, kräkningar, epigastrisk ångest, diarré och hematuri. Vid överdosering, sätt in allmänna stödåtgärder.
Forcerad diures, peritonealdialys, hemodialys eller kolhemoperfusion har inte fastställts vara fördelaktiga för en överdos av cefalexin.
KONTRAINDIKATIONER
KEFLEX är kontraindicerat hos patienter med känd överkänslighet mot cefalexin eller andra medlemmar av cefalosporinklassen av antibakteriella läkemedel.
KLINISK FARMAKOLOGI
Handlingsmekanism
Cephalexin är ett cefalosporin antibakteriellt läkemedel [se Mikrobiologi ].
Farmakokinetik
Absorption
Cephalexin är syrastabilt och kan ges utan hänsyn till måltider. Efter doser på 250 mg, 500 mg och 1 g erhölls genomsnittliga toppnivåer i serum på cirka 9, 18 respektive 32 mcg/ml efter 1 timme. Serumnivåer kunde detekteras 6 timmar efter administrering (vid en detektionsnivå av 0,2 mcg/ml).
Distribution
Cephalexin är cirka 10 % till 15 % bundet till plasmaproteiner.
Exkretion
Cefalexin utsöndras i urinen genom glomerulär filtration och tubulär sekretion. Studier visade att över 90 % av läkemedlet utsöndrades oförändrat i urinen inom 8 timmar. Under denna period var maximala urinkoncentrationer efter doserna 250 mg, 500 mg och 1 g cirka 1000, 2200 respektive 5000 mcg/ml.
Läkemedelsinteraktioner
Hos friska försökspersoner som fick engångsdoser på 500 mg av cefalexin och metformin, ökade plasmametformins genomsnittliga Cmax och AUC med i genomsnitt 34 % respektive 24 %, och det genomsnittliga njurclearancen för metformin minskade med 14 %. Ingen information finns tillgänglig om interaktionen mellan cefalexin och metformin efter flera doser av något av läkemedlen.
Mikrobiologi
Handlingsmekanism
Cephalexin är ett bakteriedödande medel som verkar genom att hämma bakteriell cellväggssyntes.
Motstånd
Meticillinresistenta stafylokocker och de flesta isolat av enterokocker är resistenta mot cefalexin. Cephalexin är inte aktivt mot de flesta isolat av Enterobacter spp., Morganella morganii och Proteus vulgaris. Cephalexin har ingen aktivitet mot Pseudomonas spp. eller Acinetobacter calcoaceticus. Penicillinresistent Streptococcus pneumoniae är vanligtvis korsresistent mot beta-laktam antibakteriella läkemedel.
Antimikrobiell aktivitet
Cephalexin har visat sig vara aktivt mot de flesta isolat av följande bakterier både in vitro och vid kliniska infektioner [se INDIKATIONER OCH ANVÄNDNING ].
Grampositiva bakterier
Staphylococcus aureus (endast meticillinkänsliga isolat) Streptococcus pneumoniae (penicillinkänsliga isolat) Streptococcus pyogenes
Gramnegativa bakterier
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Känslighetstester Metoder
När det är tillgängligt ska det kliniska mikrobiologiska laboratoriet tillhandahålla läkaren resultaten av in vitro-känslighetstestresultat för antimikrobiella läkemedel som används på inhemska sjukhus som periodiska rapporter som beskriver känslighetsprofilen för nosokomiala och samhällsförvärvade patogener. Dessa rapporter bör hjälpa läkaren att välja ett antibakteriellt läkemedel för behandling.
Endast i fall av okomplicerad urinvägsinfektion kan E. coli, K. pneumoniae och P. mirabilis känslighet för cefalexin fastställas genom att testa cefazolin2.
Spädningstekniker
Kvantitativa metoder används för att bestämma antimikrobiella minimala hämmande koncentrationer (MIC). Dessa MIC ger uppskattningar av bakteriers känslighet för antimikrobiella föreningar. MIC bör bestämmas med hjälp av standardiserade testmetoder (buljong eller agar)1,2.
Diffusionstekniker
Kvantitativa metoder som kräver mätning av zondiametrar ger också reproducerbara uppskattningar av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken ger en uppskattning av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken ska bestämmas med en standardiserad testmetod2,3.
En rapport om mottaglig (S) indikerar att det antimikrobiella läkemedlet sannolikt kommer att hämma tillväxten av patogenen om det antimikrobiella läkemedlet når den koncentration som vanligtvis kan uppnås på infektionsplatsen. En rapport av Intermediär (I) indikerar att resultatet bör anses vara tvetydigt, och om mikroorganismen inte är fullt mottaglig för alternativa kliniskt genomförbara läkemedel, bör testet upprepas. Denna kategori innebär möjlig klinisk tillämpbarhet på kroppsställen där läkemedlet är fysiologiskt koncentrerat eller i situationer där en hög dos av läkemedlet kan användas. Denna kategori ger också en buffertzon som förhindrar att små okontrollerade tekniska faktorer orsakar stora tolkningsskillnader. En rapport om resistent (R) indikerar att det antimikrobiella läkemedlet sannolikt inte kommer att hämma tillväxten av patogenen om det antimikrobiella läkemedlet når de koncentrationer som vanligtvis kan uppnås på infektionsplatsen; annan terapi bör väljas.
Kvalitetskontroll
Standardiserade förfaranden för känslighetstest kräver användning av laboratoriekontroller för att övervaka och säkerställa noggrannheten och precisionen hos förråd och reagenser som används i analysen, och teknikerna för den individ som utför testet1,2,3.
PATIENTINFORMATION
- Informera patienterna om att allergiska reaktioner, inklusive allvarliga allergiska reaktioner, kan uppstå och att allvarliga reaktioner kräver omedelbar behandling. Fråga patienten om eventuella tidigare överkänslighetsreaktioner mot KEFLEX, andra betalaktamer (inklusive cefalosporiner) eller andra allergener
- Informera patienter om att diarré är ett vanligt problem som orsakas av antibakteriella läkemedel och vanligtvis löser sig när läkemedlet avbryts. Ibland kan frekvent vattnig eller blodig diarré förekomma och kan vara ett tecken på en allvarligare tarminfektion. Om svår vattnig eller blodig diarré utvecklas, råd patienter att kontakta sin vårdgivare.
- Informera patienter om att antibakteriella läkemedel inklusive KEFLEX endast ska användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När KEFLEX 500 mg ordineras för att behandla en bakteriell infektion, berätta för patienterna att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med KEFLEX eller andra antibakteriella läkemedel i framtiden.
