Biaxin 250mg, 500mg Clarithromycin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Biaxin 500mg och hur används det?
Biaxin är ett receptbelagt läkemedel som används för att behandla symptomen på många olika bakterieinfektioner, inklusive magsår och Helicobacter pylori. Biaxin kan användas ensamt eller tillsammans med andra läkemedel.
Biaxin 500mg är ett antibiotikum.
Det är inte känt om Biaxin är säkert och effektivt hos barn yngre än 6 månader.
Vilka är de möjliga biverkningarna av Biaxin 250mg?
Biaxin 500mg kan orsaka allvarliga biverkningar inklusive:
- svåra magsmärtor,
- diarré som innehåller blod,
- snabba eller bultande hjärtslag,
- fladdrande i ditt bröst,
- andnöd,
- plötslig yrsel,
- förvirring,
- snurrande känsla,
- aptitlöshet,
- ont i övre magen,
- trötthet,
- mörk urin,
- lerfärgad pall,
- gulfärgning av ögon och hud (gulsot),
- lite eller ingen urin,
- svullnad i dina fötter eller vrister,
- känner mig trött,
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Biaxin inkluderar:
- magont,
- illamående,
- kräkningar,
- diarre,
- ovanlig eller obehaglig smak i munnen,
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Biaxin. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
Klaritromycin är ett semisyntetiskt makrolidantimikrobiellt medel för oral användning. Kemiskt är det 6-0-metylerytromycin. Molekylformeln är C38H69NO13, och molekylvikten är 747,96. Strukturformeln är:
Figur 1: Struktur för klaritromycin
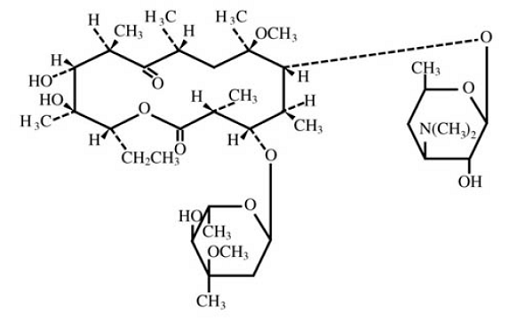
Klaritromycin är ett vitt till benvitt kristallint pulver. Det är lösligt i aceton, något lösligt i metanol, etanol och acetonitril och praktiskt taget olösligt i vatten.
BIAXIN finns som tabletter med omedelbar frisättning, tabletter med förlängd frisättning och granulat för oral suspension.
Varje gul oval filmdragerad BIAXIN Filmtab-tablett med omedelbar frisättning (klaritromycintabletter, USP) innehåller 250 mg eller 500 mg klaritromycin och följande inaktiva ingredienser:
- 250 mg tabletter: hypromellos, hydroxipropylcellulosa, kroskarmellosnatrium, D&C Yellow No. 10, FD&C Blue No. 1, magnesiumstearat, mikrokristallin cellulosa, povidon, förgelatinerad stärkelse, propylenglykol, kiseldioxid, sorbinsyra, sorbitansyra, sorbitansyra, sorbitansyra talk, titandioxid och vanillin.
- 500 mg tabletter: hypromellos, hydroxipropylcellulosa, kolloidal kiseldioxid, kroskarmellosnatrium, D&C Yellow No. 10, magnesiumstearat, mikrokristallin cellulosa, povidon, propylenglykol, sorbinsyra, sorbitanmonooleat, titandioxid och vanillindioxid.
Varje gul oval filmdragerad BIAXIN XL Filmtab-tablett (klaritromycin-tabletter med förlängd frisättning) innehåller 500 mg klaritromycin och följande inaktiva ingredienser: cellulosapolymerer, D&C Yellow No. 10, laktosmonohydrat, magnesiumstearat, propylenglykol, sorbitansyra, monooleat, talk, titandioxid och vanillin.
Varje 5 ml BIAXIN 500 mg rekonstituerad suspension (klaritromycin för oral suspension, USP) innehåller 125 mg eller 250 mg klaritromycin. Varje flaska med BIAXIN granulat innehåller 1250 mg (50 ml storlek), 2500 mg (50 och 100 ml storlekar) eller 5000 mg (100 ml storlek) klaritromycin och följande inaktiva ingredienser: karbomer, ricinolja, citronsyra, hypromellosftalat, maltodextrin, kaliumsorbat, povidon, kiseldioxid, sackaros, xantangummi, titandioxid och fruktpunchsmak.
INDIKATIONER
Akut bakteriell exacerbation av kronisk bronkit
BIAXIN (Filmtab, Granulat) och BIAXIN XL Filmtab är indicerade för vuxna för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av Haemophilus influenzae, Haemophilus parainfluenzae, Moraxella catarrhalis eller Streptococcus pneumoniae [se INDIKATIONER OCH ANVÄNDNING ].
Akut maxillär bihåleinflammation
BIAXIN (Filmtab, Granulat) och BIAXIN 500mg XL Filmtab (hos vuxna) är indicerade för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av Haemophilus influenzae, Moraxella catarrhalis eller Streptococcus pneumoniae [se INDIKATIONER OCH ANVÄNDNING ].
Samhällsförvärvad lunginflammation
BIAXIN (Filmtab, Granulat) och BIAXIN XL Filmtab är indikerade [se INDIKATIONER OCH ANVÄNDNING ] för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av:
- Haemophilus influenzae (hos vuxna)
- Haemophilus parainfluenzae (BIAXIN 500mg XL Filmtab hos vuxna)
- Moraxella catarrhalis (BIAXIN 250mg XL Filmtab hos vuxna)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500mg XL Filmtab [i vuxna]; BIAXIN Filmtab och BIAXIN Granulat [i vuxna och pediatriska patienter])
Faryngit/Tonsillit
BIAXIN 500mg Filmtab och BIAXIN 500mg Granulat är indicerade för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av Streptococcus pyogenes som ett alternativ hos individer som inte kan använda förstahandsbehandling.
Okomplicerade hud- och hudstrukturinfektioner
BIAXIN Filmtab och BIAXIN Granulat är indicerade för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av Staphylococcus aureus eller Streptococcus pyogenes.
Akut otitis media
BIAXIN Filmtab och BIAXIN 250 mg granulat är indicerade för pediatriska patienter för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av Haemophilus influenzae, Moraxella catarrhalis eller Streptococcus pneumoniae [se Kliniska studier ].
Behandling och profylax av spridda mykobakteriella infektioner
BIAXIN 500mg Filmtab och BIAXIN 250mg Granulat är indicerade för behandling av milda till måttliga infektioner orsakade av känsliga isolat på grund av Mycobacterium avium eller Mycobacterium intracellulare hos patienter med avancerad HIV-infektion [se Kliniska studier ].
Helicobacter Pylori-infektion och duodenalsårsjukdom
BIAXIN 250mg Filmtab ges i kombination med andra läkemedel till vuxna enligt beskrivningen nedan för att utrota H. pylori. Utrotning av H. pylori har visat sig minska risken för återfall av duodenalsår [se Kliniska studier ].
- BIAXIN Filmtab i kombination med amoxicillin och PREVACID (lansoprazol) eller PRILOSEC (omeprazol) kapslar med fördröjd frisättning, som trippelterapi, är indicerade för behandling av patienter med H. pylori-infektion och duodenalsårsjukdom (aktiv eller femårig historia av duodenal tolvfingertarm) sår) för att utrota H. pylori.
- BIAXIN 250 mg Filmtab i kombination med PRILOSEC (omeprazol) kapslar är indicerade för behandling av patienter med ett aktivt duodenalsår i samband med H. pylori-infektion. Regimer som innehåller BIAXIN 250 mg Filmtab som det enda antibakteriella medlet är mer sannolikt associerade med utvecklingen av klaritromycinresistens hos patienter som misslyckas med behandlingen. Regimer som innehåller klaritromycin ska inte användas till patienter med kända eller misstänkta klaritromycinresistenta isolat eftersom behandlingens effekt är reducerad i denna miljö.
Användningsbegränsningar
BIAXIN 500mg XL Filmtab är endast indicerat för akut maxillär bihåleinflammation, akut bakteriell exacerbation av kronisk bronkit och samhällsförvärvad pneumoni hos vuxna. Effekten och säkerheten för BIAXIN 500mg XL Filmtab vid behandling av andra infektioner för vilka BIAXIN Filmtab och BIAXIN Granulat är godkända har inte fastställts.
Det finns resistens mot makrolider i vissa bakterieinfektioner orsakade av Streptococcus pneumoniae och Staphylococcus aureus. Känslighetstestning bör utföras när det är kliniskt indicerat.
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos BIAXIN och andra antibakteriella läkemedel, ska BIAXIN endast användas för att behandla eller förebygga infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
Viktiga administrationsinstruktioner
BIAXIN Filmtab och BIAXIN 250 mg granulat kan ges med eller utan mat.
BIAXIN XL Filmtab ska tas med mat. Svälj BIAXIN 500mg XL Filmtab hel; tugga, krossa eller krossa inte BIAXIN 500mg XL Filmtab.
Dosering för vuxna
De rekommenderade doserna av BIAXIN 250mg Filmtab och BIAXIN 250mg XL Filmtab för behandling av milda till måttliga infektioner hos vuxna anges i Tabell 1.
Kombinationsdoseringsregimer för H. pylori-infektion
- Trippelbehandling: BIAXIN 500mg Filmtab/lansoprazol/amoxicillin Den rekommenderade dosen för vuxna är 500 mg BIAXIN 500 mg Filmtab, 30 mg lansoprazol och 1 gram amoxicillin, alla ges var 12:e timme i 10 eller 14 dagar [se INDIKATIONER OCH ANVÄNDNING och Kliniska studier ].
- Trippelbehandling: BIAXIN Filmtab/omeprazol/amoxicillin Den rekommenderade dosen för vuxna är 500 mg BIAXIN 250 mg Filmtab, 20 mg omeprazol och 1 gram amoxicillin; alla ges var 12:e timme i 10 dagar. Hos patienter med ett sår vid tidpunkten för behandlingsstart rekommenderas ytterligare 18 dagar med omeprazol 20 mg en gång dagligen för sårläkning och symtomlindring [se INDIKATIONER OCH ANVÄNDNING och Kliniska studier ].
- Dubbelbehandling: BIAXIN 500mg Filmtab/omeprazol Den rekommenderade dosen för vuxna är 500 mg BIAXIN 250 mg Filmtab givet var 8:e timme och 40 mg omeprazol ges en gång varje morgon i 14 dagar. Ytterligare 14 dagar med omeprazol 20 mg en gång dagligen rekommenderas för sårläkning och symtomlindring [se INDIKATIONER OCH ANVÄNDNING och Kliniska studier ].
Pediatrisk dosering
Den rekommenderade dagliga dosen är 15 mg/kg/dag fördelat var 12:e timme i 10 dagar (upp till vuxendosen). Se doseringsregimer för mykobakteriella infektioner hos pediatriska patienter för ytterligare doseringsinformation [se Doseringsprogram för mykobakteriella infektioner ].
Doseringsprogram för mykobakteriella infektioner
För behandling av spridd infektion på grund av Mycobacterium avium-komplex (MAC), rekommenderas BIAXIN Filmtab och BIAXIN 500 mg granulat som de primära medlen. BIAXIN Filmtab och BIAXIN Granulat ska användas i kombination med andra antimykobakteriella läkemedel (t.ex. etambutol) som har visat in vitro aktivitet mot MAC eller klinisk nytta vid MAC-behandling [se Kliniska studier ].
Vuxna patienter
För behandling och profylax av mykobakteriella infektioner hos vuxna är den rekommenderade dosen av BIAXIN 500 mg var 12:e timme.
Pediatriska patienter
För behandling och profylax av mykobakteriella infektioner hos pediatriska patienter är den rekommenderade dosen 7,5 mg/kg var 12:e timme upp till 500 mg var 12:e timme. [Ser Användning i specifika populationer och Kliniska studier ].
Behandling med BIAXIN 250 mg bör fortsätta om kliniskt svar observeras. BIAXIN kan sättas ut när patienten anses ha låg risk för spridd infektion.
Dosjustering hos patienter med nedsatt njurfunktion
Se tabell 2 för dosjustering hos patienter med måttligt eller gravt nedsatt njurfunktion med eller utan samtidig behandling som innehåller atazanavir eller ritonavir [se LÄKEMEDELSINTERAKTIONER ].
Dosjustering på grund av läkemedelsinteraktioner
Minska dosen av BIAXIN 500 mg med 50 % vid samtidig administrering med atazanavir [se LÄKEMEDELSINTERAKTIONER ]. Dosjusteringar för andra läkemedel när de administreras samtidigt med BIAXIN 250 mg kan rekommenderas på grund av läkemedelsinteraktioner [se LÄKEMEDELSINTERAKTIONER ].
Beredning av BIAXIN Granulat
De medföljande BIAXIN 250 mg granulerna måste rekonstitueras med vatten innan administrering av BIAXIN för oral suspension. Tabell 3 nedan visar volymen vatten som ska tillsättas vid rekonstituering. För att rekonstituera:
Skaka ordentligt före varje användning. Efter blandning, förvara vid 15° till 30°C (59° till 86°F) och använd inom 14 dagar. Förvara inte i kylskåp.
HUR LEVERERAS
Doseringsformer och styrkor
BIAXIN 500mg finns som:
- BIAXIN 250mg Filmtab (gul oval filmdragerad tablett):
- 250 mg: tryckt i blått med "a"-logotypen och KT
- 500 mg: präglad med "a"-logotypen på ena sidan och KL på motsatta sidan
- BIAXIN XL Filmtab (gul oval filmdragerad tablett med förlängd frisättning):
- 500 mg: präglad med "a"-logotypen och KJ
- BIAXIN granulat (vita till benvita granulat före beredning; vit till benvit ogenomskinlig suspension efter beredning):
- 125 mg/5 ml koncentration tillgänglig i 50 ml och 100 ml flaskor
- 250 mg/5 ml koncentration tillgänglig i 50 ml och 100 ml flaskor
Förvaring Och Hantering
BIAXIN 250mg Filmtab (klaritromycintabletter, USP) levereras som gula ovala filmdragerade tabletter i följande förpackningsstorlekar: 250 mg tabletter: (märkta i blått med "a"-logotypen och KT)
Flaskor med 60 st ( NDC 0074-3368-60) och enhetsdosremsor om 100 ( NDC 0074-3368-11).
Förvara BIAXIN Filmtab 250 mg vid kontrollerad rumstemperatur 15° till 30°C (59° till 86°F) i en väl tillsluten behållare. Skydda från ljus.
500 mg tabletter : (präglat med "a"-logotypen på ena sidan och KL på motsatta sidan)
Flaskor om 60 (NDC 0074-2586-60) och enhetsdosremsor om 100 ( NDC 0074-2586-11).
Förvara BIAXIN Filmtab 500 mg vid kontrollerad rumstemperatur 20° till 25°C (68° till 77°F) i en väl tillsluten behållare.
BIAXIN XL Filmtab (klaritromycin tabletter med förlängd frisättning) levereras som gula ovala filmdragerade tabletter i följande förpackningsstorlekar:
500 mg tabletter : (präglat med "a"-logotypen och KJ)
Flaskor med 60 stycken (NDC 0074-3165-60), enhetsdosremsor med 100 st ( NDC 0074-3165-11), och BIAXIN XL PAC kartong med 4 blisterförpackningar vardera 14 tabletter ( NDC 0074-3165-41).
Förvara BIAXIN 500mg XL Filmtab vid 20° till 25°C (68° till 77°F). Utflykter tillåtna till 15° till 30°C (59° till 86°F). [Ser USP-kontrollerad rumstemperatur .]
BIAXIN 500mg granulat (klaritromycin för oral suspension, USP) levereras som vita till benvita granuler i följande styrkor och storlekar:
Förvara BIAXIN 500 mg granulat under 25°C (77°F) i en väl tillsluten behållare. Förvara inte de rekonstituerade BIAXIN 500 mg granulaten i kylskåp.
BIAXIN Filmtab 250 mg och 500 mg och BIAXIN 250mg XL Filmtab 500 mg Mfd. av AbbVie LTD, Barceloneta, PR 00617. BIAXIN Granulat, 125 mg/5 mL och 250 mg/5 mL Mfd. av AbbVie Inc., North Chicago, IL 60064 För AbbVie Inc., North Chicago, IL 60064, USA Reviderad: nov 2018.
BIEFFEKTER
Följande allvarliga biverkningar beskrivs nedan och på andra ställen i märkningen:
- Akuta överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- QT-förlängning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarliga biverkningar på grund av samtidig användning med andra läkemedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Clostridium difficile associerad diarré [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Exacerbation av Myasthenia Gravis [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska studier utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Baserat på sammanslagna data för alla indikationer är de vanligaste biverkningarna för både vuxna och pediatriska populationer som observerats i kliniska prövningar buksmärtor, diarré, illamående, kräkningar och dysgeusi. Även dyspepsi, onormala leverfunktionstest, anafylaktisk reaktion, candidiasis, huvudvärk, sömnlöshet och hudutslag rapporterades.
De efterföljande underavsnitten listar de vanligaste biverkningarna för profylax och behandling av mykobakteriella infektioner och duodenalsår i samband med H. pylori-infektion. I allmänhet överensstämmer dessa profiler med de sammanslagna data som beskrivs ovan.
Profylax av mykobakteriella infektioner
Hos AIDS-patienter som behandlats med BIAXIN under långa tidsperioder för profylax mot M. avium var det ofta svårt att särskilja biverkningar som möjligen var förknippade med administrering av BIAXIN från underliggande HIV-sjukdom eller interkurrent sjukdom. Medianbehandlingslängden var 10,6 månader för BIAXIN-gruppen och 8,2 månader för placebogruppen.
Förändringar i laboratorievärden
Utvalda laboratoriebiverkningar som rapporterades under behandling hos mer än 2 % av vuxna patienter som behandlades med BIAXIN i en randomiserad dubbelblind klinisk prövning med 682 patienter presenteras i Tabell 5.
Hos immunkomprometterade patienter som fick profylax mot M. avium gjordes utvärderingar av laboratorievärden genom att analysera dessa värden utanför det allvarligt onormala värdet (dvs. den extrema höga eller låga gränsen) för det specificerade testet.
Behandling av mykobakteriella infektioner
Biverkningsprofilerna för både 500 mg och 1000 mg två gånger dagligen var liknande.
Hos AIDS-patienter och andra immunförsvagade patienter som behandlats med de högre doserna av BIAXIN under långa tidsperioder för mykobakteriella infektioner, var det ofta svårt att särskilja biverkningar som möjligen kan förknippas med administrering av BIAXIN 250 mg från underliggande tecken på HIV-sjukdom eller interkurrent sjukdom.
Följande analys sammanfattar erfarenheter under de första 12 veckorna av behandling med BIAXIN. Data rapporteras separat för försök 1 (randomiserat, dubbelblind) och försök 2 (öppenmärkt, compassionate use) och även kombinerade. Biverkningar rapporterades mindre frekvent i studie 2, vilket delvis kan bero på skillnader i övervakning mellan de två studierna.
Hos vuxna patienter som får BIAXIN 500 mg två gånger dagligen, listas de vanligast rapporterade biverkningarna, som anses möjligen eller möjligen relaterade till studieläkemedlet, med en incidens på 5 % eller mer, nedan (tabell 6). Ungefär 8 % av patienterna som fick 500 mg två gånger om dagen och 12 % av patienterna som fick 1000 mg två gånger om dagen avbröt behandlingen på grund av läkemedelsrelaterade biverkningar under de första 12 veckorna av behandlingen; Biverkningar som ledde till utsättning av behandlingen hos minst 2 patienter inkluderade illamående, kräkningar, buksmärtor, diarré, hudutslag och asteni.
Ett begränsat antal pediatriska AIDS-patienter har behandlats med BIAXIN suspension för mykobakteriella infektioner. De vanligast rapporterade biverkningarna, exklusive de som beror på patientens samtidiga tillstånd, överensstämde med de som observerats hos vuxna patienter.
Förändringar i laboratorievärden
Under de första 12 veckorna av att börja med BIAXIN 500 mg två gånger dagligen har 3 % av patienterna SGOT-ökningar och 2 % av patienterna har SGPT-ökningar > 5 gånger den övre normalgränsen i försök 2 (469 inskrivna vuxna patienter) medan försök 1 (154 inkluderade patienter) hade ingen förhöjning av transaminaser. Detta inkluderar endast patienter med baslinjevärden inom normalområdet eller låga gränsvärden.
Duodenalsår i samband med H. pylori-infektion
kliniska prövningar med kombinationsbehandling med BIAXIN 500 mg plus omeprazol och amoxicillin har inga biverkningar som är specifika för kombinationen av dessa läkemedel observerats. Biverkningar som har inträffat har begränsats till de som tidigare har rapporterats med BIAXIN 250 mg, omeprazol eller amoxicillin.
Biverkningsprofilerna visas nedan (tabell 7) för fyra randomiserade dubbelblinda kliniska prövningar där patienter fick kombinationen BIAXIN 500 mg tre gånger om dagen och omeprazol 40 mg dagligen i 14 dagar, följt av omeprazol 20 mg en gång per dag. dag, (tre studier) eller 40 mg en gång om dagen (en studie) i ytterligare 14 dagar. Av de 346 patienter som fick kombinationen avbröt 3,5 % av patienterna läkemedlet på grund av biverkningar.
Förändringar i laboratorievärden
Förändringar i laboratorievärden med möjlig klinisk betydelse hos patienter som tar BIAXIN och omeprazol i fyra randomiserade dubbelblinda studier på 945 patienter är följande:
Lever förhöjt direkt bilirubin
Mindre frekventa biverkningar observerade under kliniska prövningar av klaritromycin
Baserat på sammanslagna data för alla indikationer, observerades följande biverkningar i kliniska prövningar med klaritromycin i en frekvens på mindre än 1 %:
Blod- och lymfsystemet: Leukopeni, neutropeni, trombocytemi, eosinofili
Hjärtsjukdomar: Elektrokardiogram QT förlängt, hjärtstillestånd, förmaksflimmer, extrasystoler, hjärtklappning
Öron- och labyrintsjukdomar: Vertigo, tinnitus, hörselnedsättning
Gastrointestinala störningar: Stomatit, glossit, esofagit, gastroesofageal refluxsjukdom, gastrit, proctalgi, buken utspänd, förstoppning, muntorrhet, utslag, flatulens
Allmänna störningar och villkor för administrationsplatsen: Besvärskänsla, pyrexi, asteni, bröstsmärtor, frossa, trötthet
Lever och gallvägar: Kolestas, hepatit
Immunsystemets störningar: Överkänslighet
Infektioner och angrepp: Cellulit, gastroenterit, infektion, vaginal infektion
Undersökningar: Förhöjt bilirubin i blodet, ökat alkaliskt fosfatas i blodet, ökat laktatdehydrogenas i blodet, onormalt albuminglobulinförhållande
Metabolism och näringsstörningar: Anorexi, minskad aptit
Muskuloskeletala och bindvävssjukdomar: Myalgi, muskelspasmer, nackstyvhet
Störningar i nervsystemet: Yrsel, tremor, medvetslöshet, dyskinesi, somnolens
Psykiatriska störningar: Ångest, nervositet
Njur- och urinvägsstörningar: Kreatinin i blodet ökade, blodets urea ökade
Andningsvägar, bröstkorg och mediastinum: Astma, näsblod, lungemboli
Hud och subkutan vävnad: Urtikaria, bullös dermatit, klåda, hyperhidros, maculo-papulära utslag
Gastrointestinala biverkningar
studier av akut exacerbation av kronisk bronkit och akut maxillär bihåleinflammation rapporterades övergripande gastrointestinala biverkningar av en liknande andel patienter som tog antingen BIAXIN 250mg Filmtab eller BIAXIN 500mg XL Filmtab; dock rapporterade patienter som tog BIAXIN 500mg XL Filmtab signifikant mindre allvarliga gastrointestinala symtom jämfört med patienter som tog BIAXIN 250mg Filmtab. Dessutom hade patienter som tog BIAXIN 500mg XL Filmtab signifikant färre avbrott i förtid för läkemedelsrelaterade gastrointestinala eller onormala smakbiverkningar jämfört med BIAXIN Filmtab.
Dödlighet av alla orsaker hos patienter med kranskärlssjukdom 1 till 10 år efter exponering för BIAXIN
en klinisk prövning som utvärderade behandling med klaritromycin på utfall hos patienter med kranskärlssjukdom, observerades en ökad risk för dödlighet av alla orsaker hos patienter randomiserade till klaritromycin. Klaritromycin för behandling av kranskärlssjukdom är inte en godkänd indikation. Patienterna behandlades med klaritromycin eller placebo i 14 dagar och observerades med avseende på primära utfallshändelser (t.ex. dödlighet av alla orsaker eller icke-dödliga hjärthändelser) under flera år.1 Ett numeriskt högre antal primära utfallshändelser hos patienter som randomiserades att få klaritromycin var observerades med en hazard ratio på 1,06 (95 % konfidensintervall 0,98 till 1,14). Vid uppföljning 10 år efter behandling var det dock 866 (40 %) dödsfall i klaritromycingruppen och 815 (37 %) dödsfall i placebogruppen som representerade en riskkvot för dödlighet av alla orsaker på 1,10 (95 %). konfidensintervall 1,00 till 1,21). Skillnaden i antalet dödsfall uppstod efter ett år eller mer efter avslutad behandling.
Orsaken till skillnaden i dödlighet av alla orsaker har inte fastställts. Andra epidemiologiska studier som utvärderar denna risk har visat varierande resultat [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av BIAXIN efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Blod och lymfsystemet: Trombocytopeni, agranulocytos
Hjärt: Ventrikulär arytmi, ventrikulär takykardi, torsades de pointes
Öron och labyrint: Dövhet rapporterades främst hos äldre kvinnor och var vanligtvis reversibel.
Gastrointestinala: Akut pankreatit, missfärgning av tungan, missfärgning av tänderna rapporterades och var vanligtvis reversibel med professionell rengöring vid utsättande av läkemedlet.
Det har förekommit rapporter om BIAXIN 250mg XL Filmtab i avföringen, av vilka många har förekommit hos patienter med anatomiska (inklusive ileostomi eller kolostomi) eller funktionella gastrointestinala störningar med förkortade GI transittider. I flera rapporter har tablettrester förekommit i samband med diarré. Det rekommenderas att patienter som upplever tablettrester i avföringen och ingen förbättring av deras tillstånd ska byta till en annan klaritromycinformulering (t.ex. suspension) eller ett annat antibakteriellt läkemedel.
Lever och gallvägar: Leversvikt, gulsot hepatocellulär. Biverkningar relaterade till leverdysfunktion har rapporterats med klaritromycin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Infektioner och angrepp: Pseudomembranös kolit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Immunförsvar: Anafylaktiska reaktioner, angioödem
Undersökningar: Protrombintiden förlängdes, antalet vita blodkroppar minskade, internationellt normaliserat förhållande ökade. Onormal urinfärg har rapporterats i samband med leversvikt.
Metabolism och näring: Hypoglykemi har rapporterats hos patienter som tar orala hypoglykemiska medel eller insulin.
Muskuloskeletala och bindväv: Myopati rabdomyolys rapporterades och i några av rapporterna administrerades klaritromycin samtidigt med statiner, fibrater, kolchicin eller allopurinol [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nervsystem: Parosmi, anosmi, ageusia, parestesi och kramper
Psykiatrisk: Onormalt beteende, förvirringstillstånd, depersonalisering, desorientering, hallucinationer, depression, maniskt beteende, onormal dröm, psykotisk störning. Dessa störningar försvinner vanligtvis vid utsättande av läkemedlet.
Njurar och urinvägar: Nefrit interstitiell, njursvikt
Hud och subkutan vävnad: Stevens-Johnsons syndrom, toxisk epidermal nekrolys, läkemedelsutslag med eosinofili och systemiska symtom (DRESS), Henoch-Schonlein purpura, akne, akut generaliserad exantematös pustulos
Kärl: Blödning
LÄKEMEDELSINTERAKTIONER
Samtidig administrering av BIAXIN 250mg är känd för att hämma CYP3A, och ett läkemedel som primärt metaboliseras av CYP3A kan vara associerat med förhöjda läkemedelskoncentrationer som kan öka eller förlänga både terapeutiska och biverkningar av det samtidiga läkemedlet.
BIAXIN ska användas med försiktighet till patienter som behandlas med andra läkemedel som är kända för att vara CYP3A-enzymsubstrat, särskilt om CYP3A-substratet har en snäv säkerhetsmarginal (t.ex. karbamazepin) och/eller substratet metaboliseras i stor utsträckning av detta enzym. Justera dosen när så är lämpligt och övervaka serumkoncentrationer av läkemedel som primärt metaboliseras av CYP3A noga hos patienter som samtidigt får klaritromycin.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Akuta överkänslighetsreaktioner
Vid allvarliga akuta överkänslighetsreaktioner, såsom anafylaxi, Stevens-Johnsons syndrom, toxisk epidermal nekrolys, läkemedelsutslag med eosinofili och systemiska symtom (DRESS), Henoch-Schonlein purpura och akut generaliserad exantematös pustulos, avbryt behandlingen omedelbart och BIAXIN 250maxIN sätta in lämplig behandling.
QT-förlängning
BIAXIN 500 mg har associerats med förlängning av QT-intervallet och sällsynta fall av arytmi. Fall av torsades de pointes har spontant rapporterats under övervakning efter marknadsföring hos patienter som fått BIAXIN. Dödsfall har rapporterats.
Undvik BIAXIN hos följande patienter:
- patienter med känd förlängning av QT-intervallet, ventrikulär hjärtarytmi, inklusive torsades de pointes
- patienter som får läkemedel som är kända för att förlänga QT-intervallet [se även KONTRAINDIKATIONER ]
- patienter med pågående proarytmiska tillstånd såsom okorrigerad hypokalemi eller hypomagnesemi, kliniskt signifikant bradykardi och hos patienter som får klass IA (t.ex. kinidin, prokainamid, disopyramid) eller klass III (t.ex. dofetilid, amiodaron, sotalol) antiarytmika.
Äldre patienter kan vara mer mottagliga för läkemedelsrelaterade effekter på QT-intervallet [se Användning i specifika populationer ].
Hepatotoxicitet
Leverdysfunktion, inklusive ökade leverenzymer, och hepatocellulär och/eller kolestatisk hepatit, med eller utan gulsot, har rapporterats med klaritromycin. Denna leverdysfunktion kan vara allvarlig och är vanligtvis reversibel. I vissa fall har leversvikt med dödlig utgång rapporterats och har i allmänhet associerats med allvarliga underliggande sjukdomar och/eller samtidig medicinering. Symtom på hepatit kan vara anorexi, gulsot, mörk urin, klåda eller öm buk. Avbryt BIAXIN 500mg omedelbart om tecken och symtom på hepatit uppstår.
Allvarliga biverkningar på grund av samtidig användning med andra läkemedel
Läkemedel som metaboliseras av CYP3A4
Allvarliga biverkningar har rapporterats hos patienter som tar BIAXIN samtidigt med CYP3A4-substrat. Dessa inkluderar kolchicintoxicitet med kolchicin; rabdomyolys med simvastatin, lovastatin och atorvastatin; hypoglykemi och hjärtarytmier (t.ex. torsades de pointes) med disopyramid; hypotoni och akut njurskada med kalciumkanalblockerare som metaboliseras av CYP3A4 (t.ex. verapamil, amlodipin, diltiazem, nifedipin). De flesta rapporter om akut njurskada med kalciumkanalblockerare som metaboliseras av CYP3A4 involverade äldre patienter 65 år eller äldre. Använd BIAXIN 500mg med försiktighet när det administreras samtidigt med läkemedel som inducerar cytokrom CYP3A4-enzymet. Användning av BIAXIN 250mg med simvastatin, lovastatin, ergotamin eller dihydroergotamin är kontraindicerat [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ].
Kolchicin
Livshotande och dödliga läkemedelsinteraktioner har rapporterats hos patienter som behandlats med BIAXIN och kolchicin. Klaritromycin är en stark CYP3A4-hämmare och denna interaktion kan inträffa när båda läkemedlen används i rekommenderade doser. Om samtidig administrering av BIAXIN och kolkicin är nödvändig hos patienter med normal njur- och leverfunktion, minska dosen av kolkicin. Övervaka patienter för kliniska symtom på kolchicintoxicitet. Samtidig administrering av BIAXIN 500 mg och kolchicin är kontraindicerat hos patienter med nedsatt njur- eller leverfunktion [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ].
HMG-CoA-reduktashämmare (statiner)
Samtidig användning av BIAXIN och lovastatin eller simvastatin är kontraindicerat [se KONTRAINDIKATIONER eftersom dessa statiner i stor utsträckning metaboliseras av CYP3A4, och samtidig behandling med BIAXIN ökar deras plasmakoncentration, vilket ökar risken för myopati, inklusive rabdomyolys. Fall av rabdomyolys har rapporterats hos patienter som tar BIAXIN samtidigt med dessa statiner. Om behandling med BIAXIN inte kan undvikas, måste behandlingen med lovastatin eller simvastatin avbrytas under behandlingsförloppet.
Iaktta försiktighet när du förskriver BIAXIN 250mg med atorvastatin eller pravastatin. I situationer där samtidig användning av BIAXIN och atorvastatin eller pravastatin inte kan undvikas, bör atorvastatindosen inte överstiga 20 mg dagligen och pravastatindosen inte överstiga 40 mg dagligen. Användning av ett statin som inte är beroende av CYP3A-metabolism (t.ex. fluvastatin) kan övervägas. Det rekommenderas att förskriva den lägsta registrerade dosen om samtidig användning inte kan undvikas.
Orala hypoglykemiska medel/insulin
Samtidig användning av BIAXIN 500 mg och orala hypoglykemiska medel och/eller insulin kan resultera i betydande hypoglykemi. Med vissa hypoglykemiska läkemedel såsom nateglinid, pioglitazon, repaglinid och rosiglitazon, kan hämning av CYP3A-enzym av klaritromycin vara involverad och kan orsaka hypoglykemi vid samtidig användning. Noggrann övervakning av glukos rekommenderas [se LÄKEMEDELSINTERAKTIONER ].
Quetiapin
Använd quetiapin och klaritromycin samtidigt med försiktighet. Samtidig administrering kan resultera i ökad exponering för quetiapin och quetiapinrelaterade toxiciteter såsom somnolens, ortostatisk hypotoni, förändrat medvetandetillstånd, malignt neuroleptikasyndrom och QT-förlängning. Se förskrivningsinformation för quetiapin för rekommendationer om dosreduktion vid samtidig administrering med CYP3A4-hämmare såsom klaritromycin [se LÄKEMEDELSINTERAKTIONER ].
Orala antikoagulantia
Det finns en risk för allvarliga blödningar och signifikanta höjningar av INR och protrombintid när BIAXIN administreras samtidigt med warfarin. Övervaka INR- och protrombintider ofta medan patienter får BIAXIN och orala antikoagulantia samtidigt [se LÄKEMEDELSINTERAKTIONER ].
Bensodiazepiner
Ökad sedering och förlängning av sedering har rapporterats vid samtidig administrering av BIAXIN 250 mg och triazolobensodiazepiner, såsom triazolam och midazolam [se LÄKEMEDELSINTERAKTIONER ].
Dödlighet av alla orsaker hos patienter med kranskärlssjukdom 1 till 10 år efter exponering för BIAXIN
en klinisk prövning som utvärderade behandling med klaritromycin på utfall hos patienter med kranskärlssjukdom, observerades en ökning av risken för dödlighet av alla orsaker ett år eller mer efter avslutad behandling hos patienter som randomiserades att få klaritromycin.1 Klaritromycin för behandling av kranskärlssjukdomar. artärsjukdom är inte en godkänd indikation. Orsaken till den ökade risken har inte fastställts. Andra epidemiologiska studier som utvärderar denna risk har visat varierande resultat [se NEGATIVA REAKTIONER ]. Överväg att balansera denna potentiella risk med behandlingsfördelarna när du förskriver BIAXIN till patienter som har misstänkt eller bekräftat kranskärlssjukdom.
Clostridium Difficile associerad diarré
Clostridium difficile associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive BIAXIN, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibakteriell användning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibakteriell användning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibakteriell behandling av C. difficile och kirurgisk utvärdering bör inledas som kliniskt indicerat.
Embryofetal toxicitet
Klaritromycin ska inte användas till gravida kvinnor förutom under kliniska omständigheter där ingen alternativ behandling är lämplig. Om BIAXIN 500mg används under graviditet, eller om graviditet inträffar medan patienten tar detta läkemedel, bör patienten informeras om den potentiella faran för fostret. Klaritromycin har visat negativa effekter på graviditetsresultat och/eller embryo-fosterutveckling hos apor, råttor, möss och kaniner vid doser som producerade plasmanivåer 2 gånger till 17 gånger serumnivåerna som uppnåddes hos människor som behandlats med högsta rekommenderade humandoser [se Användning i specifika populationer ].
Exacerbation av Myasthenia Gravis
Förvärring av symtom på myasthenia gravis och nya symtom på myasteniskt syndrom har rapporterats hos patienter som får behandling med BIAXIN 250 mg.
Utveckling av läkemedelsresistenta bakterier
Att förskriva BIAXIN i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation är osannolikt att ge patienten fördel och ökar risken för utveckling av läkemedelsresistenta bakterier.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Följande mutagenitetstester in vitro har utförts med klaritromycin:
- Salmonella/däggdjursmikrosomtest
- Bakteriellt inducerad mutationsfrekvenstest
- In vitro kromosomavvikelsetest
- Råtthepatocyt-DNA-syntesanalys
- Muslymfomanalys
- Mus Dominant Lethal Study
- Mus Micronucleus Test
Alla tester hade negativa resultat förutom kromosomavvikelsetestet in vitro som var positivt i ett test och negativt i ett annat. Dessutom har ett bakteriellt omvänd mutationstest (Ames-test) utförts på klaritromycinmetaboliter med negativt resultat.
Nedsättning av fertilitet
Fertilitets- och reproduktionsstudier har visat att dagliga doser på upp till 160 mg/kg/ till han- och honråttor inte orsakade några negativa effekter på brunstcykeln, fertiliteten, förlossningen eller antalet och livsdugligheten hos avkomman. Plasmanivåerna hos råttor efter 150 mg/kg/dag var två gånger högre än humanserumnivåerna.
Testikelatrofi inträffade hos råttor vid doser 7 gånger, hos hundar vid doser 3 gånger och hos apor vid doser som var 8 gånger större än den maximala dagliga dosen för människor (på basis av kroppsyta).
Användning i specifika populationer
Graviditet
Teratogena effekter
Graviditetskategori C
Klaritromycin ska inte användas till gravida kvinnor förutom under kliniska omständigheter där ingen alternativ behandling är lämplig. Om graviditet inträffar medan du tar detta läkemedel, bör patienten informeras om den potentiella faran för fostret [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Fyra teratogenicitetsstudier på råttor (tre med orala doser och en med intravenösa doser upp till 160 mg/kg/dag administrerade under perioden med större organogenes) och två på kaniner vid orala doser upp till 125 mg/kg/dag (ungefär två gånger så mycket rekommenderad maximal humandos baserad på mg/m²) eller intravenösa doser på 30 mg/kg/dag administrerade under dräktighetsdagarna 6 till 18 visade inte någon teratogenicitet från klaritromycin. Ytterligare två orala studier på en annan råttstam vid liknande doser och liknande tillstånd visade en låg förekomst av kardiovaskulära anomalier vid doser på 150 mg/kg/dag administrerade under dräktighetsdagarna 6 till 15.
Plasmanivåerna efter 150 mg/kg/dag var två gånger högre än humanserumnivåerna. Fyra studier på möss avslöjade en varierande förekomst av gomspalt efter orala doser på 1000 mg/kg/dag (2 respektive 4 gånger den rekommenderade maximala humandosen baserat på mg/m²) under dräktighetsdagarna 6 till 15. Gomspalt var också ses vid 500 mg/kg/dag. Exponeringen på 1000 mg/kg/dag resulterade i plasmanivåer 17 gånger högre än humana serumnivåer. Hos apor gav en oral dos på 70 mg/kg/dag fostertillväxtfördröjning vid plasmanivåer som var två gånger högre än humana serumnivåer.
Ammande mödrar
Försiktighet bör iakttas när BIAXIN ges till ammande kvinnor. Utvecklingen och hälsofördelarna med utfodring av modersmjölk bör beaktas tillsammans med moderns kliniska behov av BIAXIN och eventuella negativa effekter på det modermjölksmatade barnet från läkemedlet eller från det underliggande moderns tillståndet.
Klaritromycin och dess aktiva metabolit 14-hydroxiklaritromycin utsöndras i modersmjölk. Serum- och mjölkprov erhölls efter 3 dagars behandling, vid steady state, från en publicerad studie av 12 ammande kvinnor som tog BIAXIN 250 mg oralt två gånger dagligen. Baserat på de begränsade data från denna studie, och om man antar en mjölkkonsumtion på 150 ml/kg/dag, skulle ett spädbarn som endast matas med modersmjölk få ett uppskattat genomsnitt på 136 mikrogram/kg/dag av klaritromycin och dess aktiva metabolit, med denna modersdos. regim. Detta är mindre än 2 % av moderns viktjusterade dos (7,8 mg/kg/dag, baserat på moderns genomsnittliga vikt på 64 kg), och mindre än 1 % av den pediatriska dosen (15 mg/kg/dag) för barn äldre än 6 månader.
En prospektiv observationsstudie av 55 ammade spädbarn till mödrar som tog ett makrolid antibakteriellt medel (6 exponerades för klaritromycin) jämfördes med 36 ammade spädbarn till mödrar som tog amoxicillin. Biverkningarna var jämförbara i båda grupperna. Biverkningar inträffade hos 12,7 % av spädbarn som exponerades för makrolider och inkluderade utslag, diarré, aptitlöshet och somnolens.
Pediatrisk användning
Säkerheten och effektiviteten av BIAXIN Filmtab och BIAXIN 500 mg granulat har fastställts för behandling av följande tillstånd eller sjukdomar hos pediatriska patienter 6 månader och äldre. Användning vid dessa indikationer är baserad på kliniska prövningar på pediatriska patienter eller adekvata och välkontrollerade studier på vuxna med ytterligare farmakokinetiska och säkerhetsdata hos pediatriska patienter:
- Faryngit/Tonsillit
- Samhällsförvärvad lunginflammation
- Akut maxillär bihåleinflammation
- Akut otitis media [se Kliniska studier ]
- Okomplicerade hud- och hudstrukturinfektioner
Säkerheten och effektiviteten av BIAXIN 500mg Filmtab och BIAXIN 500mg granulat har fastställts för att förebygga spridd Mycobacterium avium-komplex (MAC)-sjukdom hos pediatriska patienter 20 månader och äldre med avancerad HIV-infektion. Inga studier av BIAXIN för MAC-profylax har utförts i pediatriska populationer och doserna som rekommenderas för profylax är härledda från MAC-studier med pediatrisk behandling.
Säkerheten och effektiviteten av BIAXIN 500mg XL Filmtab vid behandling av pediatriska patienter har inte fastställts.
Säkerhet och effektivitet för BIAXIN 250 mg hos pediatriska patienter under 6 månaders ålder har inte fastställts. Säkerheten för BIAXIN 500 mg har inte studerats hos MAC-patienter under 20 månaders ålder.
Geriatrisk användning
en steady-state studie där friska äldre försökspersoner (65 år till 81 år) gavs 500 mg BIAXIN var 12:e timme, ökade de maximala serumkoncentrationerna och arean under kurvorna för klaritromycin och 14-OH klaritromycin jämfört med de som uppnås hos friska unga vuxna. Dessa förändringar i farmakokinetiken parallellt med kända åldersrelaterade minskningar av njurfunktionen. I kliniska prövningar hade äldre patienter inte en ökad förekomst av biverkningar jämfört med yngre patienter. Överväg dosjustering hos äldre patienter med gravt nedsatt njurfunktion. Äldre patienter kan vara mer mottagliga för utveckling av torsades de pointes arytmier än yngre patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
De flesta rapporter om akut njurskada med kalciumkanalblockerare som metaboliseras av CYP3A4 (t.ex. verapamil, amlodipin, diltiazem, nifedipin) involverade äldre patienter 65 år eller äldre [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Speciellt hos äldre patienter har det förekommit rapporter om kolchicintoxicitet vid samtidig användning av klaritromycin och kolchicin, av vilka en del inträffade hos patienter med njurinsufficiens. Dödsfall har rapporterats hos vissa patienter [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt njur- och leverfunktion
BIAXIN 500mg utsöndras huvudsakligen via levern och njurarna. BIAXIN kan administreras utan dosjustering till patienter med nedsatt leverfunktion och normal njurfunktion. I närvaro av gravt nedsatt njurfunktion med eller utan samexisterande nedsatt leverfunktion kan dock minskad dos eller förlängda doseringsintervall vara lämpliga [se DOSERING OCH ADMINISTRERING ].
REFERENSER
1. Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et al. Klaritromycin för stabil kranskärlssjukdom ökar kardiovaskulär mortalitet av alla orsaker och cerebrovaskulär morbiditet under 10 år i den randomiserade, blinda kliniska prövningen av CLARICOR. Int J Cardiol 2015;182:459-65.
ÖVERDOS
Överdosering av BIAXIN kan orsaka gastrointestinala symtom som buksmärtor, kräkningar, illamående och diarré.
Behandla biverkningar som åtföljer överdosering genom omedelbar eliminering av oabsorberat läkemedel och stödjande åtgärder. Som med andra makrolider förväntas BIAXIN-serumkoncentrationerna inte påverkas nämnvärt av hemodialys eller peritonealdialys.
KONTRAINDIKATIONER
Överkänslighet
BIAXIN är kontraindicerat hos patienter med känd överkänslighet mot klaritromycin, erytromycin eller något av de antibakteriella makrolidläkemedlen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hjärtarytmier
Samtidig administrering av BIAXIN med cisaprid och pimozid är kontraindicerat [se LÄKEMEDELSINTERAKTIONER ].
Det har förekommit rapporter om läkemedelsinteraktioner efter marknadsföringen när klaritromycin administreras samtidigt med cisaprid eller pimozid, vilket leder till hjärtarytmier (QT-förlängning, ventrikulär takykardi, ventrikelflimmer och torsades de pointes), troligen på grund av hämning av dessa läkemedels metabolism av BIAXIN . Dödsfall har rapporterats.
Kolestatisk gulsot/leverdysfunktion
BIAXIN är kontraindicerat hos patienter med en historia av kolestatisk gulsot eller leverdysfunktion i samband med tidigare användning av klaritromycin.
Kolchicin
Samtidig administrering av BIAXIN och kolchicin är kontraindicerat hos patienter med nedsatt njur- eller leverfunktion.
HMG-CoA-reduktashämmare
Använd inte BIAXIN samtidigt med HMG-CoA-reduktashämmare (statiner) som i stor utsträckning metaboliseras av CYP3A4 (lovastatin eller simvastatin), på grund av den ökade risken för myopati, inklusive rabdomyolys [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ].
Ergotalkaloider
Samtidig administrering av klaritromycin och ergotamin eller dihydroergotamin är kontraindicerat [se LÄKEMEDELSINTERAKTIONER ].
Kontraindikationer för samtidigt administrerade läkemedel
För information om kontraindikationer för andra läkemedel indikerade i kombination med BIAXIN, se deras fullständiga förskrivningsinformation (avsnittet kontraindikationer).
KLINISK FARMAKOLOGI
Handlingsmekanism
Klaritromycin är ett makrolid antimikrobiellt läkemedel [se Mikrobiologi ].
Farmakokinetik
Absorption
BIAXIN 250mg Filmtab Tabletter med omedelbar frisättning
Den absoluta biotillgängligheten för 250 mg klaritromycintabletter var cirka 50 %. För en engångsdos på 500 mg klaritromycin fördröjer maten uppkomsten av klaritromycin något, vilket ökar topptiden från cirka 2 till 2,5 timmar. Mat ökar också klaritromycinets maximala plasmakoncentration med cirka 24 %, men påverkar inte graden av klaritromycins biotillgänglighet. Mat påverkar inte uppkomsten av bildningen av den aktiva metaboliten, 14-OH-klaritromycin eller dess maximala plasmakoncentration, men minskar något omfattningen av metabolitbildningen, vilket indikeras av en minskning med 11 % av arean under plasmakoncentration-tidkurvan (AUC). . Därför kan BIAXIN Filmtab ges utan hänsyn till mat. Hos icke-fastande friska försökspersoner (män och kvinnor) uppnåddes maximala plasmakoncentrationer inom 2 till 3 timmar efter oral dosering.
BIAXIN 500mg XL Filmtab tabletter med förlängd frisättning
Klaritromycin-tabletter med förlängd frisättning ger utökad absorption av klaritromycin från mag-tarmkanalen efter oral administrering. I förhållande till en lika stor total daglig dos av klaritromycin-tabletter med omedelbar frisättning ger klaritromycin-tabletter med förlängd frisättning lägre och senare steady-state toppplasmakoncentrationer men motsvarande 24-timmars AUC för både klaritromycin och dess mikrobiologiskt aktiva metabolit, 14-OH klaritromycin. Även om graden av bildning av 14-OH klaritromycin efter administrering av BIAXIN 500 mg XL Filmtab (2 x 500 mg tabletter en gång dagligen) inte påverkas av mat, är administrering under fastande associerad med cirka 30 % lägre AUC för klaritromycin jämfört med administrering med mat . Därför ska BIAXIN 250mg XL Filmtab tas med mat.
Figur 2: Steady-State Clarithromycin Plasma Concentration-Time Profiler 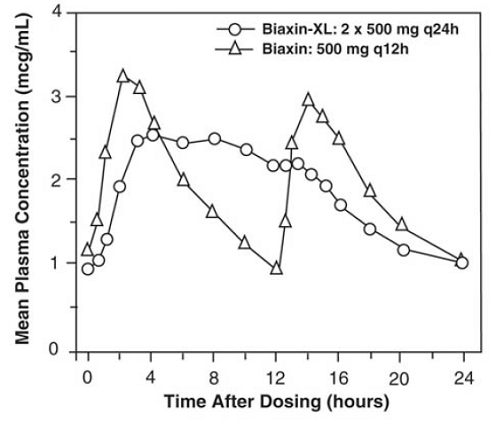
BIAXIN granulat för oral suspension
När 250 mg doser av klaritromycin som BIAXIN som oral suspension administrerades till fastande friska vuxna försökspersoner, uppnåddes maximala plasmakoncentrationer cirka 3 timmar efter dosering.
För vuxna patienter liknar biotillgängligheten för 10 ml av 125 mg/5 ml suspensionen eller 10 ml av 250 mg/5 ml suspensionen en 250 mg respektive 500 mg tablett.
Hos vuxna som fick 250 mg klaritromycin som suspension (n = 22) verkade föda minska den genomsnittliga maximala plasmakoncentrationen av klaritromycin från 1,2 (± 0,4) mcg/mL till 1,0 (± 0,4) mcg/mL och absorptionsgraden från 7,2 (± 0,4) 2,5) hr•mcg/ml till 6,5 (± 3,7) hr•mcg/ml.
Distribution
Klaritromycin och 14-OH-klaritromycinmetaboliten distribueras lätt till kroppsvävnader och vätskor. Det finns inga tillgängliga data om penetration av cerebrospinalvätska. På grund av höga intracellulära koncentrationer är vävnadskoncentrationerna högre än serumkoncentrationerna. Exempel på vävnads- och serumkoncentrationer presenteras nedan.
Metabolism och eliminering
BIAXIN 500mg Filmtab Tabletter med omedelbar frisättning
Steady-state maximala plasmaklaritromycinkoncentrationer uppnåddes inom 3 dagar och var cirka 1 mcg/ml till 2 mcg/ml med en 250 mg dos administrerad var 12:e timme och 3 mcg/ml till 4 mcg/ml med en 500 mg dos administrerad varje gång 8 timmar till 12 timmar. Elimineringshalveringstiden för klaritromycin var cirka 3 timmar till 4 timmar med 250 mg administrerat var 12:e timme men ökade till 5 timmar till 7 timmar med 500 mg administrerat var 8:e timme till 12 timmar. Icke-linjäriteten hos klaritromycins farmakokinetik är liten vid de rekommenderade doserna på 250 mg och 500 mg administrerade var 8:e timme till 12:e timme. Med en dosering på 250 mg var 12:e timme uppnår huvudmetaboliten, 14-OH-klaritromycin, en maximal steady-state-koncentration på cirka 0,6 mcg/ml och har en eliminationshalveringstid på 5 timmar till 6 timmar. Med en dosering på 500 mg var 8:e timme till 12 timmar är den maximala steady-state-koncentrationen av 14-OH klaritromycin något högre (upp till 1 mcg/ml), och dess eliminationshalveringstid är cirka 7 timmar till 9 timmar. Med någon av dessa doseringsregimer uppnås steady-state-koncentrationen av denna metabolit vanligtvis inom 3 dagar till 4 dagar.
Efter en 250 mg tablett var 12:e timme utsöndras cirka 20 % av dosen i urinen som klaritromycin, medan efter en 500 mg tablett var 12:e timme är urinutsöndringen av klaritromycin något större, cirka 30 %. Som jämförelse, efter en oral dos på 250 mg (125 mg/5 ml) suspension var 12:e timme, utsöndras cirka 40 % i urinen som klaritromycin. Det renala clearance av klaritromycin är dock relativt oberoende av dosstorleken och närmar sig den normala glomerulära filtrationshastigheten. Den huvudsakliga metaboliten som finns i urin är 14-OH klaritromycin, som står för ytterligare 10 % till 15 % av dosen med antingen en 250 mg eller en 500 mg tablett administrerad var 12:e timme.
BIAXIN 250mg XL Filmtab tabletter med förlängd frisättning
Hos friska försökspersoner uppnåddes steady-state maximala plasmakoncentrationer av klaritromycin på cirka 2 mcg/ml till 3 mcg/ml cirka 5 timmar till 8 timmar efter oral administrering av 1000 mg BIAXIN 250 mg XL Filmtab en gång dagligen; för 14-OH klaritromycin uppnåddes steady-state toppplasmakoncentrationer på cirka 0,8 mcg/ml cirka 6 timmar till 9 timmar efter dosering. Steady-state maximala plasmakoncentrationer av klaritromycin på cirka 1 mcg/ml till 2 mcg/ml uppnåddes cirka 5 timmar till 6 timmar efter oral administrering av en enda 500 mg BIAXIN XL Filmtab en gång dagligen; för 14-OH klaritromycin uppnåddes steady-state toppplasmakoncentrationer på cirka 0,6 mcg/ml cirka 6 timmar efter dosering.
Steady-state toppplasmakoncentrationer uppnåddes på 2 dagar till 3 dagar och var cirka 2 mcg/ml för klaritromycin och 0,7 mcg/ml för 14-OH klaritromycin när 250 mg doser av klaritromycinsuspensionen administrerades var 12:e timme. Eliminationshalveringstiden för klaritromycin (3 timmar till 4 timmar) och den för 14-OH klaritromycin (5 timmar till 7 timmar) liknade de som observerades vid steady state efter administrering av ekvivalenta doser av BIAXIN Filmtab.
Specifika populationer för BIAXIN Filmtab, BIAXIN 500mg XL Filmtab och BIAXIN 250mg granulatformuleringar
BIAXIN granulat för oral suspension hos pediatriska patienter
Klaritromycin tränger in i mellanörat hos pediatriska patienter med sekretorisk otitis media.
När pediatriska patienter (n = 10) administrerades en oral engångsdos på 7,5 mg/kg BIAXIN 500 mg som oral suspension, ökade maten den genomsnittliga maximala plasmakoncentrationen av klaritromycin från 3,6 (± 1,5) mcg/ml till 4,6 (± 2,8) mcg/ ml och graden av absorption från 10,0 (± 5,5) hr•mcg/ml till 14,2 (± 9,4) hr•mcg/ml.
Hos pediatriska patienter som behöver antibakteriell behandling, resulterade administrering av 7,5 mg/kg var 12:e timme av BIAXIN som oral suspension i allmänhet i steady-state maximala plasmakoncentrationer på 3 mcg/ml till 7 mcg/ml för klaritromycin och 1 mcg/ml till 2 mcg/ml för 14-OH klaritromycin.
Hos HIV-infekterade pediatriska patienter som tog 15 mg/kg BIAXIN som oral suspension var 12:e timme, varierade steady-state toppkoncentrationer av klaritromycin i allmänhet från 6 mcg/ml till 15 mcg/ml.
HIV-infektion
Steady-state-koncentrationer av klaritromycin och 14-OH-klaritromycin som observerades efter administrering av 500 mg doser av klaritromycin var 12:e timme till vuxna patienter med HIV-infektion liknade de som observerades hos friska frivilliga. Hos vuxna HIV-infekterade patienter som tog 500 mg eller 1000 mg doser av klaritromycin var 12:e timme varierade Cmax-värdena vid steady-state klaritromycin från 2 mcg/ml till 4 mcg/ml respektive 5 mcg/ml till 10 mcg/ml. .
Nedsatt leverfunktion
Steady-state-koncentrationerna av klaritromycin hos patienter med nedsatt leverfunktion skilde sig inte från dem hos normala försökspersoner; emellertid var koncentrationerna av 14-OH-klaritromycin lägre hos patienter med nedsatt leverfunktion. Den minskade bildningen av 14-OH-klaritromycin kompenserades åtminstone delvis av en ökning av renalt clearance av klaritromycin hos patienter med nedsatt leverfunktion jämfört med friska försökspersoner.
Nedsatt njurfunktion
Klaritromycins farmakokinetik förändrades också hos personer med nedsatt njurfunktion [se Användning i specifika populationer och DOSERING OCH ADMINISTRERING ].
Läkemedelsinteraktioner
Flukonazol
Efter administrering av flukonazol 200 mg dagligen och klaritromycin 500 mg två gånger dagligen till 21 friska frivilliga, ökade Cmin och AUC för klaritromycin vid steady-state med 33 % respektive 18 %. Klaritromycinexponeringen ökade och steady-state-koncentrationer av 14-OH klaritromycin påverkades inte signifikant av samtidig administrering av flukonazol.
Kolchicin
När en engångsdos av kolkicin 0,6 mg administrerades med klaritromycin 250 mg två gånger dagligen i 7 dagar, ökade kolchicinets Cmax 197 % och AUC0-∞ ökade med 239 % jämfört med administrering av enbart kolchicin.
Atazanavir
Efter administrering av klaritromycin (500 mg två gånger dagligen) med atazanavir (400 mg en gång dagligen), ökade AUC för klaritromycin med 94 %, 14-OH-klaritromycin AUC minskade med 70 % och AUC för atazanavir ökade med 28 %.
Ritonavir
Samtidig administrering av klaritromycin och ritonavir (n = 22) resulterade i en 77 % ökning av AUC för klaritromycin och en 100 % minskning av AUC för 14-OH klaritromycin.
Saquinavir
Efter administrering av klaritromycin (500 mg två gånger dagligen) och saquinavir (mjuka gelatinkapslar, 1200 mg tid) till 12 friska frivilliga, ökade steady-state AUC och Cmax för saquinavir med 177 % respektive 187 % jämfört med administrering av enbart saquinavir. Klaritromycins AUC och Cmax ökade med 45 % respektive 39 %, medan 14–OH klaritromycin AUC och Cmax minskade med 24 % respektive 34 %, jämfört med administrering med enbart klaritromycin.
Didanosin
Samtidig administrering av klaritromycintabletter och didanosin till 12 HIV-infekterade vuxna patienter resulterade inte i någon statistiskt signifikant förändring av didanosin farmakokinetik.
Zidovudin
Efter administrering av klaritromycin 500 mg tabletter två gånger dagligen med zidovudin 100 mg var 4:e timme, minskade steady-state AUC för zidovudin med 12 % jämfört med administrering av enbart zidovudin (n=4). Individuella värden varierade från en minskning med 34 % till en ökning med 14 %. När klaritromycintabletter administrerades två till fyra timmar före zidovudin, ökade steady-state zidovudin Cmax med 100 % medan AUC var opåverkad (n=24).
Omeprazol
Klaritromycin 500 mg var 8:e timme gavs i kombination med omeprazol 40 mg dagligen till friska vuxna försökspersoner. Steady-state plasmakoncentrationerna av omeprazol ökade (Cmax, AUC0-24 och t½ ökningar med 30 %, 89 % respektive 34 %) vid samtidig administrering av klaritromycin.
Plasmanivåerna av klaritromycin och 14–OH klaritromycin ökade vid samtidig administrering av omeprazol. För klaritromycin var medel-Cmax 10% högre, medel-Cmin var 27% högre och medel-AUC0-8 var 15% högre när klaritromycin administrerades med omeprazol än när klaritromycin administrerades ensamt. Liknande resultat sågs för 14–OH-klaritromycin, medel-Cmax var 45 % högre, medel-Cmin var 57 % högre och medel-AUC0-8 var 45 % högre. Klaritromycinkoncentrationerna i magvävnaden och slemmet ökade också vid samtidig administrering av omeprazol.
Klaritromycinvävnadskoncentrationer 2 timmar efter dos (mcg/ml)/(mcg/g)
Teofyllin
två studier där teofyllin administrerades tillsammans med klaritromycin (en teofyllinformulering med fördröjd frisättning doserades antingen 6,5 mg/kg eller 12 mg/kg tillsammans med 250 eller 500 mg klaritromycin varje 12 timmar), steady-state-nivåerna av Cmax, Cmin, och arean under serumkoncentrationstidskurvan (AUC) för teofyllin ökade med cirka 20 %.
Midazolam
När en engångsdos av midazolam administrerades samtidigt med klaritromycintabletter (500 mg två gånger dagligen i 7 dagar), ökade AUC för midazolam med 174 % efter intravenös administrering av midazolam och 600 % efter oral administrering.
För information om andra läkemedel indikerade i kombination med BIAXIN, se deras fullständiga förskrivningsinformation, KLINISK FARMAKOLOGI sektion.
Mikrobiologi
Handlingsmekanism
Klaritromycin utövar sin antibakteriella verkan genom att binda till den 50S ribosomala subenheten av känsliga bakterier, vilket resulterar i hämning av proteinsyntesen.
Motstånd
De huvudsakliga resistensvägarna är modifiering av 23S rRNA i den 50S ribosomala subenheten mot okänslighets- eller läkemedelsutflödespumpar. Beta-laktamasproduktion bör inte ha någon effekt på klaritromycinaktivitet.
De flesta isolat av meticillinresistenta och oxacillinresistenta stafylokocker är resistenta mot klaritromycin.
Om H. pylori inte utrotas efter behandling med klaritromycin-innehållande kombinationsregimer, kan patienter utveckla klaritromycinresistens i H. pylori-isolat. Därför, för patienter som misslyckas med behandlingen, bör klaritromycinkänslighetstest göras om möjligt. Patienter med klaritromycinresistent H. pylori bör inte behandlas med något av följande: omeprazol/klaritromycin dubbelbehandling; omeprazol/klaritromycin/amoxicillin trippelterapi; trippelbehandling med lansoprazol/klaritromycin/amoxicillin; eller andra kurer som inkluderar klaritromycin som det enda antibakteriella medlet.
Antimikrobiell aktivitet
Klaritromycin har visat sig vara aktivt mot de flesta isolaten av följande mikroorganismer både in vitro och vid kliniska infektioner [se INDIKATIONER OCH ANVÄNDNING ].
Gram-positiva bakterier
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogenes
Gram-negativa bakterier
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Andra mikroorganismer
- Chlamydophila pneumoniae
- Helicobacter pylori
- Mycobacterium avium-komplex (MAC) bestående av M. avium och M. intracellulare
- Mycoplasma pneumoniae
Minst 90 procent av mikroorganismerna som listas nedan uppvisar in vitro minimiinhibitoriska koncentrationer (MIC) som är mindre än eller lika med den klaritromycinkänsliga MIC-brytpunkten för organismer av liknande typ som de som visas i Tabell 11. Klaritromycins effektivitet vid behandling av kliniska infektioner på grund av dessa mikroorganismer har inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Gram-positiva bakterier
- Streptococcus agalactiae
- Streptokocker (Grupper C, F, G)
- Viridans grupp streptokocker
Gram-negativa bakterier
- Legionella pneumophila
- Pasteurella multocida
Anaeroba bakterier
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder erkända av FDA för detta läkemedel, se: http://www.fda.gov/STIC.
Djurtoxikologi och/eller farmakologi
Corneal opacitet uppträdde hos hundar vid doser 12 gånger och hos apor vid doser som var 8 gånger större än den maximala humana dagliga dosen (på basis av kroppsyta). Lymfoidutarmning inträffade hos hundar vid doser 3 gånger större än och hos apor vid doser 2 gånger större än den maximala humana dagliga dosen (på basis av kroppsyta).
Kliniska studier
Mykobakteriella infektioner
Profylax av mykobakteriella infektioner
En randomiserad, dubbelblind klinisk studie (studie 3) jämförde klaritromycin 500 mg två gånger dagligen med placebo hos patienter med CDC-definierad AIDS och CD4-antal mindre än 100 celler/μL. Denna studie samlade 682 patienter från november 1992 till januari 1994, med ett medianantal av CD4-celler vid inträde på 30 celler/mcL. Mediandurationen för BIAXIN 500 mg var 10,6 månader jämfört med 8,2 månader för placebo. Fler patienter i placeboarmen än BIAXIN-armen avbröt behandlingen i förtid från studien (75,6 % respektive 67,4 %). Om förtida utsättningar på grund av Mycobacterium avium-komplex (MAC) eller död utesluts, avbröt dock ungefär lika andel patienter i varje arm (54,8 %) på BIAXIN och 52,5 % på placebo studieläkemedlet tidigt av andra skäl. Försöket utformades för att utvärdera följande effektmått:
MAC bakteriemi
Hos patienter randomiserade till BIAXIN minskade risken för MAC-bakteremi med 69 % jämfört med placebo. Skillnaden mellan grupperna var statistiskt signifikant (p
Överlevnad
En statistiskt signifikant överlevnadsfördel med BIAXIN jämfört med placebo observerades (se figur 3 och tabell 13). Eftersom analysen vid 18 månader inkluderar patienter som inte längre får profylax kan överlevnadsvinsten av BIAXIN 250 mg underskattas.
Figur 3: Överlevnad av alla randomiserade AIDS-patienter över tid i försök 3 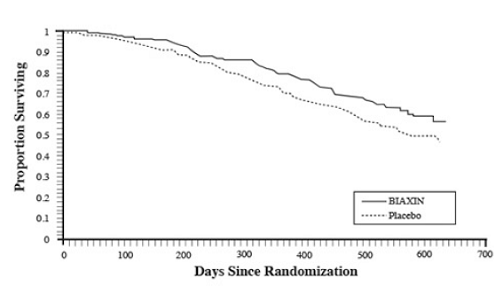
Kliniskt signifikant spridd MAC-sjukdom
I samband med den minskade incidensen av MAC-bakteremi visade patienter i gruppen som randomiserades till BIAXIN minskningar i tecken och symtom på spridd MAC-sjukdom, inklusive feber, nattliga svettningar, viktminskning och anemi.
Behandling av mykobakteriella infektioner
Dosvarierande monoterapiförsök hos vuxna AIDS-patienter med MAC
Två randomiserade kliniska studier (försök 1 och 2) jämförde olika doser av BIAXIN hos patienter med CDC-definierad AIDS och CD4-antal mindre än 100 celler/mcL. Dessa studier samlade patienter från maj 1991 till mars 1992. Försök 500 var en randomiserad, dubbelblind studie; prövning 577 var en öppen prövning med compassionate use. Båda försöken använde 500 mg och 1000 mg två gånger dagligen av BIAXIN; försök 1 hade också en BIAXIN 500 mg-grupp på 2000 mg två gånger dagligen. Försök 1 inkluderade 154 vuxna patienter och försök 2 inkluderade 469 vuxna patienter. Majoriteten av patienterna hade CD4-cellantal mindre än 50 celler/mcL vid studiestart. Försöken utformades för att utvärdera följande slutpunkter:
Resultaten för försök 1 beskrivs nedan. Resultaten av försök 2 liknade resultaten från försök 1.
MAC bakteriemi
Minskning av MAC-bakteremi eller negativa blododlingar sågs hos majoriteten av patienterna i alla BIAXIN 500 mg-dosgrupper. Den genomsnittliga minskningen av MAC-kolonibildande enheter (CFU) från baslinjen efter 4 veckors behandling i 1000 mg (n=32) två gånger dagligen och 2000 mg (n=26) två gånger dagligen var 2,3 Log CFU jämfört med 1,5 Log CFU i BIAXIN 500 mg två gånger dagligen (n=35). En separat prövning med en regim med fyra läkemedel2 (ciprofloxacin, etambutol, rifampicin och klofazimin) hade en genomsnittlig minskning på 1,4 log CFU.
Kliniska resultat utvärderade med de olika doseringsregimerna av klaritromycinmonoterapi visas i Tabell 14. Doserna på 1000 mg och 2000 mg två gånger dagligen visade signifikant bättre kontroll av bakteriemi under de första fyra veckorna av behandlingen. Inga signifikanta skillnader sågs utöver den punkten. Alla isolaten hade MIC mindre än 8 mcg/ml vid förbehandling. Återfall åtföljdes nästan alltid av en ökning av MIC.
Kliniskt signifikant spridd MAC-sjukdom
Bland patienter som upplevde nattliga svettningar före behandlingen visade 84 % upplösning eller förbättring någon gång under de 12 veckorna av BIAXIN vid doser på 500 mg till 2000 mg två gånger dagligen. På samma sätt rapporterade 77 % av patienterna att febern upphör eller förbättrades någon gång. Svarsfrekvenser för kliniska tecken på MAC anges i Tabell 15 nedan.
Mediansvartiden, definierad som förbättring eller upplösning av kliniska tecken och symtom, var 2 veckor till 6 veckor.
Eftersom studien inte var utformad för att fastställa nyttan av monoterapi efter 12 veckor, kan varaktigheten av svaret vara underskattad för de 25 % till 33 % av patienterna som fortsatte att visa kliniskt svar efter 12 veckor.
Överlevnad
Medianöverlevnadstiden från inträde i försöket (försök 1) var 249 dagar vid dosen 500 mg två gånger dagligen jämfört med 215 dagar med dosen 1000 mg två gånger dagligen. Under de första 12 veckorna av behandlingen inträffade dock 2 dödsfall hos 53 patienter i gruppen 500 mg två gånger dagligen jämfört med 13 dödsfall hos 51 patienter i gruppen med 1000 mg två gånger dagligen. Orsaken till denna skenbara dödlighetsskillnad är inte känd. Överlevnaden i de två grupperna var liknande efter 12 veckor. Medianöverlevnadstiderna för dessa doser liknade de senaste historiska kontrollerna med MAC när de behandlades med kombinationsterapier.2
Medianöverlevnadstiden från inträde i försök 2 var 199 dagar för dosen 500 mg två gånger om dagen och 179 dagar för dosen på 1000 mg två gånger dagligen. Under de första fyra veckorna av behandlingen, medan patienterna hölls på sin ursprungligen tilldelade dos, var det 11 dödsfall hos 255 patienter som tog 500 mg två gånger dagligen och 18 dödsfall hos 214 patienter som tog 1000 mg två gånger dagligen.
Dosvarierande monoterapiförsök hos pediatriska AIDS-patienter med MAC
Studie 4 var en pediatrisk studie på 3,75 mg/kg, 7,5 mg/kg och 15 mg/kg BIAXIN två gånger dagligen på patienter med CDC-definierad AIDS och CD4-antal mindre än 100 celler/mcL. Studien inkluderade 25 patienter i åldrarna 1 till 20. Studien utvärderade samma effektmått som i vuxenstudierna 1 och 2. Resultaten med dosen 7,5 mg/kg två gånger dagligen i den pediatriska studien var jämförbara med de för 500 mg två gånger dagligen i vuxenstudierna.
Kombinationsterapi hos AIDS-patienter med spridd MAC
Studie 5 jämförde säkerheten och effekten av BIAXIN 250 mg i kombination med etambutol mot BIAXIN 250 mg i kombination med etambutol och klofazimin för behandling av spridd MAC (dMAC)-infektion. Denna 24-veckors studie inkluderade 106 patienter med AIDS och dMAC, med 55 patienter randomiserade att få BIAXIN 500mg och etambutol, och 51 patienter randomiserade att få klaritromycin, etambutol och klofazim. Baslinjeegenskaperna mellan behandlingsarmarna var likartade med undantag för att medianvärdet för CFU var minst 1 log högre i BIAXIN 500 mg, etambutol och klofazim-armen.
Jämfört med tidigare erfarenhet av klaritromycinmonoterapi förlängde tvåläkemedelsregimen klaritromycin och etambutol tiden till mikrobiologiskt återfall, till stor del genom att undertrycka uppkomsten av klaritromycinresistenta stammar. Men tillägget av klofazimin till kuren gav ingen ytterligare mikrobiologiska eller kliniska fördelar. Tolerabiliteten för båda multidrug-regimerna var jämförbar med de vanligaste biverkningarna av gastrointestinal natur. Patienter som fick den klofazimin-innehållande behandlingen hade minskad överlevnadsfrekvens; deras baseline-antal av mykobakteriella kolonier var dock högre. Resultaten av denna studie stöder tillägget av etambutol till klaritromycin för behandling av initiala dMAC-infektioner men stöder inte tillsats av klofazimin som ett tredje medel.
Otitis media
Öroninflammation Försök av BIAXIN vs oralt cefalosporin
en kontrollerad klinisk prövning av pediatriska patienter med akut otitis media utförd i USA, där betydande frekvenser av betalaktamasproducerande organismer hittades, jämfördes BIAXIN 500 mg med ett oralt cefalosporin. I denna studie användes strikta utvärderingskriterier för att bestämma kliniskt svar. För de 223 patienter som utvärderades för klinisk effekt var den kliniska framgångsfrekvensen (dvs bot plus förbättring) vid besöket efter behandling 88 % för BIAXIN 500 mg och 91 % för cefalosporin.
Hos ett mindre antal patienter gjordes mikrobiologiska bestämningar vid förbehandlingsbesöket. De presumtiva bakterieutrotningen/kliniska boteresultaten (dvs klinisk framgång) visas i Tabell 16.
Otitis Media-försök av BIAXIN vs. antimikrobiell/beta-laktamasinhibitor
två andra kontrollerade kliniska prövningar av akut otitis media utförda i USA, där betydande andelar av betalaktamasproducerande organismer hittades, jämfördes BIAXIN med ett oralt antimikrobiellt medel som innehöll en specifik betalaktamashämmare. I dessa försök användes strikta utvärderingskriterier för att bestämma de kliniska svaren. Hos de 233 patienter som utvärderades med avseende på klinisk effekt var den kombinerade kliniska framgångsfrekvensen (dvs bot och förbättring) vid besöket efter behandling 91 % för både BIAXIN 500 mg och kontrollen.
För de patienter som hade mikrobiologiska bestämningar vid förbehandlingsbesöket visas de presumtiva bakteriell utrotning/klinisk botemedelsresultat (dvs klinisk framgång) i tabell 17.
Utrotning av H. pylori för att minska risken för återfall av duodenalsår
BIAXIN + Lansoprazol och Amoxicillin
Två randomiserade, dubbelblinda kliniska studier i USA (studie 6 och studie 7) på patienter med H. pylori och duodenalsår (definierad som ett aktivt sår eller historia av ett aktivt sår inom ett år) utvärderade effekten av BIAXIN 500 mg två gånger dagligen i kombination med lansoprazol 30 mg två gånger dagligen och amoxicillin 1 g två gånger dagligen som 14-dagars trippelbehandling för utrotning av H. pylori.
H. pylori-utrotning definierades som två negativa tester (odling och histologi) 4 veckor till 6 veckor efter avslutad behandling.
Kombinationen av BIAXIN plus lansoprazol och amoxicillin som trippelterapi var effektiv vid utrotning av H. pylori (se resultat i tabell 18). Utrotning av H. pylori har visat sig minska risken för återfall av duodenalsår.
En randomiserad, dubbelblind klinisk studie (studie 8) utförd i USA på patienter med H. pylori och duodenalsårsjukdom (definierad som ett aktivt sår eller historia av ett sår inom ett år) jämförde effekten av BIAXIN 250 mg i kombination med lansoprazol och amoxicillin som trippelbehandling i 10 dagar och 14 dagar. Detta försök fastställde att 10-dagars trippelterapi var ekvivalent med 14-dagars trippelterapi för att utrota H. pylori (se resultat i tabell 18).
BIAXIN + Omeprazol och Amoxicillinterapi
Tre amerikanska, randomiserade, dubbelblinda kliniska studier på patienter med H. pylori-infektion och duodenalsårsjukdom (n = 558) jämförde BIAXIN plus omeprazol och amoxicillin med BIAXIN 250 mg plus amoxicillin. Två studier (försök 9 och 10) utfördes på patienter med aktivt duodenalsår, och den tredje studien (försök 11) utfördes på patienter med sår på tolvfingertarmen under de senaste 5 åren, men utan ett sår vid tidpunkten för inskrivningen . Dosregimen i försöken var BIAXIN 500 mg två gånger om dagen plus omeprazol 20 mg två gånger om dagen plus amoxicillin 1 gram två gånger om dagen i 10 dagar. I försök 9 och 10 fick patienter som tog omeprazolkuren också ytterligare 18 dagar med omeprazol 20 mg en gång om dagen. Slutpunkter som studerades var utrotning av H. pylori och läkning av duodenalsår (endast försök 9 och 10). H. pylori-status bestämdes av CLOtest®, histologi och odling i alla tre försöken. För en given patient ansågs H. pylori vara utrotad om minst två av dessa tester var negativa och ingen var positiv. Kombinationen av BIAXIN plus omeprazol och amoxicillin var effektiv för att utrota H. pylori (se resultat i tabell 19).
BIAXIN + Omeprazol Terapi
Fyra randomiserade, dubbelblinda multicenterstudier (försök 12, 13, 14 och 15) utvärderade BIAXIN 500 mg tre gånger om dagen plus omeprazol 40 mg en gång om dagen i 14 dagar, följt av omeprazol 20 mg en gång om dagen ( försök 12, 13 och 15) eller med omeprazol 40 mg en gång om dagen (försök 14) i ytterligare 14 dagar hos patienter med aktivt duodenalsår associerat med H. pylori. Försök 12 och 13 genomfördes i USA och Kanada och inkluderade 242 respektive 256 patienter. H. pylori-infektion och duodenalsår bekräftades hos 219 patienter i försök 12 och 228 patienter i försök 13. Dessa studier jämförde kombinationsregimen med omeprazol- och BIAXIN-monoterapier. Försök 14 och 15 genomfördes i Europa och inkluderade 154 respektive 215 patienter. H. pylori-infektion och duodenalsår bekräftades hos 148 patienter i försök 14 och 208 patienter i försök 15. Dessa studier jämförde kombinationsregimen med monoterapi med omeprazol. Resultaten för effektivitetsanalyserna för dessa prövningar beskrivs i tabellerna 20, 21 och 22.
Duodenalsår läkning
Kombinationen av BIAXIN 250 mg och omeprazol var lika effektiv som omeprazol enbart för att läka duodenalsår (se tabell 20).
Utrotning av H. pylori associerad med duodenalsår
Kombinationen av BIAXIN 500 mg och omeprazol var effektiv för att utrota H. pylori (se tabell 21). H. pylori-utrotning definierades som inget positivt test (odling eller histologi) 4 veckor efter avslutad behandling, och två negativa test krävdes för att anses vara utrotade. I analysen per protokoll exkluderades följande patienter: avhopp, patienter med allvarliga protokollöverträdelser, patienter med saknade H. pylori-tester efter behandlingen och patienter som inte bedömdes för utrotning av H. pylori vid 4 veckor efter slutet av behandling eftersom de visade sig ha ett oläkt sår i slutet av behandlingen.
Duodenalsår återfall
Återkommande sår vid 6 månader och 12 månader efter avslutad behandling utvärderades för patienter hos vilka sår läkt efter behandling (se resultaten i tabell 22). Hos patienter med duodenalsår associerat med H. pylori-infektion minskade således utrotning av H. pylori återfall av sår.
REFERENSER
2. Kemper CA, et al. Behandling av Mycobacterium avium Complex Bacteremia i AIDS med en oral regim med fyra läkemedel. Ann Intern Med. 1992;116:466-472.
PATIENTINFORMATION
Ge följande instruktioner eller information om BIAXIN 250mg till patienter:
- Informera patienterna om att antibakteriella läkemedel inklusive BIAXIN (klaritromycin) endast ska användas för att behandla bakteriella infektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När BIAXIN 250mg ordineras för att behandla en bakteriell infektion, bör patienterna få veta att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med BIAXIN 250mg eller andra antibakteriella läkemedel i framtiden.
- Informera patienter om att diarré är ett vanligt problem som orsakas av antibakteriella medel inklusive BIAXIN (klaritromycin) som vanligtvis upphör när det antibakteriella medlet avbryts. Ibland kan patienter efter påbörjad behandling med antibakteriella medel utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av det antibakteriella medlet. Om detta inträffar, instruera patienterna att kontakta sin vårdgivare så snart som möjligt.
- Informera patienter om att BIAXIN (klaritromycin) kan interagera med vissa läkemedel; råd därför patienter att rapportera till sin vårdgivare användning av andra läkemedel.
- Informera patienter om att BIAXIN (klaritromycin) Filmtab och oral suspension kan tas med eller utan mat och kan tas med mjölk; dock ska BIAXIN 250mg XL Filmtab (klaritromycin-tabletter med förlängd frisättning) tas med mat. Kyl inte suspensionen.
- Det finns inga data om effekten av BIAXIN (klaritromycin) på förmågan att framföra fordon eller använda maskiner. Rådgör dock patienter om risken för yrsel, svindel, förvirring och desorientering, som kan uppstå med medicinen. Risken för dessa biverkningar bör beaktas innan patienter kör bil eller använder maskiner.
- Informera patienter om att det finns en potentiell fara för fostret om graviditet inträffar medan de tar detta läkemedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
- Råda patienter som har kranskärlssjukdom att fortsätta med medicinering och livsstilsförändringar för sin kranskärlssjukdom eftersom BIAXIN 500 mg kan vara associerat med ökad risk för dödlighet år efter avslutad BIAXIN-behandling.
