Flagyl 200mg, 400mg Metronidazole Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Flagyl och hur används det?
Flagyl är ett receptbelagt läkemedel som används för att behandla symtom på bakteriella infektioner i slidan, magen, levern, huden, lederna, hjärnan och luftvägarna. Flagyl kan användas ensamt eller tillsammans med andra läkemedel.
Flagyl är en nitroimidazoler, CYP3A4-hämmare, måttlig.
Vilka är de möjliga biverkningarna av Flagyl 200mg?
Flagyl 400mg kan orsaka allvarliga biverkningar inklusive:
- diarre,
- smärtsamt eller svårt att urinera,
- sömnproblem,
- depression,
- irritabilitet,
- huvudvärk,
- yrsel
- svaghet,
- yrsel,
- blåsor eller sår i munnen,
- rött eller svullet tandkött, och
- problem med att svälja
Tala om för din läkare om du upplever allvarliga biverkningar av Flagyl inklusive:
- domningar,
- stickningar,
- brännande smärta i händer eller fötter,
- synproblem,
- smärta bakom dina ögon,
- ser blixtar eller ljus,
- muskelsvaghet,
- koordinationssvårigheter,
- problem med att tala eller förstå vad som sägs till dig,
- beslag,
- feber,
- nackstelhet, och
- ökad känslighet för ljus
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
Dessa är inte alla möjliga biverkningar av Flagyl. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten av FLAGYL® och andra antibakteriella läkemedel, ska FLAGYL® endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta vara orsakade av bakterier.
VARNING
Metronidazol har visat sig vara cancerframkallande hos möss och råttor (se FÖRSIKTIGHETSÅTGÄRDER ). Onödig användning av läkemedlet bör undvikas. Dess användning bör reserveras för de förhållanden som beskrivs i INDIKATIONER OCH ANVÄNDNING avsnitt nedan.
BESKRIVNING
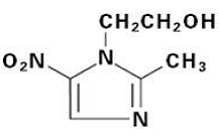
FLAGYL (metronidazol) tabletter, 250 mg eller 500 mg är en oral formulering av den syntetiska nitroimidazol antimikrobiella, 2-metyl-5-nitro-1H-imidazol-1-etanol, som har följande strukturformel:
FLAGYL (metronidazol) tabletter innehåller 250 mg eller 500 mg metronidazol. Inaktiva ingredienser inkluderar cellulosa, FD&C Blue No. 2 Lake, hydroxipropylcellulosa, hypromellos, polyetylenglykol, stearinsyra och titandioxid.
INDIKATIONER
Symtomatisk trichomoniasis. FLAGYL är indicerat för behandling av T. vaginalis-infektion hos kvinnor och män när förekomsten av trichomonad har bekräftats genom lämpliga laboratorieprocedurer (våta utstryk och/eller kulturer).
Asymtomatisk trichomoniasis. FLAGYL 400mg är indicerat för behandling av asymtomatisk T. vaginalis-infektion hos kvinnor när organismen är associerad med endocervicit, cervicit eller cervikal erosion. Eftersom det finns bevis för att närvaron av trichomonad kan störa korrekt bedömning av onormala cytologiska utstryk, bör ytterligare utstryk utföras efter utrotning av parasiten.
Behandling av asymtomatiska sexuella partners. T. vaginalis-infektion är en könssjukdom. Därför bör asymtomatiska sexpartners hos behandlade patienter behandlas samtidigt om organismen har visat sig vara närvarande, för att förhindra återinfektion av partnern. Beslutet om huruvida man ska behandla en asymtomatisk manlig partner som har en negativ kultur eller en för vilken ingen kultur har försökts är individuellt. När man fattar detta beslut bör det noteras att det finns bevis för att en kvinna kan bli återinfekterad om hennes sexpartner inte behandlas. Eftersom det kan finnas avsevärda svårigheter att isolera organismen från den asymtomatiska manliga bäraren, kan man inte lita på negativa utstryk och kulturer i detta avseende. Under alla omständigheter bör sexpartnern behandlas med FLAGYL vid återinfektion.
Amebiasis. FLAGYL är indicerat för behandling av akut intestinal amebiasis (amebisk dysenteri) och amebisk leverabscess.
Vid amebisk leverböld undanröjer inte FLAGYL-terapi behovet av aspiration eller dränering av pus.
Anaeroba bakteriella infektioner. FLAGYL 200mg är indicerat för behandling av allvarliga infektioner orsakade av känsliga anaeroba bakterier. Indikerade kirurgiska ingrepp bör utföras i samband med FLAGYL-behandling. Vid en blandad aerob och anaerob infektion bör antimikrobiella medel som är lämpliga för behandling av den aeroba infektionen användas förutom FLAGYL.
INTRAABDOMINALA INFEKTIONER, inklusive peritonit, intraabdominal abscess och leverabscess, orsakade av Bacteroides-arter inklusive B. fragilis-gruppen (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B. vulgatus), Clostridium arter, Eubacterium-arter, Peptococcus-arter och Peptostreptococcus-arter.
HUD- OCH HUDSTRUKTURINFEKTIONER orsakade av Bacteroides-arter inklusive B. fragilis-gruppen, Clostridium-arter, Peptococcus-arter, Peptostreptokockarter och Fusobacterium-arter.
GYNEKOLOGISKA INFEKTIONER, inklusive endometrit, endomyometrit, tubo-ovarial abscess och postkirurgisk vaginal manschettinfektion, orsakade av Bacteroides-arter inklusive B. fragilis-gruppen, Clostridium-arter, Peptococcus-arter, Peptostreptokockarter och Fusobacterium-arter.
BAKTERIELL SEPTICEMI orsakad av Bacteroides-arter inklusive B. fragilis-gruppen och Clostridium-arter.
BEN- OCH LEDINFEKTIONER (som tilläggsterapi), orsakade av Bacteroides-arter inklusive B. fragilis-gruppen.
INFEKTIONER I CENTRALA NERVSYSTEMET (CNS), inklusive hjärnhinneinflammation och hjärnabscess, orsakad av Bacteroides-arter inklusive B. fragilis-gruppen.
INFEKTIONER I NEDRE LUFTORGAN, inklusive lunginflammation, empyem och lungabscess, orsakade av Bacteroides-arter inklusive B. fragilis-gruppen.
ENDOKARDIT orsakad av Bacteroides-arter inklusive B. fragilis-gruppen.
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten av FLAGYL 400mg och andra antibakteriella läkemedel, ska FLAGYL endast användas för att behandla eller förebygga infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
Trichomoniasis
I Kvinnan
Endagsbehandling - två gram FLAGYL, ges antingen som engångsdos eller i två uppdelade doser på ett gram vardera, ges samma dag.
Sju dagar lång behandling - 250 mg tre gånger dagligen i sju dagar i följd. Det finns en viss indikation från kontrollerade jämförande studier på att botningsfrekvensen, bestämt av vaginala utstryk och tecken och symtom, kan vara högre efter en sjudagars behandlingskur än efter en endagsbehandling.
Doseringsregimen bör anpassas individuellt. Endosbehandling kan säkerställa följsamhet, särskilt om den administreras under övervakning, hos de patienter som inte kan lita på att fortsätta den sju dagar långa kuren. En sjudagars behandling kan minimera återinfektion genom att skydda patienten tillräckligt länge för att de sexuella kontakterna ska få lämplig behandling. Vidare kan vissa patienter tolerera en behandlingsregim bättre än den andra.
Gravida patienter ska inte behandlas under första trimestern (se KONTRAINDIKATIONER ). Hos gravida patienter för vilka alternativ behandling har varit otillräcklig, bör en-dagsbehandlingskuren inte användas, eftersom det resulterar i högre serumnivåer som kan nå fostrets cirkulation (se FÖRSIKTIGHETSÅTGÄRDER , Graviditet ).
När upprepade kurer av läkemedlet krävs, rekommenderas det att ett intervall på fyra till sex veckor går mellan kurerna och att förekomsten av trichomonad bekräftas på nytt med lämpliga laboratorieåtgärder. Totala och differentiella leukocyträkningar bör göras före och efter återbehandling.
Hos hanen: Behandlingen bör vara individualiserad som den är för honan.
Amebiasis
Vuxna
För akut intestinal amebiasis (akut amebisk dysenteri): 750 mg oralt tre gånger dagligen i 5 till 10 dagar.
För amebisk leverabscess: 500 mg eller 750 mg oralt tre gånger dagligen i 5 till 10 dagar.
Pediatriska patienter: 35 till 50 mg/kg/24 timmar, uppdelat på tre doser, oralt i 10 dagar.
Anaeroba bakteriella infektioner
Vid behandling av de flesta allvarliga anaeroba infektioner ges intravenös metronidazol vanligtvis initialt.
Den vanliga orala dosen för vuxna är 7,5 mg/kg var sjätte timme (ca 500 mg för en vuxen på 70 kg). Maximalt 4 g bör inte överskridas under en 24-timmarsperiod.
Den vanliga behandlingens varaktighet är 7 till 10 dagar; infektioner i ben och leder, nedre luftvägar och endokard kan dock kräva längre behandling.
Dosjusteringar
Patienter med gravt nedsatt leverfunktion
För patienter med gravt nedsatt leverfunktion (Child-Pugh C) ska dosen av FLAGYL minskas med 50 % (se KLINISK FARMAKOLOGI och FÖRSIKTIGHETSÅTGÄRDER ).
Patienter som genomgår hemodialys
Hemodialys avlägsnar betydande mängder metronidazol och dess metaboliter från den systemiska cirkulationen. Clearance av metronidazol beror på vilken typ av dialysmembran som används, hur länge dialyssessionen tar och andra faktorer. Om administreringen av metronidazol inte kan separeras från hemodialysperioden, bör tillägg av metronidazoldosering efter hemodialystillfället övervägas, beroende på patientens kliniska situation (se KLINISK FARMAKOLOGI ).
HUR LEVERERAS
FLAGYL 250 mg tabletterna är runda, blå, filmdragerade, med SEARLE och 1831 präglade på ena sidan och FLAGYL och 250 på den andra sidan; levereras som flaskor med 50 och 100 st.
FLAGYL 500 mg tabletterna är avlånga, blå, filmdragerade, med FLAGYL präglad på ena sidan och 500 på andra sidan; flaskor med 50 och 100 st.
Förvaring och stabilitet
Förvara under 25°C (77°F) och skydda mot ljus.
Distribueras av: Pfizer Labs, Division of Pfizre Inc., NY, NY 10017. Reviderad: Dec 2021
BIEFFEKTER
Följande reaktioner har rapporterats under behandling med metronidazol:
Centrala nervsystemet
De allvarligaste biverkningarna som rapporterats hos patienter som behandlats med metronidazol har varit konvulsiva anfall, encefalopati, aseptisk meningit, optisk och perifer neuropati, den senare kännetecknas huvudsakligen av domningar eller parestesi i en extremitet. Eftersom ihållande perifer neuropati har rapporterats hos vissa patienter som får långvarig administrering av metronidazol, bör patienterna varnas specifikt för dessa reaktioner och bör uppmanas att sluta med läkemedlet och omedelbart rapportera till sin läkare om några neurologiska symtom uppstår. Dessutom har patienter rapporterat huvudvärk, synkope, yrsel, yrsel, inkoordination, ataxi, förvirring, dysartri, irritabilitet, depression, svaghet och sömnlöshet (se VARNINGAR ).
Gastrointestinala
De vanligaste rapporterade biverkningarna har varit hänförliga till mag-tarmkanalen, särskilt illamående, ibland åtföljd av huvudvärk, anorexi och ibland kräkningar; diarre; epigastrisk nöd; och magkramper och förstoppning.
Mun
En skarp, obehaglig metallisk smak är inte ovanligt. Furry tunga, glossit och stomatit har förekommit; dessa kan vara förknippade med en plötslig överväxt av Candida som kan uppstå under behandlingen.
Dermatologiskt
Erytematösa utslag och klåda.
Hematopoetisk
Reversibel neutropeni (leukopeni); sällan, reversibel trombocytopeni.
Kardiovaskulär
QT-förlängning har rapporterats, särskilt när metronidazol administrerats tillsammans med läkemedel med potential att förlänga QT-intervallet. Tillplattning av T-vågen kan ses i elektrokardiografiska spårningar.
Överkänslighet
Urtikaria, erytematösa utslag, Stevens-Johnsons syndrom, giftig epidermal nekrolys, rodnad, nästäppa, torrhet i munnen (eller vagina eller vulva) och feber.
Njur
Dysuri, cystit, polyuri, inkontinens och en känsla av bäckentryck. Fall av mörk urin har rapporterats av ungefär en patient av 100 000. Även om pigmentet som förmodligen är ansvarigt för detta fenomen inte har identifierats positivt, är det nästan säkert en metabolit av metronidazol och verkar inte ha någon klinisk betydelse.
Lever
Fall av allvarlig irreversibel levertoxicitet/akut leversvikt, inklusive fall med dödlig utgång med mycket snabbt insättande efter påbörjad systemisk användning av metronidazol, har rapporterats hos patienter med Cockayne syndrom (latens från läkemedelsstart till tecken på leversvikt så kort som 2 dagar ) (ser KONTRAINDIKATIONER ).
Övrig
Proliferation av Candida i slidan, dyspareuni, minskning av libido, proktit och flyktiga ledsmärtor som ibland liknar "serumsjuka". Sällsynta fall av bukspottkörtelinflammation, som i allmänhet avtog vid utsättning av läkemedlet, har rapporterats.
Patienter med Crohns sjukdom är kända för att ha en ökad förekomst av gastrointestinala och vissa extraintestinala cancerformer. Det har förekommit några rapporter i den medicinska litteraturen om bröst- och tjocktarmscancer hos patienter med Crohns sjukdom som har behandlats med metronidazol i höga doser under längre perioder. Ett orsakssamband har inte fastställts. Crohns sjukdom är inte en godkänd indikation för FLAGYL 200 mg tabletter.
LÄKEMEDELSINTERAKTIONER
Disulfiram
Psykotiska reaktioner har rapporterats hos alkoholiserade patienter som använder metronidazol och disulfiram samtidigt. Metronidazol ska inte ges till patienter som har tagit disulfiram under de senaste två veckorna (se KONTRAINDIKATIONER ).
Alkoholhaltiga drycker
Magkramper, illamående, kräkningar, huvudvärk och rodnad kan uppstå om alkoholhaltiga drycker eller produkter som innehåller propylenglykol konsumeras under eller efter metronidazolbehandling (se KONTRAINDIKATIONER ).
Warfarin och andra orala antikoagulantia
Metronidazol har rapporterats förstärka den antikoagulerande effekten av warfarin och andra orala kumarinantikoagulanter, vilket resulterar i en förlängning av protrombintiden. När FLAGYL förskrivs till patienter på denna typ av antikoagulantia, bör protrombintid och INR övervakas noggrant.

Litium
Hos patienter som stabiliserats på relativt höga doser litium har korttidsbehandling med metronidazol associerats med förhöjt serumlitium och, i några få fall, tecken på litiumtoxicitet. Serumlitium- och serumkreatininnivåer bör erhållas flera dagar efter påbörjad behandling med metronidazol för att upptäcka eventuella ökningar som kan föregå kliniska symtom på litiumförgiftning.
Busulfan
Metronidazol har rapporterats öka plasmakoncentrationerna av busulfan, vilket kan resultera i en ökad risk för allvarlig busulfantoxicitet. Metronidazol ska inte administreras samtidigt med busulfan om inte nyttan uppväger risken. Om inga terapeutiska alternativ till metronidazol finns tillgängliga, och samtidig administrering med busulfan är medicinskt nödvändig, bör frekvent övervakning av busulfanplasmakoncentrationen utföras och busulfandosen bör justeras därefter.
Läkemedel som hämmar CYP450-enzymer
Samtidig administrering av läkemedel som minskar mikrosomal leverenzymaktivitet, såsom cimetidin, kan förlänga halveringstiden och minska plasmaclearance av metronidazol.
Läkemedel som inducerar CYP450-enzymer
Samtidig administrering av läkemedel som inducerar mikrosomala leverenzymer, såsom fenytoin eller fenobarbital, kan påskynda elimineringen av metronidazol, vilket resulterar i minskade plasmanivåer; nedsatt clearance av fenytoin har också rapporterats.
Läkemedel som förlänger QT-intervallet
QT-förlängning har rapporterats, särskilt när metronidazol administrerats tillsammans med läkemedel med potential att förlänga QT-intervallet.
VARNINGAR
Effekter på centrala och perifera nervsystemet
Encefalopati och perifer neuropati: Fall av encefalopati och perifer neuropati (inklusive optisk neuropati) har rapporterats med metronidazol.
Encefalopati har rapporterats i samband med cerebellär toxicitet kännetecknad av ataxi, yrsel och dysartri. CNS-lesioner som ses på MRT har beskrivits i rapporter om encefalopati. CNS-symtom är i allmänhet reversibla inom dagar till veckor efter utsättande av metronidazol. CNS-lesioner som ses på MRT har också beskrivits som reversibla.
Perifer neuropati, huvudsakligen av sensorisk typ, har rapporterats och kännetecknas av domningar eller parestesi i en extremitet.
Konvulsiva anfall har rapporterats hos patienter som behandlats med metronidazol.
Aseptisk meningit: Fall av aseptisk meningit har rapporterats med metronidazol. Symtom kan uppträda inom timmar efter dosadministrering och försvinner i allmänhet efter att metronidazolbehandlingen avbrutits.
Uppkomsten av onormala neurologiska tecken och symtom kräver en omedelbar utvärdering av nytta/risk-förhållandet vid fortsatt behandling (se NEGATIVA REAKTIONER ).
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Nedsatt leverfunktion
Patienter med nedsatt leverfunktion metaboliserar metronidazol långsamt, med resulterande ackumulering av metronidazol i plasma. För patienter med gravt nedsatt leverfunktion (Child-Pugh C) rekommenderas en reducerad dos av FLAGYL 400 mg. För patienter med lätt till måttligt nedsatt leverfunktion behövs ingen dosjustering men dessa patienter bör övervakas för metronidazolrelaterade biverkningar (se KLINISK FARMAKOLOGI och DOSERING OCH ADMINISTRERING ).
Nedsatt njurfunktion
Patienter med njursjukdom i slutstadiet kan utsöndra metronidazol och metaboliter långsamt i urinen, vilket resulterar i betydande ackumulering av metronidazolmetaboliter. Övervakning av metronidazolrelaterade biverkningar rekommenderas (se KLINISK FARMAKOLOGI ).
Svampsuperinfektioner
Känd eller tidigare okänd candidiasis kan ge mer framträdande symtom under behandling med FLAGYL och kräver behandling med ett candidacidalt medel.
Användning hos patienter med bloddyskrasier
Metronidazol är en nitroimidazol och bör användas med försiktighet till patienter med tecken på eller historia av bloddyskrasi. En mild leukopeni har observerats under administreringen; dock har inga ihållande hematologiska avvikelser hänförliga till metronidazol observerats i kliniska studier. Totalt och differentiellt antal leukocyter rekommenderas före och efter behandlingen.
Läkemedelsresistenta bakterier och parasiter
Att förskriva FLAGYL i frånvaro av en bevisad eller starkt misstänkt bakteriell eller parasitisk infektion eller en profylaktisk indikation är osannolikt att ge patienten nytta och ökar risken för utveckling av läkemedelsresistenta bakterier och parasiter.
Interaktioner med läkemedel/laboratorietest
Metronidazol kan störa vissa typer av bestämningar av serumkemivärden, såsom aspartataminotransferas (AST, SGOT), alaninaminotransferas (ALT, SGPT), laktatdehydrogenas (LDH), triglycerider och glukoshexokinas. Värden på noll kan observeras. Alla analyser där interferens har rapporterats involverar enzymatisk koppling av analysen till oxidationsreduktion av nikotinamidadenindinukleotid (NAD+NADH). Interferens beror på likheten i absorbanstoppar för NADH (340 nm) och metronidazol (322 nm) vid pH 7.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Tumörer som påverkar lever, lungor, bröst- och lymfvävnader har upptäckts i flera studier av metronidazol på råttor och möss, men inte hamstrar.
Lungtumörer har observerats i alla sex rapporterade studier på mus, inklusive en studie där djuren doserades på ett intermittent schema (administrering endast var fjärde vecka). Maligna levertumörer ökade hos möss av hankön som behandlades med cirka 1500 mg/m² (liknande den maximala rekommenderade dagliga dosen, baserat på jämförelser av kroppsytan). Maligna lymfom och pulmonella neoplasmer ökade också med livstidsmatning av läkemedlet till möss. Bröst- och levertumörer ökade bland honråttor som fick oral metronidazol jämfört med samtidiga kontroller. Två livstidsstudier av tumorigenicitet på hamstrar har utförts och rapporterats vara negativa.
Metronidazol har visat mutagen aktivitet i in vitro-analyssystem inklusive Ames-testet. Studier på däggdjur in vivo har misslyckats med att visa en potential för genetisk skada.
Metronidazol gav inte några negativa effekter på fertilitet eller testikelfunktion hos hanråttor vid doser upp till 400 mg/kg/dag (liknande den maximala rekommenderade kliniska dosen, baserat på jämförelser av kroppsytan) under 28 dagar. Råttor behandlade med samma dos i 6 veckor eller längre var emellertid infertila och visade allvarlig degeneration av sädesepitel i testiklarna såväl som markanta minskningar av antalet testikelspermatider och epididymala spermier. Fertiliteten återställdes hos de flesta råttor efter en åtta veckors, läkemedelsfri återhämtningsperiod.
Graviditet
Teratogena effekter
Det finns inga adekvata och välkontrollerade studier av FLAGYL på gravida kvinnor. Det finns publicerade data från fall-kontrollstudier, kohortstudier och 2 metaanalyser som inkluderar mer än 5000 gravida kvinnor som använde metronidazol under graviditeten. Många studier inkluderade exponeringar i första trimestern. En studie visade en ökad risk för läppspalt, med eller utan gomspalt, hos spädbarn som exponerades för metronidazol i livmodern; dessa fynd bekräftades dock inte. Dessutom inkluderade mer än tio randomiserade placebokontrollerade kliniska prövningar mer än 5 000 gravida kvinnor för att bedöma användningen av antibiotikabehandling (inklusive metronidazol) för bakteriell vaginos på förekomsten av för tidig förlossning. De flesta studier visade ingen ökad risk för medfödda anomalier eller andra ogynnsamma fosterutfall efter exponering för metronidazol under graviditet. Tre studier utförda för att bedöma risken för spädbarnscancer efter exponering för metronidazol under graviditeten visade ingen ökad risk; dessa studiers förmåga att upptäcka en sådan signal var emellertid begränsad.
Metronidazol passerar placentabarriären och dess effekter på den mänskliga fostrets organogenes är inte känd. Reproduktionsstudier har utförts på råttor, kaniner och möss i doser som liknar den maximala rekommenderade humana dosen baserat på jämförelser av kroppsytan. Det fanns inga tecken på skada på fostret på grund av metronidazol.
Ammande mödrar
Metronidazol finns i bröstmjölk i koncentrationer som liknar moderns serumnivåer, och spädbarnsserumnivåer kan vara nära eller jämförbara med spädbarns terapeutiska nivåer. På grund av potentialen för tumörframkallande egenskaper som visas för metronidazol hos mus och råtta
studier bör ett beslut fattas om man ska avbryta amningen eller avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern. Alternativt kan en ammande mamma välja att pumpa och kassera bröstmjölk under hela metronidazolbehandlingen och under 24 timmar efter att behandlingen avslutats och mata sitt spädbarn lagrad bröstmjölk eller modersmjölksersättning.
Geriatrisk användning
Hos äldre geriatriska patienter rekommenderas övervakning av metronidazolrelaterade biverkningar (se KLINISK FARMAKOLOGI , FÖRSIKTIGHETSÅTGÄRDER ). Nedsatt leverfunktion hos geriatriska patienter kan resultera i ökade koncentrationer av metronidazol som kan kräva justering av metronidazoldosen (se DOSERING OCH ADMINISTRERING ).
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts, förutom för behandling av amebiasis.
ÖVERDOS
Enstaka orala doser av metronidazol, upp till 15 g, har rapporterats vid självmordsförsök och oavsiktliga överdoser. Symtom som rapporterats inkluderar illamående, kräkningar och ataxi.
Oral metronidazol har studerats som ett strålsensibiliserande medel vid behandling av maligna tumörer. Neurotoxiska effekter, inklusive kramper och perifer neuropati, har rapporterats efter 5 till 7 dagar med doser på 6 till 10,4 g varannan dag.
Behandling av överdosering
Det finns ingen specifik motgift mot överdosering av metronidazol; Därför bör behandlingen av patienten bestå av symtomatisk och stödjande terapi.
KONTRAINDIKATIONER
Överkänslighet
FLAGYL tabletter är kontraindicerat till patienter med tidigare överkänslighet mot metronidazol eller andra nitroimidazolderivat.
Hos patienter med trichomoniasis är FLAGYL 200 mg tabletter kontraindicerat under graviditetens första trimester (se FÖRSIKTIGHETSÅTGÄRDER ).
Psykotisk reaktion med disulfiram
Användning av oral metronidazol är associerad med psykotiska reaktioner hos alkoholiserade patienter som samtidigt använder disulfiram. Ge inte metronidazol till patienter som har tagit disulfiram under de senaste två veckorna (se FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ).
Interaktion med alkohol
Användning av oral metronidazol är associerad med en disulfiram-liknande reaktion på alkohol, inklusive magkramper, illamående, kräkningar, huvudvärk och rodnad. Sluta konsumera alkohol eller produkter som innehåller propylenglykol under och i minst tre dagar efter behandling med metronidazol (se FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ).
Cockaynes syndrom
FLAGYL 400 mg tabletter är kontraindicerade hos patienter med Cockaynes syndrom. Allvarlig irreversibel levertoxicitet/akut leversvikt med dödlig utgång har rapporterats efter påbörjad behandling med metronidazol hos patienter med Cockayne syndrom (se NEGATIVA REAKTIONER ).
KLINISK FARMAKOLOGI
Absorption
Fördelningen av metronidazol i kroppen är liknande för både orala och intravenösa doseringsformer. Efter oral administrering absorberas metronidazol väl, med maximala plasmakoncentrationer som inträffar mellan en och två timmar efter administrering.
Plasmakoncentrationerna av metronidazol är proportionella mot den administrerade dosen. Oral administrering av 250 mg, 500 mg eller 2 000 mg gav maximala plasmakoncentrationer på 6 mcg/ml, 12 mcg/ml respektive 40 mcg/ml. Studier visar inga signifikanta skillnader i biotillgänglighet mellan män och kvinnor; men på grund av viktskillnader är de resulterande plasmanivåerna hos män i allmänhet lägre.
Distribution
Metronidazol är den huvudsakliga komponenten som förekommer i plasma, med mindre mängder metaboliter också närvarande. Mindre än 20 % av den cirkulerande metronidazolen är bunden till plasmaproteiner. Metronidazol förekommer i cerebrospinalvätska, saliv och bröstmjölk i koncentrationer liknande de som finns i plasma. Baktericida koncentrationer av metronidazol har också påvisats i pus från leverbölder.
Metabolism/utsöndring
Den huvudsakliga elimineringsvägen för metronidazol och dess metaboliter är via urinen (60 % till 80 % av dosen), med fekal utsöndring som står för 6 % till 15 % av dosen. Metaboliterna som uppträder i urinen härrör främst från sidokedjeoxidation [1-(Ÿhydroxietyl)-2-hydroximetyl-5-nitroimidazol och 2-metyl-5-nitroimidazol-1-ylättiksyra] och glukuronidkonjugering, med oförändrad metronidazolredovisning för cirka 20 % av totalen. Både moderföreningen och hydroxylmetaboliten har antimikrobiell aktivitet in vitro.
Njurclearance av metronidazol är cirka 10 ml/min/1,73 m². Den genomsnittliga eliminationshalveringstiden för metronidazol hos friska försökspersoner är åtta timmar.
Nedsatt njurfunktion
Nedsatt njurfunktion förändrar inte farmakokinetiken för engångsdoser för metronidazol.
Försökspersoner med njursjukdom i slutstadiet (ESRD; CLCR= 8,1±9,1 ml/min) och som fick en enda intravenös infusion av metronidazol 500 mg hade ingen signifikant förändring i metronidazols farmakokinetik men hade 2 gånger högre Cmax för hydroxy-metronidazol och 5 -faldigt högre Cmax för metronidazolacetat, jämfört med friska försökspersoner med normal njurfunktion (CLCR= 126±16 ml/min). På grund av den potentiella ackumuleringen av metronidazolmetaboliter hos ESRD-patienter rekommenderas övervakning av metronidazolrelaterade biverkningar (se FÖRSIKTIGHETSÅTGÄRDER ).
Effekt av dialys
Efter en intravenös engångsinfusion eller oral dos av metronidazol 500 mg undersöktes clearance av metronidazol hos ESRD-patienter som genomgick hemodialys eller kontinuerlig ambulatorisk peritonealdialys (CAPD). En hemodialyssession som varade i 4 till 8 timmar tog bort 40 % till 65 % av den administrerade metronidazoldosen, beroende på vilken typ av dialysmembran som användes och hur länge dialyssessionen varar. Om administreringen av metronidazol inte kan separeras från dialyssessionen, bör tillägg av metronidazoldos efter hemodialys övervägas (se DOSERING OCH ADMINISTRERING ). En peritonealdialys som varade i 7,5 timmar tog bort cirka 10 % av den administrerade metronidazoldosen. Ingen justering av metronidazoldos behövs hos ESRD-patienter som genomgår CAPD.
Nedsatt leverfunktion
Efter en enstaka intravenös infusion av 500 mg metronidazol var medel-AUC24 för metronidazol högre med 114 % hos patienter med gravt (Child-Pugh C) nedsatt leverfunktion och med 54 % och 53 % hos patienter med mild (Child-Pugh A) respektive måttlig (Child-Pugh B) nedsatt leverfunktion jämfört med friska kontrollpersoner. Det fanns inga signifikanta förändringar i AUC24 för hydroxyl-metronidazol hos dessa patienter med nedsatt leverfunktion. En minskning av metronidazoldosen med 50 % rekommenderas till patienter med gravt (Child-Pugh C) nedsatt leverfunktion (se DOSERING OCH ADMINISTRERING ). Ingen dosjustering behövs för patienter med lätt till måttligt nedsatt leverfunktion. Patienter med lätt till måttligt nedsatt leverfunktion bör övervakas för metronidazolrelaterade biverkningar (se FÖRSIKTIGHETSÅTGÄRDER och DOSERING OCH ADMINISTRERING ).
Geriatriska patienter
Efter en engångsdos på 500 mg oral eller IV av metronidazol hade försökspersoner >70 år gamla utan uppenbar njur- eller leverdysfunktion en 40 % till 80 % högre genomsnittlig AUC för hydroxi-metronidazol (aktiv metabolit), utan någon uppenbar ökning av medelvärdet. AUC för metronidazol (moderförening), jämfört med unga friska kontroller FÖRSIKTIGHETSÅTGÄRDER ).
Pediatriska patienter
I en studie verkade nyfödda spädbarn uppvisa minskad förmåga att eliminera metronidazol. Elimineringshalveringstiden, mätt under de första 3 dagarna av livet, var omvänt relaterad till graviditetsåldern. Hos spädbarn vars graviditetsålder var mellan 28 och 40 veckor varierade motsvarande eliminationshalveringstider från 109 till 22,5 timmar.
Mikrobiologi
Handlingsmekanism
Metronidazol, en nitroimidazol, utövar antibakteriella effekter i en anaerob miljö mot de flesta obligatoriska anaerober. När metronidazol väl kommer in i organismen genom passiv diffusion och aktiveras i cytoplasman hos känsliga anaeroba bakterier, reduceras det; denna process inkluderar intracellulära elektrontransportproteiner såsom ferredoxin, överföring av en elektron till nitrogruppen i metronidazolen och bildning av en kortlivad fri nitroso-radikal. På grund av denna förändring av metronidazolmolekylen skapas och bibehålls en koncentrationsgradient som främjar läkemedlets intracellulära transport. Den reducerade formen av metronidazol och fria radikaler kan interagera med DNA vilket leder till hämning av DNA-syntes och DNA-nedbrytning som leder till bakteriedöd. Den exakta verkningsmekanismen för metronidazol är oklar.
Motstånd
Det finns en potential för utveckling av resistens mot metronidazol.
Resistens kan bero på flera mekanismer som inkluderar minskat upptag av läkemedlet, förändrad reduktionseffektivitet, överuttryck av effluxpumparna, inaktivering av läkemedlet och/eller ökad reparation av DNA-skador.
Metronidazol har ingen kliniskt relevant aktivitet mot fakultativa anaerober eller obligat aerober.
Antimikrobiell aktivitet
Metronidazol har visat sig vara aktivt mot de flesta isolat av följande bakterier både in vitro och vid kliniska infektioner enligt beskrivningen i avsnittet INDIKATIONER OCH ANVÄNDNING.
Gram-positiva anaerober
Clostridium-arter Eubacterium-arter Peptococcus-arter Peptostreptococcus-arter
Gramnegativa aaerober
Bacteroides fragilis-grupp (B. fragilis, B. distasonis, B. ovatus, B. thetaiotaomicron, B.vulgatus) Fusobacterium-arter
Protozoala parasiter
Entamoeba histolytica Trichomonas vaginalis
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd:
Metronidazol uppvisar in vitro minimala hämmande koncentrationer (MIC) på 8 mcg/ml eller mindre mot de flesta (≥ 90 %) isolat av följande bakterier; men metronidazols säkerhet och effektivitet vid behandling av kliniska infektioner på grund av dessa bakterier har inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Gramnegativa Anaerober
Gruppen Bacteroides fragilis (B. caccae, B. uniformis) Prevotella-arter (P. bivia, P. buccae, P. disiens)
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder som erkänns av FDA för detta läkemedel, se: https://www.fda.gov/STIC.
PATIENTINFORMATION
Interaktion med alkohol
Sluta konsumera alkoholhaltiga drycker eller produkter som innehåller propylenglykol medan du tar FLAGYL 400 mg och i minst tre dagar efteråt eftersom magkramper, illamående, kräkningar, huvudvärk och rodnad kan uppstå (se KONTRAINDIKATIONER och FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ).
Behandling av bakteriella och parasitära infektioner
Patienter bör informeras om att FLAGYL 400 mg endast ska användas för att behandla bakteriella och parasitära infektioner. FLAGYL 400mg behandlar inte virusinfektioner (t.ex. förkylning). När FLAGYL ordineras för att behandla en bakteriell infektion, bör patienterna informeras om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med FLAGYL 400 mg i framtiden.
