Vantin 200mg, 100mg Cefpodoxime Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Vantin 100mg och hur används det?
Vantin 100mg är ett receptbelagt läkemedel som används för att behandla symtom på olika bakterieinfektioner såsom bronkit, lunginflammation, bihåleinflammation, faryngit, tonsillit, urinvägsinfektioner, hudinfektioner och gonorré. Vantin 200mg kan användas ensamt eller tillsammans med andra läkemedel.
Vantin tillhör en klass av läkemedel som kallas kaphalosporiner, 3:e generationen.
Det är inte känt om Vantin är säkert och effektivt för barn yngre än 2 månader.
Vilka är de möjliga biverkningarna av Vantin 200mg?
Vantin kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- feber,
- öm hals,
- brännande i dina ögon,
- smärta i huden,
- röda eller lila hudutslag som sprider sig och orsakar blåsor och fjällning,
- svåra magsmärtor,
- diarré som är vattnig eller blodig,
- svullna körtlar,
- ledvärk,
- allmän dålig känsla,
- bultande hjärtslag,
- fladdrande i ditt bröst,
- andnöd, och
- beslag
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Vantin inkluderar:
- vaginal klåda eller flytningar,
- blöjutslag hos ett spädbarn som använder detta läkemedel,
- illamående,
- kräkningar,
- diarre,
- ont i magen och
- huvudvärk
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Vantin. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos VANTIN 100mg och andra antibakteriella läkemedel, ska VANTIN 100mg endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta vara orsakade av bakterier.
BESKRIVNING
Cefpodoxim proxetil är ett oralt administrerat, halvsyntetiskt antibiotikum med utökat spektrum av cefalosporinklassen. Det kemiska namnet är (RS)-1(isopropoxikarbonyloxi)etyl-(+)-(6R,7R)-7-[2-(2-amino-4-tiazolyl)-2-{(Z)metoxiimino}acetamido]-3 -metoximetyl-8-oxo-5-tia-l-azabicyklo[4.2.0]okt-2-en-2-karboxylat. Dess empiriska formel är C21H27N5O9S2 och dess strukturformel är representerad nedan:
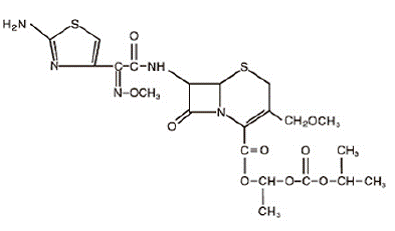
Molekylvikten för cefpodoximproxetil är 557,6.
Cefpodoxim proxetil är en prodrug; dess aktiva metabolit är cefpodoxim. Alla doser av cefpodoximproxetil i denna insats uttrycks i termer av den aktiva cefpodoximdelen. Läkemedlet tillhandahålls både som filmdragerade tabletter och som smaksatta granulat för oral suspension.
VANTIN-tabletter innehåller cefpodoximproxetil motsvarande 100 mg eller 200 mg cefpodoximaktivitet och följande inaktiva ingredienser: karboximetylcellulosakalcium, karnaubavax, FD&C Yellow No. 6, hydroxipropylcellulosa, hypromellos, vattenhaltig laktos, magnesiumstearat, natriumglycylolsulfat och propylensulfat. titandioxid. Dessutom innehåller 100 mg filmdragerade tabletter D&C Yellow No. 10 och 200 mg filmdragerade tabletter innehåller FD&C Red No. 40.
Varje 5 ml VANTIN oral suspension innehåller cefpodoximproxetil motsvarande 50 mg eller 100 mg cefpodoximaktivitet efter konstituering och följande inaktiva ingredienser: konstgjorda smakämnen, butylerad hydroxianisol (BHA), karboximetylcellulosanatrium, mikrokristallin cellulosa, cellulosa, cellulosa, carboxylsyra kiseldioxid, kroskarmellosnatrium, hydroxipropylcellulosa, laktos, maltodextrin, naturliga smakämnen, propylenglykolalginat, natriumcitrat, natriumbensoat, stärkelse, sackaros och vegetabilisk olja.
INDIKATIONER
Cefpodoxim proxetil är indicerat för behandling av patienter med milda till måttliga infektioner orsakade av mottagliga stammar av de angivna mikroorganismerna under tillstånden som anges nedan.
Rekommenderade doser, behandlingslängd och tillämpliga patientpopulationer varierar mellan dessa infektioner. Se DOSERING OCH ADMINISTRERING för specifika rekommendationer. Akut otitis media orsakas av Streptococcus pneumoniae (exklusive penicillinresistenta stammar), Streptococcus pyogenes, Haemophilus influenzae (inklusive beta-laktamasproducerande stammar) eller Moraxella (Branhamella) catarrhalis (inklusive beta-laktamasproducerande stammar).
Faryngit och/eller tonsillit orsakad av Streptococcus pyogenes.
NOTERA: Endast penicillin via intramuskulär administrering har visat sig vara effektivt vid profylax av reumatisk feber. Cefpodoximproxetil är i allmänhet effektivt vid utrotning av streptokocker från orofarynx. Data som fastställer effekten av cefpodoximproxetil för profylax av efterföljande reumatisk feber finns dock inte tillgängliga.
Samhällsförvärvad lunginflammation orsakas av S. pneumoniae eller H. Influenzae (inklusive betalaktamasproducerande stammar).
Akut bakteriell exacerbation av kronisk bronkit orsakas av S. pneumoniae, H. influenzae (endast icke-betalaktamas-producerande stammar) eller M. catarrhalis. Data är för närvarande otillräckliga för att fastställa effekt hos patienter med akuta bakteriella exacerbationer av kronisk bronkit orsakad av betalaktamasproducerande stammar av H. influenzae.
Akut, okomplicerad urethral och cervikal gonorré orsakas av Neisseria gonorrhoeae (inklusive penicillinasproducerande stammar).
Akuta, okomplicerade ano-rektala infektioner hos kvinnor på grund av Neisseria gonorrhoeae (inklusive penicillinasproducerande stammar).
NOTERA: Effekten av cefpodoxim vid behandling av manliga patienter med rektalinfektioner orsakade av N. gonorrhoeae har inte fastställts. Data stöder inte användningen av cefpodoximproxetil vid behandling av farynxinfektioner på grund av N. gonorrhoeae hos män eller kvinnor.
Okomplicerade hud- och hudstrukturinfektioner orsakas av Staphylococcus aureus (inklusive penicillinasproducerande stammar) eller Streptococcus pyogenes. Bölder ska dräneras kirurgiskt enligt klinisk indikation.
NOTERA: I kliniska prövningar var framgångsrik behandling av okomplicerade hud- och hudstrukturinfektioner dosrelaterad. Den effektiva terapeutiska dosen för hudinfektioner var högre än de som användes vid andra rekommenderade indikationer. (Ser DOSERING OCH ADMINISTRERING .)
Akut maxillär bihåleinflammation orsakas av Haemophilus influenzae (inklusive betalaktamasproducerande stammar), Streptococcus pneumoniae och Moraxella catarrhalis.
Okomplicerade urinvägsinfektioner (cystit) orsakas av Escherichia coli, Klebsiella pneumoniae, Proteus mirabilis eller Staphylococcus saprophyticus.
NOTERA: När man överväger användningen av cefpodoximproxetil vid behandling av cystit, bör cefpodoximproxetils lägre bakterieutrotningsfrekvens vägas mot den ökade utrotningsfrekvensen och olika säkerhetsprofiler för vissa andra klasser av godkända medel. (Ser Kliniska studier sektion.)
Lämpliga prover för bakteriologisk undersökning bör tas för att isolera och identifiera orsakande organismer och för att fastställa deras känslighet för cefpodoxim. Terapi kan inledas i väntan på resultaten av dessa studier. När dessa resultat blir tillgängliga bör antimikrobiell behandling anpassas därefter.
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten av VANTIN 100mg och andra antibakteriella läkemedel, ska VANTIN 200mg endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta vara orsakade av mottagliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
(Ser INDIKATIONER OCH ANVÄNDNING för indikerade patogener.)
Filmdragerade tabletter
VANTIN tabletter ska administreras oralt med mat för att förbättra absorptionen. (Ser KLINISK FARMAKOLOGI .)
De rekommenderade doserna, behandlingens varaktighet och tillämplig patientpopulation beskrivs i följande diagram:
Vuxna och ungdomar (ålder 12 år och äldre)
Granulat för oral suspension
VANTIN Oral Suspension kan ges utan hänsyn till mat. De rekommenderade doserna, behandlingens varaktighet och tillämpliga patientpopulationer är enligt beskrivningen i följande diagram:
Vuxna och ungdomar (ålder 12 år och äldre)
Spädbarn och pediatriska patienter (åldern 2 månader till 12 år)
Patienter med nedsatt njurfunktion
För patienter med gravt nedsatt njurfunktion (
När endast serumkreatininnivån är tillgänglig kan följande formel (baserat på patientens kön, vikt och ålder) användas för att uppskatta kreatininclearance (ml/min). För att denna uppskattning ska vara giltig bör serumkreatininnivån representera ett stabilt tillstånd av njurfunktionen.
Hanar (ml/min): Vikt (kg) x (140 - ålder)/72 x serumkreatinin (mg/100 ml)
Honor (ml/min) : 0,85 x högre värde
Patienter med cirros
Cefpodoxims farmakokinetik hos cirrospatienter (med eller utan ascites) liknar den hos friska försökspersoner. Dosjustering är inte nödvändig i denna population.
Förberedelse av upphängning
Konstitution Anvisningar för oral suspension
Efter blandning ska suspensionen förvaras i kylskåp, 2° till 8°C (36° till 46°F). Skaka väl innan användning. Förvara behållaren väl tillsluten. Blandningen kan användas i 14 dagar. Kassera oanvänd del efter 14 dagar.
HUR LEVERERAS
VANTIN tabletter finns i följande styrkor (motsvarande cefpodoxim), färger och storlekar:
100 mg (ljus orange, elliptisk, präglad med U3617)
20 flaskor NDC 0009-3617-01 Flaskor med 100 st NDC 0009-3617-02 Endosförpackningar om 100 st NDC 0009-3617-03
200 mg (korallröd, elliptisk, präglad med U3618)
20 flaskor NDC 0009-3618-01 Flaskor med 100 st NDC 0009-3618-02
200 mg (korallröd, elliptisk, präglad med U3618)
Endosförpackningar om 100 st NDC 0009-3618-03
Förvara tabletter vid kontrollerad rumstemperatur 20° till 25°C (68° till 77°F) [se USP ].
Sätt tillbaka locket ordentligt efter varje öppning. Skydda enhetsdosförpackningar från överdriven fukt.
VANTIN 200mg oral suspension ger motsvarande 50 mg eller 100 mg cefpodoxim per 5 ml suspension (när den är sammansatt enligt anvisningarna) och finns tillgänglig i citronkrämsmak i följande storlekar:
50 mg/5 ml
100 ml suspension NDC 0009-3531-01 75 ml suspension NDC 0009-3531-02 50 ml suspension NDC 0009-3531-03
100 mg/5 ml
100 ml suspension NDC 0009-3615-01 75 ml suspension NDC 0009-3615-02 50 ml suspension NDC 0009-3615-03
Förvara osuspenderade granulat vid kontrollerad rumstemperatur 20° till 25°C (68° till 77°F) [se USP ].
Instruktioner för blandning finns på etiketten. Efter blandning ska suspensionen förvaras i kylskåp, 2° till 8°C (36° till 46°F). Skaka väl innan användning. Förvara behållaren väl tillsluten. Blandningen kan användas i 14 dagar. Kassera oanvänd del efter 14 dagar.
Distribuerat av: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Reviderad: Aug 2016
BIEFFEKTER
Kliniska tester
Filmdragerade tabletter (flera doser)
I kliniska prövningar använder flera doser av cefpodoxim proxetil filmdragerade tabletter behandlades 4696 patienter med de rekommenderade doserna av cefpodoxim (100 till 400 mg Q 12 timmar). Det fanns inga dödsfall eller permanenta funktionshinder som ansågs relaterade till drogtoxicitet. Etthundra tjugonio (2,7 %) patienter avbröt medicineringen på grund av biverkningar som troddes möjligen eller troligtvis relaterade till läkemedelstoxicitet. Nittiotre (52 %) av de 178 patienter som avbröt behandlingen (oavsett om de trodde att de var relaterade till läkemedelsbehandling eller inte) gjorde det på grund av gastrointestinala störningar, illamående, kräkningar eller diarré. Andelen cefpodoximproxetilbehandlade patienter som avbröt studieläkemedlet på grund av biverkningar var signifikant högre vid en dos på 800 mg dagligen än vid en dos på 400 mg dagligen eller vid en dos på 200 mg dagligen. Biverkningar som ansågs möjligen eller troligen relaterade till cefpodoxim i kliniska prövningar med flera doser (N=4696 cefpodoximbehandlade patienter) var:
Incidens större än 1 %
Diarré 7,0 %
Diarré eller lös avföring var dosrelaterade: minskade från 10,4 % av patienterna som fick 800 mg per dag till 5,7 % för de som fick 200 mg per dag. Av patienter med diarré hade 10 % C. difficile-organism eller toxin i avföringen. (Ser VARNINGAR .)
Illamående 3,3 % vaginal svampinfektion 1,0 % vulvovaginal infektion 1,3 % buksmärta 1,2 % huvudvärk 1,0 %
Incidens mindre än 1 %
Efter kroppssystem i fallande ordning
Kliniska studier
Biverkningar möjliga eller troligtvis relaterade till Cefpodoxim Proxetil som inträffade hos mindre än 1 % av patienterna (N=4696)
Kropp - svampinfektioner, utspänd buk, sjukdomskänsla, trötthet, asteni, feber, bröstsmärtor, ryggsmärtor, frossa, generaliserad smärta, onormala mikrobiologiska tester, moniliasis, abscess, allergisk reaktion, ansiktsödem, bakterieinfektioner, parasitinfektioner, lokaliserat ödem, lokal smärta .
Kardiovaskulär - kongestiv hjärtsvikt, migrän, hjärtklappning, vasodilatation, hematom, hypertoni, hypotoni.
Matsmältningssystemet - kräkningar, dyspepsi, muntorrhet, flatulens, minskad aptit, förstoppning, oral moniliasis, anorexi, utslag, gastrit, munsår, gastrointestinala störningar, rektala störningar, tungstörningar, tandsjukdomar, ökad törst, orala lesioner, tenesmus, torr halsont. .
Hemisk och lymfatisk - anemi.
Metaboliskt och näringsmässigt - uttorkning, gikt, perifert ödem, viktökning.
Muskulo-skelett - myalgi.
nervös - yrsel, sömnlöshet, somnolens, ångest, skakningar, nervositet, hjärninfarkt, förändringar i drömmar, försämrad koncentration, förvirring, mardrömmar, parestesi, svindel.
Andningsorgan - astma, hosta, näsblod, rinit, väsande andning, bronkit, dyspné, pleurautgjutning, lunginflammation, bihåleinflammation.
Hud - urtikaria, utslag, klåda utan appliceringsställe, diafores, makulopapulära utslag, svampdermatit, avskalning, torr hud som inte appliceras, håravfall, vesikulobulösa utslag, solbränna.
Särskilda sinnen - smakförändringar, ögonirritation, smakförlust, tinnitus.
Urogenital - hematuri, urinvägsinfektioner, metrorragi, dysuri, urinfrekvens, natturi, penisinfektion, proteinuri, vaginal smärta.
Granulat för oral suspension (flera doser)
kliniska prövningar med multipla doser av cefpodoxim proxetil granulat för oral suspension, behandlades 2128 pediatriska patienter (varav 93 % var yngre än 12 år) med de rekommenderade doserna av cefpodoxim (10 mg/kg/dag Q 24 timmar eller uppdelade Q 12 timmar till en maximal ekvivalent dos för vuxna). Det fanns inga dödsfall eller bestående funktionsnedsättningar hos någon av patienterna i dessa studier. Tjugofyra patienter (1,1 %) avbröt medicineringen på grund av biverkningar som ansågs vara möjliga eller troligen relaterade till studieläkemedlet. I första hand var dessa avbrott för gastrointestinala störningar, vanligtvis diarré, kräkningar eller utslag.
Biverkningar som ansågs vara möjliga eller troligtvis relaterade eller av okänt samband med cefpodoximproxetil för oral suspension i kliniska prövningar med flera doser (N=2128 patienter behandlade med cefpodoxim) var:
Incidens större än 1 %
Diarré 6,0 % Incidensen av diarré hos spädbarn och småbarn (åldern 1 månad till 2 år) var 12,8 %. Blöjeutslag/svamphudutslag 2,0 % (inkluderar moniliasis) Incidensen av blöjutslag hos spädbarn och småbarn var 8,5 %. Andra hudutslag 1,8 % Kräkningar 2,3 %
Incidens mindre än 1 %
Kropp: Lokaliserad buksmärta, bukkramper, huvudvärk, monilia, generaliserad buksmärta, asteni, feber, svampinfektion.
Matsmältningskanalen: Illamående, monilia, anorexi, muntorrhet, stomatit, pseudomembranös kolit.
Hemisk och lymfatisk: Trombocytemi, positivt direkt Coombs test, eosinofili, leukocytos, leukopeni, förlängd partiell tromboplastintid, trombocytopen purpura.
Metaboliskt och näringsmässigt: Ökad SGPT.
Muskuloskeletala: Muskelvärk.
Nervös: Hallucinationer, hyperkinesi, nervositet, somnolens.
Andningsvägar: Näsblod, rinit.

Hud: Hudmoniliasis, urtikaria, svampdermatit, akne, exfoliativ dermatit, makulopapulära utslag.
Särskilda sinnen: Smakperversion.
Filmdragerade tabletter (enkeldos)
I kliniska prövningar med användning av en en dos av cefpodoxim proxetil filmdragerade tabletter behandlades 509 patienter med den rekommenderade dosen av cefpodoxim (200 mg). Det fanns inga dödsfall eller permanenta funktionshinder som ansågs vara relaterade till drogtoxicitet i dessa studier.
Biverkningar som ansågs vara möjliga eller troligen relaterade till cefpodoxim i kliniska endosprövningar utförda i USA var:
Incidens större än 1 %
Illamående 1,4 % Diarré 1,2 %
Incidens mindre än 1 %
Centrala nervsystemet: Yrsel, huvudvärk, synkope. Dermatologiskt: Utslag. Genital: Vaginit. Gastrointestinala: Magsmärtor. Psykiatrisk: Ångest.
Laboratorieförändringar
Signifikanta laboratorieförändringar som har rapporterats hos vuxna och pediatriska patienter i kliniska prövningar av cefpodoximproxetil, utan hänsyn till läkemedelsförhållande, var:
Lever: Övergående ökningar av AST (SGOT), ALT (SGPT), GGT, alkaliskt fosfatas, bilirubin och LDH.
Hematologiska: Eosinofili, leukocytos, lymfocytos, granulocytos, basofili, monocytos, trombocytos, sänkt hemoglobin, sänkt hematokrit, leukopeni, neutropeni, lymfocytopeni, trombocytopeni, trombocytemi, positivt Coombs test och förlängt PT och PTT.
Serumkemi: Hyperglykemi, hypoglykemi, hypoalbuminemi, hypoproteinemi, hyperkalemi och hyponatremi.
Njur: Ökar i BUN och kreatinin.
De flesta av dessa avvikelser var övergående och inte kliniskt signifikanta.
Erfarenhet efter marknadsföring
Följande allvarliga biverkningar har rapporterats: allergiska reaktioner inklusive Stevens-Johnsons syndrom, toxisk epidermal nekrolys, erythema multiforme och serumsjukeliknande reaktioner, pseudomembranös kolit, blodig diarré med buksmärtor, ulcerös kolit, rektorragi med hypolaktisk chock, anafy. leverskada, exponering in utero med missfall, purpurisk nefrit, lunginfiltrat med eosinofili och ögonlocksdermatit.
Ett dödsfall tillskrevs pseudomembranös kolit och spridd intravaskulär koagulation.
Klassmärkning av cefalosporin
Utöver de ovan listade biverkningarna som har observerats hos patienter som behandlats med cefpodoximproxetil, har följande biverkningar och ändrade laboratorietester rapporterats för antibiotika av cefalosporinklassen:
Biverkningar och onormala laboratorietester: Njurdysfunktion, toxisk nefropati, leverdysfunktion inklusive kolestas, aplastisk anemi, hemolytisk anemi, serumsjukeliknande reaktion, blödning, agranulocytos och pancytopeni.
Flera cefalosporiner har varit inblandade i att utlösa anfall, särskilt hos patienter med nedsatt njurfunktion när dosen inte reducerats. (Ser DOSERING OCH ADMINISTRERING och ÖVERDOSERING .) Om anfall i samband med läkemedelsbehandling uppstår ska läkemedlet avbrytas. Antikonvulsiv behandling kan ges om det är kliniskt indicerat.
LÄKEMEDELSINTERAKTIONER
Antacida
Samtidig administrering av höga doser av antacida (natriumbikarbonat och aluminiumhydroxid) eller H2-blockerare minskar maximala plasmanivåer med 24 % till 42 % respektive absorptionsgraden med 27 % till 32 %. Absorptionshastigheten förändras inte av dessa samtidiga läkemedel. Orala antikolinergika (t.ex. propantelin) fördröjer maximala plasmanivåer (47 % ökning av Tmax), men påverkar inte graden av absorption (AUC).
Probenecid
Liksom med andra betalaktamantibiotika hämmades den renala utsöndringen av cefpodoxim av probenecid och resulterade i en ökning med cirka 31 % av AUC och 20 % ökning av maximala plasmanivåer av cefpodoxim.
Nefrotoxiska läkemedel
Även om nefrotoxicitet inte har noterats när cefpodoximproxetil gavs ensamt, rekommenderas noggrann övervakning av njurfunktionen när cefpodoximproxetil administreras samtidigt med föreningar med känd nefrotoxisk potential.
Interaktioner med läkemedel/laboratorietest
Cefalosporiner, inklusive cefpodoximproxetil, är kända för att ibland inducera ett positivt direkt Coombs-test.
VARNINGAR
INNAN BEHANDLING MED CEFPODOXIM PROXETIL INSTITUERAS BÖR NOGGRUND UNDERSÖKNING GÖRAS för att avgöra OM PATIENTEN HAR HAFT TIDIGARE HYPERSENSITIVITETSREAKTIONER MOT CEFPODOXIM, ANDRA CEFALOSPORINER, PORICILLINER. OM CEFPODOXIM SKA ADMINISTRES TILL PENICILLINKÄNSLIGA PATIENTER BÖR FÖRSIKTIGHET IAKTTAGAS EFTERSOM KORSÖVERKÄNSLIGHET MELLAN BETA-LAKTAMANTIBIOTIKA HAR TYDLIGT DOKUMENTERATS OCH KAN HÄNDA OM 10 % AV TIDEN. OM EN ALLERGISK REAKTION PÅ CEFPODOXIME PROXETIL FÖREKOMMER, AVSLUTA DRYCKET. ALLVARLIGA AKUTA ÖVERKÄNSLIGHETSREAKTIONER KAN KRÄVA BEHANDLING MED EPINEFRIN OCH ANDRA NÖDÅTGÄRDER, INKLUSIVE SYRE, INTRAVENÖSA VÄTSKOR, INTRAVENÖS ANTIHISTAMIN OCH LUFTVÄGSHANTERING SOM KLINDISKT.
Clostridium difficile associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive VANTIN, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör sättas in efter klinisk indikation.
En samlad ansträngning för att övervaka för C. difficile hos cefpodoxim-behandlade patienter med diarré gjordes på grund av en ökad förekomst av diarré associerad med C. difficile i tidiga försök med normala försökspersoner. C. difficile organismer eller toxin rapporterades hos 10 % av de cefpodoximbehandlade vuxna patienterna med diarré; dock gjordes ingen specifik diagnos av pseudomembranös kolit hos dessa patienter.
Efter marknadsföring utanför USA har rapporter om pseudomembranös kolit i samband med användning av cefpodoximproxetil inkommit.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Hos patienter med övergående eller ihållande minskning av urinproduktionen på grund av njurinsufficiens, bör den totala dagliga dosen av cefpodoximproxetil minskas eftersom höga och långvariga serumantibiotikakoncentrationer kan förekomma hos sådana individer efter vanliga doser. Cefpodoxim ska, liksom andra cefalosporiner, administreras med försiktighet till patienter som samtidigt behandlas med potenta diuretika. (Ser DOSERING OCH ADMINISTRERING .)
Liksom med andra antibiotika kan långvarig användning av cefpodoximproxetil resultera i överväxt av icke-känsliga organismer. Upprepad utvärdering av patientens tillstånd är viktigt. Om superinfektion inträffar under behandlingen bör lämpliga åtgärder vidtas.
Att förskriva VANTIN i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation är osannolikt att ge patienten nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Långtidsstudier av karcinogenes på djur av cefpodoximproxetil har inte utförts. Mutagenesstudier av cefpodoxim, inklusive Ames-testet både med och utan metabolisk aktivering, kromosomavvikelsetestet, den oplanerade DNA-syntesanalysen, mitotisk rekombination och genkonvertering, den framåtriktade genmutationsanalysen och mikrokärntestet in vivo, var alla negativa. Inga ogynnsamma effekter på fertilitet eller reproduktion noterades när 100 mg/kg/dag eller mindre (2 gånger humandosen baserat på mg/m²) administrerades oralt till råttor.
Graviditet
Teratogena effekter
Cefpodoximproxetil var varken teratogent eller embryocidalt när det administrerades till råttor under organogenesen i doser upp till 100 mg/kg/dag (2 gånger humandosen baserat på mg/m²) eller till kaniner i doser upp till 30 mg/kg/dag (1 -2 gånger den mänskliga dosen baserat på mg/m²).
Det finns dock inga adekvata och välkontrollerade studier av användning av cefpodoximproxetil hos gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Arbete och leverans
Cefpodoximproxetil har inte studerats för användning under förlossning och förlossning. Behandling bör endast ges om det är tydligt nödvändigt.
Ammande mödrar
Cefpodoxim utsöndras i modersmjölk. I en studie med 3 ammande kvinnor var nivåerna av cefpodoxim i modersmjölk 0 %, 2 % och 6 % av samtidiga serumnivåer 4 timmar efter en 200 mg oral dos av cefpodoximproxetil. 6 timmar efter dosering var nivåerna 0 %, 9 % och 16 % av samtidiga serumnivåer. På grund av risken för allvarliga reaktioner hos ammande spädbarn bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern.
Pediatrisk användning
Säkerhet och effekt hos spädbarn yngre än 2 månader har inte fastställts.
Geriatrisk användning
Av de 3338 patienterna i kliniska studier med flera doser av cefpodoximproxetil filmdragerade tabletter var 521 (16%) 65 år och äldre, medan 214 (6%) var 75 år och äldre. Inga övergripande skillnader i effektivitet eller säkerhet observerades mellan äldre och yngre patienter. Hos friska geriatriska försökspersoner med normal njurfunktion var halveringstiden för cefpodoxim i plasma i genomsnitt 4,2 timmar och urinåterhämtningen i genomsnitt 21 % efter att en dos på 400 mg gavs var 12:e timme i 15 dagar. Andra farmakokinetiska parametrar var oförändrade jämfört med de som observerades hos friska yngre försökspersoner.
Dosjustering hos äldre patienter med normal njurfunktion är inte nödvändig.
ÖVERDOS
I akuta gnagartoxicitetsstudier gav en oral engångsdos på 5 g/kg inga biverkningar.
I händelse av allvarlig toxisk reaktion från överdosering kan hemodialys eller peritonealdialys hjälpa till att avlägsna cefpodoxim från kroppen, särskilt om njurfunktionen är nedsatt.
De toxiska symtomen efter en överdos av betalaktamantibiotika kan innefatta illamående, kräkningar, epigastrisk ångest och diarré.
KONTRAINDIKATIONER
Cefpodoxim proxetil är kontraindicerat hos patienter med känd allergi mot cefpodoxim eller mot cefalosporingruppen av antibiotika.
KLINISK FARMAKOLOGI
Absorption Och Utsöndring
Cefpodoxim proxetil är en prodrug som absorberas från mag-tarmkanalen och avesterifieras till dess aktiva metabolit, cefpodoxim. Efter oral administrering av 100 mg cefpodoximproxetil till fastande försökspersoner, absorberades cirka 50 % av den administrerade cefpodoximdosen systemiskt. Över det rekommenderade doseringsintervallet (100 till 400 mg) utsöndrades cirka 29 till 33 % av den administrerade cefpodoximdosen oförändrad i urinen på 12 timmar. Det finns minimal metabolism av cefpodoxim in vivo.
Effekter av mat
Absorptionsgraden (medel-AUC) och den genomsnittliga maximala plasmakoncentrationen ökade när filmdragerade tabletter administrerades med mat. Efter en 200 mg tablettdos intagen med mat var AUC 21 till 33 % högre än under fastande förhållanden, och den maximala plasmakoncentrationen var i genomsnitt 3,1 mcg/ml hos patienter som fick mat jämfört med 2,6 mcg/ml hos fastande personer. Tiden till toppkoncentrationen skilde sig inte signifikant mellan personer som fick mat och fastande.
När en 200 mg dos av suspensionen togs med föda skilde sig graden av absorption (medel-AUC) och genomsnittlig maximal plasmakoncentration hos patienter som fick mat inte signifikant från fastande personer, men absorptionshastigheten var långsammare med föda (48 % ökning i Tmax).
Farmakokinetiken för Cefpodoxim Proxetil filmdragerade tabletter
Över det rekommenderade doseringsintervallet (100 till 400 mg) uppvisade hastigheten och omfattningen av cefpodoxims absorption dosberoende; dosnormaliserad Cmax och AUC minskade med upp till 32 % med ökande dos. Över det rekommenderade doseringsintervallet var Tmax cirka 2 till 3 timmar och T½ varierade från 2,09 till 2,84 timmar. Genomsnittlig Cmax var 1,4 mcg/ml för 100 mg dosen, 2,3 mcg/ml för 200 mg dosen och 3,9 mcg/ml för 400 mg dosen. Hos patienter med normal njurfunktion noterades varken ackumulering eller signifikanta förändringar i andra farmakokinetiska parametrar efter flera orala doser på upp till 400 mg Q 12 timmar.
CEFPODOXIM PLASMANIVÅER (mcg/mL) HOS VUXNA Vuxna som fastar EFTER ADMINISTRERING AV FILMBELAGD TABLETT (Enkeldos)
Farmakokinetik för Cefpodoxim Proxetil Suspension
Hos vuxna försökspersoner gav en dos på 100 mg oral suspension en genomsnittlig maximal cefpodoximkoncentration på cirka 1,5 mcg/ml (intervall: 1,1 till 2,1 mcg/ml), vilket är ekvivalent med det som rapporterats efter administrering av 100 mg tabletten. Tiden till maximal plasmakoncentration och arean under plasmakoncentration-tidkurvan (AUC) för den orala suspensionen var också likvärdiga med de som producerades med filmdragerade tabletter hos vuxna efter en 100 mg oral dos.
Farmakokinetiken för cefpodoxim undersöktes hos 29 patienter i åldern 1 till 17 år. Varje patient fick en oral engångsdos på 5 mg/kg cefpodoxim oral suspension. Plasma- och urinprover samlades in under 12 timmar efter dosering. De plasmanivåer som rapporterats från denna studie är följande:
CEFPODOXIM PLASMANIVÅER (mcg/mL) HOS FASTA PATIENTER (1 till 17 ÅRS ÅLDER) EFTER SUSPENSIONADMINISTRERING
Distribution
Proteinbindningen av cefpodoxim varierar från 22 till 33 % i serum och från 21 till 29 % i plasma.
Hudblåsa
Efter administrering av flera doser var 12:e timme under 5 dagar av 200 mg eller 400 mg cefpodoximproxetil var den genomsnittliga maximala cefpodoximkoncentrationen i hudblistervätska 1,6 respektive 2,8 mikrogram/ml. Nivåerna av cefpodoxim i blistervätskan i huden 12 timmar efter dosering var i genomsnitt 0,2 och 0,4 mikrogram/ml för 200 mg respektive 400 mg multipeldosregimer.
Tonsilvävnad
Efter en enstaka oral 100 mg cefpodoxim proxetil filmdragerad tablett, var den genomsnittliga maximala cefpodoximkoncentrationen i tonsillvävnad 0,24 mcg/g 4 timmar efter dosering och 0,09 mcg/g 7 timmar efter dosering. Jämvikt uppnåddes mellan plasma och tonsillvävnad inom 4 timmar efter dosering. Ingen upptäckt av cefpodoxim i tonsillvävnad rapporterades 12 timmar efter dosering. Dessa resultat visade att koncentrationerna av cefpodoxim översteg MIC90 för S. pyogenes under minst 7 timmar efter dosering av 100 mg cefpodoximproxetil.
Lungvävnad
Efter en enstaka oral 200 mg cefpodoxim proxetil filmdragerad tablett var den genomsnittliga maximala cefpodoximkoncentrationen i lungvävnad 0,63 mcg/g 3 timmar efter dosering, 0,52 mcg/g 6 timmar efter dosering och 0,19 mcg/g 12 timmar efter dosering. Resultaten av denna studie indikerade att cefpodoxim trängde in i lungvävnad och producerade ihållande läkemedelskoncentrationer i minst 12 timmar efter dosering vid nivåer som översteg MIC90 för S. pneumoniae och H. influenzae.
CSF
Adekvata data om CSF-nivåer av cefpodoxim finns inte tillgängliga.
Effekter av nedsatt njurfunktion
Eliminationen av cefpodoxim är reducerad hos patienter med måttligt till gravt nedsatt njurfunktion ( FÖRSIKTIGHETSÅTGÄRDER och DOSERING OCH ADMINISTRERING .) Hos patienter med lätt nedsatt njurfunktion (50 till 80 ml/min kreatininclearance) var den genomsnittliga plasmahalveringstiden för cefpodoxim 3,5 timmar. Hos patienter med måttligt (30 till 49 ml/min kreatininclearance) eller gravt nedsatt njurfunktion (5 till 29 ml/min kreatininclearance) ökade halveringstiden till 5,9 respektive 9,8 timmar. Ungefär 23 % av den administrerade dosen avlägsnades från kroppen under en standard 3-timmars hemodialysprocedur.
Effekt av nedsatt leverfunktion (cirros)
Absorptionen var något minskad och elimineringen oförändrad hos patienter med cirros. Medelvärdet för cefpodoxim T½ och renalt clearance hos cirrospatienter liknade de som erhölls i studier på friska försökspersoner. Ascites verkade inte påverka värden hos cirrospatienter. Ingen dosjustering rekommenderas för denna patientpopulation.
Farmakokinetik hos äldre personer
Äldre patienter behöver inte dosjusteringar om de inte har nedsatt njurfunktion. (Ser FÖRSIKTIGHETSÅTGÄRDER .) Hos friska geriatriska försökspersoner var halveringstiden för cefpodoxim i plasma i genomsnitt 4,2 timmar (mot 3,3 hos yngre försökspersoner) och urinåterhämtningen var i genomsnitt 21 % efter att en dos på 400 mg administrerats var 12:e timme. Andra farmakokinetiska parametrar (Cmax, AUC och Tmax) var oförändrade jämfört med de som observerades hos friska unga försökspersoner.
Mikrobiologi
Handlingsmekanism
Cefpodoxim är ett bakteriedödande medel som verkar genom att hämma syntesen av bakteriell cellvägg. Cefpodoxim har aktivitet i närvaro av vissa beta-laktamaser, både penicillinaser och cefalosporinaser, av gramnegativa och grampositiva bakterier.
Motståndsmekanism
Resistens mot Cefpodoxim sker främst genom hydrolys av betalaktamas, förändring av penicillinbindande proteiner (PBP) och minskad permeabilitet.
Cefpodoxim har visat sig vara aktivt mot de flesta isolat av följande bakterier, både in vitro och vid kliniska infektioner som beskrivs i avsnittet Indikationer och användning (1):
Grampositiva bakterier
Staphylococcus aureus (meticillinkänsliga stammar, inklusive de som producerar penicillinaser) Staphylococcus saprophyticus Streptococcus pneumoniae (exklusive penicillinresistenta isolat) Streptococcus pyogenes
Gramnegativa bakterier
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (inklusive beta-laktamasproducerande isolat) Moraxella catarrhalis Neisseria gonorrhoeae (inklusive penicillinasproducerande isolat)
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Minst 90 procent av följande mikroorganismer uppvisar en in vitro minsta hämmande koncentration (MIC) som är mindre än eller lika med den känsliga brytpunkten för Cefpodoxim. Effekten av Cefpodoxim vid behandling av kliniska infektioner på grund av dessa mikroorganismer har dock inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Grampositiva bakterier
Streptococcus agalactiae Streptococcus spp. (Grupp C, F, G)
Gramnegativa bakterier
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Anaeroba grampositiva bakterier
Peptostreptokocker magnus
Testmetoder för känslighet
När det är tillgängligt ska det kliniska mikrobiologiska laboratoriet tillhandahålla läkaren resultaten av in vitro-känslighetstestresultat för antimikrobiella läkemedel som används på inhemska sjukhus som periodiska rapporter som beskriver känslighetsprofilen för nosokomiala och samhällsförvärvade patogener. Dessa rapporter bör hjälpa läkaren att välja ett antibakteriellt läkemedel för behandling.
Spädningstekniker
Kvantitativa metoder används för att bestämma antimikrobiella minimala hämmande koncentrationer (MIC). Dessa MIC ger uppskattningar av bakteriers känslighet för antimikrobiella föreningar. MIC bör bestämmas med hjälp av en standardiserad testmetod. MIC-värdena ska tolkas enligt kriterierna i Tabell 1.
Diffusionstekniker
Kvantitativa metoder som kräver mätning av zondiametrar ger också reproducerbara uppskattningar av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken ger en uppskattning av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken bör bestämmas med en standardiserad testmetod. Denna procedur använder pappersskivor impregnerade med 10 mcg Cefpodoxime för att testa mikroorganismers känslighet för Cefpodoxim. Tolkningskriterierna för diskdiffusion finns i tabell 1.
En rapport om Mottaglig indikerar att det antimikrobiella medlet sannolikt kommer att hämma tillväxten av patogenen om den antimikrobiella föreningen når den koncentration på infektionsstället som är nödvändig för att hämma tillväxten av patogenen. En rapport om Intermediate indikerar att resultatet bör anses tvetydigt, och om mikroorganismen inte är fullt mottaglig för alternativa, kliniskt genomförbara läkemedel, bör testet upprepas. Denna kategori innebär möjlig klinisk tillämpbarhet på kroppsställen där läkemedlet är fysiologiskt koncentrerat eller i situationer där en hög dos av läkemedel kan användas. Denna kategori ger också en buffertzon som förhindrar att små okontrollerade tekniska faktorer orsakar stora tolkningsskillnader. En rapport om resistent indikerar att det antimikrobiella medlet sannolikt inte kommer att hämma tillväxten av patogenen om den antimikrobiella föreningen når de koncentrationer som vanligtvis kan uppnås på infektionsstället; annan terapi bör väljas.
Kvalitetskontroll
Standardiserade förfaranden för känslighetstest kräver användning av laboratoriekontroller för att övervaka och säkerställa noggrannheten och precisionen hos förråd och reagenser som används i analysen, och teknikerna för den individ som utför testet1,2,3. Standard Cefpodoxim-pulver bör ge följande intervall av MIC-värden som anges i Tabell 2. För diffusionstekniken med 10 mcg-skivan bör kriterierna i Tabell 2 uppnås.
Kliniska tester
Cystit
I två dubbelblinda, 2:1 randomiserade, jämförande studier utförda på vuxna i USA, jämfördes cefpodoximproxetil med andra betalaktamantibiotika. I dessa studier erhölls följande bakterieutrotningshastigheter 5 till 9 dagar efter behandlingen:
dessa studier var den kliniska botningsfrekvensen och den bakteriella utrotningsfrekvensen för cefpodoximproxetil jämförbar med jämförelsemedlen; emellertid var den kliniska botningsfrekvensen och den bakteriologiska utrotningsfrekvensen lägre än de som observerades med vissa andra klasser av godkända medel för cystit.
Studier av akut otitis media
I kontrollerade studier av akut otitis media utförda i USA, där betydande andelar betalaktamasproducerande organismer hittades, jämfördes cefpodoximproxetil med cefixim. I dessa studier, med användning av mycket strikta utvärderingskriterier och mikrobiologiska och kliniska svarskriterier vid 4 till 21 dagars efterbehandlingsuppföljning, erhölls följande presumtiva bakteriella utrotning/kliniska framgångsresultat (botade och förbättrade).
REFERENSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder för utspädning Antimikrobiella känslighetstester för bakterier som växer aerobt; Godkänd standard - nionde upplagan. CLSI-dokument M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
2. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiell känslighetstestning; Tjugotredje informationstillägg, CLSI-dokument M100-S23. CLSI-dokument M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2013.
3. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiella diskdiffusionskänslighetstest; Godkänd standard - elfte upplagan av CLSI-dokument M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
PATIENTINFORMATION
Patienter bör informeras om att antibakteriella läkemedel inklusive VANTIN endast bör användas för att behandla bakteriella infektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När VANTIN ordineras för att behandla en bakteriell infektion, bör patienterna informeras om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med VANTIN eller andra antibakteriella läkemedel i framtiden.
Diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
