Duricef 250mg, 500mg Cefadroxil Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Duricef och hur används det?
Duricef (cefadroxil) är ett cefalosporinantibiotikum som används för att behandla många olika typer av infektioner orsakade av bakterier. Varumärket Duricef har upphört och cefadroxil finns tillgängligt i generisk form.
Vilka är biverkningarna av Duricef?
Vanliga biverkningar av Duricef (cefadroxil) inkluderar:
- magbesvär eller smärta,
- illamående,
- kräkningar,
- diarre,
- stela eller spända muskler,
- ledvärk,
- känner sig rastlös eller hyperaktiv,
- ovanlig eller obehaglig smak i munnen,
- klåda eller hudutslag, eller
- vaginal klåda eller flytningar.
Tala om för din läkare om du har osannolika men mycket allvarliga biverkningar av Duricef (cefadroxil) inklusive:
- ihållande illamående eller kräkningar,
- gulnande ögon eller hud,
- mörk urin,
- nya tecken på infektion (t.ex. ihållande ont i halsen eller feber),
- lätta blåmärken eller blödningar,
- förändringar i mängden urin, eller
- mentala/humörförändringar (som förvirring).
BESKRIVNING
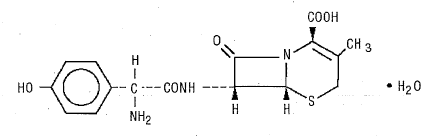
DURICEF (cefadroxil) är ett semisyntetiskt cefalosporinantibiotikum avsett för oral administrering. Det är ett vitt till gulvitt kristallint pulver. Det är lösligt i vatten och det är syrastabilt. Det är kemiskt betecknat som 5-tia-l-azabicyklo[4.2.0]okt-2-en-2-karboxylsyra, 7-[[amino(4-hydroxifenyl)acetyl]amino]-3-metyl-8-oxo -, monohydrat[6R-[6a,7p(R*)]]-. Den har formeln C16H17N3O5S•H20 och molekylvikten 381,40. Den har följande strukturformel:
DURICEF (cefadroxil) filmdragerade tabletter, 1 g, innehåller följande inaktiva ingredienser: mikrokristallin cellulosa, hydroxipropylmetylcellulosa, magnesiumstearat, polyetylenglykol, polysorbat 80, simetikonemulsion och titandioxid.
DURICEF (cefadroxil) för oral suspension innehåller följande inaktiva ingredienser: FD&C Yellow No. 6, smakämnen (naturliga och artificiella), polysorbat 80, natriumbensoat, sackaros och xantangummi.
DURICEF (cefadroxil) kapslar innehåller följande inaktiva ingredienser: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, gelatin, magnesiumstearat och titandioxid.
INDIKATIONER
DURICEF (cefadroxil) är indicerat för behandling av patienter med infektion orsakad av mottagliga stammar av de angivna organismerna i följande sjukdomar:
Urinvägsinfektioner orsakade av E. coli; P. mirabilis och Klebsiella-arter.
Hud- och hudstrukturinfektioner orsakade av stafylokocker och/eller streptokocker.
Faryngit och/eller tonsillit orsakad av Streptococcus pyogenes (Grupp A beta-hemolytiska streptokocker).
Notera: Endast penicillin via intramuskulär administrering har visat sig vara effektivt vid profylax av reumatisk feber. DURICEF (cefadroxil) är generellt effektivt vid utrotning av streptokocker från orofarynx. Data som fastställer effekten av DURICEF (cefadroxil) för profylax av efterföljande reumatisk feber finns dock inte tillgängliga.
Notera: Odlings- och känslighetstest bör initieras före och under behandlingen. Njurfunktionsstudier bör utföras när så är indicerat.
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten av DURICEF (cefadroxil) och andra antibakteriella läkemedel, bör DURICEF (cefadroxil) endast användas för att behandla eller förebygga infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
DURICEF (cefadroxil) är syrastabilt och kan administreras oralt utan hänsyn till måltider. Administrering med mat kan vara till hjälp för att minska potentiella gastrointestinala besvär som ibland är förknippade med oral cefalosporinbehandling.
Vuxna
Urinvägsinfektion: För okomplicerade nedre urinvägsinfektioner (dvs cystit) är den vanliga dosen 1 eller 2 g per dag i en enstaka (qd) eller uppdelade doser (bid).
För alla andra urinvägsinfektioner är den vanliga dosen 2 g per dag i uppdelade doser (bid).
Hud- och hudstrukturinfektioner: För hud- och hudstrukturinfektioner är den vanliga dosen 1 g per dag i enstaka (qd) eller uppdelade doser (bid).
Faryngit och tonsillit: Behandling av grupp A beta-hemolytisk streptokockfaryngit och tonsillit-1 g per dag i enstaka (qd) eller uppdelade doser (bid) i 10 dagar.
Barn
För urinvägsinfektioner är den rekommenderade dagliga dosen för barn 30 mg/kg/dag i uppdelade doser var 12:e timme. För faryngit, tonsillit och impetigo är den rekommenderade dagliga dosen för barn 30 mg/kg/dag i en engångsdos eller i lika uppdelade doser var 12:e timme. För andra hud- och hudstrukturinfektioner är den rekommenderade dagliga dosen 30 mg/kg/dag i lika uppdelade doser var 12:e timme. Vid behandling av beta-hemolytiska streptokockinfektioner bör en terapeutisk dos av DURICEF (cefadroxil) administreras i minst 10 dagar.
Se diagram för total daglig dos för barn.
Nedsatt njurfunktion
Hos patienter med nedsatt njurfunktion bör dosen av cefadroxilmonohydrat justeras enligt kreatininclearancehastigheter för att förhindra ackumulering av läkemedel. Följande schema föreslås. Hos vuxna är startdosen 1000 mg DURICEF (cefadroxil) och underhållsdosen (baserat på kreatininclearance-hastigheten [ml/min/1,73 M2]) är 500 mg vid de tidsintervall som anges nedan.
Patienter med kreatininclearance-hastigheter över 50 ml/min kan behandlas som om de vore patienter med normal njurfunktion.
HUR LEVERERAS
DURICEF® (cefadroxil monohydrat, USP) 500 mg kapslar: ogenomskinliga, rödbruna och vita hårda gelatinkapslar, märkta med "PPP" och "784" på ena änden och med "DURICEF (cefadroxil) " och "500 mg" i andra änden .
Kapslar levereras enligt följande:
N 0430-0780-19...................Flaska med 50 st
Förvara i kontrollerad rumstemperatur 15° - 30° C (59° - 86° F).
DURICEF® (cefadroxil) 1 gram Tabletter: vita till benvita, delad topp, oval formad, präglad med "PPP" på ena sidan av den halverade delen och "785" på den andra sidan av den halverade delen. Tabletter levereras enligt följande:
N 0430-0781-19...................Flaska med 50 st
Förvara i kontrollerad rumstemperatur 15° - 30° C (59° - 86° F).
DURICEF® (cefadroxil) för oral suspension är apelsin-ananassmaksatt och levereras enligt följande:
250mg/5mL................................N 0430-2782-15 50 mL flaska
Före beredning: Förvaras i kontrollerad rumstemperatur 15° - 30° C (59° - 86° F).
Tillverkad av Bristol-Myers Squibb Co. Princeton, NJ 08543. För Warner Chilcott Company, Inc. Fajardo, PR 00738. Marknadsförs av Warner Chilcott (US), Inc. Rockaway, NJ 07866. Reviderad april 2007. FDA Rev date: 6/ 5/2007
BIEFFEKTER
Gastrointestinala
Symtom på pseudomembranös kolit kan uppträda under eller efter antibiotikabehandling (se VARNINGAR ). Dyspepsi, illamående och kräkningar har rapporterats i sällsynta fall. Diarré har också förekommit.
Överkänslighet
Allergier (i form av hudutslag, urtikaria, angioödem och klåda) har observerats. Dessa reaktioner avtar vanligtvis vid utsättande av läkemedlet. Anafylaxi har också rapporterats.
Övrig
Andra reaktioner har inkluderat leverdysfunktion inklusive kolestas och förhöjda serumtransaminaser, genital pruritus, genital moniliasis, vaginit, måttlig övergående neutropeni, feber. Agranulocytos, trombocytopeni, idiosynkratisk leversvikt, erythema multiforme, Stevens-Johnsons syndrom, serumsjuka och artralgi har rapporterats i sällsynta fall.
Utöver de ovan listade biverkningarna som har observerats hos patienter som behandlats med cefadroxil, har följande biverkningar och ändrade laboratorietester rapporterats för antibiotika av cefalosporinklass:
Toxisk epidermal nekrolys, buksmärta, superinfektion, njurdysfunktion, toxisk nefropati, aplastisk anemi, hemolytisk anemi, blödning, förlängd protrombintid, positivt Coombs-test, ökad BUN, ökat kreatinin, förhöjt alkaliskt fosfatasAST, förhöjt aminofosfatas, förhöjd aminosyra. alaninaminotransferas (ALT), förhöjt bilirubin, förhöjt LDH, eosinofili, pancytopeni, neutropeni.
Flera cefalosporiner har varit inblandade i att utlösa anfall, särskilt hos patienter med nedsatt njurfunktion, när dosen inte reducerats (se DOSERING OCH ADMINISTRERING samt ÖVERDOSERING ). Om anfall i samband med läkemedelsbehandling uppstår ska läkemedlet avbrytas. Antikonvulsiv behandling kan ges om det är kliniskt indicerat.
LÄKEMEDELSINTERAKTIONER
Interaktioner med läkemedel/laboratorietest
Positiva direkta Coombs tester har rapporterats under behandling med cefalosporinantibiotika. I hematologiska studier eller i transfusions-korsmatchningsprocedurer när antiglobulin-tester utförs på den mindre sidan eller vid Coombs testning av nyfödda vars mödrar har fått cefalosporinantibiotika före förlossningen, bör det erkännas att ett positivt Coombs-test kan bero på läkemedel.
VARNINGAR
INNAN BEHANDLING MED DURICEF (cefadroxil) INSTITUERAS BÖR NOGGRANT UNDERSÖKNING GÖRAS för att avgöra OM PATIENTEN HAR HAFT TIDIGARE HYPERSENSITIVITETSREAKTIONER PÅ CEFADROXTL, CEFALOSPORINER, PENICILLINER,. OM DENNA PRODUKT SKA GES TILL PENICILLINKÄNSLIGA PATIENTER BÖR FÖRSIKTIGHET IAKTTAGAS EFTERSOM KORSKÄNSLIGHET BLAND BETA-LACTAM ANTIBIOTIKA HAR TYDLIGT DOKUMENTERATS OCH KAN FINNAS I UPP TILL EN 10 % AV UP TILL 10 % STORA ANTIBIOTIKA.
OM EN ALLERGISK REAKTION PÅ DURICEF (cefadroxil) uppstår, AVBRYT DRYCKET. ALLVARLIGA AKUTA HÖJKÄNSLIGHETSREAKTIONER KAN KRÄVA BEHANDLING MED EPINEFRIN OCH ANDRA NÖDÅTGÄRDER, INKLUSIVE SYRE, INTRAVENÖSA VÄTSKOR, INTRAVENÖSA ANTIHISTAMINER, KORTIKOSTEROIDER, PRESSMÅL, PRESSMÅL OCH LUFTSLUTSAT.
Clostridium difficile associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive DURICEF (cefadroxil), och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CD AD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CD AD måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann medicinsk historia är nödvändig eftersom CD AD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CD AD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör inledas enligt klinisk indikation.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
DURICEF (cefadroxil) ska användas med försiktighet i närvaro av markant försämrad njurfunktion (kreatininclearance-hastighet på mindre än 50 ml/min/1,73 M2). (Ser DOSERING OCH ADMINISTRERING .) Hos patienter med känd eller misstänkt nedsatt njurfunktion bör noggrann klinisk observation och lämpliga laboratoriestudier göras före och under behandlingen.
Att förskriva DURICEF (cefadroxil) i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation kommer sannolikt inte att ge patienten någon nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Långvarig användning av DURICEF (cefadroxil) kan resultera i överväxt av känsliga organismer. Noggrann observation av patienten är avgörande. Om superinfektion inträffar under behandlingen bör lämpliga åtgärder vidtas.
DURICEF (cefadroxil) bör förskrivas med försiktighet till personer med anamnes på gastrointestinala sjukdomar, särskilt kolit.
Karcinogenes, mutagenes och försämring av fertilitet
Inga långtidsstudier har utförts för att fastställa cancerframkallande potential. Inga genetiska toxicitetstester har utförts.
Graviditet: Graviditetskategori B
Reproduktionsstudier har utförts på möss och råttor i doser upp till 11 gånger den humana dosen och har inte visat några tecken på nedsatt fertilitet eller fostret skada på grund av cefadroxilmonohydrat. Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Arbete och leverans
DURICEF (cefadroxil) har inte studerats för användning under förlossning och förlossning. Behandling bör endast ges om det är tydligt nödvändigt.
Ammande mödrar
Försiktighet bör iakttas när cefadroxilmonohydrat ges till en ammande mamma.
Pediatrisk användning
(Ser DOSERING OCH ADMINISTRERING. )
Geriatrisk användning
Av cirka 650 patienter som fick cefadroxil för behandling av urinvägsinfektioner i tre kliniska prövningar var 28 % 60 år och äldre, medan 16 % var 70 år och äldre. Av cirka 1 000 patienter som fick cefadroxil för behandling av hud- och hudstrukturinfektioner i 14 kliniska prövningar var 12 % 60 år och äldre medan 4 % var 70 år och äldre. Inga övergripande skillnader i säkerhet observerades mellan de äldre patienterna i dessa studier och yngre patienter. Kliniska studier av cefadroxil för. behandling av faryngit eller tonsillit inkluderade inte tillräckligt många patienter 65 år och äldre för att avgöra om de svarar annorlunda än yngre patienter. Annan rapporterad klinisk erfarenhet av cefadroxil har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
Cefadroxil utsöndras till stor del via njurarna, och dosjustering är indicerad för patienter med nedsatt njurfunktion (se DOSERING OCH ADMINISTRERING: Nedsatt njurfunktion ). Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen.
ÖVERDOS
En studie av barn under sex år antydde att intag av mindre än 250 mg/kg cefalosporiner inte är associerat med signifikanta resultat. Ingen åtgärd krävs annat än allmänt stöd och observation. För mängder större än 250 mg/kg, inducera magtömning.
Hos fem anuriska patienter visades det att i genomsnitt 63 % av en oral dos på 1 g extraheras från kroppen under en 6-8 timmars hemodialyssession.
KONTRAINDIKATIONER
DURICEF (cefadroxil) är kontraindicerat till patienter med känd allergi mot cefalosporingruppen av antibiotika.
KLINISK FARMAKOLOGI
DURICEF (cefadroxil) absorberas snabbt efter oral administrering. Efter engångsdoser på 500 mg och 1000 mg var den genomsnittliga maximala serumkoncentrationen cirka 16 respektive 28 |ag/ml. Mätbara nivåer var närvarande 12 timmar efter administrering. Över 90 % av läkemedlet utsöndras oförändrat i urinen inom 24 timmar. Maximala urinkoncentrationer är cirka 1800 pg/ml under perioden efter en oral engångsdos på 500 mg. Dosökningar ger i allmänhet en proportionell ökning av DURICEF (cefadroxilmonohydrat, USP) urinkoncentration. Antibiotikakoncentrationen i urinen, efter en 1 g dos, hölls väl över MIC för känsliga urinvägspatogener i 20 till 22 timmar.
Mikrobiologi
In vitro-tester visar att cefalosporinerna är bakteriedödande på grund av deras hämning av cellväggssyntes. Cefadroxil har visat sig vara aktivt mot följande organismer både in vitro och vid kliniska infektioner (se INDIKATIONER ):
Beta-hemolytiska streptokocker Stafylokocker, inklusive penicillinasproducerande stammar Streptococcus (Diplococcus) pneumoniae Escherichia coli Proteus mirabilis Klebsiella arter Moraxella (Branhamella) catarrhalis
Notera: De flesta stammar av Entervcoccus faecalis (tidigare Streptococcus faecalis) och Enterococcus faecium (tidigare Streptococcus faecium) är resistenta mot DURICEF (cefadroxil). Det är inte aktivt mot de flesta stammar av Enterobacter-arter, Morganella morganii (tidigare Proteus morganii) och P. vulgaris. Den har ingen aktivitet mot Pseudomonas-arter och Acinetobacter calcoaceticus (tidigare Mima- och Herellea-arter).
Känslighetstester: Diffusionstekniker
Användningen av antibiotiska diskkänslighetstestmetoder som mäter zondiameter ger en exakt uppskattning av antibiotikakänslighet. En sådan standardprocedur1 som har rekommenderats för användning med diskar för att testa organismers mottaglighet för cefadroxil använder cefalosporinklassen (cefalotin). Tolkning involverar korrelationen av diametrarna som erhålls i disktestet med den lägsta hämmande koncentrationen (MIC) för cefadroxil.
Rapporter från laboratoriet som ger resultat från standardtestet för känslighet på en skiva med en 30 µg cefalotinskiva ska tolkas enligt följande kriterier:
En rapport om "känslig" indikerar att patogenen sannolikt kommer att hämmas av allmänt uppnåbara blodnivåer. En rapport om "mellanliggande känslighet" antyder att organismen skulle vara mottaglig om höga doser används eller om infektionen är begränsad till vävnad och vätskor (t.ex. urin) i vilka höga antibiotikanivåer uppnås. En rapport om "Resistent" indikerar att det är osannolikt att uppnåbara koncentrationer av antibiotikan är "hämmande" och annan terapi bör väljas.
Standardiserade procedurer kräver användning av laboratoriekontrollorganismer. 30 µg cefalotinskivan ska ge följande zondiametrar:
Spädningstekniker
Vid användning av NCCLS-agarspädnings- eller buljongutspädningsmetod (inklusive mikrospädning)2 eller motsvarande, kan ett bakterieisolat anses mottagligt om MIC-värdet (minimum hämmande koncentration) för cefalotin är 8 µg/ml eller mindre. Organismer anses vara resistenta om MIC är 32 µg/ml eller högre. Organismer med ett MIC-värde på mindre än 32 µg/mL men större än 8 µg/ml är mellanliggande.
Liksom med vanliga diffusionsmetoder kräver utspädningsförfaranden användning av laboratoriekontrollorganismer. Standardcefalotinpulver bör ge MIC-värden inom intervallet 0,12 µg/ml och 0,5 µg/ml för Staphylococcus aureus ATCC 29213. Vox Escherichia coli ATCC 25922, MIC-intervallet bör vara mellan 4,0 µg/mL och µ1,0 mL. För Streptococcus faecalis ATCC 29212 bör MIC-intervallet vara mellan 8,0 och 32,0 µg/ml.
REFERENSER
1. National Committee for Clinical Laboratory Standards, Approved Standard, Performance Standards for Antimicrobial Disk Susceptibility Test, 4th Edition, Vol. 10 (7): M2-A4, Villanova, PA, april 1990.
2. National Committee for Clinical Laboratory Standards, Approved Standard: Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, 2nd Edition, Vol. 10 (8): M7-A2, Villanova, PA, april 1990.
PATIENTINFORMATION
Patienter bör informeras om att antibakteriella läkemedel inklusive DURICEF (cefadroxil) endast bör användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När DURICEF (cefadroxil) ordineras för att behandla en bakteriell infektion, bör patienterna få veta att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela terapiförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med DURICEF (cefadroxil) eller andra antibakteriella läkemedel i framtiden .
Diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
