Omnicef 300mg Cefdinir Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Omnicef och hur används det?
Omnicef (cefdinir) är ett cefalosporinantibiotikum som används för att behandla många olika typer av infektioner orsakade av bakterier. Varumärket Omnicef har upphört i USA Omnicef finns tillgängligt i generisk form.
Vilka är sidoeffekterna av Omnicef?
Vanliga biverkningar av Omnicef 300mg inkluderar:
- diarre,
- illamående,
- kräkningar,
- magont,
- dålig matsmältning,
- huvudvärk,
- yrsel,
- blöjutslag hos ett spädbarn som tar flytande cefdinir,
- klåda, eller
- hudutslag,
Notera: Denna lista kanske inte inkluderar alla möjliga biverkningar.
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos OMNICEF 300mg och andra antibakteriella läkemedel, ska OMNICEF endast användas för att behandla eller förebygga infektioner som är bevisade eller starkt misstänkta vara orsakade av bakterier.
BESKRIVNING
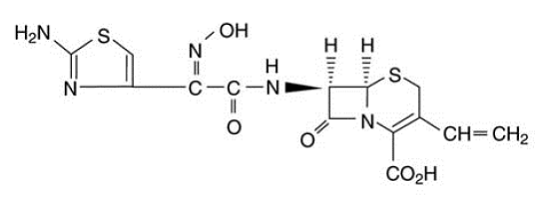
OMNICEF (cefdinir) kapslar och OMNICEF (cefdinir) för oral suspension innehåller den aktiva ingrediensen cefdinir, ett halvsyntetiskt cefalosporin med utökat spektrum, för oral administrering. Kemiskt sett är cefdinir [6R-[6a, 7β (Z)]]-7-[[(2-amino-4-tiazolyl)(hydroxiimino)acetyl]amino]3-etenyl-8-oxo-5-tia-1 -azabicyklo[4.2.0]okt-2-en-2-karboxylsyra. Cefdinir är ett vitt till svagt brungult fast ämne. Det är svagt lösligt i utspädd saltsyra och svårlösligt i 0,1 M pH 7,0 fosfatbuffert. Den empiriska formeln är C14H13N5O5S2 och molekylvikten är 395,42. Cefdinir har strukturformeln som visas nedan:
OMNICEF 300 mg kapslar innehåller 300 mg cefdinir och följande inaktiva ingredienser: karboximetylcellulosa kalcium, NF; polyoxyl 40 stearat, NF; och magnesiumstearat, NF. Kapselskalen innehåller FD&C Blue #1; FD&C Röd #40; D&C Röd #28; titandioxid, NF; gelatin, NF; kiseldioxid, NF; och natriumlaurylsulfat, NF.
OMNICEF 300 mg för oral suspension, efter beredning, innehåller 125 mg cefdinir per 5 ml eller 250 mg cefdinir per 5 ml och följande inaktiva ingredienser: sackaros, NF; citronsyra, USP; natriumcitrat, USP; natriumbensoat, NF; xantangummi, NF; guargummi, NF; konstgjorda jordgubbs- och gräddsmaker; kiseldioxid, NF; och magnesiumstearat, NF.
INDIKATIONER
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos OMNICEF 300mg och andra antibakteriella läkemedel, ska OMNICEF 300mg endast användas för att behandla eller förebygga infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
OMNICEF (cefdinir) kapslar och OMNICEF (cefdinir) för oral suspension är indicerade för behandling av patienter med milda till måttliga infektioner orsakade av mottagliga stammar av de angivna mikroorganismerna under tillstånden listade nedan.
Vuxna och tonåringar
Samhällsförvärvad lunginflammation
orsakad av Haemophilus influenzae (inklusive β-laktamasproducerande stammar), Haemophilus parainfluenzae (inklusive β-laktamasproducerande stammar), Streptococcus pneumoniae (endast penicillinkänsliga stammar) och Moraxella catlacarrhalis-producerande (β-lactamase-producerande) Kliniska studier ).
Akuta exacerbationer av kronisk bronkit
orsakad av Haemophilus influenzae (inklusive β-laktamasproducerande stammar), Haemophilus parainfluenzae (inklusive β-laktamasproducerande stammar), Streptococcus pneumoniae (endast penicillinkänsliga stammar) och Moraxella catarrhalis-stammar (β-lactarrhalis-stammar).
Akut maxillär bihåleinflammation
orsakas av Haemophilus influenzae (inklusive β-laktamasproducerande stammar), Streptococcus pneumoniae (endast penicillinkänsliga stammar) och Moraxella catarrhalis (inklusive βlaktamasproducerande stammar).
NOTERA: För information om användning hos pediatriska patienter, se Pediatrisk användning och DOSERING OCH ADMINISTRERING .
Faryngit/Tonsillit
orsakad av Streptococcus pyogenes (se Kliniska studier ).
NOTERA: Cefdinir är effektivt för att utrota S. pyogenes från orofarynx. Cefdinir har dock inte studerats för att förebygga reumatisk feber efter S. pyogenes faryngit/tonsillit. Endast intramuskulärt penicillin har visat sig vara effektivt för att förebygga reumatisk feber.
Okomplicerade hud- och hudstrukturinfektioner
orsakas av Staphylococcus aureus (inklusive β-laktamasproducerande stammar) och Streptococcus pyogenes.
Pediatriska patienter
Akut bakteriell otitis media orsakas av Haemophilus influenzae (inklusive β-laktamasproducerande stammar), Streptococcus pneumoniae (endast penicillinkänsliga stammar) och Moraxella catarrhalis (inklusive β-laktamasproducerande stammar).
Faryngit/Tonsillit
orsakad av Streptococcus pyogenes (se Kliniska studier ).
NOTERA: Cefdinir är effektivt för att utrota S. pyogenes från orofarynx. Cefdinir har dock inte studerats för att förebygga reumatisk feber efter S. pyogenes faryngit/tonsillit. Endast intramuskulärt penicillin har visat sig vara effektivt för att förebygga reumatisk feber.
Okomplicerade hud- och hudstrukturinfektioner
orsakas av Staphylococcus aureus (inklusive β-laktamasproducerande stammar) och Streptococcus pyogenes.
DOSERING OCH ADMINISTRERING
(ser INDIKATIONER OCH ANVÄNDNING för Indikerade patogener )
Kapslar
Rekommenderad dosering och behandlingslängd för infektioner hos vuxna och ungdomar beskrivs i följande diagram; den totala dagliga dosen för alla infektioner är 600 mg. Dosering en gång dagligen i 10 dagar är lika effektiv som två gånger dagligen. Dosering en gång dagligen har inte studerats vid lunginflammation eller hudinfektioner; därför ska OMNICEF kapslar administreras två gånger dagligen vid dessa infektioner. OMNICEF kapslar kan tas utan hänsyn till måltider.
Vuxna och ungdomar (ålder 13 år och äldre)
Pulver för oral suspension
Rekommenderad dosering och behandlingslängd för infektioner hos pediatriska patienter beskrivs i följande diagram; den totala dagliga dosen för alla infektioner är 14 mg/kg, upp till en maximal dos på 600 mg per dag. Dosering en gång dagligen i 10 dagar är lika effektiv som två gånger dagligen. Dosering en gång dagligen har inte studerats vid hudinfektioner; därför bör OMNICEF 300 mg för oral suspension administreras två gånger dagligen vid denna infektion. OMNICEF för oral suspension kan administreras utan hänsyn till måltider.
Pediatriska patienter (ålder 6 månader till 12 år)
OMNICEF FÖR ORAL SUSPENSION PEDIATRISK DOSSKEMA
Patienter med njurinsufficiens
För vuxna patienter med kreatininclearance
Kreatininclearance är svårt att mäta hos polikliniska patienter. Följande formel kan dock användas för att uppskatta kreatininclearance (CLcr) hos vuxna patienter. För att uppskattningarna ska vara giltiga, bör serumkreatininnivåerna återspegla steady-state nivåer av njurfunktion.
där kreatininclearance är i ml/min, ålder är i år, vikt är i kilogram och serumkreatinin är i mg/dL,4
Följande formel kan användas för att uppskatta kreatininclearance hos pediatriska patienter:
CLcr = K × kroppslängd eller höjd/serumkreatinin
där K = 0,55 för pediatriska patienter äldre än 1 år5 och 0,45 för spädbarn (upp till 1 år)6.
I ovanstående ekvation är kreatininclearance i ml/min/1,73 m², kroppslängd eller höjd i centimeter och serumkreatinin i mg/dL.
För pediatriska patienter med ett kreatininclearance på
Patienter på hemodialys
Hemodialys tar bort cefdinir från kroppen. Hos patienter som hålls i kronisk hemodialys är den rekommenderade initiala doseringsregimen en dos på 300 mg eller 7 mg/kg varannan dag.
Vid slutet av varje hemodialys bör 300 mg (eller 7 mg/kg) ges. Efterföljande doser (300 mg eller 7 mg/kg) administreras sedan varannan dag.
Instruktioner för blandning av Omnicef 300mg för oral suspension
Efter blandning kan suspensionen förvaras i rumstemperatur (25°C/77°F). Behållaren ska förvaras väl tillsluten och suspensionen ska skakas väl före varje administrering. Suspensionen får användas i 10 dagar, varefter eventuell oanvänd del måste kasseras.
HUR LEVERERAS
OMNICEF kapslar , som innehåller 300 mg cefdinir, som lavendel- och turkosa kapslar präglade med produktnamnet, finns tillgängliga enligt följande:
60 kapslar/flaska NDC 0074-3769-60 OMNI-PAC™ kartong med 3-bruksenheter, 5-dagars, 10-kapslar blisterkort NDC 0074-3769-30
OMNICEF 300mg för oral suspension är en krämfärgad pulverformulering som, när den rekonstitueras enligt anvisningarna, innehåller 125 mg cefdinir/5 ml eller 250 mg cefdinir/5 ml. De rekonstituerade suspensionerna har en krämfärgad och jordgubbssmak. Pulvret finns tillgängligt enligt följande:
125 mg/5 ml
60 ml flaskor NDC 0074-3771-60 100 ml flaskor NDC 0074-3771-13 250 mg/5 mL 60 mL flaskor NDC 0074-6151-60 100 ml flaskor NDC 0074-6151-13
Förvara kapslarna och det osuspenderade pulvret vid 25°C (77°F); utflykter tillåtna till 15°-30°C (59°-86°F) [se USP kontrollerad rumstemperatur]. Efter rekonstituering kan den orala suspensionen förvaras i kontrollerad rumstemperatur i 10 dagar.
Tillverkad av: CEPH International Corporation Carolina, Puerto Rico 00986. För: AbbVie Inc., North Chicago, IL 60064, USA, under licens från: Astellas Pharma Inc. Tokyo, Japan. Reviderad nov 2015
BIEFFEKTER
Biverkningar
Kliniska prövningar - OMNICEF kapslar (vuxna och ungdomar)
I kliniska prövningar behandlades 5093 vuxna och ungdomar (3841 US och 1252 icke-US) med den rekommenderade dosen av cefdinirkapslar (600 mg/dag). De flesta biverkningarna var milda och självbegränsande. Inga dödsfall eller permanenta funktionshinder tillskrevs cefdinir. Hundrafyrtiosju av 5093 (3%) patienter avbröt medicineringen på grund av biverkningar som utredarna trodde var möjligen, troligen eller definitivt förknippade med cefdinirbehandling. Utsättningarna gällde främst gastrointestinala störningar, vanligtvis diarré eller illamående. Nitton av 5 093 (0,4 %) patienter avbröts på grund av utslag i samband med administrering av cefdinir.
I USA ansågs följande biverkningar av utredarna vara möjligen, troligen eller definitivt relaterade till cefdinirkapslar i kliniska prövningar med flera doser (N = 3841 cefdinirbehandlade patienter):
BIVERKNINGAR SOM associeras med CEFDINIR-KAPSLAR USA-FÖRSÖKNINGAR PÅ VUXNA OCH TONGDOMAR PATIENTER (N = 3841)a
Följande laboratorievärdeförändringar av möjlig klinisk signifikans, oberoende av samband med terapi med cefdinir, sågs under kliniska prövningar utförda i USA:
LABORATORIEVÄRDEFÖRÄNDRINGAR OBSERVERADE MED CEFDINIR-KAPSLAR USA-FÖRSÖK PÅ VUXNA OCH UNGDOMAR PATIENTER (N = 3841)
Kliniska prövningar - OMNICEF för oral suspension (pediatriska patienter)
kliniska prövningar behandlades 2289 pediatriska patienter (1783 US och 506 icke-US) med den rekommenderade dosen av cefdinirsuspension (14 mg/kg/dag). De flesta biverkningarna var milda och självbegränsande. Inga dödsfall eller permanenta funktionshinder tillskrevs cefdinir. 40 av 2289 (2 %) patienter avbröt medicineringen på grund av biverkningar som av utredarna ansågs vara möjligen, troligen eller definitivt associerade med cefdinirbehandling. Utsättningar berodde främst på gastrointestinala störningar, vanligtvis diarré. Fem av 2289 (0,2 %) patienter avbröts på grund av utslag relaterade till administrering av cefdinir.
I USA ansågs följande biverkningar av utredarna vara möjligen, troligen eller definitivt relaterade till cefdinirsuspension i kliniska prövningar med flera doser (N = 1783 cefdinirbehandlade patienter):
BIVERKNINGAR I samband med CEFDINIR SUSPENSION USA FÖRSÖK PÅ PEDIATRISKA PATIENTER (N = 1783)a
OBS: Hos både cefdinir- och kontrollbehandlade patienter var frekvensen av diarré och utslag högre hos de yngsta pediatriska patienterna. Incidensen av diarré hos cefdinirbehandlade patienter ≤ 2 år var 17 % (95/557) jämfört med 4 % (51/1226) hos patienter > 2 år gamla. Incidensen av utslag (främst blöjutslag hos yngre patienter) var 8 % (43/557) hos patienter ≤ 2 år jämfört med 1 % (8/1226) hos patienter > 2 år.
Följande laboratorievärdeförändringar av möjlig klinisk signifikans, oberoende av samband med terapi med cefdinir, sågs under kliniska prövningar utförda i USA:
LABORATORIEVÄRDEÄNDRINGAR AV MÖJLIG KLINISK SIGNIFIKANS OBSERVERADE MED CEFDINIR SUSPENSION USA-FÖRSÖKNINGAR PÅ PEDIATRISKA PATIENTER (N = 1783)
Erfarenhet efter marknadsföring
Följande negativa upplevelser och förändrade laboratorietester, oavsett deras förhållande till cefdinir, har rapporterats under omfattande erfarenheter efter marknadsföring, som började med godkännande i Japan 1991: chock, anafylaxi med sällsynta fall av dödsfall, ansikts- och larynxödem, kvävningskänsla, serumsjukeliknande reaktioner, konjunktivit, stomatit, Stevens-Johnsons syndrom, toxisk epidermal nekrolys, exfoliativ dermatit, erythema multiforme, erythema nodosum, akut hepatit, kolestas, fulminant hepatit, leversvikt, gulsot, ökad amyloaras i blodet, ökad blodpropp. hemorragisk kolit, melena, pseudomembranös kolit, pancytopeni, granulocytopeni, leukopeni, trombocytopeni, idiopatisk trombocytopenisk purpura, hemolytisk anemi, akut andningssvikt, astmatisk attack, läkemedelsinducerad lunginflammation, eosinofilisk pneumoni, eosinofil pneumonia, idiopatyneal pneumoni, eosinofil pneumoni, idiopatyneal pneumoni. blödningsbenägenhet, koagulationsdis ordning, spridd intravaskulär koagulation, övre GI-blödning, magsår, ileus, medvetslöshet, allergisk vaskulit, möjlig cefdinir-diklofenak-interaktion, hjärtsvikt, bröstsmärtor, hjärtinfarkt, hypertoni, ofrivilliga rörelser och rabdomyolys.
Biverkningar av cefalosporinklass
Följande biverkningar och ändrade laboratorietester har rapporterats för antibiotika av cefalosporinklass i allmänhet:
Allergiska reaktioner, anafylaxi, Stevens-Johnsons syndrom, erythema multiforme, toxisk epidermal nekrolys, njurdysfunktion, toxisk nefropati, leverdysfunktion inklusive kolestas, aplastisk anemi, hemolytisk anemi, blödning, urinvägspositivt test, urinärtspositivt test, psykiatriskt blodprov, aplastisk anemi. . Pseudomembranös kolit symtom kan börja under eller efter antibiotikabehandling (se VARNINGAR ).
Flera cefalosporiner har varit inblandade i att utlösa anfall, särskilt hos patienter med nedsatt njurfunktion när dosen inte reducerats (se DOSERING OCH ADMINISTRERING och ÖVERDOSERING ). Om anfall i samband med läkemedelsbehandling uppstår ska läkemedlet avbrytas. Antikonvulsiv behandling kan ges om det är kliniskt indicerat.
LÄKEMEDELSINTERAKTIONER
Antacida (innehållande aluminium eller magnesium)
Samtidig administrering av 300 mg cefdinirkapslar med 30 ml Maalox® TC suspension minskar absorptionshastigheten (Cmax) och graden (AUC) med cirka 40 %. Tiden för att nå Cmax förlängs också med 1 timme. Det finns inga signifikanta effekter på cefdinirs farmakokinetik om antacida administreras 2 timmar före eller 2 timmar efter cefdinir. Om antacida krävs under behandling med OMNICEF 300 mg, ska OMNICEF 300 mg tas minst 2 timmar före eller efter antacida.
Probenecid
Som med andra β-laktamantibiotika hämmar probenecid den renala utsöndringen av cefdinir, vilket resulterar i en ungefärlig fördubbling av AUC, en 54 % ökning av maximala cefdinirplasmanivåer och en 50 % förlängning av den skenbara elimineringen t½.
Järntillskott och livsmedel berikade med järn
Samtidig administrering av cefdinir med ett terapeutiskt järntillskott innehållande 60 mg elementärt järn (som FeSO4) eller vitaminer kompletterat med 10 mg elementärt järn minskade absorptionsgraden med 80% respektive 31%. Om järntillskott krävs under behandling med OMNICEF 300 mg, ska OMNICEF tas minst 2 timmar före eller efter tillskottet.
Effekten av livsmedel som är starkt berikade med elementärt järn (främst järnberikade frukostflingor) på cefdinirabsorptionen har inte studerats.
Samtidig administrering av järnberikad modersmjölksersättning (2,2 mg elementärt järn/6 oz) har ingen signifikant effekt på cefdinirs farmakokinetik. Därför kan OMNICEF för oral suspension administreras med järnberikad modersmjölksersättning.
Det har förekommit rapporter om rödaktig avföring hos patienter som fått cefdinir. I många fall fick patienterna även järnhaltiga produkter. Den rödaktiga färgen beror på bildandet av ett icke-absorberbart komplex mellan cefdinir eller dess nedbrytningsprodukter och järn i mag-tarmkanalen.
Interaktioner med läkemedel/laboratorietest
En falsk-positiv reaktion för ketoner i urinen kan uppstå med tester med nitroprussid, men inte med de som använder nitroferricyanid. Administrering av cefdinir kan resultera i en falsk-positiv reaktion för glukos i urinen med Clinitest®, Benedicts lösning eller Fehlings lösning. Det rekommenderas att glukostester baserade på enzymatiska glukosoxidasreaktioner (som Clinistix® eller Tes-Tape®) används. Cefalosporiner är kända för att ibland inducera ett positivt direkt Coombs test.
VARNINGAR
INNAN BEHANDLING MED OMNICEF (CEFDINIR) INSTITUERAS BÖR NOGGRANT UNDERSÖKNING GÖRAS FÖR ATT AVSTÄLLA OM PATIENTEN HAR HAFT TIDIGARE HYPERSENSITIVITETSREAKTIONER MOT CEFDINIR, ANDRA CEFALOSPORINER, PENICILLER. OM CEFDINIR SKA GES TILL PENICILLINKÄNSLIGA PATIENTER, BÖR FÖRSIKTIGHET IAKTTAGAS EFTERSOM KORSHYPERKÄNSLIGHET BLAND β-LAKTAMANTIBIOTIKA HAR TYDLIGT DOKUMENTERATS OCH KAN FÖRKOMMA FRÅN 10 % AV TIDEN FÖR EN PHI. OM EN ALLERGISK REAKTION PÅ CEFDINIR FÖREKOMMER BÖR DRYCKET AVSLUTA. ALLVARLIGA AKUTA HÖJKÄNSLIGHETSREAKTIONER KAN KRÄVA BEHANDLING MED EPINEFRIN OCH ANDRA NÖDÅTGÄRDER, INKLUSIVE SYRE, INTRAVENÖSA VÄTSKOR, INTRAVENÖSA ANTIHISTAMINER, KORTIKOSTEROIDER, PRESSMÅL, PRESSMÅL OCH LUFTSLUTSAT.
Clostridium difficile associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive OMNICEF, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibakteriell användning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibakteriell användning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibakteriell behandling av C. difficile och kirurgisk utvärdering bör inledas som kliniskt indicerat.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Att förskriva OMNICEF 300 mg i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation kommer sannolikt inte att ge patienten någon nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Som med andra bredspektrumantibiotika kan långvarig behandling resultera i eventuell uppkomst och överväxt av resistenta organismer. Noggrann observation av patienten är avgörande. Om superinfektion inträffar under behandlingen bör lämplig alternativ behandling ges.
Cefdinir bör, liksom med andra bredspektrumantimikrobiella medel (antibiotika), förskrivas med försiktighet till personer med en historia av kolit.
Hos patienter med övergående eller ihållande njurinsufficiens (kreatininclearance DOSERING OCH ADMINISTRERING ).
Karcinogenes, Mutagenes, Nedsatt fertilitet
Den karcinogena potentialen för cefdinir har inte utvärderats. Inga mutagena effekter sågs i den bakteriella omvända mutationsanalysen (Ames) eller punktmutationsanalysen vid hypoxantin-guanin-fosforibosyltransferas-lokuset (HGPRT) i V79 kinesisk hamster-lungceller. Inga klastogena effekter observerades in vitro i analysen av strukturell kromosomavvikelse i V79 kinesisk hamster-lungceller eller in vivo i mikronukleusanalysen i benmärg hos mus. Hos råttor påverkades inte fertiliteten och reproduktionsförmågan av cefdinir vid orala doser upp till 1000 mg/kg/dag (70 gånger den mänskliga dosen baserat på mg/kg/dag, 11 gånger baserat på mg/m²/dag).
Graviditet
Teratogena effekter
Graviditetskategori B
Cefdinir var inte teratogent hos råttor vid orala doser upp till 1000 mg/kg/dag (70 gånger den mänskliga dosen baserat på mg/kg/dag, 11 gånger baserat på mg/m²/dag) eller hos kaniner vid orala doser upp till 10 mg/kg/dag (0,7 gånger den mänskliga dosen baserat på mg/kg/dag, 0,23 gånger baserat på mg/m²/dag). Maternell toxicitet (minskad kroppsviktsökning) observerades hos kaniner vid den maximalt tolererade dosen på 10 mg/kg/dag utan negativa effekter på avkomman. Minskad kroppsvikt inträffade hos råttfoster vid ≥ 100 mg/kg/dag och hos råttavkomma vid ≥ 32 mg/kg/dag. Inga effekter observerades på moderns reproduktionsparametrar eller avkommans överlevnad, utveckling, beteende eller reproduktionsfunktion.
Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Arbete och leverans
Cefdinir har inte studerats för användning under förlossning och förlossning.
Ammande mödrar
Efter administrering av engångsdoser på 600 mg upptäcktes inte cefdinir i human bröstmjölk.
Pediatrisk användning
Säkerhet och effekt hos nyfödda och spädbarn yngre än 6 månader har inte fastställts. Användning av cefdinir för behandling av akut maxillär bihåleinflammation hos pediatriska patienter (åldern 6 månader till 12 år) stöds av bevis från adekvata och välkontrollerade studier på vuxna och ungdomar, liknande patofysiologi för akut bihåleinflammation hos vuxna och pediatriska patienter, och jämförande farmakokinetiska data i den pediatriska populationen.
Geriatrisk användning
Effekten är jämförbar hos geriatriska patienter och yngre vuxna. Medan cefdinir har tolererats väl i alla åldersgrupper, upplevde geriatriska patienter i kliniska prövningar en lägre frekvens av biverkningar, inklusive diarré, än yngre vuxna. Dosjustering hos äldre patienter är inte nödvändig om inte njurfunktionen är markant nedsatt (se DOSERING OCH ADMINISTRERING ).
ÖVERDOS
Information om överdosering av cefdinir hos människor finns inte tillgänglig. I akuta gnagartoxicitetsstudier gav en engångsdos på 5600 mg/kg inga negativa effekter. Toxiska tecken och symtom efter överdosering med andra β-laktamantibiotika har inkluderat illamående, kräkningar, epigastrisk besvär, diarré och kramper. Hemodialys tar bort cefdinir från kroppen. Detta kan vara användbart i händelse av en allvarlig toxisk reaktion från överdosering, särskilt om njurfunktionen är nedsatt.
KONTRAINDIKATIONER
OMNICEF (cefdinir) är kontraindicerat hos patienter med känd allergi mot cefalosporinklassen av antibiotika.
KLINISK FARMAKOLOGI
Farmakokinetik och läkemedelsmetabolism
Absorption
Oral biotillgänglighet
Maximala plasmakoncentrationer av cefdinir inträffar 2 till 4 timmar efter administrering av kapsel eller suspension. Plasmakoncentrationerna av cefdinir ökar med dosen, men ökningarna är mindre än dosproportionella från 300 mg (7 mg/kg) till 600 mg (14 mg/kg). Efter administrering av suspension till friska vuxna är cefdinirs biotillgänglighet 120 % jämfört med kapslar. Beräknad biotillgänglighet för cefdinirkapslar är 21 % efter administrering av en 300 mg kapseldos och 16 % efter administrering av en 600 mg kapseldos. Beräknad absolut biotillgänglighet för cefdinirsuspension är 25 %. Cefdinir oral suspension på 250 mg/5 ml styrka visades vara bioekvivalent med styrkan 125 mg/5 ml hos friska vuxna under fastande förhållanden.
Effekten av mat
Cmax och AUC för cefdinir från kapslarna minskas med 16 % respektive 10 % när de ges tillsammans med en måltid med hög fetthalt. Hos vuxna som fått 250 mg/5 ml oral suspension tillsammans med en måltid med hög fetthalt minskas Cmax och AUC för cefdinir med 44 % respektive 33 %. Omfattningen av dessa minskningar är sannolikt inte kliniskt signifikanta eftersom säkerhets- och effektstudier av oral suspension hos pediatriska patienter utfördes utan hänsyn till födointag. Därför kan cefdinir tas utan hänsyn till mat.
Cefdinir kapslar
Cefdinirs plasmakoncentrationer och farmakokinetiska parametervärden efter administrering av orala engångsdoser på 300 och 600 mg av cefdinir till vuxna individer presenteras i följande tabell:
Genomsnittlig (± SD) plasma Cefdinir farmakokinetiska parametervärden efter administrering av kapslar till vuxna försökspersoner
Cefdinir suspension
Cefdinirs plasmakoncentrationer och farmakokinetiska parametervärden efter administrering av enstaka 7- och 14 mg/kg orala doser av cefdinir till pediatriska försökspersoner (ålder 6 månader-12 år) presenteras i följande tabell:
Genomsnittlig (± SD) plasma Cefdinir farmakokinetiska parametervärden efter administrering av suspension till pediatriska försökspersoner
Multipel dosering
Cefdinir ackumuleras inte i plasma efter administrering en eller två gånger dagligen till patienter med normal njurfunktion.
Distribution
Den genomsnittliga distributionsvolymen (Vdarea) av cefdinir hos vuxna är 0,35 l/kg (± 0,29); hos pediatriska försökspersoner (ålder 6 månader-12 år) är cefdinir Vdarea 0,67 l/kg (± 0,38). Cefdinir är 60 % till 70 % bundet till plasmaproteiner hos både vuxna och pediatriska patienter; bindning är oberoende av koncentration.
Hudblåsa
Hos vuxna försökspersoner observerades median (intervall) maximal blistervätska cefdinirkoncentrationer på 0,65 (0,33-1,1) och 1,1 (0,49-1,9) μg/ml 4 till 5 timmar efter administrering av 300- respektive 600 mg doser. Medelvärden (± SD) Cmax och AUC (0-∞) för blister var 48 % (± 13) och 91 % (± 18) av motsvarande plasmavärden.
Tonsilvävnad
Hos vuxna patienter som genomgår elektiv tonsillektomi var respektive medianhalt av cefdinir i tonsillvävnad 4 timmar efter administrering av engångsdoser på 300 och 600 mg 0,25 (0,220,46) och 0,36 (0,22-0,80) μg/g. Medelkoncentrationen av tonsillvävnad var 24 % (± 8) av motsvarande plasmakoncentrationer.
Sinus vävnad
Hos vuxna patienter som genomgår elektiv maxillär och etmoid sinuskirurgi var respektive mediankoncentration av cefdinir i sinusvävnad 4 timmar efter administrering av engångsdoser på 300 och 600 mg
Lungvävnad
Hos vuxna patienter som genomgår diagnostisk bronkoskopi var respektive mediankoncentration av bronkial mukosa cefdinir 4 timmar efter administrering av engångsdoser på 300 och 600 mg 0,78 (
Mellanörat vätska
Hos 14 pediatriska patienter med akut bakteriell otitis media var respektive mediankoncentration av cefdinir i mellanörat vätska 3 timmar efter administrering av engångsdoser på 7 och 14 mg/kg 0,21 (
CSF
Data om penetration av cefdinir i human cerebrospinalvätska finns inte tillgängliga.
Metabolism och utsöndring
Cefdinir metaboliseras inte nämnvärt. Aktiviteten beror främst på moderläkemedlet. Cefdinir elimineras huvudsakligen via renal utsöndring med en genomsnittlig plasmaelimineringshalveringstid (t½) på 1,7 (± 0,6) timmar. Hos friska försökspersoner med normal njurfunktion är njurclearance 2,0 (± 1,0) ml/min/kg, och skenbart oralt clearance är 11,6 (± 6,0) och 15,5 (± 5,4) ml/min/kg efter doser på 300- och 600 -mg, respektive. Genomsnittlig procentandel av dosen som återvinns oförändrad i urinen efter 300- och 600 mg-doser är 18,4 % (± 6,4) respektive 11,6 % (± 4,6). Cefdinir-clearance är reducerat hos patienter med nedsatt njurfunktion (se Särskilda populationer - Patienter med njurinsufficiens ).
Eftersom renal utsöndring är den dominerande elimineringsvägen, bör dosen justeras till patienter med markant nedsatt njurfunktion eller som genomgår hemodialys (se DOSERING OCH ADMINISTRERING ).
Särskilda populationer
Patienter med njurinsufficiens
Cefdinirs farmakokinetik undersöktes hos 21 vuxna försökspersoner med varierande grad av njurfunktion. Minskning av cefdinir-elimineringshastighet, skenbart oralt clearance (CL/F) och renalt clearance var ungefär proportionellt mot minskningen av kreatininclearance (CLcr). Som ett resultat var plasmakoncentrationerna av cefdinir högre och kvarstod längre hos personer med nedsatt njurfunktion än hos personer utan nedsatt njurfunktion. Hos patienter med CLcr mellan 30 och 60 ml/min ökade Cmax och t½ med cirka 2 gånger och AUC cirka 3 gånger. Hos försökspersoner med CLcr DOSERING OCH ADMINISTRERING ).
Hemodialys
Cefdinirs farmakokinetik studerades hos 8 vuxna försökspersoner som genomgick hemodialys. Dialys (4 timmars varaktighet) avlägsnade 63 % av cefdinir från kroppen och minskade skenbar eliminering t½ från 16 (± 3,5) till 3,2 (± 1,2) timmar. Dosjustering rekommenderas för denna patientpopulation (se DOSERING OCH ADMINISTRERING ).
Leversjukdom
Eftersom cefdinir huvudsakligen elimineras genom njurarna och inte metaboliseras nämnvärt, utfördes inga studier på patienter med nedsatt leverfunktion. Det förväntas inte att dosjustering kommer att krävas i denna population.
Geriatriska patienter
Effekten av ålder på cefdinirs farmakokinetik efter en engångsdos på 300 mg utvärderades hos 32 försökspersoner i åldern 19 till 91 år. Systemisk exponering för cefdinir ökade avsevärt hos äldre försökspersoner (N = 16), Cmax med 44 % och AUC med 86 %. Denna ökning berodde på en minskning av clearance av cefdinir. Den skenbara distributionsvolymen reducerades också, varför inga märkbara förändringar i skenbar eliminering t½ observerades (äldre: 2,2 ± 0,6 timmar vs unga: 1,8 ± 0,4 timmar). Eftersom cefdinir-clearance har visats vara primärt relaterat till förändringar i njurfunktionen snarare än ålder, behöver inte äldre patienter dosjusteringar om de inte har markant nedsatt njurfunktion (kreatininclearance Patienter med njurinsufficiens, ovan ).
Kön och ras
Resultaten av en metaanalys av klinisk farmakokinetik (N = 217) indikerade ingen signifikant påverkan av vare sig kön eller ras på cefdinirs farmakokinetik.
Mikrobiologi
Handlingsmekanism
Som med andra cefalosporiner, är bakteriedödande aktivitet av cefdinir ett resultat av hämning av cellväggssyntes. Cefdinir är stabilt i närvaro av vissa, men inte alla, β-laktamasenzymer. Som ett resultat är många organismer som är resistenta mot penicilliner och vissa cefalosporiner mottagliga för cefdinir.
Motståndsmekanism
Resistens mot cefdinir är främst genom hydrolys av vissa β-laktamaser, förändring av penicillinbindande proteiner (PBP) och minskad permeabilitet. Cefdinir är inaktivt mot de flesta stammar av Enterobacter spp., Pseudomonas spp., Enterococcus spp., penicillinresistenta streptokocker och meticillinresistenta stafylokocker. β-laktamasnegativa, ampicillinresistenta (BLNAR) H. influenzae-stammar är vanligtvis inte mottagliga för cefdinir.
Antimikrobiell aktivitet
Cefdinir har visat sig vara aktivt mot de flesta stammar av följande mikroorganismer, både in vitro och vid kliniska infektioner som beskrivs i INDIKATIONER OCH ANVÄNDNING .
Gram-positiva bakterier
Staphylococcus aureus (endast meticillinkänsliga stammar) Streptococcus pneumoniae (endast penicillinkänsliga stammar) Streptococcus pyogenes
Gram-negativa bakterier
Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd.
Cefdinir uppvisar in vitro lägsta hämmande koncentrationer (MIC) på 1 mcg/ml eller mindre mot (≥ 90%) stammar av följande mikroorganismer; dock har säkerheten och effektiviteten för cefdinir vid behandling av kliniska infektioner på grund av dessa mikroorganismer inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Gram-positiva bakterier
Staphylococcus epidermidis (endast meticillinkänsliga stammar) Streptococcus agalactiae Viridans grupp streptokocker
Gram-negativa bakterier
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Testmetoder för känslighet
När det är tillgängligt bör det kliniska mikrobiologiska laboratoriet tillhandahålla periodiska rapporter som beskriver den regionala/lokala känslighetsprofilen för potentiella nosokomiala och samhällsförvärvade patogener. Dessa rapporter bör hjälpa läkaren att välja ett antibakteriellt läkemedel för behandling.
Spädningstekniker
Kvantitativa metoder används för att bestämma antimikrobiella minimiinhibitoriska koncentrationer (MIC). Dessa MIC ger uppskattningar av bakteriers känslighet för antimikrobiella föreningar. MIC bör bestämmas med en standardiserad testmetod1 (buljong och/eller agar). MIC-värdena ska tolkas enligt kriterierna i Tabell 1.
Diffusionstekniker
Kvantitativa metoder som kräver mätning av zondiametrar ger också reproducerbara uppskattningar av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken bör bestämmas med en standardiserad metod.2 Förfarandet använder pappersskivor impregnerade med 5 mcg cefdinir för att testa bakteriers känslighet. Tolkningskriterierna för diskdiffusion finns i tabell 1.
Stafylokockers känslighet för cefdinir kan härledas från testning av penicillin och antingen cefoxitin eller oxacillin. Stafylokocker som är känsliga för oxacillin (cefoxitin) kan anses vara känsliga för cefdinir.3
En rapport om "känslig" indikerar att antimikrobiellt ämne sannolikt kommer att hämma tillväxten av patogenen om den antimikrobiella föreningen når de koncentrationer på infektionsstället som är nödvändiga för att hämma tillväxten av patogenen. En rapport med "Intermediate" indikerar att resultatet bör anses tvetydigt, och om mikroorganismen inte är fullt mottaglig för alternativa, kliniskt genomförbara läkemedel, bör testet upprepas. Denna kategori innebär möjlig klinisk tillämpbarhet på kroppsställen där läkemedlet är fysiologiskt koncentrerat eller i situationer där en hög dos av läkemedel kan användas. Denna kategori ger också en buffertzon som förhindrar att små okontrollerade tekniska faktorer orsakar stora tolkningsskillnader. En rapport om "Resistent" indikerar att det antimikrobiella medlet sannolikt inte kommer att hämma tillväxten av patogenen om den antimikrobiella föreningen når de koncentrationer som vanligtvis kan uppnås på infektionsplatsen; annan terapi bör väljas.
Kvalitetskontroll
Standardiserade förfaranden för känslighetstest kräver användning av laboratoriekontroller för att övervaka och säkerställa noggrannheten och precisionen hos tillbehör och reagenser som används i analysen, och teknikerna för individen som utför testet.1,2,3 Standard cefdinirpulver bör tillhandahålla följande intervall av MIC-värden enligt tabell 2. För diffusionstekniken med användning av en 5 mcg-skiva bör kriterierna i tabell 2 uppnås.
Kliniska studier
Samhällsförvärvad bakteriell lunginflammation
I en kontrollerad, dubbelblind studie på vuxna och ungdomar utförd i USA jämfördes cefdinir två gånger dagligen med cefaclor 500 mg tre gånger dagligen. Genom att använda strikt utvärderingsbarhet och mikrobiologiska/kliniska svarskriterier 6 till 14 dagar efter behandling erhölls följande kliniska botningsfrekvenser, presumtiva mikrobiologiska utrotningsfrekvenser och statistiska resultat:
US Community-Acquired Pneumonia Study Cefdinir vs Cefaclor
en andra kontrollerad, utredarblind studie på vuxna och ungdomar, som huvudsakligen genomfördes i Europa, jämfördes cefdinir två gånger dagligen med amoxicillin/klavulanat 500/125 mg tre gånger dagligen. Genom att använda strikta utvärderings- och kliniska svarskriterier 6 till 14 dagar efter behandling erhölls följande kliniska botningsfrekvenser, presumtiva mikrobiologiska utrotningsfrekvenser och statistiska resultat:
Europeiska gemenskapen förvärvad lunginflammationsstudie Cefdinir vs Amoxicillin/Clavulanat
Streptokockfaryngit/Tonsillit
fyra kontrollerade studier utförda i USA jämfördes cefdinir med 10 dagars penicillin hos vuxna, ungdomar och pediatriska patienter. Två studier (en på vuxna och ungdomar, den andra på pediatriska patienter) jämförde 10 dagar med cefdinir QD eller två gånger dagligen med penicillin 250 mg eller 10 mg/kg QID. Genom att använda strikt utvärderingsbarhet och mikrobiologiska/kliniska svarskriterier 5 till 10 dagar efter behandling erhölls följande kliniska botningsfrekvenser, mikrobiologiska utrotningsfrekvenser och statistiska resultat:
Studier av faryngit/tonsillit Cefdinir (10 dagar) vs penicillin (10 dagar)
Två studier (en på vuxna och ungdomar, den andra på pediatriska patienter) jämförde 5 dagar med cefdinir två gånger dagligen med 10 dagar med penicillin 250 mg eller 10 mg/kg QID. Genom att använda strikt utvärderingsbarhet och mikrobiologiska/kliniska svarskriterier 4 till 10 dagar efter behandling erhölls följande kliniska botningsfrekvenser, mikrobiologiska utrotningsfrekvenser och statistiska resultat:
Studier av faryngit/tonsillit Cefdinir (5 dagar) vs penicillin (10 dagar)
REFERENSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder för utspädning Antimikrobiella känslighetstester för bakterier som växer aerobt; Godkänd standard – tionde upplagan. CLSI Document M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiella diskdiffusionskänslighetstest; Godkänd standard – tolfte upplagan. CLSI Document M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiell känslighetstestning; Twenty-femth Informational Supplement, CLSI Document M100-S25 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Cockcroft DW, Gault MH. Förutsägelse av kreatininclearance från serumkreatinin. Nephron 1976;16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. En enkel uppskattning av glomerulär filtrationshastighet hos barn härledd från kroppslängd och plasmakreatinin. Pediatrics 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. En enkel uppskattning av glomerulär filtrationshastighet hos fullgångna spädbarn under det första levnadsåret. J Pediatrics 1984;104:849-54.
PATIENTINFORMATION
Patienter bör informeras om att antibakteriella läkemedel inklusive OMNICEF 300 mg endast bör användas för att behandla bakteriella infektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När OMNICEF 300 mg ordineras för att behandla en bakteriell infektion, bör patienterna informeras om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med OMNICEF 300 mg eller andra antibakteriella läkemedel i framtiden.
Antacida som innehåller magnesium eller aluminium stör absorptionen av cefdinir. Om denna typ av antacida krävs under behandling med OMNICEF 300 mg, ska OMNICEF tas minst 2 timmar före eller efter antacida.
Järntillskott, inklusive multivitaminer som innehåller järn, stör absorptionen av cefdinir. Om järntillskott krävs under behandling med OMNICEF 300 mg, ska OMNICEF tas minst 2 timmar före eller efter tillskottet.
Järnberikad modersmjölksersättning stör inte signifikant absorptionen av cefdinir. Därför kan OMNICEF 300 mg för oral suspension administreras med järnberikad modersmjölksersättning.
Diabetespatienter och vårdgivare bör vara medvetna om att den orala suspensionen innehåller 2,86 g sackaros per tesked.
Diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
