Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Cipro 750mg och hur används det?
Cipro 500mg är ett receptbelagt läkemedel som används för att behandla symtom på bakteriella infektioner. Cipro kan användas ensamt eller tillsammans med andra läkemedel.
Cipro tillhör en klass av läkemedel som kallas fluorokinoloner.
Det är inte känt om Cipro 750mg är säkert och effektivt för barn yngre än 1 år.
Vilka är möjliga biverkningar av Cipro?
Cipro kan orsaka allvarliga biverkningar inklusive:
- lågt blodsocker,
- huvudvärk,
- hunger,
- svettas,
- irritabilitet,
- yrsel,
- illamående,
- snabb puls,
- känner sig orolig eller skakig,
- domningar i händer, armar, ben eller fötter,
- svaghet,
- stickningar eller brännande smärta,
- nervositet,
- förvirring,
- agitation,
- paranoia,
- hallucinationer,
- minnesproblem,
- koncentrationssvårigheter,
- tankar på självmord,
- plötslig smärta,
- svullnad,
- blåmärken,
- ömhet,
- styvhet,
- rörelseproblem,
- knäpper eller knäpper i någon fog,
- svår eller konstant bröstsmärta, mage eller rygg,
- diarré som är vattnig eller blodig,
- fladdrande i ditt bröst,
- andnöd,
- yrsel,
- utslag,
- andningsproblem,
- lite eller ingen urinering,
- gulfärgning av huden eller ögonen,
- svår huvudvärk,
- ringer i dina öron,
- synproblem och
- smärta bakom ögonen
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Cipro 1000mg inkluderar:
- illamående,
- kräkningar,
- diarre,
- magont,
- vaginal klåda eller flytningar,
- huvudvärk och
- onormala leverfunktionstester
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Cipro. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
ALLVARLIGA BIVERKNINGAR INKLUSIVE TENDINIT, SENRUPTUR, PERIFER NEUROPATI, EFFEKTER AV CENTRALA NERVSYSTEMET OCH FÖRSVARNING AV MYASTHENIA GRAVIS
- Fluorokinoloner, inklusive Cipro 250 mg, har associerats med invalidiserande och potentiellt irreversibla allvarliga biverkningar som har inträffat tillsammans [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER], inklusive:
- Tendinit och senruptur [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- Perifer neuropati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- Effekter på centrala nervsystemet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
Avbryt Cipro 750 mg omedelbart och undvik användningen av fluorokinoloner, inklusive Cipro, hos patienter som upplever någon av dessa allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Fluorokinoloner, inklusive Cipro 750 mg, kan förvärra muskelsvaghet hos patienter med myasthenia gravis. Undvik Cipro hos patienter med känd historia av myasthenia gravis. [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- Eftersom fluorokinoloner, inklusive CIPRO 500 mg, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER], reservera CIPRO för användning till patienter som inte har några alternativa behandlingsalternativ för okomplicerade urinvägsinfektioner [se INDIKATIONER]
BESKRIVNING
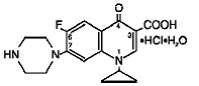
Cipro (cipro 750mgfloxacin*) tabletter med förlängd frisättning innehåller cipro 500mgfloxacin, ett syntetiskt antimikrobiellt medel för oral administrering. Cipro 1000mg tabletter är dragerade, tvåskiktstabletter som består av ett lager med omedelbar frisättning och ett lager med kontrollerad frisättning av erosionsmatristyp. Tabletterna innehåller en kombination av två typer av ciprofloxacinläkemedel, ciprofloxacinhydroklorid och ciprofloxacinbetain (bas). Cipro 750mgfloxacinhydroklorid är 1-cyklopropyl-6-fluor-1,4dihydro-4-oxo-7-(1-piperazinyl)-3-kinolinkarboxylsyrahydroklorid. Det tillhandahålls som en blandning av monohydratet och seskvihydratet. Den empiriska formeln för monohydratet är C17H18FN3O3. HCl. H2O och dess molekylvikt är 385,8. Den empiriska formeln för seskvihydratet är C17H18FN3O3. HCl. 1,5 H2O och dess molekylvikt är 394,8. Läkemedelssubstansen är en svagt gulaktig till ljusgul kristallin substans. Monohydratets kemiska struktur är som följer:
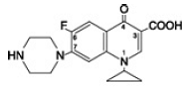
Cipro 1000mgfloxacin betain är 1-cyklopropyl-6-fluoro-1, 4-dihydro-4-oxo-7-(1-piperazinyl)-3-kinolinkarboxylsyra. Som ett hydrat är dess empiriska formel C17H18FN3O3. 3,5 H2O och dess molekylvikt är 394,3. Det är ett blekt gulaktigt till ljusgult kristallint ämne och dess kemiska struktur är som följer:
Cipro finns i tablettstyrkorna 500 mg och 1000 mg (cipro 500 mgfloxacin ekvivalent). Cipro tabletter är nästan vita till svagt gulaktiga, filmdragerade, avlånga tabletter. Varje Cipro 500 mg tablett innehåller 500 mg ciprofloxacin som ciprofloxacin HCl (287,5 mg, beräknat som ciprofloxacin på torkad basis) och cipro 1000mgfloxacin† (212,6 mg, beräknat på torkad basis). Varje Cipro 1000 mg tablett innehåller 1000 mg ciprofloxacin som ciprofloxacin HCl (574,9 mg, beräknat som ciprofloxacin på torkad basis) och cipro 750 mgfloxacin† (425,2 mg, beräknat på torkad basis). De inaktiva ingredienserna är krospovidon, hypromellos, magnesiumstearat, polyetylenglykol, kolloidal vattenfri kiseldioxid, bärnstenssyra och titandioxid.
* eftersom cipro 500mgfloxacin† och cipro 250mgfloxacinhydroklorid † inte överensstämmer med förlusten vid torkningstestet och rester vid antändningstest i USP-monografin.
INDIKATIONER
Hud Och Hudstruktur Infektioner
CIPRO 1000mg är indicerat till vuxna patienter för behandling av hud- och hudstrukturinfektioner orsakade av Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Proteus vulgaris, Providencia stuartii, Morganella morganii, Citrobacter freundomosai, a Staphylinosai, a Staphylinosai, a Staphylinosai, a Staphylinosai meticillinkänsliga Staphylococcus epidermidis eller Streptococcus pyogenes.
Ben Och Ledinfektioner
CIPRO 750mg är indicerat för vuxna patienter för behandling av ben- och ledinfektioner orsakade av Enterobacter cloacae, Serratia marcescens eller Pseudomonas aeruginosa.
Komplicerade intraabdominala infektioner
CIPRO 250 mg är indicerat till vuxna patienter för behandling av komplicerade intraabdominala infektioner (används i kombination med metronidazol) orsakade av Escherichia coli, Pseudomonas aeruginosa, Proteus mirabilis, Klebsiella pneumoniae eller Bacteroides fragilis.
Infektiös diarré
CIPRO 500mg är indicerat till vuxna patienter för behandling av infektiös diarré orsakad av Escherichia coli (enterotoxigena isolat), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri eller Shigella sonnei† när antibakteriell terapi är indicerad.
†Även om behandling av infektioner orsakade av denna organism i detta organsystem visade ett kliniskt signifikant resultat, studerades effekten hos färre än 10 patienter.
Tyfoidfeber (Enteric Fever)
CIPRO 1000mg är indicerat för vuxna patienter för behandling av tyfoidfeber (tarmfeber) orsakad av Salmonella typhi. Effekten av ciprofloxacin vid utrotning av kronisk tyfoidbärartillstånd har inte visats.
Okomplicerad cervikal och urinrörsgonorré
CIPRO är indicerat för vuxna patienter för behandling av okomplicerad cervikal och urethral gonorré på grund av Neisseria gonorrhoeae [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Inhalationsmjältbrand (efter exponering)
CIPRO 250 mg är indicerat för vuxna och pediatriska patienter från födseln till 17 års ålder för inhalationsmjältbrand (efter exponering) för att minska incidensen eller progressionen av sjukdom efter exponering för aerosoliserad Bacillus anthracis.
Serumkoncentrationer av cipro 500 mgfloxacin som uppnåtts hos människor tjänade som ett surrogateffektmått med rimlig sannolikhet för att förutsäga klinisk nytta och gav den initiala grunden för godkännande av denna indikation.1 Understödjande klinisk information för ciprofloxacin mot mjältbrand efter exponeringsprofylax erhölls under mjältbrandsbioterrorattackerna i oktober 2001 [se Kliniska studier ].
Plåga
CIPRO 1000mg är indicerat för behandling av pest, inklusive pneumonisk och septikemisk pest, på grund av Yersinia pestis (Y. pestis) och profylax mot pest hos vuxna och pediatriska patienter från födseln till 17 års ålder. Effektstudier av cipro 250mgfloxacin kunde inte utföras på människor med pest av genomförbarhetsskäl. Därför är denna indikation baserad på en effektstudie som endast utförts på djur [se Kliniska studier ].
Kronisk bakteriell prostatit
CIPRO är indicerat för vuxna patienter för behandling av kronisk bakteriell prostatit orsakad av Escherichia coli eller Proteus mirabilis.
Nedre luftvägsinfektioner
CIPRO 750mg är indicerat till vuxna patienter för behandling av nedre luftvägsinfektioner orsakade av Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa, Haemophilus influenzae, Haemophilus influenzae, Haemophilus pneumoniae.
CIPRO är inte ett förstahandsläkemedel vid behandling av förmodad eller bekräftad lunginflammation sekundär till Streptococcus pneumoniae.
CIPRO är indicerat för behandling av akuta exacerbationer av kronisk bronkit (AECB) orsakad av Moraxella catarrhalis.
Eftersom fluorokinoloner, inklusive CIPRO, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ] och för vissa patienter är AECB självbegränsande, reservera CIPRO 750 mg för behandling av AECB hos patienter som inte har några alternativa behandlingsalternativ.
Urinvägsinfektion
Urinvägsinfektioner hos vuxna
CIPRO 500mg är indicerat för vuxna patienter för behandling av urinvägsinfektioner orsakade av Escherichia coli, Klebsiella pneumoniae, Enterobacter cloacae, Serratia marcescens, Proteus mirabilis, Providencia rettgeri, Morganella morganii, Citrobacter metricomidosa, Stapinosauri, Stapinosauri, Stapinosauris, Plococil, Stapinosauris , Staphylococcus saprophyticus eller Enterococcus faecalis.
Akut okomplicerad cystit
CIPRO 750mg är indicerat till vuxna kvinnliga patienter för behandling av akut okomplicerad cystit orsakad av Escherichia coli eller Staphylococcus saprophyticus.
Eftersom fluorokinoloner, inklusive CIPRO, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ] och för vissa patienter är akut okomplicerad cystit självbegränsande, reservera CIPRO för behandling av akut okomplicerad cystit hos patienter som inte har några alternativa behandlingsalternativ.
Komplicerad urinvägsinfektion och pyelonefrit hos pediatriska patienter
CIPRO är indicerat för pediatriska patienter i åldern ett till 17 år för behandling av komplicerade urinvägsinfektioner (cUTI) och pyelonefrit orsakad av Escherichia coli [se Användning i specifika populationer ].
Även om det är effektivt i kliniska prövningar, är CIPRO inte ett förstahandsval i den pediatriska populationen på grund av en ökad förekomst av biverkningar jämfört med kontroller, inklusive reaktioner relaterade till leder och/eller omgivande vävnader. CIPRO 250 mg, liksom andra fluorokinoloner, är associerat med artropati och histopatologiska förändringar i viktbärande leder hos unga djur [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER , Användning i specifika populationer och Icke-klinisk toxikologi ].
Akut bihåleinflammation
CIPRO är indicerat för vuxna patienter för behandling av akut bihåleinflammation orsakad av Haemophilus influenzae, Streptococcus pneumoniae eller Moraxella catarrhalis.
Eftersom fluorokinoloner, inklusive CIPRO, har associerats med allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ] och för vissa patienter är akut bihåleinflammation självbegränsande, reservera CIPRO för behandling av akut bihåleinflammation hos patienter som inte har några alternativa behandlingsalternativ.
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos CIPRO 1000mg och andra antibakteriella läkemedel, ska CIPRO 500mg endast användas för att behandla eller förebygga infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
Om anaeroba organismer misstänks bidra till infektionen bör lämplig behandling ges. Lämpliga odlings- och känslighetstester bör utföras före behandling för att isolera och identifiera organismer som orsakar infektion och för att fastställa deras känslighet för ciprofloxacin. Behandling med CIPRO kan påbörjas innan resultaten av dessa tester är kända; När resultaten blir tillgängliga bör lämplig behandling fortsätta.
Som med andra läkemedel kan vissa isolat av Pseudomonas aeruginosa utveckla resistens ganska snabbt under behandling med cipro 1000mgfloxacin. Odlings- och känslighetstest som utförs regelbundet under behandlingen ger information inte bara om den terapeutiska effekten av det antimikrobiella medlet utan också om eventuell uppkomst av bakteriell resistens.
DOSERING OCH ADMINISTRERING
CIPRO 1000mg tabletter och oral suspension ska administreras oralt enligt beskrivningen i lämpliga tabeller för doseringsriktlinjer.
Dosering hos vuxna
Bestämningen av dosering och varaktighet för en viss patient måste ta hänsyn till infektionens svårighetsgrad och karaktär, känsligheten hos den orsakande mikroorganismen, integriteten hos patientens värdförsvarsmekanismer och statusen för njur- och leverfunktion. . CIPRO tabletter eller CIPRO för oral suspension kan administreras till vuxna patienter när det är kliniskt indicerat enligt läkarens bedömning. Administrera CIPRO för oral suspension med den samförpackade graderade skeden [se DOSERING OCH ADMINISTRERING ].
Konvertering av IV till oral dosering hos vuxna
Patienter vars behandling påbörjas med CIPRO IV kan bytas till CIPRO 750mg tabletter eller oral suspension när det är kliniskt indicerat enligt läkarens bedömning (tabell 2) [se KLINISK FARMAKOLOGI ].
Dosering hos pediatriska patienter
Dosering och initial behandlingsväg (det vill säga IV eller oral) för cUTI eller pyelonefrit bör bestämmas av infektionens svårighetsgrad. CIPRO ska administreras enligt beskrivningen i Tabell 3. Administrera CIPRO för oral suspension med hjälp av den samförpackade graderade skeden [se DOSERING OCH ADMINISTRERING ].
Dosändringar hos patienter med nedsatt njurfunktion
Cipro 250mgfloxacin elimineras främst genom renal utsöndring; men läkemedlet metaboliseras och elimineras delvis genom leverns gallsystem och genom tarmen. Dessa alternativa vägar för eliminering av läkemedel verkar kompensera för den minskade njurutsöndringen hos patienter med nedsatt njurfunktion. Icke desto mindre rekommenderas viss modifiering av doseringen, särskilt för patienter med allvarlig njurfunktionsnedsättning. Riktlinjer för dosering för patienter med nedsatt njurfunktion visas i Tabell 4.
När endast serumkreatininkoncentrationen är känd, kan följande formler användas för att uppskatta kreatininclearance:
Serumkreatininet bör representera ett stabilt tillstånd av njurfunktionen.
Hos patienter med svåra infektioner och gravt nedsatt njurfunktion kan en enhetsdos på 750 mg administreras med de intervall som anges ovan. Patienter bör övervakas noggrant.
Pediatriska patienter med måttlig till svår njurinsufficiens exkluderades från den kliniska prövningen av cUTI och pyelonefrit. Det finns ingen information tillgänglig om nödvändiga dosjusteringar för pediatriska patienter med måttlig till svår njurinsufficiens (dvs kreatininclearance
Viktiga administrationsinstruktioner
Med multivalenta katjoner
Administrera CIPRO minst 2 timmar före eller 6 timmar efter magnesium/aluminium antacida; polymera fosfatbindemedel (till exempel sevelamer, lantankarbonat) eller sukralfat; Videx® (didanosin) tuggbara/buffrade tabletter eller pediatriskt pulver för oral lösning; andra högbuffrade läkemedel; eller andra produkter som innehåller kalcium, järn eller zink.
Med mejeriprodukter
Samtidig administrering av CIPRO 500 mg med mejeriprodukter (som mjölk eller yoghurt) eller enbart kalciumberikade juicer bör undvikas eftersom minskad absorption är möjlig; CIPRO kan dock tas tillsammans med en måltid som innehåller dessa produkter.
Hydrering av patienter som får CIPRO
Säkerställ adekvat hydrering av patienter som får CIPRO 1000mg för att förhindra bildandet av högkoncentrerad urin. Kristalluri har rapporterats med kinoloner.
Instruera patienten om lämplig administrering av CIPRO 1000 mg [se Information om patientrådgivning ].
Missade doser
Om en dos glöms bort ska den tas när som helst men inte senare än 6 timmar före nästa schemalagda dos. Om det återstår mindre än 6 timmar innan nästa dos ska den missade dosen inte tas och behandlingen ska fortsätta enligt ordination med nästa schemalagda dos. Dubbla doser ska inte tas för att kompensera för en missad dos.
Dela CIPRO 1000mg tabletter
CIPRO 750 mg tabletter, 250 mg och 500 mg är tabletter med funktionella skåror som kan delas i hälften vid den skårade linjen för att ge en styrka på 125 mg respektive 250 mg.
Instruktioner för rekonstitution av CIPRO 500 mg mikrokapslar för oral suspension
CIPRO 750 mg oral suspension tillhandahålls i styrkorna 5 % (5 g ciprofloxacin i 100 ml) och 10 % (10 g cipro 750 mgfloxacin i 100 ml). CIPRO 250 mg oral suspension består av två komponenter (mikrokapslar och spädningsmedel) som måste kombineras innan dispensering.
Förberedelse av upphängningen
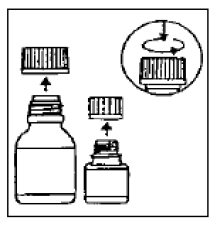
Steg 1
Den lilla flaskan innehåller mikrokapslarna, den stora flaskan innehåller spädningsmedlet.

Steg 2
Öppna båda flaskorna. Barnsäkert lock: Tryck ned enligt instruktionerna på locket samtidigt som du vrider åt vänster.

Steg 3
 Häll mikrokapslarna helt i den större flaskan med spädningsmedel. Tillsätt inte vatten till suspensionen .
Steg 4
 Ta bort det översta lagret av spädningsflaskans etikett (för att visa etiketten CIPRO 1000 mg oral suspension). Stäng den stora flaskan helt enligt anvisningarna på locket och skaka kraftigt i cirka 15 sekunder. Suspensionen är klar att användas.
Steg 5
Skriv utgångsdatumet för den rekonstituerade orala suspensionen på flaskans etikett.
Rekonstituerad produkt kan förvaras under 30°C (86°F) i 14 dagar. Skydda mot frysning.
Inga tillsatser bör göras till den blandade slutliga ciprofloxacinsuspensionen. CIPRO 1000mg oral suspension bör inte administreras genom matning eller NG (nasogastriska) sond på grund av dess fysiska egenskaper.
Administreringsinstruktioner för CIPRO För oral suspension efter beredning
- Skaka CIPRO 750 mg oral suspension kraftigt varje gång före användning i cirka 15 sekunder.
- Administrera CIPRO oral suspension med den samförpackade graderade teskeden som tillhandahålls för patienten (se figur 1)
Figur 1: Samförpackad 5 mL graderad tesked
Den samförpackade graderade teskeden (5 mL) medföljer, med markeringar för ½ (2,5 mL) och 1/1 (5 mL)
- Efter användning, rengör den graderade teskeden under rinnande vatten med diskmedel och torka ordentligt.
- Tugga inte mikrokapslarna i CIPRO 250 mg oral suspension, svälj dem istället hela.
- Vatten kan tas efteråt.
- Förslut flaskan ordentligt efter varje användning enligt instruktionerna på locket.
- Efter avslutad behandling ska CIPRO 1000mg oral suspension inte återanvändas.
Dosering av CIPRO för oral suspension med hjälp av den medförpackade skeden hos vuxna och pediatriska patienter
HUR LEVERERAS
Doseringsformer och styrkor
Tabletter
- 250 mg, lätt gulaktig, filmdragerad, rund, funktionell skåra, präglad med "BAYER" på ena sidan och "CIP 250" på den andra.
- 500 mg, lätt gulaktig, filmdragerad, kapselformad, funktionell skåra, präglad med "BAYER" på ena sidan och "CIP 500" på den andra.
Oral suspension
- % oral suspension: 250 mg cipro 750mgfloxacin per 5 ml efter beredning
- 10 % oral suspension: 500 mg cipro 250mgfloxacin per 5 ml efter beredning
Förvaring Och Hantering
CIPRO (cipro 750mgfloxacinhydroklorid) Tabletter finns som runda, lätt gulaktiga filmdragerade tabletter innehållande 250 mg cipro 500mgfloxacin. 250 mg tabletten är kodad med ordet "BAYER" på ena sidan och funktionell skåra och graverad med "CIP 250" på baksidan. CIPRO finns även som kapselformade, lätt gulaktiga filmdragerade tabletter innehållande 500 mg ciprofloxacin. 500 mg tabletten är kodad med ordet "BAYER" på ena sidan och funktionell skåra och graverad med "CIP 500" på baksidan. CIPRO 250 mg och 500 mg finns i flaskor med 100 stycken.
Förvara vid 20° till 25°C (68° till 77°F); utflykter tillåtna till 15° till 30°C (59° till 86°F) [se USP-kontrollerad rumstemperatur ].
CIPRO Oral Suspension levereras i styrkor på 5 % och 10 %. Läkemedlet är sammansatt av två komponenter (mikrokapslar som innehåller den aktiva ingrediensen och spädningsmedel) som måste blandas av apotekaren [se DOSERING OCH ADMINISTRERING ].
Förvara mikrokapslar och spädningsmedel under 25°C (77°F); utflykter är tillåtna från 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ]. Skydda mot frysning.
Den rekonstituerade produkten kan förvaras vid 25°C (77°F) i 14 dagar; utflykter är tillåtna från 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ]. Skydda mot frysning.
En graderad tesked (5 mL) med markeringarna ½ (2,5 mL) och 1/1 (5 mL) tillhandahålls för patienten.
REFERENSER
1. 21 CFR 314.510 (Subpart H – Accelererat godkännande av nya läkemedel för livshotande sjukdomar).
2. Friedman J, Polifka J. Teratogena effekter av läkemedel: en resurs för kliniker (TERIS). Baltimore, Maryland: Johns Hopkins University Press, 2000:149-195.
3. Loebstein R, Addis A, Ho E, et al. Graviditetsresultat efter graviditetsexponering för fluorokinoloner: en multicenter prospektiv kontrollerad studie. Antimikrobiska medel Kemother. 1998;42(6):1336-1339.
Tillverkad för: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Reviderad: nov 2021
BIEFFEKTER
Följande allvarliga och i övrigt viktiga biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Inaktiverande och potentiellt irreversibla allvarliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Tendinit och senbristning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Perifer neuropati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Centrala nervsystemets effekter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ] Exacerbation av Myasthenia Gravis [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Andra allvarliga och ibland dödliga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Risk för aortaaneurysm och dissektion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarliga biverkningar med samtidig teofyllin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Clostridioides difficile-associerad diarré [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Förlängning av QT-intervallet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Muskuloskeletala sjukdomar hos pediatriska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Fotosensitivitet/fototoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Utveckling av läkemedelsresistenta bakterier [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Vuxna patienter
Under kliniska undersökningar med oral och parenteral CIPRO 750 mg fick 49 038 patienter kurer med läkemedlet.
De vanligast rapporterade biverkningarna, från kliniska prövningar av alla formuleringar, alla doser, alla läkemedelsbehandlingslängder och för alla indikationer på ciprofloxacinbehandling var illamående (2,5 %), diarré (1,6 %), onormala leverfunktionstester (1,3 %). ), kräkningar (1 %) och utslag (1 %).
I randomiserade, dubbelblinda kontrollerade kliniska studier som jämförde CIPRO-tabletter [500 mg två gånger dagligen (BID)] med cefuroximaxetil (250 mg–500 mg BID) och med klaritromycin (500 mg BID) hos patienter med luftvägsinfektioner, visade CIPRO en biverkningsprofil för CNS som är jämförbar med kontrollläkemedlen.
Pediatriska patienter
Kort (6 veckor) och långvarig (1 år) muskuloskeletal och neurologisk säkerhet för oral/intravenös ciprofloxacin jämfördes med ett cefalosporin för behandling av cUTI eller pyelonefrit hos pediatriska patienter 1 till 17 år (medelålder 6 ± 4 år) ) i en internationell multicenterförsök. Behandlingstiden var 10 till 21 dagar (medelbehandlingslängden var 11 dagar med ett intervall på 1 till 88 dagar). Totalt 335 cipro 250mgfloxacin- och 349 jämförelsebehandlade patienter inkluderades.
En oberoende pediatrisk säkerhetskommitté (IPSC) granskade alla fall av muskuloskeletala biverkningar inklusive onormal gång eller onormal ledundersökning (baslinje eller behandlingsuppkommande). Inom 6 veckor efter behandlingsstart var frekvensen av muskuloskeletala biverkningar 9,3 % (31/335) i den cipro 750 mgfloxacinbehandlade gruppen jämfört med 6 % (21/349) hos patienter behandlade med jämförelseläkemedel. Alla muskuloskeletala biverkningar som inträffade inom 6 veckor försvann (klinisk upplösning av tecken och symtom), vanligtvis inom 30 dagar efter avslutad behandling. Radiologiska utvärderingar användes inte rutinmässigt för att bekräfta upplösningen av biverkningarna. Cipro 500 mgfloxacin-behandlade patienter var mer benägna att rapportera mer än en biverkning och vid mer än ett tillfälle jämfört med kontrollpatienter. Frekvensen av muskuloskeletala biverkningar var genomgående högre i ciprofloxacingruppen jämfört med kontrollgruppen i alla åldersundergrupper. Vid slutet av 1 år var frekvensen av dessa biverkningar som rapporterades när som helst under den perioden 13,7 % (46/335) i den cipro 250 mgfloxacinbehandlade gruppen jämfört med 9,5 % (33/349) hos de patienter som behandlades med jämförelseläkemedlet ( Tabell 9).
Incidensen av neurologiska biverkningar inom 6 veckor efter behandlingsstart var 3 % (9/335) i CIPRO-gruppen jämfört med 2 % (7/349) i jämförelsegruppen och inkluderade yrsel, nervositet, sömnlöshet och somnolens.
denna studie var den totala förekomsten av biverkningar inom 6 veckor efter behandlingsstart 41 % (138/335) i cipro 250mgfloxacingruppen jämfört med 31 % (109/349) i jämförelsegruppen. De vanligaste biverkningarna var gastrointestinala: 15 % (50/335) av ciprofloxacinpatienterna jämfört med 9 % (31/349) av jämförelsepatienterna. Allvarliga biverkningar sågs hos 7,5 % (25/335) av ciprofloxacinbehandlade patienter jämfört med 5,7 % (20/349) av kontrollpatienterna. Utsättning av läkemedel på grund av en biverkning observerades hos 3 % (10/335) av ciprofloxacinbehandlade patienter jämfört med 1,4 % (5/349) av jämförelsepatienter. Andra biverkningar som inträffade hos minst 1 % av ciprofloxacinpatienterna var diarré 4,8 %, kräkningar 4,8 %, buksmärtor 3,3 %, dyspepsi 2,7 %, illamående 2,7 %, feber 2,1 %, astma 1,8 % och utslag 1,8 %.
Korttidssäkerhetsdata för cipro 1000mgfloxacin samlades också in i en randomiserad, dubbelblind klinisk prövning för behandling av akuta pulmonella exacerbationer hos patienter med cystisk fibros (5–17 år). Sextiosju patienter fick CIPRO IV 10 mg/kg/dos var 8:e timme under en vecka följt av CIPRO 250 mg tabletter 20 mg/kg/dos var 12:e timme för att slutföra 10–21 dagars behandling och 62 patienter fick kombinationen av ceftazidim intravenöst 50 mg/kg/dos var 8:e timme och tobramycin intravenöst 3 mg/kg/dos var 8:e timme i totalt 10–21 dagar. Periodiska muskuloskeletala bedömningar utfördes av behandlingsblinda granskare. Patienterna följdes i genomsnitt 23 dagar efter avslutad behandling (intervall 0–93 dagar). Muskuloskeletala biverkningar rapporterades hos 22 % av patienterna i ciprofloxacingruppen och 21 % i jämförelsegruppen. Minskad rörelseomfång rapporterades hos 12 % av försökspersonerna i ciprofloxacingruppen och 16 % i jämförelsegruppen. Artralgi rapporterades hos 10 % av patienterna i cipro 500mgfloxacingruppen och 11 % i jämförelsegruppen. Andra biverkningar var liknande till sin natur och frekvens mellan behandlingsarmarna. Effekten av CIPRO för behandling av akuta pulmonella exacerbationer hos pediatriska patienter med cystisk fibros har inte fastställts.
Utöver de biverkningar som rapporterats hos pediatriska patienter i kliniska prövningar, bör det förväntas att biverkningar som rapporterats hos vuxna under kliniska prövningar eller erfarenhet efter marknadsföring också kan förekomma hos pediatriska patienter.
Erfarenhet efter marknadsföring
Följande biverkningar har rapporterats från världsomspännande marknadsföringserfarenhet med fluorokinoloner, inklusive CIPRO. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering (tabell 10).
Negativa laboratorieförändringar
Förändringar i laboratorieparametrar under behandling med CIPRO 250mg listas nedan:
Lever – Förhöjda ALT (SGPT), AST (SGOT), alkaliskt fosfatas, LDH, serumbilirubin.
Hematologiska – Eosinofili, leukopeni, minskade blodplättar, förhöjda blodplättar, pancytopeni.
Njur – Förhöjda serumkreatinin, BUN, kristalluri, cylindruri och hematuri har rapporterats.
Andra förändringar som inträffade var: förhöjt serumgammaglutamyltransferas, förhöjt serumamylas, sänkning av blodsocker, förhöjd urinsyra, minskning av hemoglobin, anemi, blödningsdiates, ökning av blodmonocyter och leukocytos.
LÄKEMEDELSINTERAKTIONER
Ciprofloxacin är en hämmare av human cytokrom P450 1A2 (CYP1A2)-medierad metabolism. Samtidig administrering av CIPRO med andra läkemedel som primärt metaboliseras av CYP1A2 resulterar i ökade plasmakoncentrationer av dessa läkemedel och kan leda till kliniskt signifikanta biverkningar av det samtidigt administrerade läkemedlet.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Invalidiserande och potentiellt irreversibla allvarliga biverkningar inklusive tendinit och senruptur, perifer neuropati och effekter på centrala nervsystemet
Fluorokinoloner, inklusive CIPRO, har associerats med invalidiserande och potentiellt irreversibla allvarliga biverkningar från olika kroppssystem som kan uppstå tillsammans hos samma patient. Vanliga biverkningar inkluderar tendinit, senruptur, artralgi, myalgi, perifer neuropati och effekter på centrala nervsystemet (hallucinationer, ångest, depression, sömnlöshet, svår huvudvärk och förvirring). Dessa reaktioner kan uppstå inom timmar till veckor efter start av CIPRO. Patienter i alla åldrar eller utan redan existerande riskfaktorer har upplevt dessa biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Avbryt CIPRO 250 mg omedelbart vid de första tecknen eller symtomen på någon allvarlig biverkning. Undvik dessutom användningen av fluorokinoloner, inklusive CIPRO 500 mg, hos patienter som har upplevt någon av dessa allvarliga biverkningar i samband med fluorokinoloner.
Tendinit Och Senruptur
Fluorokinoloner, inklusive CIPRO, har associerats med en ökad risk för tendinit och senruptur i alla åldrar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ]. Denna biverkning involverar oftast akillessenan och har även rapporterats med rotatorkuffen (axeln), handen, bicepsen, tummen och andra senor. Tendinit eller senruptur kan uppstå inom timmar eller dagar efter start av CIPRO 500 mg, eller så länge som flera månader efter avslutad fluorokinolonbehandling. Tendinit och senruptur kan uppstå bilateralt.
Risken för att utveckla fluorokinolonrelaterad tendinit och senruptur är ökad hos patienter över 60 år, hos patienter som tar kortikosteroidläkemedel och hos patienter med njur-, hjärt- eller lungtransplantationer. Andra faktorer som oberoende av varandra kan öka risken för senruptur inkluderar ansträngande fysisk aktivitet, njursvikt och tidigare sensjukdomar som reumatoid artrit. Tendinit och senruptur har även förekommit hos patienter som tar fluorokinoloner som inte har ovanstående riskfaktorer. Avbryt CIPRO 250 mg omedelbart om patienten upplever smärta, svullnad, inflammation eller bristning av en sena. Undvik fluorokinoloner, inklusive CIPRO 250 mg, hos patienter som har en historia av senor eller har upplevt tendinit eller senruptur [se NEGATIVA REAKTIONER ].
Perifer neuropati
Fluorokinoloner, inklusive CIPRO, har associerats med en ökad risk för perifer neuropati. Fall av sensorisk eller sensorimotorisk axonal polyneuropati som påverkar små och/eller stora axoner som resulterar i parestesier, hypoestesier, dysestesier och svaghet har rapporterats hos patienter som får fluorokinoloner, inklusive CIPRO. Symtom kan uppträda kort efter påbörjad behandling med CIPRO och kan vara irreversibla hos vissa patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Avbryt CIPRO omedelbart om patienten upplever symtom på perifer neuropati inklusive smärta, sveda, stickningar, domningar och/eller svaghet, eller andra förändringar i känslor inklusive lätt beröring, smärta, temperatur, positionskänsla och vibrationskänsla och/eller motorisk styrka i för att minimera utvecklingen av ett irreversibelt tillstånd. Undvik fluorokinoloner, inklusive CIPRO 500 mg, hos patienter som tidigare har upplevt perifer neuropati [se NEGATIVA REAKTIONER ].
Effekter på centrala nervsystemet
Psykiatriska biverkningar
Fluorokinoloner, inklusive CIPRO, har associerats med en ökad risk för psykiatriska biverkningar, inklusive: toxisk psykos, psykotiska reaktioner som utvecklas till självmordstankar/-tankar, hallucinationer eller paranoia; depression eller självskadebeteende såsom försök till eller fullbordat självmord; ångest, agitation eller nervositet; förvirring, delirium, desorientering eller störningar i uppmärksamheten; sömnlöshet eller mardrömmar; minnesskada. Dessa reaktioner kan inträffa efter den första dosen. Råda patienter som får CIPRO att omedelbart informera sin vårdgivare om dessa reaktioner inträffar, avbryta läkemedlet och inleda lämplig vård.
Centrala nervsystemets biverkningar
Fluorokinoloner, inklusive CIPRO 750 mg, har associerats med en ökad risk för kramper (kramper), ökat intrakraniellt tryck (pscudotumor cerebri), yrsel och skakningar. CIPRO, liksom andra fluorokinoloner, är känt för att utlösa anfall eller sänka anfallströskeln. Fall av status epilepticus har rapporterats. Som med alla fluorokinoloner, använd CIPRO med försiktighet till epileptiska patienter och patienter med kända eller misstänkta CNS-störningar som kan predisponera för krampanfall eller sänka kramptröskeln (till exempel svår cerebral arterioskleros, tidigare anamnes på kramper, minskat cerebralt blodflöde, förändrat hjärna struktur, eller stroke), eller i närvaro av andra riskfaktorer som kan predisponera för anfall eller sänka kramptröskeln (till exempel viss läkemedelsbehandling, njurfunktion). Om anfall uppstår, avbryt behandlingen med CIPRO 500mg och inled lämplig vård [se NEGATIVA REAKTIONER och LÄKEMEDELSINTERAKTIONER ].
Exacerbation av Myasthenia Gravis
Fluorokinoloner, inklusive CIPRO, har neuromuskulär blockerande aktivitet och kan förvärra muskelsvaghet hos patienter med myasthenia gravis. Allvarliga biverkningar efter marknadsföring, inklusive dödsfall och behov av ventilationsstöd, har associerats med användning av fluorokinolon hos patienter med myasthenia gravis. Undvik CIPRO hos patienter med känd historia av myasthenia gravis [se NEGATIVA REAKTIONER ].
Andra allvarliga och ibland dödliga biverkningar
Andra allvarliga och ibland dödliga biverkningar, några på grund av överkänslighet och några på grund av osäker etiologi, har rapporterats hos patienter som behandlas med kinoloner, inklusive CIPRO. Dessa händelser kan vara allvarliga och uppträder vanligtvis efter administrering av flera doser. Kliniska manifestationer kan inkludera en eller flera av följande:
- Feber, hudutslag eller allvarliga dermatologiska reaktioner (till exempel toxisk epidermal nekrolys, Stevens-Johnsons syndrom);
- Vaskulit; artralgi; muskelvärk; serumsjuka;
- Allergisk pneumonit;
- Interstitiell nefrit; akut njurinsufficiens eller -svikt;
- Hepatit; gulsot; akut levernekros eller -svikt;
- Anemi, inklusive hemolytisk och aplastisk; trombocytopeni, inklusive trombotisk trombocytopen purpura; leukopeni; agranulocytos; pancytopeni; och/eller andra hematologiska abnormiteter.
Avbryt CIPRO 500 mg omedelbart vid första uppkomsten av hudutslag, gulsot eller andra tecken på överkänslighet och stödjande åtgärder vidtagna [se NEGATIVA REAKTIONER ].
Överkänslighetsreaktioner
Allvarliga och ibland dödliga överkänslighetsreaktioner (anafylaktiska), vissa efter den första dosen, har rapporterats hos patienter som får fluorokinolonbehandling, inklusive CIPRO. Vissa reaktioner åtföljdes av kardiovaskulär kollaps, medvetslöshet, stickningar, svalg eller ansiktsödem, dyspné, urtikaria och klåda. Endast ett fåtal patienter hade en historia av överkänslighetsreaktioner. Allvarliga anafylaktiska reaktioner kräver omedelbar akut behandling med epinefrin och andra återupplivningsåtgärder, inklusive syre, intravenösa vätskor, intravenösa antihistaminer, kortikosteroider, pressoraminer och luftvägshantering, inklusive intubation, enligt indikation [se NEGATIVA REAKTIONER ].
Hepatotoxicitet
Fall av allvarlig levertoxicitet, inklusive levernekros, livshotande leversvikt och fatala händelser, har rapporterats med CIPRO. Akut leverskada debuterar snabbt (intervall 1–39 dagar), och är ofta förknippad med överkänslighet. Skademönstret kan vara hepatocellulärt, kolestatiskt eller blandat. De flesta patienter med dödlig utgång var äldre än 55 år. Vid eventuella tecken och symtom på hepatit (såsom anorexi, gulsot, mörk urin, klåda eller öm buk), avbryt behandlingen omedelbart.
Det kan finnas en tillfällig ökning av transaminaser, alkaliskt fosfatas eller kolestatisk gulsot, särskilt hos patienter med tidigare leverskador som behandlas med CIPRO [se NEGATIVA REAKTIONER ].
Risk för aortaaneurysm och dissektion
Epidemiologiska studier rapporterar en ökad frekvens av aortaaneurysm och dissektion inom två månader efter användning av fluorokinoloner, särskilt hos äldre patienter. Orsaken till den ökade risken har inte identifierats. Hos patienter med känt aortaaneurysm eller patienter som löper större risk för aortaaneurysm, reservera CIPRO 750 mg för användning endast när det inte finns några alternativa antibakteriella behandlingar tillgängliga.
Allvarliga biverkningar med samtidig teofyllin
Allvarliga och dödliga reaktioner har rapporterats hos patienter som fått samtidig administrering av CIPRO 250 mg och teofyllin. Dessa reaktioner har inkluderat hjärtstillestånd, anfall, status epilepticus och andningssvikt. Fall av illamående, kräkningar, tremor, irritabilitet eller hjärtklappning har också förekommit.
Även om liknande allvarliga biverkningar har rapporterats hos patienter som får enbart teofyllin, kan möjligheten att dessa reaktioner kan förstärkas av CIPRO inte elimineras. Om samtidig användning inte kan undvikas, kontrollera serumnivåerna av teofyllin och justera dosen efter behov [se LÄKEMEDELSINTERAKTIONER ].
Clostridioides Difficile-associerad diarré
Clostridioides difficile (C. difficile)-associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive CIPRO, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande isolat av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibakteriell användning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibakteriell användning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibakteriell behandling av C. difficile och sätt in kirurgisk utvärdering enligt klinisk indikation [se NEGATIVA REAKTIONER ].
Förlängning av QT-intervallet
Vissa fluorokinoloner, inklusive CIPRO 750 mg, har associerats med förlängning av QT-intervallet på elektrokardiogrammet och fall av arytmi. Fall av torsade de pointes har rapporterats under övervakning efter marknadsföring hos patienter som får fluorokinoloner, inklusive CIPRO.
Undvik CIPRO 1000mg hos patienter med känd förlängning av QT-intervallet, riskfaktorer för QT-förlängning eller torsade de pointes (till exempel medfödda långt QT-syndrom, okorrigerad elektrolytobalans, såsom hypokalemi eller hypomagnesemi och hjärtsjukdomar, såsom hjärtsvikt, myokard infarkt eller bradykardi) och patienter som får klass IA antiarytmika (kinidin, prokainamid), eller klass III antiarytmika (amiodaron, sotalol), tricykliska antidepressiva medel, makrolider och antipsykotika. Äldre patienter kan också vara mer mottagliga för läkemedelsrelaterade effekter på QT-intervallet [se NEGATIVA REAKTIONER , Användning i specifika populationer ].
Muskuloskeletala sjukdomar hos pediatriska patienter och artropatiska effekter hos djur
CIPRO 250 mg är indicerat till pediatriska patienter (under 18 år) endast för cUTI, förebyggande av inhalationsmjältbrand (efter exponering) och pest [se INDIKATIONER OCH ANVÄNDNING ]. En ökad förekomst av biverkningar jämfört med kontroller, inklusive reaktioner relaterade till leder och/eller omgivande vävnader, har observerats [se NEGATIVA REAKTIONER ].
I prekliniska studier orsakade oral administrering av CIPRO hälta hos omogna hundar. Histopatologisk undersökning av de viktbärande lederna hos dessa hundar avslöjade permanenta lesioner i brosket. Besläktade läkemedel av kinolonklass producerar också erosioner av brosk i viktbärande leder och andra tecken på artropati hos omogna djur av olika arter [se Användning i specifika populationer och Icke-klinisk toxikologi ].
Fotosensitivitet/fototoxicitet
Måttliga till svåra ljuskänslighets-/fototoxicitetsreaktioner, av vilka de senare kan visa sig som överdrivna solbränna reaktioner (till exempel sveda, erytem, utsöndring, blåsor, blåsor, ödem) som involverar områden som exponeras för ljus (vanligtvis ansiktet, "V"-området på hals, sträckytor på underarmarna, dorsa på händerna), kan associeras med användning av kinoloner inklusive CIPRO efter exponering för sol eller UV-ljus. Undvik därför överdriven exponering för dessa ljuskällor. Avbryt behandlingen med CIPRO 250 mg om fototoxicitet uppstår [se NEGATIVA REAKTIONER ].
Utveckling av läkemedelsresistenta bakterier
Att förskriva CIPRO 250 mg tabletter och CIPRO oral suspension i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation är osannolikt att ge patienten nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Potentiella risker med samtidig användning av läkemedel som metaboliseras av cytokrom P450 1A2 enzymer
CIPRO 750 mg är en hämmare av den hepatiska CYP1A2-enzymvägen. Samtidig administrering av CIPRO och andra läkemedel som primärt metaboliseras av CYP1A2 (till exempel teofyllin, metylxantiner, koffein, tizanidin, ropinirol, klozapin, olanzapin och zolpidem), resulterar i ökade plasmakoncentrationer av det samtidigt administrerade läkemedlet och kan leda till kliniskt signifikanta farmakodynamiska biverkningar av det samtidigt administrerade läkemedlet [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Interferens med snabb diagnos av syfilis
CIPRO 1000mg har inte visat sig vara effektivt vid behandling av syfilis. Antimikrobiella medel som används i höga doser under korta perioder för att behandla gonorré kan maskera eller fördröja symtomen vid inkubering av syfilis. Utför ett serologiskt test för syfilis hos alla patienter med gonorré vid tidpunkten för diagnosen. Utför ett uppföljande serologiskt test för syfilis tre månader efter CIPRO-behandling.
Kristalluria
Kristaller av ciprofloxacin har observerats sällan i urinen hos människor men oftare i urinen hos försöksdjur, som vanligtvis är alkalisk [se Icke-klinisk toxikologi ]. Kristalluri relaterad till CIPRO har endast rapporterats i sällsynta fall hos människor eftersom mänsklig urin vanligtvis är sur. Undvik alkalinitet i urinen hos patienter som får CIPRO. Återfukta patienterna väl för att förhindra bildandet av högkoncentrerad urin [se DOSERING OCH ADMINISTRERING ].
Blodsockerstörningar
Fluorokinoloner, inklusive CIPRO, har associerats med störningar av blodsocker, inklusive symptomatisk hyperglykemi och hypoglykemi, vanligtvis hos diabetespatienter som samtidigt behandlas med ett oralt hypoglykemiskt medel (till exempel glyburid) eller med insulin. Hos dessa patienter rekommenderas noggrann övervakning av blodsockret. Allvarliga fall av hypoglykemi som resulterat i koma eller död har rapporterats. Om en hypoglykemisk reaktion inträffar hos en patient som behandlas med CIPRO, avbryt behandlingen med CIPRO 750 mg och påbörja lämplig behandling omedelbart [se NEGATIVA REAKTIONER , LÄKEMEDELSINTERAKTIONER ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide )
Allvarliga biverkningar
Rekommendera patienter att sluta ta CIPRO 250 mg om de upplever en biverkning och att ringa sin vårdgivare för råd om att slutföra hela behandlingen med ett annat antibakteriellt läkemedel.
Informera patienter om följande allvarliga biverkningar som har associerats med CIPRO eller annan användning av fluorokinolon:
- Invalidiserande och potentiellt irreversibla allvarliga biverkningar som kan uppstå tillsammans: Informera patienterna om att invalidiserande och potentiellt irreversibla allvarliga biverkningar, inklusive tendinit och senorruptur, perifera neuropatier och effekter på centrala nervsystemet, har associerats med användning av CIPRO 1000 mg och kan förekomma samtidigt hos samma patient. Informera patienterna att omedelbart sluta ta CIPRO om de upplever en biverkning och att ringa sin vårdgivare.
- Tendinit och senruptur: Instruera patienter att kontakta sin vårdgivare om de upplever smärta, svullnad eller inflammation i en sena, eller svaghet eller oförmåga att använda en av sina leder; vila och avstå från träning; och avbryt behandlingen med CIPRO 750mg. Symtomen kan vara irreversibla. Risken för allvarlig sensjukdom med fluorokinoloner är högre hos äldre patienter, vanligtvis över 60 år, hos patienter som tar kortikosteroidläkemedel och hos patienter med njur-, hjärt- eller lungtransplantationer.
- Perifera neuropatier: Informera patienterna om att perifera neuropatier har associerats med användning av ciprofloxacin, symtom kan uppstå kort efter påbörjad behandling och kan vara irreversibla. Om symtom på perifer neuropati inklusive smärta, sveda, stickningar, domningar och/eller svaghet utvecklas ska du omedelbart avbryta behandlingen med CIPRO och tala om för dem att kontakta sin läkare.
- Effekter på centrala nervsystemet (till exempel kramper, yrsel, yrsel, ökat intrakraniellt tryck): Informera patienter om att kramper har rapporterats hos patienter som får fluorokinoloner, inklusive Ciprofloxacin. Instruera patienterna att meddela sin läkare innan de tar detta läkemedel om de har en historia av kramper. Informera patienterna om att de borde veta hur de reagerar på CIPRO innan de använder en bil eller maskiner eller deltar i andra aktiviteter som kräver mental vakenhet och koordination. Instruera patienterna att meddela sin läkare om ihållande huvudvärk med eller utan dimsyn uppstår.
- Exacerbation av Myasthenia Gravis: Instruera patienterna att informera sin läkare om någon historia av myasthenia gravis. Instruera patienterna att meddela sin läkare om de upplever några symtom på muskelsvaghet, inklusive andningssvårigheter.
- Överkänslighetsreaktioner: Informera patienterna om att ciprofloxacin kan orsaka överkänslighetsreaktioner, även efter en engångsdos, och att avbryta behandlingen vid första tecken på hudutslag, nässelfeber eller andra hudreaktioner, snabba hjärtslag, svårigheter att svälja eller andas, svullnad som tyder på angioödem ( till exempel svullnad av läppar, tunga, ansikte, täthet i halsen, heshet) eller andra symptom på en allergisk reaktion.
- Hepatotoxicitet: Informera patienter om att allvarlig levertoxicitet (inklusive akut hepatit och dödliga händelser) har rapporterats hos patienter som tar CIPRO. Instruera patienterna att informera sin läkare om de upplever några tecken eller symtom på leverskada inklusive: aptitlöshet, illamående, kräkningar, feber, svaghet, trötthet, ömhet i den övre högra kvadranten, klåda, gulfärgning av hud och ögon, ljusa tarmrörelser eller mörkfärgad urin.
- Aortaaneurysm och dissektion: Informera patienter att söka akut medicinsk vård om de upplever plötslig smärta i bröstet, magen eller ryggen.
- Diarre: Diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar, instruera patienterna att kontakta sin läkare så snart som möjligt.
- Förlängning av QT-intervallet: Instruera patienterna att informera sin läkare om eventuell personlig eller familjehistoria av QT-förlängning eller proarytmiska tillstånd såsom hypokalemi, bradykardi eller nyligen genomförd myokardischemi; om de tar något klass IA (kinidin, prokainamid) eller klass III (amiodaron, sotalol) antiarytmika. Instruera patienterna att meddela sin läkare om de har några symtom på förlängning av QT-intervallet, inklusive långvarig hjärtklappning eller medvetslöshet.
- Muskuloskeletala sjukdomar hos pediatriska patienter: Instruera föräldrar att informera sitt barns läkare om barnet har en historia av ledrelaterade problem innan de tar detta läkemedel. Informera föräldrar till pediatriska patienter att meddela deras barns läkare om ledrelaterade problem som uppstår under eller efter behandling med cipro 1000mgfloxacin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
- Tizanidin: Instruera patienter att inte använda cipro 250mgfloxacin om de redan tar tizanidin. CIPRO ökar effekten av tizanidin (Zanaflex®).
- Teofyllin: Informera patienterna om att cipro 250mgfloxacin CIPRO 1000mg kan öka effekten av teofyllin. Livshotande CNS-effekter och arytmier kan förekomma. Rekommendera patienterna att omedelbart söka medicinsk hjälp om de upplever kramper, hjärtklappning eller andningssvårigheter.
- Koffein: Informera patienterna om att CIPRO 500 mg kan öka effekten av koffein. Det finns en risk för koffeinackumulering när produkter som innehåller koffein konsumeras medan du tar kinoloner.
- Fotosensitivitet/fototoxicitet: Informera patienter om att ljuskänslighet/fototoxicitet har rapporterats hos patienter som får fluorokinoloner. Informera patienterna om att minimera eller undvika exponering för naturligt eller artificiellt solljus (solarier eller UVA/B-behandling) när de tar kinoloner. Om patienter behöver vara utomhus medan de använder kinoloner, instruera dem att bära löst sittande kläder som skyddar huden från solexponering och diskutera andra solskyddsåtgärder med sin läkare. Om en solbränna-liknande reaktion eller hudutslag inträffar, instruera patienterna att kontakta sin läkare.
- Blodsockerstörningar: Informera patienterna om att om de är diabetiker och behandlas med insulin eller ett oralt hypoglykemiskt medel och en hypoglykemisk reaktion inträffar, ska de avbryta behandlingen med CIPRO 250 mg och konsultera en läkare.
- Laktation: För andra indikationer än inhalationsmjältbrand (efter exponering), informera en kvinna om att amning inte rekommenderas under behandling med Cipro och under ytterligare 2 dagar efter den sista dosen. Alternativt kan en kvinna pumpa och kassera under behandlingen och i ytterligare 2 dagar efter den sista dosen [se Användning i specifika populationer ].
Antibakteriell resistens
Informera patienterna om att antibakteriella läkemedel inklusive CIPRO 250 mg tabletter och CIPRO 1000 mg oral suspension endast bör användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (till exempel förkylning). När CIPRO 500 mg tabletter och CIPRO 500 mg oral suspension förskrivs för att behandla en bakteriell infektion, bör patienterna informeras om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier utvecklar resistens och inte kommer att kunna behandlas med CIPRO 500 mg tabletter och CIPRO 250 mg oral suspension eller andra antibakteriella medel. droger i framtiden.
Administrationsinstruktioner
Instruera patienten
- Skaka CIPRO Oral Suspension kraftigt varje gång före användning i cirka 15 sekunder.
- Att alltid använda den samförpackade graderade mätskeden med markeringar för ½ (2,5 mL) och 1/1 (5 mL), för att få den exakta dosen.
- Efter användning ska den graderade måttskeden rengöras under rinnande vatten med diskmedel och torkas noggrant.
- Inte för att tugga mikrokapslarna, utan för att svälja dem hela.
- Det vattnet får tas efteråt.
- Förslut flaskan ordentligt efter varje användning enligt instruktionerna på locket.
- Efter avslutad behandling ska CIPRO 1000mg oral suspension inte återanvändas.
Informera patienterna om att CIPRO 250 mg kan tas med eller utan mat.
Informera patienterna att dricka rikligt med vätska medan de tar CIPRO för att undvika bildning av högkoncentrerad urin och kristallbildning i urinen.
Informera patienterna om att antacida innehållande magnesium eller aluminium, samt sukralfat, metallkatjoner såsom järn och multivitaminpreparat med zink eller didanosin bör tas minst två timmar före eller sex timmar efter administrering av CIPRO 1000 mg. CIPRO ska inte tas tillsammans med mejeriprodukter (som mjölk eller yoghurt) eller kalciumberikade juicer enbart eftersom absorptionen av ciprofloxacin kan minska avsevärt; dock kan CIPRO 500mg tas med en måltid som innehåller dessa produkter.
Informera patienterna om att om en dos missas ska den tas när som helst men inte senare än 6 timmar före nästa schemalagda dos. Om det återstår mindre än 6 timmar innan nästa dos ska den missade dosen inte tas och behandlingen ska fortsätta enligt ordination med nästa schemalagda dos. Dubbla doser ska inte tas för att kompensera för en missad dos.
Informera patienterna om att CIPRO 500 mg tabletter (250 mg och 500 mg) är skårade och kan delas i hälften vid den skårade linjen för att ge en styrka på 125 mg respektive 250 mg.
Läkemedelsinteraktioner Orala antidiabetiska medel
Informera patienter om att hypoglykemi har rapporterats när cipro 250mgfloxacin och orala antidiabetika administrerades samtidigt; om lågt blodsocker inträffar med CIPRO 750mg, instruera dem att rådfråga sin läkare och att deras antibakteriella medicin kan behöva ändras.
Mjältbrand och peststudier
Informera patienter som fått CIPRO för dessa tillstånd att effektstudier inte kunde utföras på människor av genomförbarhetsskäl. Därför baserades godkännandet för dessa tillstånd på effektstudier utförda på djur.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Åtta mutagenitetstester in vitro har utförts med cipro 500mgfloxacin, och testresultaten listas nedan:
- Salmonella/mikrosomtest (negativt)
- E. coli DNA-reparationsanalys (negativ)
- Muslymfom cell framåtmutationsanalys (positiv)
- Kinesisk hamster V79 Cell HGPRT-test (negativt)
- Syrisk hamster embryocellstransformationsanalys (negativ)
- Saccharomyces cerevisiae punktmutationsanalys (negativ)
- Saccharomyces cerevisiae mitotisk korsning och genkonverteringsanalys (negativ)
- DNA-reparationsanalys för hepatocyter från råtta (positiv)
Således var 2 av de 8 testerna positiva, men resultaten av följande 3 in vivo testsystem gav negativa resultat:
- DNA-reparationsanalys för råtthepatocyter
- Mikrokärntest (möss)
- Dominant dödligt test (möss)
Långtidsstudier av karcinogenicitet på råttor och möss resulterade inte i några karcinogena eller tumörframkallande effekter på grund av cipro 500mgfloxacin vid dagliga orala dosnivåer upp till 250 mg/kg och 750 mg/kg för råttor respektive möss (ungefär 1,7- och 2,5- gånger den högsta rekommenderade terapeutiska dosen baserat på kroppsyta respektive).
Resultat från foto-co-carcinogenicitetstester indikerar att cipro 1000mgfloxacin inte minskar tiden till uppkomsten av UV-inducerade hudtumörer jämfört med vehikelkontroll. Hårlösa (Skh-1) möss exponerades för UVA-ljus i 3,5 timmar fem gånger varannan vecka i upp till 78 veckor medan de samtidigt administrerades ciprofloxacin. Tiden till utveckling av de första hudtumörerna var 50 veckor hos möss som behandlades samtidigt med UVA och cipro 1000mgfloxacin (musdos ungefär lika med maximal rekommenderad humandos baserat på kroppsyta), till skillnad från 34 veckor när djuren behandlades med både UVA och fordon. Tiden till utveckling av hudtumörer varierade från 16 veckor till 32 veckor hos möss som behandlades samtidigt med UVA och andra kinoloner.5
I denna modell utvecklade möss som behandlats med enbart ciprofloxacin inte hud- eller systemiska tumörer. Det finns inga data från liknande modeller som använder pigmenterade möss och/eller helhåriga möss. Den kliniska betydelsen av dessa fynd för människor är okänd.
Fertilitetsstudier utförda på han- och honråttor vid orala doser av cipro 250 mgfloxacin upp till 100 mg/kg (cirka 0,6 gånger den högsta rekommenderade terapeutiska orala dosen baserat på kroppsyta) visade inga tecken på funktionsnedsättning. Hanråttor fick oralt ciprofloxacin i 10 veckor före parning och honor doserades i 3 veckor före parning till och med dräktighetsdag 7.
Användning i specifika populationer
Graviditet
Risksammanfattning
Långvarig erfarenhet av cipro 1000mgfloxacin hos gravida kvinnor under flera decennier, baserat på tillgänglig publicerad information från fallrapporter, fallkontrollstudier och observationsstudier av cipro 1000mgfloxacin administrerat under graviditet, har inte identifierat någon läkemedelsrelaterad risk för allvarliga fosterskador, missfall eller negativa effekter. mödra- eller fosterresultat (se Data ). Oral administrering av cipro 500mgfloxacin under organogenes i doser upp till 100 mg/kg till gravida möss och råttor och upp till 30 mg/kg till dräktiga kaniner orsakade inte fostermissbildningar (se Data ). Dessa doser var upp till 0,3, 0,6 och 0,4 gånger den maximala rekommenderade kliniska orala dosen till möss, råttor respektive kaniner, baserat på kroppsyta. Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är de uppskattade bakgrundsriskerna för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 till 4 % respektive 15 till 20 %.
Data
Mänskliga data
Även om tillgängliga studier inte definitivt kan fastställa frånvaron av risk, har publicerade data från prospektiva observationsstudier under flera decennier inte etablerat ett samband med användning av cipro 250mgfloxacin under graviditet och allvarliga missbildningar, missfall eller ogynnsamma resultat hos modern eller foster. Tillgängliga studier har metodologiska begränsningar inklusive liten provstorlek och vissa av dem är inte specifika för ciprofloxacin. En kontrollerad prospektiv observationsstudie följde 200 kvinnor exponerade för fluorokinoloner (52,5 % exponerade för cipro 250mgfloxacin och 68 % exponeringar under första trimestern) under graviditeten. In utero exponering för fluorokinoloner under embryogenes var inte associerad med ökad risk för allvarliga missbildningar. De rapporterade frekvenserna av allvarliga medfödda missbildningar var 2,2 % för fluorokinolongruppen och 2,6 % för kontrollgruppen (bakgrundsincidensen av större missbildningar är 1–5 %). Frekvensen av spontana aborter, prematuritet och låg födelsevikt skilde sig inte mellan grupperna och det fanns inga kliniskt signifikanta muskuloskeletala dysfunktioner upp till ett års ålder hos de cipro 500 mgfloxacinexponerade barnen.
En annan prospektiv uppföljningsstudie rapporterade om 549 graviditeter med exponering för fluorokinolon (93 % exponeringar i första trimestern). Det förekom 70 exponeringar för cipro 500mgfloxacin, alla under den första trimestern. Missbildningsfrekvensen bland levande födda barn som exponerats för cipro 750mgfloxacin och för fluorokinoloner totalt sett låg inom bakgrundsfrekvensen. Inga specifika mönster av medfödda avvikelser hittades. Studien avslöjade inga tydliga biverkningar på grund av exponering för ciprofloxacin in utero.
Inga skillnader i antalet prematuriteter, spontana aborter eller födelsevikt sågs hos kvinnor som exponerats för ciprofloxacin under graviditeten. Dessa små epidemiologiska studier efter marknadsföring, av vilka de flesta erfarenheter är från kortvarig exponering i första trimestern, är dock otillräckliga för att utvärdera risken för mindre vanliga defekter eller för att tillåta tillförlitliga och definitiva slutsatser om säkerheten för ciprofloxacin hos gravida kvinnor och deras foster under utveckling. .
Djurdata
Toxikologiska studier har utförts med cipro 500mgfloxacin på råttor, möss och kaniner. Hos råttor och möss var orala doser upp till 100 mg/kg administrerade under organogenesen (Gestation Days, GD, 6-17) inte associerade med negativa utvecklingsresultat, inklusive embryofetal toxicitet eller missbildningar. Hos råttor och möss är en dos på 100 mg/kg cirka 0,6 respektive 0,3 gånger den maximala dagliga orala dosen för människor (1500 mg/dag) baserat på kroppsyta. I en serie av utvecklingstoxikologiska studier på kanin fick hon oralt eller intravenöst cipro 250mgfloxacin under en av följande 5-dagarsperioder: GD 6 till 10, GD 10 till 14 eller GD 14 till 18, avsedda att täcka perioden av organogenes. Detta var ett försök att mildra den gastrointestinala intoleransen som observerats hos kaniner som får antibakteriella medel, vilket manifesteras av minskad matkonsumtion och viktminskning, vilket kan leda till embryofetal resorption eller spontan abort. En oral dos av cipro 750 mgfloxacin på 100 mg/kg (cirka 1,3 gånger den högsta rekommenderade kliniska orala dosen baserat på kroppsyta) orsakade överdriven maternell toxicitet som förvirrade utvärderingen av fostret. En oral dos på 30 mg/kg (cirka 0,4 gånger den högsta rekommenderade kliniska orala dosen) var associerad med undertryckande av moderns och fostrets viktökning, men fostermissbildningar observerades inte. Intravenös administrering av doser upp till 20 mg/kg (cirka 0,3 gånger den högsta rekommenderade kliniska orala dosen baserat på kroppsyta) till dräktiga kaniner var inte toxisk för modern och varken embryofetal toxicitet eller fostermissbildningar observerades.
peri- och postnatala studier fick råttor doser av cipro 1000 mgfloxacin upp till 200 mg/kg/dag (oralt) eller upp till 30 mg/kg/dag (subkutant) från GD 16 till 22 dagar efter förlossningen. Dosen på 200 mg/kg är cirka 1,3 gånger den maximala rekommenderade kliniska orala dosen baserat på kroppsyta. Varken maternell toxicitet eller negativa effekter på tillväxt och utveckling av ungarna observerades, inklusive inga tecken på artropati på ungarnas bakre benleder. Ciprofloxacin och andra kinoloner har visat sig orsaka artropati hos omogna djur av de flesta arter som testats när de administreras direkt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Icke-klinisk toxikologi ].
Laktation
Risksammanfattning
Publicerad litteratur rapporterar att cipro 1000mgfloxacin förekommer i bröstmjölk efter intravenös och oral administrering. Det finns ingen information om effekterna av CIPRO på mjölkproduktionen eller det ammade barnet. På grund av den potentiella risken för allvarliga biverkningar hos spädbarn som ammas, inklusive artropati som visats i studier på unga djur [se Användning i specifika populationer (Kliniska överväganden)], för de flesta indikationer kan en ammande kvinna överväga att pumpa och kassera bröstmjölk under behandling med CIPRO 500 mg och ytterligare två dagar (fem halveringstider) efter den sista dosen. Alternativt, informera en kvinna om att amning inte rekommenderas under behandling med CIPRO och under ytterligare två dagar (fem halveringstider) efter den sista dosen.
Men för inhalationsmjältbrand (efter exponering), under en incident som resulterar i exponering för mjältbrand, kan risk-nytta-bedömningen av att fortsätta amma medan modern (och eventuellt spädbarnet) är (är) på CIPRO vara acceptabel [se DOSERING OCH ADMINISTRERING , Pediatrisk användning , och Kliniska studier ]. De utvecklingsmässiga och hälsomässiga fördelarna med amning bör övervägas tillsammans med moderns kliniska behov av CIPRO och eventuella negativa effekter på det ammade barnet från CIPRO 1000mg eller från det underliggande moderns tillståndet.
Kliniska överväganden
Cipro 1000mgfloxacin kan orsaka förändringar i tarmfloran hos det ammande barnet. Råd en kvinna att övervaka det ammade barnet för lös eller blodig avföring och candidiasis (trast, blöjutslag).
Pediatrisk användning
Även om det är effektivt i kliniska prövningar är CIPRO 750 mg inte ett förstahandsval i den pediatriska populationen på grund av en ökad förekomst av biverkningar jämfört med kontroller. Kinoloner, inklusive CIPRO, orsakar artropati (artralgi, artrit) hos unga djur [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Icke-klinisk toxikologi ].
Komplicerad urinvägsinfektion och pyelonefrit
CIPRO 250 mg är indicerat för behandling av cUTI och pyelonefrit orsakad av Escherichia coli hos pediatriska patienter i åldern 1 till 17 år. Även om CIPRO 500 mg är effektivt i kliniska prövningar är det inte ett förstahandsval i den pediatriska populationen på grund av en ökad förekomst av biverkningar jämfört med kontrollerna, inklusive händelser relaterade till leder och/eller omgivande vävnader [se NEGATIVA REAKTIONER och Kliniska studier ].
Inhalationsmjältbrand (efter exponering)
CIPRO 750mg är indicerat för pediatriska patienter från födseln till 17 års ålder för inhalationsmjältbrand (efter exponering). Risk-nytta-bedömningen indikerar att administrering av ciprofloxacin till pediatriska patienter är lämplig [se DOSERING OCH ADMINISTRERING och Kliniska studier ].
Plåga
CIPRO 500mg är indicerat för pediatriska patienter från födseln till 17 års ålder, för behandling av pest, inklusive pneumonisk och septikemisk pest på grund av Yersinia pestis (Y. pestis) och profylax mot pest. Effektstudier av CIPRO kunde inte utföras på människor med pneumonisk pest av genomförbarhetsskäl. Därför baserades godkännandet av denna indikation på en effektstudie utförd på djur. Risk-nyttabedömningen indikerar att administrering av CIPRO till pediatriska patienter är lämplig [se INDIKATIONER OCH ANVÄNDNING , DOSERING OCH ADMINISTRERING och Kliniska studier ].
Geriatrisk användning
Geriatriska patienter löper en ökad risk att utveckla allvarliga sensjukdomar inklusive senruptur när de behandlas med en fluorokinolon som CIPRO. Denna risk ökar ytterligare hos patienter som samtidigt får kortikosteroidbehandling. Tendinit eller senruptur kan involvera akilles, hand, axel eller andra senor och kan uppstå under eller efter avslutad behandling; fall som inträffat upp till flera månader efter behandling med fluorokinolon har rapporterats. Försiktighet bör iakttas vid förskrivning av CIPRO 500 mg till äldre patienter, särskilt de som tar kortikosteroider. Patienterna bör informeras om denna potentiella biverkning och rådas att avbryta behandlingen med CIPRO 500mg och kontakta sin vårdgivare om några symtom på tendinit eller senruptur uppstår [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och NEGATIVA REAKTIONER ].
Epidemiologiska studier rapporterar en ökad frekvens av aortaaneurysm och dissektion inom två månader efter användning av fluorokinoloner, särskilt hos äldre patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
en retrospektiv analys av 23 flerdoskontrollerade kliniska prövningar av CIPRO som omfattade över 3500 ciprofloxacinbehandlade patienter, var 25 % av patienterna äldre än eller lika med 65 år och 10 % var äldre än eller lika med 75 år. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre försökspersoner, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer för någon läkemedelsbehandling kan inte uteslutas. Ciprofloxacin är känt för att utsöndras till stor del via njurarna, och risken för biverkningar kan vara större hos patienter med nedsatt njurfunktion. Ingen dosförändring är nödvändig för patienter äldre än 65 år med normal njurfunktion. Men eftersom vissa äldre individer upplever nedsatt njurfunktion på grund av sin höga ålder, bör man vara försiktig vid val av dos för äldre patienter, och övervakning av njurfunktionen kan vara användbar hos dessa patienter [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
allmänhet kan äldre patienter vara mer mottagliga för läkemedelsrelaterade effekter på QT-intervallet. Därför bör försiktighet vidtas vid användning av CIPRO 500 mg tillsammans med läkemedel som kan resultera i förlängning av QT-intervallet (till exempel klass IA eller klass III antiarytmika) eller hos patienter med riskfaktorer för torsade de pointes (till exempel känd QT-förlängning , okorrigerad hypokalemi) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt njurfunktion
Cipro 500mgfloxacin elimineras främst genom renal utsöndring; men läkemedlet metaboliseras och elimineras delvis genom leverns gallsystem och genom tarmen. Dessa alternativa vägar för eliminering av läkemedel verkar kompensera för den minskade njurutsöndringen hos patienter med nedsatt njurfunktion. Icke desto mindre rekommenderas viss modifiering av doseringen, särskilt för patienter med svår njurfunktion [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
Nedsatt leverfunktion
preliminära studier på patienter med stabil kronisk levercirros har inga signifikanta förändringar i ciprofloxacins farmakokinetik observerats. Farmakokinetiken för cipro 500mgfloxacin hos patienter med akut leverinsufficiens har inte studerats.
ÖVERDOS
I händelse av akut överdosering har reversibel njurtoxicitet rapporterats i vissa fall. Töm magen genom att framkalla kräkningar eller genom magsköljning. Observera patienten noggrant och ge stödjande behandling, inklusive övervakning av njurfunktion, urin-pH och surgör vid behov för att förhindra kristalluri och administrering av magnesium-, aluminium- eller kalciuminnehållande antacida som kan minska absorptionen av cipro 750mgfloxacin. Tillräcklig hydrering måste upprätthållas. Endast en liten mängd cipro 250mgfloxacin (mindre än 10%) avlägsnas från kroppen efter hemodialys eller peritonealdialys.
KONTRAINDIKATIONER
Överkänslighet
CIPRO 1000mg är kontraindicerat för personer med en historia av överkänslighet mot cipro 750mgfloxacin, någon medlem av kinolonklassen av antibakteriella medel eller någon av produktkomponenterna [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Tizanidin
Samtidig administrering med tizanidin är kontraindicerad [se LÄKEMEDELSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Ciprofloxacin är en medlem av fluorokinolonklassen av antibakteriella medel [se Mikrobiologi ].
Farmakokinetik
Absorption
Den absoluta biotillgängligheten av cipro 500mgfloxacin när det ges som en oral tablett är cirka 70 % utan någon väsentlig förlust vid first pass-metabolism. Ciprofloxacins maximala serumkoncentrationer (Cmax) och area under kurvan (AUC) visas i diagrammet för dosintervallet 250 mg till 1000 mg (tabell 12).
Maximala serumkoncentrationer uppnås 1 till 2 timmar efter oral dosering. Medelkoncentrationer 12 timmar efter dosering med 250, 500 eller 750 mg är 0,1, 0,2 respektive 0,4 mcg/ml. Elimineringshalveringstiden i serum hos patienter med normal njurfunktion är cirka 4 timmar. Serumkoncentrationerna ökar proportionellt med doser upp till 1000 mg.
En 500 mg oral dos som ges var 12:e timme har visat sig ge en AUC motsvarande den som produceras av en intravenös infusion av 400 mg CIPRO 1000 mg givet under 60 minuter var 12:e timme. En 750 mg oral dos som ges var 12:e timme har visat sig ge en AUC vid steady-state motsvarande den som produceras av en intravenös infusion av 400 mg givet under 60 minuter var 8:e timme. En 750 mg oral dos resulterar i ett Cmax som liknar det som observeras med en 400 mg intravenös dos (tabell 13). En 250 mg oral dos som ges var 12:e timme ger en AUC motsvarande den som produceras av en infusion av 200 mg CIPRO 1000 mg som ges var 12:e timme.
Mat
När CIPRO tablett ges samtidigt med föda uppstår en fördröjning i absorptionen av läkemedlet, vilket resulterar i toppkoncentrationer som inträffar närmare 2 timmar efter dosering snarare än 1 timme, medan det inte observeras någon fördröjning när CIPRO 750mg Suspension ges tillsammans med mat . Den totala absorptionen av CIPRO 1000mg tablett eller CIPRO 500mg suspension påverkas dock inte nämnvärt. Farmakokinetiken för cipro 750mgfloxacin som ges som suspension påverkas inte heller av mat. Undvik samtidig administrering av CIPRO med mejeriprodukter (som mjölk eller yoghurt) eller enbart kalciumberikade juicer eftersom minskad absorption är möjlig; dock kan CIPRO 1000mg tas med en måltid som innehåller dessa produkter
Vid oral administrering är en 500 mg dos, given som 10 ml av 5% CIPRO-suspensionen (innehållande 250 mg ciprofloxacin/5 ml) bioekvivalent med 500 mg tabletten. En 10 ml volym av 5% CIPRO 1000 mg suspension (innehållande 250 mg ciprofloxacin/5 ml) är bioekvivalent med en 5 ml volym av 10% CIPRO 750 mg suspension (innehållande 500 mg cipro 1000 mg/5 ml).
Distribution
Bindningen av ciprofloxacin till serumproteiner är 20 % till 40 %, vilket sannolikt inte är tillräckligt högt för att orsaka signifikanta proteinbindande interaktioner med andra läkemedel.
Efter oral administrering distribueras cipro 250mgfloxacin brett i hela kroppen. Vävnadskoncentrationerna överstiger ofta serumkoncentrationerna hos både män och kvinnor, särskilt i genital vävnad inklusive prostata. Ciprofloxacin finns i aktiv form i saliv, näs- och bronkial sekret, slemhinna i bihålorna, sputum, hudblåsvätska, lymfa, peritonealvätska, galla och prostatiska sekret. Cipro 500mgfloxacin har också upptäckts i lungor, hud, fett, muskler, brosk och ben. Läkemedlet diffunderar in i cerebrospinalvätskan (CSF); CSF-koncentrationerna är dock i allmänhet mindre än 10 % av maximala serumkoncentrationer. Låga nivåer av läkemedlet har upptäckts i ögats vatten- och glaskroppar.
Ämnesomsättning
Fyra metaboliter har identifierats i mänsklig urin som tillsammans står för cirka 15 % av en oral dos. Metaboliterna har antimikrobiell aktivitet, men är mindre aktiva än oförändrad cipro 500mgfloxacin. Cipro 500mgfloxacin är en hämmare av human cytokrom P450 1A2 (CYP1A2)-medierad metabolism. Samtidig administrering av ciprofloxacin med andra läkemedel som primärt metaboliseras av CYP1A2 resulterar i ökade plasmakoncentrationer av dessa läkemedel och kan leda till kliniskt signifikanta biverkningar av det samtidigt administrerade läkemedlet [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och LÄKEMEDELSINTERAKTIONER ].
Exkretion
Elimineringshalveringstiden i serum hos patienter med normal njurfunktion är cirka 4 timmar. Cirka 40 till 50 % av en oralt administrerad dos utsöndras i urinen som oförändrat läkemedel. Efter en 250 mg oral dos överstiger urinkoncentrationerna av cipro 500mgfloxacin vanligtvis 200 mcg/ml under de första två timmarna och är cirka 30 mcg/ml 8 till 12 timmar efter dosering. Urinutsöndringen av ciprofloxacin är praktiskt taget fullständig inom 24 timmar efter dosering. Njurclearancen för cipro 250mgfloxacin, vilket är cirka 300 ml/minut, överstiger den normala glomerulära filtrationshastigheten på 120 ml/minut. Sålunda verkar aktiv tubulär sekretion spela en betydande roll i dess eliminering. Samtidig administrering av probenecid med ciprofloxacin resulterar i cirka 50 % minskning av njurclearance för ciprofloxacin och en 50 % ökning av dess koncentration i den systemiska cirkulationen.
Även om gallkoncentrationerna av cipro 250mgfloxacin är flera gånger högre än serumkoncentrationerna efter oral dosering, återvinns endast en liten mängd av den administrerade dosen från gallan som oförändrat läkemedel. Ytterligare 1 % till 2 % av dosen återvinns från gallan i form av metaboliter. Cirka 20 % till 35 % av en oral dos återvinns från avföringen inom 5 dagar efter dosering. Detta kan uppstå från antingen biliär clearance eller transintestinal eliminering.
Specifika populationer
Äldre
Farmakokinetiska studier av orala (engångsdos) och intravenösa (enkel- och multipeldoser) former av cipro 250mgfloxacin indikerar att plasmakoncentrationerna av ciprofloxacin är högre hos äldre försökspersoner (äldre än 65 år) jämfört med unga vuxna. Även om Cmax ökas med 16 % till 40 %, är ökningen i genomsnittlig AUC cirka 30 % och kan åtminstone delvis tillskrivas minskat renalt clearance hos äldre. Eliminationshalveringstiden är endast något (~20%) förlängd hos äldre. Dessa skillnader anses inte vara kliniskt signifikanta [se Användning i specifika populationer ].
Nedsatt njurfunktion
Hos patienter med nedsatt njurfunktion är halveringstiden för ciprofloxacin något förlängd. Dosjusteringar kan behövas [se Användning i specifika populationer och DOSERING OCH ADMINISTRERING ].
Nedsatt leverfunktion
I preliminära studier på patienter med stabil kronisk levercirros har inga signifikanta förändringar i ciprofloxacins farmakokinetik observerats. Kinetiken för cipro 750mgfloxacin hos patienter med akut leverinsufficiens har inte studerats fullständigt.
Pediatrik
Tabell 14 sammanfattar farmakokinetiska parametrar hos pediatriska patienter i åldern yngre än 1 till yngre än 12 år som får intravenös behandling.
Dessa värden ligger inom det intervall som rapporterats för vuxna vid terapeutiska doser. Baserat på populationsfarmakokinetisk analys av pediatriska patienter med olika infektioner, är den förväntade genomsnittliga halveringstiden för barn cirka 4 timmar – 5 timmar, och biotillgängligheten för den orala suspensionen är cirka 60 %.
Läkemedelsinteraktioner
Antacida
Samtidig administrering av antacida innehållande magnesiumhydroxid eller aluminiumhydroxid kan minska biotillgängligheten av cipro 500mgfloxacin med så mycket som 90 % [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ].
Histamin H2-receptorantagonister
Histamin H2-receptorantagonister verkar inte ha någon signifikant effekt på biotillgängligheten av cipro 250mgfloxacin.
Metronidazol
Serumkoncentrationerna av ciprofloxacin och metronidazol förändrades inte när dessa två läkemedel gavs samtidigt.
Tizanidin
en farmakokinetisk studie ökade den systemiska exponeringen av tizanidin (4 mg engångsdos) signifikant (Cmax 7 gånger, AUC 10 gånger) när läkemedlet gavs samtidigt med CIPRO (500 mg två gånger dagligen i 3 dagar). Samtidig administrering av tizanidin och CIPRO är kontraindicerad på grund av att tizanidin förstärker hypotensiva och sedativa effekter [se KONTRAINDIKATIONER ].
Ropinirol
I en studie utförd på 12 patienter med Parkinsons sjukdom som fick 6 mg ropinirol en gång dagligen med 500 mg CIPRO 250 mg två gånger dagligen, ökade medel-Cmax och medel-AUC för ropinirol med 60% respektive 84%. Övervakning av ropinirolrelaterade biverkningar och lämplig dosjustering av ropinirol rekommenderas under och kort efter samtidig administrering med CIPRO [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Klozapin
Efter samtidig administrering av 250 mg CIPRO 500 mg med 304 mg klozapin under 7 dagar, ökade serumkoncentrationerna av klozapin och N-desmetylklozapin med 29 % respektive 31 %. Noggrann övervakning av klozapinrelaterade biverkningar och lämplig justering av klozapindosen under och kort efter samtidig administrering med CIPRO rekommenderas.
Sildenafil
Efter samtidig administrering av en oral singeldos på 50 mg sildenafil med 500 mg CIPRO 1000 mg till friska försökspersoner ökade både medel-Cmax och medel-AUC för sildenafil ungefär två gånger. Använd sildenafil med försiktighet när det administreras samtidigt med CIPRO 500 mg på grund av den förväntade tvåfaldiga ökningen av exponeringen av sildenafil vid samtidig administrering av CIPRO.
Duloxetin
kliniska studier har det visat sig att samtidig användning av duloxetin och starka hämmare av CYP450 1A2-isozymet, såsom fluvoxamin, kan resultera i en 5-faldig ökning av genomsnittlig AUC och en 2,5-faldig ökning av genomsnittlig Cmax för duloxetin.
Lidokain
I en studie utförd på 9 friska frivilliga, resulterade samtidig användning av 1,5 mg/kg IV lidokain och CIPRO 500 mg två gånger dagligen i en ökning av lidokain Cmax och AUC med 12 % respektive 26 %. Även om lidokainbehandling tolererades väl vid denna förhöjda exponering, kan en möjlig interaktion med CIPRO och en ökning av biverkningar relaterade till lidokain inträffa vid samtidig administrering.
Metoklopramid
Metoklopramid påskyndar signifikant absorptionen av oral cipro 750mgfloxacin, vilket resulterar i en kortare tid för att nå maximala plasmakoncentrationer. Ingen signifikant effekt observerades på biotillgängligheten av ciprofloxacin.
Omeprazol
När CIPRO administrerades som en engångsdos på 1000 mg samtidigt med omeprazol (40 mg en gång dagligen i tre dagar) till 18 friska frivilliga, reducerades medel-AUC och Cmax för ciprofloxacin med 20% respektive 23%. Den kliniska betydelsen av denna interaktion har inte fastställts.
Mikrobiologi
Handlingsmekanism
Den bakteriedödande effekten av cipro 750mgfloxacin beror på hämning av enzymerna topoisomeras II (DNA-gyras) och topoisomeras IV (båda typ II-topoisomeraser), som krävs för bakteriell DNA-replikation, transkription, reparation och rekombination.
Motståndsmekanism
Verkningsmekanismen för fluorokinoloner, inklusive ciprofloxacin, skiljer sig från den för penicilliner, cefalosporiner, aminoglykosider, makrolider och tetracykliner; därför kan mikroorganismer som är resistenta mot dessa klasser av läkemedel vara mottagliga för ciprofloxacin. Resistens mot fluorokinoloner uppstår främst genom antingen mutationer i DNA-gyraserna, minskad yttre membranpermeabilitet eller läkemedelsutflöde. In vitro-resistens mot ciprofloxacin utvecklas långsamt genom flerstegsmutationer. Resistens mot ciprofloxacin på grund av spontana mutationer förekommer med en allmän frekvens på mellan
Korsmotstånd
Det finns ingen känd korsresistens mellan cipro 1000mgfloxacin och andra klasser av antimikrobiella medel.
Ciprofloxacin har visat sig vara aktivt mot de flesta isolat av följande bakterier, både in vitro och vid kliniska infektioner [se INDIKATIONER OCH ANVÄNDNING ].
Grampositiva bakterier
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (endast meticillinkänsliga isolat) Staphylococcus epidermidis (endast meticillinkänsliga isolat) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Gramnegativa bakterier
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Minst 90 procent av följande bakterier uppvisar en in vitro minsta hämmande koncentration (MIC) som är mindre än eller lika med den mottagliga brytpunkten för cipro 750mgfloxacin mot isolat av liknande släkte eller organismgrupp. Effekten av cipro 500mgfloxacin vid behandling av kliniska infektioner orsakade av dessa bakterier har dock inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Grampositiva bakterier
Staphylococcus haemolyticus (endast meticillinkänsliga isolat) Staphylococcus hominis (endast meticillinkänsliga isolat)
Gramnegativa bakterier
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder som erkänns av FDA för detta läkemedel, se: https://www.fda.gov/STIC.
Kliniska studier
Komplicerad urinvägsinfektion och pyelonefrit – effekt hos barn
CIPRO administrerat intravenöst och/eller oralt jämfördes med ett cefalosporin för behandling av cUTI och pyelonefrit hos pediatriska patienter i åldern 1 till 17 år (medelålder 6 ± 4 år). Rättegången genomfördes i USA, Kanada, Argentina, Peru, Costa Rica, Mexiko, Sydafrika och Tyskland. Behandlingstiden var 10 till 21 dagar (medelbehandlingslängden var 11 dagar med ett intervall på 1 till 88 dagar). Det primära syftet med studien var att bedöma muskuloskeletal och neurologisk säkerhet.
Patienterna utvärderades för klinisk framgång och bakteriologisk utrotning av baslinjeorganismen(-erna) utan ny infektion eller superinfektion 5 till 9 dagar efter behandlingen (Test of Cure eller TOC). Protokollpopulationen hade en eller flera orsakande organism(er) med protokoll specificerade koloniantal(er) vid baslinjen, inga protokollöverträdelser och inget för tidigt avbrott eller förlust till uppföljning (bland andra kriterier).
Den kliniska framgången och bakteriologiska utrotningsfrekvensen i populationen enligt protokoll var liknande mellan CIPRO 250 mg och jämförelsegruppen enligt nedan.
Inhalationsmjältbrand Hos Vuxna Och Pediatrik
De genomsnittliga serumkoncentrationerna av ciprofloxacin som är förknippade med en statistiskt signifikant förbättring av överlevnaden i rhesusapmodellen för inhalationsmjältbrand nås eller överskrids hos vuxna och pediatriska patienter som får orala och intravenösa behandlingar. Cipro 500mgfloxacins farmakokinetik har utvärderats i olika humanpopulationer. Den genomsnittliga maximala serumkoncentrationen som uppnås vid steady-state hos vuxna människor som får 500 mg oralt var 12:e timme är 2,97 mcg/ml och 4,56 mcg/ml efter 400 mg intravenöst var 12:e timme. Den genomsnittliga dalkoncentrationen i serum vid steady-state för båda dessa regimer är 0,2 mcg/ml. I en studie av 10 pediatriska patienter mellan 6 och 16 år var den genomsnittliga maximala plasmakoncentrationen 8,3 mcg/ml och dalkoncentrationerna varierar från 0,09 mcg/ml till 0,26 mcg/ml, efter två 30-minuters intravenösa infusioner på 10 mg/kg administrerat med 12 timmars mellanrum. Efter den andra intravenösa infusionen som patienter bytte till 15 mg/kg oralt var 12:e timme uppnår en genomsnittlig toppkoncentration på 3,6 mcg/ml efter den initiala orala dosen. Långtidssäkerhetsdata, inklusive effekter på brosk, efter administrering av CIPRO till pediatriska patienter är begränsade. Cipro 1000mgfloxacin serumkoncentrationer som uppnåtts hos människor fungerar som ett surrogateffektmått som rimligen kan förutsäga klinisk nytta och utgöra grunden för denna indikation.1
En placebokontrollerad djurstudie på rhesusapor som exponerats för en inhalerad medeldos på 11 LD50 (~5,5 x 105 sporer (intervall 5–30 LD50) av B. anthracis utfördes. Den minimala hämmande koncentrationen (MIC) av cipro 250mgfloxacin för mjältbrandsstammen som användes i denna studie var 0,08 mcg/ml. Hos de studerade djuren varierade medelserumkoncentrationerna av cipro 1000mgfloxacin vid förväntat Tmax (1 timme efter dosering) efter oral dosering till steady-state från 0,98 mcg/ml till 169. mcg/ml. Genomsnittliga dalkoncentrationer vid steady-state 12 timmar efter dosering varierade från 0,12 mcg/ml till 0,19 mcg/ml.6 Dödlighet på grund av mjältbrand för djur som fick en 30-dagars regim med oral cipro 750mgfloxacin med början av 750 mgfloxacin - exponeringen var signifikant lägre (1/9) jämfört med placebogruppen (9/10) [p= 0,001] Det enda CIPRO-behandlade djuret som dog av mjältbrand gjorde det efter 30-dagars administreringsperioden för läkemedel.7
Mer än 9300 personer rekommenderades att genomföra minst 60 dagars antibakteriell profylax mot eventuell inhalationsexponering för B. anthracis under 2001. CIPRO 250 mg rekommenderades till de flesta av dessa individer för hela eller delar av profylaxen. Vissa personer fick också mjältbrandsvaccin eller bytte till alternativa antibakteriella läkemedel. Ingen som fick CIPRO 1000mg eller andra behandlingar som profylaktisk behandling utvecklade därefter inhalationsmjältbrand. Antalet personer som fick CIPRO som hela eller delar av sin profylax efter exponering är okänt.
Plåga
En placebokontrollerad djurstudie på afrikanska gröna apor som exponerats för en inhalerad medeldos på 110 LD50 (intervall 92 till 127 LD50) av Yersinia pestis (CO92-stam) utfördes. Den minimala hämmande koncentrationen (MIC) av ciprofloxacin för Y. pestis-stammen som användes i denna studie var 0,015 mcg/ml. Den genomsnittliga maximala serumkoncentrationen av ciprofloxacin som uppnåddes vid slutet av en enstaka 60 minuters infusion var 3,49 ± mcg/ml 0,55 mcg/ml, 3,91 mcg/ml ± 0,58 mcg/ml och 4,03 mcg/ml ± 2,2 mL på dag ± 2,2 mL. Dag 6 respektive dag 10 av behandlingen på afrikanska gröna apor. Alla dalkoncentrationer (dag 2, dag 6 och dag 10) var
Djurtoxikologi och/eller farmakologi
Cipro 250mgfloxacin och andra kinoloner har visat sig orsaka artropati hos omogna djur av de flesta arter som testats [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Skador på viktbärande leder observerades hos unga hundar och råttor. Hos unga beaglar orsakade 100 mg/kg ciprofloxacin, givet dagligen i 4 veckor, degenerativa ledförändringar i knäleden. Vid 30 mg/kg var effekten på leden minimal. I en efterföljande studie på unga beaglehundar orsakade orala cipro 750mgfloxacindoser på 30 mg/kg och 90 mg/kg cipro 750mgfloxacin (ungefär 1,3 gånger och 3,5 gånger den pediatriska dosen baserat på jämförande plasma-AUC 2 veckor) dagliga AUC:er i plasma. förändringar som fortfarande observerades av histopatologi efter en behandlingsfri period på 5 månader. Vid 10 mg/kg (ungefär 0,6 gånger den pediatriska dosen baserat på jämförande plasma-AUC) observerades inga effekter på lederna. Denna dos var inte heller associerad med artrotoxicitet efter en ytterligare behandlingsfri period på 5 månader. I en annan studie minskade borttagning av viktbärande från leden lesionerna men förhindrade dem inte helt.
Kristalluri, ibland förknippad med sekundär nefropati, förekommer hos laboratoriedjur som doserats med ciprofloxacin. Detta är främst relaterat till den minskade lösligheten av ciprofloxacin under alkaliska förhållanden, som dominerar i urinen hos försöksdjur; hos människa är kristalluri sällsynt eftersom mänsklig urin vanligtvis är sur. Hos rhesusapor noterades kristalluri utan nefropati efter orala enstaka doser så låga som 5 mg/kg. (ungefär 0,07 gånger den högsta rekommenderade terapeutiska dosen baserat på kroppsyta). Efter 6 månaders intravenös dosering med 10 mg/kg/dag noterades inga nefropatologiska förändringar; dock observerades nefropati efter dosering med 20 mg/kg/dag under samma tid (ungefär 0,2 gånger den högsta rekommenderade terapeutiska dosen baserat på kroppsyta).
Hos hundar ger ciprofloxacin vid 3 mg/kg och 10 mg/kg genom snabb intravenös injektion (15 sek.) uttalade hypotensiva effekter. Dessa effekter anses vara relaterade till histaminfrisättning, eftersom de delvis antagoniseras av pyrilamin, ett antihistamin. Hos rhesusapor ger snabb intravenös injektion också hypotoni, men effekten hos denna art är inkonsekvent och mindre uttalad.
Hos möss har samtidig administrering av icke-steroida antiinflammatoriska läkemedel såsom fenylbutazon och indometacin med kinoloner rapporterats förstärka den CNS-stimulerande effekten av kinoloner.
Okulär toxicitet sett med vissa relaterade läkemedel har inte observerats hos ciprofloxacinbehandlade djur
REFERENSER
1. 21 CFR 314.510 (Subpart H – Accelererat godkännande av nya läkemedel för livshotande sjukdomar).
5. Rapport presenterad vid mötet i FDA:s rådgivande kommitté för anti-infektionsläkemedel och dermatologiska läkemedel, 31 mars 1993, Silver Spring, MD. Rapport tillgänglig från FDA, CDER, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, USA.
6. Kelly DJ, et al. Serumkoncentrationer av penicillin, doxycyklin och ciprofloxacin under långvarig behandling hos rhesusapor. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, et al. Postexponeringsprofylax mot experimentell inhalationsmjältbrand. J Infect Dis 1993; 167:1239-42.
8. Möte med rådgivande kommittén mot infektionsläkemedel, 3 april 2012 - Ciprofloxacins effektivitet för behandling av lungpest.
PATIENTINFORMATION
CIPRO® (Sip-row) (ciprofloxacinhydroklorid) tabletter, för oral användning
CIPRO® (Sip-rad) (cipro 1000mgfloxacin) för oral suspension
Läs denna medicinguide innan du börjar ta CIPRO 500mg och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling.
Vilken är den viktigaste informationen jag borde veta om CIPRO 500mg?
CIPRO, ett antibakteriellt läkemedel med fluorokinolon, kan orsaka allvarliga biverkningar. Vissa av dessa allvarliga biverkningar kan inträffa samtidigt och kan leda till döden.
Om du får någon av följande allvarliga biverkningar när du tar CIPRO, ska du sluta ta CIPRO 750 mg omedelbart och få medicinsk hjälp omedelbart.
1. Senruptur eller svullnad av senan (tendinit).
- Senproblem kan uppstå hos personer i alla åldrar som tar CIPRO. Senor är hårda vävnadssträngar som förbinder muskler med ben. Symtom på senproblem kan vara:
- smärta
- svullnad
- revor och svullnad av senor inklusive baksidan av fotleden (Achilles), axel, hand, tumme eller andra senor.
- Risken att få problem med senor medan du tar CIPRO är högre om du:
- är över 60 år
- tar steroider (kortikosteroider)
- har genomgått en njur-, hjärt- eller lungtransplantation.
- Senproblem kan uppstå hos personer som inte har ovanstående riskfaktorer när de tar CIPRO.
- Andra orsaker som kan öka risken för senproblem kan vara:
- fysisk aktivitet eller träning
- njursvikt
- senproblem i det förflutna, såsom hos personer med reumatoid artrit (RA).
- Sluta ta CIPRO omedelbart och få medicinsk hjälp omedelbart vid de första tecknen på sensmärta, svullnad eller inflammation. Det vanligaste området med smärta och svullnad är akillessenan på baksidan av din fotled. Detta kan även hända med andra senor.
- Senruptur kan inträffa medan du tar eller efter att du har slutat ta CIPRO. Senrupturer kan inträffa inom timmar eller dagar efter att de tagit CIPRO och har inträffat upp till flera månader efter att människor har slutat ta sin fluorokinolon.
- Sluta ta CIPRO 500 mg omedelbart och få medicinsk hjälp omedelbart om du får något av följande tecken eller symtom på en senoruptur:
- hör eller känner ett knäpp eller pop i ett senorområde
- blåmärken direkt efter en skada i ett senområde
- oförmögen att flytta det drabbade området eller bära vikt
Senproblemen kan vara bestående.
2. Förändringar i känsel och eventuell nervskada (perifer neuropati). Skador på nerverna i armar, händer, ben eller fötter kan inträffa hos personer som tar fluorokinoloner, inklusive CIPRO. Sluta ta CIPRO 750mg omedelbart och prata med din läkare omedelbart om du får något av följande symtom på perifer neuropati i armar, händer, ben eller fötter:
- smärta
- domningar
- brinnande
- svaghet
- stickningar
CIPRO 500 mg kan behöva stoppas för att förhindra permanent nervskada.
3. Effekter på centrala nervsystemet (CNS). Psykiska problem och anfall har rapporterats hos personer som tar antibakteriella läkemedel med fluorokinolon, inklusive CIPRO. Berätta för din vårdgivare om du har haft anfall innan du börjar ta CIPRO. CNS-biverkningar kan inträffa så snart efter att du tagit den första dosen CIPRO. Sluta ta CIPRO omedelbart och prata med din läkare omedelbart om du får någon av dessa biverkningar eller andra förändringar i humör eller beteende:
- anfall
- sömnproblem
- hör röster, se saker eller känna saker som inte finns där (hallucinationer)
- mardrömmar
- känna sig yr eller yr
- känna sig upprörd
- känna sig mer misstänksam (paranoia)
- skakningar
- självmordstankar eller handlingar
- känna sig orolig eller nervös
- huvudvärk som inte försvinner, med eller utan
- förvirring dimsyn
- depression
- minnesproblem
- minskad medvetenhet om omgivningen
- falska eller konstiga tankar eller övertygelser (vanföreställningar)
Dessa ändringar kan vara permanenta.
4. Försämring av myasthenia gravis (ett problem som orsakar muskelsvaghet). Fluorokinoloner som CIPRO 500 mg kan orsaka försämring av myasthenia gravis-symtom, inklusive muskelsvaghet och andningsproblem. Berätta för din vårdgivare om du har en historia av myasthenia gravis innan du börjar ta CIPRO. Ring din vårdgivare omedelbart om du har förvärrad muskelsvaghet eller andningsproblem.
Vad är CIPRO 750mg?
CIPRO är ett antibakteriellt läkemedel med fluorokinolon som används av vuxna 18 år och äldre för att behandla vissa infektioner orsakade av vissa bakterier som kallas bakterier. Dessa bakteriella infektioner inkluderar:
-
- urinvägsinfektion
- ben- och ledinfektion
- cervikal och urethral gonorré, okomplicerad
- kronisk prostatainfektion
- nosokomial lunginflammation
- personer med lågt antal vita blodkroppar och feber
- nedre luftvägsinfektion
- intraabdominal infektion, komplicerad
- inhalationsmjältbrand
- bihåleinflammation
- infektiös diarré
- plåga
- hudinfektion
- tyfoidfeber (tarmfeber).
- Studier av CIPRO 1000mg för användning vid behandling av pest och mjältbrand gjordes endast på djur, eftersom pest och mjältbrand inte kunde studeras hos människor.
- CIPRO 250mg ska inte användas till personer med akut exacerbation av kronisk bronkit, akut okomplicerad cystit och bihåleinflammation, om det finns andra tillgängliga behandlingsalternativ.
- CIPRO 750mg ska inte användas som förstahandsval av antibakteriell medicin för att behandla nedre luftvägsinfektioner orsakade av en viss typ av bakterie som kallas Streptococcus pneumoniae.
- CIPRO 1000mg används även till barn yngre än 18 år för att behandla komplicerade urinvägs- och njurinfektioner eller som kan ha andats in mjältbrandsbakterier, har pest eller har varit utsatt för pestbakterier.
- Barn yngre än 18 år har en högre risk att få problem med ben, leder eller senor (muskuloskeletala) såsom smärta eller svullnad när de tar CIPRO. CIPRO 500mg ska inte användas som förstahandsval av antibakteriell medicin till barn under 18 år.
Vem bör inte ta CIPRO 1000mg?
Ta inte CIPRO 500 mg om du:
- någonsin haft en allvarlig allergisk reaktion mot ett antibakteriellt läkemedel som kallas fluorokinolon, eller är allergisk mot cipro 500mgfloxacinhydroklorid eller något av innehållsämnena i CIPRO. Se slutet av denna medicineringsguide för en komplett lista över ingredienser i CIPRO.
- ta även ett läkemedel som heter tizanidin (Zanaflex®). Fråga din vårdgivare om du är osäker.
Vad ska jag berätta för min vårdgivare innan jag tar CIPRO?
Innan du tar CIPRO, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har problem med senor. CIPRO ska inte användas till personer som har haft senproblem i anamnesen.
- har en sjukdom som orsakar muskelsvaghet (myasthenia gravis). CIPRO ska inte användas till personer som har en känd historia av myasthenia gravis.
- har leverproblem.
- har problem med centrala nervsystemet (som epilepsi).
- har nervproblem. CIPRO 500mg ska inte användas till personer som har en historia av ett nervproblem som kallas perifer neuropati eller någon i din familj har en oregelbunden hjärtrytm eller hjärtinfarkt, särskilt ett tillstånd som kallas "QT-förlängning".
- har lågt blodkalium (hypokalemi) eller lågt magnesium (hypomagnesemi).
- har eller har haft anfall.
- har njurproblem. Du kan behöva en lägre dos av CIPRO 500 mg om dina njurar inte fungerar bra.
- har diabetes eller problem med lågt blodsocker (hypoglykemi).
- har ledproblem inklusive reumatoid artrit (RA).
- har svårt att svälja piller.
- är gravid eller planerar att bli gravid. Det är inte känt om CIPRO 250 mg kommer att skada ditt ofödda barn.
- ammar eller planerar att amma. CIPRO 250mg går över i din bröstmjölk.
- Du ska inte amma under behandling med CIPRO 500 mg och under 2 dagar efter att du tagit din sista dos av CIPRO. Du kan pumpa din bröstmjölk och slänga den under behandling med CIPRO och i 2 dagar efter att du tagit din sista dos av CIPRO.
- Om du tar CIPRO för inhalationsmjältbrand bör du och din vårdgivare bestämma om du kan fortsätta amma medan du tar CIPRO.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
- CIPRO 1000mg och andra läkemedel kan påverka varandra och orsaka biverkningar.
- Berätta särskilt för din vårdgivare om du tar:
- en steroidmedicin.
- ett antipsykotiskt läkemedel.
- ett tricykliskt antidepressivt medel.
- ett vattenpiller (vätskedrivande).
- teofyllin (såsom Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- ett läkemedel för att kontrollera din hjärtfrekvens eller rytm (antiarytmika).
- ett oralt läkemedel mot diabetes.
- fenytoin (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Phenytoin Sodium®, Prompt Phenytoin Sodium®, Phenytek®).
- cyklosporin (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- ett blodförtunnande medel (som warfarin, Coumadin®, Jantoven®).
- metotrexat (Trexall®).
- ropinirol (Requip®).
- klozapin (Clozaril®, Fazaclo® ODT®).
- ett icke-steroid antiinflammatoriskt läkemedel (NSAID). Många vanliga läkemedel för smärtlindring är NSAID. Att ta ett NSAID medan du tar CIPRO 500 mg eller andra fluorokinoloner kan öka risken för effekter på centrala nervsystemet och kramper.
- sildenafil (Viagra®, Revatio®).
- duloxetin.
- produkter som innehåller koffein.
- probenecid (Probalan®, Col-probenecid®).
- Vissa läkemedel kan hindra CIPRO tabletter och CIPRO oral suspension från att fungera korrekt. Ta CIPRO tabletter och oral suspension antingen 2 timmar före eller 6 timmar efter att du tagit dessa läkemedel, vitaminer eller kosttillskott:
- ett antacidum, multivitamin eller annat läkemedel eller kosttillskott som innehåller magnesium, kalcium, aluminium, järn eller zink.
- sukralfat (Carafate®).
- didanosin (Videx®, Videx EC®).
Fråga din vårdgivare om en lista över dessa läkemedel om du är osäker.
Vet vilka mediciner du tar. Håll en lista över dem för att visa din vårdgivare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta CIPRO 500mg?
- Ta CIPRO exakt som din läkare säger åt dig att ta det.
- Din vårdgivare kommer att tala om för dig hur mycket CIPRO du ska ta och när du ska ta det.
- CIPRO kan tas med eller utan mat.
- CIPRO ska inte tas tillsammans med mejeriprodukter (som mjölk eller yoghurt) eller kalciumberikade juicer enbart utan kan tas tillsammans med en måltid som innehåller dessa produkter.
- Drick mycket vätska medan du tar CIPRO.
- Hoppa inte över några doser av CIPRO eller sluta ta det, även om du börjar må bättre, förrän du avslutat din ordinerade behandling om inte:
- du har problem med senor. Ser "Vilken är den viktigaste informationen jag borde veta om CIPRO?"
- du har nervproblem. Ser "Vilken är den viktigaste informationen jag borde veta om CIPRO?"
- du har problem med centrala nervsystemet. Ser "Vilken är den viktigaste informationen jag borde veta om CIPRO 1000mg?"
- du har en allvarlig allergisk reaktion. Ser "Vilka är de möjliga biverkningarna av CIPRO 750mg?"
- din läkare säger åt dig att sluta ta CIPRO.
Att ta alla dina CIPRO-doser hjälper till att säkerställa att alla bakterier dödas. Om du tar alla dina CIPRO-doser minskar risken för att bakterierna blir resistenta mot CIPRO. Om du blir resistent mot CIPRO, kanske CIPRO 1000mg och andra antibakteriella läkemedel inte kommer att fungera för dig i framtiden.
-
Om du tar för mycket CIPRO 750mg, ring din vårdgivare eller få medicinsk hjälp omedelbart.
-
CIPRO levereras som en tablett med skåror (CIPRO 1000 mg tabletter), oral suspension (CIPRO 750 mg oral suspension), tablett med förlängd frisättning (CIPRO XR) och injektion för intravenös infusion (CIPRO IV). Läs och följ instruktionerna nedan för den typ av CIPRO 500mg din läkare har ordinerat åt dig.
CIPRO tabletter:
- CIPRO tabletter kommer som 250 mg och 500 mg tabletter med skåror som kan tas hela eller kan delas på mitten vid den skårade linjen. Din vårdgivare kommer att tala om för dig hur mycket CIPRO 500 mg tabletter du ska ta och om du kommer att behöva dela CIPRO 1000 mg tabletter på mitten för att få din ordinerade dos.
- Ta CIPRO tabletter morgon och kväll vid ungefär samma tid varje dag. Krossa eller tugga inte tabletten. Berätta för din vårdgivare om du inte kan svälja tabletten.
- Om du missar en dos av CIPRO 500 mg tabletter och det är:
- 6 timmar eller mer till din nästa schemalagda dos, ta din missade dos omedelbart. Ta sedan nästa dos vid din vanliga tidpunkt.
- mindre än 6 timmar förrän nästa schemalagda dos, ta inte den missade dosen. Ta nästa dos vid din ordinarie tid.
- Ta inte 2 doser CIPRO 750 mg tabletter vid en gång för att kompensera för en missad dos. Om du är osäker på när du ska ta CIPRO 500 mg tabletter efter en missad dos, fråga din vårdgivare eller apotekspersonal.
CIPRO oral suspension:
- Ta CIPRO 1000 mg oral suspension på morgonen och kvällen vid ungefär samma tidpunkt varje dag. Skaka CIPRO 750 mg oral suspensionsflaska väl varje gång före användning i cirka 15 sekunder för att säkerställa att suspensionen är väl blandad. Stäng flaskan helt efter användning.
- Om du missar en dos av CIPRO oral suspension och det är:
- 6 timmar eller mer till din nästa schemalagda dos, ta din missade dos omedelbart. Ta sedan nästa dos vid din vanliga tidpunkt.
- mindre än 6 timmar förrän nästa schemalagda dos, ta inte den missade dosen. Ta nästa dos vid din ordinarie tid.
- Ta inte 2 doser CIPRO 750 mg oral suspension vid en gång för att kompensera för en missad dos. Om du inte är säker på när du ska ta CIPRO Oral Suspension efter en missad dos, fråga din läkare eller apotekspersonal.
Vad ska jag undvika när jag tar CIPRO?
- CIPRO 250mg kan få dig att känna dig yr och yr. Kör inte bil, använd inte maskiner eller gör andra aktiviteter som kräver mental vakenhet eller koordination förrän du vet hur CIPRO 250 mg påverkar dig.
- Undvik solljus, solarier och försök att begränsa din tid i solen. CIPRO 500mg kan göra din hud känslig för solen (ljuskänslighet) och ljuset från sollampor och solarier. Du kan få en allvarlig solbränna, blåsor eller svullnad av huden. Om du får något av dessa symtom när du tar CIPRO 250mg, kontakta din läkare omedelbart. Du bör använda en solkräm och bära en hatt och kläder som täcker din hud om du måste vara i solljus.
Vilka är de möjliga biverkningarna av CIPRO?
CIPRO kan orsaka allvarliga biverkningar, inklusive:
- Ser "Vilken är den viktigaste informationen jag borde veta om CIPRO?"
- Allvarliga allergiska reaktioner. Allvarliga allergiska reaktioner, inklusive dödsfall, kan inträffa hos personer som tar fluorokinoloner, inklusive CIPRO, även efter endast 1 dos. Sluta ta CIPRO och få akut medicinsk hjälp omedelbart om du får något av följande symtom på en allvarlig allergisk reaktion:
- nässelfeber
- snabba hjärtslag
- svårt att andas eller svälja
- svag
- svullnad av läppar, tunga, ansikte
- hudutslag
- trånghet i halsen, heshet
Hudutslag kan uppstå hos personer som tar CIPRO 1000 mg även efter endast 1 dos. Sluta ta CIPRO 500 mg vid första tecken på hudutslag och ring din vårdgivare. Hudutslag kan vara ett tecken på en allvarligare reaktion på CIPRO.
- Leverskada (hepatotoxicitet). Hepatotoxicitet kan inträffa hos personer som tar CIPRO. Ring din vårdgivare omedelbart om du har oförklarliga symtom som:
- illamående eller kräkningar
- ovanlig trötthet
- magont
- aptitlöshet
- feber
- ljusa tarmrörelser
- svaghet
- mörkfärgad urin
- buksmärtor eller ömhet
- gulfärgning av huden och ögonvitorna
- klåda
Sluta ta CIPRO 750 mg och berätta omedelbart för din läkare om du får gulfärgning på huden eller vita delen av ögonen eller om du har mörk urin. Dessa kan vara tecken på en allvarlig reaktion på CIPRO (ett leverproblem).
- Aortaaneurysm och dissektion. Berätta för din vårdgivare om du någonsin har fått veta att du har ett aortaaneurysm, en svullnad av den stora artären som transporterar blod från hjärtat till kroppen. Få akut medicinsk hjälp omedelbart om du plötsligt har ont i bröstet, magen eller ryggen.
- Tarminfektion (Clostridioides difficile – associerad diarré). Clostridioides difficile-associerad diarré (CDAD) kan inträffa med många antibakteriella läkemedel, inklusive CIPRO. Ring din vårdgivare direkt om du får vattnig diarré, diarré som inte försvinner eller blodig avföring. Du kan ha magkramper och feber. CDAD kan inträffa 2 eller fler månader efter att du har avslutat din antibakteriella medicin.
- Allvarliga hjärtrytmförändringar (QT-förlängning och torsade de pointes). Berätta omedelbart för din vårdgivare om du har en förändring i ditt hjärtslag (en snabb eller oregelbunden hjärtrytm) eller om du svimmar. CIPRO kan orsaka ett sällsynt hjärtproblem som kallas förlängning av QT-intervallet. Detta tillstånd kan orsaka onormalt hjärtslag och kan vara mycket farligt. Chansen för denna händelse är högre hos människor:
- som är äldre.
- med en familjehistoria med förlängt QT-intervall.
- med lågt blodkalium (hypokalemi) eller lågt magnesium (hypomagnesemi).
- som tar vissa mediciner för att kontrollera hjärtrytmen (antiarytmika).
- Ledproblem. Ökad risk för problem med leder och vävnader runt leder hos barn under 18 år kan inträffa. Berätta för ditt barns vårdgivare om ditt barn har några ledproblem under eller efter behandling med CIPRO.
- Känslighet för solljus (ljuskänslighet). Se "Vad ska jag undvika när jag tar CIPRO 250mg?"
- Förändringar i blodsockret. Personer som tar CIPRO och andra fluorokinolonläkemedel tillsammans med orala läkemedel mot diabetes eller med insulin kan få lågt blodsocker (hypoglykemi) och högt blodsocker (hyperglykemi). Följ din vårdgivares instruktioner för hur ofta du ska kontrollera ditt blodsocker. Om du har diabetes och du får lågt blodsocker när du tar CIPRO, sluta ta CIPRO och ring din vårdgivare omedelbart. Din antibiotikamedicin kan behöva ändras.
De vanligaste biverkningarna av CIPRO 750mg inkluderar:
- illamående
- diarre
- förändringar i leverfunktionstester
- kräkningar
- utslag
Berätta för din vårdgivare om eventuella biverkningar som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av CIPRO. För mer information, fråga din vårdgivare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara CIPRO?
CIPRO 500mg tabletter
- Förvara i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
CIPRO 750mg oral suspension
- Förvara mikrokapslar och spädningsmedel i rumstemperatur upp till 77°F (25°C).
- Frys inte.
- Efter att din CIPRO-behandling är avslutad, kasta på ett säkert sätt all oanvänd oral suspension.
Förvara CIPRO 250mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av CIPRO.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte CIPRO för ett tillstånd som det inte är ordinerat för. Ge inte CIPRO till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna medicinguide sammanfattar den viktigaste informationen om CIPRO. Om du vill ha mer information om CIPRO, prata med din vårdgivare. Du kan fråga din vårdgivare eller apotekspersonal om information om CIPRO 250mg som är skriven för vårdpersonal.
Vilka är ingredienserna i CIPRO 500mg?
CIPRO 1000mg tabletter:
- Aktiv beståndsdel: cipro 250mgfloxacinhydroklorid
- Inaktiva Ingredienser: majsstärkelse, krospovidon, hypromellos, magnesiumstearat, mikrokristallin cellulosa, polyetylenglykol, kiseldioxid och titandioxid.
CIPRO oral suspension:
- Aktiv beståndsdel: ciprofloxacin
- Inaktiva Ingredienser:
- Mikrokapslar innehåller: hypromellos, magnesiumstearat, metakrylsyrasampolymer och polysorbat 20 och povidon.
- Spädningsmedel innehåller: medelkedjiga triglycerider, sackaros, sojalecitin, vatten och jordgubbssmak.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
