Tofranil 25mg, 50mg, 75mg Imipramine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Tofranil och hur används det?
Tofranil 50mg är ett receptbelagt läkemedel som används för att behandla symtom på depression. Tofranil 25mg kan användas ensamt eller tillsammans med andra läkemedel.
Tofranil tillhör en klass av läkemedel som kallas antidepressiva medel, TCA.
Det är inte känt om Tofranil är säkert och effektivt hos barn yngre än 6 år.
Vilka är de möjliga biverkningarna av Tofranil 50mg?
Tofranil kan orsaka allvarliga biverkningar inklusive:
- humör eller beteendeförändringar,
- ångest,
- panikattacker,
- sömnproblem,
- impulsivt beteende,
- irritabilitet,
- agitation,
- fientlighet,
- aggression,
- rastlöshet,
- hyperaktivitet (mentalt eller fysiskt),
- mer depression,
- självmordstankar,
- suddig syn,
- tunnelseende,
- ögonsmärta eller svullnad,
- ser glorier runt ljus,
- yrsel,
- ny eller förvärrad bröstsmärta,
- bultande hjärtslag,
- fladdrande i ditt bröst,
- plötslig domningar eller svaghet,
- problem med syn, tal eller balans,
- feber,
- öm hals,
- förvirring,
- hallucinationer,
- ovanliga tankar eller beteende,
- smärtsam eller svår urinering,
- anfall och
- gulfärgning av huden eller ögonen (gulsot)
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Tofranil inkluderar:
- pirrande känsla,
- svaghet,
- bristande koordination,
- torr mun,
- illamående,
- kräkningar,
- förstoppning,
- diarre,
- synförändringar,
- ringer i dina öron,
- bröstsvällning (både män och kvinnor),
- minskad sexlust,
- impotens och
- svårt att få orgasm
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Tofranil. För mer information, fråga din läkare eller apotekspersonal.
Suicidalitet och antidepressiva läkemedel
Antidepressiva läkemedel ökade risken jämfört med placebo för suicidtänkande och suicidalitet (suicidalitet) hos barn, ungdomar och unga vuxna i korttidsstudier av egentlig depression (MDD) och andra psykiatriska störningar. Alla som överväger att använda imipraminhydroklorid eller något annat antidepressivt medel hos ett barn, tonåring eller ung vuxen måste balansera denna risk med det kliniska behovet. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det fanns en minskning av risken med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre. Depression och vissa andra psykiatriska störningar är i sig förknippade med ökad risk för självmord. Patienter i alla åldrar som påbörjas med antidepressiv behandling bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet eller ovanliga beteendeförändringar. Familjer och vårdgivare bör informeras om behovet av noggrann observation och kommunikation med förskrivaren. Imipraminhydroklorid är inte godkänt för användning hos pediatriska patienter (se VARNINGAR Klinisk försämring och självmordsrisk; FÖRSIKTIGHETSÅTGÄRDER Information för patienter; och FÖRSIKTIGHETSÅTGÄRDER , Pediatrisk användning).
BESKRIVNING
Tofranil™ tillhandahålls i tablettform för oral administrering.
Tofranil 75mg, imipraminhydroklorid USP, det ursprungliga tricykliska antidepressiva medlet, är en medlem av dibensazepingruppen av föreningar. Den betecknas 5-3-(dimetylamino)propyl-10,11-dihydro-5Hdibens[b,f]-azepinmonohydroklorid. Dess strukturformel är:
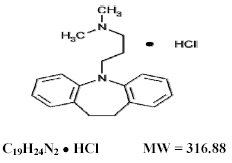
Imipraminhydroklorid USP är ett vitt till benvitt, luktfritt eller praktiskt taget luktfritt kristallint pulver. Det är fritt lösligt i vatten och i alkohol, lösligt i aceton och olösligt i eter och i bensen.
Inaktiva Ingredienser
Kalciumfosfat, cellulosaföreningar, dokusatnatrium, järnoxider, magnesiumstearat, polyetylenglykol, povidon, natriumstärkelseglykolat, sackaros, talk och titandioxid.
INDIKATIONER
Depression
För lindring av symtom på depression. Endogen depression är mer sannolikt att lindras än andra depressiva tillstånd. En till tre veckors behandling kan behövas innan optimala terapeutiska effekter är uppenbara.
Enures i barndomen
Kan vara användbar som tillfällig tilläggsterapi för att minska enures hos barn i åldern 6 år och äldre, efter att möjliga organiska orsaker har uteslutits genom lämpliga tester. Hos patienter som har symtom på dagtid med frekvens och brådska, bör undersökningen innefatta tömningscystouretrografi och cystoskopi vid behov. Effektiviteten av behandlingen kan minska med fortsatt läkemedelsadministrering.
DOSERING OCH ADMINISTRERING
Depression
Lägre doser rekommenderas för äldre patienter och ungdomar. Lägre doser rekommenderas också för polikliniska patienter jämfört med inlagda patienter som kommer att vara under noggrann övervakning. Doseringen bör initieras på en låg nivå och ökas gradvis, varvid det kliniska svaret och eventuella tecken på intolerans noggrant noteras. Efter remission kan underhållsmedicin behövas under en längre tid, vid den lägsta dos som upprätthåller remission.
Vanlig vuxendos
Inlagda patienter
Initialt ökade 100 mg/dag i uppdelade doser gradvis till 200 mg/dag efter behov. Om inget svar efter två veckor, öka till 250 till 300 mg/dag.
Polispatienter
Initialt ökade 75 mg/dag till 150 mg/dag. Doser över 200 mg/dag rekommenderas inte. Underhåll, 50 till 150 mg/dag.
Ungdoms- och geriatriska patienter
Inledningsvis 30 till 40 mg/dag; det är i allmänhet inte nödvändigt att överskrida 100 mg/dag.
Enures i barndomen
Inledningsvis bör en oral dos på 25 mg/dag prövas till barn från 6 år och äldre. Medicin bör ges en timme före sänggåendet. Om ett tillfredsställande svar inte inträffar inom en vecka, öka dosen till 50 mg per natt hos barn under 12 år; barn över 12 år kan få upp till 75 mg per natt. En daglig dos större än 75 mg ökar inte effekten och tenderar att öka biverkningarna. Bevis tyder på att läkemedlet är mer effektivt för sängvätare tidigt på natten och i uppdelade mängder, dvs. 25 mg mitt på eftermiddagen, upprepat vid sänggåendet. Man bör överväga att inleda en läkemedelsfri period efter en adekvat terapeutisk prövning med gynnsamt svar. Doseringen bör minskas gradvis i stället för att abrupt avbrytas; detta kan minska tendensen till återfall. Barn som återfaller när läkemedlet avbryts svarar inte alltid på en efterföljande behandling.
En dos på 2,5 mg/kg/dag bör inte överskridas. EKG-förändringar av okänd betydelse har rapporterats hos pediatriska patienter med doser som är dubbelt så stora.
Säkerheten och effektiviteten av Tofranil som tillfällig tilläggsbehandling för nattlig enures hos barn under 6 år har inte fastställts.
HUR LEVERERAS
De tre styrkorna av Tofranil™ (imipraminhydroklorid USP) är tillgängliga enligt följande:
– triangulär, bikonvex, korallrödbrun, sockerdragerad tablett, märkt med på ena sidan och ”10” på den andra sidan i svart.
30 flaskor NDC 0406-9920-03 Flaskor med 100 st NDC 0406-9920-01
– rund, bikonvex, korallrödbrun, sockerdragerad tablett, märkt med på ena sidan och ”25” på den andra sidan i svart.
30 flaskor NDC 0406-9921-03 Flaskor med 100 st NDC 0406-9921-01
– rund, bikonvex, korallrödbrun, sockerdragerad tablett, märkt med på ena sidan och ”50” på den andra sidan i svart.
30 flaskor NDC 0406-9922-03 Flaskor à 100 st NDC 0406-9922-01
Förvara vid 20° till 25°C (68° till 77°F) [se USP kontrollerad rumstemperatur].
Fördela i tät behållare (USP) med barnsäker förslutning.
Tillverkad av: Patheon Inc. Whitby, Ontario, Kanada, L1N 5Z5. Reviderad: april 2017
BIEFFEKTER
Notera – Även om listan som följer inkluderar ett fåtal biverkningar som inte har rapporterats med detta specifika läkemedel, kräver de farmakologiska likheterna mellan de tricykliska antidepressiva läkemedlen att var och en av reaktionerna beaktas när Tofranil 25 mg administreras.
Kardiovaskulär: Ortostatisk hypotoni, hypertoni, takykardi, hjärtklappning, hjärtinfarkt, arytmier, hjärtblock, EKG-förändringar, utfällning av kronisk hjärtsvikt, stroke.
Psykiatrisk: Förvirringstillstånd (särskilt hos äldre) med hallucinationer, desorientering, vanföreställningar; ångest, rastlöshet, agitation; sömnlöshet och mardrömmar; hypomani; förvärring av psykos.
Neurologiska: Domningar, stickningar, parestesier i extremiteter; inkoordination, ataxi, skakningar; perifer neuropati; extrapyramidala symtom; anfall, förändringar i EEG-mönster; tinnitus.
Antikolinergika: Muntorrhet och, sällan, associerad sublingual adenit; dimsyn, logistörningar, mydriasis; förstoppning, paralytisk ileus; urinretention, försenad miktion, dilatation av urinvägarna.
Allergisk: Hudutslag, petekier, urtikaria, klåda, fotosensibilisering; ödem (allmänt eller i ansikte och tunga); drogfeber; korskänslighet med desipramin.
Hematologiska: Benmärgsdepression inklusive agranulocytos; eosinofili; purpura; trombocytopeni.
Gastrointestinala: Illamående och kräkningar, anorexi, epigastrisk besvär, diarré; säregen smak, stomatit, magkramper, svart tunga.
Endokrin: Gynekomasti hos män; bröstförstoring och galaktorré hos honan; ökad eller minskad libido, impotens; testikelsvullnad; förhöjning eller sänkning av blodsockernivåer; olämpligt antidiuretiskt hormon (ADH) sekretionssyndrom.
Övrig: Gulsot (simulerande obstruktiv); förändrad leverfunktion; viktökning eller förlust; svett; spolning; Urinfrekvens; dåsighet, yrsel, svaghet och trötthet; huvudvärk; parotis svullnad; alopeci; fallbenägenhet.
Abstinenssymptom: Även om det inte tyder på beroende, kan plötsligt avbrytande av behandlingen efter långvarig behandling orsaka illamående, huvudvärk och sjukdomskänsla.
Notera – Hos enuretiska barn som behandlats med Tofranil 75 mg har de vanligaste biverkningarna varit nervositet, sömnstörningar, trötthet och lindriga gastrointestinala störningar. Dessa försvinner vanligtvis under fortsatt läkemedelsadministrering eller när dosen minskas. Andra reaktioner som har rapporterats inkluderar förstoppning, kramper, ångest, emotionell instabilitet, synkope och kollaps. Alla biverkningar som rapporterats vid användning av vuxna bör beaktas.
LÄKEMEDELSINTERAKTIONER
Läkemedel som metaboliseras av P450 2D6
Den biokemiska aktiviteten hos det läkemedelsmetaboliserande isozymet cytokrom P450 2D6 (debrisoquinhydroxylas) är reducerad i en undergrupp av den kaukasiska befolkningen (cirka 7 % till 10 % av kaukasierna är så kallade "dåliga metaboliserare"); Tillförlitliga uppskattningar av förekomsten av minskad P450 2D6-isozymaktivitet bland asiatiska, afrikanska och andra populationer är ännu inte tillgängliga. Dåliga metaboliserare har högre än förväntade plasmakoncentrationer av tricykliska antidepressiva (TCA) när de ges vanliga doser. Beroende på andelen läkemedel som metaboliseras av P450 2D6 kan ökningen i plasmakoncentration vara liten eller ganska stor (8-faldig ökning av plasma-AUC för TCA).
Dessutom hämmar vissa läkemedel aktiviteten av detta isozym och gör att normala metaboliserare liknar dåliga metaboliserare. En individ som är stabil på en given dos av TCA kan bli plötsligt giftig när den ges ett av dessa hämmande läkemedel som samtidig behandling. De läkemedel som hämmar cytokrom P450 2D6 inkluderar några som inte metaboliseras av enzymet (kinidin; cimetidin) och många som är substrat för P450 2D6 (många andra antidepressiva medel, fenotiaziner och typ 1C antiarytmika propafenon och flekainid). Medan alla selektiva serotoninåterupptagshämmare (SSRI), t.ex. fluoxetin, sertralin och paroxetin, hämmar P450 2D6, kan de variera i omfattningen av hämning. I vilken utsträckning SSRI-TCA-interaktion kan orsaka kliniska problem kommer att bero på graden av hämning och farmakokinetiken för det inblandade SSRI:t. Icke desto mindre är försiktighet indikerad vid samtidig administrering av TCA med någon av SSRI-preparaten och även vid byte från en klass till en annan. Av särskild vikt måste det förflyta tillräckligt med tid innan TCA-behandling påbörjas hos en patient som slutar med fluoxetin, med tanke på den långa halveringstiden för föräldern och den aktiva metaboliten (minst 5 veckor kan vara nödvändigt).
Samtidig användning av tricykliska antidepressiva medel och läkemedel som kan hämma cytokrom P450 2D6 kan kräva lägre doser än vad som vanligtvis föreskrivs för antingen det tricykliska antidepressiva medlet eller det andra läkemedlet. Dessutom, närhelst något av dessa andra läkemedel tas bort från samtidig behandling, kan en ökad dos av tricykliskt antidepressivt medel krävas. Det är önskvärt att övervaka TCA-plasmanivåer närhelst en TCA kommer att administreras samtidigt med ett annat läkemedel som är känt för att vara en hämmare av P450 2D6.
Plasmakoncentrationen av imipramin kan öka när läkemedlet ges samtidigt med leverenzyminhibitorer (t.ex. cimetidin, fluoxetin) och minska vid samtidig administrering med leverenzyminducerare (t.ex. barbiturater, fenytoin), och justering av dosen av imipramin kan därför vara nödvändigt.
Hos enstaka känsliga patienter eller hos de som dessutom får antikolinerga läkemedel (inklusive medel mot parkinsonism) kan de atropinliknande effekterna bli mer uttalade (t.ex. paralytisk ileus). Noggrann övervakning och noggrann justering av dosen krävs när imipraminhydroklorid administreras samtidigt med antikolinerga läkemedel.
Undvik användningen av preparat, såsom avsvällande medel och lokalanestetika, som innehåller någon sympatomimetisk amin (t.ex. epinefrin, noradrenalin), eftersom det har rapporterats att tricykliska antidepressiva medel kan potentiera effekten av katekolaminer.
Försiktighet bör iakttas när imipraminhydroklorid används tillsammans med medel som sänker blodtrycket. Imipraminhydroklorid kan förstärka effekten av CNS-depressiva läkemedel.
Patienter bör varnas för att imipraminhydroklorid kan förstärka de CNS-depressiva effekterna av alkohol (se VARNINGAR ).
VARNINGAR
Klinisk försämring och självmordsrisk
Patienter med egentlig depression (MDD), både vuxna och barn, kan uppleva förvärring av sin depression och/eller uppkomsten av självmordstankar och självmordsbeteende (suicidalitet) eller ovanliga beteendeförändringar, oavsett om de tar antidepressiva mediciner eller inte, och detta risken kan kvarstå tills betydande remission inträffar. Självmord är en känd risk för depression och vissa andra psykiatriska störningar, och dessa störningar i sig är de starkaste prediktorerna för självmord. Det har dock funnits en långvarig oro för att antidepressiva medel kan ha en roll i att framkalla förvärring av depression och uppkomsten av suicidalitet hos vissa patienter under de tidiga faserna av behandlingen. Sammanslagna analyser av kortvariga placebokontrollerade studier av antidepressiva läkemedel (SSRI och andra) visade att dessa läkemedel ökar risken för suicidtänkande och självmordsbeteende (suicidalitet) hos barn, ungdomar och unga vuxna (åldrar 18 till 24) med svår depression. störning (MDD) och andra psykiatriska störningar. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det var en minskning med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre.
De sammanslagna analyserna av placebokontrollerade studier på barn och ungdomar med MDD, tvångssyndrom (OCD) eller andra psykiatriska störningar inkluderade totalt 24 korttidsstudier av 9 antidepressiva läkemedel på över 4400 patienter. De sammanslagna analyserna av placebokontrollerade studier på vuxna med MDD eller andra psykiatriska störningar inkluderade totalt 295 korttidsstudier (medianlängd på 2 månader) av 11 antidepressiva läkemedel på över 77 000 patienter. Det fanns avsevärd variation i risk för suicidalitet bland droger, men en tendens till en ökning av de yngre patienterna för nästan alla studerade droger. Det fanns skillnader i absolut risk för suicidalitet mellan de olika indikationerna, med den högsta förekomsten av MDD. Riskskillnaderna (läkemedel kontra placebo) var dock relativt stabila inom åldersskikt och över indikationer. Dessa riskskillnader (skillnad mellan läkemedel och placebo i antalet fall av suicidalitet per 1 000 behandlade patienter) anges i tabell 1.
Inga självmord inträffade i någon av de pediatriska prövningarna. Det förekom självmord i vuxenstudierna, men antalet var inte tillräckligt för att dra någon slutsats om läkemedelseffekt på självmord.
Det är okänt om suicidalitetsrisken sträcker sig till långvarig användning, dvs. längre än flera månader. Det finns dock betydande bevis från placebokontrollerade underhållsstudier på vuxna med depression att användning av antidepressiva medel kan fördröja återkommande depression.
Alla patienter som behandlas med antidepressiva medel för någon indikation bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet och ovanliga beteendeförändringar, särskilt under de första månaderna av en läkemedelsbehandlingskur, eller vid tidpunkter med dosförändringar, antingen ökningar eller minskar.
Följande symtom, ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani och mani, har rapporterats hos vuxna och pediatriska patienter som behandlas med antidepressiva medel även för egentlig depression vad gäller andra indikationer, både psykiatriska och icke-psykiatriska. Även om ett orsakssamband mellan uppkomsten av sådana symtom och antingen försämringen av depression och/eller uppkomsten av självmordsimpulser inte har fastställts, finns det oro för att sådana symtom kan representera föregångare till framväxande suicidalitet.
Man bör överväga att ändra den terapeutiska kuren, inklusive eventuellt avbrytande av medicineringen, hos patienter vars depression är ihållande värre, eller som upplever framväxande suicidalitet eller symtom som kan vara prekursorer till förvärrad depression eller suicidalitet, särskilt om dessa symtom är allvarliga, plötsliga. i början, eller var inte en del av patientens uppvisande symtom.
Familjer och vårdgivare till patienter som behandlas med antidepressiva medel för allvarlig depressiv sjukdom eller andra indikationer, både psykiatriska och icke-psykiatriska, bör uppmärksammas om behovet av att övervaka patienter för uppkomsten av agitation, irritabilitet, ovanliga beteendeförändringar och de andra symtomen som beskrivs ovan. , såväl som uppkomsten av suicidalitet, och att rapportera sådana symtom omedelbart till vårdgivare. Sådan övervakning bör innefatta daglig observation av familjer och vårdgivare. Recept på imipraminhydroklorid bör skrivas ut för den minsta mängden tabletter som överensstämmer med god patienthantering, för att minska risken för överdosering.
Screening av patienter för bipolär sjukdom
En allvarlig depressiv episod kan vara den första presentationen av bipolär sjukdom. Det anses allmänt (även om det inte har fastställts i kontrollerade studier) att behandling av en sådan episod med enbart ett antidepressivt läkemedel kan öka sannolikheten för utfällning av en blandad/manisk episod hos patienter med risk för bipolär sjukdom. Huruvida något av de ovan beskrivna symptomen representerar en sådan omvandling är okänt. Innan behandling med ett antidepressivt läkemedel påbörjas bör dock patienter med depressiva symtom screenas på lämpligt sätt för att fastställa om de löper risk för bipolär sjukdom; sådan screening bör inkludera en detaljerad psykiatrisk historia, inklusive en familjehistoria av självmord, bipolär sjukdom och depression. Det bör noteras att imipraminhydroklorid inte är godkänt för användning vid behandling av bipolär depression.
Stängningsvinkelglaukom
Pupillvidgningen som uppstår efter användning av många antidepressiva läkemedel inklusive Tofranil kan utlösa en vinkelattack hos en patient med anatomiskt smala vinklar som inte har en patenterad iridektomi.
Barn
En dos på 2,5 mg/kg/dag av Tofranil 25 mg bör inte överskridas i barndomen. EKG-förändringar av okänd betydelse har rapporterats hos pediatriska patienter med doser som är dubbelt så stora.
Extrem försiktighet bör iakttas när detta läkemedel ges till: patienter med hjärt-kärlsjukdom på grund av risken för ledningsdefekter, arytmier, kronisk hjärtsvikt, hjärtinfarkt, stroke och takykardi. Dessa patienter kräver hjärtövervakning vid alla doseringsnivåer av läkemedlet;
patienter med anamnes på urinretention, eller historia av trångvinkelglaukom på grund av läkemedlets antikolinerga egenskaper; hypertyreoideapatienter eller de som tar sköldkörtelmedicin på grund av risken för kardiovaskulär toxicitet;
patienter med en historia av anfallsstörning eftersom detta läkemedel har visat sig sänka anfallströskeln;
patienter som får guanetidin, klonidin eller liknande medel, eftersom Tofranil kan blockera de farmakologiska effekterna av dessa läkemedel;
patienter som får metylfenidathydroklorid. Eftersom metylfenidathydroklorid kan hämma metabolismen av Tofranil 75 mg, kan nedjustering av dosen av imipraminhydroklorid behövas när det ges samtidigt med metylfenidathydroklorid.
Tofranil kan förstärka de CNS-depressiva effekterna av alkohol. Därför bör man komma ihåg att riskerna med ett självmordsförsök eller oavsiktlig överdosering av läkemedlet kan öka för patienten som använder för stora mängder alkohol (se FÖRSIKTIGHETSÅTGÄRDER ).
Eftersom Tofranil kan försämra den mentala och/eller fysiska förmågan som krävs för att utföra potentiellt farliga uppgifter, såsom att köra bil eller maskiner, bör patienten varnas i enlighet därmed.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
En EKG-registrering bör göras före påbörjandet av större doser av Tofranil än vanligt och med lämpliga intervall därefter tills steady state uppnås. (Patienter med tecken på kardiovaskulär sjukdom kräver hjärtövervakning vid alla doseringsnivåer av läkemedlet. Se VARNINGAR .) Äldre patienter och patienter med hjärtsjukdom eller tidigare hjärtsjukdom i anamnesen löper en speciell risk att utveckla hjärtavvikelser i samband med användning av Tofranil.
Man bör komma ihåg att risken för självmord hos allvarligt deprimerade patienter är inneboende i sjukdomen och kan kvarstå tills betydande remission inträffar. Sådana patienter bör övervakas noggrant under den tidiga fasen av behandlingen med Tofranil 75 mg och kan behöva sjukhusvård. Recept bör skrivas ut för minsta möjliga mängd. Hypomana eller maniska episoder kan förekomma, särskilt hos patienter med cykliska störningar. Sådana reaktioner kan göra det nödvändigt att avbryta läkemedlet. Vid behov kan Tofranil 75 mg återupptas i lägre dos när dessa episoder lindras.
Administrering av ett lugnande medel kan vara användbart för att kontrollera sådana episoder.
En aktivering av psykosen kan ibland observeras hos schizofrena patienter och kan kräva minskning av dosen och tillägg av ett fenotiazin.
Samtidig administrering av Tofranil 50 mg och elektrochockbehandling kan öka riskerna; sådan behandling bör begränsas till de patienter för vilka den är väsentlig, eftersom det finns begränsad klinisk erfarenhet.
Patienter som tar imipraminhydroklorid bör undvika överdriven exponering för solljus eftersom det har förekommit rapporter om fotosensibilisering.
Både förhöjda och sänkta blodsockernivåer har rapporterats vid användning av imipraminhydroklorid.
Imipraminhydroklorid ska användas med försiktighet till patienter med signifikant nedsatt njur- eller leverfunktion.
Patienter som utvecklar feber och ont i halsen under behandling med imipraminhydroklorid bör få leukocytvärden och differentiella blodvärden. Imipraminhydroklorid ska avbrytas om det finns tecken på patologisk neutrofil depression.
Före elektiv kirurgi ska imipraminhydroklorid sättas ut så länge som den kliniska situationen tillåter.
Information för patienter
Förskrivare eller annan hälso- och sjukvårdspersonal bör informera patienter, deras familjer och deras vårdgivare om fördelarna och riskerna med behandling med imipraminhydroklorid och bör ge dem råd om lämplig användning. En patient Läkemedelsguide om "Antidepressiva läkemedel, depression och andra allvarliga psykiska sjukdomar och självmordstankar eller handlingar" finns tillgänglig för imipraminhydroklorid. Förskrivaren eller sjukvårdspersonalen bör instruera patienter, deras familjer och deras vårdgivare att läsa medicinguiden och bör hjälpa dem att förstå innehållet. Patienterna ska ges möjlighet att diskutera innehållet i Läkemedelsguiden och få svar på eventuella frågor de kan ha. Den fullständiga texten i läkemedelsguiden återges i slutet av detta dokument.
Patienter bör informeras om följande problem och uppmanas att varna sin förskrivare om dessa inträffar när de tar imipraminhydroklorid.
Patienter bör informeras om att intag av Tofranil kan orsaka mild pupillvidgning, vilket hos känsliga individer kan leda till en episod av vinkelglaukom. Redan existerande glaukom är nästan alltid glaukom med öppen vinkel eftersom stängningsvinkelglaukom, när det diagnostiseras, kan behandlas definitivt med iridektomi. Öppenvinkelglaukom är inte en riskfaktor för slutvinkelglaukom. Patienter kan vilja undersökas för att avgöra om de är mottagliga för vinkelstängning och genomgå en profylaktisk procedur (t.ex. iridektomi), om de är mottagliga.
Klinisk försämring och självmordsrisk
Patienter, deras familjer och deras vårdgivare bör uppmuntras att vara uppmärksamma på uppkomsten av ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani, mani, andra ovanliga beteendeförändringar , försämring av depression och självmordstankar, särskilt tidigt under antidepressiv behandling och när dosen justeras upp eller ner. Familjer och vårdgivare till patienter bör rådas att leta efter uppkomsten av sådana symtom på en daglig basis, eftersom förändringar kan vara abrupta. Sådana symtom bör rapporteras till patientens förskrivare eller hälso- och sjukvårdspersonal, särskilt om de är allvarliga, plötsliga debuterande eller inte var en del av patientens uppvisande symtom. Symtom som dessa kan vara förknippade med en ökad risk för suicidtänkande och självmordsbeteende och tyder på behov av mycket noggrann övervakning och eventuellt förändringar i medicineringen.
Graviditet
Reproduktionsstudier på djur har gett ofullständiga resultat (se även Djurfarmakologi ).
Det har inte gjorts några välkontrollerade studier med gravida kvinnor för att fastställa effekten av Tofranil på fostret. Det har dock förekommit kliniska rapporter om medfödda missbildningar i samband med användningen av läkemedlet. Även om ett orsakssamband mellan dessa effekter och läkemedlet inte kunde fastställas, kan möjligheten för fosterrisk från moderns intag av Tofranil inte uteslutas. Därför ska Tofranil endast användas till kvinnor som är eller kan bli gravida om det kliniska tillståndet tydligt motiverar en potentiell risk för fostret.
Ammande mödrar
Begränsade data tyder på att Tofranil 75 mg sannolikt utsöndras i human bröstmjölk. Som en allmän regel bör en kvinna som tar ett läkemedel inte amma eftersom det finns risk för att läkemedlet kan utsöndras i bröstmjölk och vara skadligt för barnet.
Pediatrisk användning
Säkerhet och effektivitet hos den pediatriska populationen förutom pediatriska patienter med nattlig enures har inte fastställts (se LÅDA VARNING och VARNINGAR , Klinisk försämring och självmordsrisk ). Alla som överväger att använda imipraminhydroklorid hos ett barn eller en ungdom måste balansera de potentiella riskerna med det kliniska behovet.
Läkemedlets säkerhet och effektivitet som tillfällig tilläggsbehandling för nattlig enures hos pediatriska patienter yngre än 6 år har inte fastställts.
Läkemedlets säkerhet för långvarig, kronisk användning som tilläggsterapi för nattlig enures hos pediatriska patienter 6 år eller äldre har inte fastställts; bör övervägas att inleda en drogfri period efter en adekvat terapeutisk prövning med gynnsamt svar.
En dos på 2,5 mg/kg/dag bör inte överskridas i barndomen. EKG-förändringar av okänd betydelse har rapporterats hos pediatriska patienter med doser som är dubbelt så stora.
Geriatrisk användning
litteraturen fanns fyra välkontrollerade, randomiserade, dubbelblinda, parallella gruppjämförelsestudier gjorda med Tofranil 50 mg i den äldre befolkningen. Totalt ingick 651 försökspersoner i dessa studier. Dessa studier gav ingen jämförelse med yngre försökspersoner. Det fanns inga ytterligare biverkningar identifierade hos äldre.
Kliniska studier av Tofranil 75 mg i den ursprungliga ansökan inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Klinisk erfarenhet efter marknadsföring har inte identifierat skillnader i svar mellan äldre och yngre försökspersoner. I allmänhet bör dosval för äldre vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar högre frekvens av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
(Se även DOSERING OCH ADMINISTRERING , Tonåring och Geriatriska patienter .)
(Se även FÖRSIKTIGHETSÅTGÄRDER , Allmän. )
ÖVERDOS
Dödsfall kan inträffa på grund av överdosering med denna klass av läkemedel. Flera läkemedelsintag (inklusive alkohol) är vanligt vid avsiktlig tricyklisk överdos. Eftersom hanteringen är komplex och föränderlig rekommenderas det att läkaren kontaktar en giftcentral för aktuell information om behandlingen. Tecken och symtom på toxicitet utvecklas snabbt efter tricyklisk överdos. Därför krävs sjukhusövervakning så snart som möjligt.
Barn har rapporterats vara mer känsliga än vuxna för en akut överdosering av imipraminhydroklorid. En akut överdos av vilken mängd som helst hos spädbarn eller småbarn, särskilt, måste betraktas som allvarlig och potentiellt dödlig.
Manifestationer
Dessa kan variera i svårighetsgrad beroende på faktorer som mängden absorberat läkemedel, patientens ålder och intervallet mellan läkemedelsintag och behandlingsstart. Kritiska manifestationer av överdosering inkluderar hjärtrytmrubbningar, allvarlig hypotoni, kramper och CNS-depression inklusive koma. Förändringar i elektrokardiogrammet, särskilt i QRS-axeln eller -bredden, är kliniskt signifikanta indikatorer på tricyklisk toxicitet.
Andra CNS-manifestationer kan inkludera dåsighet, stupor, ataxi, rastlöshet, agitation, hyperaktiva reflexer, muskelstelhet, atetoid- och koreiforma rörelser.
Hjärtavvikelser kan innefatta takykardi och tecken på kongestiv svikt. Andningsdepression, cyanos, chock, kräkningar, hyperpyrexi, mydriasis och diafores kan också förekomma.
Förvaltning
Skaffa ett EKG och påbörja omedelbart hjärtövervakning. Skydda patientens luftvägar, upprätta en intravenös linje och påbörja magdekontaminering. Minst 6 timmars observation med hjärtövervakning och observation för tecken på CNS eller andningsdepression, hypotoni, hjärtrytmrubbningar och/eller ledningsblockader och kramper är nödvändiga. Om tecken på toxicitet uppstår någon gång under denna period krävs utökad övervakning. Det finns fallrapporter om patienter som ger efter för dödliga rytmrubbningar sent efter överdosering; dessa patienter hade kliniska bevis på betydande förgiftning före döden och de flesta fick otillräcklig gastrointestinal dekontaminering. Övervakning av plasmanivåer av läkemedel bör inte vägleda behandlingen av patienten.
Gastrointestinal dekontaminering
Alla patienter som misstänks för tricyklisk överdosering bör få gastrointestinal dekontaminering. Detta bör inkludera storvolym magsköljning följt av aktivt kol. Om medvetandet är nedsatt ska luftvägarna säkras före sköljning. Emesis är kontraindicerat.
Kardiovaskulär
En maximal QRS-varaktighet för extremiteter på ≥0,10 sekunder kan vara den bästa indikationen på hur allvarlig överdosen är. Intravenöst natriumbikarbonat bör användas för att upprätthålla serum-pH i intervallet 7,45 till 7,55. Om pH-svaret är otillräckligt kan hyperventilering också användas. Samtidig användning av hyperventilation och natriumbikarbonat bör göras med extrem försiktighet, med frekvent pH-övervakning. Ett pH >7,60 eller ett pCO2
sällsynta fall kan hemoperfusion vara fördelaktigt vid akut refraktär kardiovaskulär instabilitet hos patienter med akut toxicitet. Emellertid har hemodialys, peritonealdialys, utbytestransfusioner och påtvingad diures generellt rapporterats som ineffektiva vid tricyklisk förgiftning.
CNS
Hos patienter med CNS-depression rekommenderas tidig intubation på grund av risken för plötslig försämring. Anfall bör kontrolleras med bensodiazepiner, eller om dessa är ineffektiva, andra antikonvulsiva medel (t.ex. fenobarbital, fenytoin). Physostigmin rekommenderas inte förutom för att behandla livshotande symtom som inte har svarat på andra behandlingar, och då endast i samråd med en giftkontrollcentral.
Psykiatrisk uppföljning
Eftersom överdosering ofta är avsiktlig kan patienter försöka begå självmord på andra sätt under återhämtningsfasen. Psykiatrisk remiss kan vara lämplig.
Pediatrisk hantering
Principerna för hantering av överdoseringar för barn och vuxna är likartade. Det rekommenderas starkt att läkaren kontaktar den lokala giftkontrollcentralen för specifik pediatrisk behandling.
KONTRAINDIKATIONER
Samtidig användning av monoaminoxidashämmande föreningar är kontraindicerad. Hyperpyretiska kriser eller svåra konvulsiva anfall kan förekomma hos patienter som får sådana kombinationer. Potentieringen av biverkningar kan vara allvarlig eller till och med dödlig. När det är önskvärt att ersätta Tofranil hos patienter som får en monoaminoxidashämmare, bör ett intervall förflyta så länge som den kliniska situationen tillåter, med minst 14 dagar. Den initiala dosen bör vara låg och ökningar bör ske gradvis och med försiktighet.
Läkemedlet är kontraindicerat under den akuta återhämtningsperioden efter en hjärtinfarkt. Patienter med känd överkänslighet mot denna förening bör inte ges läkemedlet. Möjligheten av korskänslighet mot andra dibensazepinföreningar bör beaktas.
KLINISK FARMAKOLOGI
Verkningsmekanismen för Tofranil 25 mg är inte definitivt känd. Det verkar dock inte primärt genom stimulering av det centrala nervsystemet. Den kliniska effekten antas bero på förstärkning av adrenerga synapser genom att blockera upptaget av noradrenalin vid nervändarna. Läkemedlets verkningssätt för att kontrollera barndomens enures tros skilja sig från dess antidepressiva effekt.
Djurfarmakologi och toxikologi
A. Akut
Orala LD50-intervall är följande:
Råtta 355 till 682 mg/kg Hund 100 till 215 mg/kg
Beroende på doseringen hos båda arterna fortgick toxiska tecken progressivt från depression, oregelbunden andning och ataxi till kramper och död.
B. Reproduktion/teratogent
Den övergripande utvärderingen kan sammanfattas på följande sätt:
Oralt: Oberoende studier på tre arter (råtta, mus och kanin) visade att när Tofranil administreras oralt i doser upp till cirka 2-1/2 gånger den maximala humana dosen i de första 2 arterna och upp till 25 gånger den maximala humana dosen dosen hos den tredje arten är läkemedlet väsentligen fritt från teratogen potential. I de tre studerade arterna inträffade endast ett fall av fosteravvikelse (hos kaninen) och i den studien fanns det också en avvikelse i kontrollgruppen. Det finns dock bevis från råttstudierna för att viss systemisk och embryotoxisk potential är påvisbar. Detta manifesteras av minskad kullstorlek, en liten ökning av antalet dödfödda och en minskning av den genomsnittliga födelsevikten.
