Effexor 37.5mg, 75mg Venlafaxine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
PATIENTINFORMATION
Effexor (venlafaxin) (ven-la-fax-een) Tabletter, USP
Läs medicinguiden som medföljer venlafaxintabletter, USP innan du börjar ta den och varje gång du får påfyllning. Det kan komma ny information. Denna medicineringsguide ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling. Prata med din vårdgivare om det är något du inte förstår eller vill veta mer om.
Vilken är den viktigaste informationen jag borde veta om Venlafaxine Tablets, USP?
Venlafaxintabletter, USP och andra antidepressiva läkemedel kan orsaka allvarliga biverkningar, inklusive:
1. Självmordstankar eller självmordstankar:
- Venlafaxintabletter, USP och andra antidepressiva läkemedel kan öka självmordstankar eller -handlingar hos vissa barn, tonåringar eller unga vuxna inom de första månaderna av behandlingen eller när dosen ändras.
- Depression eller andra allvarliga psykiska sjukdomar är de viktigaste orsakerna till självmordstankar eller -handlingar.
- Se upp för dessa förändringar och ring din vårdgivare omedelbart om du märker:
- Nya eller plötsliga förändringar i humör, beteende, handlingar, tankar eller känslor, särskilt om det är allvarligt.
- Var särskilt uppmärksam på sådana förändringar när venlafaxintabletter, USP påbörjas eller när dosen ändras.
Håll alla uppföljningsbesök hos din vårdgivare och ring mellan besöken om du är orolig för symtom.
Ring din vårdgivare omedelbart om du har något av följande symtom, eller ring 911 om en nödsituation, särskilt om de är nya, värre eller oroar dig:
- försök att begå självmord
- agerar på farliga impulser
- agerar aggressivt eller våldsamt
- tankar om självmord eller att dö
- ny eller värre depression
- ny eller värre ångest eller panikattacker
- känner sig upprörd, rastlös, arg eller irriterad
- sömnproblem
- ökad aktivitet eller prata mer än vad som är normalt för dig
- andra ovanliga förändringar i beteende eller humör
Ring din vårdgivare omedelbart om du har något av följande symtom, eller ring 911 om en nödsituation. Venlafaxin tabletter, USP kan vara associerade med dessa allvarliga biverkningar:
2. Serotoninsyndrom
Detta tillstånd kan vara livshotande och kan innefatta:
- agitation, hallucinationer, koma eller andra förändringar i mental status
- koordinationsproblem eller muskelryckningar (överaktiva reflexer)
- snabba hjärtslag, högt eller lågt blodtryck
- svettningar eller feber
- illamående, kräkningar eller diarré
- muskelstelhet
3. Förändringar i blodtrycket. Venlafaxin tabletter, USP kan:
- öka ditt blodtryck. Kontrollera högt blodtryck innan behandlingen påbörjas och kontrollera blodtrycket regelbundet
4. Förstorade pupiller (mydriasis).
5. Ångest och sömnlöshet.
6. Förändringar i aptit eller vikt.
- barn och ungdomar bör övervakas längd och vikt under behandlingen
7. Maniska/hypomana episoder:
- kraftigt ökad energi
- svåra sömnproblem
- racing tankar
- hänsynslöst beteende
- ovanligt storslagna idéer
- överdriven lycka eller irritabilitet
- prata mer eller snabbare än vanligt
8. Låga saltnivåer (natrium) i blodet.
Äldre människor kan löpa större risk för detta. Symtom kan inkludera:
- huvudvärk
- svaghet eller att känna sig ostadig
- förvirring, problem med att koncentrera sig eller tänka eller minnesproblem
9. Kramper eller kramper.
10. Onormal blödning: venlafaxintabletter, USP och andra antidepressiva läkemedel kan öka risken för blödningar eller blåmärken, särskilt om du tar blodförtunnande warfarin (Coumadin®, Jantoven®), ett icke-steroida antiinflammatoriska läkemedel (NSAID, som t.ex. ibuprofen eller naproxen), eller aspirin.
11. Förhöjt kolesterol.
12. Lungsjukdom och lunginflammation: venlafaxintabletter, USP kan orsaka sällsynta lungproblem. Symtom inkluderar:
- förvärrad andnöd
- hosta
- obehag i bröstet
13. Allvarliga allergiska reaktioner:
- problem att andas
- svullnad i ansikte, tunga, ögon eller mun
- utslag, kliande nässelutslag eller blåsor, ensamma eller med feber eller ledvärk
14. Synproblem:
- ögonsmärta
- förändringar i synen
- svullnad eller rodnad i eller runt ögat
Endast vissa människor är i riskzonen för dessa problem. Du kanske vill genomgå en synundersökning för att se om du är i riskzonen och få förebyggande behandling om du är det.
Sluta inte med Venlafaxine Tablets, USP utan att först prata med din läkare. Att stoppa venlafaxintabletter, USP för snabbt eller byta från ett annat antidepressivt läkemedel för snabbt kan orsaka allvarliga symtom inklusive:
- ångest, irritabilitet
- trötthet, rastlöshet eller sömnproblem
- huvudvärk, svettning, yrsel
- elchockliknande förnimmelser, skakningar, förvirring, mardrömmar
- kräkningar, illamående, diarré
Vad är Venlafaxine Tabletter, USP?
Venlafaxin tabletter, USP är ett receptbelagt läkemedel som används för att behandla depression. Det är viktigt att prata med din vårdgivare om riskerna med att behandla depression och även riskerna med att inte behandla den. Du bör diskutera alla behandlingsval med din vårdgivare.
Prata med din vårdgivare om du inte tror att ditt tillstånd blir bättre med venlafaxintabletter, USP-behandling.
Vem bör inte ta Venlafaxin Tabletter, USP?
- Ta inte venlafaxin tabletter, USP om du:
- är allergiska mot venlafaxintabletter, USP eller någon av ingredienserna i venlafaxintabletter, USP. Se slutet av denna medicineringsguide för en komplett lista över ingredienser i venlafaxintabletter, USP.
- har okontrollerad trångvinkelglaukom
- ta en monoaminoxidashämmare (MAO-hämmare). Fråga din vårdgivare eller apotekspersonal om du är osäker på om du tar en MAO-hämmare, inklusive antibiotikumet linezolid.
- Ta inte en MAO-hämmare inom 7 dagar efter att du avslutat venlafaxin tabletter, USP såvida inte din läkare har ordinerat att göra det.
- Börja inte med venlafaxin tabletter, USP om du slutat ta en MAO-hämmare under de senaste 2 veckorna såvida inte din läkare har beordrat det.
Personer som tar Venlafaxin tabletter, USP nära en MAO-hämmare kan ha allvarliga eller till och med livshotande biverkningar. Få medicinsk hjälp omedelbart om du har något av dessa symtom:
- hög feber
- okontrollerade muskelspasmer
- stela muskler
- snabba förändringar i hjärtfrekvens eller blodtryck
- förvirring
- förlust av medvetande (svimma)
Vad ska jag berätta för min vårdgivare innan jag tar Venlafaxine Tablets, USP? Fråga om du är osäker.
Innan du börjar med venlafaxin tabletter, USP, berätta för din vårdgivare om du:
- Tar vissa droger som:
- Läkemedel som används för att behandla migrän som:
- triptaner
- Läkemedel som används för att behandla humör, ångest, psykotiska störningar eller tankestörningar, såsom:
- tricykliska antidepressiva medel
- litium
- SSRI
- SNRI
- antipsykotiska läkemedel
- Läkemedel som används för att behandla smärta som:
- tramadol
- Läkemedel som används för att tunna ut ditt blod som:
- warfarin
- Läkemedel som används för att behandla halsbränna som:
- Cimetidin
- Receptfria läkemedel eller kosttillskott som:
- Aspirin eller andra NSAID
- Tryptofan
- Johannesört
- har hjärtproblem
- har diabetes
- har leverproblem
- har njurproblem
- har problem med sköldkörteln
- har glaukom
- har eller haft kramper eller kramper
- har bipolär sjukdom eller mani
- har låga natriumnivåer i ditt blod
- har högt blodtryck
- har högt kolesterol
- har eller haft blödningsproblem
- är gravid eller planerar att bli gravid. Det är inte känt om venlafaxin tabletter, USP kommer att skada ditt ofödda barn. Prata med din vårdgivare om fördelarna och riskerna med att behandla depression under graviditeten
- ammar eller planerar att amma. Vissa venlafaxintabletter, USP kan passera över i din bröstmjölk. Prata med din vårdgivare om det bästa sättet att mata ditt barn medan du tar venlafaxintabletter, USP.
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Venlafaxintabletter, USP och vissa läkemedel kan interagera med varandra, kanske inte fungera lika bra eller kan orsaka allvarliga biverkningar.
Din vårdgivare eller apotekspersonal kan berätta för dig om det är säkert att ta venlafaxintabletter, USP tillsammans med dina andra läkemedel. Starta eller sluta inte med någon medicin medan du tar venlafaxin tabletter, USP utan att först prata med din läkare.
Om du tar venlafaxintabletter, USP, ska du inte ta några andra läkemedel som innehåller (venlafaxin) inklusive: venlafaxin HCl.
Hur ska jag ta Venlafaxin Tabletter, USP?
- Ta venlafaxintabletter, USP precis som ordinerats. Din vårdgivare kan behöva ändra dosen av venlafaxintabletter, USP tills det är rätt dos för dig.
- Venlafaxin tabletter, USP ska tas med mat.
- Om du missar en dos av venlafaxintabletter, USP, ta den missade dosen så snart du kommer ihåg det. Om det nästan är dags för nästa dos, hoppa över den missade dosen och ta din nästa dos vid ordinarie tidpunkt. Ta inte två doser venlafaxintabletter, USP samtidigt.
- Om du tar för mycket venlafaxintabletter, USP, ring din vårdgivare eller giftcentral direkt, eller få akut behandling.
- När du byter från ett annat antidepressivt läkemedel till venlafaxintabletter, kan din läkare vilja sänka dosen av det initiala antidepressiva medlet först för att undvika biverkningar
Vad ska jag undvika när jag tar Venlafaxin Tabletter, USP?
Venlafaxin tabletter, USP kan orsaka sömnighet eller kan påverka din förmåga att fatta beslut, tänka klart eller reagera snabbt.
Du ska inte köra bil, använda tunga maskiner eller göra andra farliga aktiviteter förrän du vet hur venlafaxin tabletter, USP påverkar dig. Drick inte alkohol när du använder venlafaxintabletter, USP.
Vilka är de möjliga biverkningarna av Venlafaxin Tabletter, USP?
Venlafaxin tabletter, USP kan orsaka allvarliga biverkningar, inklusive:
- Se "Vilken är den viktigaste informationen jag borde veta om Venlafaxine Tablets, USP?"
- Förhöjt kolesterol - kontrollera ditt kolesterol regelbundet
- Nyfödda vars mödrar tar venlafaxintabletter, USP under tredje trimestern kan ha problem direkt efter födseln, inklusive:
- problem med matning och andning
- anfall
- skakningar, skakningar eller konstant gråt
- Trångvinkelglaukom/förstorade pupiller.
Kontrollera ögontrycket regelbundet om du:
- har en historia av ökat ögontryck
- är i riskzonen för vissa typer av glaukom
Vanliga möjliga biverkningar hos personer som tar venlafaxintabletter, USP inkluderar:
ovanliga drömmar
- sexuella problem
- aptitlöshet, förstoppning, diarré, illamående eller kräkningar eller muntorrhet
- känner dig trött, utmattad eller alltför sömnig
- förändrade sömnvanor, sömnproblem
- gapande
- darrningar eller skakningar
- yrsel, dimsyn
- svettas
- känner dig orolig, nervös eller nervös
- huvudvärk
- ökning av hjärtfrekvensen
Berätta för din vårdgivare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av venlafaxintabletter, USP.
För mer information, fråga din vårdgivare eller apotekspersonal.
RING DIN LÄKARE FÖR MEDICINSK RÅD OM BIVERKNINGAR. DU KAN RAPPORTERA BIVERKNINGAR TILL FDA PÅ 1-800-FDA-1088.
Hur ska jag förvara Venlafaxin Tabletter, USP?
- Förvara vid 20° till 25°C (68° till 77°F) tillåtna utflykter 15° till 30°C (59° till 86°F) [Se USP-kontrollerad rumstemperatur ].
- Förvara velafaxin tabletter, USP på en torr plats.
Förvara Venlafaxin Tabletter, USP och alla läkemedel utom räckhåll för barn.
Allmän information om venlafaxintabletter, USP Läkemedel skrivs ibland ut för andra ändamål än de som anges i en medicinguide. Använd inte venlafaxintabletter, USP för ett tillstånd som det inte ordinerats för. Ge inte venlafaxin tabletter, USP till andra personer, även om de har samma tillstånd. Det kan skada dem.
Denna medicinguide sammanfattar den viktigaste informationen om venlafaxintabletter, USP. Om du vill ha mer information, prata med din vårdgivare. Du kan fråga din vårdgivare eller apotekspersonal om information om venlafaxintabletter, USP som är skriven för vårdpersonal.
För att rapportera MISSTÄNKTA BIVERKNINGAR, kontakta Sun Pharmaceutical Industries, Inc. på 1-800-818-4555.
Vilka är ingredienserna i Venlafaxine Tabletter, USP?
Aktiv ingrediens: (venlafaxin)
Inaktiva Ingredienser:
- Tabletter: mikrokristallin cellulosa, laktosmonohydrat, förgelatinerad stärkelse, natriumstärkelseglykolat, röd järnoxid, gul järnoxid, kolloidal kiseldioxid och magnesiumstearat
Denna medicinguide har godkänts av US Food and Drug Administration för alla antidepressiva medel.
INDIKATIONER
Major depressiv sjukdom
Effexor XR (venlafaxinhydroklorid) kapslar med förlängd frisättning är indicerade för behandling av egentlig depression (MDD). Effekten fastställdes i tre korttidsstudier (4, 8 och 12 veckor) och två långsiktiga underhållsstudier.
Generaliserat ångestsyndrom
Effexor XR är indicerat för behandling av generaliserat ångestsyndrom (GAD). Effekten fastställdes i två 8-veckors och två 26-veckors placebokontrollerade studier.
Social fobi
Effexor XR är indicerat för behandling av socialt ångestsyndrom (SAD), även känd som social fobi. Effekten fastställdes i fyra 12-veckors och en 26-veckors placebokontrollerade prövningar.
Panikångest
Effexor XR är indicerat för behandling av panikångest (PD), med eller utan agorafobi. Effekten fastställdes i två 12-veckors placebokontrollerade studier.
DOSERING OCH ADMINISTRERING
Effexor 37,5 mg XR ska ges i en engångsdos tillsammans med mat, antingen på morgonen eller på kvällen vid ungefär samma tidpunkt varje dag [se KLINISK FARMAKOLOGI ]. Varje kapsel ska sväljas hel med vätska och inte delas, krossas, tuggas eller placeras i vatten eller så kan den administreras genom att försiktigt öppna kapseln och strö hela innehållet på en sked äppelmos. Denna blandning av läkemedel och livsmedel ska sväljas omedelbart utan att tugga och följas upp med ett glas vatten för att säkerställa fullständig sväljning av pellets (sfäroider).
Major depressiv sjukdom
För de flesta patienter är den rekommenderade startdosen för Effexor 37,5 mg XR 75 mg per dag, administrerad i en engångsdos. För vissa patienter kan det vara önskvärt att börja med 37,5 mg per dag i 4 till 7 dagar för att låta nya patienter anpassa sig till medicineringen innan de ökar till 75 mg per dag. Patienter som inte svarar på den initiala dosen på 75 mg per dag kan ha nytta av dosökningar till maximalt 225 mg per dag. Dosökningar bör ske i steg med upp till 75 mg per dag, efter behov, och bör göras med minst 4 dagars intervall, eftersom steady-state plasmanivåer av venlafaxin och dess huvudmetaboliter uppnås hos de flesta patienter vid dag 4 [ser KLINISK FARMAKOLOGI ]. I de kliniska studierna som fastställde effekt tilläts uppåttitrering med intervaller på 2 veckor eller mer.
Det bör noteras att även om den maximala rekommenderade dosen för måttligt deprimerade öppenvårdspatienter också är 225 mg per dag för Effexor (omedelbar frisättning), svarade mer allvarligt deprimerade slutenvårdspatienter i en studie av utvecklingsprogrammet för den produkten på en medeldos på 350 mg per dag (intervall från 150 till 375 mg per dag). Huruvida högre doser av Effexor 37,5 mg XR behövs för mer allvarligt deprimerade patienter är okänt; erfarenheten av Effexor 75 mg XR doser högre än 225 mg per dag är dock mycket begränsad.
Generaliserat ångestsyndrom
För de flesta patienter är den rekommenderade startdosen för Effexor XR 75 mg per dag, administrerad i en engångsdos. För vissa patienter kan det vara önskvärt att börja med 37,5 mg per dag i 4 till 7 dagar för att låta nya patienter anpassa sig till medicineringen innan de ökar till 75 mg per dag. Patienter som inte svarar på den initiala dosen på 75 mg per dag kan ha nytta av dosökningar till maximalt 225 mg per dag. Dosökningar bör ske i steg med upp till 75 mg per dag, efter behov, och bör göras med minst 4 dagars intervall, eftersom steady-state plasmanivåer av venlafaxin och dess huvudmetaboliter uppnås hos de flesta patienter vid dag 4 [ser KLINISK FARMAKOLOGI ].
Social ångeststörning (social fobi)
Den rekommenderade dosen är 75 mg per dag, administrerad i en enda dos. Det fanns inga bevis för att högre doser ger någon ytterligare fördel.
Panikångest
Den rekommenderade startdosen är 37,5 mg per dag av Effexor 75 mg XR i 7 dagar. Patienter som inte svarar på 75 mg per dag kan ha nytta av dosökningar till maximalt cirka 225 mg per dag. Dosökningar bör ske i steg med upp till 75 mg per dag, efter behov, och bör göras med minst 7 dagars intervall.
Byta patient från Effexor 37,5 mg tabletter
Deprimerade patienter som för närvarande behandlas med en terapeutisk dos med Effexor (omedelbar frisättning) kan bytas till Effexor 37,5 mg XR vid närmaste ekvivalenta dos (mg per dag), t.ex. 37,5 mg venlafaxin två gånger dagligen till 75 mg Effexor 75 mg XR en gång om dagen. Individuella dosjusteringar kan dock vara nödvändiga.
Specifika populationer
Patienter med nedsatt leverfunktion
Den totala dygnsdosen bör minskas med 50 % hos patienter med lätt (Child-Pugh=5-6) till måttligt (Child-Pugh=7-9) nedsatt leverfunktion. Hos patienter med gravt nedsatt leverfunktion (Child-Pugh=10-15) eller levercirros kan det vara nödvändigt att minska dosen med 50 % eller mer [se Användning i specifika populationer ].
Patienter med nedsatt njurfunktion
Den totala dagliga dosen bör minskas med 25 % till 50 % hos patienter med mild (CLcr=60-89 ml/min) eller måttlig (CLcr=30-59 ml/min) njurfunktionsnedsättning. Hos patienter som genomgår hemodialys eller med gravt nedsatt njurfunktion (CLcr Användning i specifika populationer ].
Underhållsbehandling
Det finns inga bevis tillgängliga från kontrollerade studier som indikerar hur länge patienter med MDD, GAD, SAD eller PD ska behandlas med Effexor 75mg XR.
Det är allmänt överens om att akuta episoder av MDD kräver flera månader eller längre av långvarig farmakologisk terapi utöver svaret på den akuta episoden. Effexor XR/Effexor har visat fortsatt svar i kliniska studier upp till 52 veckor, vid samma dos som patienterna svarade på under den initiala behandlingen [se Kliniska studier ]. Det är inte känt om den dos av Effexor XR som behövs för underhållsbehandling är identisk med den dos som behövs för att uppnå ett initialt svar. Patienterna bör regelbundet utvärderas för att fastställa behovet av underhållsbehandling och lämplig dos för sådan behandling.
Hos patienter med GAD och SAD har Effexor 37,5 mg XR visat sig vara effektivt i 6-månaders kliniska studier. Behovet av fortsatt medicinering hos patienter med GAD och SAD som förbättras med Effexor XR-behandling bör regelbundet omvärderas.
I en klinisk studie för PD upplevde patienter som fortsatte med Effexor 75 mg XR i samma dos som de svarade under de första 12 veckorna av behandlingen en statistiskt signifikant längre tid till återfall än patienter som randomiserades till placebo [se Kliniska studier ]. Behovet av fortsatt medicinering hos patienter med PD som förbättras med Effexor XR-behandling bör regelbundet omvärderas.
Upphör med Effexor XR
En gradvis minskning av dosen, snarare än abrupt utsättande, rekommenderas när behandlingen med Effexor 37,5 mg XR avbryts. I kliniska studier med Effexor 37,5 mg XR uppnåddes nedtrappning genom att minska den dagliga dosen med 75 mg med en veckas intervall. Individualisering av avsmalning kan vara nödvändig [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Hos vissa patienter kan behandlingen behöva avbrytas under en period av flera månader.
Byta patienter till eller från en monoaminoxidashämmare (MAO-hämmare) avsedd att behandla psykiatriska störningar
Minst 14 dagar bör förflyta mellan utsättande av en MAO-hämmare (avsedd att behandla psykiatriska störningar) och påbörjande av behandling med Effexor XR. Dessutom bör minst 7 dagar tillåtas efter avslutad Effexor XR innan man påbörjar en MAO-hämmare avsedd att behandla psykiatriska störningar [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och LÄKEMEDELSINTERAKTIONER ].
Användning av Effexor XR med andra MAO-hämmare som Linezolid eller Intravenous Methylene Blue
Starta inte Effexor 75 mg XR hos en patient som behandlas med linezolid eller intravenöst metylenblått, eftersom det finns en ökad risk för serotonergt syndrom. Hos en patient som behöver mer akut behandling av ett psykiatriskt tillstånd bör andra insatser, inklusive sjukhusvistelse övervägas [se KONTRAINDIKATIONER ].
vissa fall kan en patient som redan får Effexor 37,5 mg XR-behandling behöva akut behandling med linezolid eller intravenöst metylenblått. Om acceptabla alternativ till linezolid eller intravenös metylenblått inte finns tillgängliga och de potentiella fördelarna med linezolid eller intravenös metylenblåttbehandling bedöms uppväga riskerna för serotonergt syndrom hos en viss patient, ska Effexor XR stoppas omedelbart och linezolid eller intravenös metylenblått kan administreras. Övervaka patienten med avseende på symtom på serotonergt syndrom i 7 dagar eller till 24 timmar efter den sista dosen av linezolid eller intravenöst metylenblått, beroende på vad som inträffar först. Behandling med Effexor 75 mg XR kan återupptas 24 timmar efter den sista dosen av linezolid eller intravenös metylenblått [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Risken med att administrera metylenblått på icke-intravenös väg (såsom orala tabletter eller genom lokal injektion) eller i intravenösa doser mycket lägre än 1 mg/kg samtidigt med Effexor XR är oklar. Läkaren bör dock vara medveten om möjligheten av uppkommande symtom på serotonergt syndrom vid sådan användning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
HUR LEVERERAS
Doseringsformer och styrkor
Effexor 37,5 mg XR® (venlafaxinhydroklorid) kapslar med förlängd frisättning finns i följande styrkor:
- 37,5 mg kapslar (grå lock/persika underdel med "W" och "Effexor 75mg XR" på locket och "37,5" på underdelen)
- 75 mg kapslar (persikalock och stomme med "W" och "Effexor 37,5mg XR" på locket och "75" på stommen)
- 150 mg kapslar (mörkt orange lock och underdel med "W" och "Effexor 75mg XR" på locket och "150" på underdelen)
Förvaring Och Hantering
Effexor XR® (venlafaxinhydroklorid) kapslar med förlängd frisättning finns tillgängliga enligt följande:
NDC 0008-0837-20, flaska med 15 kapslar i enhetsförpackning. NDC 0008-0837-21, flaska med 30 kapslar i enhetsförpackning. NDC 0008-0837-22, flaska med 90 kapslar i enhetsförpackning. NDC 0008-0837-03, kartong med 10 Redipak® blisterremsor med 10 kapslar vardera.
NDC 0008-0833-20, flaska med 15 kapslar i enhetsförpackning. NDC 0008-0833-21, flaska med 30 kapslar i enhetsförpackning. NDC 0008-0833-22, flaska med 90 kapslar i enhetsförpackning. NDC 0008-0833-03, kartong med 10 Redipak® blisterremsor med 10 kapslar vardera.
NDC 0008-0836-20, flaska med 15 kapslar i enhetsförpackning. NDC 0008-0836-21, flaska med 30 kapslar i enhetsförpackning. NDC 0008-0836-22, flaska med 90 kapslar i enhetsförpackning. NDC 0008-0836-03, kartong med 10 Redipak® blisterremsor med 10 kapslar vardera.
- 37,5 mg , grå keps/persika stomme med "W" och "Effexor XR" på locket och "37.5" på stommen.
- 75 mg , persikalock och stomme med "W" och "Effexor 37.5mg XR" på locket och "75" på stommen.
- 150 mg mörkt orange lock och stomme med "W" och "Effexor XR" på locket och "150" på stommen.
Förvara vid kontrollerad rumstemperatur, 20° till 25°C (68° till 77°F).
Användningsenhetsförpackningen är avsedd att dispenseras som en enhet.
Distribuerat av: Wyeth Pharmaceuticals LLC, ett dotterbolag till Pfizer Inc, Philadelpia, PA 19101. Reviderad: nov 2021
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av etiketten:
- Överkänslighet [se KONTRAINDIKATIONER ]
- Suicidala tankar och beteenden hos barn, ungdomar och vuxna [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Serotoninsyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Förhöjda blodtryck [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Onormal blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Vinkelstängning glaukom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Aktivering av mani/hypomani [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Utsättningssyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anfall [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hyponatremi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Vikt- och längdförändringar hos pediatriska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Aptitförändringar hos pediatriska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Interstitiell lungsjukdom och eosinofil lunginflammation [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Sexuell dysfunktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska studier
Eftersom kliniska studier utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
De vanligaste biverkningarna
De vanligaste observerade biverkningarna i den kliniska studiedatabasen i Effexor XR-behandlade patienter i MDD, GAD, SAD och PD (incidens ≥ 5 % och minst dubbelt så hög som placebo) var: illamående (30,0 %), somnolens (15,3) %), muntorrhet (14,8%), svettning (11,4%), onormal utlösning (9,9%), anorexi (9,8%), förstoppning (9,3%), impotens (5,3%) och minskad libido (5,1%).
Biverkningar rapporterade som skäl till att behandlingen avbryts
Kombinerat över korttids, placebokontrollerade premarketingstudier för alla indikationer, avbröt 12 % av de 3 558 patienter som fick Effexor XR (37,5-225 mg) behandlingen på grund av en negativ upplevelse, jämfört med 4 % av de 2 197 placebobehandlade patienterna i de studierna.De vanligaste biverkningarna som leder till utsättning av behandlingen hos ≥ 1 % av de Effexor XR-behandlade patienterna i korttidsstudierna (upp till 12 veckor) över indikationerna visas i Tabell 7.
Vanliga biverkningar i placebokontrollerade studier
Antalet patienter som fick flera doser av Effexor XR under bedömningen före marknadsföringen för varje godkänd indikation visas i tabell 8. Tillstånden och varaktigheten av exponeringen för venlafaxin i alla utvecklingsprogram varierade mycket och inkluderade (i överlappande kategorier) öppna och dubbel- blinda studier, okontrollerade och kontrollerade studier, slutenvårdsstudier (endast Effexor) och polikliniska studier, fasta doser och titreringsstudier.
Incidensen av vanliga biverkningar (de som inträffade hos ≥ 2 % av Effexor XR-behandlade patienter [357 MDD-patienter, 1 381 GAD-patienter, 819 SAD-patienter och 1 001 PD-patienter] och oftare än placebo) hos Effexor XR-behandlade patienter i korthet Tidiga, placebokontrollerade, fasta och flexibla kliniska studier (doser 37,5 till 225 mg per dag) visas i Tabell 9.
Biverkningsprofilen skilde sig inte väsentligt mellan de olika patientpopulationerna.
Andra biverkningar som observerats i kliniska studier
Kroppen som helhet: Fotosensitivitetsreaktion, frossa
Kardiovaskulära systemet: Postural hypotoni, synkope, hypotoni, takykardi
Matsmältningssystemet: Gastrointestinal blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ],
bruxism Hemiska/lymfatiska systemet: Ekkymos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Metaboliskt/näringsmässigt: Hyperkolesterolemi, viktökning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], viktminskning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Nervsystem: Kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], manisk reaktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], agitation, förvirring, akatisi, hallucinationer, hypertoni, myoklonus, depersonalisering, apati
Hud och bihang: Urtikaria, klåda, hudutslag, alopeci
Speciella sinnen: Mydriasis, abnormitet av boende, tinnitus, smakförvrängning
Urogenitala systemet: Urinretention, nedsatt urinering, urininkontinens, ökad urinfrekvens, menstruationsrubbningar associerade med ökad blödning eller ökad oregelbunden blödning (t.ex. menorragi, metrorragi)
Vital Sign Changes
placebokontrollerade premarketingstudier förekom ökningar i medelblodtrycket (se tabell 10). För de flesta indikationerna var en dosrelaterad ökning av det genomsnittliga systoliska och diastoliska blodtrycket på rygg uppenbar hos patienter som behandlades med Effexor 37,5 mg XR. I alla kliniska studier i MDD, GAD, SAD och PD upplevde 1,4 % av patienterna i Effexor XR-grupperna en ökning av SDBP på ≥15 mm Hg tillsammans med ett blodtryck ≥ 105 mm Hg, jämfört med 0,9 % av patienterna i placebogrupper. På liknande sätt upplevde 1 % av patienterna i Effexor 37,5 mg XR-grupperna en ökning av SSBP på ≥ 20 mm Hg med ett blodtryck ≥ 180 mm Hg, jämfört med 0,3 % av patienterna i placebogrupperna.
Effexor 37,5 mg XR-behandling var associerad med ihållande hypertoni (definierad som behandlingsuppkommande diastoliskt blodtryck [SDBP] ≥ 90 mm Hg och ≥ 10 mm Hg över baslinjen under tre på varandra följande behandlingsbesök (se tabell 11). av patienterna fick medeldoser av Effexor XR över 300 mg per dag i kliniska studier för att fullständigt utvärdera förekomsten av ihållande ökningar av blodtrycket vid dessa högre doser.
Effexor 37,5 mg XR var associerad med genomsnittlig ökning av puls jämfört med placebo i placebokontrollerade studier före marknadsföring (se tabell 12) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Laboratorieförändringar
Serum kolesterol
Effexor XR associerades med genomsnittliga slutliga ökningar av serumkolesterolkoncentrationer jämfört med genomsnittliga slutliga minskningar för placebo i kliniska studier av MDD, GAD, SAD och PD (tabell 13).
Behandling med Effexor 75 mg XR (venlafaxinhydroklorid) kapslar med förlängd frisättning i upp till 12 veckor i placebokontrollerade studier före marknadsföring för egentlig depressiv sjukdom var associerad med en genomsnittlig slutlig ökning av serumkolesterolkoncentrationen på cirka 1,5 mg/dL jämfört med en genomsnittlig slutlig minskning med 7,4 mg/dL för placebo. Effexor XR-behandling i upp till 8 veckor och upp till 6 månader i placebokontrollerade GAD-studier före marknadsföring var associerad med genomsnittliga slutliga ökningar av serumkolesterolkoncentrationen på cirka 1,0 mg/dL respektive 2,3 mg/dL medan placebopatienter upplevde genomsnittliga slutliga minskningar på 4,9 mg/dL respektive 7,7 mg/dL. Effexor XR-behandling i upp till 12 veckor och upp till 6 månader i placebokontrollerade studier med sociala ångeststörningar före marknadsföringen var associerad med genomsnittliga slutliga ökningar i serumkolesterolkoncentrationen på cirka 7,9 mg/dL respektive 5,6 mg/dL under behandling. med genomsnittliga slutliga minskningar på 2,9 respektive 4,2 mg/dL för placebo. Effexor XR-behandling i upp till 12 veckor i placebokontrollerade paniksyndromstudier före marknadsföring var associerad med genomsnittliga slutliga ökningar av serumkolesterolkoncentrationen på cirka 5,8 mg/dL jämfört med en genomsnittlig slutlig minskning på 3,7 mg/dL för placebo.
Patienter som behandlats med Effexor (omedelbar frisättning) i minst 3 månader i placebokontrollerade 12-månaders förlängningsstudier hade en genomsnittlig slutlig ökning av totalkolesterol under behandlingen på 9,1 mg/dL jämfört med en minskning med 7,1 mg/dL bland placebo- behandlade patienter. Denna ökning var varaktighetsberoende under studieperioden och tenderade att vara större med högre doser. Kliniskt relevanta ökningar av serumkolesterol, definierade som 1) en slutlig ökning av serumkolesterol under behandling ≥50 mg/dL från baslinjen och till ett värde ≥261 mg/dL, eller 2) en genomsnittlig ökning av serumkolesterol under behandling ≥ 50 mg/dL från baslinjen och till ett värde ≥261 mg/dL, registrerades hos 5,3 % av venlafaxinbehandlade patienter och 0,0 % av placebobehandlade patienter.
Serum triglycerider
Effexor 75 mg XR associerades med genomsnittliga slutliga ökningar under behandling av fastande serumtriglycerider jämfört med placebo i kliniska studier före marknadsföring av SAD och PD upp till 12 veckor (sammanslagna data) och 6 månaders varaktighet (tabell 14).
Pediatriska patienter
Generellt sett liknade biverkningsprofilen för venlafaxin (i placebokontrollerade kliniska studier) hos barn och ungdomar (6 till 17 år) den som setts för vuxna. Liksom hos vuxna observerades minskad aptit, viktminskning, ökat blodtryck och ökat serumkolesterol [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
I pediatriska kliniska studier observerades biverkningen, självmordstankar.
Särskilt följande biverkningar observerades hos pediatriska patienter: buksmärtor, agitation, dyspepsi, ekkymos, näsblod och myalgi.
Biverkningar identifierade under användning efter godkännande
Följande biverkningar har identifierats under användning av Effexor XR efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering:
Kroppen som helhet: Anafylaxi, angioödem
Kardiovaskulära systemet: QT-förlängning, ventrikelflimmer, ventrikulär takykardi (inklusive torsade de pointes), takotsubo kardiomyopati
Matsmältningssystemet: Pankreatit
Hemiska/lymfatiska systemet: Slemhinneblödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], bloddyskrasier (inklusive agranulocytos, aplastisk anemi, neutropeni och pancytopeni), förlängd blödningstid, trombocytopeni
Metaboliskt/näringsmässigt: Hyponatremi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], Syndrom av olämplig utsöndring av antidiuretisk hormon (SIADH) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], onormala leverfunktionstester, hepatit, ökat prolaktin
Muskuloskeletala: Rabdomyolys
Nervsystem: Malignt neuroleptikasyndrom (NMS) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], delirium, extrapyramidala reaktioner (inklusive dystoni och dyskinesi), försämrad koordination och balans, tardiv dyskinesi
Andningssystem: Dyspné, interstitiell lungsjukdom, pulmonell eosinofili [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Hud och bihang: Stevens-Johnsons syndrom, toxisk epidermal nekrolys, erythema multiforme
Speciella sinnen: Stängningsvinkelglaukom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
LÄKEMEDELSINTERAKTIONER
Centrala nervsystemet (CNS)-aktiva läkemedel
Risken att använda venlafaxin i kombination med andra CNS-aktiva läkemedel har inte utvärderats systematiskt. Följaktligen rekommenderas försiktighet när Effexor XR tas i kombination med andra CNS-aktiva läkemedel.
Monoaminoxidashämmare
Biverkningar, av vilka några var allvarliga, har rapporterats hos patienter som nyligen har avbrutits på grund av en MAO-hämmare och börjat på antidepressiva läkemedel med farmakologiska egenskaper som liknar Effexor XR (SNRI eller SSRI), eller som nyligen har fått SNRI- eller SSRI-behandling avbruten tidigare till initiering av en MAO-hämmare [se DOSERING OCH ADMINISTRERING , KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Serotonerga läkemedel
Baserat på verkningsmekanismen för Effexor XR och potentialen för serotonergt syndrom, rekommenderas försiktighet när Effexor XR administreras samtidigt med andra läkemedel som kan påverka de serotonerga neurotransmittorsystemen, såsom triptaner, SSRI, andra SNRI, linezolid (ett antibiotikum som är en reversibel icke-selektiv MAO-hämmare), litium, tramadol eller johannesört. Om samtidig behandling med Effexor XR och dessa läkemedel är kliniskt motiverad, rekommenderas noggrann observation av patienten, särskilt under behandlingsstart och dosökningar. Samtidig användning av Effexor 75mg XR med tryptofantillskott rekommenderas inte [se DOSERING OCH ADMINISTRERING , KONTRAINDIKATIONER , och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Läkemedel som stör hemostas (t.ex. NSAID, aspirin och warfarin)
Serotoninfrisättning av blodplättar spelar en viktig roll vid hemostas. Användningen av psykotropa läkemedel som stör serotoninåterupptaget är associerad med förekomsten av övre gastrointestinala blödningar och samtidig användning av ett NSAID eller acetylsalicylsyra kan förstärka denna blödningsrisk [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Förändrade antikoagulantiaeffekter, inklusive ökad blödning, har rapporterats när SSRI och SNRI administreras samtidigt med warfarin. Patienter som får warfarinbehandling bör övervakas noggrant när Effexor 37,5 mg XR påbörjas eller avbryts.
Viktminskningsmedel
Säkerheten och effekten av venlafaxinbehandling i kombination med viktminskningsmedel, inklusive fentermin, har inte fastställts. Samtidig administrering av Effexor XR och viktminskningsmedel rekommenderas inte. Effexor XR är inte indicerat för viktminskning enbart eller i kombination med andra produkter.
Effekter av andra droger på Effexor XR
Figur 1: Effekt av interagerande läkemedel på farmakokinetiken för venlafaxin och den aktiva metaboliten O-desmetylvenlafaxin (ODV).
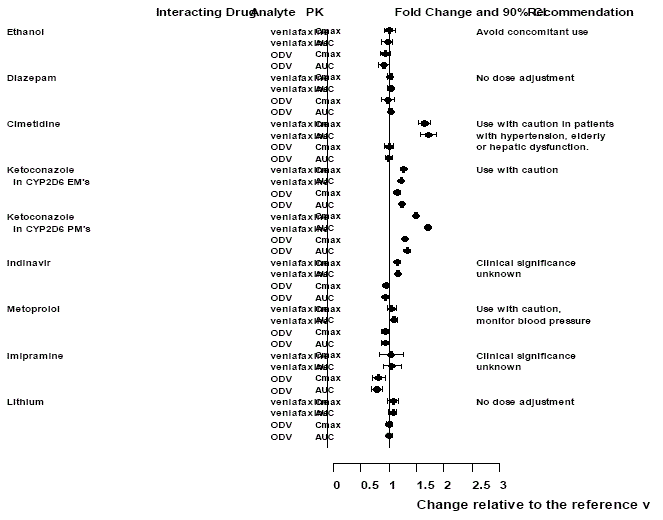
Effekter av Effexor XR på andra droger
Figur 2: Effekt av venlafaxin på de farmakokinetiska interagerande läkemedlen och deras aktiva metaboliter.
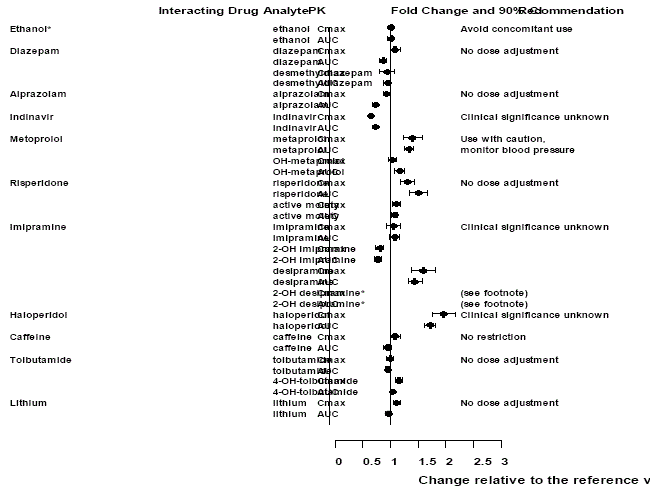
Notera
Administrering av venlafaxin i en stabil regim överdrev inte de psykomotoriska och psykometriska effekterna inducerade av etanol hos samma patienter när de inte fick venlafaxin.
Interaktioner mellan läkemedel och laboratorietest
Falskt positiva screeningtest för urinimmunanalys för fencyklidin (PCP) och amfetamin har rapporterats hos patienter som tar venlafaxin. Detta beror på bristande specificitet hos screeningtesterna. Falskt positiva testresultat kan förväntas i flera dagar efter avslutad venlafaxinbehandling. Bekräftande tester, såsom gaskromatografi/masspektrometri, kommer att skilja venlafaxin från PCP och amfetamin.
Narkotikamissbruk och beroende
Kontrollerad substans
Effexor 75mg XR är inte en kontrollerad substans.
Missbruk
Även om venlafaxin inte systematiskt har studerats i kliniska studier med avseende på dess potential för missbruk, fanns det ingen indikation på läkemedelssökande beteende i de kliniska studierna. Det är dock inte möjligt att förutsäga på basis av erfarenheter från förmarknadsföring i vilken utsträckning ett CNS-aktivt läkemedel kommer att missbrukas, avledas och/eller missbrukas när det väl marknadsförts. Följaktligen bör läkare noggrant utvärdera patienter med avseende på historia av drogmissbruk och följa sådana patienter noggrant, observera dem för tecken på missbruk eller missbruk av venlafaxin (t.ex. utveckling av tolerans, ökning av dosen, läkemedelssökande beteende).
Beroende
In vitro-studier visade att venlafaxin praktiskt taget inte har någon affinitet för opiat-, bensodiazepin-, fencyklidin- (PCP) eller N-metyl-D-asparaginsyra (NMDA)-receptorer.
Venlafaxin visade sig inte ha någon signifikant CNS-stimulerande aktivitet hos gnagare. I studier på diskriminering av primater visade venlafaxin ingen signifikant risk för missbruk av stimulerande eller depressiva medel.
Utsättningseffekter har rapporterats hos patienter som får venlafaxin [se DOSERING OCH ADMINISTRERING ].
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Självmordstankar och -beteenden hos barn, ungdomar och unga vuxna
Patienter med egentlig depression (MDD), både vuxna och barn, kan uppleva förvärring av sin depression och/eller uppkomsten av självmordstankar och självmordsbeteende (suicidalitet) eller ovanliga beteendeförändringar, oavsett om de tar antidepressiva mediciner eller inte, och detta risken kan kvarstå tills betydande remission inträffar. Självmord är en känd risk för depression och vissa andra psykiatriska störningar, och dessa störningar i sig är de starkaste prediktorerna för självmord. Det har dock funnits en långvarig oro för att antidepressiva medel kan ha en roll i att framkalla förvärring av depression och uppkomsten av suicidalitet hos vissa patienter under de tidiga faserna av behandlingen. Poolade analyser av korttidsstudier av placebokontrollerade läkemedel av antidepressiva läkemedel (SSRI och andra) visade att dessa läkemedel ökar risken för suicidtänkande och suicidalitet (suicidalitet) hos barn, ungdomar och unga vuxna (18-24 år) med MDD och andra psykiatriska störningar. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det var en minskning med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre.
De sammanslagna analyserna av placebokontrollerade studier på barn och ungdomar med MDD, tvångssyndrom (OCD) eller andra psykiatriska störningar inkluderade totalt 24 korttidsstudier av 9 antidepressiva läkemedel på över 4 400 patienter. De sammanslagna analyserna av placebokontrollerade studier på vuxna med MDD eller andra psykiatriska störningar inkluderade totalt 295 korttidsstudier (medianlängd på 2 månader) av 11 antidepressiva läkemedel på över 77 000 patienter. Det fanns avsevärd variation i risk för suicidalitet bland droger, men en tendens till en ökning av de yngre patienterna för nästan alla studerade droger. Det fanns skillnader i absolut risk för suicidalitet mellan de olika indikationerna, med den högsta förekomsten av MDD. Riskskillnaderna (läkemedel kontra placebo) var dock relativt stabila inom åldersskikt och över indikationer. Dessa riskskillnader (skillnad mellan läkemedel och placebo i antalet fall av suicidalitet per 1 000 behandlade patienter) anges i Tabell 1.
Inga självmord inträffade i någon av de pediatriska studierna. Det förekom självmord i vuxenstudierna, men antalet var inte tillräckligt för att dra någon slutsats om läkemedelseffekt på självmord.
Det är okänt om suicidalitetsrisken sträcker sig till långvarig användning, dvs över flera månader. Det finns dock betydande bevis från placebokontrollerade underhållsstudier på vuxna med depression att användning av antidepressiva medel kan fördröja återkommande depression.
Alla patienter som behandlas med antidepressiva medel för någon indikation bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet och ovanliga beteendeförändringar, särskilt under de första månaderna av en läkemedelsbehandlingskur, eller vid tidpunkter med dosförändringar, antingen ökningar eller minskar.
Följande symtom, ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani och mani, har rapporterats hos vuxna och pediatriska patienter som behandlas med antidepressiva medel för MDD, samt för andra indikationer, både psykiatriska och icke-psykiatriska. Även om ett orsakssamband mellan uppkomsten av sådana symtom och antingen försämringen av depression och/eller uppkomsten av självmordsimpulser inte har fastställts, finns det oro för att sådana symtom kan representera föregångare till framväxande suicidalitet.
Man bör överväga att ändra den terapeutiska kuren, inklusive eventuellt avbrytande av medicineringen, hos patienter vars depression är ihållande värre, eller som upplever framväxande suicidalitet eller symtom som kan vara prekursorer till förvärrad depression eller suicidalitet, särskilt om dessa symtom är allvarliga, plötsliga. i början eller inte var en del av patientens symptom.
Om beslutet har fattats att avbryta behandlingen, bör medicineringen minskas så snabbt som möjligt, men med insikt om att plötsligt avbrytande kan vara förknippat med vissa symtom [se Utsättningssyndrom och DOSERING OCH ADMINISTRERING ].
Familjer och vårdgivare till patienter som behandlas med antidepressiva medel för MDD eller andra indikationer, både psykiatriska och icke-psykiatriska, bör uppmärksammas om behovet av att övervaka patienter för uppkomsten av agitation, irritabilitet, ovanliga beteendeförändringar och de andra symtomen som beskrivs ovan, som samt uppkomsten av suicidalitet, och att omedelbart rapportera sådana symtom till vårdgivare. Sådan övervakning bör innefatta daglig observation av familjer och vårdgivare. Recept för Effexor XR bör skrivas ut för den minsta mängden kapslar som överensstämmer med god patienthantering, för att minska risken för överdosering.
Screening av patienter för bipolär sjukdom
En allvarlig depressiv episod kan vara den första presentationen av bipolär sjukdom. Det anses allmänt (även om det inte har fastställts i kontrollerade studier) att behandling av en sådan episod med enbart ett antidepressivt läkemedel kan öka sannolikheten för utfällning av en blandad/manisk episod hos patienter med risk för bipolär sjukdom. Huruvida något av de ovan beskrivna symptomen representerar en sådan omvandling är okänt. Innan behandling med ett antidepressivt läkemedel påbörjas bör dock patienter med depressiva symtom screenas på lämpligt sätt för att fastställa om de löper risk för bipolär sjukdom; sådan screening bör inkludera en detaljerad psykiatrisk historia, inklusive en familjehistoria av självmord, bipolär sjukdom och depression. Det bör noteras att Effexor XR inte är godkänd för behandling av bipolär depression.
Serotonin syndrom
Utvecklingen av ett potentiellt livshotande serotonergt syndrom har rapporterats med serotonin-noradrenalinåterupptagshämmare (SNRI) och SSRI, inklusive Effexor XR enbart, men särskilt vid samtidig användning av andra serotonerga läkemedel (inklusive triptaner, tricykliska antidepressiva medel, lithium, lithium, tramadol, tryptofan, buspiron, amfetamin och johannesört) och med läkemedel som försämrar metabolismen av serotonin i synnerhet, MAO-hämmare, både de som är avsedda att behandla psykiatriska störningar och andra, såsom linezolid eller intravenös metylenblått).
Symtom på serotonergt syndrom kan inkludera förändringar i mental status (t.ex. agitation, hallucinationer, delirium, koma) autonom instabilitet (t.ex. takykardi, labilt blodtryck, hypertermi, diafores, rodnad och yrsel), neuromuskulära symtom (t.ex. tremor, stelhet, myoklonus). , hyperreflexi, inkoordination); kramper och gastrointestinala symtom (t.ex. illamående, kräkningar, diarré). Patienter bör övervakas med avseende på uppkomsten av serotonergt syndrom.
Samtidig användning av Effexor XR och MAO-hämmare (avsedda att behandla psykiatriska störningar) är kontraindicerad. Effexor XR ska inte heller påbörjas hos en patient som behandlas med MAO-hämmare såsom linezolid eller intravenöst metylenblått. Alla rapporter med metylenblått som gav information om administreringssättet involverade intravenös administrering i dosintervallet 1 mg/kg till 8 mg/kg. Inga rapporter involverade administrering av metylenblått på andra sätt (såsom orala tabletter eller lokal vävnadsinjektion) eller vid lägre doser. Det kan finnas omständigheter då det är nödvändigt att påbörja behandling med en MAO-hämmare såsom linezolid eller intravenös metylenblått hos en patient som tar Effexor 37,5 mg XR. Effexor XR ska avbrytas innan behandling med MAO-hämmaren påbörjas [se KONTRAINDIKATIONER , DOSERING OCH ADMINISTRERING , och LÄKEMEDELSINTERAKTIONER ].
Om samtidig användning av Effexor 37,5 mg XR med andra serotonerga läkemedel (t.ex. triptaner, tricykliska antidepressiva medel, mirtazapin, fentanyl, litium, tramadol, buspiron, amfetamin, tryptofan eller johannesört) är kliniskt motiverad, noggrann observation av patienten rekommenderas, särskilt under behandlingsstart och dosökningar [se LÄKEMEDELSINTERAKTIONER ]. Patienter bör göras medvetna om den potentiella risken för serotonergt syndrom. Behandling med Effexor XR och eventuella samtidiga serotonerga medel ska avbrytas omedelbart om ovanstående händelser inträffar, och stödjande symtomatisk behandling bör inledas.
Förhöjda blodtryck
I kontrollerade studier fanns dosrelaterade ökningar av systoliskt och diastoliskt blodtryck, såväl som fall av ihållande hypertoni [se NEGATIVA REAKTIONER ].
Övervaka blodtrycket innan behandling med Effexor 37,5 mg XR påbörjas och regelbundet under behandlingen. Kontrollera redan existerande hypertoni innan behandling med Effexor 75mg XR påbörjas. Var försiktig vid behandling av patienter med redan existerande hypertoni eller kardiovaskulära eller cerebrovaskulära tillstånd som kan äventyras av förhöjt blodtryck. Ihållande blodtryckshöjning kan leda till negativa resultat. Fall av förhöjt blodtryck som kräver omedelbar behandling har rapporterats med Effexor XR. Överväg dossänkning eller avbrytande av behandlingen för patienter som upplever en ihållande ökning av blodtrycket.
alla kliniska studier med Effexor 37,5 mg upplevde 1,4 % av patienterna i de Effexor XR-behandlade grupperna en ökning av ≥15 mm Hg i liggande diastoliskt blodtryck (SDBP) ≥ 105 mm Hg, jämfört med 0,9 % av patienterna i placebogrupperna. På liknande sätt upplevde 1 % av patienterna i de Effexor 75 mg XR-behandlade grupperna en ≥ 20 mm Hg ökning av systoliskt blodtryck (SSBP) med blodtryck ≥ 180 mm Hg, jämfört med 0,3 % av patienterna i placebogrupperna [se tabell 10 i NEGATIVA REAKTIONER ]. Effexor 75 mg XR-behandling var associerad med ihållande hypertoni (definierad som behandlingsuppkommande SDBP ≥ 90 mm Hg och ≥ 10 mm Hg över baslinjen under tre på varandra följande behandlingsbesök [se tabell 11 i NEGATIVA REAKTIONER ]. Ett otillräckligt antal patienter fick medeldoser av Effexor 37,5 mg XR över 300 mg per dag i kliniska studier för att fullständigt kunna utvärdera förekomsten av ihållande blodtrycksökningar vid dessa högre doser.
Onormal blödning
SSRI och SNRI, inklusive Effexor 37,5 mg XR, kan öka risken för blödningar, allt från ekkymoser, hematom, näsblod, petekier och gastrointestinala blödningar till livshotande blödningar. Samtidig användning av aspirin, icke-steroida antiinflammatoriska läkemedel (NSAID), warfarin och andra antikoagulantia eller andra läkemedel som är kända för att påverka trombocytfunktionen kan öka denna risk. Fallrapporter och epidemiologiska studier (fallkontroll och kohortdesign) har visat ett samband mellan användning av läkemedel som stör serotoninåterupptaget och förekomsten av gastrointestinala blödningar. Varna patienter för risken för blödning i samband med samtidig användning av Effexor 75 mg XR och NSAID, aspirin eller andra läkemedel som påverkar koagulationen.
Stängningsvinkelglaukom
Pupillvidgningen som uppstår efter användning av många antidepressiva läkemedel inklusive Effexor XR kan utlösa en vinkelattack hos en patient med anatomiskt smala vinklar som inte har en patenterad iridektomi.
Aktivering av mani/hypomani
Mani eller hypomani rapporterades hos patienter behandlade med Effexor 37,5 mg XR i premarketingstudierna vid MDD, SAD och PD (se tabell 2). Mani/hypomani har också rapporterats hos en liten del av patienter med humörstörningar som behandlats med andra marknadsförda läkemedel för att behandla MDD. Effexor 37,5 mg XR ska användas med försiktighet till patienter med mani eller hypomani i anamnesen.
Utsättningssyndrom
Utsättningssymtom har systematiskt utvärderats hos patienter som tar venlafaxin, inklusive prospektiva analyser av kliniska studier i GAD och retrospektiva undersökningar av studier i MDD och SAD. Plötsligt avbrytande eller dosreduktion av venlafaxin vid olika doser har visat sig vara associerat med uppkomsten av nya symtom, vars frekvens ökade med ökad dosnivå och med längre behandlingstid. Rapporterade symtom inkluderar agitation, anorexi, ångest, förvirring, försämrad koordination och balans, diarré, yrsel, muntorrhet, dysforiskt humör, fascikulation, trötthet, influensaliknande symtom, huvudvärk, hypomani, sömnlöshet, illamående, nervositet, mardrömmar, känselstörningar ( inklusive stötliknande elektriska förnimmelser), somnolens, svettning, tremor, yrsel och kräkningar.
Det har förekommit rapporter om allvarliga utsättningssymtom som kan vara utdragna och allvarliga efter marknadsföringen. Fullbordat självmord, självmordstankar, aggression och våldsamt beteende har observerats hos patienter under minskning av Effexor 75 mg XR-dosen, inklusive under utsättning. Andra rapporter efter marknadsföringen beskriver synförändringar (som suddig syn eller problem med att fokusera) och ökat blodtryck efter att ha stoppat eller minskat dosen av Effexor XR.
Under marknadsföringen av Effexor XR, andra SNRI och SSRI har det förekommit spontana rapporter om andra biverkningar som inträffat vid utsättning av dessa läkemedel, särskilt vid abrupt behandling, inklusive följande: irritabilitet, letargi, emotionell labilitet, tinnitus och anfall.
Patienter bör övervakas för dessa symtom när behandlingen med Effexor XR avbryts. En gradvis minskning av dosen, snarare än abrupt upphörande, rekommenderas. Om oacceptabla symtom uppstår efter en minskning av dosen eller efter avslutad behandling, kan återuppta den tidigare ordinerade dosen övervägas. Därefter kan vårdgivaren fortsätta att minska dosen, men i en mer gradvis takt. Hos vissa patienter kan utsättning av behandlingen behöva ske under en period av flera månader [se DOSERING OCH ADMINISTRERING ].
Anfall
Kramper har förekommit med venlafaxinbehandling. Effexor 75mg XR ska, liksom många antidepressiva läkemedel, användas med försiktighet till patienter med anamnes på anfall och bör avbrytas hos alla patienter som utvecklar anfall. [Måste minska risken: Riskfaktorer, samtidig medicinering som sänker kramptröskeln.]
Hyponatremi
Hyponatremi kan uppstå som ett resultat av behandling med SSRI och SNRI, inklusive Effexor 37,5 mg XR. I många fall verkar hyponatremin vara resultatet av syndromet av olämpligt antidiuretiskt hormon (SIADH). Fall med serumnatrium lägre än 110 mmol/L har rapporterats. Äldre patienter kan löpa större risk att utveckla hyponatremi med SSRI och SNRI [se Användning i specifika populationer ]. Dessutom kan patienter som tar diuretika, eller de som på annat sätt är utarmade i volym, löpa större risk. Överväg att avbryta behandlingen med Effexor 37,5 mg XR hos patienter med symtomatisk hyponatremi och sätt in lämplig medicinsk intervention.
Tecken och symtom på hyponatremi inkluderar huvudvärk, koncentrationssvårigheter, minnesstörning, förvirring, svaghet och ostadighet, vilket kan leda till fall. Tecken och symtom förknippade med mer allvarliga och/eller akuta fall har inkluderat hallucinationer, synkope, anfall, koma, andningsstopp och dödsfall.
Vikt- och längdförändringar hos pediatriska patienter
Viktförändringar
Den genomsnittliga förändringen i kroppsvikt och incidensen av viktminskning (andel av patienter som förlorade 3,5 % eller mer) i de placebokontrollerade pediatriska studierna i MDD, GAD och SAD visas i tabellerna 3 och 4.
Viktminskning var inte begränsad till patienter med behandlingsuppkomna anorexi [se Aptitförändringar hos pediatriska patienter ].
Riskerna förknippade med långvarig användning av Effexor 75 mg XR bedömdes i en öppen MDD-studie av barn och ungdomar som fick Effexor XR i upp till sex månader. Barnen och ungdomarna i studien hade viktökningar som var mindre än förväntat, baserat på data från ålders- och könsmatchade kamrater. Skillnaden mellan observerad viktökning och förväntad viktökning var större för barn (
Höjdförändringar
Tabell 5 visar den genomsnittliga höjdökningen hos pediatriska patienter i korttidsstudierna med placebokontrollerad MDD, GAD och SAD. Skillnaderna i höjdökningar i GAD- och MDD-studier var mest anmärkningsvärda hos patienter yngre än tolv.
I den sex månader långa, öppna MDD-studien hade barn och ungdomar höjdökningar som var mindre än förväntat, baserat på data från ålders- och könsmatchade jämnåriga. Skillnaden mellan observerad och förväntad tillväxthastighet var större för barn (
Aptitförändringar hos pediatriska patienter
Minskad aptit (rapporterad som behandlingsutlöst anorexi) observerades vanligare hos Effexor XR-behandlade patienter jämfört med placebobehandlade patienter i premarketingutvärderingen av Effexor XR för MDD, GAD och SAD (se tabell 6).
Interstitiell lungsjukdom och eosinofil lunginflammation
Interstitiell lungsjukdom och eosinofil lunginflammation i samband med venlafaxinbehandling har rapporterats i sällsynta fall. Möjligheten för dessa biverkningar bör övervägas hos venlafaxinbehandlade patienter som uppvisar progressiv dyspné, hosta eller obehag i bröstet. Sådana patienter bör genomgå en omedelbar medicinsk utvärdering och avbrytande av venlafaxinbehandling bör övervägas.
Sexuell dysfunktion
Användning av SNRI, inklusive Effexor XR, kan orsaka symtom på sexuell dysfunktion [se NEGATIVA REAKTIONER ]. Hos manliga patienter kan användning av SNRI resultera i fördröjning eller ejakulationssvikt, minskad libido och erektil dysfunktion. Hos kvinnliga patienter kan användning av SNRI resultera i minskad libido och försenad eller utebliven orgasm.
Det är viktigt för förskrivare att fråga sig om sexuell funktion innan behandlingen med Effexor 37,5 mg XR påbörjas och att fråga specifikt om förändringar i sexuell funktion under behandlingen, eftersom sexuell funktion kanske inte rapporteras spontant. När man utvärderar förändringar i sexuell funktion är det viktigt att få en detaljerad historia (inklusive tidpunkten för symtomdebut) eftersom sexuella symtom kan ha andra orsaker, inklusive den underliggande psykiatriska störningen. Diskutera potentiella hanteringsstrategier för att stödja patienter i att fatta välgrundade beslut om behandling.
Information om patientrådgivning
Se FDA-godkänd PATIENTINFORMATION ( Läkemedelsguide ).
Förskrivare eller annan hälso- och sjukvårdspersonal bör informera patienter, deras familjer och deras vårdgivare om fördelarna och riskerna med behandling med Effexor 37,5 mg XR och bör ge dem råd om lämplig användning. En patientmedicineringsguide om "antidepressiva läkemedel, depression och andra allvarliga psykiska sjukdomar och självmordstankar eller -handlingar" finns tillgänglig för Effexor 75mg XR. Förskrivaren eller sjukvårdspersonalen bör instruera patienter, deras familjer och deras vårdgivare att läsa medicinguiden och bör hjälpa dem att förstå dess innehåll. Patienterna ska ges möjlighet att diskutera innehållet i Läkemedelsguiden och få svar på eventuella frågor de kan ha. Den fullständiga texten i läkemedelsguiden återges i slutet av detta dokument. Patienter bör informeras om följande problem och bör uppmanas att varna sin förskrivare om dessa inträffar när de tar Effexor XR.
Självmordstankar och -beteenden
Råda patienter, deras familjer och vårdgivare att leta efter uppkomsten av suicidalitet, förvärring av depression och andra psykiatriska symtom (ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi, psykomotorisk rastlöshet, hypomani, mani, andra ovanliga beteendeförändringar), särskilt tidigt under behandlingen och när dosen justeras upp eller ner. Sådana symtom bör rapporteras till patientens förskrivare eller hälso- och sjukvårdspersonal, särskilt om de är allvarliga, plötsliga debuterande eller inte var en del av patientens symtom. Symtom som dessa kan vara förknippade med en ökad risk för suicidalt tänkande och beteende och indikerar ett behov av mycket noggrann övervakning [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Samtidig medicinering
Råda patienter som tar Effexor XR att inte använda andra produkter som innehåller venlafaxin eller desvenlafaxin samtidigt. Sjukvårdspersonal bör instruera patienterna att inte ta Effexor XR med en MAO-hämmare eller inom 14 dagar efter att ha avslutat en MAO-hämmare och att vänta 7 dagar efter avslutad Effexor XR innan en MAO-hämmare påbörjas [se KONTRAINDIKATIONER ].
Serotonin syndrom
Patienter bör varnas för risken för serotonergt syndrom vid samtidig användning av Effexor 75 mg XR och triptaner, tramadol, amfetamin, tryptofantillskott, med antipsykotika eller andra dopaminantagonister eller andra serotonerga medel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ].
Förhöjt blodtryck
Informera patienterna att de bör ha regelbunden kontroll av blodtrycket när de tar Effexor XR [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Onormal blödning
Patienter bör varnas för samtidig användning av Effexor 75 mg XR och NSAID, acetylsalicylsyra, warfarin eller andra läkemedel som påverkar koagulationen eftersom kombinerad användning av psykotropa läkemedel som stör serotoninåterupptaget och dessa medel har associerats med en ökad risk för blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Vinkelstängning glaukom
Patienter bör informeras om att intag av Effexor XR kan orsaka mild pupillvidgning, vilket hos känsliga individer kan leda till en episod av vinkelglaukom. Redan existerande glaukom är nästan alltid glaukom med öppen vinkel eftersom stängningsvinkelglaukom, när det diagnostiseras, kan behandlas definitivt med iridektomi. Öppenvinkelglaukom är inte en riskfaktor för stängningsvinkelglaukom. Patienter kan vilja undersökas för att avgöra om de är mottagliga för vinkelstängning och genomgå en profylaktisk procedur (t.ex. iridektomi), om de är mottagliga [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Aktivering av mani/hypomani
Råda patienter, deras familjer och vårdgivare att observera efter tecken på aktivering av mani/hypomani [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kardiovaskulär/Cerebrovaskulär sjukdom
Försiktighet tillråds vid administrering av Effexor XR till patienter med kardiovaskulära, cerebrovaskulära eller lipidmetabolismstörningar [se NEGATIVA REAKTIONER ].
Förhöjning av serumkolesterol och triglycerider
Informera patienterna om att förhöjningar av totalt kolesterol, LDL och triglycerider kan förekomma och att mätning av serumlipider kan övervägas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Utsättningssyndrom
Rekommendera patienter att inte sluta ta Effexor 75mg XR utan att först prata med sin läkare. Patienter bör vara medvetna om att utsättningseffekter kan uppstå när man avslutar Effexor XR [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Sexuell dysfunktion
Informera patienter om att användning av Effexor XR kan orsaka symtom på sexuell dysfunktion hos både manliga och kvinnliga patienter. Informera patienter om att de bör diskutera eventuella förändringar i sexuell funktion och potentiella hanteringsstrategier med sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Interferens med kognitiva och motoriska prestanda
Varna patienter för att använda farliga maskiner, inklusive bilar, tills de är rimligt säkra på att Effexor 37,5 mg XR-behandling inte negativt påverkar deras förmåga att delta i sådana aktiviteter.
Alkohol
Rekommendera patienter att undvika alkohol när de tar Effexor 37,5 mg XR [se LÄKEMEDELSINTERAKTIONER ].
Allergiska reaktioner
Rekommendera patienter att meddela sin läkare om de utvecklar allergiska fenomen som hudutslag, nässelfeber, svullnad eller andningssvårigheter.
Graviditet
Rekommendera patienter att meddela sin läkare om de blir gravida eller avser att bli gravida under behandlingen [se Användning i specifika populationer ].
Amning
Råda patienter att meddela sin läkare om de ammar ett spädbarn [se Användning i specifika populationer ].
Kvarvarande sfäroider
Effexor XR innehåller sfäroider, som släpper ut läkemedlet långsamt i matsmältningskanalen. Den olösliga delen av dessa sfäroider elimineras, och patienter kan märka att sfäroider passerar i avföringen eller via kolostomi. Patienterna bör informeras om att den aktiva medicinen redan har absorberats när patienten ser sfäroiderna.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Tumörer ökade inte vid behandling med venlafaxin hos möss eller råttor. Venlafaxin gavs genom oral sondmatning till möss i 18 månader i doser upp till 120 mg/kg per dag, vilket var 1,7 gånger den maximala rekommenderade humana dosen på mg/m2-basis. Venlafaxin gavs också till råttor genom oral sondmatning under 24 månader i doser upp till 120 mg/kg per dag. Hos råttor som fick dosen 120 mg/kg var plasmakoncentrationerna av venlafaxin vid obduktion 1 gånger (hanråttor) och 6 gånger (honråttor) plasmakoncentrationerna hos patienter som fick den maximala rekommenderade humana dosen. Plasmanivåerna av O-desmetylmetaboliten (ODV) var lägre hos råttor än hos patienter som fick den maximala rekommenderade dosen. O-desmetylvenlafaxin (ODV), den huvudsakliga humana metaboliten av venlafaxin, administrerad genom oral sondmatning till möss och råttor under 2 år ökade inte förekomsten av tumörer i någon av studierna. Möss fick ODV i doser upp till 500/300 mg/kg/dag (dosen sänktes efter 45 veckors dosering). Exponeringen vid dosen 300 mg/kg/dag är 9 gånger den för en human dos på 225 mg/dag. Råttor fick ODV i doser upp till 300 mg/kg/dag (hanar) eller 500 mg/kg/dag (honor). Exponeringen vid den högsta dosen är cirka 8 (män) eller 11 (kvinnor) gånger den för en human dos på 225 mg/dag.
Mutagenes
Venlafaxin och den huvudsakliga humana metaboliten, ODV, var inte mutagena i Ames omvänd mutationsanalysen i Salmonella-bakterier eller den kinesiska hamsterns äggstock/HGPRT-däggdjurscellframåtmutationsanalysen. Venlafaxin var inte heller mutagent eller klastogent i in vitro BALB/c-3T3 muscellstransformationsanalysen, systerkromatidbytesanalysen i odlade kinesiska hamsteräggstocksceller eller i in vivo kromosomavvikelseanalysen i benmärg hos råtta. ODV var inte klastogent i in vitro analysen av kromosomavvikelser i kinesisk hamster på äggstocksceller eller i in vivo-analysen av kromosomavvikelser på råttor.
Nedsättning av fertilitet
Reproduktions- och fertilitetsstudier av venlafaxin på råttor visade inga negativa effekter av venlafaxin på manlig eller kvinnlig fertilitet vid orala doser på upp till 2 gånger den maximala rekommenderade humana dosen på 225 mg/dag på mg/m2 basis. Dock observerades minskad fertilitet i en studie där han- och honråttor behandlades med O-desmetylvenlafaxin (ODV), den huvudsakliga mänskliga metaboliten av venlafaxin, före och under parning och dräktighet. Detta inträffade vid en ODV-exponering (AUC) cirka 2 till 3 gånger den som associerades med en human venlafaxindos på 225 mg/dag.
Användning i specifika populationer
Graviditet
Teratogena effekter
Graviditetskategori C
Venlafaxin orsakade inga missbildningar hos avkommor till råttor eller kaniner som gavs doser upp till 2,5 gånger (råtta) eller 4 gånger (kanin) den maximala rekommenderade dagliga dosen för människor på mg/m2-basis. Hos råttor var det dock en minskning av valpvikten, en ökning av dödfödda ungar och en ökning av valpdöd under de första 5 dagarna av laktationen, när doseringen började under dräktigheten och fortsatte fram till avvänjningen. Orsaken till dessa dödsfall är inte känd. Dessa effekter inträffade vid 2,5 gånger (mg/m2) den maximala humana dagliga dosen. Ingen effektdos för dödlighet av råttungar var 0,25 gånger humandosen på mg/m2-basis. I reproduktionsstudier på råttor och kaniner med O-desmetylvenlafaxin (ODV), den huvudsakliga humana metaboliten av venlafaxin, observerades inga tecken på teratogenicitet vid exponeringsmarginaler på 13 hos råttor och 0,3 hos kaniner. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Effexor XR ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Icke-teratogene effekter
Nyfödda som exponerats för Effexor 37,5 mg XR, andra SNRI eller SSRI sent i tredje trimestern har utvecklat komplikationer som kräver långvarig sjukhusvistelse, andningsstöd och sondmatning. Sådana komplikationer kan uppstå omedelbart efter leverans. Rapporterade kliniska fynd har inkluderat andnöd, cyanos, apné, kramper, temperaturinstabilitet, ätsvårigheter, kräkningar, hypoglykemi, hypotoni, hypertoni, hyperreflexi, tremor, skakningar, irritabilitet och konstant gråt. Dessa egenskaper överensstämmer med antingen en direkt toxisk effekt av SSRI och SNRI, eller möjligen ett läkemedelsavbrottssyndrom. Det bör noteras att den kliniska bilden i vissa fall överensstämmer med serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ]. Vid behandling av en gravid kvinna med Effexor XR under tredje trimestern bör läkaren noggrant överväga de potentiella riskerna och fördelarna med behandlingen.
Arbete och leverans
Effekten av venlafaxin på förlossning och förlossning hos människor är okänd.
Ammande mödrar
Venlafaxin och ODV har rapporterats utsöndras i modersmjölk. På grund av risken för allvarliga biverkningar hos ammande spädbarn från Effexor XR, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern.
Pediatrisk användning
Två placebokontrollerade studier på 766 pediatriska patienter med MDD och två placebokontrollerade studier på 793 pediatriska patienter med GAD har utförts med Effexor XR, och data var inte tillräckliga för att stödja ett påstående om användning hos pediatriska patienter.
Alla som överväger att använda Effexor XR hos ett barn eller en ungdom måste balansera de potentiella riskerna med det kliniska behovet [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Även om inga studier har utformats för att i första hand bedöma Effexor 37,5 mg XRs inverkan på tillväxt, utveckling och mognad hos barn och ungdomar, tyder studierna som har gjorts på att Effexor XR kan påverka vikt och längd negativt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Skulle beslut fattas att behandla en pediatrisk patient med Effexor XR rekommenderas regelbunden övervakning av vikt och längd under behandlingen, särskilt om behandlingen ska fortsätta under lång tid [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Säkerheten av Effexor 75 mg XR-behandling för pediatriska patienter har inte systematiskt utvärderats för kronisk behandling som varar längre än sex månader. I de studier som utfördes på pediatriska patienter (6-17 år) liknade förekomsten av blodtrycks- och kolesterolhöjningar som anses vara kliniskt relevanta hos pediatriska patienter den som observerats hos vuxna patienter. Följaktligen gäller försiktighetsåtgärderna för vuxna pediatriska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Geriatrisk användning
Andelen patienter i kliniska studier för Effexor 37,5 mg XR för MDD, GAD, SAD och PD som var 65 år eller äldre visas i Tabell 15.
Inga övergripande skillnader i effektivitet eller säkerhet observerades mellan geriatriska patienter och yngre patienter, och annan rapporterad klinisk erfarenhet har i allmänhet inte identifierat skillnader i svar mellan äldre och yngre patienter. Större känslighet hos vissa äldre individer kan dock inte uteslutas. SSRI och SNRI, inklusive Effexor XR, har associerats med fall av kliniskt signifikant hyponatremi hos äldre patienter, som kan löpa större risk för denna biverkning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
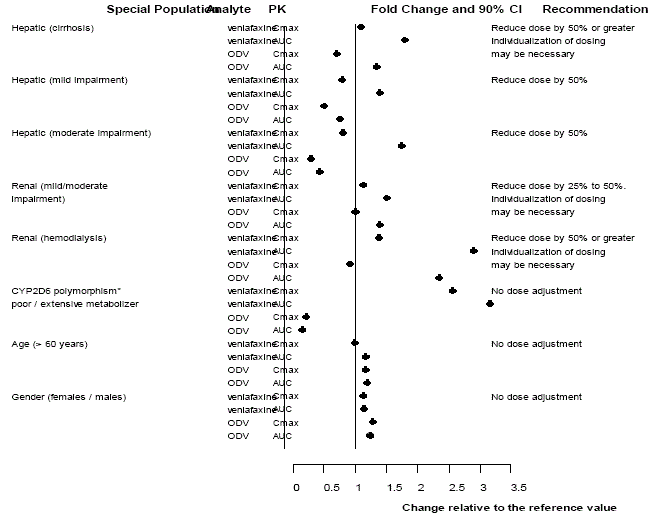
Farmakokinetiken för venlafaxin och ODV är inte väsentligt förändrad hos äldre [se KLINISK FARMAKOLOGI ] (se figur 3). Ingen dosjustering rekommenderas för äldre enbart på grundval av ålder, även om andra kliniska omständigheter, av vilka några kan vara vanligare hos äldre, såsom nedsatt njur- eller leverfunktion, kan motivera en dosminskning [se DOSERING OCH ADMINISTRERING ].
Ålder Och Kön
En populationsfarmakokinetisk analys av 404 Effexor-behandlade patienter från två studier som involverade regimer både två gånger dagligen och tre gånger dagligen visade att dosnormaliserade dalplasmanivåer av antingen venlafaxin eller ODV var oförändrade av ålders- eller könsskillnader. Dosjustering baserat på en patients ålder eller kön är i allmänhet inte nödvändig [se DOSERING OCH ADMINISTRERING ] (se tabell 15).
Användning i patientundergrupper
Figur 3: Farmakokinetik för venlafaxin och dess metabolit O-desmetylvenlafaxin (ODV) i speciella populationer.
ÖVERDOS
Mänsklig erfarenhet
Under förmarknadsföringsutvärderingarna av Effexor 75 mg XR (för MDD, GAD, SAD och PD) och Effexor (för MDD), fanns det tjugo rapporter om akut överdosering med Effexor (6 och 14 rapporter hos Effexor XR- respektive Effexor 75 mg-patienter) , antingen ensamt eller i kombination med andra droger och/eller alkohol.
Somnolens var det vanligaste rapporterade symtomet. Bland de andra rapporterade symtomen var parestesi av alla fyra extremiteterna, måttlig yrsel, illamående, domnade händer och fötter och varma-förkylningar 5 dagar efter överdosen. I de flesta fall var inga tecken eller symtom associerade med överdosering. Majoriteten av rapporterna gällde intag där den totala dosen av venlafaxin som togs uppskattades vara högst flera gånger högre än den vanliga terapeutiska dosen. En patient som fick i sig 2,75 g venlafaxin observerades ha två generaliserade konvulsioner och en förlängning av QTc till 500 ms, jämfört med 405 ms vid baslinjen. Mild sinustakykardi rapporterades hos två av de andra patienterna.
Åtgärder som vidtogs för att behandla överdosen inkluderade ingen behandling, sjukhusvistelse och symtomatisk behandling, och sjukhusvistelse plus behandling med aktivt kol. Alla patienter återhämtade sig.
Efter marknadsföring har överdosering av venlafaxin förekommit främst i kombination med alkohol och/eller andra droger. De vanligaste rapporterade händelserna vid överdosering inkluderar takykardi, förändringar i medvetandenivå (från somnolens till koma), mydriasis, kramper och kräkningar.
Elektrokardiogramförändringar (t.ex. förlängning av QT-intervall, grenblockering, QRS-förlängning), ventrikulär takykardi, bradykardi, hypotoni, rabdomyolys, svindel, levernekros, serotonergt syndrom och dödsfall har rapporterats.
Publicerade retrospektiva studier rapporterar att överdosering av venlafaxin kan vara associerad med en ökad risk för dödliga utfall jämfört med den som observerats med SSRI-antidepressiva produkter, men lägre än för tricykliska antidepressiva. Epidemiologiska studier har visat att venlafaxinbehandlade patienter har en högre redan existerande börda av självmordsriskfaktorer än SSRI-behandlade patienter. I vilken utsträckning upptäckten av en ökad risk för dödliga utfall kan tillskrivas venlafaxins toxicitet vid överdosering, i motsats till vissa egenskaper hos venlafaxinbehandlade patienter, är inte klarlagt. Recept för Effexor 75 mg XR bör skrivas ut för den minsta mängden kapslar som är förenlig med god patienthantering, för att minska risken för överdosering.
Hantering av överdosering
Kontakta ett certifierat giftkontrollcenter för uppdaterad vägledning och råd (1-800-222-1222 eller www.poison.org). I händelse av en överdos, ge stödjande vård, inklusive noggrann medicinsk övervakning och övervakning. Behandlingen bör bestå av de allmänna åtgärder som används vid hanteringen av överdosering med vilket läkemedel som helst. Överväg möjligheten av flera läkemedelsöverdoser. Säkerställ en tillräcklig luftväg, syresättning och ventilation. Övervaka hjärtrytmen och vitala tecken. Ge stödjande och symtomatiska åtgärder.
KONTRAINDIKATIONER
Överkänslighet
Överkänslighet mot venlafaxinhydroklorid, desvenlafaxinsuccinat eller mot något hjälpämne i formuleringen
Samtidig användning med monoaminoxidashämmare (MAO-hämmare)
Användning av MAO-hämmare (avsedda att behandla psykiatriska störningar) samtidigt med Effexor 75 mg XR eller inom 7 dagar efter avslutad behandling med Effexor XR är kontraindicerat på grund av en ökad risk för serotonergt syndrom. Användning av Effexor 37,5 mg XR inom 14 dagar efter avslutad behandling med en MAO-hämmare (avsedd att behandla psykiatriska störningar) är också kontraindicerat [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och LÄKEMEDELSINTERAKTIONER ].
Att starta Effexor XR hos en patient som behandlas med en MAO-hämmare såsom linezolid eller intravenös metylenblått är också kontraindicerat på grund av en ökad risk för serotonergt syndrom [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och LÄKEMEDELSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Den exakta mekanismen för den antidepressiva effekten av venlafaxin hos människor är okänd, men tros vara relaterad till förstärkningen av serotonin och noradrenalin i det centrala nervsystemet genom hämning av deras återupptag. Icke-kliniska studier har visat att venlafaxin och dess aktiva metabolit, ODV, är potenta och selektiva hämmare av neuronalt serotonin- och noradrenalinåterupptag och svaga hämmare av dopaminåterupptag.
Farmakodynamik
Venlafaxin och ODV har ingen signifikant affinitet för muskarin-kolinerga, H1-histaminerga eller α1-adrenerga receptorer in vitro. Farmakologisk aktivitet vid dessa receptorer antas vara associerad med de olika antikolinerga, sedativa och kardiovaskulära effekterna som ses med andra psykotropa läkemedel. Venlafaxin och ODV har inte monoaminoxidas (MAO)-hämmande aktivitet.
Hjärtets elektrofysiologi
Effekten av venlafaxin på QT-intervallet utvärderades i en randomiserad, dubbelblind, placebo- och positivt kontrollerad treperiods crossover grundlig QT-studie på 54 friska vuxna försökspersoner. Ingen signifikant QT-förlängningseffekt av venlafaxin 450 mg upptäcktes.
Farmakokinetik
Steady-state-koncentrationer av venlafaxin och ODV i plasma uppnås inom 3 dagar efter oral flerdosbehandling. Venlafaxin och ODV uppvisade linjär kinetik över dosintervallet 75 till 450 mg per dag. Medel±SD steady-state plasmaclearance av venlafaxin och ODV är 1,3±0,6 respektive 0,4±0,2 L/h/kg; skenbar eliminationshalveringstid är 5±2 respektive 11±2 timmar; och skenbar (steady-state) distributionsvolym är 7,5±3,7 respektive 5,7±1,8 l/kg. Venlafaxin och ODV är minimalt bundna vid terapeutiska koncentrationer till plasmaproteiner (27 % respektive 30 %).
Absorption och distribution
Venlafaxin absorberas väl och metaboliseras i stor utsträckning i levern. ODV är den huvudsakliga aktiva metaboliten. Baserat på massbalansstudier absorberas minst 92 % av en oral engångsdos av venlafaxin. Den absoluta biotillgängligheten för venlafaxin är cirka 45 %.
Administrering av Effexor 37,5 mg XR (150 mg en gång dagligen) resulterade i allmänhet i lägre Cmax och senare Tmax-värden än för Effexor (omedelbar frisättning) administrerat två gånger dagligen (tabell 16). När lika dagliga doser av venlafaxin administrerades som antingen en tablett med omedelbar frisättning eller kapsel med förlängd frisättning, var exponeringen för både venlafaxin och ODV liknande för de två behandlingarna, och fluktuationen i plasmakoncentrationer var något lägre med Effexor 37,5 mg XR kapsel. Därför ger Effexor XR en långsammare absorptionshastighet, men samma grad av absorption jämfört med tabletten med omedelbar frisättning.
Mat påverkade inte biotillgängligheten av venlafaxin eller dess aktiva metabolit, ODV. Administreringstid (AM kontra PM) påverkade inte farmakokinetiken för venlafaxin och ODV från 75 mg Effexor 75 mg XR kapsel.
Venlafaxin är inte i hög grad bundet till plasmaproteiner; Därför bör administrering av Effexor 37,5 mg XR till en patient som tar ett annat läkemedel som är starkt proteinbundet inte orsaka ökade fria koncentrationer av det andra läkemedlet.
Metabolism och eliminering
Efter absorption genomgår venlafaxin en omfattande presystemisk metabolism i levern, främst till ODV, men även till N-desmetylvenlafaxin, N,O-didesmetylvenlafaxin och andra mindre metaboliter. In vitro-studier indikerar att bildningen av ODV katalyseras av CYP2D6; detta har bekräftats i en klinisk studie som visar att patienter med låga CYP2D6-nivåer (dåliga metaboliserare) hade ökade nivåer av venlafaxin och minskade nivåer av ODV jämfört med personer med normala CYP2D6-nivåer (extensiva metaboliserare) [se Användning i specifika populationer ].
Cirka 87 % av en venlafaxindos återfinns i urinen inom 48 timmar som oförändrad venlafaxin (5 %), okonjugerad ODV (29 %), konjugerad ODV (26 %) eller andra mindre inaktiva metaboliter (27 %). Renal eliminering av venlafaxin och dess metaboliter är således den primära utsöndringsvägen.
Kliniska studier
Major depressiv sjukdom
Effekten av Effexor 75mg XR (venlafaxinhydroklorid) kapslar med förlängd frisättning som behandling för egentlig depression (MDD) fastställdes i två placebokontrollerade, korttids (8 veckor för studie 1; 12 veckor för studie 2), flexibla -dosstudier, med doser som börjar på 75 mg per dag och sträcker sig till 225 mg per dag på vuxna öppenvårdspatienter som uppfyller DSM-III-R- eller DSM-IV-kriterierna för MDD. Hos måttligt deprimerade öppenvårdspatienter var den initiala dosen venlafaxin 75 mg per dag. I båda studierna visade Effexor XR överlägsenhet gentemot placebo på det primära effektmåttet definierat som förändring från baslinjen i HAM-D-21 totalpoäng till endpointbesöket, Effexor XR visade också överlägsenhet gentemot placebo på det viktigaste sekundära effektmåttet, den kliniska Global Impressions (CGI) Skala för sjukdomens svårighetsgrad. Undersökning av könsundergrupper av den studerade populationen avslöjade inte någon differentiell lyhördhet på basis av kön.
En 4-veckors studie av slutenvårdspatienter som uppfyller DSM-III-R-kriterierna för MDD med melankoli med användning av Effexor 37,5 mg i ett intervall på 150 till 375 mg per dag (uppdelat i ett schema tre gånger om dagen) visade att Effexor är överlägset jämfört med placebo baserat på HAM-D-21 totalpoäng. Medeldosen för fullbordare var 350 mg per dag (studie 3).
en långtidsstudie randomiserades vuxna polikliniska patienter med MDD som hade svarat under en 8-veckors öppen studie på Effexor 37,5 mg XR (75, 150 eller 225 mg, en gång dagligen varje morgon) till att fortsätta med sin Effexor XR-dos eller placebo, i upp till 26 veckors observation för återfall. Svar under den öppna fasen definierades som ett CGI-allvarlighetsvärde av sjukdomen på ≤3 och ett HAM-D-21-totalpoäng på ≤10 vid utvärderingen av dag 56. Återfall under den dubbelblinda fasen definierades enligt följande: (1) ett återuppträdande av allvarlig depressiv sjukdom enligt definitionen av DSM-IV-kriterier och en CGI-svårhetsgrad av sjukdomspostpoäng på ≥4 (måttligt sjuk), (2) 2 på varandra följande CGI Allvarlighetsgraden av sjukdomen punktpoäng på ≥4, eller (3) en slutlig CGI-allvarlighetsgrad av sjukdomen punktpoäng på ≥4 för varje patient som drog sig ur studien av någon anledning. Patienter som fick fortsatt Effexor 37,5 mg XR-behandling upplevde statistiskt signifikant lägre återfallsfrekvenser under de efterföljande 26 veckorna jämfört med de som fick placebo (studie 4).
en andra långtidsstudie, vuxna öppenvårdspatienter med MDD, återkommande typ, som hade svarat (HAM-D21 totalpoäng ≤ 12 vid utvärderingen dag 56) och fortsatte att förbättras [definierat som att följande kriterier uppfylldes för dag 56 till 180 : (1) ingen HAM-D-21 totalpoäng ≥ 20; (2) inte mer än 2 HAM39 D-21 totalpoäng > 10, och (3) ingen enstaka CGI-allvarlighetsgrad för sjukdomen punktpoäng ≥ 4 (måttligt sjuk)] under de första 26 veckors behandling med Effexor [100 till 200 mg per dag, på ett schema två gånger dagligen] randomiserades till att fortsätta med sin Effexor-dos eller till placebo. Uppföljningsperioden för att observera patienter för återfall, definierad som en CGI-allvarlighetsgrad för sjukdomspunkt ≥ 4, var upp till 52 veckor. Patienter som fick fortsatt Effexor-behandling upplevde statistiskt signifikant lägre återfallsfrekvenser under de efterföljande 52 veckorna jämfört med de som fick placebo (studie 5).
Generaliserat ångestsyndrom
Effekten av Effexor XR som behandling för generaliserat ångestsyndrom (GAD) fastställdes i två 8-veckors placebokontrollerade studier med fasta doser (75 till 225 mg per dag), en 6-månaders, placebokontrollerad, flexibel -dosstudie (75 till 225 mg per dag), och en 6-månaders, placebokontrollerad studie med fasta doser (37,5, 75 och 150 mg per dag) på vuxna öppenvårdspatienter som uppfyller DSM-IV-kriterierna för GAD.
en 8-veckors studie visade Effexor XR överlägsenhet över placebo för doserna 75, 150 och 225 mg per dag, mätt med Hamilton Rating Scale for Anxiety (HAM-A) totalpoäng, både HAM-A-ångest och spänning objekt och skalan Clinical Global Impressions (CGI). Doserna på 75 och 150 mg per dag var dock inte lika konsekvent effektiva som den högsta dosen (studie 1). En andra 8-veckors studie som utvärderade doser på 75 och 150 mg per dag och placebo visade att båda doserna var mer effektiva än placebo på vissa av samma resultat; dock var dosen på 75 mg per dag mer konsekvent effektiv än dosen på 150 mg per dag (studie 2). Ett dos-responssamband för effektivitet vid GAD var inte klart fastställt inom det studerade dosintervallet 75 till 225 mg per dag.
Två 6-månadersstudier, en som utvärderade Effexor 75 mg XR-doser på 37,5, 75 och 150 mg per dag (studie 3) och den andra som utvärderade Effexor XR-doser på 75 till 225 mg per dag (studie 4), visade att dagliga doser av 75 mg eller mer var effektivare än placebo på HAM-A-total, både HAM-A-ångest- och spänningsposterna och CGI-skalan under 6 månaders behandling. Även om det också fanns bevis för överlägsenhet jämfört med placebo för dosen på 37,5 mg per dag, var denna dos inte lika konsekvent effektiv som de högre doserna.
Undersökning av könsundergrupper av den studerade populationen avslöjade inte någon differentiell lyhördhet på basis av kön.
Social ångeststörning (även känd som social fobi)
Effekten av Effexor 37,5 mg XR som behandling för social ångeststörning (SAD) fastställdes i fyra dubbelblinda, parallellgruppsstudier, 12-veckors, multicenter, placebokontrollerade, flexibel dosstudier (studier 1-4) och en dubbelblind, parallellgruppsstudie, 6 månader lång, placebokontrollerad, fast/flexibel dosstudie, som inkluderade doser i intervallet 75 till 225 mg per dag på vuxna öppenvårdspatienter som uppfyller DSM-IV-kriterierna för SAD (studie 5 ).
I dessa fem studier var Effexor 75 mg XR statistiskt signifikant effektivare än placebo vid förändring från baslinje till effektmått på Liebowitz Social Anxiety Scale (LSAS) totalpoäng. Det fanns inga bevis för någon större effektivitet av 150 till 225 mg per dag-gruppen jämfört med 75 mg per dag-gruppen i 6-månadersstudien.
Undersökning av delmängder av den studerade populationen avslöjade inte någon differentiell lyhördhet på basis av kön. Det fanns otillräcklig information för att fastställa effekten av ålder eller ras på resultatet i dessa studier.
Panikångest
Effekten av Effexor XR som behandling för panikångest (PD) fastställdes i två dubbelblinda, 12-veckors, multicenter, placebokontrollerade studier på vuxna öppenvårdspatienter som uppfyller DSM-IV-kriterierna för PD, med eller utan agorafobi. Patienterna fick fasta doser på 75 eller 150 mg per dag i en studie (studie 1) och 75 eller 225 mg per dag i den andra studien (studie 2).
Effekten utvärderades på basis av utfall i tre variabler: (1) procentandel av patienter som var fria från fullsymptomiga panikattacker på Panic and Anticipatory Anxiety Scale (PAAS); (2) genomsnittlig förändring från baslinje till effektmått på totalpoängen för Panic Disorder Severity Scale (PDSS); och (3) procentandel av patienter som bedömts som responders (mycket förbättrade eller mycket förbättrade) på Clinical Global Impressions (CGI) Improvement-skalan. I dessa två studier var Effexor XR statistiskt signifikant effektivare än placebo (för varje fast dos) på alla tre endpoints, men ett dos-responssamband var inte klart fastställt.
Undersökning av delmängder av den studerade populationen avslöjade inte någon differentiell lyhördhet på basis av kön. Det fanns otillräcklig information för att fastställa effekten av ålder eller ras på resultatet i dessa studier.
en långtidsstudie (studie 3) slumpades vuxna polikliniska patienter som uppfyller DSM-IV-kriterierna för PD som hade svarat under en 12-veckors öppen fas med Effexor 75 mg XR (75 till 225 mg per dag) att fortsätta med samma Effexor 75 mg XR-dos (75, 150 eller 225 mg) eller byt till placebo för observation för återfall under dubbelblinda tillstånd. Svar under den öppna fasen definierades som ≤ 1 panikattack med full symtom per vecka under de sista 2 veckorna av den öppna fasen och en CGI-förbättringspoäng på 1 (mycket förbättrad) eller 2 (mycket förbättrad). Återfall under den dubbelblinda fasen definierades som att ha 2 eller fler panikattacker med full symtom per vecka under 2 på varandra följande veckor eller att behandlingen avbröts på grund av förlust av effektivitet, vilket fastställts av utredarna under studien. Randomiserade patienter var i svarsstatus under en genomsnittlig tid på 34 dagar innan de randomiserades. I den randomiserade fasen efter den 12-veckors öppna perioden upplevde patienter som fick fortsatt Effexor 75 mg XR en statistiskt signifikant längre tid till återfall.
Pediatriska patienter
Två placebokontrollerade studier på 766 pediatriska patienter med MDD och två placebokontrollerade studier på 793 pediatriska patienter med GAD har utförts med Effexor XR, och data var inte tillräckliga för att stödja ett påstående om användning hos pediatriska patienter.
Vad är Effexor och hur används det?
Effexor är ett receptbelagt läkemedel som används för att behandla symtom på depression, generaliserad ångest, social ångest och panikångest. Effexor kan användas ensamt eller tillsammans med andra läkemedel.
Effexor tillhör en klass av läkemedel som kallas antidepressiva, selektiva serotonin och noradrenalinåterupptagshämmare (SNRI).
Vilka är de möjliga biverkningarna av Effexor 37,5 mg?
Effexor kan orsaka allvarliga biverkningar inklusive:
- suddig syn,
- tunnelseende,
- ögonsmärta eller svullnad,
- ser glorier runda ljus,
- lätta blåmärken eller blödningar (näsblod, blödande tandkött),
- blod i din urin eller avföring,
- hosta blod,
- hosta,
- tryck över bröstet,
- problem att andas,
- kramper (kramper),
- huvudvärk,
- förvirring,
- sluddrigt tal,
- allvarlig svaghet,
- kräkningar,
- förlust av koordination,
- känner sig ostadig,
- mycket stel (stel) muskel,
- hög feber,
- svettas,
- förvirring,
- snabba eller ojämna hjärtslag,
- skakningar och
- yrsel
- Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
- De vanligaste biverkningarna av Effexor inkluderar:
- yrsel,
- dåsighet,
- ångest,
- känna sig nervös,
- sömnproblem (sömnlöshet),
- synförändringar,
- illamående,
- kräkningar,
- diarre,
- förändringar i vikt eller aptit,
- torr mun,
- gapande,
- ökad svettning,
- minskad sexlust,
- impotens,
- onormal utlösning, och
- svårt att få orgasm
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Effexor. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
Suicidalitet och antidepressiva läkemedel
Antidepressiva läkemedel ökade risken jämfört med placebo för suicidtänkande och självmordsbeteende (suicidalitet) hos barn, ungdomar och unga vuxna i korttidsstudier av Major Depressive Disorder (MDD) och andra psykiatriska störningar. Alla som överväger att använda venlafaxintabletter, USP eller något annat antidepressivt medel hos ett barn, ungdom eller ung vuxen måste balansera denna risk med det kliniska behovet. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det fanns en minskning av risken med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre. Depression och vissa andra psykiatriska störningar är i sig förknippade med ökad risk för självmord. Patienter i alla åldrar som påbörjas med antidepressiv behandling bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet eller ovanliga beteendeförändringar. Familjer och vårdgivare bör informeras om behovet av noggrann observation och kommunikation med förskrivaren. Venlafaxin tabletter, USP är inte godkänd för användning hos pediatriska patienter. (Ser VARNINGAR : Klinisk försämring och självmordsrisk , PATIENTINFORMATION , och FÖRSIKTIGHETSÅTGÄRDER : Pediatrisk användning ).
BESKRIVNING
Venlafaxin tabletter, USP är ett strukturellt nytt antidepressivt medel för oral administrering. Den betecknas (R/S)-1-[2-(dimetylamino)-1-(4-metoxifenyl)etyl]cyklohexanolhydroklorid eller (±)-1-[α-[(dimetylamino)metyl]-p- metoxibensyl]cyklohexanolhydroklorid och har den empiriska formeln C17H27NO2 HCl. Dess molekylvikt är 313,87. Strukturformeln visas nedan.
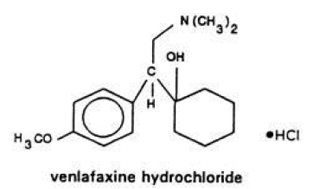
Venlafaxinhydroklorid är ett vitt till benvitt kristallint fast ämne med en löslighet på 572 mg/ml i vatten (justerad till jonstyrka på 0,2 M med natriumklorid). Dess oktanol:vatten (0,2 M natriumklorid) fördelningskoefficient är 0,43.
Komprimerade tabletter innehåller venlafaxinhydroklorid, USP motsvarande 25 mg, 37,5 mg, 50 mg, 75 mg eller 100 mg venlafaxinbas och följande inaktiva ingredienser: mikrokristallin cellulosa, laktosmonohydrat, förgelatinerad stärkelse, natriumstärkelseglykolat, järnoxidröd järnoxidgul, kolloidal kiseldioxid och magnesiumstearat.
