Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Cymbalta och hur används det?
Cymbalta är ett receptbelagt läkemedel som används för att behandla symtom på egentlig depression, diabetisk perifer neuropatisk smärta, generaliserat ångestsyndrom, fibromyalgi och kronisk muskelsmärta. Cymbalta kan användas ensamt eller tillsammans med andra läkemedel.
- Cymbalta tillhör en klass av läkemedel som kallas antidepressiva, SNRI, fibromyalgimedel.
- Det är inte känt om Cymbalta är säkert och effektivt för barn yngre än 7 år.
Vilka är de möjliga biverkningarna av Cymbalta 20mg?
Cymbalta kan orsaka allvarliga biverkningar inklusive:
- bultande hjärtslag eller fladdrande i bröstet,
- yrsel,
- lätt att få blåmärken,
- ovanlig blödning,
- synförändringar,
- smärtsam eller svår urinering,
- impotens,
- sexuella problem,
- högersidiga övre magsmärtor,
- klåda,
- mörk urin,
- gulfärgning av huden eller ögonen (gulsot),
- huvudvärk,
- förvirring,
- sluddrigt tal,
- allvarlig svaghet,
- kräkningar,
- förlust av koordination,
- känner sig ostadig,
- racing tankar,
- ökad energi,
- hänsynslöst beteende,
- känna sig extremt glad eller irriterad,
- pratar mer än vanligt, och
- allvarliga sömnproblem
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Cymbalta inkluderar:
- dåsighet,
- illamående,
- förstoppning,
- aptitlöshet,
- muntorrhet och
- ökad svettning
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Cymbalta. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
SJÄLVmordstankar och -beteenden
Antidepressiva läkemedel ökade risken för självmordstankar och självmordsbeteende hos barn, ungdomar och unga vuxna i korttidsstudier. Dessa studier visade ingen ökning av risken för suicidtankar och självmordsbeteende vid användning av antidepressiva läkemedel hos patienter över 24 år; det fanns en minskning av risken med användning av antidepressiva läkemedel hos patienter 65 år och äldre [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hos patienter i alla åldrar som påbörjas med antidepressiv behandling, övervaka noga för försämring och uppkomsten av självmordstankar och självmordsbeteenden. Informera familjer och vårdgivare om behovet av nära observation och kommunikation med förskrivaren [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
BESKRIVNING
CYMBALTA® (duloxetin kapslar med fördröjd frisättning) är en selektiv serotonin- och noradrenalinåterupptagshämmare (SSNRI) för oral administrering. Dess kemiska beteckning är (+)-(S)-N-metyl-y-(1-naftyloxi)-2-tiofenpropylaminhydroklorid. Den empiriska formeln är C18H19NOS•HCl, vilket motsvarar en molekylvikt på 333,88. Strukturformeln är:
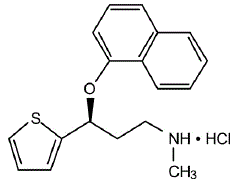
Duloxetinhydroklorid är ett vitt till svagt brunvitt fast ämne som är lätt lösligt i vatten.
Varje kapsel innehåller enterodragerade pellets av 22,4, 33,7 eller 67,3 mg duloxetinhydroklorid motsvarande 20, 30 respektive 60 mg duloxetin. Dessa enterodragerade pellets är utformade för att förhindra nedbrytning av läkemedlet i den sura miljön i magen. Inaktiva ingredienser inkluderar FD&C Blue No. 2, gelatin, hypromellos, hydroxipropylmetylcellulosaacetatsuccinat, natriumlaurylsulfat, sackaros, sockersfärer, talk, titandioxid och trietylcitrat. Kapslarna på 20 och 60 mg innehåller också gul järnoxid.
INDIKATIONER
CYMBALTA® är indicerat för behandling av:
- Major depression hos vuxna
- Generaliserat ångestsyndrom hos vuxna och pediatriska patienter 7 år och äldre
- Diabetisk perifer neuropatisk smärta hos vuxna
- Fibromyalgi hos vuxna och pediatriska patienter 13 år och äldre
- hronic muskuloskeletal smärta hos vuxna
DOSERING OCH ADMINISTRERING
Viktiga administrationsinstruktioner
Administrera CYMBALTA oralt (med eller utan måltider) och svälj hel. Tugga eller krossa inte och öppna inte kapseln med fördröjd frisättning och strö inte dess innehåll på mat eller blanda med vätska eftersom dessa åtgärder kan påverka den enteriska beläggningen. Om en dos av CYMBALTA 20 mg glöms bort, ta den glömda dosen så snart du kommer ihåg den. Om det nästan är dags för nästa dos, hoppa över den missade dosen och ta nästa dos vid ordinarie tidpunkt. Ta inte två doser av CYMBALTA 60 mg samtidigt.
Dosering för behandling av allvarlig depressiv sjukdom hos vuxna
Den rekommenderade startdosen för vuxna med MDD är 40 mg/dag (given som 20 mg två gånger dagligen) till 60 mg/dag (given antingen en gång dagligen eller som 30 mg två gånger dagligen). För vissa patienter kan det vara önskvärt att börja med 30 mg en gång dagligen i 1 vecka, för att låta patienterna anpassa sig till CYMBALTA 30 mg innan de ökar till 60 mg en gång dagligen. Även om en dos på 120 mg/dag visade sig vara effektiv, finns det inga bevis för att doser över 60 mg/dag ger några ytterligare fördelar. Utvärdera regelbundet för att fastställa behovet av underhållsbehandling och lämplig dos för sådan behandling.
Dosering för behandling av generaliserat ångestsyndrom
Rekommenderad dosering för vuxna yngre än 65 år
För de flesta vuxna yngre än 65 år med GAD, initiera CYMBALTA 60 mg en gång dagligen. För vissa patienter kan det vara önskvärt att börja med 30 mg en gång dagligen under 1 vecka, för att låta patienterna anpassa sig till CYMBALTA 40 mg innan de ökar till 60 mg en gång dagligen. Även om en dos på 120 mg en gång dagligen visade sig vara effektiv, finns det inga bevis för att doser över 60 mg/dag ger ytterligare fördelar. Ändå, om ett beslut fattas att öka dosen över 60 mg en gång dagligen, öka dosen i steg om 30 mg en gång dagligen. Utvärdera regelbundet för att fastställa det fortsatta behovet av underhållsbehandling och lämplig dos för sådan behandling.
Rekommenderad dosering för geriatriska patienter
Hos geriatriska patienter med GAD, påbörja CYMBALTA med en dos på 30 mg en gång dagligen i 2 veckor innan du överväger en ökning till måldosen på 60 mg/dag. Därefter kan patienter dra nytta av doser över 60 mg en gång dagligen. Om ett beslut fattas att öka dosen över 60 mg en gång dagligen, öka dosen i steg om 30 mg en gång dagligen. Den maximala dosen som studerades var 120 mg per dag.
Rekommenderad dosering för pediatriska patienter i åldern 7 till 17 år
Initiera CYMBALTA 30 mg hos pediatriska patienter 7 till 17 år med GAD i en dos på 30 mg en gång dagligen i 2 veckor innan du överväger en ökning till 60 mg en gång dagligen. Det rekommenderade doseringsintervallet är 30 till 60 mg en gång dagligen. Vissa patienter kan ha nytta av doser över 60 mg en gång dagligen. Om ett beslut fattas att öka dosen över 60 mg en gång dagligen, öka dosen i steg om 30 mg en gång dagligen. Den maximala dosen som studerades var 120 mg per dag.
Dosering för behandling av diabetisk perifer neuropatisk smärta hos vuxna
Administrera 60 mg en gång dagligen till vuxna med diabetisk perifer neuropatisk smärta. Det finns inga bevis för att doser högre än 60 mg en gång dagligen ger ytterligare betydande fördelar och den högre dosen tolereras klart mindre väl. För patienter för vilka tolerabilitet är ett problem kan en lägre startdos övervägas.
Eftersom diabetes ofta kompliceras av njursjukdom, överväg en lägre startdos och gradvis ökning av dosen för patienter med nedsatt njurfunktion [se Dosering hos patienter med nedsatt leverfunktion eller gravt nedsatt njurfunktion och Användning i specifika populationer ].
Dosering för behandling av fibromyalgi
Rekommenderad dosering för vuxna
Den rekommenderade dosen CYMBALTA är 60 mg en gång dagligen hos vuxna med fibromyalgi. Börja behandlingen med 30 mg en gång dagligen i 1 vecka, så att patienterna kan anpassa sig till CYMBALTA 20 mg innan de ökar till 60 mg en gång dagligen. Vissa patienter kan svara på startdosen. Det finns inga bevis för att doser över 60 mg/dag ger ytterligare fördelar, även hos patienter som inte svarar på en dos på 60 mg/dag, och högre doser var förknippade med en högre frekvens av biverkningar.
Rekommenderad dosering för pediatriska patienter i åldern 13 till 17 år
Den rekommenderade startdosen CYMBALTA 60 mg till pediatriska patienter 13-17 år med fibromyalgi är 30 mg en gång dagligen. Dosen kan ökas till 60 mg en gång dagligen baserat på respons och tolerabilitet.
Dosering för behandling av kronisk muskuloskeletal smärta hos vuxna
Den rekommenderade dosen CYMBALTA är 60 mg en gång dagligen hos vuxna med kronisk muskuloskeletal smärta. Börja behandlingen med 30 mg en gång dagligen i en vecka för att låta patienterna anpassa sig till CYMBALTA innan de ökar till 60 mg en gång dagligen. Det finns inga bevis för att högre doser ger ytterligare fördelar, även hos patienter som inte svarar på en dos på 60 mg en gång dagligen, och högre doser är förknippade med en högre frekvens av biverkningar [se Kliniska studier ].
Dosering hos patienter med nedsatt leverfunktion eller gravt nedsatt njurfunktion
Undvik användning till patienter med kronisk leversjukdom eller cirros [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Undvik användning till patienter med gravt nedsatt njurfunktion, GFR VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Avbryter CYMBALTA
Biverkningar efter utsättning av CYMBALTA, efter abrupt eller avsmalnande avbrott, inkluderar: yrsel, huvudvärk, illamående, diarré, parestesi, irritabilitet, kräkningar, sömnlöshet, ångest, hyperhidros och trötthet. En gradvis minskning av dosen snarare än abrupt utsättning rekommenderas när så är möjligt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Byta en patient till eller från en monoaminoxidashämmare (MAO-hämmare) avsedd att behandla psykiatriska sjukdomar
Minst 14 dagar bör förflyta mellan utsättande av en MAO-hämmare avsedd för behandling av psykiatriska störningar och påbörjande av behandling med CYMBALTA. Omvänt bör minst 5 dagar tillåtas efter avslutad CYMBALTA 60 mg innan man påbörjar en MAO-hämmare avsedd att behandla psykiatriska störningar [se KONTRAINDIKATIONER ].
Användning av CYMBALTA med andra MAO-hämmare såsom linezolid eller metylenblått
Starta inte CYMBALTA hos en patient som behandlas med linezolid eller intravenöst metylenblått eftersom det finns en ökad risk för serotonergt syndrom. Hos en patient som behöver mer akut behandling av ett psykiatriskt tillstånd bör andra insatser, inklusive sjukhusvistelse, övervägas [se KONTRAINDIKATIONER ].
vissa fall kan en patient som redan får CYMBALTA-behandling behöva akut behandling med linezolid eller intravenöst metylenblått. Om acceptabla alternativ till linezolid eller intravenös behandling med metylenblått inte är tillgängliga och de potentiella fördelarna med behandling med linezolid eller intravenös metylenblått bedöms uppväga riskerna för serotonergt syndrom hos en viss patient, ska CYMBALTA stoppas omedelbart och linezolid eller intravenöst metylenblått kan administreras. Patienten ska övervakas med avseende på symtom på serotonergt syndrom i 5 dagar eller fram till 24 timmar efter den sista dosen av linezolid eller intravenöst metylenblått, beroende på vilket som inträffar först. Behandling med CYMBALTA kan återupptas 24 timmar efter den sista dosen av linezolid eller intravenös metylenblått [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Risken för att administrera metylenblått på icke-intravenös väg (såsom orala tabletter eller genom lokal injektion) eller i intravenösa doser mycket lägre än 1 mg/kg med CYMBALTA är oklar. Läkaren bör dock vara medveten om möjligheten av uppkommande symtom på serotonergt syndrom vid sådan användning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
HUR LEVERERAS
Doseringsformer och styrkor
CYMBALTA finns som kapslar med fördröjd frisättning:
- 20 mg ogenomskinliga gröna kapslar märkta med "Lilly 3235 20mg"
- 30 mg ogenomskinliga vita och blå kapslar märkta med "Lilly 3240 30mg"
- 60 mg ogenomskinliga gröna och blå kapslar märkta med "Lilly 3270 60mg"
CYMBALTA (duloxetin kapslar med fördröjd frisättning) finns i följande styrkor, färger, avtryck och presentationer:
Förvaring Och Hantering
Förvara vid 25°C (77°F); utflykter tillåtna till 15-30°C (59-86°F) [se USP-kontrollerad rumstemperatur].
Marknadsförs av: Lilly USA, LLC Indianapolis, IN 46285, USA. Reviderad: juli 2021
BIEFFEKTER
Följande allvarliga biverkningar beskrivs nedan och på andra ställen i märkningen:
- Suicidala tankar och beteenden hos barn, ungdomar och unga vuxna [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ortostatisk hypotoni, fall och synkope [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Serotoninsyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ökad risk för blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarliga hudreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Utsättningssyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Aktivering av mani/hypomani [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Stängningsvinkelglaukom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ökning av blodtrycket [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kliniskt viktiga läkemedelsinteraktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hyponatremi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Tveksamhet och retention i urinen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Sexuell dysfunktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
De angivna biverkningsfrekvenserna representerar andelen patienter som åtminstone en gång upplevde en behandlingsuppkommen biverkning av den listade typen. En reaktion ansågs vara framkallande av behandling om den inträffade för första gången eller förvärrades under behandling efter baslinjeutvärdering.
Biverkningar hos vuxna
Databas för kliniska prövningar för vuxna
Data som beskrivs nedan återspeglar exponering för CYMBALTA i placebokontrollerade vuxenstudier för MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), och FM (N=1294). Åldersintervallet i denna poolade population var 17 till 89 år. I denna poolade population var 66 %, 61 %, 61 %, 43 % och 94 % av vuxna patienter kvinnor; och 82 %, 73 %, 85 %, 74 % och 86 % av vuxna patienter var kaukasiska i MDD-, GAD-, OA- och CLBP-, DPNP- respektive FM-populationerna. De flesta patienter fick CYMBALTA-doser på totalt 60 till 120 mg per dag [se Kliniska studier ]. Data nedan inkluderar inte resultaten från studien som utvärderade effekten av CYMBALTA 30 mg för behandling av GAD hos patienter ≥65 år gamla (studie GAD-5) [se Kliniska studier ]; De biverkningar som observerades i denna geriatriska population liknade dock i allmänhet biverkningar i den totala vuxna populationen.
Biverkningar som leder till att behandlingen avbryts i placebokontrollerade prövningar för vuxna
Major depressiv sjukdom
Cirka 8,4 % (319/3779) av CYMBALTA-behandlade patienter i placebokontrollerade vuxenstudier för MDD avbröt behandlingen på grund av en biverkning, jämfört med 4,6 % (117/2536) av placebobehandlade patienter. Illamående (CYMBALTA 1,1 %, placebo 0,4 %) var den enda biverkning som rapporterades som orsak till utsättning och ansågs vara läkemedelsrelaterad (dvs utsättning inträffade hos minst 1 % av de CYMBALTA-behandlade patienterna och med en frekvens av kl. minst dubbelt så mycket som för placebobehandlade patienter).
Generaliserat ångestsyndrom
Ungefär 13,7 % (139/1018) av de CYMBALTA-behandlade patienterna i placebokontrollerade vuxenstudier för GAD avbröt behandlingen på grund av en biverkning, jämfört med 5 % (38/767) för placebobehandlade patienter. Vanliga biverkningar som rapporterats som orsak till utsättning och ansetts vara läkemedelsrelaterade (enligt definitionen ovan) inkluderar illamående (CYMBALTA 3,3 %, placebo 0,4 %) och yrsel (CYMBALTA 1,3 %, placebo 0,4 %).
Diabetisk perifer neuropatisk smärta
Ungefär 12,9 % (117/906) av de CYMBALTA-behandlade patienterna i placebokontrollerade vuxenstudier för DPNP avbröt behandlingen på grund av en biverkning, jämfört med 5,1 % (23/448) för placebobehandlade patienter. Vanliga biverkningar som rapporterats som orsak till utsättning och ansetts vara läkemedelsrelaterade (enligt definitionen ovan) inkluderar illamående (CYMBALTA 3,5 %, placebo 0,7 %), yrsel (CYMBALTA 1,2 %, placebo 0,4 %) och somnolens (CYMBALTA 1,1 % , placebo 0 %).
Fibromyalgi
Ungefär 17,5 % (227/1294) av de CYMBALTA-behandlade patienterna i 3- till 6-månaders placebokontrollerade vuxenstudier för FM avbröt behandlingen på grund av en biverkning, jämfört med 10,1 % (96/955) för placebobehandlade patienter . Biverkningar som rapporterats som orsak till utsättning och ansetts vara läkemedelsrelaterade (enligt definitionen ovan) inkluderar illamående (CYMBALTA 2,0 %, placebo 0,5 %), huvudvärk (CYMBALTA 1,2 %, placebo 0,3 %), somnolens (CYMBALTA 1,1 %, placebo 0 %) och trötthet (CYMBALTA 1,1 %, placebo 0,1 %).
Kronisk smärta på grund av artros
Ungefär 15,7 % (79/503) av de CYMBALTA-behandlade patienterna i 13-veckors placebokontrollerade vuxenstudier för kronisk smärta på grund av artrose avbröt behandlingen på grund av en biverkning, jämfört med 7,3 % (37/508) för placebo- behandlade patienter. Biverkningar som rapporterats som orsak till avbrott och ansetts vara läkemedelsrelaterade (enligt definitionen ovan) inkluderade illamående (CYMBALTA 2,2 %, placebo 1 %).
Kronisk ländryggssmärta
Ungefär 16,5 % (99/600) av de CYMBALTA-behandlade patienterna i 13-veckors placebokontrollerade vuxenstudier för CLBP avbröt behandlingen på grund av en biverkning, jämfört med 6,3 % (28/441) för placebobehandlade patienter. Biverkningar som rapporterats som orsak till avbrott och ansetts vara läkemedelsrelaterade (enligt definitionen ovan) inkluderar illamående (CYMBALTA 3 %, placebo 0,7 %) och somnolens (CYMBALTA 1 %, placebo 0 %).
De vanligaste biverkningarna i vuxenförsök
De vanligaste observerade biverkningarna hos CYMBALTA-behandlade patienter (enligt definitionen ovan) var:
- Diabetes perifer neuropatisk smärta: illamående, somnolens, minskad aptit, förstoppning, hyperhidros och muntorrhet.
- Fibromyalgi: illamående, muntorrhet, förstoppning, somnolens, minskad aptit, hyperhidros och agitation.
- Kronisk smärta på grund av artros: illamående, trötthet, förstoppning, muntorrhet, sömnlöshet, somnolens och yrsel.
- Kronisk ländryggssmärta: illamående, muntorrhet, sömnlöshet, somnolens, förstoppning, yrsel och trötthet.
De vanligaste observerade biverkningarna hos CYMBALTA-behandlade patienter i alla poolade vuxna populationer (dvs. MDD, GAD, DPNP, FM, OA och CLBP) (incidens på minst 5 % och minst dubbelt så stor incidensen hos placebobehandlade patienter) var illamående, muntorrhet, somnolens, förstoppning, minskad aptit och hyperhidros.
Tabell 2 visar förekomsten av biverkningar i placebokontrollerade prövningar för godkända vuxna populationer (dvs. MDD, GAD, DPNP, FM, OA och CLBP) som inträffade hos 5 % eller fler av CYMBALTA-behandlade patienter och med en högre incidens än placebobehandlade patienter.
Biverkningar i poolade MDD- och GAD-försök hos vuxna
Tabell 3 visar förekomsten av biverkningar i MDD och GAD placebokontrollerade vuxenstudier som inträffade hos 2 % eller fler av CYMBALTA-behandlade patienter och med en incidens som var högre än placebobehandlade patienter.
Biverkningar i DPNP, FM, OA och CLBP vuxenförsök
Tabell 4 visar förekomsten av biverkningar som inträffade hos 2 % eller fler av CYMBALTA-behandlade patienter (bestämt före avrundning) i den akuta fasen före marknadsföring av DPNP, FM, OA och CLBP placebokontrollerade vuxenstudier och med en högre incidens än placebobehandlade patienter.
Effekter på manlig och kvinnlig sexuell funktion hos vuxna med MDD
Förändringar i sexuell lust, sexuell prestation och sexuell tillfredsställelse förekommer ofta som manifestationer av psykiatriska störningar eller diabetes, men de kan också vara en konsekvens av farmakologisk behandling. Eftersom negativa sexuella reaktioner antas vara frivilligt underrapporterade, användes Arizona Sexual Experience Scale (ASEX), ett validerat mått utformat för att identifiera sexuella biverkningar, prospektivt i 4 MDD placebokontrollerade vuxenstudier (studier MDD-1, MDD-2 , MDD-3 och MDD-4) [se Kliniska studier ]. ASEX-skalan inkluderar fem frågor som hänför sig till följande aspekter av sexuell funktion: 1) sexlust, 2) lätthet i upphetsning, 3) förmåga att uppnå erektion (män) eller smörjning (kvinnor), 4) lätt att nå orgasm, och 5) orgasm tillfredsställelse. Positiva siffror betyder en försämring av sexuell funktion från baslinjen. Negativa siffror betecknar en förbättring från en baslinjenivå av dysfunktion, vilket vanligtvis ses hos deprimerade patienter.
dessa prövningar upplevde CYMBALTA-behandlade manliga patienter signifikant mer sexuell dysfunktion, mätt som den totala poängen på ASEX och förmågan att nå orgasm, än placebobehandlade manliga patienter (se ). CYMBALTA-behandlade kvinnliga patienter upplevde inte mer sexuell dysfunktion än placebobehandlade kvinnliga patienter mätt med ASEX totalpoäng. Vårdgivare bör rutinmässigt fråga om möjliga sexuella biverkningar hos CYMBALTA-behandlade patienter.
Vital tecken förändringar hos vuxna
I placebokontrollerade kliniska prövningar över godkända vuxna populationer för förändring från baslinje till effektmått, hade CYMBALTA-behandlade patienter genomsnittliga ökningar på 0,23 mm Hg i systoliskt blodtryck (SBP) och 0,73 mm Hg i diastoliskt blodtryck (DBP) jämfört med genomsnittliga sänkningar av 1,09 mm Hg i SBP och 0,55 mm Hg i DBP hos placebobehandlade patienter. Det fanns ingen signifikant skillnad i frekvensen av ihållande (3 på varandra följande besök) förhöjt blodtryck [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Behandling med CYMBALTA 20 mg, i upp till 26 veckor i placebokontrollerade studier i godkända vuxna populationer, orsakade vanligtvis en liten ökning av hjärtfrekvensen för förändring från baslinje till effektmått jämfört med placebo med upp till 1,37 slag per minut (ökning med 1,20 slag per minut) hos CYMBALTA-behandlade patienter, minskning med 0,17 slag per minut hos placebobehandlade patienter).
Laboratorieförändringar hos vuxna
CYMBALTA-behandling i placebokontrollerade kliniska prövningar i godkända vuxna populationer var associerad med små genomsnittliga ökningar från baslinje till effektmått i ALAT, ASAT, CPK och alkaliskt fosfatas; sällsynta, måttliga, övergående, onormala värden observerades för dessa analyter hos CYMBALTA-behandlade patienter jämfört med placebobehandlade patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Högt bikarbonat, kolesterol och onormalt (högt eller lågt) kalium observerades oftare hos CYMBALTA-behandlade patienter jämfört med placebobehandlade patienter.
Andra biverkningar som observerats under den kliniska utvärderingen av CYMBALTA hos vuxna
Följande är en lista över biverkningar som rapporterats av patienter som behandlats med CYMBALTA 40 mg i kliniska prövningar för vuxna. I kliniska prövningar av alla godkända vuxna populationer behandlades 34 756 patienter med CYMBALTA. Av dessa tog 27 % (9337) CYMBALTA 60 mg i minst 6 månader och 12 % (4317) tog CYMBALTA i minst ett år. Följande lista är inte avsedd att inkludera reaktioner (1) som redan har listats i tidigare tabeller eller någon annanstans i märkningen, (2) för vilka en drogorsak var avlägsen, (3) som var så generella att de inte var informativa, (4) som var inte anses ha signifikanta kliniska implikationer, eller (5) som inträffade i en takt lika med eller mindre än placebo.
Reaktioner kategoriseras efter kroppssystem enligt följande definitioner: frekventa biverkningar är de som inträffar hos minst 1/100 patienter; sällsynta biverkningar är de som inträffar hos 1/100 till 1/1000 patienter; sällsynta reaktioner är de som inträffar hos färre än 1/1000 patienter.
- Hjärtsjukdomar - Frekvent: hjärtklappning; Sällsynt: hjärtinfarkt, takykardi och Takotsubo kardiomyopati.
- Öron- och labyrintsjukdomar - Frekvent: svindel; Sällsynt: öronvärk och tinnitus.
- Endokrina störningar - Sällsynt: hypotyreos.
- Ögonstörningar - Frekvent: syn suddig; Sällsynt: dubbelsidighet, torra ögon och synnedsättning.
- Gastrointestinala störningar - Frekvent: flatulens; Sällsynt: dysfagi, utslag, gastrit, gastrointestinala blödningar, halitos och stomatit; Sällsynt: magsår.
- Allmänna störningar och villkor för administrationsplatsen - Frekvent: frossa/påfrestningar; Sällsynt: fall, onormal känsla, varm och/eller kall känsla, sjukdomskänsla och törst; Sällsynt: gångstörning.
- Infektioner och angrepp - Sällsynt: gastroenterit och laryngit.
- Utredningar Frekvent: vikt ökad, vikt minskad; Sällsynt: ökat kolesterol i blodet.
- Metabolism och näringsstörningar - Sällsynt: uttorkning och hyperlipidemi; Sällsynt: dyslipidemi.
- Muskuloskeletala och bindvävssjukdomar - Frekvent: muskuloskeletal smärta; Sällsynt: muskeltäthet och muskelryckningar.
- Störningar i nervsystemet - Frekvent: dysgeusi, letargi och parestesi/hypoestesi; Sällsynt: uppmärksamhetsstörning, dyskinesi, myoklonus och dålig sömnkvalitet; Sällsynt: dysartri.
- Psykiatriska störningar - Frekventa: onormala drömmar och sömnstörningar; Sällsynt: apati, bruxism, desorientering/förvirring, irritabilitet, humörsvängningar och självmordsförsök; Sällsynt: fullbordat självmord.
- Njur- och urinvägsstörningar - Frekvent: urinfrekvens; Sällsynt: dysuri, brådskande miktion, natturi, polyuri och onormal urinlukt.
- Reproduktionssystemet och bröststörningar - Frekvent: anorgasmi/orgasm onormal; Sällsynta: klimakteriebesvär, sexuell dysfunktion och testikulär smärta; Sällsynt: menstruationsstörning.
- Andningsvägar, bröstkorg och mediastinum Frekvent: gäspningar, orofaryngeal smärta; Sällsynt: trånghet i halsen.
- Hud och subkutan vävnad - Frekvent: klåda; Sällsynt: kallsvett, kontakt med dermatit, erytem, ökad tendens till blåmärken, nattliga svettningar och ljuskänslighetsreaktion; Sällsynt: ekkymos.
- Vaskulära sjukdomar - Frekvent: värmevallningar; Sällsynt: rodnad, ortostatisk hypotoni och perifer kyla.
Biverkningar observerade i placebokontrollerade kliniska prövningar på pediatriska patienter
Databas för pediatrisk klinisk prövning
Data som beskrivs nedan återspeglar exponering för CYMBALTA (N=567) hos pediatriska patienter i åldern 7 till 18 år från två 10-veckors placebokontrollerade studier på patienter med MDD (N=341) (Studier MDD-6 och MDD- 7), en 10-veckors placebokontrollerad studie i GAD (N=135) (Studie GAD-6), och en 13-veckors studie i fibromyalgi (N=91). CYMBALTA 60 mg är inte godkänt för behandling av MDD hos pediatriska patienter [se Användning i specifika populationer ]. Av de CYMBALTA-behandlade patienterna i dessa studier var 36 % 7 till 11 år gamla (64 % var mellan 12 och 18 år gamla), 55 % var kvinnor och 69 % var kaukasiska. Patienterna fick 30 till 120 mg CYMBALTA per dag under placebokontrollerade akuta behandlingsstudier. I de pediatriska MDD-, GAD- och fibromyalgistudierna upp till 40 veckor långa fanns det 988 CYMBALTA-behandlade pediatriska patienter i åldern 7 till 17 år (de flesta patienter fick 30-120 mg per dag) – 35 % var 7 till 11 år ålder (65 % var 12 till 17 år gamla) och 56 % var kvinnor.
De vanligaste biverkningarna i pediatriska prövningar
De vanligaste biverkningarna (≥5 % hos CYMBALTA-behandlade patienter och minst dubbelt så stor incidens som placebobehandlade patienter) i alla poolade pediatriska populationer (MDD, GAD och fibromyalgi) var minskad vikt, minskad aptit, illamående, kräkningar, trötthet och diarré.
Biverkningar hos pediatriska patienter i åldern 7 till 17 år med MDD och GAD
Biverkningsprofilen som observerades i kliniska prövningar på pediatriska patienter i åldern 7 till 18 år med MDD och GAD överensstämde med biverkningsprofilen som observerades i kliniska prövningar för vuxna. De vanligaste (≥5 % och två gånger placebo) biverkningar som observerats i dessa pediatriska kliniska prövningar inkluderade: illamående, diarré, viktminskning och yrsel.
Tabell 6 visar förekomsten av biverkningar i MDD och GAD pediatriska placebokontrollerade studier som inträffade hos mer än 2 % av patienterna som behandlades med CYMBALTA och med en incidens som var högre än hos patienterna behandlade med placebo. CYMBALTA är inte godkänt för behandling av MDD hos pediatriska patienter [se Användning i specifika populationer ].
Andra biverkningar som inträffade med en incidens på mindre än 2 % och rapporterades av fler CYMBALTA-behandlade patienter än placebobehandlade patienter i pediatriska MDD och GAD kliniska prövningar inkluderade: onormala drömmar (inklusive mardröm), ångest, rodnad (inklusive värmevallningar) ), hyperhidros, hjärtklappning, ökad puls och tremor (CYMBALTA 20mg är inte godkänt för behandling av pediatriska patienter med MDD).
De vanligaste rapporterade symtomen efter utsättande av CYMBALTA 30 mg i kliniska prövningar av pediatriska MDD och GAD inkluderade huvudvärk, yrsel, sömnlöshet och buksmärtor [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Tillväxt (längd och vikt) hos pediatriska patienter 7 till 17 år gamla med GAD och MDD
Minskad aptit och viktminskning har observerats i samband med användning av SSRI och SNRI. CYMBALTA-behandlade pediatriska patienter i kliniska prövningar upplevde en genomsnittlig viktminskning på 0,1 kg efter 10 veckor, jämfört med en genomsnittlig viktökning på cirka 0,9 kg hos placebobehandlade pediatriska patienter. Andelen patienter som upplevde en kliniskt signifikant viktminskning (≥3,5 %) var större i CYMBALTA-gruppen än i placebogruppen (16 % respektive 6 %). Därefter, under de 4 till 6 månader långa okontrollerade förlängningsperioderna, trendade CYMBALTA-behandlade patienter i genomsnitt mot återhämtning till sin förväntade viktpercentil vid utgångsläget baserat på populationsdata från jämnåriga med ålders- och könsmatchning.
studier upp till 9 månader upplevde CYMBALTA-behandlade pediatriska patienter en ökning i längd på 1,7 cm i genomsnitt (2,2 cm ökning hos patienter 7 till 11 år och 1,3 cm ökning hos patienter 12 till 17 år). Även om höjdökning observerades under dessa studier, observerades en genomsnittlig minskning av längdpercentilen med 1 % (minskning med 2 % hos patienter i åldern 7 till 11 år och ökning med 0,3 % hos patienter i åldern 12 till 17 år). Vikt och längd bör övervakas regelbundet hos pediatriska patienter som behandlas med CYMBALTA [se Användning i specifika populationer ].
Biverkningar hos pediatriska patienter i åldern 13 till 17 år gamla med fibromyalgi
Tabell 7 visar förekomsten av biverkningar i en fibromyalgi pediatrisk placebokontrollerad studie (studie FM-4) som inträffade hos mer än 5 % av patienterna som behandlades med CYMBALTA 30 mg och med en incidens som var högre än hos patienter som behandlades med placebo [se Kliniska studier ].
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av CYMBALTA efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Biverkningar som rapporterats sedan marknadsintroduktionen och som var tidsmässigt relaterade till CYMBALTA 40 mg-behandling och som inte nämns någon annanstans i märkningen inkluderar: akut pankreatit, anafylaktisk reaktion, aggression och ilska (särskilt tidigt i behandlingen eller efter avslutad behandling), angioneurotiskt ödem, glaukom med stängningsvinkel, kolit (mikroskopisk eller ospecificerad), kutan vaskulit (ibland förknippad med systemisk inblandning), extrapyramidal störning, galaktorré, gynekologisk blödning, hallucinationer, hyperglykemi, hyperprolaktinemi, överkänslighet, hypertensiv kris, muskelspasmer, hudutslag, restless legs syndrome, diskontinuerliga benssyndrom vid behandling, supraventrikulär arytmi, tinnitus (vid behandlingsavbrott), trismus och urtikaria.
LÄKEMEDELSINTERAKTIONER
Både CYP1A2 och CYP2D6 är ansvariga för duloxetinmetabolismen.
CYP1A2-hämmare
När CYMBALTA 60 mg administrerades samtidigt med fluvoxamin 100 mg, en potent CYP1A2-hämmare, till manliga försökspersoner (n=14) ökade AUC för duloxetin cirka 6 gånger, Cmax ökade cirka 2,5 gånger och duloxetin t1/2 var ökade cirka 3 gånger. Andra läkemedel som hämmar CYP1A2-metabolismen inkluderar cimetidin och kinolonantimikrobiella medel som ciprofloxacin och enoxacin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
CYP2D6-hämmare
Samtidig användning av CYMBALTA (40 mg en gång dagligen) och paroxetin (20 mg en gång dagligen) ökade koncentrationen av duloxetin AUC med cirka 60 %, och högre grader av hämning förväntas med högre doser av paroxetin. Liknande effekter kan förväntas med andra potenta CYP2D6-hämmare (t.ex. fluoxetin, kinidin) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Dubbel hämning av CYP1A2 och CYP2D6
Samtidig administrering av CYMBALTA 40 mg två gånger dagligen med fluvoxamin 100 mg, en potent CYP1A2-hämmare, till försökspersoner med låg CYP2D6-metabolism (n=14) resulterade i en sexfaldig ökning av duloxetin AUC och Cmax.
Läkemedel som stör hemostas (t.ex. NSAID, aspirin och warfarin)
Serotoninfrisättning av blodplättar spelar en viktig roll vid hemostas. Epidemiologiska studier av fall-kontroll och kohortdesign som har visat ett samband mellan användning av psykotropa läkemedel som stör serotoninåterupptaget och förekomsten av övre gastrointestinala blödningar har också visat att samtidig användning av ett NSAID eller acetylsalicylsyra kan förstärka denna risk för blödning. Förändrade antikoagulantiaeffekter, inklusive ökad blödning, har rapporterats när SSRI eller SNRI administreras samtidigt med warfarin. Samtidig administrering av warfarin (2-9 mg en gång dagligen) under steady state-förhållanden med CYMBALTA 60 eller 120 mg en gång dagligen i upp till 14 dagar hos friska försökspersoner (n=15) förändrade inte signifikant INR från baslinjen (genomsnittliga INR-förändringar varierade från 0,05 till +0,07). Den totala farmakokinetiken för warfarin (proteinbundet plus fritt läkemedel) (AUCτ,ss, Cmax,ss eller tmax,ss) för både R- och S-warfarin förändrades inte av duloxetin. På grund av den potentiella effekten av duloxetin på trombocyter, bör patienter som får warfarinbehandling övervakas noggrant när CYMBALTA påbörjas eller avbryts [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Lorazepam
Under steady-state-förhållanden för CYMBALTA (60 mg Q 12 timmar) och lorazepam (2 mg Q 12 timmar), påverkades inte duloxetins farmakokinetik av samtidig administrering.
Temazepam
Under steady-state-förhållanden för CYMBALTA (20 mg qhs) och temazepam (30 mg qhs), påverkades inte duloxetins farmakokinetik av samtidig administrering.
Läkemedel som påverkar magsyra
CYMBALTA har en magsaftresistent beläggning som motstår upplösning tills den når ett segment av mag-tarmkanalen där pH överstiger 5,5. Under extremt sura förhållanden kan CYMBALTA 20 mg, oskyddad av den magsaftresistenta beläggningen, genomgå hydrolys för att bilda naftol. Försiktighet rekommenderas vid användning av CYMBALTA 30 mg till patienter med tillstånd som kan bromsa magtömningen (t.ex. vissa diabetiker). Läkemedel som höjer det gastrointestinala pH-värdet kan leda till en tidigare frisättning av duloxetin. Samtidig administrering av CYMBALTA 60 mg med antacida innehållande aluminium och magnesium (51 mEq) eller CYMBALTA med famotidin hade dock ingen signifikant effekt på hastigheten eller omfattningen av duloxetinabsorptionen efter administrering av en 40 mg oral
Läkemedel som metaboliseras av CYP1A2
In vitro läkemedelsinteraktionsstudier visar att duloxetin inte inducerar CYP1A2-aktivitet. Därför förväntas inte en ökning av metabolismen av CYP1A2-substrat (t.ex. teofyllin, koffein) till följd av induktion, även om kliniska studier av induktion inte har utförts. Duloxetin är en hämmare av isoformen CYP1A2 i in vitro-studier, och i två kliniska studier var den genomsnittliga (90 % konfidensintervall) ökningen av AUC för teofyllin 7 % (1 %-15 %) och 20 % (13 %-27 %) vid samtidig administrering med CYMBALTA (60 mg två gånger dagligen).
Läkemedel som metaboliseras av CYP2D6
Duloxetin är en måttlig hämmare av CYP2D6. När CYMBALTA administrerades (i en dos på 60 mg två gånger dagligen) i kombination med en engångsdos på 50 mg desipramin, ett CYP2D6-substrat, ökade AUC för desipramin tre gånger [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Läkemedel som metaboliseras av CYP2C9
Resultat av in vitro-studier visar att duloxetin inte hämmar aktiviteten. I en klinisk studie påverkades inte farmakokinetiken för S-warfarin, ett CYP2C9-substrat, signifikant av duloxetin [se Läkemedel som stör hemostas (t.ex. NSAID, aspirin och warfarin) ].
Läkemedel som metaboliseras av CYP3A
Resultat av in vitro-studier visar att duloxetin inte hämmar eller inducerar CYP3A-aktivitet. Därför förväntas inte en ökning eller minskning av metabolismen av CYP3A-substrat (t.ex. orala preventivmedel och andra steroida medel) till följd av induktion eller hämning, även om kliniska studier inte har utförts.
Läkemedel som metaboliseras av CYP2C19
Resultat av in vitro-studier visar att duloxetin inte hämmar CYP2C19-aktivitet vid terapeutiska koncentrationer. Hämning av metabolismen av CYP2C19-substrat förväntas därför inte, även om kliniska studier inte har utförts.
Monoaminoxidashämmare (MAO-hämmare)
[Ser DOSERING OCH ADMINISTRERING , KONTRAINDIKATIONER , och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Serotonerga läkemedel
[Ser DOSERING OCH ADMINISTRERING , KONTRAINDIKATIONER , och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Alkohol
När CYMBALTA 40 mg och etanol administrerades med flera timmars mellanrum så att maximala koncentrationer av var och en skulle sammanfalla, ökade CYMBALTA inte försämringen av mentala och motoriska färdigheter orsakade av alkohol.
I CYMBALTA-databasen för kliniska prövningar hade tre CYMBALTA-behandlade patienter leverskada som manifesterades av ALAT och totala bilirubinhöjningar, med tecken på obstruktion. Betydande interkurrent etanolanvändning förekom i vart och ett av dessa fall, och detta kan ha bidragit till de avvikelser som setts [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
CNS-läkemedel
[Ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Läkemedel starkt bundna till plasmaprotein
Eftersom duloxetin är starkt bundet till plasmaprotein, kan administrering av CYMBALTA 30 mg till en patient som tar ett annat läkemedel som är starkt proteinbundet orsaka ökade fria koncentrationer av det andra läkemedlet, vilket potentiellt kan resultera i biverkningar. Samtidig administrering av CYMBALTA (60 eller 120 mg) med warfarin (2-9 mg), ett starkt proteinbundet läkemedel, resulterade dock inte i signifikanta förändringar i INR och i farmakokinetiken för varken total S- eller total R- warfarin (proteinbundet plus fritt läkemedel) [se Läkemedel som stör hemostas (t.ex. NSAID, aspirin och warfarin) ].
Narkotikamissbruk och beroende
Missbruk
I djurstudier visade duloxetin ingen barbituratliknande (depressiv) missbrukspotential.
Även om CYMBALTA inte systematiskt har studerats på människor med avseende på dess potential för missbruk, fanns det inga tecken på drogsökande beteende i de kliniska prövningarna. Det är dock inte möjligt att förutsäga på basis av erfarenheter från förmarknadsföring i vilken utsträckning ett CNS-aktivt läkemedel kommer att missbrukas, avledas och/eller missbrukas när det väl marknadsförts. Följaktligen bör läkare noggrant utvärdera patienter med avseende på en historia av drogmissbruk och följa sådana patienter noggrant, observera dem för tecken på felaktig användning eller missbruk av CYMBALTA (t.ex. utveckling av tolerans, ökning av dosen, läkemedelssökande beteende).
Beroende
I läkemedelsberoendestudier visade inte duloxetin någon beroendeproducerande potential hos råttor.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Självmordstankar och -beteenden hos barn, ungdomar och unga vuxna
Patienter med egentlig depression (MDD), både vuxna och barn, kan uppleva förvärring av sin depression och/eller uppkomsten av självmordstankar och självmordsbeteende (suicidalitet) eller ovanliga beteendeförändringar, oavsett om de tar antidepressiva mediciner eller inte, och detta risken kan kvarstå tills betydande remission inträffar. Självmord är en känd risk för depression och vissa andra psykiatriska störningar, och dessa störningar i sig är de starkaste prediktorerna för självmord. Det har dock funnits en långvarig oro för att antidepressiva medel kan ha en roll i att framkalla förvärring av depression och uppkomsten av suicidalitet hos vissa patienter under de tidiga faserna av behandlingen.
Sammanslagna analyser av kortvariga placebokontrollerade studier av antidepressiva läkemedel (SSRI och andra) visade att dessa läkemedel ökar risken för självmordstankar och suicidalitet (suicidalitet) hos barn, ungdomar och unga vuxna (ålder 1824) med egentlig depression ( MDD) och andra psykiatriska störningar. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det var en minskning med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre.
De sammanslagna analyserna av placebokontrollerade studier på barn och ungdomar med MDD, tvångssyndrom (OCD) eller andra psykiatriska störningar inkluderade totalt 24 korttidsstudier av 9 antidepressiva läkemedel på över 4400 patienter. De sammanslagna analyserna av placebokontrollerade studier på vuxna med MDD eller andra psykiatriska störningar inkluderade totalt 295 korttidsstudier (medianlängd på 2 månader) av 11 antidepressiva läkemedel på över 77 000 patienter. Det fanns avsevärd variation i risk för suicidalitet bland droger, men en tendens till en ökning av de yngre patienterna för nästan alla studerade droger. Det fanns skillnader i absolut risk för suicidalitet mellan de olika indikationerna, med den högsta förekomsten av MDD. Risken för skillnader (läkemedel vs placebo) var dock relativt stabil inom åldersskikt och över indikationer. Dessa riskskillnader (skillnad mellan läkemedel och placebo i antalet fall av suicidalitet per 1 000 behandlade patienter) anges i tabell 1.
Inga självmord inträffade i någon av de pediatriska CYMBALTA-studierna. Det förekom självmord i CYMBALTA 20 mg-studierna för vuxna, men antalet var inte tillräckligt för att dra någon slutsats om CYMBALTAs effekt på självmord.
Det är okänt om suicidalitetsrisken sträcker sig till långvarig användning, dvs. längre än flera månader. Det finns dock betydande bevis från placebokontrollerade underhållsstudier på vuxna med depression att användning av antidepressiva medel kan fördröja återkommande depression.
Alla patienter som behandlas med antidepressiva medel för någon indikation bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet och ovanliga beteendeförändringar, särskilt under de första månaderna av en läkemedelsbehandlingskur, eller vid tidpunkter med dosförändringar, antingen ökningar eller minskar.
Följande symtom, ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani och mani, har rapporterats hos vuxna och pediatriska patienter som behandlas med antidepressiva medel även för egentlig depression vad gäller andra indikationer, både psykiatriska och icke-psykiatriska. Även om ett orsakssamband mellan uppkomsten av sådana symtom och antingen försämringen av depression och/eller uppkomsten av självmordsimpulser inte har fastställts, finns det oro för att sådana symtom kan representera föregångare till framväxande suicidalitet.
Man bör överväga att ändra den terapeutiska kuren, inklusive eventuellt avbrytande av medicineringen, hos patienter vars depression är ihållande värre, eller som upplever framväxande suicidalitet eller symtom som kan vara prekursorer till förvärrad depression eller suicidalitet, särskilt om dessa symtom är allvarliga, plötsliga. i början, eller var inte en del av patientens uppvisande symtom.
Om beslutet har fattats att avbryta behandlingen, bör medicineringen minskas, så snabbt som möjligt, men med erkännande av att utsättningen kan vara förknippad med vissa symtom [se DOSERING OCH ADMINISTRERING och Utsättningssyndrom ] för beskrivningar av riskerna för utsättande av CYMBALTA.
Familjer och vårdgivare till patienter som behandlas med antidepressiva medel för allvarlig depressiv sjukdom eller andra indikationer, både psykiatriska och icke-psykiatriska, bör uppmärksammas om behovet av att övervaka patienter för uppkomsten av agitation, irritabilitet, ovanliga beteendeförändringar och de andra symtomen som beskrivs ovan. , såväl som uppkomsten av suicidalitet, och att rapportera sådana symtom omedelbart till vårdgivare. Sådan övervakning bör innefatta daglig observation av familjer och vårdgivare. Recept för CYMBALTA bör skrivas ut för den minsta mängden kapslar som överensstämmer med god patienthantering, för att minska risken för överdosering.
Screening av patienter för bipolär sjukdom
En allvarlig depressiv episod kan vara den första presentationen av bipolär sjukdom. Det anses allmänt (även om det inte har fastställts i kontrollerade studier) att behandling av en sådan episod med enbart ett antidepressivt läkemedel kan öka sannolikheten för utfällning av en blandad/manisk episod hos patienter med risk för bipolär sjukdom. Huruvida något av de ovan beskrivna symptomen representerar en sådan omvandling är okänt. Innan behandling med ett antidepressivt läkemedel påbörjas bör dock patienter med depressiva symtom screenas på lämpligt sätt för att fastställa om de löper risk för bipolär sjukdom; sådan screening bör inkludera en detaljerad psykiatrisk historia, inklusive en familjehistoria av självmord, bipolär sjukdom och depression. Det bör noteras att CYMBALTA inte är godkänt för behandling av bipolär depression.
Hepatotoxicitet
Det har rapporterats om leversvikt, ibland dödlig, hos patienter som behandlats med CYMBALTA. Dessa fall har visat sig som hepatit med buksmärtor, hepatomegali och förhöjda transaminasnivåer till mer än tjugo gånger den övre normalgränsen (ULN) med eller utan gulsot, vilket återspeglar ett blandat eller hepatocellulärt mönster av leverskada. CYMBALTA 30 mg ska avbrytas hos patienter som utvecklar gulsot eller andra tecken på kliniskt signifikant leverdysfunktion och ska inte återupptas om inte annan orsak kan fastställas.
Fall av kolestatisk gulsot med minimal förhöjning av transaminasnivåer har också rapporterats. Andra rapporter efter marknadsföring tyder på att förhöjda transaminaser, bilirubin och alkaliskt fosfatas har förekommit hos patienter med kronisk leversjukdom eller cirros.
CYMBALTA ökade risken för förhöjda serumtransaminasnivåer i kliniska prövningar av utvecklingsprogram. Förhöjda levertransaminaser resulterade i att 0,3 % (92/34 756) av CYMBALTA-behandlade patienter avbröts. Hos de flesta patienter var mediantiden till detektion av transaminashöjningen cirka två månader. I placebokontrollerade prövningar för vuxna, för patienter med normala och onormala ALAT-värden vid utgångsläget, inträffade en höjning av ALAT >3 gånger ULN hos 1,25 % (144/11 496) av CYMBALTA-behandlade patienter jämfört med 0,45 % (39/8716) av placebo -behandlade patienter. I placebokontrollerade vuxna studier med en fast dosdesign fanns det tecken på ett CYMBALTA-dosresponssamband för ALAT- och ASAT-förhöjningar på >3 gånger ULN respektive >5 gånger ULN.
Eftersom det är möjligt att CYMBALTA och alkohol kan interagera och orsaka leverskada eller att CYMBALTA 20 mg kan förvärra redan existerande leversjukdom, bör CYMBALTA inte förskrivas till patienter med betydande alkoholkonsumtion eller tecken på kronisk leversjukdom.
Ortostatisk hypotoni, fall och synkope
Ortostatisk hypotoni, fall och synkope har rapporterats hos patienter som behandlats med de rekommenderade CYMBALTA-doserna. Synkope och ortostatisk hypotoni tenderar att inträffa inom den första veckan av behandlingen men kan uppträda när som helst under CYMBALTA-behandling, särskilt efter dosökningar. Fallrisken verkar vara relaterad till graden av ortostatisk sänkning av blodtrycket (BP) samt andra faktorer som kan öka den underliggande risken för fall.
en analys av patienter från alla placebokontrollerade studier rapporterade patienter som behandlats med CYMBALTA 20 mg en högre fallfrekvens jämfört med patienter som behandlades med placebo. Risken verkar vara relaterad till närvaron av ortostatisk minskning av blodtrycket. Risken för blodtryckssänkningar kan vara större hos patienter som samtidigt tar mediciner som inducerar ortostatisk hypotoni (som antihypertensiva) eller är potenta CYP1A2-hämmare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Kliniskt viktiga läkemedelsinteraktioner ] och hos patienter som tar CYMBALTA 20 mg i doser över 60 mg dagligen. Dosminskning eller utsättande av CYMBALTA bör övervägas hos patienter som upplever symptomatisk ortostatisk hypotoni, fall och/eller synkope under behandling med CYMBALTA 40 mg.
Fallrisken verkade också vara proportionell mot en patients underliggande risk för fall och verkade öka stadigt med åldern. Eftersom geriatriska patienter tenderar att ha en högre underliggande risk för fall på grund av en högre förekomst av riskfaktorer som användning av flera mediciner, medicinska samsjukligheter och gångstörningar, är effekten av stigande ålder i sig oklar. Fall med allvarliga konsekvenser inklusive frakturer och sjukhusinläggningar har rapporterats vid användning av CYMBALTA 30 mg [se NEGATIVA REAKTIONER ].
Serotonin syndrom
Utveckling av ett potentiellt livshotande serotonergt syndrom har rapporterats med SNRI och SSRI, inklusive CYMBALTA 60 mg, enbart men särskilt vid samtidig användning av andra serotonerga läkemedel (inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadolamin, tryptofan, busamfetamin, tryptofan, , och johannesört) och med läkemedel som försämrar metabolismen av serotonin (särskilt MAO-hämmare, både de som är avsedda att behandla psykiatriska störningar och även andra, såsom linezolid och intravenöst metylenblått).
Symtom på serotonergt syndrom kan inkludera förändringar i mental status (t.ex. agitation, hallucinationer, delirium och koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, yrsel, diafores, rodnad, hypertermi), neuromuskulära symtom (t.ex. tremor, stelhet, myoklonus, hyperreflexi, inkoordination), kramper och/eller gastrointestinala symtom (t.ex. illamående, kräkningar, diarré). Patienter bör övervakas med avseende på uppkomsten av serotonergt syndrom.
Samtidig användning av CYMBALTA 30 mg och MAO-antidepressiva medel är kontraindicerad. CYMBALTA 60 mg ska inte heller påbörjas hos en patient som behandlas med MAO-hämmare såsom linezolid eller intravenöst metylenblått. Alla rapporter med metylenblått som gav information om administreringssättet involverade intravenös administrering i dosintervallet 1 mg/kg till 8 mg/kg. Inga rapporter involverade administrering av metylenblått på andra sätt (såsom orala tabletter eller lokal vävnadsinjektion) eller vid lägre doser. Det kan finnas omständigheter då det är nödvändigt att påbörja behandling med en MAO-hämmare såsom linezolid eller intravenös metylenblått hos en patient som tar CYMBALTA. CYMBALTA bör avbrytas innan behandling med MAO-hämmaren påbörjas [se DOSERING OCH ADMINISTRERING och KONTRAINDIKATIONER ].
Om samtidig användning av CYMBALTA 20 mg och andra serotonerga läkemedel inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadol, buspiron, tryptofan, amfetamin och johannesört är kliniskt motiverad, bör patienterna göras medvetna om en potentiell ökad risk för serotonergt syndrom. , särskilt under behandlingsstart och dosökningar. Behandling med CYMBALTA 60 mg och eventuella samtidiga serotonerga medel ska avbrytas omedelbart om ovanstående händelser inträffar och understödjande symtomatisk behandling bör inledas.
Ökad risk för blödning
Läkemedel som interfererar med hämning av serotoninåterupptag, inklusive CYMBALTA, kan öka risken för blödningar. Fallrapporter och epidemiologiska studier (fallkontroll och kohortdesign) har visat ett samband mellan användning av läkemedel som stör serotoninåterupptaget och förekomsten av gastrointestinala blödningar. En studie efter marknadsföring visade en högre förekomst av postpartumblödning hos mödrar som tog CYMBALTA. Andra blödningshändelser relaterade till användning av SSRI och SNRI har varierat från ekkymos, hematom, näsblod och petekier till livshotande blödningar. Samtidig användning av aspirin, icke-steroida antiinflammatoriska läkemedel (NSAID), warfarin och andra antikoagulantia kan öka denna risk.
Informera patienter om risken för blödning i samband med samtidig användning av CYMBALTA och NSAID, acetylsalicylsyra eller andra läkemedel som påverkar koagulationen [se LÄKEMEDELSINTERAKTIONER ].
Allvarliga hudreaktioner
Allvarliga hudreaktioner, inklusive erythema multiforme och Stevens-Johnsons syndrom (SJS), kan förekomma med CYMBALTA. Rapporteringsfrekvensen för SJS i samband med CYMBALTA-användning överstiger den allmänna bakgrundsfrekvensen för denna allvarliga hudreaktion (1 till 2 fall per miljon personår). Rapporteringsgraden anses allmänt vara en underskattning på grund av underrapportering.
CYMBALTA ska avbrytas vid första uppkomsten av blåsor, skalande utslag, slemhinneerosion eller andra tecken på överkänslighet om ingen annan etiologi kan identifieras.
Utsättningssyndrom
Symtom på utsättning har systematiskt utvärderats hos patienter som tar CYMBALTA. Efter plötsligt eller avsmalnande avbrott i placebokontrollerade kliniska prövningar för vuxna uppträdde följande symtom vid 1 % eller mer och i en signifikant högre frekvens hos CYMBALTA-behandlade patienter jämfört med de som avbröt placebo: yrsel, huvudvärk, illamående, diarré, parestesi, irritabilitet, kräkningar, sömnlöshet, ångest, hyperhidros och trötthet.
Under marknadsföringen av andra SSRI och SNRI (serotonin- och noradrenalinåterupptagshämmare) har det förekommit spontana rapporter om biverkningar som inträffat vid utsättning av dessa läkemedel, särskilt vid abrupt behandling, inklusive följande: dysforiskt humör, irritabilitet, agitation, yrsel, känselrubbningar ( parestesier såsom elektriska stötar), ångest, förvirring, huvudvärk, letargi, känslomässig labilitet, sömnlöshet, hypomani, tinnitus och kramper. Även om dessa händelser i allmänhet är självbegränsande, har vissa rapporterats vara allvarliga.
Patienter bör övervakas för dessa symtom när behandlingen med CYMBALTA avbryts. En gradvis minskning av dosen snarare än abrupt utsättning rekommenderas när så är möjligt. Om oacceptabla symtom uppstår efter en minskning av dosen eller efter avslutad behandling, kan återuppta den tidigare ordinerade dosen övervägas. Därefter kan vårdgivaren fortsätta att minska dosen men i en mer gradvis takt [se DOSERING OCH ADMINISTRERING ].
Aktivering av mani/hypomani
placebokontrollerade vuxna studier på patienter med MDD rapporterades aktivering av mani eller hypomani hos 0,1 % (4/3779) av CYMBALTA-behandlade patienter och 0,04 % (1/2536) av placebobehandlade patienter. Ingen aktivering av mani eller hypomani rapporterades i placebokontrollerade studier med DPNP, GAD, fibromyalgi eller kronisk muskuloskeletal smärta. Aktivering av mani eller hypomani har rapporterats hos en liten del av patienter med humörstörningar som behandlats med andra marknadsförda läkemedel som är effektiva vid behandling av egentlig depression. Liksom med dessa andra medel ska CYMBALTA 60 mg användas med försiktighet till patienter med mani i anamnesen.
Stängningsvinkelglaukom
Pupillutvidgningen som uppstår efter användning av många antidepressiva läkemedel inklusive CYMBALTA kan utlösa en vinkelattack hos en patient med anatomiskt smala vinklar som inte har en patenterad iridektomi.
Anfall
CYMBALTA har inte utvärderats systematiskt hos patienter med krampanfall, och sådana patienter uteslöts från kliniska studier. I placebokontrollerade kliniska prövningar för vuxna inträffade anfall/kramper hos 0,02 % (3/12 722) av patienterna som behandlades med CYMBALTA 60 mg och 0,01 % (1/9513) av patienterna som behandlades med placebo. CYMBALTA ska förskrivas med försiktighet till patienter med anamnes på krampanfall.
Blodtryckshöjningar
placebokontrollerade kliniska prövningar för vuxna över godkända vuxna populationer från baslinje till effektmått, var CYMBALTA-behandling associerad med genomsnittliga ökningar på 0,5 mm Hg i systoliskt blodtryck och 0,8 mm Hg i diastoliskt blodtryck jämfört med genomsnittliga minskningar på 0,6 mm Hg systoliskt och 0,3 mm Hg diastoliskt hos placebobehandlade patienter. Det fanns ingen signifikant skillnad i frekvensen av ihållande (3 på varandra följande besök) förhöjt blodtryck. I en klinisk farmakologisk studie utformad för att utvärdera effekterna av CYMBALTA 60 mg på olika parametrar, inklusive blodtryck vid supraterapeutiska doser med en accelererad dostitrering, fanns det tecken på ökningar av liggande blodtryck vid doser upp till 200 mg två gånger dagligen (ungefär 3,3 gånger dagligen) den maximala rekommenderade dosen). Vid den högsta dosen på 200 mg två gånger dagligen var ökningen av medelpulsfrekvensen 5,0 till 6,8 slag och ökningar av medelblodtrycket var 4,7 till 6,8 mm Hg (systoliskt) och 4,5 till 7 mm Hg (diastoliskt) upp till 12 timmar efter dosering .
Blodtrycket ska mätas innan behandlingen påbörjas och regelbundet mätas under hela behandlingen [se NEGATIVA REAKTIONER ].
Kliniskt viktiga läkemedelsinteraktioner
Både CYP1A2 och CYP2D6 är ansvariga för CYMBALTA-metabolismen.
Potentiell för andra droger att påverka CYMBALTA
CYP1A2-hämmare
Samtidig administrering av CYMBALTA 40 mg och potenta CYP1A2-hämmare bör undvikas [se LÄKEMEDELSINTERAKTIONER ].
CYP2D6-hämmare
Eftersom CYP2D6 är involverat i CYMBALTA-metabolismen, skulle samtidig användning av CYMBALTA och potenta hämmare av CYP2D6 förväntas, och gör, resultera i högre koncentrationer (i genomsnitt 60%) av CYMBALTA [se LÄKEMEDELSINTERAKTIONER ].
Potentiell för CYMBALTA 30mg att påverka andra droger
Läkemedel som metaboliseras av CYP2D6
Samtidig administrering av CYMBALTA 20mg med läkemedel som i stor utsträckning metaboliseras av CYP2D6 och som har ett snävt terapeutiskt index, inklusive vissa antidepressiva medel (tricykliska antidepressiva medel [TCA], såsom nortriptylin, amitriptylin och imipramin), fentiaziner och typ 1C antiarytmika (t.ex. propafenon, flekainid), bör behandlas med försiktighet. TCA-koncentrationer i plasma kan behöva övervakas och dosen av TCA kan behöva minskas om en TCA administreras samtidigt med CYMBALTA. På grund av risken för allvarliga ventrikulära arytmier och plötslig död, potentiellt förknippad med förhöjda plasmanivåer av tioridazin, bör CYMBALTA 30 mg och tioridazin inte administreras samtidigt [se LÄKEMEDELSINTERAKTIONER ].
Andra kliniskt viktiga läkemedelsinteraktioner
Alkohol
Användning av CYMBALTA 40 mg samtidigt med stort alkoholintag kan vara associerat med allvarlig leverskada. Av denna anledning bör CYMBALTA 60 mg inte förskrivas till patienter med betydande alkoholkonsumtion [se Hepatotoxicitet och LÄKEMEDELSINTERAKTIONER ].
CNS-verkande droger
Med tanke på de primära CNS-effekterna av CYMBALTA bör det användas med försiktighet när det tas i kombination med eller ersätter andra centralt verkande läkemedel, inklusive de med liknande verkningsmekanism [se Kliniskt viktiga läkemedelsinteraktioner och LÄKEMEDELSINTERAKTIONER ].
Hyponatremi
Hyponatremi kan uppstå som ett resultat av behandling med SSRI och SNRI, inklusive CYMBALTA. I många fall verkar denna hyponatremi vara resultatet av syndromet med olämplig antidiuretisk hormonsekretion (SIADH). Fall med serumnatrium lägre än 110 mmol/L har rapporterats vid användning av CYMBALTA 40 mg och verkade vara reversibla när behandlingen med CYMBALTA avbröts. Geriatriska patienter kan löpa större risk att utveckla hyponatremi med SSRI och SNRI. Dessutom kan patienter som tar diuretika eller som på annat sätt är utarmade i volym löpa större risk [se Användning i specifika populationer ]. Utsättning av CYMBALTA bör övervägas hos patienter med symtomatisk hyponatremi och lämplig medicinsk intervention bör sättas in.
Tecken och symtom på hyponatremi inkluderar huvudvärk, koncentrationssvårigheter, minnesstörning, förvirring, svaghet och ostadighet, vilket kan leda till fall. Mer allvarliga och/eller akuta fall har associerats med hallucinationer, synkope, anfall, koma, andningsstopp och död.
Användning hos patienter med samtidig sjukdom
Klinisk erfarenhet av CYMBALTA hos patienter med samtidiga systemiska sjukdomar är begränsad. Det finns ingen information om vilken effekt förändringar i gastrisk motilitet kan ha på stabiliteten av CYMBALTAs enteriska beläggning. Under extremt sura förhållanden kan CYMBALTA, oskyddad av den magsaftresistenta beläggningen, genomgå hydrolys för att bilda naftol. Försiktighet tillråds vid användning av CYMBALTA hos patienter med tillstånd som kan bromsa magtömningen (t.ex. vissa diabetiker).
CYMBALTA 30 mg har inte utvärderats systematiskt hos patienter med en nyligen anamnes på hjärtinfarkt eller instabil kranskärlssjukdom. Patienter med dessa diagnoser uteslöts i allmänhet från kliniska studier under produktens premarketingtestning.
Nedsatt leverfunktion
Undvik användning till patienter med kronisk leversjukdom eller cirros [se DOSERING OCH ADMINISTRERING , Hepatotoxicitet , och Användning i specifika populationer ].
Svårt nedsatt njurfunktion
Undvik användning till patienter med gravt nedsatt njurfunktion, GFR DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Glykemisk kontroll hos patienter med diabetes
Som observerats i DPNP-studier försämrade behandling med CYMBALTA 30 mg den glykemiska kontrollen hos vissa patienter med diabetes. I tre kliniska prövningar av CYMBALTA för behandling av neuropatisk smärta i samband med diabetisk perifer neuropati [se Kliniska studier ], den genomsnittliga varaktigheten av diabetes var cirka 12 år, det genomsnittliga fasteblodsockret vid baslinjen var 176 mg/dL och medelvärdet för hemoglobin A1c (HbA1c) vid baslinjen var 7,8 %. Under den 12 veckor långa akuta behandlingsfasen av dessa studier var CYMBALTA associerad med en liten ökning av genomsnittlig fasteblodsocker jämfört med placebo. I förlängningsfasen av dessa studier, som varade i upp till 52 veckor, ökade det genomsnittliga fastande blodsockret med 12 mg/dL i CYMBALTA 40 mg-gruppen och minskade med 11,5 mg/dL i rutinvårdsgruppen. HbA1c ökade med 0,5 % i CYMBALTA 40 mg-gruppen och med 0,2 % i rutinvårdsgruppen.
Tveksamhet och retention i urinvägarna
CYMBALTA 60mg är i en klass av läkemedel som är kända för att påverka urinrörets motstånd. Om symtom på urintveksamhet utvecklas under behandling med CYMBALTA 20 mg, bör möjligheten att de kan vara läkemedelsrelaterade övervägas.
Efter marknadsföring har fall av urinretention observerats. I vissa fall av urinretention i samband med användning av CYMBALTA 60 mg har sjukhusvistelse och/eller kateterisering behövts.
Sexuell dysfunktion
Användning av SNRI, inklusive CYMBALTA 60 mg, kan orsaka symtom på sexuell dysfunktion [se NEGATIVA REAKTIONER ]. Hos manliga patienter kan användning av SNRI resultera i fördröjning eller ejakulationssvikt, minskad libido och erektil dysfunktion. Hos kvinnliga patienter kan användning av SNRI resultera i minskad libido och försenad eller utebliven orgasm.
Det är viktigt för förskrivare att fråga om sexuell funktion innan behandlingen med CYMBALTA 40 mg påbörjas och att fråga specifikt om förändringar i sexuell funktion under behandlingen, eftersom sexuell funktion kanske inte spontant rapporteras. När man utvärderar förändringar i sexuell funktion är det viktigt att få en detaljerad historia (inklusive tidpunkten för symtomdebut) eftersom sexuella symtom kan ha andra orsaker, inklusive den underliggande psykiatriska störningen. Diskutera potentiella hanteringsstrategier för att stödja patienter i att fatta välgrundade beslut om behandling.
Patientrådgivning Information
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ).
Självmordstankar och -beteenden
Råda patienter, deras familjer och deras vårdgivare att leta efter uppkomsten av självmordstankar och självmordsbeteende, särskilt under behandling och när dosen justeras upp eller ner och instruera dem att rapportera sådana symtom till sin vårdgivare [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Administrering
Rekommendera patienter att svälja CYMBALTA 20 mg hel och att inte tugga, krossa eller öppna kapseln (strö inte innehåll på mat eller blandad med vätskor) eftersom dessa åtgärder kan påverka den enteriska beläggningen.
Hepatotoxicitet
Informera patienter om att allvarliga leverproblem, ibland dödliga, har rapporterats hos patienter som behandlats med CYMBALTA. Instruera patienterna att prata med sin vårdgivare om de utvecklar klåda, smärta i övre högra delen av magen, mörk urin eller gul hud/ögon medan de tar CYMBALTA, vilket kan vara tecken på leverproblem. Instruera patienterna att prata med sin vårdgivare om sin alkoholkonsumtion. Användning av CYMBALTA med stort alkoholintag kan vara förknippat med allvarlig leverskada [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Alkohol
Även om CYMBALTA inte ökar försämringen av mentala och motoriska färdigheter orsakade av alkohol, kan användning av CYMBALTA samtidigt med stort alkoholintag vara förknippat med allvarlig leverskada [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ].
Ortostatisk hypotoni, fall och synkope
Informera patienter om risken för ortostatisk hypotoni, fall och synkope, särskilt under perioden med initial användning och efterföljande dosökning, och i samband med samtidig användning av läkemedel som kan potentiera den ortostatiska effekten av CYMBALTA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Serotonin syndrom
Varna patienter för risken för serotonergt syndrom vid samtidig användning av CYMBALTA 30 mg och andra serotonerga medel inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadol, buspiron, tryptofan, amfetamin och johannesört [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och LÄKEMEDELSINTERAKTIONER ]. Informera patienter om de tecken och symtom som är förknippade med serotonergt syndrom som kan innefatta förändringar i mental status (t.ex. agitation, hallucinationer, delirium och koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, yrsel, diafores, rodnad, hypertermi), neuromuskulära förändringar (t.ex. tremor, stelhet, myoklonus, hyperreflexi, inkoordination), kramper och/eller gastrointestinala symtom (t.ex. illamående, kräkningar, diarré). Varna patienterna att omedelbart söka läkarvård om de upplever dessa symtom.
Ökad risk för blödning
Varna patienter för samtidig användning av CYMBALTA 30 mg och NSAID, acetylsalicylsyra, warfarin eller andra läkemedel som påverkar koagulationen sedan kombinerad användning av psykotropa läkemedel som stör serotoninåterupptaget och dessa medel har associerats med en ökad risk för blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Allvarliga hudreaktioner
Varna patienter för att CYMBALTA kan orsaka allvarliga hudreaktioner. Detta kan behöva behandlas på sjukhus och kan vara livshotande. Rekommendera patienter att ringa sin läkare omedelbart eller få akut hjälp om de har blåsor, skalande utslag, sår i munnen, nässelfeber eller andra allergiska reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Avbrytande av behandling
Instruera patienterna att utsättande av CYMBALTA 30 mg kan vara förknippat med symtom som yrsel, huvudvärk, illamående, diarré, parestesi, irritabilitet, kräkningar, sömnlöshet, ångest, hyperhidros och trötthet, och bör rådas att inte ändra sin doseringsregim eller sluta. tar CYMBALTA utan att rådfråga sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Aktivering av mani eller hypomani
Screena patienter med depressiva symtom på lämpligt sätt för risk för bipolär sjukdom (t.ex. familjehistoria med självmord, bipolär sjukdom och depression) innan behandling med CYMBALTA påbörjas. Rekommendera patienter att rapportera tecken eller symtom på en manisk reaktion såsom kraftigt ökad energi, svåra sömnproblem, tjafsande tankar, hänsynslöst beteende, prata mer eller snabbare än vanligt, ovanligt storslagna idéer och överdriven lycka eller irritabilitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Stängningsvinkelglaukom
Informera patienter om att att ta CYMBALTA 40 mg kan orsaka mild pupillvidgning, vilket hos känsliga individer kan leda till en episod av glaukom med vinkelstängning. Redan existerande glaukom är nästan alltid glaukom med öppen vinkel eftersom stängningsvinkelglaukom, när det diagnostiseras, kan behandlas definitivt med iridektomi. Öppenvinkelglaukom är inte en riskfaktor för slutvinkelglaukom. Patienter kan vilja undersökas för att avgöra om de är mottagliga för vinkelstängning och genomgå en profylaktisk procedur (t.ex. iridektomi), om de är mottagliga [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anfall
Rekommendera patienter att informera sin vårdgivare om de har en historia av anfallsstörning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Effekter På Blodtrycket
Varna patienter för att CYMBALTA 60 mg kan orsaka en ökning av blodtrycket [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Samtidig medicinering
Rekommendera patienter att informera sin vårdgivare om de tar eller planerar att ta några receptbelagda eller receptfria läkemedel, eftersom det finns risk för interaktioner [se DOSERING OCH ADMINISTRERING , KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och LÄKEMEDELSINTERAKTIONER ].
Hyponatremi
Informera patienter om att hyponatremi har rapporterats som ett resultat av behandling med SNRI och SSRI, inklusive CYMBALTA. Informera patienter om tecken och symtom på hyponatremi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].

Samtidiga sjukdomar
Råda patienter att informera sin vårdgivare om alla sina medicinska tillstånd [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Tveksamhet och retention i urinvägarna
CYMBALTA tillhör en klass av läkemedel som kan påverka urinering. Instruera patienter att rådgöra med sin vårdgivare om de utvecklar problem med urinflödet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sexuell dysfunktion
Informera patienter om att användning av CYMBALTA 40 mg kan orsaka symtom på sexuell dysfunktion hos både manliga och kvinnliga patienter. Informera patienter om att de bör diskutera eventuella förändringar i sexuell funktion och potentiella hanteringsstrategier med sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Graviditet
- Rekommendera kvinnor att meddela sin vårdgivare om de blir gravida eller planerar att bli gravida under behandling med CYMBALTA.
- Informera gravida kvinnor eller patienter som avser att bli gravida att användning av CYMBALTA 40 mg under månaden före förlossningen kan leda till en ökad risk för postpartumblödning och kan öka risken för neonatala komplikationer som kräver långvarig sjukhusvistelse, andningsstöd och sondmatning.
- Informera gravida kvinnor om att det finns risk för återfall vid utsättande av antidepressiva läkemedel.
- Informera patienter om att det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för duloxetin under graviditeten [se Användning i specifika populationer ].
Laktation
Rekommendera ammande kvinnor som använder CYMBALTA 30 mg för att övervaka spädbarn för sedering, dålig matning och dålig viktökning och att söka läkarvård om de märker dessa tecken [se Användning i specifika populationer ].
Interferens med psykomotorisk prestanda
CYMBALTA 30 mg kan vara förknippat med sedering och yrsel. Var därför försiktig med patienterna för att använda farliga maskiner inklusive bilar, tills de är rimligen säkra på att CYMBALTA-behandling inte påverkar deras förmåga att delta i sådana aktiviteter.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Duloxetin administrerades i kosten till möss och råttor under 2 år.
Hos honmöss som fick duloxetin 140 mg/kg/dag (3 gånger den maximala rekommenderade humana dosen (MRHD) på 120 mg/dag till barn på mg/m2-basis), fanns en ökad incidens av hepatocellulära adenom och karcinom. Dos utan effekt var 50 mg/kg/dag (1 gång MRHD som gavs till barn). Tumörincidensen ökade inte hos möss av hankön som fick duloxetin i doser upp till 100 mg/kg/dag (2 gånger MRHD som ges till barn).
Hos råttor ökade inte dietdoser av duloxetin upp till 27 mg/kg/dag hos honor (1 gång MRHD givet till barn) och upp till 36 mg/kg/dag hos hanar (1,4 gånger MRHD givet till barn) förekomst av tumörer.
Mutagenes
Duloxetin var inte mutagent i in vitro bakteriell omvänd mutation (Ames test) och var inte klastogent i ett in vivo kromosomavvikelsetest i benmärgsceller från mus. Dessutom var duloxetin inte genotoxiskt i en in vitro analys av däggdjurs framåtgenmutation i muslymfomceller eller i en in vitro analys av oplanerad DNA-syntes (UDS) i primära råtthepatocyter och inducerade inte systerkromatidutbyte i benmärg från kinesisk hamster in vivo .
Nedsättning av fertilitet
Duloxetin administrerat oralt till antingen han- eller honråttor före och under hela parningen i doser upp till 45 mg/kg/dag (3 gånger MRHD som ges till ungdomar på mg/m2-basis) förändrade inte parningen eller fertiliteten.
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsresultaten hos kvinnor som exponerats för CYMBALTA under graviditeten. För att registrera dig, kontakta CYMBALTA Pregnancy Registry på 1-866-814-6975 eller www.cymbalta 20mgpregnancyregistry.com.
Risksammanfattning
Data från en retrospektiv kohortstudie efter marknadsföring tyder på att användning av duloxetin månaden före förlossningen kan vara associerad med en ökad risk för postpartumblödning. Data från publicerad litteratur och från en retrospektiv kohortstudie efter marknadsföring har inte identifierat en tydlig läkemedelsassocierad risk för allvarliga fosterskador eller andra negativa utvecklingsresultat (se Data ). Det finns risker förknippade med obehandlad depression och fibromyalgi under graviditet och med exponering för SNRI och SSRI, inklusive CYMBALTA, under graviditet (se Kliniska överväganden ).
Hos råttor och kaniner som behandlats med duloxetin under organogenesperioden minskade fostervikten men det fanns inga tecken på utvecklingseffekter vid doser upp till 3 respektive 6 gånger den maximala rekommenderade humandosen (MRHD) på 120 mg/dag givet till ungdomar på basis av mg/m2. När duloxetin administrerades oralt till gravida råttor under hela dräktigheten och laktationen, minskade valpvikten vid födseln och valpöverlevnad till 1 dag efter förlossningen i en dos som var 2 gånger den MRHD som gavs till ungdomar på mg/m2-basis. Vid denna dos observerades valpbeteenden i överensstämmelse med ökad reaktivitet, såsom ökat skrämselsvar på buller och minskad tillvänjning av rörelseaktivitet. Tillväxten efter avvänjning påverkades inte negativt.
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 till 4 % respektive 15 till 20 %.
Kliniska överväganden
Sjukdomsrelaterad risk för modern och/eller embryo/foster
Kvinnor som slutar använda antidepressiva läkemedel under graviditeten är mer benägna att uppleva ett återfall av allvarlig depression än kvinnor som fortsätter med antidepressiva. Detta fynd kommer från en prospektiv, longitudinell studie som följde 201 gravida kvinnor med en historia av allvarlig depressiv sjukdom som var euthymic och tog antidepressiva i början av graviditeten. Tänk på risken för obehandlad depression när du avbryter eller byter behandling med antidepressiv medicin under graviditet och efter förlossningen.
Gravida kvinnor med fibromyalgi löper ökad risk för ogynnsamma resultat hos mödrar och spädbarn, inklusive för tidig tidig membranruptur, för tidig födsel, liten för graviditetsåldern, intrauterin tillväxtrestriktion, placentaavbrott och venös trombos. Det är inte känt om dessa ogynnsamma mödra- och fosterresultat är ett direkt resultat av fibromyalgi eller andra komorbida faktorer.
Biverkningar hos modern
Användning av duloxetin under månaden före förlossningen kan vara associerad med en ökad risk för postpartumblödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Fetal/neonatal biverkning
Nyfödda som exponerats för CYMBALTA och andra SNRI eller SSRI sent i tredje trimestern har utvecklat komplikationer som kräver långvarig sjukhusvistelse, andningsstöd och sondmatning. Sådana komplikationer kan uppstå omedelbart efter leverans. Rapporterade kliniska fynd har inkluderat andnöd, cyanos, apné, kramper, temperaturinstabilitet, ätsvårigheter, kräkningar, hypoglykemi, hypotoni, hypertoni, hyperreflexi, tremor, skakningar, irritabilitet och konstant gråt. Dessa fynd överensstämmer med antingen en direkt toxisk effekt av SNRI eller SSRI, eller möjligen ett läkemedelsavbrottssyndrom. Det bör noteras att den kliniska bilden i vissa fall överensstämmer med serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Data
Mänskliga data
Data från en eftermarknadsföring retrospektiv påstående-baserad kohortstudie fann en ökad risk för postpartumblödning bland 955 gravida kvinnor som exponerats för duloxetin under den sista månaden av graviditeten jämfört med 4 128 460 oexponerade gravida kvinnor (justerad relativ risk: 1,53; 95 % 9-2. ). Samma studie fann inte en kliniskt meningsfull ökning av risken för allvarliga fosterskador i jämförelsen mellan 2 532 kvinnor som exponerades för duloxetin under graviditetens första trimester med 1 284 827 oexponerade kvinnor efter justering för flera konfounders. Metodiska begränsningar inkluderar möjlig kvarstående förvirring, felklassificering av exponering och resultat, brist på direkta mått på sjukdomens svårighetsgrad och brist på information om alkoholanvändning, näring och exponeringar för receptfria läkemedel.
Djurdata
I reproduktionsstudier på djur har duloxetin visat sig ha negativa effekter på embryo/foster och postnatal utveckling.
När duloxetin administrerades oralt till dräktiga råttor och kaniner under organogenesperioden fanns inga tecken på missbildningar eller utvecklingsvariationer vid doser upp till 45 mg/kg/dag [3 respektive 6 gånger MRHD på 120 mg/dag ges till ungdomar på en mg/m2-basis]. Emellertid minskade fostervikten vid denna dos, med en dos utan effekt på 10 mg/kg/dag (ungefär lika med MRHD hos råttor och 2 gånger MRHD hos kaniner).
När duloxetin administrerades oralt till dräktiga råttor under hela dräktigheten och laktationen, minskade överlevnaden för ungar till 1 dag efter förlossningen och valparnas kroppsvikt vid födseln och under laktationsperioden med en dos på 30 mg/kg/dag (2 gånger den MRHD som gavs till ungdomar på en mg/m2-basis); dosen utan effekt var 10 mg/kg/dag. Vidare observerades beteenden som överensstämmer med ökad reaktivitet, såsom ökad skrämselreaktion på buller och minskad tillvänjning av rörelseaktivitet, hos ungar efter maternell exponering för 30 mg/kg/dag. Tillväxt och reproduktionsförmåga hos avkomman efter avvänjning påverkades inte negativt av maternell duloxetinbehandling.
Laktation
Risksammanfattning
Data från publicerad litteratur rapporterar förekomsten av duloxetin i bröstmjölk (se Data ). Det finns rapporter om sedering, dålig utfodring och dålig viktökning hos spädbarn som exponerats för duloxetin via bröstmjölk (se Kliniska överväganden ). Det finns inga data om effekten av duloxetin på mjölkproduktionen.
Utvecklings- och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av CYMBALTA och eventuella negativa effekter på det ammade barnet från CYMBALTA eller från det underliggande moderns tillståndet.
Kliniska överväganden
Spädbarn som exponeras för CYMBALTA bör övervakas med avseende på sedering, dålig mat och dålig viktökning.
Data
Fördelning av CYMBALTA 60 mg studerades hos 6 ammande kvinnor som var minst 12 veckor efter förlossningen och hade valt att avvänja sina spädbarn. Kvinnorna fick 40 mg CYMBALTA 60 mg två gånger dagligen under 3,5 dagar. Den maximala koncentrationen uppmätt i bröstmjölk inträffade i median 3 timmar efter dosen. Mängden CYMBALTA i bröstmjölk var cirka 7 mikrogram/dag under den dosen; den uppskattade dagliga dosen för spädbarn var cirka 2 mikrogram/kg/dag, vilket är mindre än 1 % av moderns dos. Förekomsten av CYMBALTA 40 mg metaboliter i bröstmjölk undersöktes inte.
Pediatrisk användning
Säkerheten och effektiviteten av CYMBALTA 60 mg har fastställts för behandling av generaliserat ångestsyndrom (GAD) hos patienter 7 till 17 år och för behandling av juvenilt fibromyalgisyndrom hos patienter 13 till 17 år. Säkerheten och effekten av CYMBALTA 20 mg har inte fastställts hos pediatriska patienter med egentlig depression (MDD), diabetisk perifer neuropatisk smärta eller kronisk muskuloskeletal smärta.
Antidepressiva läkemedel ökade risken för självmordstankar och självmordsbeteende hos barn. Övervaka alla pediatriska patienter som behandlas med antidepressiva med avseende på klinisk försämring och uppkomst av självmordstankar och -beteenden, särskilt under de första månaderna av behandlingen, eller vid tidpunkter med dosförändringar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Utför regelbunden övervakning av vikt och tillväxt hos pediatriska patienter som behandlas med CYMBALTA [se NEGATIVA REAKTIONER ].
Generaliserat ångestsyndrom
Användning av CYMBALTA för behandling av GAD hos patienter i åldern 7 till 17 år stöds av en 10-veckors placebokontrollerad studie (GAD-6). Studien inkluderade 272 pediatriska patienter med GAD, varav 47 % var 7 till 11 år (53 % var 12 till 17 år gamla). CYMBALTA visade överlägsenhet gentemot placebo mätt som större förbättring i Pediatric Anxiety Rating Scale (PARS) för GAD-svårighetspoäng [se Kliniska studier ].
Säkerheten och effektiviteten av CYMBALTA 20 mg för behandling av GAD hos pediatriska patienter yngre än 7 år har inte fastställts.
Fibromyalgi
Användning av CYMBALTA för behandling av fibromyalgi hos patienter 13 till 17 år stöds av en 13-veckors placebokontrollerad studie på 184 patienter med juvenilt fibromyalgisyndrom (studie FM-4). CYMBALTA visade förbättring jämfört med placebo på det primära effektmåttet, förändring från baslinje till slutet av behandlingen på Brief Pain Inventory (BPI) – Modifierad kortform: Adolescentversion 24-timmars genomsnittlig smärta. Kliniska studier ].
Säkerheten och effektiviteten av CYMBALTA för behandling av fibromyalgi hos patienter yngre än 13 år har inte fastställts.
Major depressiv sjukdom
Säkerheten och effektiviteten av CYMBALTA har inte fastställts hos pediatriska patienter för behandling av MDD.
Effekten av CYMBALTA visades inte i två 10-veckors placebokontrollerade studier med 800 pediatriska patienter i åldern 7 till 17 år gamla med MDD (MDD-6 och MDD-7). Varken CYMBALTA eller en aktiv kontroll (godkänd för behandling av pediatrisk MDD) var överlägsen placebo.
De vanligast observerade biverkningarna i de kliniska prövningarna för MDD på barn inkluderade illamående, huvudvärk, minskad vikt och buksmärtor. Minskad aptit och viktminskning har observerats i samband med användning av SSRI och SNRI.
Toxikologiska data för unga djur
Administrering av duloxetin till unga råttor från postnatal dag 21 (avvänjning) till postnatal dag 90 (vuxen) resulterade i minskade kroppsvikter som kvarstod in i vuxen ålder, men återhämtade sig när läkemedelsbehandlingen avbröts; något försenad (~1,5 dagar) könsmognad hos honor, utan någon effekt på fertiliteten; och en försening i att lära sig en komplex uppgift i vuxen ålder, som inte observerades efter att läkemedelsbehandlingen avbröts. Dessa effekter observerades vid den höga dosen på 45 mg/kg/dag (2 gånger MRHD, för ett barn); nivån utan effekt var 20 mg/kg/dag (≈1 gånger MRHD, för ett barn).
Geriatrisk användning
Geriatrisk exponering i premarketing kliniska prövningar av CYMBALTA
- Av de 2 418 patienterna i MDD-studier var 6 % (143) 65 år eller äldre.
- Av de 1041 patienterna i CLBP-studier var 21 % (221) 65 år eller äldre.
- Av de 487 patienterna i OA-studier var 41 % (197) 65 år eller äldre.
- Av de 1 074 patienterna i DPNP-studierna var 33 % (357) 65 år eller äldre.
- Av de 1 761 patienterna i FM-studier var 8 % (140) 65 år eller äldre.
I MDD-, GAD-, DPNP-, FM-, OA- och CLBP-studierna observerades generellt inga övergripande skillnader i säkerhet eller effektivitet mellan dessa patienter och yngre vuxna patienter, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan dessa geriatriska och yngre patienter. vuxna patienter, men större känslighet hos vissa äldre patienter kan inte uteslutas.
SSRI och SNRI, inklusive CYMBALTA har associerats med kliniskt signifikant hyponatremi hos geriatriska patienter, som kan löpa större risk för denna biverkning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
en analys av data från alla placebokontrollerade studier rapporterade CYMBALTA-behandlade patienter en högre fallfrekvens jämfört med placebobehandlade patienter. Den ökade risken tycks vara proportionell mot en patients underliggande risk för fall. Den underliggande risken tycks öka stadigt med åldern. Eftersom geriatriska patienter tenderar att ha en högre prevalens av riskfaktorer för fall såsom mediciner, medicinska samsjukligheter och gångstörningar, är effekten av stigande ålder i sig på fall under behandling med CYMBALTA 30 mg oklar. Fall med allvarliga konsekvenser inklusive benfrakturer och sjukhusvistelser har rapporterats vid användning av CYMBALTA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Farmakokinetiken för duloxetin efter en singeldos på 40 mg jämfördes hos friska äldre kvinnor (65 till 77 år) och friska medelålders kvinnor (32 till 50 år). Det fanns ingen skillnad i Cmax, men AUC för duloxetin var något (cirka 25 %) högre och halveringstiden cirka 4 timmar längre hos äldre kvinnor. Populationsfarmakokinetiska analyser tyder på att de typiska värdena för clearance minskar med cirka 1 % för varje åldersår mellan 25 och 75 år; men ålder som en prediktiv faktor står bara för en liten andel av variationen mellan patienter. Dosjustering baserat på den vuxna patientens ålder är inte nödvändig.
Kön
Duloxetins halveringstid är liknande hos män och kvinnor. Dosjustering baserat på kön är inte nödvändig.
Rökning status
Duloxetins biotillgänglighet (AUC) tycks vara minskad med cirka en tredjedel hos rökare. Dosändringar rekommenderas inte för rökare.
Lopp
Ingen specifik farmakokinetisk studie utfördes för att undersöka effekterna av ras.
Nedsatt leverfunktion
Patienter med kliniskt tydligt nedsatt leverfunktion har minskad metabolism och eliminering av duloxetin. Efter en engångsdos på 20 mg av CYMBALTA 20 mg hade 6 cirrospatienter med måttligt nedsatt leverfunktion (Child-Pugh klass B) ett genomsnittligt plasmaclearance för duloxetin på cirka 15 % av det för ålders- och könsmatchade friska försökspersoner, med en 5-faldig ökning i medelexponering (AUC). Även om Cmax liknade det normala hos cirrospatienter var halveringstiden cirka 3 gånger längre [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Svårt nedsatt njurfunktion
Begränsade data finns tillgängliga om effekterna av CYMBALTA 40 mg hos patienter med njursjukdom i slutstadiet (ESRD). Efter en engångsdos på 60 mg av CYMBALTA 20 mg var Cmax- och AUC-värdena cirka 100 % högre hos patienter med ESRD som fick kronisk intermittent hemodialys än hos patienter med normal njurfunktion. Halveringstiden för eliminering var dock likartad i båda grupperna. AUC för de huvudsakliga cirkulerande metaboliterna, 4-hydroxi duloxetinglukuronid och 5-hydroxi, 6metoxi duloxetinsulfat, som till stor del utsöndras i urinen, var cirka 7 till 9 gånger högre och skulle förväntas öka ytterligare vid upprepad dosering. Populations-PK-analyser tyder på att mild till måttlig grad av nedsatt njurfunktion (uppskattad CrCl 30-80 ml/min) inte har någon signifikant effekt på duloxetins skenbara clearance [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
ÖVERDOS
Tecken och symtom
Efter marknadsföring har dödliga utfall rapporterats för akuta 60 mg överdoser av CYMBALTA, främst med blandade överdoser, men även med endast CYMBALTA 20 mg, inklusive 1 000 mg CYMBALTA (ungefär 8,3 gånger den maximala rekommenderade dosen). Tecken och symtom på överdosering (CYMBALTA enbart eller med blandade läkemedel) inkluderade somnolens, koma, serotonergt syndrom, kramper, synkope, takykardi, hypotoni, hypertoni och kräkningar.
Hantering av överdosering
Det finns ingen specifik motgift mot en överdosering av CYMBALTA 60 mg, men om serotonergt syndrom uppstår kan specifik behandling (som med cyproheptadin och/eller temperaturkontroll) övervägas.
händelse av akut överdos med CYMBALTA 30 mg, bör behandlingen bestå av de allmänna åtgärder som används vid hanteringen av överdosering av vilket läkemedel som helst, såsom att säkerställa en adekvat luftväg, syresättning och ventilation och övervakning av hjärtrytm och vitala tecken. Magsköljning med en orogastrisk sond med stor borrning med lämpligt luftvägsskydd, vid behov, kan vara indicerat om det utförs strax efter intag eller hos symtomatiska patienter. Induktion av kräkning rekommenderas inte.
Aktivt kol kan vara användbart för att begränsa absorptionen av duloxetin från mag-tarmkanalen. Administrering av aktivt kol har visat sig minska AUC och Cmax för duloxetin med i genomsnitt en tredjedel, även om vissa patienter hade en begränsad effekt av aktivt kol. På grund av den stora distributionsvolymen av duloxetin är det osannolikt att forcerad diures, dialys, hemoperfusion och utbytestransfusion är fördelaktigt.
Vid hantering av överdosering bör möjligheten av flera läkemedelsinblandning övervägas. En särskild försiktighet omfattar patienter som överdoserar CYMBALTA 60 mg och tricykliska antidepressiva medel. I ett sådant fall kan minskat clearance av den modertricykliska och/eller dess aktiva metabolit öka risken för kliniskt signifikanta följdsjukdomar och förlänga den tid som behövs för noggrann medicinsk observation [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ].
Överväg att kontakta ett giftkontrollcenter (1-800-222-1222 eller www.poison.org) för ytterligare information om behandling av överdosering.
KONTRAINDIKATIONER
Användning av MAO-hämmare avsedda att behandla psykiatriska störningar med CYMBALTA 40 mg eller inom 5 dagar efter avslutad behandling med CYMBALTA är kontraindicerat på grund av en ökad risk för serotonergt syndrom. Användning av CYMBALTA inom 14 dagar efter avslutad MAO-hämmare avsedd för behandling av psykiatriska störningar är kontraindicerad [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Att börja med CYMBALTA 30 mg hos en patient som behandlas med MAO-hämmare som linezolid eller intravenöst metylenblått är också kontraindicerat på grund av en ökad risk för serotonergt syndrom [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Även om de exakta mekanismerna för det antidepressiva, centrala smärthämmande och anxiolytiska verkningarna av duloxetin hos människor är okända, tros dessa effekter vara relaterade till dess förstärkning av serotonerg och noradrenerg aktivitet i CNS.
Farmakodynamik
Prekliniska studier har visat att duloxetin är en potent hämmare av neuronalt serotonin- och noradrenalinåterupptag och en mindre potent hämmare av dopaminåterupptag. Duloxetin har ingen signifikant affinitet för dopaminerga, adrenerga, kolinerga, histaminerga, opioid-, glutamat- och GABA-receptorer in vitro. Duloxetin hämmar inte monoaminoxidas (MAO).
CYMBALTA är i en klass av läkemedel som är kända för att påverka urinrörets motstånd [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hjärtets elektrofysiologi
Effekten av CYMBALTA 160 mg och 200 mg administrerade två gånger dagligen (2,7 respektive 3,3 gånger den maximala rekommenderade dosen) till steady state utvärderades i en randomiserad, dubbelblind, tvåvägs crossover-studie på 117 friska kvinnliga vuxna försökspersoner. Ingen förlängning av QT-intervallet upptäcktes. CYMBALTA 40 mg verkar vara associerat med koncentrationsberoende men inte kliniskt betydelsefull QT-förkortning.
Farmakokinetik
Duloxetin har en eliminationshalveringstid på cirka 12 timmar (intervall 8 till 17 timmar) och dess farmakokinetik är dosproportionell över det terapeutiska området. Steady-state plasmakoncentrationer uppnås vanligtvis efter 3 dagars dosering. Eliminering av duloxetin sker huvudsakligen genom levermetabolism som involverar två P450-isozymer, CYP1A2 och CYP2D6.
Absorption
Efter oral administrering av CYMBALTA 30 mg absorberas duloxetinhydroklorid väl. Det finns en medianfördröjning på 2 timmar tills absorptionen börjar (Tlag), med maximala plasmakoncentrationer (Cmax) av duloxetin 6 timmar efter dosering. Det finns en 3 timmars fördröjning i absorptionen och en tredjedel ökning av skenbart clearance av duloxetin efter en kvällsdos jämfört med en morgondos.
Effekten av mat
Mat påverkar inte Cmax för duloxetin, men fördröjer tiden för att nå toppkoncentrationen från 6 till 10 timmar och det minskar absorptionsgraden (AUC) marginellt med cirka 10 %.
Distribution
Den skenbara distributionsvolymen är i genomsnitt cirka 1640 L. Duloxetin är starkt bundet (>90 %) till proteiner i human plasma och binder främst till albumin och α1-syraglykoprotein. Interaktionen mellan duloxetin och andra mycket proteinbundna läkemedel har inte utvärderats fullständigt. Plasmaproteinbindning av duloxetin påverkas inte av nedsatt njur- eller leverfunktion.
Eliminering
Ämnesomsättning
Biotransformation och disposition av duloxetin hos människor har fastställts efter oral administrering av 14C-märkt duloxetin. Duloxetin utgör cirka 3 % av det totala radiomärkta materialet i plasman, vilket indikerar att det genomgår omfattande metabolism till ett flertal metaboliter. De huvudsakliga biotransformationsvägarna för duloxetin involverar oxidation av naftylringen följt av konjugering och ytterligare oxidation. Både CYP1A2 och CYP2D6 katalyserar oxidationen av naftylringen in vitro. Metaboliter som finns i plasma inkluderar 4-hydroxi duloxetinglukuronid och 5hydroxi, 6-metoxi duloxetinsulfat.
Exkretion
Många ytterligare metaboliter har identifierats i urin, några representerar endast mindre eliminationsvägar. Endast spår (
Specifika populationer
Pediatriska patienter
Duloxetin steady-state plasmakoncentration var jämförbar hos pediatriska patienter 7 till 17 år och vuxna patienter. Den genomsnittliga steady-state duloxetinkoncentrationen var cirka 30 % lägre i denna pediatriska population jämfört med vuxna patienter. De modellförutsägda steady state-plasmakoncentrationerna av duloxetin hos pediatriska patienter 7 till 17 år låg oftast inom det koncentrationsintervall som observerats hos vuxna patienter och översteg inte koncentrationsintervallet hos vuxna.
Kliniska studier
Översikt över de kliniska prövningarna
Effekten av CYMBALTA 60 mg har fastställts i följande populationer i adekvata och välkontrollerade studier:
Major depressiv sjukdom (MDD)
4 korttidsstudier (studier MDD-1, MDD-2, MDD-3 och MDD-4) och 1 underhållsstudie (studie MDD-5) på vuxna [se Major depressiv sjukdom hos vuxna ].
Generaliserat ångestsyndrom (GAD)
3 korttidsstudier på vuxna (studier GAD-1, GAD-2 och GAD-3), 1 underhållsstudie på vuxna (studie GAD-4), 1 korttidsstudie på geriatriska patienter (studie GAD-5), och 1 korttidsstudie på pediatriska patienter 7 till 17 år (studie GAD-6) [se Generaliserat ångestsyndrom ].
Diabetisk perifer neuropatisk smärta (DPNP)
Två 12-veckorsstudier på vuxna (studier DPNP-1 och DPNP-2) [se Diabetisk perifer neuropatisk smärta hos vuxna ].
Fibromyalgi (FM)
Två studier på vuxna (en på 3 månader och en på 6 månader) (studier FM-1 och FM-2) och en 13-veckors studie på pediatriska patienter 13 till 17 år (studie FM-4) [se Fibromyalgi ].
Kronisk muskuloskeletal smärta
Två 12 till 13 veckor långa studier på vuxna patienter med kronisk ländryggssmärta (CLBP) (studier CLBP-1 och CLBP-3) och en 13-veckors studie på vuxna patienter med kronisk smärta på grund av osteoartrit (OA) (studie OA) -1) [se Kronisk Muskuloskeletal Smärta Hos Vuxna ].
Dessutom presenteras en sammanfattning av följande studier som inte visade effekt nedan: Studie FM-3 (en 16 veckor lång studie på vuxna patienter med fibromyalgi), studie CLBP-2 (en 13-veckors studie på vuxna patienter med CLBP) och Studie OA-2 (en 13-veckors studie på vuxna patienter med kronisk smärta på grund av OA).
Major depressiv sjukdom hos vuxna
Effekten av CYMBALTA som behandling för MDD hos vuxna fastställdes i 4 randomiserade, dubbelblinda, placebokontrollerade, fasta dosstudier på vuxna öppenvårdspatienter (18 till 83 år) som uppfyller DSM-IV-kriterierna för MDD:
- studierna MDD-1 och MDD-2 randomiserades patienterna till CYMBALTA 60 mg en gång dagligen (N=123 respektive N=128) eller placebo (N=122 respektive N=139) i 9 veckor
- I studie MDD-3 randomiserades patienterna till CYMBALTA 20 eller 40 mg två gånger dagligen (N=86 respektive N=91) eller placebo (N=89) i 8 veckor
- I studie MDD-4 randomiserades patienterna till CYMBALTA 40 eller 60 mg två gånger dagligen (N=95 respektive N=93) eller placebo (N=93) i 8 veckor.
I alla fyra försöken visade CYMBALTA 40 mg överlägsenhet jämfört med placebo mätt som förbättring av Hamilton Depression Rating Scale (HAMD-17) med 17 punkter (se ). Det finns inga bevis för att doser över 60 mg/dag ger ytterligare fördelar.
I alla dessa kliniska prövningar antydde inte analyser av sambandet mellan behandlingsresultat och ålder, kön och ras någon differentiell respons på grund av dessa patientegenskaper.
Studie MDD-1 CYMBALTA (60 mg/dag)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
I studie MDD-5 fick 533 vuxna patienter som uppfyller DSM-IV-kriterierna för MDD CYMBALTA 60 mg en gång dagligen under en initial 12-veckors öppen behandlingsfas. Tvåhundrasjuttioåtta patienter som svarade på öppen behandling [definierad som att uppfylla följande kriterier vid vecka 10 och 12: en HAMD-17 totalpoäng ≤9, Clinical Global Impressions of Severity (CGI-S) ≤2, och inte som uppfyller DSM-IV-kriterierna för MDD] slumpmässigt tilldelades fortsättning av CYMBALTA i samma dos (N=136) eller till placebo (N=142) i 6 månader.
I studie MDD-5 upplevde patienter på CYMBALTA en statistiskt signifikant längre tid till återfall av depression än patienter på placebo (se Figur 1 ). Återfall definierades som en ökning av CGI-S-poängen på ≥2 poäng jämfört med den som erhölls vid vecka 12, samt uppfylla DSM-IV-kriterierna för MDD vid 2 på varandra följande besök med minst 2 veckors mellanrum, där 2-veckors det tidsmässiga kriteriet måste uppfyllas endast vid det andra besöket.
Figur 1: Kumulativ proportion av vuxna patienter med MDD-återfall (studie MDD-5)
Generaliserat ångestsyndrom
GAD-försök hos vuxna (inklusive geriatriska patienter)
Effekten av CYMBALTA 20 mg vid behandling av generaliserad ångeststörning (GAD) fastställdes i 1 fast dos randomiserad, dubbelblind, placebokontrollerad studie och 2 flexibel dos randomiserade, dubbelblinda, placebokontrollerade studier på vuxna öppenvårdspatienter mellan 18 och 83 år som uppfyller DSM-IV-kriterierna för GAD (studier GAD-1, GAD-2 respektive GAD-3).
studierna GAD-1 och GAD-2 var startdosen 60 mg en gång dagligen (nedtitrering till 30 mg en gång dagligen var tillåten av tolerabilitetsskäl; dosen kunde ökas till 60 mg en gång dagligen). Femton procent av patienterna titrerades ned. Studie GAD-3 hade en startdos på 30 mg en gång dagligen i 1 vecka innan den ökades till 60 mg en gång dagligen.
Studierna GAD-2 och GAD-3 involverade dostitrering med CYMBALTA-doser från 60 mg en gång dagligen till 120 mg en gång dagligen (N=168 och N=162) jämfört med placebo (N=159 och N=161) över en 10- veckas behandlingsperiod. Medeldosen för fullbordare vid endpoint i dessa studier var 104,8 mg/dag. Studie GAD-1 utvärderade CYMBALTA 60 mg doser på 60 mg en gång dagligen (N=168) och 120 mg en gång dagligen (N=170) jämfört med placebo (N=175) under en 9-veckors behandlingsperiod. Även om en dos på 120 mg/dag visade sig vara effektiv, finns det inga bevis för att doser större än 60 mg/dag ger ytterligare fördelar.
alla tre försöken visade CYMBALTA överlägsenhet gentemot placebo mätt genom större förbättring av Hamilton Anxiety Scale (HAM-A) totalpoäng (se ) och av Sheehan Disability Scale (SDS) globala funktionsnedsättningspoäng. SDS är ett sammansatt mått på i vilken utsträckning känslomässiga symtom stör patientens funktion i tre livsområden: arbete/skola, socialt liv/fritidsaktiviteter och familjeliv/hemansvar.
studie GAD-4 fick 887 patienter som uppfyller DSM-IV-TR-kriterierna för GAD CYMBALTA 60 mg till 120 mg en gång dagligen under en initial 26-veckors öppen behandlingsfas. Fyrahundratjugonio patienter som svarade på öppen behandling [definierad som att uppfylla följande kriterier vid veckorna 24 och 26: en minskning från baseline HAM-A totalpoäng med minst 50 % till en poäng som inte är högre än 11, och ett Clinical Global Impressions of Improvement (CGI-Improvement)-poäng på 1 eller 2] tilldelades slumpmässigt till fortsättning av CYMBALTA 30 mg i samma dos (N=216) eller till placebo (N=213) och observerades för återfall. Av de randomiserade patienterna hade 73 % varit i responsstatus i minst 10 veckor. Återfall definierades som en ökning av CGI-allvarlighetspoängen med minst 2 poäng till en poäng ≥4 och en MINI-diagnos (Mini-International Neuropsychiatric Interview) av GAD (exklusive varaktighet), eller avbrott på grund av bristande effekt. Patienter som tog CYMBALTA fick en statistiskt signifikant längre tid till återfall av GAD än patienter som fick placebo (se figur 2 ).
Subgruppsanalyser tydde inte på att det fanns några skillnader i behandlingsresultat som funktion av ålder eller kön.
GAD-försök hos geriatriska patienter
Effekten av CYMBALTA vid behandling av patienter ≥65 år med GAD fastställdes i en 10-veckors flexibel dos, randomiserad, dubbelblind, placebokontrollerad studie på vuxna ≥65 år som uppfyller DSM-IV-kriterierna för GAD (Studie GAD-5). I studie GAD-5 var startdosen 30 mg en gång dagligen i 2 veckor innan ytterligare dosökningar i 30 mg-steg vid behandlingsveckorna 2, 4 och 7 upp till 120 mg en gång dagligen tillåts baserat på utredarens bedömning av kliniskt svar och tolerabilitet. Medeldosen för patienter som fullföljde den 10 veckor långa akuta behandlingsfasen var 51 mg. Patienter som behandlats med CYMBALTA (N=151) visade signifikant större förbättring jämfört med placebo (N=140) på genomsnittlig förändring från baslinje till effektmått mätt med HAM-A totalpoäng (se ).
GAD-försök hos pediatriska patienter 7 till 17 år gamla
Effekten av CYMBALTA vid behandling av pediatriska patienter 7 till 17 år med GAD fastställdes i 1 randomiserad, dubbelblind, placebokontrollerad prövning med flexibel dos på pediatriska polikliniska patienter med GAD (baserat på DSM-IV-kriterier) (Studie) GAD-6).
I studie GAD-6 var startdosen 30 mg en gång dagligen i 2 veckor. Ytterligare dosökningar i steg om 30 mg upp till 120 mg en gång dagligen tillåts baserat på utredarens bedömning av kliniskt svar och tolerabilitet. Medeldosen för patienter som fullbordade den 10 veckor långa behandlingsfasen var 57,6 mg/dag. I denna studie visade CYMBALTA (N=135) överlägsenhet gentemot placebo (N=137) från baslinje till effektmått mätt som en större förbättring i Pediatric Anxiety Rating Scale (PARS) för GAD-svårighetspoäng (se ).
Figur 2: Kumulativ proportion av vuxna patienter med GAD-återfall (studie GAD-4)
Diabetisk perifer neuropatisk smärta hos vuxna
Effekten av CYMBALTA 30 mg för behandling av neuropatisk smärta associerad med diabetisk perifer neuropati hos vuxna fastställdes i 2 randomiserade, 12 veckor långa, dubbelblinda, placebokontrollerade, fasta dosstudier på vuxna patienter med diabetisk perifer neuropatisk smärta (DPNP) ) i minst 6 månader (studie DPNP-1 och studie DPNP-2). Dessa prövningar inkluderade totalt 791 patienter, av vilka 592 (75%) fullföljde prövningarna. De inskrivna patienterna hade typ I eller II diabetes mellitus med diagnosen smärtsam distal symmetrisk sensorimotorisk polyneuropati i minst 6 månader. Patienterna hade ett smärtpoäng på ≥4 på en 11-gradig skala från 0 (ingen smärta) till 10 (värsta möjliga smärta). Patienterna tilläts upp till 4 gram paracetamol per dag vid behov för smärta, förutom CYMBALTA. Patienterna registrerade sin smärta dagligen i en dagbok.
Båda studierna jämförde CYMBALTA 60 mg en gång dagligen eller 60 mg två gånger dagligen med placebo. Studien DPNP-1 jämförde dessutom CYMBALTA 20 mg med placebo. Totalt 457 patienter (342 CYMBALTA, 115 placebo) inkluderades i studie DPNP-1 och totalt 334 patienter (226 CYMBALTA, 108 placebo) inkluderades i studie DPNP-2.
Behandling med CYMBALTA 60 mg en eller två gånger om dagen förbättrade statistiskt signifikant de genomsnittliga smärtpoängen för endpointen från baslinjen och ökade andelen patienter med minst 50 % minskning av smärtpoängen från baslinjen. För olika grader av förbättring av smärta från baslinjen till studiens slutpunkt, visar figurerna 3 och 4 andelen patienter som uppnår den graden av förbättring i studierna DPNP-1 respektive DPNP-2. Siffrorna är kumulativa, så att patienter vars förändring från utgångsvärdet är till exempel 50 %, också ingår vid varje förbättringsnivå under 50 %. Patienter som inte fullföljde studien tilldelades 0 % förbättring. Vissa patienter upplevde en minskning av smärtan redan i vecka 1, vilket kvarstod under hela försöket.
Figur 3: Procentandel av DPNP-vuxna patienter som uppnår olika nivåer av smärtlindring mätt med 24-timmars genomsnittlig smärta (Studie DPNP-1)
Figur 4: Andel av DPNP-vuxna patienter som uppnår olika nivåer av smärtlindring mätt med 24-timmars genomsnittlig smärta (Studie DPNP-2)
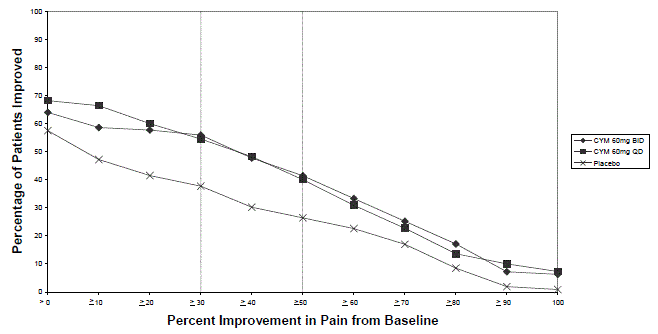
Fibromyalgi
Vuxenförsök inom fibromyalgi
Effekten av CYMBALTA för behandling av fibromyalgi hos vuxna fastställdes i två randomiserade, dubbelblinda, placebokontrollerade, fasta dosstudier på vuxna patienter som uppfyller American College of Rheumatologys kriterier för fibromyalgi (en historia av utbredd smärta i 3 månader) och smärta närvarande vid 11 eller fler av de 18 specifika ömma punkterna). Studie FM-1 var tre månader lång och inkluderade endast kvinnliga patienter. Studien FM-2 var sex månader lång och inkluderade manliga och kvinnliga patienter. Ungefär 25 % av deltagarna hade en komorbid diagnos av MDD. Studierna FM1 och FM-2 inkluderade totalt 874 patienter av vilka 541 (62%) fullföljde studierna. Totalt 354 patienter (234 CYMBALTA 40 mg, 120 placebo) deltog i studie FM-1 och totalt 520 patienter (376 CYMBALTA, 144 placebo) deltog i studie FM-2 (5 % män, 95 % kvinnor). Patienterna hade en baslinjesmärtpoäng på 6,5 på en 11-gradig skala från 0 (ingen smärta) till 10 (värre möjlig smärta).
Studierna FM-1 och FM-2 jämförde CYMBALTA 60 mg en gång dagligen eller 120 mg dagligen (given i uppdelade doser i studie FM-1 och som en engångsdos i studie FM-2) med placebo. Studie FM-2 jämförde dessutom CYMBALTA 20 mg med placebo under de första tre månaderna av en sex månader lång studie.
Behandling med CYMBALTA 60 mg eller 120 mg dagligen förbättrade statistiskt signifikant de genomsnittliga smärtpoängen för endpointen från baslinjen och ökade andelen patienter med minst 50 % minskning av smärtpoängen från baslinjen. Smärtminskning observerades hos patienter både med och utan komorbid MDD. Graden av smärtreduktion kan dock vara större hos patienter med komorbid MDD. För olika grader av förbättring av smärta från baslinje till studiens slutpunkt visar figurerna 5 och 6 andelen patienter som uppnår den graden av förbättring i studierna FM-1 respektive FM-2. Siffrorna är kumulativa så att patienter vars förändring från baseline är till exempel 50 %, också inkluderas vid varje förbättringsnivå under 50 %. Patienter som inte fullföljde studien tilldelades 0 % förbättring. Vissa patienter upplevde en minskning av smärtan redan i vecka 1, vilket kvarstod under hela försöket. Förbättring visades också på funktionsmått (Fibromyalgia Impact Questionnaires) och patientens globala intryck av förändring (PGI). Ingen av studierna visade en fördel på 120 mg jämfört med 60 mg, och en högre dos var associerad med fler biverkningar och för tidigt avbrytande av behandlingen.
Figur 5: Andel av vuxna fibromyalgipatienter som uppnår olika nivåer av smärtlindring vid studiens slutpunkt mätt med 24-timmars genomsnittlig smärta (Studie FM-1)
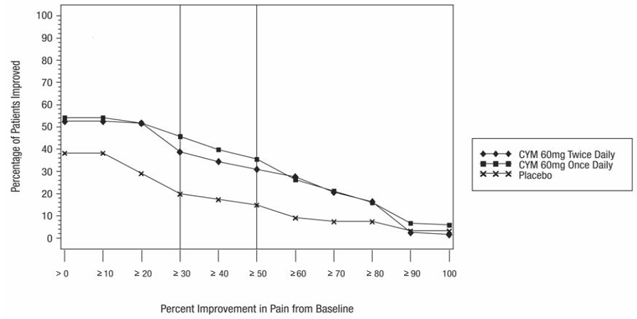
Figur 6: Andel av vuxna fibromyalgipatienter som uppnår olika nivåer av smärtlindring vid studiens slutpunkt mätt med 24-timmars genomsnittlig smärtsvårighet (studie FM-2)
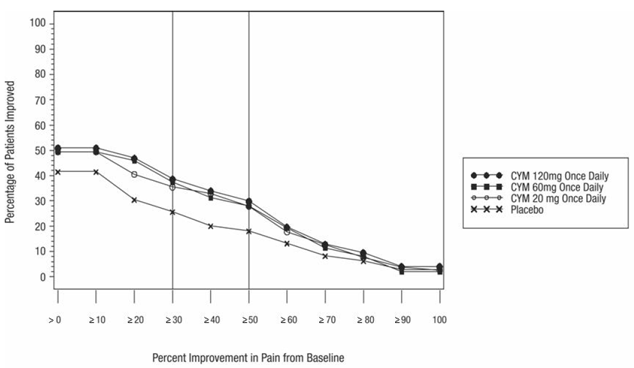
Dessutom utvärderades fördelen med upptitrering hos icke-svarare på CYMBALTA vid 60 mg/dag i en separat studie (studie FM-3). Vuxna patienter behandlades initialt med CYMBALTA 60 mg en gång dagligen i åtta veckor på ett öppet sätt. Därefter randomiserades personer som slutfört denna fas till dubbelblind behandling med CYMBALTA med antingen 60 mg en gång dagligen eller 120 mg en gång dagligen. Responders definierades som patienter som hade minst 30 % minskning av smärtpoängen från baslinjen vid slutet av den 8 veckor långa behandlingen. Patienter som inte svarade efter 8 veckor var inte mer benägna att uppfylla svarskriterier vid slutet av 60 veckors behandling om de blev blint titrerade till CYMBALTA 120 mg jämfört med de som fortsatte med CYMBALTA 60 mg.
Pediatrisk prövning i fibromyalgi
CYMBALTA studerades på 184 pediatriska patienter i åldern 13 till 17 år med juvenilt fibromyalgisyndrom i en 13-veckors placebokontrollerad studie (studie FM-4). I studie FM-4 fullföljde 149 (81%) patienter studien. CYMBALTA (N=91) initierades med en dos på 30 mg en gång dagligen under en vecka och titrerades till 60 mg en gång dagligen i 12 veckor, allt efter tolerans. Medeldosen för patienter som fullbordade den 12 veckor långa behandlingsfasen var 49 mg/dag. CYMBALTA visade förbättring jämfört med placebo på det primära effektmåttet [förändring från baslinje till behandlingsslut på Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-timmars medelvärde för smärta] med ett p-värde på 0,052 från den fördefinierade primära analysen och p-värden som sträcker sig från 0,011-0,020 från känslighetsanalyser som tilldelade baslinjevärden till uteblivna bedömningar av vissa patienter som av olika anledningar inte fullföljde studien. Patienterna hade en baslinje BPI på 5,7. För olika grader av förbättring av smärta från baslinjen till studiens slutpunkt, visar figur 7 andelen patienter som uppnår den graden av förbättring i studie FM-4.
Figur 7: Andel pediatriska patienter i åldrarna 13 till 17 år med juvenilt fibromyalgisyndrom som uppnår olika nivåer av smärtlindring vid vecka 12 (Studie FM-4)a
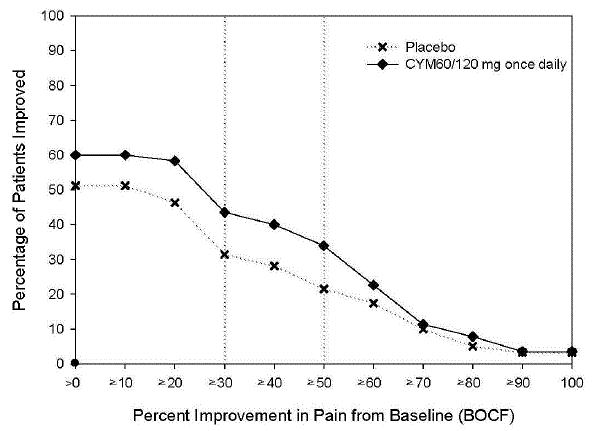
Kronisk muskuloskeletal smärta hos vuxna
CYMBALTA är indicerat för behandling av kronisk muskuloskeletal smärta hos vuxna. Detta har fastställts i studier på vuxna patienter med kronisk ländryggssmärta och kronisk smärta på grund av artros.
Försök med kronisk ländryggssmärta hos vuxna
Effekten av CYMBALTA 60 mg vid kronisk ländryggssmärta (CLBP) hos vuxna utvärderades i två dubbelblinda, placebokontrollerade, randomiserade kliniska studier av 13 veckors varaktighet (studier CLBP-1 och CLBP-2), och en av 12 -veckors varaktighet (CLBP-3). Studier CLBP-1 och CLBP-3 visade effektiviteten av CYMBALTA vid behandling av CLBP. Patienterna i alla studier hade inga tecken på radikulopati eller spinal stenos.
Studera CLBP-1
Tvåhundratrettiosex vuxna patienter (N=115 på CYMBALTA 40 mg, N=121 på placebo) inkluderades och 182 (77 %) fullbordade en 13-veckors behandlingsfas. Efter 7 veckors behandling fick CYMBALTA-behandlade patienter med mindre än 30 % minskning av genomsnittlig daglig smärta och som kunde tolerera 60 mg en gång dagligen sin CYMBALTA-dos, på ett dubbelblindat sätt, ökad till 120 mg en gång dagligen för återstoden av rättegången. Patienterna hade ett genomsnittligt smärtvärde på 6 på en numerisk betygsskala från 0 (ingen smärta) till 10 (värsta möjliga smärta). Efter 13 veckors behandling hade patienter som tog CYMBALTA 60-120 mg dagligen en signifikant större smärtreduktion jämfört med patienter som fick placebo. Randomiseringen stratifierades efter patienternas baslinjeanvändningsstatus för NSAID. Subgruppsanalyser tydde inte på att det fanns skillnader i behandlingsresultat som en funktion av användning av NSAID.
Studera CLBP-2
Fyrahundrafyra patienter randomiserades till att få fasta doser av CYMBALTA 60 mg dagligen eller en matchande placebo (N=59 på CYMBALTA 20 mg, N=116 på CYMBALTA 60 mg, N=112 på CYMBALTA 120 mg, N=117 på placebo) och 267 (66%) fullföljde hela den 13 veckor långa studien. Efter 13 veckors behandling visade ingen av de tre CYMBALTA 30 mg-doserna en statistiskt signifikant skillnad i smärtreduktion jämfört med placebo.
Studera CLBP-3
Fyrahundra och en patienter randomiserades till att få fasta doser av CYMBALTA 60 mg dagligen eller placebo (N=198 på CYMBALTA 20 mg, N=203 på placebo), och 303 (76%) fullföljde studien. Patienterna hade ett genomsnittligt smärtvärde på 6 på en numerisk betygsskala från 0 (ingen smärta) till 10 (värsta möjliga smärta). Efter 12 veckors behandling hade patienter som tog CYMBALTA 60 mg dagligen signifikant större smärtreduktion jämfört med patienter som fick placebo.
För olika grader av förbättring av smärta från baslinjen till studiens slutpunkt, visar figurerna 8 och 9 andelen patienter i studierna CLBP-1 respektive CLBP-3 som uppnår den graden av förbättring. Siffrorna är kumulativa, så att patienter vars förändring från utgångsvärdet är till exempel 50 %, också ingår vid varje förbättringsnivå under 50 %. Patienter som inte fullföljde studien tilldelades värdet 0 % förbättring.
Figur 8: Procentandel vuxna patienter med CLBP som uppnår olika nivåer av smärtlindring mätt som 24-timmars genomsnittlig smärtsvårighet (studie CLBP-1)
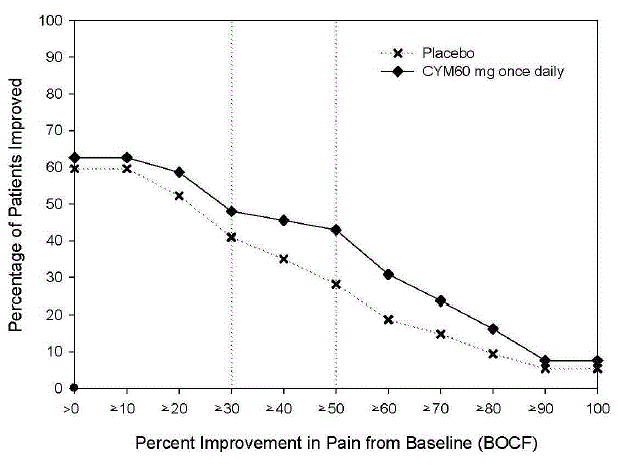
Figur 9: Andel vuxna patienter med CLBP som uppnår olika nivåer av smärtlindring, mätt med 24-timmars genomsnittlig smärtsvårighet (studie CLBP-3)
Försök med kronisk smärta på grund av artros hos vuxna
Effekten av CYMBALTA vid kronisk smärta på grund av artros (OA) hos vuxna utvärderades i 2 dubbelblinda, placebokontrollerade, randomiserade kliniska studier av 13 veckors varaktighet (studie OA-1 och studie OA-2). Alla patienter i båda studierna uppfyllde de kliniska och radiografiska kriterierna för ACR för klassificering av idiopatisk artrose i knäet. Randomisering stratifierades efter patienternas baslinjeanvändningsstatus för NSAID.
Patienter som tilldelats CYMBALTA påbörjade behandlingen i båda studierna med en dos på 30 mg en gång dagligen under en vecka. Efter den första veckan ökades dosen av CYMBALTA till 60 mg en gång dagligen. Efter 7 veckors behandling med CYMBALTA 60 mg en gång dagligen fick i studie OA-1 patienter med suboptimalt svar på behandlingen (
Studera OA-1
Tvåhundrafemtiosex patienter (N=128 på CYMBALTA 30 mg, N=128 på placebo) registrerades och 204 (80%) fullföljde studien. Patienterna hade ett genomsnittligt smärtvärde på 6 på en numerisk betygsskala från 0 (ingen smärta) till 10 (värsta möjliga smärta). Efter 13 veckors behandling hade patienter som tog CYMBALTA 20 mg signifikant större smärtreduktion än patienter som fick placebo. Subgruppsanalyser tydde inte på att det fanns skillnader i behandlingsresultat som en funktion av användning av NSAID.
Studera OA-2
Tvåhundratrettioen patienter (N=111 på CYMBALTA 30 mg, N=120 på placebo) registrerades och 173 (75%) fullföljde studien. Patienterna hade en genomsnittlig baslinjesmärta på 6 på en numerisk betygsskala från 0 (ingen smärta) till 10 (värsta möjliga smärta). Efter 13 veckors behandling visade patienter som tog CYMBALTA 20 mg inte en signifikant större smärtreduktion än patienter som fick placebo.
studie OA-1, för olika grader av förbättring av smärta från baslinje till studieändpunkt, visar figur 10 andelen patienter som uppnår den graden av förbättring. Siffran är kumulativ, så att patienter vars förändring från baseline är t.ex. 50 %, också inkluderas vid varje förbättringsnivå under 50 %. Patienter som inte fullföljde studien tilldelades värdet 0 % förbättring.
Figur 10: Andel vuxna patienter med OA som uppnår olika nivåer av smärtlindring mätt som 24-timmarsgenomsnittlig smärtsvårighet (studie OA-1)
PATIENTINFORMATION
Cymbalta® [sim-BALL-tah] (duloxetin kapslar med fördröjd frisättning)
Läs denna medicinguide innan du börjar ta Cymbalta® och varje gång du får en påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling.
Prata med din vårdgivare om:
- alla risker och fördelar med behandling med antidepressiva läkemedel
- alla behandlingsval för depression eller annan allvarlig psykisk sjukdom
Vilken är den viktigaste informationen jag bör veta om antidepressiva läkemedel, depression, andra allvarliga psykiska sjukdomar och självmordstankar eller -handlingar?
- Var noga uppmärksam på alla förändringar i humör, beteende, handlingar, tankar eller känslor, särskilt plötsliga förändringar. Detta är mycket viktigt när ett antidepressivt läkemedel påbörjas eller när dosen ändras.
- Ring din vårdgivare direkt för att rapportera nya eller plötsliga förändringar i humör, beteende, tankar eller känslor.
- Håll alla uppföljningsbesök hos din vårdgivare som planerat. Ring din vårdgivare mellan besöken vid behov, särskilt om du är orolig för symtom.
Ring din vårdgivare omedelbart om du har något av följande symtom eller känslor, särskilt om de är nya, värre eller oroar dig. I en nödsituation ring 911.
- försök att begå självmord
- agerar på farliga impulser
- agerar aggressivt, är arg eller våldsam
- tankar om självmord eller att dö
- ny eller värre depression
- ny eller värre ångest
- panikattacker
- känner sig väldigt upprörd eller rastlös
- ny eller värre irritabilitet
- sömnproblem
- en extrem ökning av aktivitet eller prat (mani)
- andra ovanliga förändringar i beteende eller humör
Vad mer behöver jag veta om antidepressiva läkemedel?
- Sluta aldrig med ett antidepressivt läkemedel utan att först prata med en vårdgivare. Att plötsligt stoppa ett antidepressivt läkemedel kan orsaka andra symtom.
- Antidepressiva medel är läkemedel som används för att behandla depression och andra sjukdomar. Det är viktigt att diskutera alla risker med att behandla depression och även riskerna med att inte behandla den. Patienter bör diskutera alla behandlingsval med din vårdgivare, inte bara användningen av antidepressiva.
- Antidepressiva läkemedel har andra biverkningar. Prata med din vårdgivare om biverkningarna av läkemedlet som ordinerats till dig eller din familjemedlem.
- Antidepressiva läkemedel kan interagera med andra läkemedel. Känn till alla läkemedel som du eller din familjemedlem tar. Håll en lista över alla läkemedel för att visa din vårdgivare. Börja inte med nya läkemedel utan att först kontrollera med din vårdgivare.
Vad är Cymbalta 60mg?
Cymbalta är ett receptbelagt läkemedel som används för att behandla en viss typ av depression som kallas Major Depressive Disorder (MDD). Cymbalta 20mg tillhör en klass av läkemedel som kallas SNRI (orserotonin-noradrenalinåterupptagshämmare).
Cymbalta 60mg används också för att behandla eller hantera:
- Generaliserat ångestsyndrom (GAD)
- Diabetisk perifer neuropatisk smärta (DPNP)
- Fibromyalgi (FM)
- Kronisk muskuloskeletal smärta
Vem ska inte ta Cymbalta?
Ta inte Cymbalta 20 mg om du:
- ta en monoaminoxidashämmare (MAO-hämmare). Fråga din vårdgivare eller apotekspersonal om du är osäker på om du tar en MAO-hämmare, inklusive antibiotikumet linezolid eller intravenöst metylenblått.
- Ta inte en MAO-hämmare inom 5 dagar efter att du avslutat Cymbalta såvida inte din vårdgivare uppmanas att göra det.
- Starta inte Cymbalta om du slutat ta en MAO-hämmare under de senaste 14 dagarna såvida inte din läkare har beordrat det.
Personer som tar Cymbalta 60 mg nära en MAO-hämmare kan ha ett allvarligt problem som kallas serotoninsyndrom (se "Vilka är de möjliga biverkningarna av Cymbalta 60 mg?").
Vad ska jag berätta för min vårdgivare innan jag tar Cymbalta?
Innan du börjar med Cymbalta, berätta för din vårdgivare om du:
- har hjärtproblem eller högt blodtryck
- har diabetes (Cymbalta 40 mg behandling gör det svårare för vissa personer med diabetes att kontrollera sitt blodsocker)
- har leverproblem
- har njurproblem
- har glaukom
- har eller haft kramper eller kramper
- har bipolär sjukdom eller mani
- har låga natriumnivåer i ditt blod
- har försenad magtömning
- har eller haft blödningsproblem
- är gravid eller planerar att bli gravid. Cymbalta kan skada ditt ofödda barn. Tala med din läkare om risken för ditt ofödda barn om du tar Cymbalta under graviditeten.
- Berätta genast för din vårdgivare om du blir gravid eller tror att du är gravid under behandling med Cymbalta.
- Om du blir gravid medan du tar Cymbalta 30mg, prata med din vårdgivare om att registrera dig hos Cymbalta Pregnancy Registry. Du kan registrera dig genom att ringa 1-866-8146975 eller genom att besöka www.cymbalta 40mgpregnancyregistry.com. Syftet med detta register är att övervaka graviditetsresultaten hos kvinnor som har behandlats med Cymbalta när som helst under graviditeten.
- ammar eller planerar att amma. Cymbalta går över i din bröstmjölk och kan skada ditt barn. Prata med din vårdgivare om det bästa sättet att mata ditt barn medan du tar Cymbalta.
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Cymbalta och vissa läkemedel kan interagera med varandra, kanske inte fungera lika bra eller kan orsaka allvarliga biverkningar.
Berätta särskilt för din vårdgivare om du tar:
- triptaner som används för att behandla migränhuvudvärk
- läkemedel som används för att behandla humör, ångest, psykotiska störningar eller tankestörningar, inklusive tricykliska läkemedel, litium, buspiron, SSRI, SNRI eller MAO-hämmare
- tramadol och fentanyl
- amfetamin
- cimetidin
- antibiotikan ciprofloxacin, enoxacin
- läkemedel för att behandla oregelbunden hjärtfrekvens (som propafenon, flekainid, kinidin)
- teofyllin
- det blodförtunnare warfarinet (Coumadin, Jantoven)
- icke-steroida antiinflammatoriska läkemedel (NSAID) (som ibuprofen, naproxen eller aspirin).
- receptfria kosttillskott som tryptofan eller johannesört
- tioridazin (Mellaril). Mellaril tillsammans med Cymbalta kan orsaka allvarliga hjärtrytmproblem eller plötslig död.
Fråga din vårdgivare om en lista över dessa läkemedel om du är osäker.
Ta inte Cymbalta tillsammans med något annat läkemedel som innehåller duloxetin.
Hur ska jag ta Cymbalta 60mg?
- Ta Cymbalta exakt som din läkare säger åt dig att ta det. Din vårdgivare kan behöva ändra dosen av Cymbalta 20 mg tills det är rätt dos för dig.
- Svälj Cymbalta hel. Tugga eller krossa inte Cymbalta.
- Öppna inte kapseln och strö inte på mat eller blanda med vätska. Att öppna kapseln kan påverka hur väl Cymbalta fungerar.
- Cymbalta kan tas med eller utan mat.
- Om du missar en dos av Cymbalta 30 mg, ta den missade dosen så snart du kommer ihåg det. Om det nästan är dags för nästa dos, hoppa över den missade dosen och ta din nästa dos vid vanlig tidpunkt. Ta inte två doser Cymbalta 30 mg samtidigt.
- Om du tar för mycket Cymbalta, ring din vårdgivare eller giftkontrollcentral på 1800-222-1222 direkt, eller få akutvård.
- När du byter från ett annat antidepressivt läkemedel till Cymbalta kanske din vårdgivare vill sänka dosen av det initiala antidepressiva medlet först för att eventuellt undvika biverkningar.
Vad ska jag undvika när jag tar Cymbalta?
- Cymbalta kan orsaka sömnighet eller kan påverka din förmåga att fatta beslut, tänka klart eller reagera snabbt. Du ska inte köra bil, använda tunga maskiner eller göra andra farliga aktiviteter förrän du vet hur Cymbalta påverkar dig.
- Användning av Cymbalta samtidigt med stort alkoholintag kan vara associerat med allvarlig leverskada. Undvik kraftig alkoholanvändning när du tar Cymbalta.
Vilka är de möjliga biverkningarna av Cymbalta?
Cymbalta 30mg kan orsaka allvarliga biverkningar, inklusive: Se "Vad är den viktigaste informationen jag bör veta om Cymbalta?"
Vanliga möjliga biverkningar hos personer som tar Cymbalta 20mg inkluderar:
Symtom hos män kan inkludera:
Symtom hos kvinnor kan inkludera:
Tala med din vårdgivare om du utvecklar några förändringar i din sexuella funktion eller om du har några frågor eller funderingar kring sexuella problem under behandling med CYMBALTA. Det kan finnas behandlingar som din vårdgivare kan föreslå.
- klåda
- höger övre buksmärta
- mörk urin
- gul hud eller ögon
- förstorad lever
- ökade leverenzymer
- öka ditt blodtryck.
- minska ditt blodtryck när du står och orsaka yrsel eller svimning, mestadels när du börjar med Cymbalta eller när du ökar dosen.
- öka risken för fall, särskilt hos äldre.
- agitation, hallucinationer, koma eller andra förändringar i mental status
- koordinationsproblem eller muskelryckningar (överaktiva reflexer)
- snabba hjärtslag, högt eller lågt blodtryck
- svettningar eller feber
- illamående, kräkningar eller diarré
- muskelstelhet
- yrsel
- spolning
- darrning
- anfall
- ångest
- irritabilitet
- trötthet eller sömnproblem
- huvudvärk
- svettas
- yrsel
- elektriska stötar
- kräkningar eller illamående
- diarre
- kraftigt ökad energi
- svåra sömnproblem
- racing tankar
- hänsynslöst beteende
- ovanligt storslagna idéer
- överdriven lycka eller irritabilitet
- prata mer eller snabbare än vanligt
Endast vissa människor är i riskzonen för dessa problem. Du kanske vill genomgå en ögonundersökning för att se om du är i riskzonen och få förebyggande behandling om du är det.
- ögonsmärta
- förändringar i synen
- svullnad eller rodnad i eller runt ögat
- huvudvärk
- svaghet eller att känna sig ostadig
- förvirring, problem med att koncentrera sig eller tänka eller minnesproblem
- ökat urinflöde
- kan inte kissa
- försenad utlösning eller oförmåga att få utlösning
- minskad sexlust
- problem att få eller behålla erektion
- minskad sexlust
- försenad orgasm eller oförmåga att få orgasm
De vanligaste biverkningarna av Cymbalta 20mg inkluderar:
- illamående
- torr mun
- sömnighet
- Trötthet
- förstoppning
- aptitlöshet
- ökad svettning
- yrsel
Vanliga möjliga biverkningar hos barn och ungdomar som tar Cymbalta 20 mg inkluderar:
- illamående
- minskad vikt
- yrsel
Biverkningar hos vuxna kan även förekomma hos barn och ungdomar som tar Cymbalta. Barn och ungdomar bör övervakas längd och vikt under behandlingen.
Berätta för din vårdgivare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Cymbalta. För mer information, fråga din vårdgivare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till 1800-FDA-1088.
Hur ska jag förvara Cymbalta 40mg?
Förvara Cymbalta i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
Förvara Cymbalta och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av Cymbalta.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en medicinguide. Använd inte Cymbalta för ett tillstånd som det inte ordinerats för. Ge inte Cymbalta 20 mg till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna medicinguide sammanfattar den viktigaste informationen om Cymbalta. Om du vill ha mer information, prata med din vårdgivare. Du kan fråga din vårdgivare på apoteket om information om Cymbalta som är skriven för vårdpersonal.
För mer information, ring 1-800-545-5979.
Vilka är ingredienserna i Cymbalta 30mg?
Aktiv ingrediens: duloxetinhydroklorid
Inaktiva Ingredienser:
FD&C Blue No. 2, gelatin, hypromellos, hydroxipropylmetylcellulosaacetatsuccinat, natriumlaurylsulfat, sackaros, sockersfärer, talk, titandioxid och trietylcitrat. Kapslarna på 20 och 60 mg innehåller också gul järnoxid.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
