Eskalith 300mg Lithium carbonate Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Eskalith och hur används det?
Eskalith 300mg är ett receptbelagt läkemedel som används för att behandla symtomen på bipolär sjukdom. Eskalith 300mg kan användas ensamt eller tillsammans med andra läkemedel.
Eskalith 300mg tillhör en klass av läkemedel som kallas medel för bipolär sjukdom.
Det är inte känt om Eskalith är säkert och effektivt för barn yngre än 7 år.
Vilka är de möjliga biverkningarna av Eskalith?
Eskalith 300mg kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- muskelsvaghet,
- ryckningar,
- dåsighet,
- yrsel,
- humörförändringar,
- suddig syn,
- ringer i dina öron,
- oregelbundna hjärtslag,
- förvirring,
- sluddrigt tal,
- klumpighet,
- problem att andas,
- anfall,
- andnöd,
- feber,
- ökad törst eller urinering,
- svaghet,
- yrsel,
- snurrande känsla,
- minnesproblem,
- hallucinationer,
- problem med balans eller muskelrörelser,
- förlust av kontroll över tarmen eller urinblåsan,
- beslag,
- känner mig väldigt törstig eller varm,
- oförmåga att urinera,
- kraftig svettning,
- varm och torr hud,
- svår huvudvärk,
- ringer i dina öron,
- illamående,
- synproblem,
- smärta bakom dina ögon,
- agitation,
- feber
- ,
- huttrar,
- snabb puls,
- muskelstelhet,
- ryckningar,
- förlust av koordination, och
- diarre
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Eskalith 300mg inkluderar:
- yrsel,
- dåsighet,
- skakningar i dina händer,
- problem med att gå,
- torr mun,
- ökad törst eller urinering,
- illamående,
- kräkningar,
- aptitlöshet,
- magont,
- kall känsla,
- missfärgning i dina fingrar eller tår,
- utslag, och
- suddig syn
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Eskalith. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
Litiumtoxicitet är nära relaterad till serumlitiumnivåer och kan förekomma vid doser nära terapeutiska nivåer. Faciliteter för snabba och exakta serumlitiumbestämningar bör finnas tillgängliga innan behandlingen påbörjas (se DOSERING OCH ADMINISTRERING ).
BESKRIVNING
ESKALITH innehåller litiumkarbonat, ett vitt, lätt alkaliskt pulver med molekylformel Li2CO3 och molekylvikt 73,89. Litium är ett grundämne i alkalimetallgruppen med atomnummer 3, atomvikt 6,94 och en emissionslinje vid 671 nm på flamfotometern.
ESKALITH (litiumkarbonat) kapslar: Varje kapsel, med ogenomskinlig grå lock och ogenomskinlig gul kropp, är märkt med produktnamnet ESKALITH (litiumkarbonat) och SB och innehåller litiumkarbonat, 300 mg. Inaktiva ingredienser består av bensylalkohol, cetylpyridiniumklorid, D&C Yellow No. 10, FD&C Green No. 3, FD&C Red No. 40, FD&C Yellow No. 6, gelatin, laktos, magnesiumstearat, povidon, natriumlaurylsulfat, titandioxid, och spårmängder av andra inaktiva ingredienser.
ESKALITH (litiumkarbonat) CR tabletter med kontrollerad frisättning : Varje rund, gul, bikonvex tablett, präglad med SKF och J10 på ena sidan och skåra på andra sidan, innehåller litiumkarbonat, 450 mg. Inaktiva ingredienser består av alginsyra, gelatin, järnoxid, magnesiumstearat och natriumstärkelseglykolat.
ESKALITH (litiumkarbonat) CR-tabletter 450 mg är utformade för att frigöra en del av dosen initialt och resten gradvis; frisättningsmönstret för tabletterna med kontrollerad frisättning minskar variationen i litiumnivåer i blodet som ses med doseringsformerna för omedelbar frisättning.
INDIKATIONER
ESKALITH (litiumkarbonat) är indicerat för behandling av maniska episoder av mano-depressiv sjukdom. Underhållsterapi förhindrar eller minskar intensiteten av efterföljande episoder hos de manodepressiva patienter med en historia av mani.
Typiska symptom på mani inkluderar taltryck, motorisk hyperaktivitet, minskat behov av sömn, idéflykt, storslagenhet, upprymdhet, dåligt omdöme, aggressivitet och möjligen fientlighet. När det ges till en patient som upplever en manisk episod kan ESKALITH (litiumkarbonat) ge en normalisering av symtomen inom 1 till 3 veckor.
DOSERING OCH ADMINISTRERING
Kapslar med omedelbar frisättning ges vanligtvis tid eller qid. Doser av tabletter med kontrollerad frisättning ges vanligtvis två gånger dagligen (cirka 12 timmars intervall). När behandling med litium med omedelbar frisättning eller kontrollerad frisättning påbörjas, måste doseringen anpassas efter serumnivåer och kliniskt svar.
När en patient byter från kapslar med omedelbar frisättning till ESKALITH (litiumkarbonat) CR-tabletter med kontrollerad frisättning, ge samma totala dagliga dos när det är möjligt. De flesta patienter på underhållsbehandling stabiliseras på 900 mg dagligen, t.ex. ESKALITH (litiumkarbonat) CR 450 mg två gånger dagligen När den tidigare dosen av litium med omedelbar frisättning inte är en multipel av 450 mg, t.ex. 1 500 mg, påbörja ESKALITH (litiumkarbonat) ) CR vid multipeln av 450 mg närmast, men under, den ursprungliga dagliga dosen, dvs 1 350 mg. När de 2 doserna är olika, ge den större dosen på kvällen. I exemplet ovan, med en total daglig dos på 1 350 mg, bör i allmänhet 450 mg ESKALITH (litiumkarbonat) CR ges på morgonen och 900 mg ESKALITH (litiumkarbonat) CR på kvällen. Om så önskas kan den totala dagliga dosen på 1 350 mg ges i 3 lika stora doser på 450 mg ESKALITH (litiumkarbonat) CR. Dessa patienter bör övervakas med 1 till 2 veckors intervall, och dosen justeras vid behov, tills stabila och tillfredsställande serumnivåer och kliniskt tillstånd uppnås.
När patienter kräver närmare titrering än vad som är tillgängligt med doser av ESKALITH (litiumkarbonat) CR i steg om 450 mg, ska kapslar med omedelbar frisättning användas.
Akut mani: Optimalt patientsvar på ESKALITH (litiumkarbonat) kan vanligtvis fastställas och bibehållas med 1 800 mg per dag i uppdelade doser. Sådana doser ger normalt den önskade serumlitiumnivån som sträcker sig mellan 1,0 och 1,5 mekv/l.
Doseringen måste anpassas efter serumnivåer och kliniskt svar. Regelbunden övervakning av patientens kliniska tillstånd och serumlitiumnivåer är nödvändig. Serumnivåer bör bestämmas två gånger per vecka under den akuta fasen, och tills serumnivån och patientens kliniska tillstånd har stabiliserats.
Långsiktig kontroll: De önskvärda serumlitiumnivåerna är 0,6 till 1,2 mekv/l. Doseringen kommer att variera från en individ till en annan, men vanligtvis kommer 900 mg till 1 200 mg per dag i uppdelade doser att bibehålla denna nivå. Serumlitiumnivåer i okomplicerade fall som får underhållsbehandling under remission bör övervakas minst varannan månad.
Patienter som är ovanligt känsliga för litium kan uppvisa toxiska tecken vid serumnivåer under 1,0 mEq/L.
OBS! : Blodprover för serumlitiumbestämningar bör tas omedelbart före nästa dos när litiumkoncentrationerna är relativt stabila (dvs. 8 till 12 timmar efter föregående dos). Totalt beroende av serumnivåer får inte vara enbart. Noggrann patientutvärdering kräver både klinisk analys och laboratorieanalys.
Äldre patienter svarar ofta på reducerad dos och kan uppvisa tecken på toxicitet vid serumnivåer som vanligtvis tolereras av yngre patienter.
HUR LEVERERAS
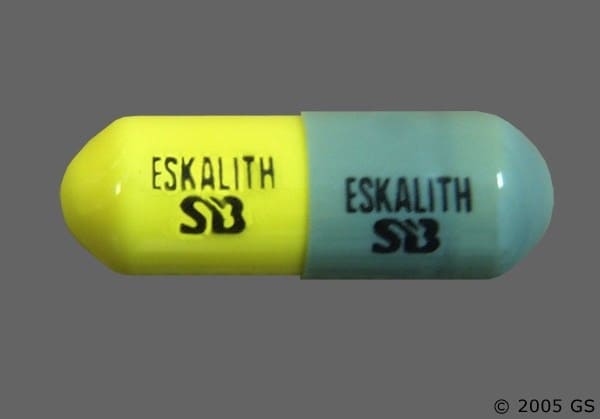
ESKALITH (litiumkarbonat) Kapslar 300 mg är grå och gula kapslar präglade med "ESKALITH (litiumkarbonat)" och "SB" på ena sidan av varje halva av kapseln, i flaskor om 100 (NDC 0007-4007-20).
ESKALITH (litiumkarbonat) CR Tabletter 450 mg är runda, gula, bikonvexa tabletter med kontrollerad frisättning, präglade med "SKF" och "J10" på ena sidan och skåra på den andra sidan, i burkar om 100 (NDC 0007-4010-20).
LAGRINGSFÖRHÅLLANDEN : Förvara vid 25°C (77°F), utflykter tillåtna till 15-30°C (59-86°F) [se USP-kontrollerad rumstemperatur].
Tillverkad av: Cardinal Health., Winchester, KY 40391 för GlaxoSmithKline., Research Triangle Park, NC 27709. September 2003 FDA rev datum: 03/11/2004
BIEFFEKTER
Förekomsten och svårighetsgraden av biverkningar är i allmänhet direkt relaterade till serumlitiumkoncentrationer såväl som till individuella patienters känslighet för litium, och uppträder i allmänhet oftare och med större svårighetsgrad vid högre koncentrationer.
Biverkningar kan uppstå vid serumlitiumnivåer under 1,5 mEq/L. Milda till måttliga biverkningar kan förekomma vid nivåer från 1,5 till 2,5 mEq/L, och måttliga till svåra reaktioner kan ses vid nivåer på 2,0 mEq/L och över.
Fin handtremor, polyuri och mild törst kan förekomma under initial behandling för den akuta maniska fasen och kan kvarstå under hela behandlingen. Övergående och lätt illamående och allmänt obehag kan också uppträda under de första dagarna av litiumtillförsel.
Dessa biverkningar avtar vanligtvis med fortsatt behandling eller en tillfällig minskning eller upphörande av doseringen. Om det är ihållande kan det krävas att litiumbehandlingen avbryts.
Diarré, kräkningar, dåsighet, muskelsvaghet och bristande koordination kan vara tidiga tecken på litiumförgiftning och kan förekomma vid litiumnivåer under 2,0 mEq/L. Vid högre nivåer kan ataxi, yrsel, tinnitus, dimsyn och en stor mängd utspädd urin ses. Serumlitiumnivåer över 3,0 mEq/L kan ge en komplex klinisk bild som involverar flera organ och organsystem. Serumlitiumnivåerna bör inte tillåtas överstiga 2,0 mEq/L under den akuta behandlingsfasen.
Följande reaktioner har rapporterats och verkar vara relaterade till serumlitiumnivåer, inklusive nivåer inom det terapeutiska området:
Neuromuskulära/Centrala nervsystemet Tremor, muskelöverirritabilitet (fascikulationer, ryckningar, kloniska rörelser av hela extremiteter), hypertonicitet, ataxi, koreo-atetotiska rörelser, hyperaktiv djup senreflex, extrapyramidala symtom inklusive akut dystoni, kugghjulsstyvhet, blackout-anfall, epileptiforma anfall, yrsel, anfall yrsel, nedslagen nystagmus, inkontinens i urin eller avföring, somnolens, psykomotorisk retardation, rastlöshet, förvirring, stupor, koma, tungrörelser, tics, tinnitus, hallucinationer, dåligt minne, långsammare intellektuell funktion, upprörd respons, försämring av organiska hjärnsyndrom, myasthenia gravis (sällan).
Kardiovaskulär : Hjärtarytmi, hypotoni, perifer cirkulationskollaps, bradykardi, sinusknutedysfunktion med svår bradykardi (som kan resultera i synkope).
Gastrointestinala : Anorexi, illamående, kräkningar, diarré, gastrit, svullnad av spottkörteln, buksmärtor, överdriven salivutsöndring, flatulens, matsmältningsbesvär.
Genitourinary Glykosuri, minskat kreatininclearance, albuminuri, oliguri och symtom på nefrogen diabetes insipidus inklusive polyuri, törst och polydipsi.
Dermatologiskt : Uttorkning och förtunning av hår, håravfall, anestesi av hud, akne, kronisk follikulit, xerosis cutis, psoriasis eller dess exacerbation, generaliserad klåda med eller utan utslag, hudsår, angioödem.
Autonom : Dimsyn, torr mun, impotens/sexuell dysfunktion.
Sköldkörtelavvikelser : Euthyroid struma och/eller hypotyreos (inklusive myxödem) åtföljd av lägre T3 och T4. I131-upptaget kan vara förhöjt. (Ser FÖRSIKTIGHETSÅTGÄRDER .) Paradoxalt nog har sällsynta fall av hypertyreos rapporterats.
EEG-förändringar : Diffus bromsning, breddning av frekvensspektrum, potentiering och desorganisering av bakgrundsrytm.
EKG-förändringar: Reversibel tillplattning, isoelektricitet eller inversion av T-vågor. Övrigt: Trötthet, slöhet, övergående scotomat, exoftalmos, uttorkning, viktminskning, leukocytos, huvudvärk, övergående hyperglykemi, hyperkalcemi, hyperparatyreos, överdriven viktökning, ödematös svullnad av anklar eller handleder, metallisk smak, dysgeusi/smakförvrängning, smakförvrängning. , svullna läppar, täthet i bröstet, svullna och/eller smärtsamma leder, feber, polyartralgi, tandkaries.
Vissa rapporter om nefrogen diabetes insipidus, hyperparatyreos och hypotyreos som kvarstår efter utsättning av litium har inkommit.
Ett fåtal rapporter har inkommit om utveckling av smärtsam missfärgning av fingrar och tår och kyla i extremiteterna inom en dag efter påbörjad behandling med litium. Mekanismen genom vilken dessa symtom (som liknar Raynauds syndrom) utvecklades är inte känd. Återhämtning följde avbrott.
Fall av pseudotumor cerebri (förhöjt intrakraniellt tryck och papillödem) har rapporterats vid användning av litium. Om det inte upptäcks kan detta tillstånd resultera i förstoring av den blinda fläcken, förträngning av synfält och eventuell blindhet på grund av optisk atrofi. Litium bör sättas ut, om det är kliniskt möjligt, om detta syndrom inträffar.
LÄKEMEDELSINTERAKTIONER
Försiktighet bör iakttas när litium och diuretika används samtidigt eftersom diuretika-inducerad natriumförlust kan minska det renala clearance av litium och öka serumlitiumnivåerna med risk för litiumtoxicitet. Patienter som får sådan kombinerad behandling bör kontrolleras noggrant med serumlitiumnivåer och litiumdosen justeras vid behov.
Litiumnivåer bör övervakas noggrant när patienter påbörjar eller avbryter användning av NSAID. I vissa fall har litiumtoxicitet resulterat från interaktioner mellan ett NSAID och litium. Indometacin och piroxikam har rapporterats öka signifikant steady-state litiumkoncentrationer i plasma. Det finns också bevis för att andra icke-steroida antiinflammatoriska medel, inklusive de selektiva cyklooxygenas-2 (COX-2)-hämmarna, har samma effekt. I en studie utförd på friska försökspersoner ökade de genomsnittliga steady-state litiumplasmanivåerna med cirka 17 % hos försökspersoner som fick litium 450 mg två gånger dagligen med celecoxib 200 mg två gånger dagligen jämfört med försökspersoner som enbart fick litium.
Samtidig användning av metronidazol och litium kan provocera litiumtoxicitet på grund av minskat renalt clearance. Patienter som får sådan kombinerad behandling bör övervakas noggrant.
Det finns bevis för att angiotensinomvandlande enzymhämmare, såsom enalapril och kaptopril, och angiotension II-receptorantagonister, såsom losartan, avsevärt kan öka steady-state plasmalitiumnivåer, vilket ibland resulterar i litiumtoxicitet. När sådana kombinationer används kan litiumdoseringen behöva minskas och plasmalitiumnivåerna bör mätas oftare.
Samtidig användning av kalciumkanalblockerare med litium kan öka risken för neurotoxicitet i form av ataxi, skakningar, illamående, kräkningar, diarré och/eller tinnitus. Försiktighet rekommenderas.
Samtidig administrering av litium och selektiva serotoninåterupptagshämmare bör ske med försiktighet eftersom denna kombination har rapporterats resultera i symtom som diarré, förvirring, tremor, yrsel och agitation.
Följande läkemedel kan sänka serumlitiumkoncentrationerna genom att öka utsöndringen av litium i urinen: acetazolamid, urea, xantinpreparat och alkaliserande medel som natriumbikarbonat.
Följande har också visats interagera med litium: metyldopa, fenytoin och karbamazepin.
VARNINGAR
Litium bör i allmänhet inte ges till patienter med signifikant njur- eller kardiovaskulär sjukdom, allvarlig försvagning eller uttorkning eller natriumbrist, eftersom risken för litiumtoxicitet är mycket hög hos sådana patienter. Om den psykiatriska indikationen är livshotande, och om en sådan patient inte svarar på andra åtgärder, kan litiumbehandling utföras med extrem försiktighet, inklusive dagliga serumlitiumbestämningar och anpassning till de vanligtvis låga doser som vanligtvis tolereras av dessa individer. I sådana fall är sjukhusvistelse en nödvändighet.
Kronisk litiumbehandling kan vara associerad med försämring av njurkoncentrationsförmågan, ibland uppträdande som nefrogen diabetes insipidus, med polyuri och polydipsi. Sådana patienter bör hanteras noggrant för att undvika uttorkning med resulterande litiumretention och toxicitet. Detta tillstånd är vanligtvis reversibelt när litium avbryts.
Morfologiska förändringar med glomerulär och interstitiell fibros och nefronatrofi har rapporterats hos patienter på kronisk litiumbehandling. Morfologiska förändringar har också setts hos manodepressiva patienter som aldrig exponerats för litium. Sambandet mellan njurfunktionella och morfologiska förändringar och deras samband med litiumbehandling har inte fastställts.
När njurfunktionen bedöms, för baslinjedata före start av litiumbehandling eller därefter, kan rutinmässig urinanalys och andra tester användas för att utvärdera tubulär funktion (t.ex. urinspecifik vikt eller osmolalitet efter en period av vattenbrist, eller 24-timmars urinvolym ) och glomerulär funktion (t.ex. serumkreatinin eller kreatininclearance). Under litiumbehandling indikerar progressiva eller plötsliga förändringar i njurfunktionen, även inom det normala intervallet, behovet av omvärdering av behandlingen.
Ett encefalopatiskt syndrom (kännetecknat av svaghet, letargi, feber, skakningar och förvirring, extrapyramidala symtom, leukocytos, förhöjda serumenzymer, BUN och FBS) har förekommit hos ett fåtal patienter som behandlats med litium plus ett neuroleptika. I vissa fall följdes syndromet av irreversibel hjärnskada. På grund av ett möjligt orsakssamband mellan dessa händelser och samtidig administrering av litium och neuroleptika, bör patienter som får sådan kombinerad behandling övervakas noggrant med avseende på tidiga tecken på neurologisk toxicitet och behandlingen avbrytas omedelbart om sådana tecken uppträder. Detta encefalopatiska syndrom kan likna eller vara samma som malignt neuroleptikasyndrom (NMS).
Litiumtoxicitet är nära relaterad till serumlitiumnivåer och kan förekomma vid doser nära terapeutiska nivåer (se DOSERING OCH ADMINISTRERING ).
Polikliniska patienter och deras familjer bör varnas för att patienten måste avbryta litiumkarbonatbehandlingen och kontakta sin läkare om sådana kliniska tecken på litiumtoxicitet som diarré, kräkningar, tremor, mild ataxi, dåsighet eller muskelsvaghet uppstår.
Litiumkarbonat kan försämra mentala och/eller fysiska förmågor. Varna patienter för aktiviteter som kräver vakenhet (t.ex. köra fordon eller maskiner).
Litium kan förlänga effekten av neuromuskulära blockerande medel. Därför bör neuromuskulära blockerande medel ges med försiktighet till patienter som får litium.
FÖRSIKTIGHETSÅTGÄRDER
Användning under graviditet: Skadliga effekter på implantation hos råttor, embryoviabilitet hos möss och metabolism in vitro hos råtttestis och mänskliga spermier har tillskrivits litium, liksom teratogenicitet hos subdäggdjursarter och gomspalter hos möss.
Hos människor kan litiumkarbonat orsaka fosterskador när det ges till en gravid kvinna. Data från litiumfödelseregister tyder på en ökning av hjärt- och andra anomalier, särskilt Ebsteins anomali. Om detta läkemedel används till kvinnor i fertil ålder, eller under graviditet, eller om en patient blir gravid medan du tar detta läkemedel, bör patienten informeras om den potentiella faran för fostret.
Användning hos ammande mödrar : Litium utsöndras i modersmjölk. Omvårdnad bör inte utföras under litiumbehandling förutom i sällsynta och ovanliga omständigheter där, enligt läkarens uppfattning, de potentiella fördelarna för modern uppväger möjliga faror för barnet.
Användning hos pediatriska patienter: Eftersom information om säkerheten och effektiviteten av litiumkarbonat hos barn under 12 år inte finns tillgänglig, rekommenderas inte användningen av det till sådana patienter.
Det har förekommit en rapport om ett övergående syndrom av akut dystoni och hyperreflexi hos ett barn på 15 kg som fick i sig 300 mg litiumkarbonat.
Användning hos äldre : Äldre patienter kräver ofta lägre litiumdoser för att uppnå terapeutiska serumnivåer. De kan också uppvisa biverkningar vid serumnivåer som vanligtvis tolereras av yngre patienter.
Allmän : Förmågan att tolerera litium är större under den akuta maniska fasen och minskar när maniska symtom avtar (se DOSERING OCH ADMINISTRERING ).
Fördelningsutrymmet för litium är ungefär det för hela kroppsvattnet. Litium utsöndras främst i urinen med obetydlig utsöndring i avföring. Renal utsöndring av litium är proportionell mot dess plasmakoncentration. Halveringstiden för eliminering av litium är cirka 24 timmar. Litium minskar natriumreabsorption i njurtubuli, vilket kan leda till natriumbrist. Därför är det viktigt för patienten att bibehålla en normal diet, inklusive salt, och ett adekvat vätskeintag (2 500 till 3 000 ml) åtminstone under den initiala stabiliseringsperioden. Minskad tolerans mot litium har rapporterats vara en följd av utdragen svettning eller diarré och, om sådana inträffar, bör tillskott av vätska och salt administreras under noggrann medicinsk övervakning och litiumintaget minskas eller avbrytas tills tillståndet är över.
Förutom svettning och diarré, kan samtidig infektion med förhöjda temperaturer också nödvändiggöra en tillfällig minskning eller avbrytande av medicinering.
Tidigare existerande underliggande sköldkörtelsjukdomar utgör inte nödvändigtvis en kontraindikation mot litiumbehandling; där hypotyreos förekommer, möjliggör noggrann övervakning av sköldkörtelfunktionen under litiumstabilisering och underhåll korrigering av förändrade sköldkörtelparametrar, om sådana finns; där hypotyreos förekommer under litiumstabilisering och underhåll, kan kompletterande sköldkörtelbehandling användas.
ÖVERDOS
De toxiska nivåerna för litium ligger nära de terapeutiska nivåerna. Det är därför viktigt att patienter och deras familjer uppmanas att se upp för tidiga toxiska symtom och att avbryta behandlingen och informera läkaren om de skulle inträffa. Toxiska symtom listas i detalj under BIVERKNINGAR.
Behandling: Ingen specifik motgift mot litiumförgiftning är känd. Tidiga symtom på litiumtoxicitet kan vanligtvis behandlas genom minskning eller upphörande av doseringen av läkemedlet och återupptagande av behandlingen med en lägre dos efter 24 till 48 timmar. I allvarliga fall av litiumförgiftning består det första och främsta målet med behandlingen av att eliminera denna jon från patienten. Behandlingen är i huvudsak densamma som den som används vid barbituratförgiftning: 1) magsköljning, 2) korrigering av vätske- och elektrolytbalans och 3) reglering av njurfunktionen. Urea, mannitol och aminofyllin ger alla betydande ökningar av litiumutsöndring. Hemodialys är ett effektivt och snabbt sätt att avlägsna jonen från den allvarligt giftiga patienten. Infektionsprofylax, regelbunden lungröntgen och bevarande av adekvat andning är avgörande.
KONTRAINDIKATIONER
Ingen information lämnas.
KLINISK FARMAKOLOGI
ÅTGÄRDER
Prekliniska studier har visat att litium förändrar natriumtransporten i nerv- och muskelceller och åstadkommer en förskjutning mot intraneuronal metabolism av katekolaminer, men den specifika biokemiska mekanismen för litiumverkan vid mani är okänd.
PATIENTINFORMATION
Ingen information lämnas. Vänligen se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER avsnitt.
