Remeron 15mg, 30mg Mirtazapine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Remeron och hur används det?
Remeron är ett receptbelagt läkemedel som används för att behandla symtom på depression. Remeron 30mg kan användas ensamt eller tillsammans med andra läkemedel.
Remeron tillhör en klass av läkemedel som kallas antidepressiva medel, alfa-2-antagonister; Antidepressiva medel, Övrigt.
Det är inte känt om Remeron 30mg är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Remeron 30mg?
Remeron kan orsaka allvarliga biverkningar inklusive:
- känner sig rastlös,
- racing tankar,
- minskat behov av sömn,
- ovanligt risktagande beteende,
- känslor av extrem lycka eller sorg,
- vara mer pratsam än vanligt,
- suddig syn,
- tunnelseende,
- ögonsmärta eller svullnad,
- ser glorier runt ljus,
- yrsel,
- feber,
- frossa,
- öm hals,
- munsår,
- förändringar i vikt eller aptit,
- svåra utslag, blåsor eller svullnad på handflatorna eller fotsulorna,
- kramper (kramper),
- huvudvärk,
- förvirring,
- sluddrigt tal,
- allvarlig svaghet,
- kräkningar,
- förlust av koordination, och
- känner sig ostadig
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Remeron inkluderar:
- dåsighet,
- yrsel,
- konstiga drömmar,
- torr mun,
- förstoppning,
- ökad aptit, och
- viktökning
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Remeron. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Suicidalitet och antidepressiva läkemedel
Antidepressiva läkemedel ökade risken jämfört med placebo för suicidtänkande och suicidalitet (suicidalitet) hos barn, ungdomar och unga vuxna i korttidsstudier av egentlig depression (MDD) och andra psykiatriska störningar. Alla som överväger att använda REMERON® (mirtazapin) tabletter eller något annat antidepressivt medel hos barn, ungdomar eller unga vuxna måste balansera denna risk med det kliniska behovet. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det fanns en minskning av risken med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre. Depression och vissa andra psykiatriska störningar är i sig förknippade med ökad risk för självmord. Patienter i alla åldrar som påbörjas med antidepressiv behandling bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet eller ovanliga beteendeförändringar. Familjer och vårdgivare bör informeras om behovet av noggrann observation och kommunikation med förskrivaren. REMERON är inte godkänt för användning hos pediatriska patienter. (Se VARNINGAR: Klinisk försämring och självmordsrisk, PATIENTINFORMATION och FÖRSIKTIGHETSÅTGÄRDER: Pediatrisk användning)
BESKRIVNING
REMERON® (mirtazapin) tabletter är ett oralt administrerat läkemedel. Mirtazapin har en tetracyklisk kemisk struktur och tillhör gruppen piperazinoazepiner. Det betecknas 1,2,3,4,10,14b-hexahydro-2-metylpyrazino[2,1-a]pyrido[2,3-c]bensazepin och har den empiriska formeln C17H19N3. Dess molekylvikt är 265,36. Strukturformeln är följande och det är den racemiska blandningen:
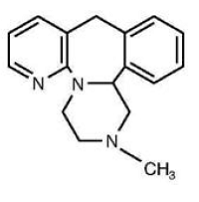
Mirtazapin är ett vitt till krämigt vitt kristallint pulver som är lätt lösligt i vatten.
REMERON tillhandahålls för oral administrering som filmdragerade tabletter med skåra innehållande 15 eller 30 mg mirtazapin och filmdragerade tabletter utan skåror innehållande 45 mg mirtazapin. Varje tablett innehåller också majsstärkelse, hydroxipropylcellulosa, magnesiumstearat, kolloidal kiseldioxid, laktos och andra inaktiva ingredienser.
INDIKATIONER
REMERON (mirtazapin) tabletter är indicerade för behandling av egentlig depression.
Effekten av REMERON vid behandling av egentlig depression fastställdes i 6-veckors kontrollerade prövningar av öppenvårdspatienter vars diagnoser motsvarade närmast Diagnostic and Statistical Manual of Mental Disorders - 3:e upplagan (DSM-III) kategorin av egentlig depression (se KLINISK FARMAKOLOGI ).
En stor depressiv episod (DSM-IV) innebär ett framträdande och relativt ihållande (nästan varje dag i minst 2 veckor) deprimerat eller dysforiskt humör som vanligtvis stör den dagliga funktionen, och inkluderar minst 5 av följande 9 symtom: nedstämdhet, förlust av intresse för vanliga aktiviteter, betydande förändring i vikt och/eller aptit, sömnlöshet eller hypersomni, psykomotorisk agitation eller retardation, ökad trötthet, skuldkänslor eller värdelöshet, långsamt tänkande eller nedsatt koncentrationsförmåga, ett självmordsförsök eller självmordstankar.
Effekten av REMERON 15 mg hos inlagda deprimerade patienter har inte studerats tillräckligt.
Effekten av REMERON 15 mg för att bibehålla ett svar hos patienter med egentlig depression i upp till 40 veckor efter 8 till 12 veckors initial öppen behandling visades i en placebokontrollerad studie. Icke desto mindre bör den läkare som väljer att använda REMERON 15 mg under längre perioder med jämna mellanrum omvärdera läkemedlets långsiktiga användbarhet för den enskilda patienten (se KLINISK FARMAKOLOGI ).
DOSERING OCH ADMINISTRERING
Inledande behandling
Den rekommenderade startdosen för REMERON (mirtazapin) tabletter är 15 mg/dag, administrerad som engångsdos, helst på kvällen före sömn. I de kontrollerade kliniska prövningarna som fastställde effekten av REMERON vid behandling av egentlig depression var det effektiva dosintervallet i allmänhet 15 till 45 mg/dag. Även om sambandet mellan dos och tillfredsställande svar vid behandling av egentlig depression för REMERON 15 mg inte har undersökts tillräckligt, kan patienter som inte svarar på den initiala 15 mg dosen dra nytta av dosökningar upp till maximalt 45 mg/dag. REMERON har en eliminationshalveringstid på cirka 20 till 40 timmar; dosändringar bör därför inte göras med intervall på mindre än 1 till 2 veckor för att ge tillräcklig tid för utvärdering av det terapeutiska svaret på en given dos.
Äldre och patienter med nedsatt njur- eller leverfunktion
Clearance av mirtazapin minskar hos äldre patienter och hos patienter med måttligt till gravt nedsatt njur- eller leverfunktion. Följaktligen bör förskrivaren vara medveten om att plasmanivåerna av mirtazapin kan öka i dessa patientgrupper, jämfört med nivåerna som observerats hos yngre vuxna utan nedsatt njur- eller leverfunktion (se FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ).
Underhåll/Utvidgad behandling
Det är allmänt överens om att akuta episoder av depression kräver flera månader eller längre av långvarig farmakologisk terapi utöver svaret på den akuta episoden. Systematisk utvärdering av REMERON (mirtazapin) tabletter har visat att dess effekt vid egentlig depression bibehålls i perioder på upp till 40 veckor efter 8 till 12 veckors initial behandling med en dos på 15 till 45 mg/dag (se KLINISK FARMAKOLOGI ). Baserat på dessa begränsade data är det okänt om den dos av REMERON 30 mg som behövs för underhållsbehandling är identisk med den dos som behövs för att uppnå ett initialt svar. Patienterna bör regelbundet utvärderas för att fastställa behovet av underhållsbehandling och lämplig dos för sådan behandling.
Byta en patient till eller från en monoaminoxidashämmare (MAO-hämmare) avsedd att behandla psykiatriska störningar
Minst 14 dagar bör förflyta mellan utsättande av en MAO-hämmare avsedd för behandling av psykiatriska störningar och påbörjande av behandling med REMERON (mirtazapin) tabletter. Omvänt bör minst 14 dagar tillåtas efter avslutad REMERON 30 mg innan man påbörjar en MAO-hämmare avsedd att behandla psykiatriska störningar (se KONTRAINDIKATIONER ).
Användning av REMERON 15mg med andra MAO-hämmare, såsom linezolid eller metylenblått
Starta inte REMERON 15 mg hos en patient som behandlas med linezolid eller intravenöst metylenblått eftersom det finns en ökad risk för serotonergt syndrom. Hos en patient som behöver mer akut behandling av ett psykiatriskt tillstånd bör andra insatser, inklusive sjukhusvistelse, övervägas (se KONTRAINDIKATIONER ).
vissa fall kan en patient som redan får behandling med REMERON 30 mg behöva akut behandling med linezolid eller intravenöst metylenblått. Om acceptabla alternativ till linezolid eller intravenös behandling med metylenblått inte finns tillgängliga och de potentiella fördelarna med behandling med linezolid eller intravenös metylenblått bedöms uppväga riskerna för serotonergt syndrom hos en viss patient, ska REMERON 30 mg stoppas omedelbart och linezolid eller intravenös metylen blått kan administreras. Patienten ska övervakas med avseende på symtom på serotonergt syndrom i 2 veckor eller fram till 24 timmar efter den sista dosen av linezolid eller intravenöst metylenblått, beroende på vilket som inträffar först. Behandling med REMERON 30 mg kan återupptas 24 timmar efter den sista dosen av linezolid eller intravenös metylenblått (se VARNINGAR ).
Risken för att administrera metylenblått på icke-intravenös väg (som orala tabletter eller genom lokal injektion) eller i intravenösa doser mycket lägre än 1 mg/kg med REMERON är oklar. Läkaren bör dock vara medveten om möjligheten av uppkommande symtom på serotonergt syndrom vid sådan användning (se VARNINGAR ).
Avbrytande av REMERON-behandling
Symtom associerade med utsättning eller dosreduktion av REMERON 15 mg tabletter har rapporterats. Patienter bör övervakas för dessa och andra symtom när behandlingen avbryts eller under dosreduktion. En gradvis minskning av dosen under flera veckor, snarare än abrupt upphörande, rekommenderas när så är möjligt. Om oacceptabla symtom uppstår efter en minskning av dosen eller efter avslutad behandling, bör dostitrering hanteras på basis av patientens kliniska svar (se FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ).
Information för patienter
Patienter bör informeras om att användning av REMERON kan orsaka mild pupillvidgning, vilket hos känsliga individer kan leda till en episod av glaukom med slutande vinkel. Redan existerande glaukom är nästan alltid glaukom med öppen vinkel eftersom stängningsvinkelglaukom, när det diagnostiseras, kan behandlas definitivt med iridektomi. Öppenvinkelglaukom är inte en riskfaktor för slutvinkelglaukom. Patienter kan vilja undersökas för att avgöra om de är mottagliga för vinkelstängning och genomgå en profylaktisk procedur (t.ex. iridektomi), om de är mottagliga.
HUR LEVERERAS
REMERON (mirtazapin) tabletter levereras som:
15 mg tabletter - oval, skårad, gul, belagd, med "Organon" präglad på ena sidan och "T3Z" på andra sidan.
30 flaskor NDC 0052-0105-30
30 mg tabletter - oval, skårad, rödbrun, belagd, med "Organon" präglad på ena sidan och "T5Z" på andra sidan.
30 flaskor NDC 0052-0107-30
45 mg tabletter — oval, vit, belagd, med "Organon" präglad på ena sidan och "T7Z" på andra sidan.
30 flaskor NDC 0052-0109-30
Lagring
Förvara vid 20°C till 25°C (68°F till 77°F); utflykter tillåtna till 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ]. Skydda mot ljus och fukt.
Tillverkad för: Merck Sharp & Dohme Corp., ett dotterbolag till Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Tillverkad av: NV Organon, Oss, Nederländerna, ett dotterbolag till Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Reviderad: juli 2016
BIEFFEKTER
I samband med avbrytande av behandling
Ungefär 16 % av de 453 patienter som fick REMERON (mirtazapin) tabletter i amerikanska 6-veckors kontrollerade kliniska prövningar avbröt behandlingen på grund av en negativ upplevelse, jämfört med 7 % av de 361 placebobehandlade patienterna i dessa studier. De vanligaste händelserna (≥ 1%) associerade med utsättande av behandlingen och anses vara läkemedelsrelaterade (dvs de händelser associerade med avhopp i en takt som är minst dubbelt så stor som placebo) är inkluderade i tabell 2.
Vanliga observerade biverkningar i kontrollerade kliniska prövningar i USA
De vanligaste observerade biverkningarna förknippade med användning av REMERON (mirtazapin) tabletter (incidens på 5 % eller mer) och som inte observerats vid en motsvarande incidens bland placebobehandlade patienter (REMERON-incidens minst dubbelt så stor som för placebo) listas i tabell 3.
Biverkningar som inträffar med en incidens av 1 % eller mer bland REMERON-behandlade patienter
Tabell 4 räknar upp biverkningar som inträffade med en incidens på 1 % eller mer, och som var vanligare än i placebogruppen, bland REMERON (mirtazapin) tabletter-behandlade patienter som deltog i korttids placebokontrollerade prövningar i USA där patienterna var doseras i intervallet 5 till 60 mg/dag. Den här tabellen visar andelen patienter i varje grupp som haft minst 1 episod av en händelse någon gång under sin behandling. Rapporterade biverkningar klassificerades med en standard COSTART-baserad ordboksterminologi.
Förskrivaren bör vara medveten om att dessa siffror inte kan användas för att förutsäga förekomsten av biverkningar under ordinarie medicinsk praxis där patientegenskaper och andra faktorer skiljer sig från de som rådde i de kliniska prövningarna. På samma sätt kan de angivna frekvenserna inte jämföras med siffror som erhållits från andra utredningar som involverar olika behandlingar, användningar och utredare. De citerade siffrorna ger dock den förskrivande läkaren viss grund för att uppskatta det relativa bidraget av läkemedel och icke-läkemedelsfaktorer till biverkningsfrekvensen i den studerade populationen.
EKG-förändringar
Elektrokardiogrammen för 338 patienter som fick REMERON (mirtazapin) tabletter och 261 patienter som fick placebo i 6-veckors placebokontrollerade studier analyserades. Förlängning av QTc ≥ 500 msek observerades inte bland mirtazapinbehandlade patienter; genomsnittlig förändring i QTc var +1,6 msek för mirtazapin och -3,1 msek för placebo. Mirtazapin associerades med en genomsnittlig ökning av hjärtfrekvensen på 3,4 slag/min, jämfört med 0,8 slag/min för placebo. Den kliniska betydelsen av dessa förändringar är okänd.
Effekten av REMERON (mirtazapin) på QTc-intervallet utvärderades i en klinisk randomiserad studie med placebo och positiva (moxifloxacin) kontroller som involverade 54 friska frivilliga med hjälp av exponeringsresponsanalys. Denna studie visade ett positivt samband mellan mirtazapinkoncentrationer och förlängning av QTc-intervallet. Graden av QT-förlängning som observerades med både 45 mg (terapeutisk) och 75 mg (supraterapeutisk) doser av mirtazapin var dock inte på en nivå som allmänt anses vara kliniskt betydelsefull.
Andra biverkningar som observerats under premarketingutvärderingen av REMERON
Under utvärderingen före marknadsföringen gavs flera doser av REMERON (mirtazapin) tabletter till 2796 patienter i kliniska studier. Tillstånden och varaktigheten av exponeringen för mirtazapin varierade mycket och inkluderade (i överlappande kategorier) öppna och dubbelblinda studier, okontrollerade och kontrollerade studier, slutenvårds- och öppenvårdsstudier, studier med fasta doser och titreringsstudier. Olyckliga händelser associerade med denna exponering registrerades av kliniska utredare med terminologi som de själva valt. Följaktligen är det inte möjligt att ge en meningsfull uppskattning av andelen individer som upplever biverkningar utan att först gruppera liknande typer av ogynnsamma händelser i ett mindre antal standardiserade händelsekategorier.
tabellerna som följer klassificerades rapporterade biverkningar med hjälp av en standard COSTART-baserad ordboksterminologi. Frekvenserna som presenteras representerar därför andelen av de 2796 patienter som exponerats för flera doser av REMERON som upplevde en händelse av den typ som nämnts vid minst ett tillfälle när de fick REMERON. Alla rapporterade händelser är inkluderade förutom de som redan listats i tabell 4, de negativa upplevelser som ingår i COSTART-termer som antingen är alltför generella eller överdrivet specifika för att vara oinformativa, och de händelser för vilka en drogorsak var mycket avlägsen.
Det är viktigt att betona att även om de rapporterade händelserna inträffade under behandling med REMERON 30 mg, så var de inte nödvändigtvis orsakade av det.
Händelser kategoriseras vidare efter kroppssystem och listas i ordning efter minskande frekvens enligt följande definitioner: frekventa biverkningar är de som inträffar vid 1 eller flera tillfällen hos minst 1/100 patienter; sällsynta biverkningar är de som inträffar hos 1/100 till 1/1000 patienter; sällsynta händelser är de som inträffar hos färre än 1/1000 patienter. Endast de händelser som inte redan är listade i Tabell 4 visas i denna lista. Händelser av stor klinisk betydelse beskrivs också i avsnitten VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER.
Kroppen som helhet: frekvent: sjukdomskänsla, buksmärtor, akut buksyndrom; sällsynta: frossa, feber, ansiktsödem, sår, ljuskänslighetsreaktion, stelhet i nacken, nacksmärta, förstorad buk; sällsynta: cellulit, bröstsmärta substernal.
Kardiovaskulära systemet: frekvent: hypertoni, vasodilatation; sällan: angina pectoris, hjärtinfarkt, bradykardi, ventrikulära extrasystoler, synkope, migrän, hypotoni; sällsynta: förmaksarytmi, bigeminy, vaskulär huvudvärk, lungemboli, cerebral ischemi, kardiomegali, flebit, vänster hjärtsvikt.
Matsmältningssystemet: frekvent: kräkningar, anorexi; sällsynta: utslag, glossit, kolecystit, illamående och kräkningar, tandköttsblödning, stomatit, kolit, onormala leverfunktionstester; sällsynta: missfärgning av tungan, ulcerös stomatit, spottkörtelförstoring, ökad salivutsöndring, tarmobstruktion, pankreatit, aftös stomatit, levercirros, gastrit, gastroenterit, oral moniliasis, tungödem.
Endokrina systemet: sällsynt: struma, hypotyreos.
Hemiska och lymfatiska systemet: sällsynta: lymfadenopati, leukopeni, peteki, anemi, trombocytopeni, lymfocytos, pancytopeni.
Metaboliska och näringsmässiga störningar: frekvent: törst; sällsynt: uttorkning, viktminskning; sällsynta: gikt, ökad SGOT, onormal läkning, ökat surt fosfatas, ökat SGPT, diabetes mellitus, hyponatremi.
Muskuloskeletala systemet: frekvent: myasteni, artralgi; sällsynt: artrit, tenosynovit; sällsynta: patologisk fraktur, osteoporosfraktur, skelettsmärta, myosit, senruptur, artros, bursit.
Nervsystem: frekvent: hypestesi, apati, depression, hypokinesi, yrsel, ryckningar, agitation, ångest, minnesförlust, hyperkinesi, parestesi; sällsynta: ataxi, delirium, vanföreställningar, depersonalisering, dyskinesi, extrapyramidalt syndrom, ökad libido, onormal koordination, dysartri, hallucinationer, manisk reaktion, neuros, dystoni, fientlighet, ökade reflexer, känslomässig labilitet, eufori, paranoid reaktion; sällsynta: afasi, nystagmus, akatisi (psykomotorisk rastlöshet), stupor, demens, dubbelsidighet, drogberoende, förlamning, grand malkonvulsioner, hypotoni, myoklonus, psykotisk depression, abstinenssyndrom, serotonergt syndrom.
Andningssystem: frekvent: ökad hosta, bihåleinflammation; sällsynt: näsblod, bronkit, astma, lunginflammation; sällsynta: asfyxi, laryngit, pneumothorax, hicka.
Hud och bihang: frekvent: klåda, utslag; sällsynt: akne, exfoliativ dermatit, torr hud, herpes simplex, alopeci; sällsynta: urtikaria, herpes zoster, hudhypertrofi, seborré, hudsår.
Särskilda sinnen: sällsynt: ögonsmärta, abnormitet av ackommodation, konjunktivit, dövhet, keratokonjunktivit, tårbildningsstörning, glaukom med vinkelstängning, hyperakusis, öronvärk; sällsynta: blefarit, partiell övergående dövhet, otitis media, smakbortfall, parosmi.
Urogenitala systemet: frekvent: urinvägsinfektion; sällsynta: njursten, cystit, dysuri, urininkontinens, urinretention, vaginit, hematuri, bröstsmärtor, amenorré, dysmenorré, leukorré, impotens; sällsynta: polyuri, uretrit, metrorragi, menorragi, onormal ejakulation, bröstförstoring, bröstförstoring, urinträngning.
Andra biverkningar som observerats under utvärdering av REMERON efter marknadsföring
Biverkningar som rapporterats sedan marknadsintroduktionen, som var temporärt (men inte nödvändigtvis kausalt) relaterade till mirtazapinbehandling, inkluderar fall av ventrikulär arytmi Torsades de Pointes. I de flesta av dessa fall var dock samtidiga läkemedel inblandade. Fall av allvarliga hudreaktioner, inklusive Stevens-Johnsons syndrom, bullös dermatit, erythema multiforme och toxisk epidermal nekrolys har också rapporterats. Ökade kreatinkinasnivåer i blodet och rabdomyolys har också rapporterats.
Narkotikamissbruk och beroende
Kontrollerat ämnesklass
REMERON (mirtazapin) Tabletter är inte en kontrollerad substans.
Fysiskt och psykologiskt beroende
REMERON (mirtazapin) tabletter har inte systematiskt studerats på djur eller människor med avseende på dess risk för missbruk, tolerans eller fysiskt beroende. Även om de kliniska prövningarna inte avslöjade någon tendens till något läkemedelssökande beteende, var dessa observationer inte systematiska och det är inte möjligt att utifrån denna begränsade erfarenhet förutsäga i vilken utsträckning ett CNS-aktivt läkemedel kommer att missbrukas, avledas och /eller missbrukas när den väl har marknadsförts. Följaktligen bör patienter utvärderas noggrant med avseende på drogmissbruk i anamnesen, och sådana patienter bör observeras noggrant för tecken på felaktig användning eller missbruk av REMERON (t.ex. utveckling av tolerans, ökningar av dosen, drogsökande beteende).
LÄKEMEDELSINTERAKTIONER
Liksom med andra läkemedel är potentialen för interaktion genom en mängd olika mekanismer (t.ex. farmakodynamisk, farmakokinetisk hämning eller förstärkning etc.) en möjlighet (se KLINISK FARMAKOLOGI ).
Monoaminoxidashämmare
(Ser KONTRAINDIKATIONER , VARNINGAR , och DOSERING OCH ADMINISTRERING .)
Serotonerga läkemedel
(Ser KONTRAINDIKATIONER och VARNINGAR .)
Läkemedel som påverkar levermetabolismen
Metabolismen och farmakokinetiken för REMERON (mirtazapin) tabletter kan påverkas av induktion eller hämning av läkemedelsmetaboliserande enzymer.
Läkemedel som metaboliseras av och/eller hämmar cytokrom P450-enzymer
CYP enzyminducerare
(dessa studier använde båda läkemedlen vid steady state)
fenytoin
Hos friska manliga patienter (n=18) ökade fenytoin (200 mg dagligen) mirtazapin (30 mg dagligen) clearance cirka två gånger, vilket resulterade i en minskning av den genomsnittliga plasmakoncentrationen av mirtazapin med 45 %. Mirtazapin påverkade inte farmakokinetiken för fenytoin signifikant.
Karbamazepin
Hos friska manliga patienter (n=24) ökade karbamazepin (400 mg två gånger dagligen) mirtazapin (15 mg två gånger dagligen) clearance omkring 2 gånger, vilket resulterade i en minskning av den genomsnittliga plasmakoncentrationen av mirtazapin med 60 %.
När fenytoin, karbamazepin eller annan inducerare av levermetabolism (såsom rifampicin) läggs till mirtazapinbehandling, kan mirtazapindosen behöva ökas. Om behandlingen med ett sådant läkemedel avbryts kan det bli nödvändigt att minska mirtazapindosen.
CYP-enzymhämmare
Cimetidin
Hos friska manliga patienter (n=12), när cimetidin, en svag hämmare av CYP1A2, CYP2D6 och CYP3A4, givet 800 mg två gånger dagligen vid steady state, administrerades samtidigt med mirtazapin (30 mg dagligen) vid steady state, Area Under the Curve (AUC) av mirtazapin ökade med mer än 50 %. Mirtazapin orsakade inte relevanta förändringar i farmakokinetiken för cimetidin. Mirtazapindosen kan behöva minskas när samtidig behandling med cimetidin påbörjas, eller ökas när cimetidinbehandlingen avbryts.
Ketokonazol
Hos friska, manliga, kaukasiska patienter (n=24), ökade samtidig administrering av den potenta CYP3A4-hämmaren ketokonazol (200 mg två gånger dagligen i 6,5 dagar) toppplasmanivåerna och AUC för en engångsdos på 30 mg mirtazapin med cirka 40 % och 50 % respektive.
Försiktighet bör iakttas vid samtidig administrering av mirtazapin med potenta CYP3A4-hämmare, HIV-proteashämmare, azol-antimykotika, erytromycin eller nefazodon.
Paroxetin
I en interaktionsstudie in vivo på friska patienter med omfattande CYP2D6 metaboliserare (n=24), orsakade mirtazapin (30 mg/dag), vid steady state, inte relevanta förändringar i farmakokinetiken för steady state paroxetin (40 mg/dag), en CYP2D6-hämmare.
Andra läkemedel-läkemedelsinteraktioner
Amitriptylin
Hos friska patienter med omfattande CYP2D6-metabolisering (n=32) orsakade amitriptylin (75 mg dagligen), vid steady state, inga relevanta förändringar i farmakokinetiken för steady state mirtazapin (30 mg dagligen); mirtazapin orsakade inte heller relevanta förändringar i farmakokinetiken för amitriptylin.
Warfarin
Hos friska manliga försökspersoner (n=16) orsakade mirtazapin (30 mg dagligen), vid steady state, en liten (0,2) men statistiskt signifikant ökning av INR (International Normalized Ratio) hos försökspersoner som behandlades med warfarin. Eftersom en mer uttalad effekt inte kan uteslutas vid en högre dos av mirtazapin, är det tillrådligt att övervaka INR vid samtidig behandling av warfarin och mirtazapin.
Litium
Inga relevanta kliniska effekter eller signifikanta förändringar i farmakokinetiken har observerats hos friska manliga försökspersoner vid samtidig behandling med subterapeutiska nivåer av litium (600 mg/dag i 10 dagar) vid steady state och en engångsdos på 30 mg mirtazapin. Effekterna av högre doser litium på farmakokinetiken för mirtazapin är okända.
Risperidon
I en in vivo, icke-randomiserad interaktionsstudie, visade försökspersoner (n=6) i behov av behandling med ett antipsykotiskt och antidepressivt läkemedel att mirtazapin (30 mg dagligen) vid steady state inte påverkade farmakokinetiken för risperidon (upp till 3 mg) bud).
Alkohol
Samtidig administrering av alkohol (motsvarande 60 g) hade en minimal effekt på plasmanivåerna av mirtazapin (15 mg) hos 6 friska manliga försökspersoner. Men den försämring av kognitiva och motoriska färdigheter som produceras av REMERON visade sig vara additiv till de som produceras av alkohol. Patienter bör därför rådas att undvika alkohol medan de tar REMERON.
Diazepam
Samtidig administrering av diazepam (15 mg) hade en minimal effekt på plasmanivåerna av mirtazapin (15 mg) hos 12 friska försökspersoner. Den försämring av motoriken som produceras av REMERON 30mg har dock visat sig vara additiv till de som orsakas av diazepam. Patienter bör därför rådas att undvika diazepam och andra liknande läkemedel medan de tar REMERON.
QTc-förlängande läkemedel
Risken för QT-förlängning och/eller ventrikulära arytmier (t.ex. Torsades de Pointes) kan öka vid samtidig användning av läkemedel som förlänger QTc-intervallet (t.ex. vissa antipsykotika och antibiotika) och vid överdosering av mirtazapin (se NEGATIVA REAKTIONER och ÖVERDOS avsnitt).
VARNINGAR
Klinisk försämring och självmordsrisk
Patienter med egentlig depression (MDD), både vuxna och barn, kan uppleva förvärring av sin depression och/eller uppkomsten av självmordstankar och självmordsbeteende (suicidalitet) eller ovanliga beteendeförändringar, oavsett om de tar antidepressiva mediciner eller inte, och detta risken kan kvarstå tills betydande remission inträffar. Självmord är en känd risk för depression och vissa andra psykiatriska störningar, och dessa störningar i sig är de starkaste prediktorerna för självmord. Det har dock funnits en långvarig oro för att antidepressiva medel kan ha en roll i att framkalla förvärring av depression och uppkomsten av suicidalitet hos vissa patienter under de tidiga faserna av behandlingen. Sammanslagna analyser av kortvariga placebokontrollerade studier av antidepressiva läkemedel (SSRI och andra) visade att dessa läkemedel ökar risken för självmordstankar och självmordsbeteende (suicidalitet) hos barn, ungdomar och unga vuxna (18-24 år) med svår depression störning (MDD) och andra psykiatriska störningar. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det fanns en minskning av risken med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre.
De sammanslagna analyserna av placebokontrollerade studier på barn och ungdomar med MDD, tvångssyndrom (OCD) eller andra psykiatriska störningar inkluderade totalt 24 korttidsstudier av 9 antidepressiva läkemedel på över 4400 patienter. De sammanslagna analyserna av placebokontrollerade studier på vuxna med MDD eller andra psykiatriska störningar inkluderade totalt 295 korttidsstudier (medianlängd på 2 månader) av 11 antidepressiva läkemedel på över 77 000 patienter. Det fanns avsevärd variation i risk för suicidalitet bland droger, men en tendens till en ökning av de yngre patienterna för nästan alla studerade droger. Det fanns skillnader i absolut risk för suicidalitet mellan olika indikationer, med den högsta förekomsten av MDD. Riskskillnaderna (läkemedel kontra placebo) var dock relativt stabila inom åldersskikt och över indikationer. Dessa riskskillnader (skillnad mellan läkemedel och placebo i antalet fall av suicidalitet per 1 000 behandlade patienter) anges i tabell 1.
Inga självmord inträffade i någon av de pediatriska prövningarna. Det förekom självmord i vuxenstudierna, men antalet var inte tillräckligt för att dra någon slutsats om läkemedelseffekt på självmord.
Det är okänt om suicidalitetsrisken sträcker sig till långvarig användning, dvs. längre än flera månader. Det finns dock betydande bevis från placebokontrollerade underhållsstudier på vuxna med depression att användning av antidepressiva medel kan fördröja återkommande depression.
Alla patienter som behandlas med antidepressiva medel för någon indikation bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet och ovanliga beteendeförändringar, särskilt under de första månaderna av en läkemedelsbehandlingskur, eller vid tidpunkter med dosförändringar, antingen ökningar eller minskar.
Följande symtom, ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani och mani, har rapporterats hos vuxna och pediatriska patienter som behandlas med antidepressiva medel även för egentlig depression vad gäller andra indikationer, både psykiatriska och icke-psykiatriska. Även om ett orsakssamband mellan uppkomsten av sådana symtom och antingen försämringen av depression och/eller uppkomsten av självmordsimpulser inte har fastställts, finns det oro för att sådana symtom kan representera föregångare till framväxande suicidalitet.
Man bör överväga att ändra den terapeutiska kuren, inklusive eventuellt avbrytande av medicineringen, hos patienter vars depression är ihållande värre, eller som upplever framväxande suicidalitet eller symtom som kan vara prekursorer till förvärrad depression eller suicidalitet, särskilt om dessa symtom är allvarliga, plötsliga. i början, eller var inte en del av patientens uppvisande symtom.
Familjer och vårdgivare till patienter som behandlas med antidepressiva medel för allvarlig depressiv sjukdom eller andra indikationer, både psykiatriska och icke-psykiatriska, bör uppmärksammas om behovet av att övervaka patienter för uppkomsten av agitation, irritabilitet, ovanliga beteendeförändringar och de andra symtomen som beskrivs ovan. , såväl som uppkomsten av suicidalitet, och att rapportera sådana symtom omedelbart till vårdgivare . Sådan övervakning bör innefatta daglig observation av familjer och vårdgivare. Recept för REMERON (mirtazapin) Tabletter bör skrivas ut för den minsta mängden tabletter som är förenlig med god patienthantering, för att minska risken för överdosering.
Screening av patienter för bipolär sjukdom
En allvarlig depressiv episod kan vara den första presentationen av bipolär sjukdom. Det anses allmänt (även om det inte har fastställts i kontrollerade studier) att behandling av en sådan episod med enbart ett antidepressivt läkemedel kan öka sannolikheten för utfällning av en blandad/manisk episod hos patienter med risk för bipolär sjukdom. Huruvida något av de ovan beskrivna symptomen representerar en sådan omvandling är okänt. Innan behandling med ett antidepressivt läkemedel påbörjas bör dock patienter med depressiva symtom screenas på lämpligt sätt för att fastställa om de löper risk för bipolär sjukdom; sådan screening bör inkludera en detaljerad psykiatrisk historia, inklusive en familjehistoria av självmord, bipolär sjukdom och depression. Det bör noteras att REMERON (mirtazapin) tabletter inte är godkända för användning vid behandling av bipolär depression.
Agranulocytos
premarketing kliniska prövningar utvecklade 2 (1 med Sjögrens syndrom) av 2796 patienter som behandlades med REMERON (mirtazapin) tabletter agranulocytos [absolut neutrofilantal (ANC)
Serotonin syndrom
Utvecklingen av ett potentiellt livshotande serotonergt syndrom har rapporterats med SNRI och SSRI, inklusive REMERON 30 mg, enbart men särskilt vid samtidig användning av andra serotonerga läkemedel (inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadol, tryptofan, buspiron, buspiron, johannesört), och med läkemedel som försämrar metabolismen av serotonin (särskilt MAO-hämmare, både de som är avsedda att behandla psykiatriska störningar och även andra, såsom linezolid och intravenös metylenblått).
Symtom på serotonergt syndrom kan inkludera förändringar i mental status (t.ex. agitation, hallucinationer, delirium och koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, yrsel, diafores, rodnad, hypertermi), neuromuskulära symtom (t.ex. tremor, stelhet, myoklonus, hyperreflexi, inkoordination), kramper och/eller gastrointestinala symtom (t.ex. illamående, kräkningar, diarré). Patienter bör övervakas med avseende på uppkomsten av serotonergt syndrom.
Samtidig användning av REMERON 15 mg och MAO-hämmare avsedda att behandla psykiatriska störningar är kontraindicerat. REMERON ska inte heller sättas in hos en patient som behandlas med MAO-hämmare som linezolid eller intravenöst metylenblått. Alla rapporter med metylenblått som gav information om administreringssättet involverade intravenös administrering i dosintervallet 1 mg/kg till 8 mg/kg. Inga rapporter involverade administrering av metylenblått på andra sätt (såsom orala tabletter eller lokal vävnadsinjektion) eller vid lägre doser. Det kan finnas omständigheter då det är nödvändigt att påbörja behandling med en MAO-hämmare såsom linezolid eller intravenös metylenblått hos en patient som tar REMERON. REMERON 15 mg bör avbrytas innan behandling med MAO-hämmaren påbörjas (se KONTRAINDIKATIONER och DOSERING OCH ADMINISTRERING ).
Om samtidig användning av REMERON 30 mg och andra serotonerga läkemedel, inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadol, buspiron, tryptofan och johannesört, är kliniskt motiverad, var medveten om en potentiell ökad risk för serotonergt syndrom, särskilt under behandlingsstart och dosökningar.
Behandling med REMERON 30 mg och eventuella samtidiga serotonerga medel ska avbrytas omedelbart om ovanstående händelser inträffar och stödjande symtomatisk behandling bör inledas.
Stängningsvinkelglaukom
Pupillutvidgningen som uppstår efter användning av många antidepressiva läkemedel inklusive REMERON 15 mg kan utlösa en vinkelattack hos en patient med anatomiskt smala vinklar som inte har en patenterad iridektomi.
QT-förlängning och Torsades de Pointes
Effekten av REMERON (mirtazapin) på QTc-intervallet utvärderades i en klinisk randomiserad studie med placebo och positiva (moxifloxacin) kontroller som involverade 54 friska frivilliga med hjälp av exponeringsresponsanalys. Denna studie visade ett positivt samband mellan mirtazapinkoncentrationer och förlängning av QTc-intervallet. Graden av QT-förlängning som observerades med både 45 mg (terapeutisk) och 75 mg (supraterapeutisk) doser av mirtazapin var dock inte på en nivå som allmänt anses vara kliniskt betydelsefull. Under användningen av mirtazapin efter marknadsföring har fall av QT-förlängning, Torsades de Pointes, ventrikulär takykardi och plötslig död rapporterats (se NEGATIVA REAKTIONER ). Majoriteten av rapporterna inträffade i samband med överdosering eller hos patienter med andra riskfaktorer för QT-förlängning, inklusive samtidig användning av QTc-förlängande läkemedel (se LÄKEMEDELSINTERAKTIONER och ÖVERDOS avsnitt). Försiktighet bör iakttas när REMERON förskrivs till patienter med känd kardiovaskulär sjukdom eller familjehistoria av QT-förlängning, och vid samtidig användning med andra läkemedel som anses förlänga QTc-intervallet.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Utsättningssymtom
Det har rapporterats om biverkningar efter utsättande av REMERON (mirtazapin) tabletter (särskilt vid abrupt), inklusive men inte begränsat till följande: yrsel, onormala drömmar, känselstörningar (inklusive parestesi och elektriska stötar), agitation, ångest, trötthet, förvirring, huvudvärk, tremor, illamående, kräkningar och svettning eller andra symtom som kan vara av klinisk betydelse. Majoriteten av de rapporterade fallen är milda och självbegränsande. Även om dessa har rapporterats som biverkningar, bör man inse att dessa symtom kan vara relaterade till underliggande sjukdom.
Patienter som för närvarande tar REMERON bör INTE avbryta behandlingen abrupt på grund av risk för utsättningssymtom. När ett medicinskt beslut fattas om att avbryta behandlingen med REMERON, rekommenderas en gradvis minskning av dosen snarare än ett abrupt utsättande.
Akatisi/psykomotorisk rastlöshet
Användningen av antidepressiva medel har associerats med utvecklingen av akatisi, kännetecknad av en subjektivt obehaglig eller plågsam rastlöshet och behov av att röra sig, ofta åtföljd av oförmåga att sitta eller stå still. Detta är mest sannolikt att inträffa inom de första veckorna av behandlingen. Hos patienter som utvecklar dessa symtom kan ökning av dosen vara skadlig.
Hyponatremi
Hyponatremi har rapporterats mycket sällan vid användning av mirtazapin. Försiktighet bör iakttas hos patienter i riskzonen, såsom äldre patienter eller patienter som samtidigt behandlas med läkemedel som är kända för att orsaka hyponatremi.

Sömnighet
kontrollerade studier i USA rapporterades somnolens hos 54 % av patienterna som behandlades med REMERON (mirtazapin) tabletter, jämfört med 18 % för placebo och 60 % för amitriptylin. I dessa studier resulterade somnolens i att behandlingen avbröts för 10,4 % av de REMERON-behandlade patienterna, jämfört med 2,2 % för placebo. Det är oklart om tolerans utvecklas mot de somnolenta effekterna av REMERON eller inte. På grund av de potentiellt signifikanta effekterna av REMERON 30 mg på nedsatt prestationsförmåga, bör patienter varnas för att delta i aktiviteter som kräver vakenhet tills de har kunnat bedöma läkemedlets effekt på sin egen psykomotoriska prestation (se PATIENTINFORMATION ).
Yrsel
I kontrollerade studier i USA rapporterades yrsel hos 7 % av patienterna som behandlades med REMERON, jämfört med 3 % för placebo och 14 % för amitriptylin. Det är oklart om tolerans utvecklas mot yrsel som observeras i samband med användning av REMERON.
Ökad aptit/viktuppgång
USA-kontrollerade studier rapporterades aptitökning hos 17 % av patienterna som behandlades med REMERON 30 mg, jämfört med 2 % för placebo och 6 % för amitriptylin. I samma prövningar rapporterades viktökning på ≥ 7 % av kroppsvikten hos 7,5 % av patienterna som behandlades med mirtazapin, jämfört med 0 % för placebo och 5,9 % för amitriptylin. I en pool av förmarknadsföringsstudier i USA, inklusive många patienter för långvarig, öppen behandling, avbröt 8 % av patienterna som fick REMERON 30 mg på grund av viktökning. I en 8 veckor lång pediatrisk klinisk prövning med doser mellan 15 och 45 mg/dag, hade 49 % av REMERON-behandlade patienter en viktökning på minst 7 %, jämfört med 5,7 % av placebobehandlade patienter (se FÖRSIKTIGHETSÅTGÄRDER : Pediatrisk användning ).
Kolesterol/triglycerider
kontrollerade studier i USA observerades icke-fastande kolesterolökningar till ≥ 20 % över de övre normala gränserna hos 15 % av patienterna som behandlades med REMERON 30 mg, jämfört med 7 % för placebo och 8 % för amitriptylin. I samma studier observerades icke-fastande triglyceridökningar till ≥ 500 mg/dL hos 6 % av patienterna som behandlades med mirtazapin, jämfört med 3 % för placebo och 3 % för amitriptylin.
Transaminasförhöjningar
Kliniskt signifikanta ALAT (SGPT)-höjningar (≥ 3 gånger den övre gränsen för normalintervallet) observerades hos 2,0 % (8/424) av patienterna som exponerades för REMERON 30 mg i en pool av korttidskontrollerade USA-studier, jämfört med 0,3 % (1/328) av placebopatienterna och 2,0 % (3/181) av amitriptylinpatienterna. De flesta av dessa patienter med ALAT-ökningar utvecklade inte tecken eller symtom associerade med nedsatt leverfunktion. Medan vissa patienter avbröts på grund av ALAT-ökningarna, återgick enzymnivåerna i andra fall till det normala trots fortsatt REMERON-behandling. REMERON ska användas med försiktighet till patienter med nedsatt leverfunktion (se KLINISK FARMAKOLOGI och DOSERING OCH ADMINISTRERING ).
Aktivering av mani/hypomani
Mani/hypomani förekom hos cirka 0,2 % (3/1299 patienter) av REMERON-behandlade patienter i amerikanska studier. Även om incidensen av mani/hypomani var mycket låg under behandling med mirtazapin, bör det användas försiktigt hos patienter med en historia av mani/hypomani.
Beslag
kliniska prövningar före marknadsföringen rapporterades endast ett anfall bland de 2796 amerikanska och icke-amerikanska patienter som behandlades med REMERON. Inga kontrollerade studier har dock utförts på patienter med anamnes på anfall. Därför bör försiktighet iakttas när mirtazapin används till dessa patienter.
Användning hos patienter med samtidig sjukdom
Klinisk erfarenhet av REMERON hos patienter med samtidig systemisk sjukdom är begränsad. Därför rekommenderas försiktighet vid förskrivning av mirtazapin till patienter med sjukdomar eller tillstånd som påverkar metabolism eller hemodynamiska svar.
REMERON har inte systematiskt utvärderats eller använts i någon nämnvärd omfattning hos patienter med en nyligen anamnes på hjärtinfarkt eller annan signifikant hjärtsjukdom. REMERON associerades med signifikant ortostatisk hypotoni i tidiga kliniska farmakologiska prövningar med normala frivilliga. Ortostatisk hypotoni observerades sällan i kliniska prövningar med deprimerade patienter. REMERON 15 mg ska användas med försiktighet till patienter med känd kardiovaskulär eller cerebrovaskulär sjukdom som kan förvärras av hypotoni (historia av hjärtinfarkt, angina eller ischemisk stroke) och tillstånd som skulle predisponera patienter för hypotoni (dehydrering, hypovolemi och behandling med antihypertensiva läkemedel). medicin).
Mirtazapin-clearance är minskat hos patienter med måttlig [glomerulär filtrationshastighet (GFR)=11 - 39 ml/min/1,73 m²] och gravt [GFR KLINISK FARMAKOLOGI och DOSERING OCH ADMINISTRERING ).
Information för patienter
Förskrivare eller annan hälso- och sjukvårdspersonal bör informera patienter, deras familjer och deras vårdgivare om fördelarna och riskerna med behandling med REMERON (mirtazapin) tabletter och bör ge dem råd om lämplig användning. En patient Läkemedelsguide om "Antidepressiva läkemedel, depression och andra allvarliga psykiska sjukdomar och självmordstankar eller -handlingar" finns tillgänglig för REMERON. Förskrivaren eller sjukvårdspersonalen bör instruera patienter, deras familjer och deras vårdgivare att läsa Läkemedelsguide och bör hjälpa dem att förstå dess innehåll. Patienterna bör ges möjlighet att diskutera innehållet i Läkemedelsguide och få svar på alla frågor de kan ha. Den fullständiga texten till Läkemedelsguide återges i slutet av detta dokument.
Patienter bör informeras om följande problem och uppmanas att varna sin förskrivare om dessa inträffar när de tar REMERON.
Klinisk försämring och självmordsrisk
Patienter, deras familjer och deras vårdgivare bör uppmuntras att vara uppmärksamma på uppkomsten av ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani, mani, andra ovanliga beteendeförändringar , försämring av depression och självmordstankar, särskilt tidigt under antidepressiv behandling och när dosen justeras upp eller ner. Familjer och vårdgivare till patienter bör rådas att leta efter uppkomsten av sådana symtom på en daglig basis, eftersom förändringar kan vara abrupta. Sådana symtom bör rapporteras till patientens förskrivare eller hälso- och sjukvårdspersonal, särskilt om de är allvarliga, plötsliga debuterande eller inte var en del av patientens uppvisande symtom. Symtom som dessa kan vara förknippade med en ökad risk för suicidtänkande och självmordsbeteende och tyder på behov av mycket noggrann övervakning och eventuellt förändringar i medicineringen.
Agranulocytos
Patienter som ska få REMERON bör varnas för risken att utveckla agranulocytos. Patienter bör rådas att kontakta sin läkare om de upplever någon indikation på infektion såsom feber, frossa, halsont, sår på slemhinnor eller andra möjliga tecken på infektion. Särskild uppmärksamhet bör ägnas åt influensaliknande besvär eller andra symtom som kan tyda på infektion.
Interferens med kognitiva och motoriska prestanda
REMERON 15mg kan försämra omdömet, tänkandet och särskilt motoriken på grund av dess framträdande lugnande effekt. Dåsigheten i samband med användning av mirtazapin kan försämra en patients förmåga att köra bil, använda maskiner eller utföra uppgifter som kräver vakenhet. Patienter bör därför varnas för att ägna sig åt farliga aktiviteter tills de är rimligt säkra på att REMERON-behandling inte negativt påverkar deras förmåga att ägna sig åt sådana aktiviteter.
Slutför terapikursen
Även om patienter kan märka förbättring med REMERON 15 mg-behandling inom 1 till 4 veckor, bör de rådas att fortsätta behandlingen enligt anvisningarna.
Samtidig medicinering
Patienter bör rådas att informera sin läkare om de tar eller avser att ta några receptbelagda eller receptfria läkemedel, eftersom det finns risk för att REMERON interagerar med andra läkemedel.
Patienter bör göras medvetna om en potentiell ökad risk för serotonergt syndrom om samtidig användning av REMERON 15 mg och andra serotonerga läkemedel, inklusive triptaner, tricykliska antidepressiva, fentanyl, litium, tramadol, buspiron, tryptofan och johannesört, är kliniskt motiverad, särskilt under behandlingsstart och dosökningar.
Alkohol
Försämringen av kognitiva och motoriska färdigheter som produceras av REMERON har visat sig vara additiv till de som produceras av alkohol. Patienter bör därför rådas att undvika alkohol medan de tar mirtazapin.
Graviditet
Patienter bör rådas att meddela sin läkare om de blir gravida eller planerar att bli gravida under REMERON-behandling.
Amning
Patienter bör rådas att meddela sin läkare om de ammar ett spädbarn.
Laboratorietester
Det rekommenderas inga rutinmässiga laboratorietester.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Karcinogenicitetsstudier utfördes med mirtazapin som gavs i kosten i doser på 2, 20 och 200 mg/kg/dag till möss och 2, 20 och 60 mg/kg/dag till råttor. De högsta doserna som används är cirka 20 och 12 gånger den maximala rekommenderade humandosen (MRHD) på 45 mg/dag på mg/m²-basis hos möss respektive råttor. Det fanns en ökad förekomst av hepatocellulärt adenom och karcinom hos hanmöss vid den höga dosen. Hos råttor förelåg en ökning av hepatocellulärt adenom hos honor vid mellan- och höga doser och i hepatocellulära tumörer och sköldkörtelfollikulärt adenom/cystadenom och karcinom hos hanar vid den höga dosen. Data tyder på att ovanstående effekter möjligen kan förmedlas av icke-genotoxiska mekanismer, vars relevans för människor inte är känd.
Doserna som användes i musstudien kanske inte var tillräckligt höga för att helt karakterisera den karcinogena potentialen hos REMERON (mirtazapin) tabletter.
Mutagenes
Mirtazapin var inte mutagent eller klastogent och inducerade inte allmän DNA-skada som fastställts i flera genotoxicitetstester: Ames-test, in vitro genmutationsanalys i kinesisk hamster V 79-celler, in vitro systerkromatidutbytesanalys i odlade kaninlymfocyter, in vivo benmärg mikronukleustest på råttor och oplanerad DNA-syntesanalys i HeLa-celler.
Nedsättning av fertilitet
I en fertilitetsstudie på råttor gavs mirtazapin i doser upp till 100 mg/kg [20 gånger den maximala rekommenderade humandosen (MRHD) på mg/m-basis]. Parning och befruktning påverkades inte av läkemedlet, men brunstcykeln avbröts vid doser som var 3 eller fler gånger MRHD, och preimplantationsförluster inträffade vid 20 gånger MRHD.
Graviditet
Teratogena effekter
Graviditetskategori C
Reproduktionsstudier på dräktiga råttor och kaniner vid doser upp till 100 mg/kg respektive 40 mg/kg [20 respektive 17 gånger den maximala rekommenderade humandosen (MRHD) på mg/m²-basis] har inte visat några bevis för teratogena effekter. Hos råttor sågs dock en ökning av postimplantationsförlusterna hos mödrar som behandlats med mirtazapin. Det var en ökning av valpdöden under de första 3 dagarna av laktationen och en minskning av valparnas födelsevikt. Orsaken till dessa dödsfall är inte känd. Effekterna inträffade vid doser som var 20 gånger MRHD, men inte vid 3 gånger MRHD, på en mg/m² basis. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Ammande mödrar
Eftersom en del REMERON kan utsöndras i bröstmjölk, bör försiktighet iakttas när REMERON (mirtazapin) tabletter administreras till ammande kvinnor.
Pediatrisk användning
Säkerhet och effektivitet i den pediatriska populationen har inte fastställts (se LÅDA VARNING och VARNINGAR : Klinisk försämring och självmordsrisk ). Två placebokontrollerade studier på 258 pediatriska patienter med MDD har utförts med REMERON (mirtazapin) tabletter, och data var inte tillräckliga för att stödja ett påstående om användning hos pediatriska patienter. Alla som överväger att använda REMERON 30mg hos ett barn eller en ungdom måste balansera de potentiella riskerna med det kliniska behovet.
I en 8 veckor lång pediatrisk klinisk prövning med doser mellan 15 och 45 mg/dag, hade 49 % av REMERON-behandlade patienter en viktökning på minst 7 %, jämfört med 5,7 % av placebobehandlade patienter. Den genomsnittliga viktökningen var 4 kg (2 kg SD) för REMERON-behandlade patienter jämfört med 1 kg (2 kg SD) för placebobehandlade patienter (se FÖRSIKTIGHETSÅTGÄRDER : Ökad aptit/viktuppgång ).
Geriatrisk användning
Cirka 190 äldre individer (≥ 65 år) deltog i kliniska studier med REMERON (mirtazapin) tabletter. Detta läkemedel är känt för att väsentligt utsöndras via njurarna (75 %), och risken för minskad clearance av detta läkemedel är större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör försiktighet iakttas vid val av dos. Sederande läkemedel kan orsaka förvirring och översedering hos äldre. Inga ovanliga ogynnsamma åldersrelaterade fenomen identifierades i denna grupp. Farmakokinetiska studier visade ett minskat clearance hos äldre. Försiktighet är indicerat vid administrering av REMERON till äldre patienter (se KLINISK FARMAKOLOGI och DOSERING OCH ADMINISTRERING ).
ÖVERDOS
Mänsklig erfarenhet
Det finns mycket begränsad erfarenhet av överdosering av REMERON (mirtazapin) tabletter. I kliniska studier före marknadsföring förekom 8 rapporter om överdosering av REMERON enbart eller i kombination med andra farmakologiska medel. Den enda överdosdöd som rapporterades när du tog REMERON var i kombination med amitriptylin och klorprotixen i en icke-amerikansk klinisk studie. Baserat på plasmanivåer var REMERON 15 mg-dosen 30 till 45 mg, medan plasmanivåerna av amitriptylin och klorprotixen visade sig vara på toxiska nivåer. Alla andra fall av överdosering före marknadsföring resulterade i full återhämtning. Tecken och symtom som rapporterats i samband med överdosering inkluderar desorientering, dåsighet, nedsatt minne och takykardi. Det fanns inga rapporter om EKG-avvikelser, koma eller kramper efter överdosering med enbart REMERON.
Baserat på rapporter efter marknadsföring finns det dock en möjlighet till allvarligare utfall (inklusive dödsfall) vid doser som är mycket högre än den terapeutiska dosen, särskilt vid blandade överdoser. I dessa fall har QT-förlängning och Torsades de Pointes också rapporterats (se LÄKEMEDELSINTERAKTIONER och NEGATIVA REAKTIONER avsnitt).
Överdoshantering
Behandlingen bör bestå av de allmänna åtgärder som används för att hantera överdosering av något läkemedel som är effektivt vid behandling av egentlig depression. Säkerställ en tillräcklig luftväg, syresättning och ventilation. Övervaka EKG-parametrar (inklusive hjärtrytm) och vitala tecken. Allmänna stödjande och symtomatiska åtgärder rekommenderas också. Induktion av kräkning rekommenderas inte. Magsköljning med en orogastrisk sond med stor borrning med lämpligt luftvägsskydd, om det behövs, kan vara indicerat om det utförs kort efter intag, eller hos symtomatiska patienter. Aktivt kol bör administreras. Det finns ingen erfarenhet av användning av forcerad diures, dialys, hemoperfusion eller utbytestransfusion vid behandling av överdosering av mirtazapin. Inga specifika antidoter för mirtazapin är kända.
Vid hantering av överdosering, överväg möjligheten av flera läkemedelsinblandning. Läkaren bör överväga att kontakta ett giftkontrollcenter för ytterligare information om behandling av eventuell överdos. Telefonnummer till certifierade giftcentraler finns listade i Physicians' Desk Reference (PDR).
KONTRAINDIKATIONER
Överkänslighet
REMERON (mirtazapin) tabletter är kontraindicerade till patienter med känd överkänslighet mot mirtazapin eller mot något av hjälpämnena.
Monoaminoxidashämmare
Användning av monoaminoxidashämmare (MAO-hämmare) avsedda att behandla psykiatriska störningar med REMERON 15 mg tabletter eller inom 14 dagar efter avslutad behandling med REMERON 15 mg är kontraindicerat på grund av en ökad risk för serotonergt syndrom. Användning av REMERON 15 mg inom 14 dagar efter avslutad MAO-hämmare avsedd för behandling av psykiatriska störningar är också kontraindicerat (se VARNINGAR och DOSERING OCH ADMINISTRERING ).
Att starta REMERON hos en patient som behandlas med MAO-hämmare såsom linezolid eller intravenös metylenblått är också kontraindicerat på grund av en ökad risk för serotonergt syndrom (se VARNINGAR och DOSERING OCH ADMINISTRERING ).
KLINISK FARMAKOLOGI
Farmakodynamik
Verkningsmekanismen för REMERON (mirtazapin) tabletter, liksom andra läkemedel som är effektiva vid behandling av egentlig depression, är okänd.
Bevis som samlats in i prekliniska studier tyder på att mirtazapin förstärker central noradrenerg och serotonerg aktivitet. Dessa studier har visat att mirtazapin verkar som en antagonist vid centrala presynaptiska α2 - adrenerga hämmande autoreceptorer och heteroreceptorer, en verkan som antas resultera i en ökning av central noradrenerg och serotonerg aktivitet.
Mirtazapin är en potent antagonist av 5-HT2- och 5-HT3-receptorer. Mirtazapin har ingen signifikant affinitet för 5-HT1A- och 5-HT1B-receptorerna.
Mirtazapin är en potent antagonist av histamin (H1) receptorer, en egenskap som kan förklara dess framträdande lugnande effekter.
Mirtazapin är en måttlig perifer α-adrenerg antagonist, en egenskap som kan förklara den enstaka ortostatiska hypotoni som rapporterats i samband med dess användning.
Mirtazapin är en måttlig antagonist mot muskarina receptorer, en egenskap som kan förklara den relativt låga förekomsten av antikolinerga biverkningar i samband med dess användning.
Farmakokinetik
REMERON (mirtazapin) tabletter absorberas snabbt och fullständigt efter oral administrering och har en halveringstid på cirka 20 till 40 timmar. Maximala plasmakoncentrationer uppnås inom cirka 2 timmar efter en oral dos. Närvaron av mat i magen har en minimal effekt på både hastigheten och graden av absorption och kräver ingen dosjustering.
Mirtazapin metaboliseras i stor utsträckning efter oral administrering. Huvudvägar för biotransformation är demetylering och hydroxylering följt av glukuronidkonjugering. In vitro-data från humana levermikrosomer indikerar att cytokrom 2D6 och 1A2 är involverade i bildningen av 8-hydroximetaboliten av mirtazapin, medan cytokrom 3A anses vara ansvarig för bildningen av N-desmetyl- och N-oxidmetaboliten. Mirtazapin har en absolut biotillgänglighet på cirka 50 %. Det elimineras huvudsakligen via urin (75 %) med 15 % i avföring. Flera okonjugerade metaboliter har farmakologisk aktivitet men är närvarande i plasma i mycket låga nivåer. (-)-enantiomeren har en halveringstid för eliminering som är ungefär dubbelt så lång som (+)-enantiomeren och uppnår därför plasmanivåer som är ungefär 3 gånger så höga som för (+)-enantiomeren.
Plasmanivåerna är linjärt relaterade till dosen inom ett dosintervall på 15 till 80 mg. Den genomsnittliga halveringstiden för mirtazapin efter oral administrering sträcker sig från cirka 20 till 40 timmar över ålders- och könsundergrupper, där kvinnor i alla åldrar uppvisar signifikant längre eliminationshalveringstider än män (medelhalveringstid på 37 timmar för kvinnor kontra 26 timmar för män). Steady state plasmanivåer av mirtazapin uppnås inom 5 dagar, med cirka 50 % ackumulering (ackumulationskvot = 1,5).
Mirtazapin är till cirka 85 % bundet till plasmaproteiner över ett koncentrationsområde på 0,01 till 10 mcg/ml.
Särskilda populationer
Geriatrisk
Efter oral administrering av REMERON (mirtazapin) tabletter 20 mg/dag i 7 dagar till försökspersoner i varierande åldrar (intervall, 25 - 74), minskade oral clearance av mirtazapin hos äldre jämfört med yngre försökspersoner. Skillnaderna var mest slående hos män, med 40 % lägre clearance hos äldre män jämfört med yngre män, medan clearance hos äldre kvinnor endast var 10 % lägre jämfört med yngre kvinnor. Försiktighet bör iakttas vid administrering av REMERON 30 mg till äldre patienter (se FÖRSIKTIGHETSÅTGÄRDER och DOSERING OCH ADMINISTRERING ).
Pediatrik
Säkerhet och effektivitet för mirtazapin i den pediatriska populationen har inte fastställts (se FÖRSIKTIGHETSÅTGÄRDER ).
Kön
Den genomsnittliga eliminationshalveringstiden för mirtazapin efter oral administrering sträcker sig från cirka 20 till 40 timmar över ålders- och könsundergrupper, där kvinnor i alla åldrar uppvisar signifikant längre eliminationshalveringstider än män (medelhalveringstid på 37 timmar för kvinnor vs. 26 timmar för män) (se Farmakokinetik ).
Lopp
Det har inte gjorts några kliniska studier för att utvärdera effekten av ras på farmakokinetiken för REMERON.
Njurinsufficiens
Fördelningen av mirtazapin studerades hos patienter med olika grader av njurfunktion. Elimination av mirtazapin är korrelerad med kreatininclearance. Totalt kroppsclearance av mirtazapin minskade med cirka 30 % hos patienter med måttligt (Clcr=11 - 39 ml/min/1,73 m²) och cirka 50 % hos patienter med gravt (Clcr= FÖRSIKTIGHETSÅTGÄRDER och DOSERING OCH ADMINISTRERING ).
Leverinsufficiens
Efter en oral engångsdos på 15 mg REMERON minskade det orala clearance av mirtazapin med cirka 30 % hos patienter med nedsatt leverfunktion jämfört med patienter med normal leverfunktion. Försiktighet bör iakttas vid administrering av REMERON till patienter med nedsatt leverfunktion (se FÖRSIKTIGHETSÅTGÄRDER och DOSERING OCH ADMINISTRERING ).
Kliniska prövningar som visar effektivitet
Effekten av REMERON (mirtazapin) tabletter som behandling för egentlig depression fastställdes i 4 placebokontrollerade 6-veckorsstudier på vuxna öppenvårdspatienter som uppfyller DSM-III-kriterierna för allvarlig depressiv sjukdom. Patienterna titrerades med mirtazapin från ett dosintervall på 5 mg upp till 35 mg/dag. Sammantaget visade dessa studier att mirtazapin är överlägset placebo på minst 3 av följande 4 mått: 21-Item Hamilton Depression Rating Scale (HDRS) totalpoäng; HDRS nedstämdhet föremål; CGI Allvarlighetspoäng; och Montgomery och Asberg Depression Rating Scale (MADRS). Mirtazapins överlägsenhet jämfört med placebo hittades också för vissa faktorer av HDRS, inklusive ångest/somatiseringsfaktor och sömnstörningsfaktor. Den genomsnittliga mirtazapindosen för patienter som genomförde dessa 4 studier varierade från 21 till 32 mg/dag. En femte studie av liknande design använde en högre dos (upp till 50 mg) per dag och visade också effektivitet.
Undersökning av ålders- och könsundergrupper av befolkningen avslöjade inte någon differentiell lyhördhet på basis av dessa undergrupper.
I en långtidsstudie randomiserades patienter som uppfyllde (DSM-IV) kriterier för egentlig depression och som hade svarat under en initial 8 till 12 veckors akut behandling med REMERON 30 mg till fortsatt behandling med REMERON 15 mg eller placebo i upp till 40 veckors behandling. observation för återfall. Respons under den öppna fasen definierades som att ha uppnått ett HAM-D 17 totalpoäng på ≤ 8 och ett CGI-förbättringspoäng på 1 eller 2 vid 2 på varandra följande besök som börjar med vecka 6 av de 8 till 12 veckorna i den öppna fasen av studien. Återfall under den dubbelblinda fasen bestämdes av de individuella utredarna. Patienter som fick fortsatt behandling med REMERON 30 mg upplevde signifikant lägre återfallsfrekvenser under de efterföljande 40 veckorna jämfört med de som fick placebo. Detta mönster visades hos både manliga och kvinnliga patienter.
PATIENTINFORMATION
REMERON® (rem' - e - ron) (mirtazapin) Tabletter
Vilken är den viktigaste informationen jag bör veta om REMERON®?
REMERON 15mg och andra antidepressiva läkemedel kan orsaka allvarliga biverkningar, inklusive:
1. Självmordstankar eller -handlingar:
- REMERON 30mg och andra antidepressiva läkemedel kan öka självmordstankar eller -handlingar hos vissa barn, tonåringar eller unga vuxna under de första månaderna av behandlingen eller när dosen ändras.
- Depression eller andra allvarliga psykiska sjukdomar är de viktigaste orsakerna till självmordstankar eller -handlingar.
- Se upp för dessa förändringar och ring din vårdgivare omedelbart om du märker:
- Nya eller plötsliga förändringar i humör, beteende, handlingar, tankar eller känslor, särskilt om det är allvarligt.
- Var särskilt uppmärksam på sådana förändringar när REMERON startas eller när dosen ändras.
Håll alla uppföljningsbesök hos din vårdgivare och ring mellan besöken om du är orolig för symtom.
Ring din vårdgivare omedelbart om du har något av följande symtom, eller ring 911 om en nödsituation, särskilt om de är nya, värre eller oroar dig:
- försök att begå självmord
- agerar på farliga impulser
- agerar aggressivt eller våldsamt
- tankar om självmord eller att dö
- ny eller värre depression
- ny eller värre ångest eller panikattacker
- känner sig upprörd, rastlös, arg eller irriterad
- sömnproblem
- ökad aktivitet eller prata mer än vad som är normalt för dig
- andra ovanliga förändringar i beteende eller humör
Ring din vårdgivare omedelbart om du har något av följande symtom, eller ring 911 om en nödsituation. REMERON kan förknippas med dessa allvarliga biverkningar:
2. Maniska avsnitt:
- kraftigt ökad energi
- hänsynslöst beteende
- prata mer eller snabbare än vanligt
- svåra sömnproblem
- ovanligt storslagna idéer
- racing tankar
- överdriven lycka eller irritabilitet
3. Minskade vita blodkroppar kallas neutrofiler, som behövs för att bekämpa infektioner. Tala om för din läkare om du har några tecken på infektion såsom feber, frossa, ont i halsen eller mun- eller nässår, särskilt symtom som är influensaliknande.
4. Serotoninsyndrom. Detta tillstånd kan vara livshotande och kan innefatta:
- agitation, hallucinationer, koma eller andra förändringar i mental status
- snabba hjärtslag, högt eller lågt blodtryck
- illamående, kräkningar eller diarré
- koordinationsproblem eller muskelryckningar (överaktiva reflexer)
- svettning eller feber
- muskelstelhet
5. Synproblem
- ögonsmärta
- förändringar i synen
- svullnad eller rodnad i eller runt ögat
Endast vissa människor är i riskzonen för dessa problem. Du kanske vill genomgå en synundersökning för att se om du är i riskzonen och få förebyggande behandling om du är det.
6. Kramper
7. Låga saltnivåer (natrium) i blodet.
Äldre människor kan löpa större risk för detta. Symtom kan inkludera:
- huvudvärk
- förvirring, problem med att koncentrera sig eller tänka eller minnesproblem
- svaghet eller att känna sig ostadig
8. Sömnighet. Det är bäst att ta REMERON nära läggdags.
9. Allvarliga hudreaktioner: Ring din läkare omedelbart om du har något eller alla av följande symtom:
- allvarliga utslag med svullnad av huden (inklusive på handflatorna och fotsulorna)
- smärtsam rodnad av huden, blåsor eller sår på kroppen eller i munnen
10. Allvarliga allergiska reaktioner: andningssvårigheter, svullnad av ansikte, tunga, ögon eller mun
- utslag, kliande nässelutslag eller blåsor, ensamma eller med feber eller ledvärk
11. Ökar i aptit eller vikt. Barn och ungdomar bör övervakas längd och vikt under behandlingen.
12. Ökade kolesterol- och triglyceridnivåer i ditt blod
Börja inte med REMERON 15mg utan att först prata med din vårdgivare. Att stoppa REMERON 15mg för snabbt kan orsaka potentiellt allvarliga symtom inklusive:
- yrsel
- Trötthet
- kittlande känsla
- onormala drömmar
- förvirring
- illamående, kräkningar
- agitation
- huvudvärk
- svettas
- ångest
- skakning
Vad är REMERON 15mg?
REMERON 15mg är ett receptbelagt läkemedel som används för att behandla depression. Det är viktigt att prata med din vårdgivare om riskerna med att behandla depression och även riskerna med att inte behandla den. Du bör diskutera alla behandlingsval med din vårdgivare.
Prata med din vårdgivare om du inte tror att ditt tillstånd blir bättre med REMERON-behandling.
Vem bör inte ta REMERON 15mg?
Ta inte REMERON:
- om du är allergisk mot mirtazapin eller något av innehållsämnena i REMERON. Se slutet av denna medicineringsguide för en komplett lista över ingredienser i REMERON.
- om du tar en monoaminoxidashämmare (MAO-hämmare). Fråga din vårdgivare eller apotekspersonal om du är osäker på om du tar en MAO-hämmare, inklusive antibiotikumet linezolid.
- Ta inte en MAO-hämmare inom 2 veckor efter att du avslutat REMERON såvida inte din läkare uppmanas att göra det.
- Starta inte REMERON om du slutat ta en MAO-hämmare under de senaste 2 veckorna såvida inte din läkare har ordinerats att göra det.
Människor som tar REMERON 15mg nära en MAO-hämmare kan ha allvarliga eller till och med livshotande biverkningar. Få medicinsk hjälp omedelbart om du har något av dessa symtom:
- hög feber
- snabba förändringar i hjärtfrekvens eller blodtryck
- okontrollerade muskelspasmer
- förvirring
- stela muskler
- förlust av medvetande (svimma)
Vad ska jag berätta för min vårdgivare innan jag tar REMERON?
Innan du tar REMERON, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- tar vissa droger som:
- Triptaner används för att behandla migränhuvudvärk
- Läkemedel som används för att behandla humör, ångest, psykotiska störningar eller tankestörningar, inklusive tricykliska läkemedel, litium, SSRI, SNRI eller antipsykotika
- Tramadol används för att behandla smärta
- Receptfria kosttillskott som tryptofan eller johannesört
- Fenytoin, karbamazepin eller rifampicin (dessa läkemedel kan minska din blodnivå av REMERON)
- Cimetidin eller ketokonazol (dessa läkemedel kan öka din blodnivå av REMERON)
- Läkemedel som kan påverka ditt hjärtas rytm (som vissa antibiotika och vissa antipsykotika)
- har eller haft:
- leverproblem
- njurproblem
- hjärtproblem eller vissa tillstånd som kan förändra din hjärtrytm
- anfall eller kramper
- bipolär sjukdom eller mani
- en tendens att bli yr eller svimma
- är gravid eller planerar att bli gravid. Det är inte känt om REMERON kommer att skada ditt ofödda barn. Prata med din vårdgivare om fördelarna och riskerna med att behandla depression under graviditeten
- ammar eller planerar att amma. Vissa REMERON kan passera över i din bröstmjölk. Prata med din vårdgivare om det bästa sättet att mata ditt barn medan du tar REMERON
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. REMERON och vissa läkemedel kan interagera med varandra, kanske inte fungera lika bra eller kan orsaka allvarliga biverkningar.
Din vårdgivare eller apotekspersonal kan tala om för dig om det är säkert att ta REMERON 15 mg tillsammans med dina andra läkemedel. Starta eller sluta inte med någon medicin medan du tar REMERON utan att först prata med din läkare. Om du tar REMERON 30mg ska du inte ta några andra läkemedel som innehåller mirtazapin inklusive REMERON 30mgSolTab®.
Hur ska jag ta REMERON?
- Ta REMERON exakt som ordinerats. Din vårdgivare kan behöva ändra dosen av REMERON 15 mg tills det är rätt dos för dig.
- Ta REMERON vid samma tidpunkt varje dag, helst på kvällen vid sänggåendet.
- Svälj REMERON 15mg enligt anvisningarna.
- Det är vanligt att antidepressiva läkemedel som REMERON tar upp till några veckor innan du börjar må bättre. Sluta inte ta REMERON 15 mg om du inte känner resultat direkt.
- Sluta inte ta eller ändra dosen av REMERON 15 mg utan att först prata med din läkare, även om du känner dig bättre.
- REMERON kan tas med eller utan mat.
- Om du missar en dos av REMERON 30 mg, ta den missade dosen så snart du kommer ihåg det. Om det nästan är dags för nästa dos, hoppa över den missade dosen och ta din nästa dos vid ordinarie tidpunkt. Ta inte två doser REMERON 15 mg samtidigt.
- Om du tar för mycket REMERON 15mg, ring din vårdgivare eller giftcentral direkt, eller få akut behandling. Tecken på en överdos av REMERON (utan andra läkemedel eller alkohol) inkluderar:
- förvirring,
- minnesproblem
- dåsighet
- ökad hjärtrytm.
Symtomen på en möjlig överdos kan inkludera förändringar i din hjärtrytm (snabb, oregelbunden hjärtrytm) eller svimning, vilket kan vara symtom på ett livshotande tillstånd som kallas Torsades de Pointes.
Vad ska jag undvika när jag tar REMERON 15mg?
- REMERON kan orsaka sömnighet eller kan påverka din förmåga att fatta beslut, tänka klart eller reagera snabbt. Du ska inte köra bil, använda tunga maskiner eller göra andra farliga aktiviteter förrän du vet hur REMERON påverkar dig.
- Undvik att dricka alkohol eller ta diazepam (ett läkemedel som används för till exempel ångest, sömnlöshet och anfall) eller liknande mediciner när du tar REMERON. Om du är osäker på om vissa läkemedel kan tas med REMERON 30mg, vänligen diskutera med din läkare.
Vilka är de möjliga biverkningarna av REMERON?
REMERON kan orsaka allvarliga biverkningar:
- Se "Vad är den viktigaste informationen jag borde veta om REMERON?"
De vanligaste biverkningarna av REMERON inkluderar:
- sömnighet
- förstoppning
- ökad aptit
- yrsel
- viktökning
- muntorrhet onormala drömmar
Dessa är inte alla möjliga biverkningar av REMERON.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag slita REMERON?
- Förvara REMERON 15 mg i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
- Håll REMERON 15 mg borta från ljus.
- Förvara REMERON 30mg-flaskan väl stängd.
Förvara REMERON 30mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av REMERON.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte REMERON 15mg för ett tillstånd som det inte har ordinerats för. Ge inte REMERON till andra personer, även om de har samma symtom som du har. Det kan skada dem. Du kan fråga din apotekspersonal eller vårdgivare om information om REMERON 30mg som är skriven för vårdpersonal.
Vilka är ingredienserna i REMERON 15mg?
Aktiv beståndsdel: mirtazapin
Inaktiva Ingredienser :
- 15 mg tabletter: Stärkelse (majs), hydroxipropylcellulosa, magnesiumstearat, kolloidal kiseldioxid, laktos, hypromellos, polyetylenglykol 8000, titandioxid, järn(III)oxid (gul).
- 30 mg tabletter: Stärkelse (majs), hydroxipropylcellulosa, magnesiumstearat, kolloidal kiseldioxid, laktos, hypromellos, polyetylenglykol 8000, titandioxid, järnoxid (gul), järnoxid (röd).
- 45 mg tabletter: Stärkelse (majs), hydroxipropylcellulosa, magnesiumstearat, kolloidal kiseldioxid, laktos, hypromellos, polyetylenglykol 8000, titandioxid.
