Abilify 10mg, 15mg, 20mg Aripiprazole Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.

Vad är Abilify 20mg och hur används det?
Abilify är ett receptbelagt läkemedel som används för att behandla symptomen på schizofreni, bipolär sjukdom I (manodepression) och egentlig depression. Abilify 10mg kan användas ensamt eller tillsammans med andra mediciner. Abilify är ett antipsykotiskt, antimaniskt medel.
- Det är inte känt om Abilify är säkert och effektivt för barn yngre än 6 år.
Vilka är de möjliga biverkningarna av Abilify 15mg?
Abilify 15mg kan orsaka allvarliga biverkningar inklusive:
- allvarlig oro eller ångest,
- känner sig rastlös,
- ryckningar eller okontrollerbara rörelser i dina ögon, läppar, tunga, ansikte, armar eller ben,
- ansiktsmaskliknande utseende,
- problem med att svälja,
- talproblem,
- anfall (kramper),
- tankar på självmord eller självskada,
- stela eller stela muskler,
- hög feber,
- svettas,
- förvirring,
- snabba eller ojämna hjärtslag,
- skakningar (skakningar),
- känner sig yr,
- frossa,
- öm hals,
- munsår,
- hudsår,
- hosta,
- svårt att andas,
- ökad törst,
- ökad urinering,
- muntorrhet och
- fruktig andedräkt lukt
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Abilify 20mg inkluderar:
- okontrollerade muskelrörelser,
- ångest,
- känner sig rastlös,
- viktökning,
- illamående,
- kräkningar,
- förstoppning,
- ökad aptit,
- huvudvärk,
- yrsel,
- dåsighet,
- känner mig trött,
- sömnproblem (sömnlöshet),
- täppt näsa, och
- öm hals
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Abilify. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
ÖKAD DÖDLIGHET HOS ÄLDRE PATIENTER MED DEMENSREATERAT PSYKOS och SJÄLVmordstankar och -beteenden med antidepressiva droger
Äldre patienter med demensrelaterad psykos som behandlas med antipsykotiska läkemedel löper en ökad risk att dö. ABILIFY 20mg är inte godkänt för behandling av patienter med demensrelaterad psykos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
Antidepressiva läkemedel ökade risken för självmordstankar och självmordsbeteende hos barn, ungdomar och unga vuxna i korttidsstudier. Dessa studier visade ingen ökning av risken för suicidtankar och självmordsbeteende vid användning av antidepressiva läkemedel hos patienter över 24 år; det fanns en minskning av risken med användning av antidepressiva läkemedel hos patienter i åldern 65 år och äldre [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
Hos patienter i alla åldrar som påbörjas med antidepressiv behandling, övervaka noga för försämring och uppkomsten av självmordstankar och självmordsbeteenden. Informera familjer och vårdgivare om behovet av noggrann observation och kommunikation med förskrivaren [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
BESKRIVNING
Aripiprazol är ett psykotropiskt läkemedel som finns tillgängligt som ABILIFY® (aripiprazol) tabletter, ABILIFY DISCMELT® (aripiprazol) oralt sönderfallande tabletter, ABILIFY® (aripiprazol) oral lösning och ABILIFY® (aripiprazol) injektion, en lösning för intramuskulär injektion. Aripiprazol är 7-[4-[4-(2,3-diklorfenyl)-1-piperazinyl]butoxi]-3,4-dihydrokarbostyril. Den empiriska formeln är C23H27Cl2N3O2 och dess molekylvikt är 448,38. Den kemiska strukturen är:
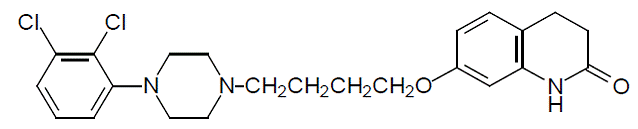
ABILIFY tabletter finns i styrkorna 2 mg, 5 mg, 10 mg, 15 mg, 20 mg och 30 mg. Inaktiva ingredienser inkluderar majsstärkelse, hydroxipropylcellulosa, laktosmonohydrat, magnesiumstearat och mikrokristallin cellulosa. Färgämnen inkluderar järnoxid (gul eller röd) och FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT Oralt sönderfallande tabletter finns i styrkorna 10 mg och 15 mg. Inaktiva ingredienser inkluderar acesulfamkalium, aspartam, kalciumsilikat, kroskarmellosnatrium, krospovidon, crème de vanilla (naturliga och artificiella smakämnen), magnesiumstearat, mikrokristallin cellulosa, kiseldioxid, vinsyra och xylitol. Färgämnen inkluderar järnoxid (gul eller röd) och FD&C Blue No. 2 Aluminium Lake.
ABILIFY oral lösning är en klar, färglös till ljusgul lösning tillgänglig i en koncentration av 1 mg/ml. De inaktiva ingredienserna i denna lösning inkluderar dinatriumedetat, fruktos, glycerin, dl-mjölksyra, metylparaben, propylenglykol, propylparaben, natriumhydroxid, sackaros och renat vatten. Den orala lösningen är smaksatt med naturlig apelsinkräm och andra naturliga smakämnen.
ABILIFY Injection finns i endosflaskor som en klar att använda, 9,75 mg/1,3 ml (7,5 mg/ml) klar, färglös, steril, vattenlösning endast för intramuskulär användning. Inaktiva ingredienser för denna lösning inkluderar 199,5 mg sulfobutyleter-β-cyklodextrin (SBECD), 10,4 mg vinsyra, qs till pH 4,3 av natriumhydroxid och qs till 1,33 ml vatten för injektion.
INDIKATIONER
ABILIFY orala tabletter, oralt sönderfallande tabletter och oral lösning är indicerade för behandling av:
- Schizofreni [se Kliniska studier ]
- Akut behandling av maniska och blandade episoder associerade med bipolär störning I [se Kliniska studier ]
- Tilläggsbehandling av allvarlig depressiv sjukdom [se Kliniska studier ]
- Irritabilitet associerad med autistisk sjukdom [se Kliniska studier ]
- Behandling av Tourettes sjukdom [se Kliniska studier ]
ABILIFY Injection är indicerat för behandling av:
- Agitation i samband med schizofreni eller bipolär mani [se Kliniska studier ]
DOSERING OCH ADMINISTRERING
Schizofreni
Vuxna
Den rekommenderade start- och måldosen för ABILIFY är 10 eller 15 mg/dag administrerat på ett schema en gång om dagen utan hänsyn till måltider. ABILIFY har systematiskt utvärderats och visat sig vara effektivt i ett dosintervall på 10 till 30 mg/dag, när det administreras som tablettformulering; dock var doser högre än 10 eller 15 mg/dag inte mer effektiva än 10 eller 15 mg/dag. Dosökningar bör i allmänhet inte göras förrän efter 2 veckor, den tid som krävs för att uppnå steady-state [se Kliniska studier ].
Underhållsbehandling: Bibehållande av effekt vid schizofreni visades i en studie som involverade patienter med schizofreni som hade varit symtomatiskt stabila på andra antipsykotiska läkemedel under perioder på 3 månader eller längre. Dessa patienter avbröts från dessa mediciner och randomiserades till antingen ABILIFY 15 mg/dag eller placebo, och observerades för återfall [se Kliniska studier ]. Patienter bör regelbundet utvärderas för att fastställa det fortsatta behovet av underhållsbehandling.
Tonåringar
Den rekommenderade måldosen av ABILIFY är 10 mg/dag. Aripiprazol studerades hos ungdomar i åldern 13 till 17 år med schizofreni i dagliga doser på 10 mg och 30 mg. Den dagliga startdosen av tablettformuleringen hos dessa patienter var 2 mg, som titrerades till 5 mg efter 2 dagar och till måldosen på 10 mg efter ytterligare 2 dagar. Efterföljande dosökningar bör administreras i steg om 5 mg. Dosen på 30 mg/dag visades inte vara mer effektiv än dosen på 10 mg/dag. ABILIFY kan administreras utan hänsyn till måltider [se Kliniska studier ]. Patienter bör regelbundet utvärderas för att fastställa behovet av underhållsbehandling.
Byte från andra antipsykotika
Det finns inga systematiskt insamlade data för att specifikt adressera byte av patienter med schizofreni från andra antipsykotika till ABILIFY 20 mg eller om samtidig administrering med andra antipsykotika. Även om omedelbart utsättande av den tidigare antipsykotiska behandlingen kan vara acceptabelt för vissa patienter med schizofreni, kan mer gradvis utsättning vara lämpligast för andra. I alla fall bör perioden med överlappande antipsykotisk administrering minimeras.
Bipolär störning I
Akut behandling av maniska och blandade episoder
Vuxna
Den rekommenderade startdosen för vuxna är 15 mg en gång dagligen som monoterapi och 10 mg till 15 mg en gång dagligen som tilläggsbehandling med litium eller valproat. ABILIFY 10mg kan ges utan hänsyn till måltider. Den rekommenderade måldosen av ABILIFY är 15 mg/dag, som monoterapi eller som tilläggsbehandling med litium eller valproat. Dosen kan ökas till 30 mg/dag baserat på kliniskt svar. Säkerheten för doser över 30 mg/dag har inte utvärderats i kliniska prövningar.
Pediatrik
Den rekommenderade startdosen för pediatriska patienter (10 till 17 år) som monoterapi är 2 mg/dag, med titrering till 5 mg/dag efter 2 dagar och en måldos på 10 mg/dag efter ytterligare 2 dagar. Rekommenderad dosering som tilläggsbehandling till litium eller valproat är densamma. Efterföljande dosökningar, om det behövs, bör administreras i steg om 5 mg/dag. ABILIFY kan ges utan hänsyn till måltider [se Kliniska studier ].
Tilläggsbehandling av allvarlig depressiv sjukdom
Vuxna
Den rekommenderade startdosen för ABILIFY som tilläggsbehandling för patienter som redan tar ett antidepressivt läkemedel är 2 till 5 mg/dag. Det rekommenderade doseringsintervallet är 2 till 15 mg/dag. Dosjusteringar på upp till 5 mg/dag bör ske gradvis, med minst 1 veckas intervall [se Kliniska studier ]. Patienter bör regelbundet utvärderas för att fastställa det fortsatta behovet av underhållsbehandling.
Irritabilitet associerad med autistisk sjukdom
Pediatriska patienter (6 till 17 år)
Det rekommenderade doseringsintervallet för behandling av pediatriska patienter med irritabilitet i samband med autistisk störning är 5 till 15 mg/dag.
Dosering bör påbörjas med 2 mg/dag. Dosen bör ökas till 5 mg/dag, med efterföljande ökningar till 10 eller 15 mg/dag vid behov. Dosjusteringar på upp till 5 mg/dag bör ske gradvis, med minst 1 veckas intervall [se Kliniska studier ]. Patienter bör regelbundet utvärderas för att fastställa det fortsatta behovet av underhållsbehandling.
Tourettes sjukdom
Pediatriska patienter (6 till 18 år)
Det rekommenderade dosintervallet för Tourettes sjukdom är 5 till 20 mg/dag.
För patienter som väger mindre än 50 kg bör doseringen påbörjas med 2 mg/dag med en måldos på 5 mg/dag efter 2 dagar. Dosen kan ökas till 10 mg/dag hos patienter som inte uppnår optimal kontroll av tics. Dosjusteringar bör ske gradvis med minst 1 veckas intervall.
För patienter som väger 50 kg eller mer bör doseringen påbörjas med 2 mg/dag i 2 dagar och sedan ökas till 5 mg/dag i 5 dagar, med en måldos på 10 mg/dag på dag 8. Dosen kan ökat upp till 20 mg/dag för patienter som inte uppnår optimal kontroll av tics. Dosjusteringar bör ske gradvis i steg om 5 mg/dag med minst 1 veckas intervall. [Ser Kliniska studier ].
Patienter bör regelbundet utvärderas för att fastställa det fortsatta behovet av underhållsbehandling.
Agitation associerad med schizofreni eller bipolär mani (intramuskulär injektion)
Vuxna
Den rekommenderade dosen för dessa patienter är 9,75 mg. Det rekommenderade dosintervallet är 5,25 till 15 mg. Ingen ytterligare fördel visades för 15 mg jämfört med 9,75 mg. En lägre dos på 5,25 mg kan övervägas när kliniska faktorer motiverar det. Om agitation som motiverar en andra dos kvarstår efter den initiala dosen, kan kumulativa doser upp till totalt 30 mg/dag ges. Effekten av upprepade doser av ABILIFY 10 mg injektion hos upprörda patienter har dock inte systematiskt utvärderats i kontrollerade kliniska prövningar. Säkerheten för totala dagliga doser större än 30 mg eller injektioner som ges oftare än varannan timme har inte utvärderats tillräckligt i kliniska prövningar [se Kliniska studier ].
Om pågående ABILIFY-behandling är kliniskt indicerad, bör oral ABILIFY i intervallet 10 till 30 mg/dag ersätta ABILIFY-injektion så snart som möjligt [se DOSERING OCH ADMINISTRERING ].
Administrering av ABILIFY-injektion
För att administrera ABILIFY 10 mg injektion, dra upp den erforderliga volymen lösning i sprutan enligt tabell 1. Kassera eventuell oanvänd del.
ABILIFY Injection är endast avsedd för intramuskulär användning. Administreras inte intravenöst eller subkutant. Injicera långsamt, djupt in i muskelmassan.
Parenterala läkemedelsprodukter bör inspekteras visuellt med avseende på partiklar och missfärgning före administrering, närhelst lösning och behållare tillåter.
Dosjusteringar för Cytochrome P450-överväganden
Dosjusteringar rekommenderas till patienter som är kända CYP2D6-låga metaboliserare och till patienter som samtidigt tar CYP3A4-hämmare eller CYP2D6-hämmare eller starka CYP3A4-inducerare (se tabell 2). När det samtidigt administrerade läkemedlet avbryts från kombinationsbehandlingen, ska ABILIFY 10 mg-dosen justeras till sin ursprungliga nivå. När den samtidigt administrerade CYP3A4-induceraren dras tillbaka, ska ABILIFY-dosen reduceras till den ursprungliga nivån under 1 till 2 veckor. Patienter som kan få en kombination av starka, måttliga och svaga hämmare av CYP3A4 och CYP2D6 (t.ex. en stark CYP3A4-hämmare och en måttlig CYP2D6-hämmare eller en måttlig CYP3A4-hämmare med en måttlig CYP2D6-hämmare), kan dosen reduceras till en -fjärdedel (25%) av den vanliga dosen initialt och sedan justerad för att uppnå ett gynnsamt kliniskt svar.
När tilläggsmedlet ABILIFY ges till patienter med egentlig depression, ska ABILIFY 10 mg administreras utan dosjustering enligt beskrivningen i Dosering och administrering (2.3).
Dosering av oral lösning
Den orala lösningen kan ersätta tabletter på mg-per-mg-basis upp till dosnivån 25 mg. Patienter som får 30 mg tabletter ska få 25 mg av lösningen [se KLINISK FARMAKOLOGI ].
Dosering av oralt sönderfallande tabletter
Doseringen för ABILIFY 10 mg oralt desintegrerande tabletter är densamma som för orala tabletter [se ovanstående avsnitt ].
HUR LEVERERAS
Doseringsformer och styrkor
ABILIFY® (aripiprazol) tabletter finns tillgängliga enligt beskrivningen i Tabell 3.
ABILIFY DISCMELT® (aripiprazol) oralt sönderfallande tabletter finns tillgängliga enligt beskrivningen i Tabell 4.
ABILIFY® (aripiprazol) oral lösning (1 mg/ml) är en klar, färglös till ljusgul lösning, som levereras i barnsäkra flaskor tillsammans med en kalibrerad oral doseringskopp.
ABILIFY® (aripiprazol) injektion för intramuskulär användning är en klar, färglös lösning tillgänglig som en färdig att använda, 9,75 mg/1,3 ml (7,5 mg/ml) lösning i klara glasflaskor av typ 1.
Förvaring Och Hantering
ABILIFY® (aripiprazol) tabletter har markeringar på ena sidan och finns i styrkorna och förpackningarna som anges i Tabell 32.
ABILIFY 15mg DISCMELT® (aripiprazol) oralt sönderfallande tabletter är runda tabletter med markeringar på vardera sidan. ABILIFY 15mg DISCMELT finns i styrkorna och förpackningarna som anges i Tabell 33.
ABILIFY® (aripiprazol) oral lösning (1 mg/ml) levereras i barnsäkra flaskor tillsammans med en kalibrerad oral doseringskopp. ABILIFY 20 mg oral lösning finns tillgänglig enligt följande:
150 mL flaska NDC 59148-013-15
ABILIFY® (aripiprazol) Injektion för intramuskulär användning finns tillgänglig som en bruksfärdig, 9,75 mg/1,3 ml (7,5 mg/ml) lösning i klara, typ 1 glasflaskor enligt följande:
9,75 mg/1,3 mL enkeldosflaska NDC 59148-016-65
Lagring
Tabletter
Förvara vid 25°C (77°F); utflykter tillåtna mellan 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ].
Oral lösning
Förvara vid 25°C (77°F); utflykter tillåtna mellan 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ]. Öppnade flaskor med ABILIFY oral lösning kan användas i upp till 6 månader efter öppnandet, men inte efter utgångsdatumet på flaskan. Flaskan och dess innehåll ska kasseras efter utgångsdatumet.
Injektion
Förvara vid 25°C (77°F); utflykter tillåtna mellan 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ]. Skydda mot ljus genom att förvara i originalförpackningen. Förvara i kartong tills den ska användas.
Distribueras och marknadsförs av Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc.,. Rev augusti 2019
BIEFFEKTER
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Ökad dödlighet hos äldre patienter med demensrelaterad psykos [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Cerebrovaskulära biverkningar, inklusive stroke [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Suicidala tankar och beteenden hos barn, ungdomar och unga vuxna [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Malignt neuroleptikasyndrom (NMS) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Tardiv dyskinesia [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Metaboliska förändringar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Patologiskt spelande och andra tvångsmässiga beteenden [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ortostatisk hypotoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Faller [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Leukopeni, Neutropeni och Agranulocytos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kramper/kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Potential för kognitiv och motorisk funktionsnedsättning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kroppstemperaturreglering [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Självmord [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Dysfagi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
De vanligaste biverkningarna hos vuxna patienter i kliniska prövningar (≥10%) var illamående, kräkningar, förstoppning, huvudvärk, yrsel, akatisi, ångest, sömnlöshet och rastlöshet.
De vanligaste biverkningarna i de pediatriska kliniska prövningarna (≥10%) var somnolens, huvudvärk, kräkningar, extrapyramidala störningar, trötthet, ökad aptit, sömnlöshet, illamående, nasofaryngit och viktökning.
ABILIFY har utvärderats för säkerhet hos 13 543 vuxna patienter som deltog i kliniska prövningar med flera doser av schizofreni, bipolär sjukdom, egentlig depression, demens av Alzheimers typ, Parkinsons sjukdom och alkoholism, och som hade cirka 7 619 patientår av exponering för oral ABILIFY 10 mg och 749 patienter med exponering för ABILIFY-injektion. Totalt 3390 patienter behandlades med oral ABILIFY i minst 180 dagar och 1933 patienter som behandlades med oral ABILIFY hade minst 1 års exponering.
ABILIFY 15mg har utvärderats för säkerhet hos 1 686 patienter (6 till 18 år) som deltog i kliniska prövningar med flera doser av schizofreni, bipolär mani, autistisk störning eller Tourettes sjukdom och som hade exponering för oral ABILIFY i cirka 1 342 patientår. . Totalt 959 pediatriska patienter behandlades med oral ABILIFY i minst 180 dagar och 556 pediatriska patienter som behandlades med oral ABILIFY 10 mg hade minst 1 års exponering.
Tillstånden och varaktigheten av behandlingen med ABILIFY (monoterapi och tilläggsbehandling med antidepressiva eller humörstabilisatorer) inkluderade (i överlappande kategorier) dubbelblinda, jämförande och icke-jämförande öppna studier, slutenvårds- och öppenvårdsstudier, studier med fasta och flexibla doser, och kort- och långtidsexponering.
Erfarenhet av kliniska prövningar
Vuxna patienter med schizofreni
Följande fynd är baserade på en pool av fem placebokontrollerade studier (fyra 4-veckors och en 6-veckors) där oral ABILIFY 15 mg administrerades i doser från 2 till 30 mg/dag.
Vanligt observerade biverkningar
Den enda vanligen observerade biverkningen i samband med användning av ABILIFY 20 mg hos patienter med schizofreni (incidens på 5 % eller mer och ABILIFY-incidens minst dubbelt så hög som för placebo) var akatisi (ABILIFY 8 %; placebo 4 %).
Vuxna patienter med bipolär mani
Monoterapi
Följande fynd är baserade på en pool av 3-veckors placebokontrollerade, bipolär manistudier där oral ABILIFY 15 mg administrerades i doser på 15 eller 30 mg/dag.
Vanligt observerade biverkningar
Vanliga observerade biverkningar associerade med användning av ABILIFY hos patienter med bipolär mani (incidens på 5 % eller mer och ABILIFY 15 mg incidens minst dubbelt så hög som för placebo) visas i Tabell 16.
Mindre vanliga biverkningar hos vuxna
Tabell 17 räknar upp den sammanslagna incidensen, avrundad till närmaste procent, av biverkningar som inträffade under akut behandling (upp till 6 veckor vid schizofreni och upp till 3 veckor vid bipolär mani), inklusive endast de reaktioner som inträffade hos 2 % eller mer av patienter som behandlats med ABILIFY (doser ≥2 mg/dag) och för vilka incidensen hos patienter behandlade med ABILIFY 20 mg var högre än incidensen hos patienter som behandlades med placebo i den kombinerade datamängden.
En undersökning av populationsundergrupper avslöjade inga tydliga bevis för differentiell biverkningsincidens på grundval av ålder, kön eller ras.
Vuxna patienter med tilläggsterapi med bipolär mani
Följande fynd är baserade på en placebokontrollerad studie av vuxna patienter med bipolär sjukdom där ABILIFY 15 mg administrerades i doser på 15 eller 30 mg/dag som tilläggsbehandling med litium eller valproat.
Biverkningar i samband med avbrytande av behandlingen
I en studie av patienter som redan tolererade antingen litium eller valproat som monoterapi, var utsättningsfrekvensen på grund av biverkningar 12 % för patienter som behandlades med tilläggsmedlet ABILIFY jämfört med 6 % för patienter som behandlades med tilläggsplacebo. De vanligaste biverkningarna förknippade med utsättning av behandling med ABILIFY som tilläggsbehandling jämfört med placebobehandlade patienter var akatisi (5 % respektive 1 %) och tremor (2 % respektive 1 %).
Vanligt observerade biverkningar
De vanligast observerade biverkningarna förknippade med tilläggsmedlet ABILIFY och litium eller valproat hos patienter med bipolär mani (incidens på 5 % eller mer och incidens minst dubbelt så hög som för tilläggsplacebo) var: akatisi, sömnlöshet och extrapyramidal störning.
Mindre vanliga biverkningar hos vuxna patienter med tilläggsterapi vid bipolär mani
Tabell 18 räknar upp förekomsten, avrundad till närmaste procent, av biverkningar som inträffade under akut behandling (upp till 6 veckor), inklusive endast de reaktioner som inträffade hos 2 % eller fler av patienterna som behandlades med tilläggsmedlet ABILIFY (doser på 15 eller 30 mg/dag) och litium eller valproat och för vilka incidensen hos patienter som behandlades med denna kombination var högre än förekomsten hos patienter behandlade med placebo plus litium eller valproat.
Pediatriska patienter (13 till 17 år) med schizofreni
Följande fynd är baserade på en 6-veckors placebokontrollerad studie där oral ABILIFY administrerades i doser från 2 till 30 mg/dag.
Biverkningar i samband med avbrytande av behandlingen
Incidensen av avbrott på grund av biverkningar mellan ABILIFY-behandlade och placebobehandlade pediatriska patienter (13 till 17 år) var 5 % respektive 2 %.
Vanligt observerade biverkningar
Vanliga observerade biverkningar associerade med användning av ABILIFY 10 mg hos ungdomar med schizofreni (incidens på 5 % eller mer och ABILIFY-incidens minst dubbelt så hög som för placebo) var extrapyramidal störning, somnolens och tremor.
Pediatriska patienter (10 till 17 år) med bipolär mani
Följande fynd baseras på en 4-veckors placebokontrollerad studie där oral ABILIFY administrerades i doser på 10 eller 30 mg/dag.
Biverkningar i samband med avbrytande av behandlingen
Incidensen av avbrott på grund av biverkningar mellan ABILIFY-behandlade och placebobehandlade pediatriska patienter (10 till 17 år) var 7 % respektive 2 %.
Vanligt observerade biverkningar
Vanliga observerade biverkningar associerade med användning av ABILIFY 20 mg hos pediatriska patienter med bipolär mani (incidens på 5 % eller mer och ABILIFY-incidens minst dubbelt så hög som för placebo) visas i Tabell 19.
Pediatriska patienter (6 till 17 år) med autistisk sjukdom
Följande fynd är baserade på två 8-veckors placebokontrollerade studier där oral ABILIFY 20 mg administrerades i doser på 2 till 15 mg/dag.
Biverkningar i samband med avbrytande av behandlingen
Incidensen av avbrott på grund av biverkningar mellan ABILIFY-behandlade och placebobehandlade pediatriska patienter (6 till 17 år) var 10 % respektive 8 %.
Vanligt observerade biverkningar
Vanliga observerade biverkningar associerade med användning av ABILIFY hos pediatriska patienter med autistisk sjukdom (incidens på 5 % eller mer och ABILIFY 10 mg incidens minst dubbelt så hög som för placebo) visas i Tabell 20.
Pediatriska patienter (6 till 18 år) med Tourettes sjukdom
Följande fynd är baserade på en 8-veckors och en 10-veckors, placebokontrollerad prövning där oral ABILIFY 15 mg administrerades i doser på 2 till 20 mg/dag.
Biverkningar i samband med avbrytande av behandlingen
Incidensen av avbrott på grund av biverkningar mellan ABILIFY-behandlade och placebobehandlade pediatriska patienter (6 till 18 år) var 7 % respektive 1 %.
Vanligt observerade biverkningar
Vanliga observerade biverkningar associerade med användning av ABILIFY hos pediatriska patienter med Tourettes sjukdom (incidens på 5 % eller mer och ABILIFY 10 mg incidens minst dubbelt så hög som för placebo) visas i Tabell 21.
Mindre vanliga biverkningar hos pediatriska patienter (6 till 18 år) med schizofreni, bipolär mani, autistisk störning eller Tourettes sjukdom
Tabell 22 räknar upp den sammanslagna förekomsten, avrundad till närmaste procent, av biverkningar som inträffade under akut terapi (upp till 6 veckor vid schizofreni, upp till 4 veckor vid bipolär mani, upp till 8 veckor vid autistisk sjukdom och upp till 10 veckor vid Tourettes sjukdom), inklusive endast de reaktioner som inträffade hos 2 % eller fler av pediatriska patienter som behandlades med ABILIFY (doser ≥2 mg/dag) och för vilka incidensen hos patienter som behandlades med ABILIFY 10 mg var högre än förekomsten hos patienter som behandlades med placebo.
Vuxna patienter som får ABILIFY som tilläggsbehandling av allvarlig depressiv sjukdom
Följande fynd är baserade på en pool av två placebokontrollerade studier på patienter med egentlig depression där ABILIFY 20 mg administrerades i doser på 2 mg till 20 mg som tilläggsbehandling till fortsatt antidepressiv behandling.
Biverkningar i samband med avbrytande av behandlingen
Incidensen av avbrott på grund av biverkningar var 6 % för patienter som fick tilläggsbehandling med ABILIFY och 2 % för patienter som fick tilläggsplacebo.
Vanligt observerade biverkningar
De vanligast observerade biverkningarna i samband med användning av tilläggsmedlet ABILIFY 15 mg hos patienter med egentlig depression (incidens på 5 % eller mer och ABILIFY 15 mg incidens minst dubbelt så hög som för placebo) var: akatisi, rastlöshet, sömnlöshet, förstoppning, trötthet och suddig syn.
Mindre vanliga biverkningar hos vuxna patienter med allvarlig depressiv sjukdom
Tabell 23 räknar upp den sammanslagna incidensen, avrundad till närmaste procent, av biverkningar som inträffade under akut behandling (upp till 6 veckor), inklusive endast de biverkningar som inträffade hos 2 % eller fler av patienterna som behandlades med tilläggsmedlet ABILIFY (doser ≥2) mg/dag) och för vilka incidensen hos patienter som behandlades med tilläggsmedlet ABILIFY 10 mg var högre än incidensen hos patienter som behandlades med tilläggsplacebo i den kombinerade datamängden.
Patienter med agitation associerad med schizofreni eller bipolär mani (intramuskulär injektion)
Följande fynd är baserade på en pool av tre placebokontrollerade studier på patienter med agitation associerad med schizofreni eller bipolär mani där ABILIFY 20 mg injektion administrerades i doser på 5,25 mg till 15 mg.
Vanligt observerade biverkningar
Det fanns en vanlig observerad biverkning (illamående) i samband med användning av ABILIFY 10 mg injektion hos patienter med agitation förknippad med schizofreni och bipolär mani (incidens på 5 % eller mer och ABILIFY 20 mg incidens minst dubbelt så hög som för placebo).
Mindre vanliga biverkningar hos patienter med agitation associerad med schizofreni eller bipolär mani
Tabell 24 räknar upp den sammanslagna incidensen, avrundad till närmaste procent, av biverkningar som inträffade under akut behandling (24 timmar), inklusive endast de biverkningar som inträffade hos 2 % eller fler av patienterna som behandlades med ABILIFY-injektion (doser ≥5,25 mg) /dag) och för vilka incidensen hos patienter behandlade med ABILIFY 15 mg-injektion var högre än förekomsten hos patienter behandlade med placebo i den kombinerade datamängden.
Dosrelaterade biverkningar
Schizofreni
Dosresponssamband för incidensen av behandlingsuppkomna biverkningar utvärderades från fyra studier på vuxna patienter med schizofreni där olika fasta doser (2, 5, 10, 15, 20 och 30 mg/dag) av oral ABILIFY jämfördes med placebo. Denna analys, stratifierad genom studie, visade att den enda biverkningen som hade ett möjligt dosresponssamband, och då mest framträdande endast med 30 mg, var somnolens [inklusive sedering]; (incidensen var placebo, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
I studien av pediatriska patienter (13 till 17 år) med schizofreni verkade tre vanliga biverkningar ha ett möjligt dosresponssamband: extrapyramidal störning (incidensen var placebo, 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); somnolens (incidensen var placebo, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); och tremor (incidensen var placebo, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Bipolär mani
studien av pediatriska patienter (10 till 17 år) med bipolär mani hade fyra vanliga biverkningar ett möjligt dosresponssamband efter 4 veckor; extrapyramidal störning (incidensen var placebo, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); somnolens (incidensen var placebo, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); akatisi (incidensen var placebo, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); och saliv hypersekretion (incidensen var placebo, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Autistisk sjukdom
I en studie av pediatriska patienter (6 till 17 år) med autistisk störning hade en vanlig biverkning ett möjligt dosresponssamband: trötthet (incidensen var placebo, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5 %).
Tourettes sjukdom
I en studie av pediatriska patienter (7 till 17 år) med Tourettes sjukdom hade inga vanliga biverkningar ett dosresponssamband.
Extrapyramidala symtom
Schizofreni
kortvariga, placebokontrollerade studier av schizofreni hos vuxna var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för ABILIFY-behandlade patienter 13 % jämfört med 12 % för placebo; och incidensen av akatisirelaterade händelser för ABILIFY-behandlade patienter var 8 % mot 4 % för placebo. I den kortsiktiga, placebokontrollerade studien av schizofreni hos pediatriska patienter (13 till 17 år) var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för ABILIFY-behandlade patienter 25 % mot 7 % för placebo; och incidensen av akatisirelaterade händelser för ABILIFY-behandlade patienter var 9 % mot 6 % för placebo.
Objektivt insamlad data från dessa försök samlades in på Simpson Angus Rating Scale (för EPS), Barnes Akathisia Scale (för akatisi) och Assessments of Involuntary Movement Scales (för dyskinesier). I schizofrenistudierna för vuxna visade de objektivt insamlade data ingen skillnad mellan ABILIFY 10 mg och placebo, med undantag för Barnes Akathisia Scale (ABILIFY 20 mg, 0,08; placebo, -0,05). I den pediatriska (13 till 17 år) schizofrenistudien visade objektivt insamlade data ingen skillnad mellan ABILIFY 20 mg och placebo, med undantag för Simpson Angus Rating Scale (ABILIFY 20 mg, 0,24; placebo, -0,29).
På liknande sätt, i en långvarig (26-veckors), placebokontrollerad studie av schizofreni hos vuxna, objektivt insamlade data om Simpson Angus Rating Scale (för EPS), Barnes Akathisia Scale (för akatisi) och Assessments of Involuntary Movement Scales (för dyskinesier) visade ingen skillnad mellan ABILIFY och placebo.
Bipolär mani
de kortsiktiga, placebokontrollerade studierna av bipolär mani hos vuxna, var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för ABILIFY-behandlade patienter med monoterapi 16 % jämfört med 8 % för placebo och incidensen av akatisirelaterade händelser för monoterapi ABILIFY-behandlade patienter var 13 % jämfört med 4 % för placebo. I den 6 veckor långa, placebokontrollerade studien med bipolär mani för tilläggsbehandling med litium eller valproat, var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi för patienter behandlade med tilläggs ABILIFY, 15 % jämfört med 8 % för tilläggsbehandling. placebo och incidensen av akatisirelaterade händelser för patienter behandlade med tilläggs ABILIFY var 19 % jämfört med 5 % för tilläggsplacebo. I den kortsiktiga, placebokontrollerade studien av bipolär mani hos pediatriska (10 till 17 år) patienter var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för ABILIFY-behandlade patienter 26 % mot 5 % för placebo och incidensen av akatisirelaterade händelser för ABILIFY-behandlade patienter var 10 % mot 2 % för placebo.
försök med bipolär mani för vuxna med ABILIFY monoterapi, visade Simpson Angus Rating Scale och Barnes Akathisia Scale en signifikant skillnad mellan ABILIFY 15mg och placebo (ABILIFY, 0,50; placebo, -0,01 och ABILIFY 10mg, 0,20,0; placebo, -5). Förändringar i bedömningar av ofrivilliga rörelser var liknande för ABILIFY 15 mg och placebogrupperna. I försöken med bipolär mani med ABILIFY 20 mg som tilläggsterapi med antingen litium eller valproat, visade Simpson Angus Rating Scale och Barnes Akathisia Scale en signifikant skillnad mellan adjuvant ABILIFY och adjuvant placebo (ABILIFY 20 mg, 0,70, 0,70, ABILg och placebo). 0,30; placebo, 0,11). Förändringar i bedömningar av ofrivilliga rörelser var liknande för tilläggs ABILIFY 20 mg och tilläggsplacebo. I den pediatriska (10 till 17 år), korttidsstudien med bipolär mani, visade Simpson Angus Rating Scale en signifikant skillnad mellan ABILIFY 10 mg och placebo (ABILIFY 15 mg, 0,90; placebo, -0,05). Förändringar i Barnes Akathisia-skalan och bedömningarna av ofrivilliga rörelser var liknande för gruppen ABILIFY 20 mg och placebo.
Major depressiv sjukdom
I de kortsiktiga, placebokontrollerade studierna av egentlig depressiv sjukdom var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för patienter behandlade med tilläggs ABILIFY 8 % jämfört med 5 % för patienter behandlade med tilläggsplacebo; och incidensen av akatisirelaterade händelser för patienter behandlade med tilläggs ABILIFY var 25 % jämfört med 4 % för patienter behandlade med tilläggsplacebo.
I försöken med major depressiva sjukdomar visade Simpson Angus Rating Scale och Barnes Akathisia Scale en signifikant skillnad mellan adjuvant ABILIFY och adjuvant placebo (ABILIFY 10 mg, 0,31; placebo, 0,03 och ABILIFY, 0,22; placebo, 0,02). Förändringar i bedömningar av ofrivilliga rörelser var liknande för de kompletterande ABILIFY-grupperna och de tilläggsplacebogrupperna.
Autistisk sjukdom
de kortsiktiga, placebokontrollerade studierna av autistisk sjukdom hos pediatriska patienter (6 till 17 år), var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för ABILIFY-behandlade patienter 18 % mot 2 % för placebo och incidensen av akatisirelaterade händelser för ABILIFY-behandlade patienter var 3 % mot 9 % för placebo.
I de pediatriska (6 till 17 år) prövningarna med kortvariga autistiska störningar visade Simpson Angus Rating Scale en signifikant skillnad mellan ABILIFY och placebo (ABILIFY 20 mg, 0,1; placebo, -0,4). Förändringar i Barnes Akathisia-skalan och bedömningarna av ofrivilliga rörelser var liknande för gruppen ABILIFY 10 mg och placebo.
Tourettes sjukdom
de kortsiktiga, placebokontrollerade studierna av Tourettes sjukdom hos pediatriska patienter (6 till 18 år), var incidensen av rapporterade EPS-relaterade händelser, exklusive händelser relaterade till akatisi, för ABILIFY-behandlade patienter 7 % mot 6 % för placebo och incidensen av akatisirelaterade händelser för ABILIFY-behandlade patienter var 4 % mot 6 % för placebo.
I de pediatriska (6 till 18 år) korttidsstudierna med Tourettes sjukdom var förändringar i Simpson Angus Rating Scale, Barnes Akathisia Scale och Assessments of Involuntary Movement Scale inte kliniskt meningsfullt olika för ABILIFY 15 mg och placebo.
Agitation associerad med schizofreni eller bipolär mani
de placebokontrollerade studierna på patienter med agitation associerad med schizofreni eller bipolär mani, var incidensen av rapporterade EPS-relaterade händelser exklusive händelser relaterade till akatisi för ABILIFY-behandlade patienter 2 % mot 2 % för placebo och incidensen av akatisi- relaterade händelser för ABILIFY-behandlade patienter var 2 % mot 0 % för placebo. Objektivt insamlade data på Simpson Angus Rating Scale (för EPS) och Barnes Akathisia Scale (för akatisi) för alla behandlingsgrupper visade ingen skillnad mellan ABILIFY 10 mg och placebo.
Dystoni
Symtom på dystoni, långvariga onormala sammandragningar av muskelgrupper, kan förekomma hos känsliga individer under de första dagarna av behandlingen. Dystoniska symtom inkluderar: spasmer i nackmusklerna, som ibland utvecklas till täthet i halsen, sväljsvårigheter, andningssvårigheter och/eller utskjutande tunga. Även om dessa symtom kan uppträda vid låga doser, förekommer de oftare och med större svårighetsgrad med hög styrka och vid högre doser av första generationens antipsykotiska läkemedel. En förhöjd risk för akut dystoni observeras hos män och yngre åldersgrupper.
Ytterligare fynd observerade i kliniska prövningar
Biverkningar i långvariga, dubbelblinda, placebokontrollerade försök
De biverkningar som rapporterades i en 26-veckors dubbelblind studie som jämförde oral ABILIFY 10 mg och placebo hos patienter med schizofreni överensstämde generellt med de som rapporterades i de kortsiktiga, placebokontrollerade studierna, förutom en högre incidens av tremor [8 % (12/153) för ABILIFY 20 mg vs. 2% (3/153) för placebo]. I denna studie var majoriteten av fallen av tremor av mild intensitet (8/12 mild och 4/12 måttlig), inträffade tidigt i behandlingen (9/12 ≤49 dagar) och var av begränsad varaktighet (7/12 ≤ 10 dagar). Tremor ledde sällan till utsättning (
Andra biverkningar som observerats under premarketingutvärderingen av ABILIFY
Följande lista inkluderar inte reaktioner: 1) som redan finns upptagna i tidigare tabeller eller på andra ställen i märkningen, 2) för vilka en drogorsak var avlägsen, 3) som var så allmänna att de inte var informativa, 4) som inte ansågs ha betydande kliniska implikationer, eller 5) som inträffade i en takt lika med eller mindre än placebo.
Reaktioner kategoriseras efter kroppssystem enligt följande definitioner: frekventa biverkningar är de som inträffar hos minst 1/100 patienter; sällsynta biverkningar är de som inträffar hos 1/100 till 1/1000 patienter; sällsynta reaktioner är de som inträffar hos färre än 1/1000 patienter:
Vuxna - Muntlig administrering
Blod- och lymfsystemet: sällsynt - trombocytopeni
Hjärtsjukdomar: sällsynt - bradykardi, hjärtklappning, sällsynt - förmaksfladder, hjärtstillestånd, atrioventrikulär blockering, förmaksflimmer, angina pectoris, myokardischemi, hjärtinfarkt, hjärt- och lungsvikt
Ögonstörningar: sällsynt - fotofobi; sällsynt - diplopi
Gastrointestinala störningar: sällsynt - gastroesofageal refluxsjukdom
Allmänna störningar och villkor för administrationsplatsen: frekvent - asteni; sällsynt - perifert ödem, bröstsmärta; sällsynt - ansiktsödem
Lever och gallvägar: sällsynt - hepatit, gulsot
Immunsystemets störningar : sällsynt - överkänslighet
Skada, förgiftning och procedurkomplikationer: sällsynt - falla; sällsynt - värmeslag
Undersökningar: frekvent - viktminskning, sällan - ökat leverenzym, ökat blodsocker, ökat blodlaktatdehydrogenas, ökat gamma-glutamyltransferas; sällsynt - ökat prolaktin i blodet, ökat urea i blodet, ökat kreatinin i blodet, ökat bilirubin i blodet, EKQ-QT förlängt, ökat glykosylerat hemoglobin
Metabolism och näringsstörningar: frekvent - anorexi; sällsynt - hypokalemi, hyponatremi, hypoglykemi
Muskuloskeletala och bindvävssjukdomar: sällsynt - muskelsvaghet, muskeltäthet; sällsynt - rabdomyolys, minskad rörlighet
Störningar i nervsystemet: sällsynt - parkinsonism, minnesstörning, kugghjulsstyvhet, hypokinesi, bradykinesi; sällsynta - akinesi, myoklonus, onormal koordination, talstörning, Grand Mal-konvulsion;
Psykiatriska störningar: sällsynt - aggression, förlust av libido, delirium; sällsynt - ökad libido, anorgasmi, tic, mordtankar, katatoni, sömngång
Njur- och urinvägsstörningar: sällsynt - urinretention, natturi
Reproduktionssystemet och bröststörningar: sällsynt - erektil dysfunktion; sällsynt - gynekomasti, oregelbunden menstruation, amenorré, bröstsmärtor, priapism
Respiratoriska, thorax- och mediastinumsjukdomar: sällsynt - nästäppa, dyspné
Hud och subkutan vävnad: sällsynt - utslag, hyperhidros, klåda, ljuskänslighetsreaktion, alopeci; sällsynt - urtikaria
Vaskulära sjukdomar: sällsynt - hypotoni, hypertoni
Pediatriska patienter - Oral administrering
De flesta biverkningar som observerats i den poolade databasen med 1 686 pediatriska patienter i åldern 6 till 18 år observerades också i den vuxna populationen. Ytterligare biverkningar som observerats i den pediatriska populationen listas nedan.
Ögonstörningar sällsynt - oculologisk kris
Gastrointestinala störningar: sällan -torr i tungan, spasm i tungan
Undersökningar: frekvent - blodinsulin ökat
Störningar i nervsystemet: sällan - sömnsamtal
Njur- och urinvägsstörningar frekvent - enures
Hud och subkutan vävnad: sällsynt - hirsutism
Vuxna - Intramuskulär injektion
De flesta biverkningar som observerats i den sammanslagna databasen med 749 vuxna patienter som behandlats med ABILIFY-injektion, observerades också i den vuxna populationen som behandlades med oral ABILIFY. Ytterligare biverkningar som observerats i ABILIFY-injektionspopulationen listas nedan.
Allmänna störningar och villkor för administrationsplatsen: ≥1/100 patienter - reaktion på injektionsstället; ≥1/1000 patienter och
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av ABILIFY efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att fastställa ett orsakssamband till läkemedelsexponering: förekomst av allergisk reaktion (anafylaktisk reaktion, angioödem, laryngospasm, klåda/urtikaria eller orofaryngeal spasm), patologiskt spelande. , hicka och blodsockerfluktuationer.
LÄKEMEDELSINTERAKTIONER
Läkemedel som har kliniskt viktiga interaktioner med ABILIFY
Läkemedel som inte har några kliniskt viktiga interaktioner med ABILIFY
Baserat på farmakokinetiska studier krävs ingen dosjustering av ABILIFY när det administreras samtidigt med famotidin, valproat, litium, lorazepam.
Dessutom är ingen dosjustering nödvändig för substrat av CYP2D6 (t.ex. dextrometorfan, fluoxetin, paroxetin eller venlafaxin), CYP2C9 (t.ex. warfarin), CYP2C19 (t.ex. omeprazol, warfarin, escitalopram) eller CYP3Ax4n när det administreras tillsammans med ABILIFY. Dessutom är ingen dosjustering nödvändig för valproat, litium, lamotrigin, lorazepam eller sertralin vid samtidig administrering med ABILIFY [se KLINISK FARMAKOLOGI ].
Narkotikamissbruk och beroende
Kontrollerad substans
ABILIFY är inte ett kontrollerat ämne.
Missbruk
ABILIFY har inte systematiskt studerats på människor för dess potential för missbruk, tolerans eller fysiskt beroende. Följaktligen bör patienter utvärderas noggrant med avseende på en historia av drogmissbruk, och sådana patienter bör observeras noggrant med avseende på tecken på ABILIFY 20 mg missbruk eller missbruk (t.ex. utveckling av tolerans, ökad dos, läkemedelssökande beteende).
Beroende
I studier av fysiskt beroende på apor observerades abstinenssymtom vid plötsligt upphörande av doseringen. Även om de kliniska prövningarna inte avslöjade någon tendens till något läkemedelssökande beteende, var dessa observationer inte systematiska och det är inte möjligt att på basis av denna begränsade erfarenhet förutsäga i vilken utsträckning ett CNS-aktivt läkemedel kommer att missbrukas, avledas, och/eller missbrukas när den väl har marknadsförts.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Ökad dödlighet hos äldre patienter med demensrelaterad psykos
Ökad dödlighet
Äldre patienter med demensrelaterad psykos som behandlas med antipsykotiska läkemedel löper en ökad risk att dö. ABILIFY (aripiprazol) är inte godkänt för behandling av patienter med demensrelaterad psykos [se VARNING].
Säkerhetserfarenhet hos äldre patienter med psykos associerad med Alzheimers sjukdom
I tre, 10 veckor långa, placebokontrollerade studier av ABILIFY 10 mg på äldre patienter med psykos associerad med Alzheimers sjukdom (n=938; medelålder: 82,4 år; intervall: 56-99 år), var de biverkningar som var rapporterades med en incidens på ≥3 % och ABILIFY 15 mg incidens minst dubbelt så stor som för placebo var letargi  [placebo 2 %, ABILIFY 5 %], somnolens (inklusive sedering) [placebo 3 %, ABILIFY 8 %] och inkontinens (främst , urininkontinens) [placebo 1 %, ABILIFY 5 %], överdriven salivutsöndring [placebo 0 %, ABILIFY 4 %] och yrsel [placebo 1 %, ABILIFY 4 %].
Säkerheten och effekten av ABILIFY 15 mg vid behandling av patienter med psykos associerad med demens har inte fastställts. Om förskrivaren väljer att behandla sådana patienter med ABILIFY 15 mg, utvärdera för uppkomsten av svårigheter att svälja eller överdriven somnolens, vilket kan predisponera för oavsiktlig skada eller aspiration [se LÅDA VARNING ].
Cerebrovaskulära biverkningar, inklusive stroke
I placebokontrollerade kliniska studier (två flexibla doser och en studie med fasta doser) av demensrelaterad psykos, fanns en ökad förekomst av cerebrovaskulära biverkningar (t.ex. stroke, övergående ischemisk attack), inklusive dödsfall, hos ABILIFY-behandlade patienter ( medelålder: 84 år; intervall: 78-88 år). I studien med fast dos fanns det ett statistiskt signifikant dosresponssamband för cerebrovaskulära biverkningar hos patienter som behandlades med ABILIFY. ABILIFY är inte godkänt för behandling av patienter med demensrelaterad psykos [se LÅDA VARNING ].
Självmordstankar och -beteenden hos barn, ungdomar och unga vuxna
Patienter med egentlig depression (MDD), både vuxna och barn, kan uppleva förvärring av sin depression och/eller uppkomsten av självmordstankar och självmordsbeteende (suicidalitet) eller ovanliga beteendeförändringar, oavsett om de tar antidepressiva mediciner eller inte, och detta risken kan kvarstå tills betydande remission inträffar. Självmord är en känd risk för depression och vissa andra psykiatriska störningar, och dessa störningar i sig är de starkaste prediktorerna för självmord. Det har dock funnits en långvarig oro för att antidepressiva medel kan ha en roll i att framkalla förvärring av depression och uppkomsten av suicidalitet hos vissa patienter under de tidiga faserna av behandlingen. Sammanlagda analyser av kortsiktiga, placebokontrollerade studier av antidepressiva läkemedel (SSRI och andra) visade att dessa läkemedel ökar risken för suicidtänkande och suicidalitet (suicidalitet) hos barn, ungdomar och unga vuxna (18-24 år) med MDD och andra psykiatriska störningar. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det var en minskning med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre.
De sammanslagna analyserna av placebokontrollerade studier på barn och ungdomar med MDD, tvångssyndrom (OCD) eller andra psykiatriska störningar inkluderade totalt 24 korttidsstudier av 9 antidepressiva läkemedel på över 4400 patienter. De sammanslagna analyserna av placebokontrollerade studier på vuxna med MDD eller andra psykiatriska störningar inkluderade totalt 295 korttidsstudier (medianlängd på 2 månader) av 11 antidepressiva läkemedel på över 77 000 patienter. Det fanns avsevärd variation i risk för suicidalitet bland droger, men en tendens till en ökning av de yngre patienterna för nästan alla studerade droger. Det fanns skillnader i absolut risk för suicidalitet mellan de olika indikationerna, med den högsta förekomsten av MDD. Riskskillnaderna (läkemedel kontra placebo) var dock relativt stabila inom åldersskikt och över indikationer. Dessa riskskillnader (skillnad mellan läkemedel och placebo i antalet fall av suicidalitet per 1000 behandlade patienter) anges i Tabell 5.
Inga självmord inträffade i någon av de pediatriska prövningarna. Det förekom självmord i vuxenstudierna, men antalet var inte tillräckligt för att dra någon slutsats om läkemedelseffekt på självmord.
Det är okänt om suicidalitetsrisken sträcker sig till långvarig användning, dvs. längre än flera månader. Det finns dock betydande bevis från placebokontrollerade underhållsstudier på vuxna med depression att användning av antidepressiva medel kan fördröja återkommande depression.
Alla patienter som behandlas med antidepressiva medel för någon indikation bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet och ovanliga beteendeförändringar, särskilt under de första månaderna av en läkemedelsbehandlingskur, eller vid tidpunkter med dosförändringar, antingen ökningar eller minskar.
Följande symtom, ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani och mani, har rapporterats hos vuxna och pediatriska patienter som behandlas med antidepressiva medel för MDD samt för andra indikationer, både psykiatriska och icke-psykiatriska. Även om ett orsakssamband mellan uppkomsten av sådana symtom och antingen försämringen av depression och/eller uppkomsten av självmordsimpulser inte har fastställts, finns det oro för att sådana symtom kan representera föregångare till framväxande suicidalitet.
Man bör överväga att ändra den terapeutiska kuren, inklusive eventuellt avbrytande av medicineringen, hos patienter vars depression är ihållande värre, eller som upplever framväxande suicidalitet eller symtom som kan vara prekursorer till förvärrad depression eller suicidalitet, särskilt om dessa symtom är allvarliga, plötsliga. i början, eller var inte en del av patientens uppvisande symtom.
Familjer och vårdgivare till patienter som behandlas med antidepressiva medel för allvarlig depressiv sjukdom eller andra indikationer, både psykiatriska och icke-psykiatriska, bör uppmärksammas om behovet av att övervaka patienter för uppkomsten av agitation, irritabilitet, ovanliga beteendeförändringar och de andra symtomen som beskrivs ovan. , såväl som uppkomsten av suicidalitet, och att rapportera sådana symtom omedelbart till vårdgivare. Sådan övervakning bör innefatta daglig observation av familjer och vårdgivare. Recept för ABILIFY bör skrivas ut för den minsta mängden tabletter som överensstämmer med god patienthantering, för att minska risken för överdosering.
Screening av patienter för bipolär sjukdom
En allvarlig depressiv episod kan vara den första presentationen av bipolär sjukdom. Det anses allmänt (även om det inte har fastställts i kontrollerade studier) att behandling av en sådan episod med enbart ett antidepressivt läkemedel kan öka sannolikheten för utfällning av en blandad/manisk episod hos patienter med risk för bipolär sjukdom. Huruvida något av de ovan beskrivna symptomen representerar en sådan omvandling är okänt. Innan behandling med ett antidepressivt läkemedel påbörjas bör dock patienter med depressiva symtom screenas på lämpligt sätt för att fastställa om de löper risk för bipolär sjukdom; sådan screening bör inkludera en detaljerad psykiatrisk historia, inklusive en familjehistoria av självmord, bipolär sjukdom och depression.
Det bör noteras att ABILIFY 20mg inte är godkänt för användning vid behandling av depression hos den pediatriska populationen.
Malignt neuroleptikasyndrom (NMS)
Ett potentiellt dödligt symtomkomplex som ibland kallas malignt neuroleptikasyndrom (NMS) kan uppstå vid administrering av antipsykotiska läkemedel, inklusive ABILIFY. sällsynta fall av NMS inträffade under behandling med ABILIFY 15 mg i den globala kliniska databasen. Kliniska manifestationer av NMS är hyperpyrexi, muskelstelhet, förändrad mental status och tecken på autonom instabilitet (oregelbunden puls eller blodtryck, takykardi, diafores och hjärtrytmrubbningar). Ytterligare tecken kan vara förhöjt kreatinfosfokinas, myoglobinuri (rabdomyolys) och akut njursvikt.
Den diagnostiska utvärderingen av patienter med detta syndrom är komplicerad. För att komma fram till en diagnos är det viktigt att utesluta fall där den kliniska presentationen inkluderar både allvarlig medicinsk sjukdom (t.ex. lunginflammation, systemisk infektion) och obehandlade eller otillräckligt behandlade extrapyramidala tecken och symtom (EPS). Andra viktiga överväganden i differentialdiagnosen inkluderar central antikolinerg toxicitet, värmeslag, läkemedelsfeber och primär patologi i centrala nervsystemet.
Hanteringen av NMS bör innefatta: 1) omedelbart utsättande av antipsykotiska läkemedel och andra läkemedel som inte är nödvändiga för samtidig behandling; 2) intensiv symtomatisk behandling och medicinsk övervakning; och 3) behandling av eventuella samtidiga allvarliga medicinska problem för vilka specifika behandlingar finns tillgängliga. Det finns ingen allmän enighet om specifika farmakologiska behandlingsregimer för okomplicerad NMS.
Om en patient behöver antipsykotisk läkemedelsbehandling efter återhämtning från NMS, bör det potentiella återinförandet av läkemedelsbehandling noggrant övervägas. Patienten bör övervakas noggrant, eftersom återfall av NMS har rapporterats.
Tardiv dyskinesi
Ett syndrom med potentiellt irreversibla, ofrivilliga, dyskinetiska rörelser kan utvecklas hos patienter som behandlas med antipsykotiska läkemedel. Även om prevalensen av syndromet verkar vara högst bland äldre, särskilt äldre kvinnor, är det omöjligt att förlita sig på prevalensuppskattningar för att förutsäga, vid inledningen av antipsykotisk behandling, vilka patienter som sannolikt kommer att utveckla syndromet. Huruvida antipsykotiska läkemedel skiljer sig i deras potential att orsaka tardiv dyskinesi är okänt.
Risken för att utveckla tardiv dyskinesi och sannolikheten att den blir irreversibel tros öka när behandlingstiden och den totala kumulativa dosen av antipsykotiska läkemedel som ges till patienten ökar. Syndromet kan dock utvecklas, även om det är mycket mindre vanligt, efter relativt korta behandlingsperioder vid låga doser.
Tardiv dyskinesi kan försvinna, delvis eller helt, om antipsykotisk behandling avbryts. Antipsykotisk behandling i sig kan dock undertrycka (eller delvis undertrycka) tecknen och symtomen på syndromet och kan därigenom eventuellt maskera den underliggande processen. Effekten som symtomatisk suppression har på det långvariga förloppet av syndromet är okänd.
Mot bakgrund av dessa överväganden bör ABILIFY förskrivas på ett sätt som med största sannolikhet minimerar förekomsten av tardiv dyskinesi. Kronisk antipsykotisk behandling bör i allmänhet reserveras för patienter som lider av en kronisk sjukdom som (1) är känd för att svara på antipsykotiska läkemedel och (2) för vilka alternativa, lika effektiva men potentiellt mindre skadliga behandlingar inte är tillgängliga eller lämpliga. Hos patienter som behöver kronisk behandling bör den minsta dosen och den kortaste behandlingstiden som ger ett tillfredsställande kliniskt svar eftersträvas. Behovet av fortsatt behandling bör omprövas med jämna mellanrum.
Om tecken och symtom på tardiv dyskinesi uppträder hos en patient som behandlas med ABILIFY, bör utsättning av läkemedel övervägas. Vissa patienter kan dock behöva behandling med ABILIFY 15 mg trots förekomsten av syndromet.
Metaboliska förändringar
Atypiska antipsykotiska läkemedel har associerats med metabola förändringar som inkluderar hyperglykemi/diabetes mellitus, dyslipidemi och kroppsviktsökning. Medan alla läkemedel i klassen har visat sig ge vissa metaboliska förändringar, har varje läkemedel sin egen specifika riskprofil.
Hyperglykemi/diabetes mellitus
Hyperglykemi, i vissa fall extrem och förknippad med ketoacidos eller hyperosmolär koma eller död, har rapporterats hos patienter som behandlats med atypiska antipsykotika. Det har rapporterats om hyperglykemi hos patienter som behandlats med ABILIFY [se NEGATIVA REAKTIONER ]. Bedömning av sambandet mellan atypisk antipsykotisk användning och glukosavvikelser kompliceras av möjligheten av en ökad bakgrundsrisk för diabetes mellitus hos patienter med schizofreni och den ökande incidensen av diabetes mellitus i den allmänna befolkningen. Med tanke på dessa konfounders är förhållandet mellan atypisk antipsykotisk användning och hyperglykemirelaterade biverkningar inte helt klarlagt. Epidemiologiska studier tyder dock på en ökad risk för hyperglykemirelaterade biverkningar hos patienter som behandlas med de atypiska antipsykotika. Eftersom ABILIFY inte marknadsfördes vid den tidpunkt då dessa studier utfördes, är det inte känt om ABILIFY är associerat med denna ökade risk. Exakta riskuppskattningar för hyperglykemirelaterade biverkningar hos patienter som behandlas med atypiska antipsykotika finns inte tillgängliga.
Patienter med en fastställd diagnos av diabetes mellitus som påbörjas med atypiska antipsykotika bör övervakas regelbundet för försämrad glukoskontroll. Patienter med riskfaktorer för diabetes mellitus (t.ex. fetma, familjehistoria av diabetes) som påbörjar behandling med atypiska antipsykotika bör genomgå fastande blodsockertest i början av behandlingen och regelbundet under behandlingen. Alla patienter som behandlas med atypiska antipsykotika bör övervakas för symtom på hyperglykemi inklusive polydipsi, polyuri, polyfagi och svaghet. Patienter som utvecklar symtom på hyperglykemi under behandling med atypiska antipsykotika bör genomgå fasteblodsockertest. I vissa fall har hyperglykemi försvunnit när det atypiska antipsykotiska medlet avbröts; vissa patienter krävde dock fortsatt antidiabetisk behandling trots att det misstänkta läkemedlet avbröts.
Vuxna
en analys av 13 placebokontrollerade monoterapistudier på vuxna, främst med schizofreni eller bipolär sjukdom, var den genomsnittliga förändringen av fasteglukos hos patienter behandlade med ABILIFY (+4,4 mg/dL; medianexponering 25 dagar; N=1057) inte signifikant annorlunda än hos placebobehandlade patienter (+2,5 mg/dL; medianexponering 22 dagar; N=799). Tabell 6 visar andelen ABILIFY-behandlade patienter med normal och borderline fasteglukos vid baslinjen (medianexponering 25 dagar) som hade behandlingsuppkommande höga fasteglukosmätningar jämfört med placebobehandlade patienter (medianexponering 22 dagar).
Vid 24 veckor var den genomsnittliga förändringen av fasteglukos hos ABILIFY-behandlade patienter inte signifikant annorlunda än hos placebobehandlade patienter [+2,2 mg/dL (n=42) respektive +9,6 mg/dL (n=28)] .
Den genomsnittliga förändringen av fasteglukos hos patienter som behandlades med ABILIFY som tillägg med egentlig depression (+0,7 mg/dL; medianexponering 42 dagar; N=241) var inte signifikant annorlunda än hos placebobehandlade patienter (+0,8 mg/dL; medianexponering exponering 42 dagar; N=246). Tabell 7 visar andelen vuxna patienter med förändringar i fastande glukosnivåer från två placebokontrollerade, tilläggsstudier (medianexponering 42 dagar) hos patienter med egentlig depression.
Pediatriska patienter och tonåringar
I en analys av två placebokontrollerade studier på ungdomar med schizofreni (13 till 17 år) och pediatriska patienter med bipolär sjukdom (10 till 17 år), den genomsnittliga förändringen av fasteglukos hos ABILIFY-behandlade patienter (+4,8 mg/dL; med en medianexponering på 43 dagar; N=259) var inte signifikant annorlunda än hos placebobehandlade patienter (+1,7 mg/dL; med en medianexponering på 42 dagar; N=123).
en analys av två placebokontrollerade studier på pediatriska och ungdomar med irritabilitet associerad med autistisk sjukdom (6 till 17 år) med medianexponering på 56 dagar, visade den genomsnittliga förändringen av fasteglukos hos ABILIFY-behandlade patienter (–0,2 mg) /dL; N=83) var inte signifikant annorlunda än hos placebobehandlade patienter (–0,6 mg/dL; N=33).
I en analys av två placebokontrollerade studier på pediatriska och ungdomar med Tourettes sjukdom (6 till 18 år) med medianexponering på 57 dagar, visade den genomsnittliga förändringen av fasteglukos hos ABILIFY-behandlade patienter (0,79 mg/dL; N=90) var inte signifikant annorlunda än hos placebobehandlade patienter (–1,66 mg/dL; N=58).
Tabell 8 visar andelen patienter med förändringar i fastande glukosnivåer från poolade schizofreni- och pediatriska bipolära patienter (medianexponering på 42-43 dagar), från två placebokontrollerade studier på pediatriska patienter (6 till 17 år) med irritabilitet associerad med autistisk störning (medianexponering på 56 dagar) och från de två placebokontrollerade studierna på pediatriska patienter (6 till 18 år) med Tourettes sjukdom (medianexponering 57 dagar).
Efter 12 veckor i de poolade studierna med schizofreni och pediatrisk bipolär sjukdom hos ungdomar var den genomsnittliga förändringen av fasteglukos hos ABILIFY-behandlade patienter inte signifikant annorlunda än hos placebobehandlade patienter [+2,4 mg/dL (n=81) och +0,1 mg /dL (n=15) respektive].
Dyslipidemi
Oönskade förändringar i lipider har observerats hos patienter som behandlats med atypiska antipsykotika.
Det fanns inga signifikanta skillnader mellan ABILIFY- och placebobehandlade patienter i andelen med förändringar från normala till kliniskt signifikanta nivåer för fastande/icke-fastande totalkolesterol, fastande triglycerider, fastande LDL och fastande/icke-fastande HDL. Analyser av patienter med minst 12 eller 24 veckors exponering begränsades av ett litet antal patienter.
Vuxna
Tabell 9 visar andelen vuxna patienter, främst från poolade schizofreni och bipolär sjukdom som monoterapi placebokontrollerade studier, med förändringar i totalt kolesterol (sammanslagna från 17 studier; medianexponering 21 till 25 dagar), fastande triglycerider (poolade från åtta studier; medianvärde). exponering 42 dagar), fastande LDL-kolesterol (sammanslagna från åtta prövningar; medianexponering 39 till 45 dagar, förutom placebobehandlade patienter med normala faste-LDL-mätningar vid baslinjen, som hade en medianexponering för behandling på 24 dagar) och HDL-kolesterol (poolad från nio försök, medianexponering 40 till 42 dagar).
monoterapistudier på vuxna var andelen patienter efter 12 veckor och 24 veckor med förändringar från normalt till högt i totalkolesterol (fastande/icke-fastande), fastande triglycerider och fastande LDL-kolesterol likartad mellan ABILIFY- och placebobehandlade patienter: 12 veckor, totalt kolesterol (fastande/icke fastande), 1/71 (1,4%) mot 3/74 (4,1%); Fastande triglycerider, 8/62 (12,9%) mot 5/37 (13,5%); Fastande LDL-kolesterol, 0/34 (0%) respektive 1/25 (4,0%); och vid 24 veckor, totalt kolesterol (fastande/icke-fastande), 1/42 (2,4%) mot 3/37 (8,1%); Fastande triglycerider, 5/34 (14,7%) mot 5/20 (25%); Fastande LDL-kolesterol, 0/22 (0%) respektive 1/18 (5,6%).
Tabell 10 visar andelen patienter med förändringar i totalt kolesterol (fastande/icke fastande), fastande triglycerider, fastande LDL-kolesterol och HDL-kolesterol från två placebokontrollerade tilläggsstudier på vuxna patienter med egentlig depression (medianexponering 42 dagar).
Pediatriska patienter och tonåringar
Tabell 11 visar andelen ungdomar med schizofreni (13 till 17 år) och pediatriska patienter med bipolär sjukdom (10 till 17 år) med förändringar i totalt kolesterol och HDL-kolesterol (sammanslagna från två placebokontrollerade studier; medianexponering 42 till 43 dagar ) och fastande triglycerider (poolade från två placebokontrollerade studier; medianexponering 42 till 44 dagar).
monoterapistudier av ungdomar med schizofreni och pediatriska patienter med bipolär sjukdom var andelen patienter efter 12 veckor och 24 veckor med förändringar från normalt till högt i totalt kolesterol (fastande/icke fastande), fastande triglycerider och fastande LDL-kolesterol liknande mellan ABILIFY - och placebobehandlade patienter: vid 12 veckor, totalt kolesterol (fastande/icke-fastande), 0/57 Â (0%) vs. 0/15 (0%); Fastande triglycerider, 2/72 (2,8%) respektive 1/14 (7,1%); och vid 24 veckor, totalt kolesterol (fastande/icke fastande), 0/36 (0%) mot 0/12 (0%); Fastande triglycerider, 1/47 (2,1 %) respektive 1/10 (10,0 %).
Tabell 12 visar andelen patienter med förändringar i totalt kolesterol (fastande/icke-fastande) och fastande triglycerider (medianexponering 56 dagar) och HDL-kolesterol (medianexponering 55 till 56 dagar) från två placebokontrollerade studier på pediatriska patienter (6 till 17 dagar) år) med irritabilitet i samband med autistisk störning.
Tabell 13 visar andelen patienter med förändringar i totalt kolesterol (fastande/icke fastande) och fastande triglycerider (medianexponering 57 dagar) och HDL-kolesterol (medianexponering 57 dagar) från två placebokontrollerade studier på pediatriska patienter (6 till 18 år) med Tourettes sjukdom.
Viktökning
Viktökning har observerats vid atypisk antipsykotisk användning. Klinisk övervakning av vikten rekommenderas.
Vuxna
I en analys av 13 placebokontrollerade monoterapistudier, främst från poolad schizofreni och bipolär sjukdom, med en medianexponering på 21 till 25 dagar, var den genomsnittliga förändringen i kroppsvikt hos ABILIFY-behandlade patienter +0,3 kg (N=1673) jämfört med till –0,1 kg (N=1100) hos placebokontrollerade patienter. Vid 24 veckor var den genomsnittliga förändringen från baslinjen i kroppsvikt hos ABILIFY-behandlade patienter –1,5 kg (n=73) jämfört med –0,2 kg (n=46) hos placebobehandlade patienter.
prövningarna med tillsats av ABILIFY till antidepressiva läkemedel fick patienterna först 8 veckors antidepressiv behandling följt av 6 veckors tilläggs ABILIFY 10 mg eller placebo utöver sin pågående antidepressiva behandling. Den genomsnittliga förändringen i kroppsvikt hos patienter som fick tilläggsbehandling med ABILIFY var +1,7 kg (N=347) jämfört med +0,4 kg (N=330) hos patienter som fick tilläggsplacebo.
Tabell 14 visar andelen vuxna patienter med viktökning ≥7 % av kroppsvikten per indikation.
Pediatriska patienter och tonåringar
I en analys av två placebokontrollerade studier på ungdomar med schizofreni (13 till 17 år) och pediatriska patienter med bipolär sjukdom (10 till 17 år) med medianexponering på 42 till 43 dagar, visade den genomsnittliga förändringen i kroppsvikt hos ABILIFY-behandlade patienterna var +1,6 kg (N=381) jämfört med +0,3 kg (N=187) hos placebobehandlade patienter. Vid 24 veckor, den genomsnittliga förändringen från baslinjen i kroppsvikt i
ABILIFY-behandlade patienter var +5,8 kg (n=62) jämfört med +1,4 kg (n=13) hos placebobehandlade patienter.
två kortvariga, placebokontrollerade studier på patienter (6 till 17 år) med irritabilitet associerad med autistisk sjukdom med medianexponering på 56 dagar, var den genomsnittliga förändringen i kroppsvikt hos ABILIFY-behandlade patienter +1,6 kg (n=209) ) jämfört med +0,4 kg (n=98) hos placebobehandlade patienter.
I två kortvariga, placebokontrollerade studier på patienter (6 till 18 år) med Tourettes sjukdom med medianexponering på 57 dagar, var den genomsnittliga förändringen i kroppsvikt hos ABILIFY-behandlade patienter +1,5 kg (n=105) ) jämfört med +0,4 kg (n=66) hos placebobehandlade patienter.
Tabell 15 visar andelen pediatriska och ungdomar med viktökning ≥7 % av kroppsvikten per indikation.
en öppen studie som inkluderade patienter från de två placebokontrollerade studierna med ungdomar med schizofreni (13 till 17 år) och pediatriska patienter med bipolär sjukdom (10 till 17 år), fullföljde 73,2 % av patienterna (238/325) 26 veckors terapi med ABILIFY. Efter 26 veckor ökade 32,8 % av patienterna ≥7 % av sin kroppsvikt, inte justerat för normal tillväxt. För att justera för normal tillväxt härleddes z-poäng (mätt i standardavvikelser [SD]), som normaliserar den naturliga tillväxten hos pediatriska patienter och ungdomar genom jämförelser med ålders- och könsmatchade befolkningsstandarder. En z-poängförändring
en öppen studie som inkluderade patienter från två kortvariga, placebokontrollerade studier, patienter (6 till 17 år) med irritabilitet associerad med autistisk störning, samt de novo patienter, fullföljde 60,3 % (199/330) en års terapi med ABILIFY. Den genomsnittliga förändringen i vikt z-poäng var 0,26 SD för patienter som fick >9 månaders behandling.
Vid behandling av pediatriska patienter för någon indikation bör viktökning övervakas och bedömas mot vad som förväntas för normal tillväxt.
Patologiskt spelande och andra tvångsmässiga beteenden
Fallrapporter efter marknadsföring tyder på att patienter kan uppleva intensiva drifter, särskilt för spel, och oförmågan att kontrollera dessa drifter när de tar aripiprazol. Andra tvångsmässiga drifter, rapporterade mer sällan, inkluderar: sexuella drifter, shopping, ätande eller hetsätning och andra impulsiva eller tvångsmässiga beteenden. Eftersom patienter kanske inte känner igen dessa beteenden som onormala är det viktigt för förskrivare att fråga patienter eller deras vårdgivare specifikt om utvecklingen av nya eller intensiva speldrifter, tvångsmässiga sexuella drifter, tvångsmässigt shopping, hetsätning eller tvångsmässigt ätande eller andra behov under behandling. med aripiprazol. Det bör noteras att impulskontrollsymtom kan associeras med den underliggande störningen. I vissa fall, även om inte alla, rapporterades att driften hade upphört när dosen reducerades eller medicineringen avbröts. Tvångsmässigt beteende kan leda till skada för patienten och andra om de inte upptäcks. Överväg att minska dosen eller avbryta medicineringen om en patient utvecklar sådana behov.
Ortostatisk hypotension
ABILIFY 20mg kan orsaka ortostatisk hypotoni, kanske på grund av dess α1-adrenerga receptorantagonism. Incidensen av ortostatisk hypotoni-associerade händelser från kortvariga, placebokontrollerade studier av vuxna patienter på oral ABILIFY (n=2467) inkluderade (ABILIFY 20 mg incidens, placebo-incidens) ortostatisk hypotension (1 %, 0,3 %), postural yrsel ( 0,5%, 0,3%) och synkope (0,5%, 0,4%); av pediatriska patienter 6 till 18 år (n=732) på oral ABILIFY inkluderade ortostatisk hypotoni (0,5 %, 0 %), postural yrsel (0,4 %, 0 %) och synkope (0,2 %, 0 %); och av patienter på ABILIFY-injektion (n=501) inkluderade ortostatisk hypotoni (0,6 %, 0 %), postural yrsel (0,2 %, 0,5 %) och synkope (0,4 %, 0 %) [se NEGATIVA REAKTIONER ].
Incidensen av en signifikant ortostatisk blodtrycksförändring (definierad som en minskning av systoliskt blodtryck ≥20 mmHg åtföljd av en ökning av hjärtfrekvensen ≥25 slag/min vid jämförelse av stående och liggande värden) för ABILIFY skilde sig inte väsentligt från placebo (ABILIFY-incidensen) , placeboincidens): hos vuxna orala ABILIFY-behandlade patienter (4 %, 2 %), hos pediatriska orala
ABILIFY-behandlade patienter i åldern 6 till 18 år (0,4 %, 1 %) eller hos ABILIFY 15 mg injektionsbehandlade patienter (3 %, 2 %).
ABILIFY 20mg ska användas med försiktighet till patienter med känd hjärt-kärlsjukdom (historia av hjärtinfarkt eller ischemisk hjärtsjukdom, hjärtsvikt eller överledningsstörningar), cerebrovaskulär sjukdom eller tillstånd som skulle predisponera patienter för hypotoni (dehydrering, hypovolemi och behandling med antihypertensiva läkemedel). mediciner) [se LÄKEMEDELSINTERAKTIONER ].
Om parenteral bensodiazepinbehandling anses nödvändig utöver ABILIFY-injektionsbehandling, ska patienter övervakas för överdriven sedering och ortostatisk hypotoni [se LÄKEMEDELSINTERAKTIONER ].
Falls
Antipsykotika, inklusive ABILIFY 10mg, kan orsaka somnolens, postural hypotoni, motorisk och sensorisk instabilitet, vilket kan leda till fall och följaktligen frakturer eller andra skador. För patienter med sjukdomar, tillstånd eller mediciner som kan förvärra dessa effekter, slutföra fallriskbedömningar vid inledande av antipsykotisk behandling och återkommande för patienter på långvarig antipsykotisk behandling.
Leukopeni, Neutropeni och Agranulocytos
I kliniska prövningar och/eller erfarenheter efter marknadsföring har händelser av leukopeni och neutropeni rapporterats tidsmässigt relaterade till antipsykotiska medel, inklusive ABILIFY. Agranulocytos har också rapporterats.
Möjliga riskfaktorer för leukopeni/neutropeni inkluderar redan existerande lågt antal vita blodkroppar (WBC)/absolut antal neutrofiler (ANC) och historia av läkemedelsinducerad leukopeni/neutropeni. Hos patienter med en anamnes på kliniskt signifikant lågt WBC/ANC eller läkemedelsinducerad leukopeni/neutropeni, utför ett fullständigt blodvärde (CBC) ofta under de första månaderna av behandlingen. Hos sådana patienter, överväg att avbryta behandlingen med ABILIFY vid första tecken på en kliniskt signifikant minskning av WBC i frånvaro av andra orsaksfaktorer.
Övervaka patienter med kliniskt signifikant neutropeni för feber eller andra symtom eller tecken på infektion och behandla omedelbart om sådana symtom eller tecken uppstår. Avbryt ABILIFY 20 mg hos patienter med svår neutropeni (absolut neutrofilantal
Kramper/kramper
kortsiktiga, placebokontrollerade studier förekom patienter med en historia av anfall uteslutna anfall/kramper hos 0,1 % (3/2467) av odiagnostiserade vuxna patienter som behandlades med oral ABILIFY 20 mg, hos 0,1 % (1/732) av barnpatienterna (6 till 18 år) och hos 0,2 % (1/501) av vuxna ABILIFY 15 mg injektionsbehandlade patienter.
Som med andra antipsykotiska läkemedel ska ABILIFY 15 mg användas med försiktighet till patienter med anamnes på anfall eller med tillstånd som sänker kramptröskeln. Tillstånd som sänker anfallströskeln kan vara vanligare i en befolkning på 65 år eller äldre.
Potential för kognitiv och motorisk funktionsnedsättning
ABILIFY kan, liksom andra antipsykotika, ha potential att försämra omdöme, tänkande eller motorik. Till exempel, i kortvariga, placebokontrollerade studier rapporterades somnolens (inklusive sedering) enligt följande (ABILIFY-incidens, placebo-incidens): hos vuxna patienter (n=2467) behandlade med oral ABILIFY (11%, 6%), hos pediatriska patienter i åldrarna 6 till 17 (n=611) (24 %, 6 %) och hos vuxna patienter (n=501) på ABILIFY-injektion (9 %, 6 %). Somnolens (inklusive sedering) ledde till avbrott hos 0,3 % (8/2467) av vuxna patienter och 3 % (20/732) av pediatriska patienter (6 till 18 år) på oral ABILIFY 10 mg i kortvariga, placebokontrollerade studier, men ledde inte till utsättning av några vuxna patienter på ABILIFY-injektion.
Trots den relativt blygsamma ökade förekomsten av dessa händelser jämfört med placebo, bör patienterna varnas för att använda farliga maskiner, inklusive bilar, tills de är rimligt säkra på att behandling med ABILIFY 15 mg inte påverkar dem negativt.
Reglering av kroppstemperatur
Störningar i kroppens förmåga att sänka kroppstemperaturen har tillskrivits antipsykotiska medel. Lämplig vård rekommenderas vid förskrivning av ABILIFY 10 mg till patienter som kommer att uppleva tillstånd som kan bidra till en höjning av kroppstemperaturen, (t.ex. ansträngande träning, exponering för extrem värme, samtidig medicinering med antikolinerg aktivitet eller uttorkning) [ser NEGATIVA REAKTIONER ].
Självmord
Möjligheten till ett självmordsförsök är inneboende i psykotiska sjukdomar, bipolär sjukdom och egentlig depression, och noggrann övervakning av högriskpatienter bör åtfölja läkemedelsbehandling. Recept för ABILIFY bör skrivas ut för den minsta kvantitet som överensstämmer med god patienthantering för att minska risken för överdosering [se NEGATIVA REAKTIONER ].
Dysfagi
Esofageal dysmotilitet och aspiration har associerats med användning av antipsykotiska läkemedel, inklusive ABILIFY. Aspirationspneumoni är en vanlig orsak till sjuklighet och dödlighet hos äldre patienter, särskilt de med avancerad Alzheimers demens. ABILIFY och andra antipsykotiska läkemedel ska användas med försiktighet till patienter med risk för aspirationspneumoni [se Ökad dödlighet hos äldre patienter med demensrelaterad psykos  och NEGATIVA REAKTIONER ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ).
Diskutera följande problem med patienter som ordinerats ABILIFY:
Klinisk försämring av depression och självmordsrisk
Patienter, deras familjer och deras vårdgivare bör uppmuntras att vara uppmärksamma på uppkomsten av ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani, mani, andra ovanliga beteendeförändringar , försämring av depression och självmordstankar, särskilt tidigt under antidepressiv behandling och när dosen justeras upp eller ner. Familjer och vårdgivare till patienter bör rådas att leta efter uppkomsten av sådana symtom på en daglig basis, eftersom förändringar kan vara abrupta. Sådana symtom bör rapporteras till patientens förskrivare eller hälso- och sjukvårdspersonal, särskilt om de är allvarliga, plötsligt debuterande eller inte var en del av patientens uppvisande symtom. Symtom som dessa kan vara förknippade med en ökad risk för suicidtänkande och självmordsbeteende och indikerar behov av mycket noggrann övervakning och eventuellt förändringar i medicineringen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Förskrivare eller annan hälso- och sjukvårdspersonal bör informera patienter, deras familjer och deras vårdgivare om fördelarna och riskerna som är förknippade med behandling med ABILIFY och bör ge dem råd om lämplig användning. En patientmedicineringsguide med information om "antidepressiva läkemedel, depression och andra allvarliga psykiska sjukdomar och självmordstankar eller -handlingar" finns tillgänglig för ABILIFY. Förskrivaren eller sjukvårdspersonalen bör instruera patienter, deras familjer och deras vårdgivare att läsa medicinguiden och bör hjälpa dem att förstå innehållet. Patienterna ska ges möjlighet att diskutera innehållet i Läkemedelsguiden och få svar på eventuella frågor de kan ha. Det bör noteras att ABILIFY inte är godkänt som ett enda läkemedel för behandling av depression och inte har utvärderats vid pediatrisk egentlig depression.
Patologiskt spelande och andra tvångsmässiga beteenden
Informera patienter och deras vårdgivare om möjligheten att de kan uppleva tvångsmässiga behov av att handla, intensiva behov av att spela, tvångsmässiga sexuella drifter, hetsätning och/eller andra tvångsmässiga drifter och oförmåga att kontrollera dessa drifter när de tar aripiprazol. I vissa fall, men inte alla, rapporterades drifterna ha upphört när dosen minskades eller upphörde [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Användning av oralt sönderfallande tablett
Öppna inte blisterförpackningen förrän den är klar att administreras. För borttagning av en tablett, öppna förpackningen och dra av folien på blisterförpackningen för att exponera tabletten. Tryck inte tabletten genom folien eftersom det kan skada tabletten. Omedelbart efter att blistern öppnats, använd torra händer, ta bort tabletten och placera hela ABILIFY DISCMELT oralt sönderfallande tablett på tungan. Tablettsönderdelning sker snabbt i saliv. Det rekommenderas att ABILIFY DISCMELT tas utan vätska. Men om det behövs kan det tas med vätska. Försök inte att dela tabletten.
Interferens med kognitiva och motoriska prestanda
Eftersom ABILIFY kan ha potential att försämra omdöme, tänkande eller motorik, bör patienter varnas för att använda farliga maskiner, inklusive bilar, tills de är rimligt säkra på att ABILIFY-terapi inte påverkar dem negativt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Samtidig medicinering
Patienter bör rådas att informera sina läkare om de tar eller planerar att ta några receptbelagda eller receptfria läkemedel, eftersom det finns risk för interaktioner [se LÄKEMEDELSINTERAKTIONER ].
Värmeexponering och uttorkning
Patienter bör informeras om lämplig vård för att undvika överhettning och uttorkning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sockerinnehåll
Patienter bör informeras om att varje ml ABILIFY 10 mg oral lösning innehåller 400 mg sackaros och 200 mg fruktos.
Graviditet
Rekommendera patienter att meddela sin vårdgivare om de blir gravida eller tänker bli gravida under behandling med ABILIFY. Informera patienter om att ABILIFY 20 mg kan orsaka extrapyramidala och/eller abstinenssymtom (agitation, hypertoni, hypotoni, tremor, somnolens, andningsbesvär och ätstörningar) hos en nyfödd. Informera patienter om att det finns ett graviditetsregister som övervakar graviditetsresultat hos kvinnor som exponerats för ABILIFY 15 mg under graviditeten [se Användning i specifika populationer ].
Fenylketonurik
Fenylalanin är en komponent i aspartam. Varje ABILIFY DISCMELT oralt desintegrerande tablett innehåller följande mängder: 10 mg, 1,12 mg fenylalanin och 15 mg, 1,68 mg fenylalanin.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Livstidsstudier av karcinogenicitet utfördes på ICR-möss, F344-råttor och Sprague-Dawley (SD)-råttor. Aripiprazol administrerades i 2 år i kosten i doser på 1, 3, 10 och 30 mg/kg/dag till ICR-möss och 1, 3 och 10 mg/kg/dag till F344-råttor (0,2, 0,5, 2 och 5 gånger respektive 0,3, 1 och 3 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta). Dessutom doserades SD-råttor oralt i 2 år med 10, 20, 40 och 60 mg/kg/dag, vilket är 3, 6, 13 och 19 gånger MRHD baserat på mg/m² kroppsyta. Aripiprazol inducerade inte tumörer hos hanmöss eller hanråttor. Hos honmöss ökade incidensen av hypofysadenom och bröstkörteladenokarcinom och adenoakantom vid dietdoser på 3 till 30 mg/kg/dag (0,5 till 5 gånger MRHD). Hos honråttor ökade incidensen av fibroadenom i bröstkörteln vid en dietdos på 10 mg/kg/dag (3 gånger MRHD); och incidensen av binjurebarkcarcinom och kombinerade binjurebarkadenom/karcinom ökade vid en oral dos på 60 mg/kg/dag (19 gånger MRHD).
En ökning av bröst-, hypofys- och endokrina pankreasneoplasmer har hittats hos gnagare efter kronisk administrering av andra antipsykotiska läkemedel och anses förmedlas av förlängd dopamin D2-receptorantagonism och hyperprolaktinemi. Serumprolaktin mättes inte i karcinogenicitetsstudierna för aripiprazol. Emellertid observerades ökningar av serumprolaktinnivåer hos möss av honkön i en 13-veckors dietstudie vid doser associerade med bröstkörtel- och hypofystumörer. Serumprolaktin ökade inte hos honråttor i 4-veckors och 13-veckors koststudier vid den dos som associerades med bröstkörteltumörer. Relevansen för mänsklig risk av fynden av prolaktinmedierade endokrina tumörer hos gnagare är oklar.
Mutagenes
Den mutagena potentialen för aripiprazol testades i in vitro bakteriell omvänd mutationsanalysen, in vitro bakteriell DNA-reparationsanalysen, in vitro framåtgenmutationsanalysen i muslymfomceller, in vitro analysen av kromosomavvikelser i kinesisk hamsterlunga (CHL) celler, mikrokärnanalysen in vivo på möss och den oplanerade DNA-syntesanalysen på råttor. Aripiprazol och en metabolit (2,3-DCPP) var klastogena i in vitro-analys av kromosomavvikelser i CHL-celler med och utan metabolisk aktivering. Metaboliten, 2,3DCPP, ökade numeriska avvikelser i in vitro-analysen i CHL-celler i frånvaro av metabolisk aktivering. Ett positivt svar erhölls i in vivo mikrokärnanalysen på möss; dock berodde svaret på en mekanism som inte ansågs vara relevant för människor.
Nedsättning av fertilitet
Honråttor behandlades oralt med aripiprazol från 2 veckor före parning till och med dräktighetsdag 7 i doser på 2, 6 och 20 mg/kg/dag, vilket är 0,6, 2 och 6 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta. Oregelbundenheter i estruscykeln och ökad corpora lutea sågs vid alla doser, men ingen försämring av fertiliteten sågs. Ökad pre-implantationsförlust sågs vid 2 och 6 gånger MRHD, och minskad fostervikt sågs vid 6 gånger MRHD.
Hanråttor behandlades oralt med aripiprazol från 9 veckor före parning till parning med doser på 20, 40 och 60 mg/kg/dag, vilket är 6, 13 och 19 gånger MRHD på 30 mg/dag baserat på mg/ m² kroppsyta. Störningar i spermatogenesen sågs vid 19 gånger MRHD och prostataatrofi sågs vid 13 och 19 gånger MRHD utan försämring av fertiliteten.
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsutfall hos kvinnor som exponerats för atypiska antipsykotika, inklusive ABILIFY, under graviditeten. Sjukvårdsleverantörer uppmuntras att registrera patienter genom att kontakta National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller besöka http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Risksammanfattning
Nyfödda som exponerats för antipsykotiska läkemedel, inklusive ABILIFY 20 mg, under graviditetens tredje trimester löper risk för extrapyramidala och/eller abstinenssymtom efter förlossningen (se Kliniska överväganden ). Övergripande tillgängliga data från publicerade epidemiologiska studier av gravida kvinnor som exponerats för aripiprazol har inte fastställt en läkemedelsrelaterad risk för allvarliga fosterskador, missfall eller ogynnsamma resultat hos modern eller foster (se Data ). Det finns risker för mamman i samband med obehandlad schizofreni, bipolär störning I eller egentlig depression, och med exponering för antipsykotika, inklusive ABILIFY, under graviditeten (se Kliniska överväganden ).
I reproduktionsstudier på djur producerades oral och intravenös administrering av aripiprazol under organogenes till råttor och/eller kaniner i doser 10 respektive 19 gånger den maximala rekommenderade humandosen (MRHD) på 30 mg/dag baserat på mg/m² kroppsyta. fosterdöd, minskad fostervikt, ej nedsjunkna testiklar, försenad skelettförbening, skelettavvikelser och diafragmabråck. Oral och intravenös administrering av aripiprazol under pre- och postnatalperioden till råttor i doser 10 gånger MRHD baserat på mg/m² kroppsyta, gav förlängd dräktighet, dödfödsel, minskad valpvikt och minskad valpöverlevnad (se Data ).
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2-4% respektive 15-20%.
Kliniska överväganden
Sjukdomsrelaterad risk för mödrar och/eller embryon/foster
Det finns en risk för modern från obehandlad schizofreni eller bipolär störning I, inklusive ökad risk för återfall, sjukhusvistelse och självmord. Schizofreni och bipolär störning I är förknippade med ökade negativa perinatala utfall, inklusive för tidig födsel. Det är inte känt om detta är ett direkt resultat av sjukdomen eller andra komorbida faktorer.
En prospektiv, longitudinell studie följde 201 gravida kvinnor med en historia av allvarlig depressiv sjukdom som var euthymic och tog antidepressiva i början av graviditeten. De kvinnor som avbröt antidepressiva läkemedel under graviditeten hade större risk att uppleva ett återfall av allvarlig depression än kvinnor som fortsatte med antidepressiva. Tänk på risken för obehandlad depression när du avbryter eller byter behandling med antidepressiv medicin under graviditet och efter förlossningen.
Fetala/neonatala biverkningar
Extrapyramidala och/eller abstinenssymtom, inklusive agitation, hypertoni, hypotoni, tremor, somnolens, andningsbesvär och ätstörningar har rapporterats hos nyfödda som exponerats för antipsykotiska läkemedel (inklusive ABILIFY) under graviditetens tredje trimester. Dessa symtom har varierat i svårighetsgrad. Övervaka nyfödda med avseende på extrapyramidala och/eller abstinenssymtom och hantera symtomen på lämpligt sätt. Vissa nyfödda återhämtade sig inom timmar eller dagar utan specifik behandling; andra krävde långvarig sjukhusvistelse.
Data
Mänskliga data
Publicerade data från observationsstudier, födelseregister och fallrapporter om användning av atypiska antipsykotika under graviditeten visar inte ett tydligt samband med antipsykotika och större fosterskador. En retrospektiv studie från en Medicaid-databas av 9258 kvinnor som exponerats för antipsykotika under graviditeten indikerade inte en övergripande ökad risk för allvarliga fosterskador.
Djurdata
djurstudier visade aripiprazol utvecklingstoxicitet, inklusive möjliga teratogena effekter hos råttor och kaniner.
Hos dräktiga råttor som behandlats oralt med aripiprazol under organogenesen i doser på 3, 10 och 30 mg/kg/dag, vilket är ungefär 1, 3 och 10 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta, en lätt förlängning av dräktigheten och försening av fosterutvecklingen, vilket framgår av minskad fostervikt och nedsänkta testiklar, observerades vid 10 gånger MRHD. Försenad skelettförbening observerades vid 3 och 10 gånger MRHD. Född avkomma hade ökad förekomst av hepatodiafragmatiska knölar och diafragmabråck observerades vid 10 gånger MRHD (de andra dosgrupperna undersöktes inte för dessa fynd). Postnatalt sågs försenad vaginalöppning vid 3 och 10 gånger MRHD. Försämrad reproduktionsförmåga (minskad fertilitet, corpora lutea, implantat, levande foster och ökad förlust efter implantation, sannolikt medierad genom effekter på kvinnliga avkommor) observerades vid 10 gånger MRHD; men det fanns inga bevis som tydde på att dessa utvecklingseffekter var sekundära till maternell toxicitet.
Hos gravida råttor som injicerades intravenöst med aripiprazol under organogenesen i doser på 3, 9 och 27 mg/kg/dag, vilket är 1, 3 och 9 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta, minskade fostervikt och fördröjd skelettförbening observerades vid 9 gånger MRHD; denna dos orsakade också maternell toxicitet.
Hos dräktiga kaniner som behandlats oralt med aripiprazol under organogenes i doser på 10, 30 och 100 mg/kg/dag, vilket är 6, 19 och 65 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta, minskad maternell matkonsumtion och ökade aborter såväl som ökad fosterdödlighet observerades vid 65 gånger MHRD. Minskad fostervikt och ökad förekomst av sammansmälta bröstbenen observerades vid 19 och 65 gånger MRHD.
Hos dräktiga kaniner som injicerades intravenöst med aripiprazol under organogenesen i doser på 3, 10 och 30 mg/kg/dag, vilket är 2, 6 och 19 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta, minskade fostervikt, ökade fosteravvikelser (främst skelett) och minskad fosterskelettförbening observerades vid 19 gånger MRHD; denna dos orsakade också maternell toxicitet. Fosterdosen utan effekt var 10 mg/kg/dag, vilket är 6 gånger MRHD.
Hos råttor som behandlats oralt med aripiprazol peri- och postnatalt från dräktighetsdag 17 till och med postpartum dag 21 i doser på 3, 10 och 30 mg/kg/dag som är 1, 3 och 10 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta observerades lätt maternell toxicitet och något förlängd graviditet vid 10 gånger MHRD. En ökning av dödfödslar och minskningar i valpvikt (som kvarstår i vuxen ålder) och överlevnad sågs också vid denna dos.
Hos råttor som injicerats intravenöst med aripiprazol från dräktighetsdag 6 till och med laktationsdag 20 i doser på 3, 8 och 20 mg/kg/dag, vilket är 1, 3 och 6 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta, ökade dödfödslar observerades vid 3 och 6 gånger MRHD; och minskningar i tidig postnatal valpvikt och överlevnad observerades vid 6 gånger MRHD; dessa doser orsakade också viss maternell toxicitet. Det fanns inga effekter på postnatal beteende- och reproduktiv utveckling.
Laktation
Risksammanfattning
Begränsade data från publicerad litteratur rapporterar förekomsten av aripiprazol i human bröstmjölk, vid relativa spädbarnsdoser som sträcker sig mellan 0,7 % till 8,3 % av den viktjusterade dosen hos modern. Det finns rapporter om dålig viktökning hos ammade spädbarn som exponerats för aripiprazol och rapporter om otillräcklig mjölktillförsel hos ammande kvinnor som tar aripiprazol.
Utvecklingen och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av ABILIFY och eventuella negativa effekter på det ammade barnet från ABILIFY eller från det underliggande moderns tillståndet.
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter med egentlig depression eller agitation i samband med schizofreni eller bipolär mani har inte fastställts.
Farmakokinetiken för aripiprazol och dehydro-aripiprazol hos pediatriska patienter, 10 till 17 år, liknade den hos vuxna efter korrigering för skillnaderna i kroppsvikt [se KLINISK FARMAKOLOGI ].
Schizofreni
Säkerhet och effektivitet hos pediatriska patienter med schizofreni fastställdes i en 6-veckors, placebokontrollerad klinisk prövning på 202 pediatriska patienter i åldern 13 till 17 år [se DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , och Kliniska studier ]. Även om underhållseffekten hos pediatriska patienter inte har utvärderats systematiskt, kan underhållseffekten extrapoleras från vuxna data tillsammans med jämförelser av aripiprazols farmakokinetiska parametrar hos vuxna och pediatriska patienter.
Bipolär störning I
Säkerhet och effektivitet hos pediatriska patienter med bipolär mani fastställdes i en 4-veckors, placebokontrollerad klinisk prövning på 197 pediatriska patienter i åldern 10 till 17 år [se DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , och Kliniska studier ]. Även om underhållseffekten hos pediatriska patienter inte har utvärderats systematiskt, kan underhållseffekten extrapoleras från vuxna data tillsammans med jämförelser av aripiprazols farmakokinetiska parametrar hos vuxna och pediatriska patienter.
Effekten av tillägg ABILIFY 10 mg med samtidig litium eller valproat vid behandling av maniska eller blandade episoder hos pediatriska patienter har inte utvärderats systematiskt. Sådan effekt och avsaknad av farmakokinetisk interaktion mellan aripiprazol och litium eller valproat kan dock extrapoleras från vuxna data, tillsammans med jämförelser av aripiprazols farmakokinetiska parametrar hos vuxna och pediatriska patienter.
Irritabilitet associerad med autistisk sjukdom
Säkerhet och effektivitet hos pediatriska patienter som uppvisar irritabilitet i samband med autistisk störning fastställdes i två 8 veckor långa, placebokontrollerade kliniska prövningar på 212 pediatriska patienter i åldern 6 till 17 år [se INDIKATIONER OCH ANVÄNDNING , DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , och Kliniska studier ]. En underhållsstudie utfördes på pediatriska patienter (6 till 17 år) med irritabilitet associerad med autistisk störning. Den första fasen av denna studie var en öppen, flexibelt doserad (aripiprazol 2 till 15 mg/dag) fas där patienterna stabiliserades (definierad som > 25 % förbättring på ABC-I-subskalan och en CGI-I-klassificering på "mycket förbättrad" eller "mycket mycket förbättrad") på ABILIFY under 12 veckor i följd. Totalt sett stabiliserades 85 patienter och gick in i den andra, 16 veckor långa, dubbelblinda fasen där de randomiserades till att antingen fortsätta ABILIFY-behandlingen eller byta till placebo. I denna studie fastställdes inte effekten av ABILIFY för underhållsbehandling av irritabilitet i samband med autistisk störning.
Tourettes sjukdom
Säkerhet och effektivitet för aripiprazol hos pediatriska patienter med Tourettes sjukdom fastställdes i en 8-veckors (i åldern 7 till 17) och en 10-veckors studie (i åldern 6 till 18) på 194 pediatriska patienter [se DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , och Kliniska studier ]. Underhållseffekt hos pediatriska patienter har inte utvärderats systematiskt.
Studier på ungdomsdjur
Aripiprazol hos unga råttor orsakade dödlighet, CNS kliniska tecken, nedsatt minne och inlärning och försenad sexuell mognad när det administrerades i orala doser på 10, 20, 40 mg/kg/dag från avvänjning (21 dagar gammal) till mognad (80 dagar gammal) . Vid 40 mg/kg/dag observerades mortalitet, minskad aktivitet, utspridda bakben, krökt hållning, ataxi, skakningar och andra CNS-tecken hos båda könen. Dessutom observerades försenad könsmognad hos män. Vid alla doser och på ett dosberoende sätt, nedsatt minne och inlärning, ökad motorisk aktivitet och histopatologiska förändringar i hypofysen (atrofi), binjurar (binjurebarkhypertrofi), bröstkörtlar (hyperplasi och ökad sekretion) och kvinnliga reproduktionsorgan ( vaginal mucifiering, endometrieatrofi, minskning av ovarial corpora lutea) observerades. Förändringarna i kvinnliga reproduktionsorgan ansågs sekundära till ökningen av prolaktinserumnivåerna. En No Observed Adverse Effect Level (NOAEL) kunde inte fastställas och vid den lägsta testade dosen på 10 mg/kg/dag finns det ingen säkerhetsmarginal i förhållande till de systemiska exponeringarna (AUC0-24) för aripiprazol eller dess huvudsakliga aktiva metabolit hos ungdomar vid den maximala rekommenderade pediatriska dosen på 15 mg/dag. Alla läkemedelsrelaterade effekter var reversibla efter en 2-månaders återhämtningsperiod, och de flesta läkemedelseffekterna hos unga råttor observerades även hos vuxna råttor från tidigare genomförda studier.
Aripiprazol hos unga hundar (2 månader gamla) orsakade CNS kliniska tecken på skakningar, hypoaktivitet, ataxi, liggandes och begränsad användning av bakbenen vid oral administrering i 6 månader med 3, 10, 30 mg/kg/dag. Genomsnittlig kroppsvikt och viktökning minskade med upp till 18 % hos kvinnor i alla läkemedelsgrupper i förhållande till kontrollvärden. Ett NOAEL kunde inte fastställas och vid den lägsta testade dosen på 3 mg/kg/dag finns det ingen säkerhetsmarginal i förhållande till de systemiska exponeringarna (AUC0-24) för aripiprazol eller dess huvudsakliga aktiva metabolit hos ungdomar vid maximalt rekommenderat barn dos på 15 mg/dag. Alla läkemedelsrelaterade effekter var reversibla efter en 2-månaders återhämtningsperiod.
Geriatrisk användning
Ingen dosjustering rekommenderas för äldre patienter [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och KLINISK FARMAKOLOGI ].
Av de 13 543 patienter som behandlades med oral ABILIFY 15 mg i kliniska prövningar var 1073 (8%) ≥65 år och 799 (6%) var ≥75 år. Placebokontrollerade studier av oral ABILIFY 10 mg vid schizofreni, bipolär mani eller egentlig depressiv sjukdom inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner.
Av de 749 patienter som behandlades med ABILIFY-injektion i kliniska prövningar var 99 (13%) ≥65 år och 78 (10%) var ≥75 år. Placebokontrollerade studier av ABILIFY-injektion hos patienter med agitation associerad med schizofreni eller bipolär mani inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner.
ABILIFY 15mg är inte godkänt för behandling av patienter med psykos associerad med Alzheimers sjukdom [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
CYP2D6 Dåliga metaboliserare
Dosjustering rekommenderas för kända CYP2D6-låga metaboliserare på grund av höga aripiprazolkoncentrationer. Ungefär 8 % av kaukasierna och 3–8 % av svarta/afroamerikaner kan inte metabolisera CYP2D6-substrat och klassificeras som dåliga metaboliserare (PM) [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
Nedsatt lever- och njurfunktion
Ingen dosjustering för ABILIFY krävs på grundval av en patients leverfunktion (lindrigt till gravt nedsatt leverfunktion, Child-Pugh-poäng mellan 5 och 15), eller njurfunktionen (lindrig till gravt nedsatt njurfunktion, glomerulär filtrationshastighet mellan 15) och 90 ml/minut) [se KLINISK FARMAKOLOGI ].
Andra specifika populationer
Ingen dosjustering för ABILIFY krävs på basis av en patients kön, ras eller rökstatus [se KLINISK FARMAKOLOGI ].
ÖVERDOS
MedDRA-terminologi har använts för att klassificera biverkningarna.
Mänsklig erfarenhet
kliniska prövningar och erfarenheter efter marknadsföring har biverkningar av avsiktlig eller oavsiktlig överdosering med oral ABILIFY rapporterats över hela världen. Dessa inkluderar överdoser med oral ABILIFY 20 mg enbart och i kombination med andra substanser. Ingen dödsfall rapporterades med endast ABILIFY. Den största kända dosen med känt utfall involverade akut intag av 1260 mg oral ABILIFY (42 gånger den maximala rekommenderade dagliga dosen) av en patient som återhämtat sig helt. Avsiktlig eller oavsiktlig överdosering rapporterades också hos barn (12 år och yngre) som involverade oralt ABILIFY 10 mg intag upp till 195 mg utan dödsfall.
Vanliga biverkningar (rapporterade i minst 5 % av alla överdosfall) som rapporterats vid oral ABILIFY-överdosering (enbart eller i kombination med andra substanser) inkluderar kräkningar, somnolens och tremor. Andra kliniskt viktiga tecken och symtom som observerats hos en eller flera patienter med ABILIFY-överdoser (ensamma eller tillsammans med andra substanser) inkluderar acidos, aggression, ökat aspartataminotransferas, förmaksflimmer, bradykardi, koma, förvirringstillstånd, kramper, ökad kreatinfosfokinas i blodet, sänkt nivå medvetande, hypertoni, hypokalemi, hypotoni, letargi, medvetslöshet, QRS-komplex förlängt, QT-förlängt, lunginflammation, andningsstopp, status epilepticus och takykardi.
Hantering av överdosering
Ingen specifik information finns tillgänglig om behandling av överdosering med ABILIFY. Ett elektrokardiogram ska tas vid överdosering och om QT-intervallet förlängs ska hjärtövervakning sättas in. I annat fall bör hanteringen av överdosering koncentreras på understödjande terapi, bibehållande av adekvata luftvägar, syresättning och ventilation samt hantering av symtom. Noggrann medicinsk övervakning och övervakning bör fortsätta tills patienten återhämtar sig.
Träkol
I händelse av en överdos av ABILIFY 10 mg kan en tidig administrering av kol vara användbar för att delvis förhindra absorptionen av aripiprazol. Administrering av 50 g aktivt kol, en timme efter en engångsdos på 15 mg av ABILIFY, minskade medel-AUC och Cmax för aripiprazol med 50 %.
Hemodialys
Även om det inte finns någon information om effekten av hemodialys vid behandling av en överdos med ABILIFY, är det osannolikt att hemodialys är användbart vid överdoshantering eftersom aripiprazol är starkt bundet till plasmaproteiner.
KONTRAINDIKATIONER
ABILIFY 15 mg är kontraindicerat till patienter med en anamnes på en överkänslighetsreaktion mot aripiprazol. Reaktionerna har varierat från klåda/urtikaria till anafylaxi [se NEGATIVA REAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Verkningsmekanismen för aripiprazol vid schizofreni eller bipolär mani är oklar. Effekten av aripiprazol vid de listade indikationerna kan emellertid medieras genom en kombination av partiell agonistaktivitet vid D2- och 5-HT1A-receptorer och antagonistaktivitet vid 5-HT2A-receptorer.
Farmakodynamik
Aripiprazol uppvisar hög affinitet för dopamin D2 och D3, serotonin 5-HT1A och 5-HT2A receptorer (Ki-värden på 0,34 nM, 0,8 nM, 1,7 nM respektive 3,4 nM), måttlig affinitet för doptonamin D4, HT2 och C. 5-HT7, alfa1-adrenerga och histamin H1-receptorer (Ki-värden på 44 nM, 15 nM, 39 nM, 57 nM respektive 61 nM) och måttlig affinitet för serotoninåterupptagsstället (Ki=98 nM). Aripiprazol har ingen märkbar affinitet för kolinerga muskarina receptorer (IC50>1000 nM).
Farmakokinetik
ABILIFY-aktiviteten beror förmodligen främst på moderläkemedlet aripiprazol, och i mindre utsträckning på dess huvudmetabolit, dehydro-aripiprazol, som har visat sig ha affiniteter för D2-receptorer liknande moderläkemedlet och representerar 40 % av moderläkemedlet. läkemedelsexponering i plasma. De genomsnittliga halveringstiderna för eliminering är cirka 75 timmar och 94 timmar för aripiprazol respektive dehydro-aripiprazol. Steady-state-koncentrationer uppnås inom 14 dagar efter dosering för båda de aktiva delarna. Aripiprazolackumulering är förutsägbar från endosfarmakokinetiken. Vid steady-state är farmakokinetiken för aripiprazol dosproportionell. Eliminering av aripiprazol sker huvudsakligen genom levermetabolism som involverar två P450-isozymer, CYP2D6 och CYP3A4. För CYP2D6 dåliga metaboliserare är den genomsnittliga eliminationshalveringstiden för aripiprazol cirka 146 timmar.
Farmakokinetiska studier visade att ABILIFY 10 mg DISCMELT oralt sönderfallande tabletter är bioekvivalenta med ABILIFY 15 mg tabletter.
Muntlig administration
Absorption
Tablett: Aripiprazol absorberas väl efter administrering av tabletten, med maximala plasmakoncentrationer inom 3 timmar till 5 timmar; den absoluta orala biotillgängligheten för tablettformuleringen är 87 %. ABILIFY 10mg kan administreras med eller utan mat. Administrering av en 15 mg ABILIFY-tablett med en standardmåltid med hög fetthalt påverkade inte signifikant Cmax eller AUC för aripiprazol eller dess aktiva metabolit, dehydro-aripiprazol, men fördröjde Tmax med 3 timmar för aripiprazol och 12 timmar för dehydro-aripiprazol.
Oral lösning: Aripiprazol absorberas väl när det administreras oralt som lösning. Vid ekvivalenta doser var plasmakoncentrationerna av aripiprazol från lösningen högre än från tablettformuleringen. I en relativ biotillgänglighetsstudie som jämförde farmakokinetiken för 30 mg aripiprazol som oral lösning med 30 mg aripiprazoltabletter hos friska försökspersoner, var förhållandet mellan lösning och tablett för geometriska medelvärden för Cmax och AUC 122 % respektive 114 % [se DOSERING OCH ADMINISTRERING ]. Endosfarmakokinetiken för aripiprazol var linjär och dosproportionell mellan doserna på 5 mg till 30 mg.
Distribution
Distributionsvolymen vid steady-state för aripiprazol efter intravenös administrering är hög (404 l eller 4,9 l/kg), vilket indikerar omfattande extravaskulär distribution. Vid terapeutiska koncentrationer är aripiprazol och dess huvudmetabolit mer än 99 % bundna till serumproteiner, främst till albumin. Hos friska frivilliga försökspersoner som administrerades 0,5 till 30 mg/dag aripiprazol under 14 dagar, fanns dosberoende D2-receptorockupation, vilket tyder på hjärnpenetrering av aripiprazol hos människor.
Metabolism och eliminering
Aripiprazol metaboliseras primärt via tre biotransformationsvägar: dehydrering, hydroxylering och N-dealkylering. Baserat på in vitro-studier är CYP3A4- och CYP2D6-enzymer ansvariga för dehydrering och hydroxylering av aripiprazol, och N-dealkylering katalyseras av CYP3A4. Aripiprazol är den dominerande läkemedelsdelen i den systemiska cirkulationen. Vid steady-state representerar dehydro-aripiprazol, den aktiva metaboliten, cirka 40 % av aripiprazols AUC i plasma.
Efter en oral engångsdos av [14C]-märkt aripiprazol återfanns cirka 25 % och 55 % av den administrerade radioaktiviteten i urinen respektive avföringen. Mindre än 1 % av oförändrad aripiprazol utsöndrades i urinen och cirka 18 % av den orala dosen återfanns oförändrad i feces.
Läkemedelsinteraktionsstudier
Effekter av andra läkemedel på exponeringen av aripiprazol och dehydro-aripiprazol sammanfattas i figur 1 respektive figur 2. Baserat på simulering förväntas en 4,5-faldig ökning av genomsnittliga Cmax- och AUC-värden vid steady-state när omfattande metaboliserare av CYP2D6 administreras med både starka CYP2D6- och CYP3A4-hämmare. En 3-faldig ökning av genomsnittliga Cmax- och AUC-värden vid steady-state förväntas hos dåliga metaboliserare av CYP2D6 administrerade med starka CYP3A4-hämmare.
Figur 1: Effekterna av andra läkemedel på aripiprazols farmakokinetik 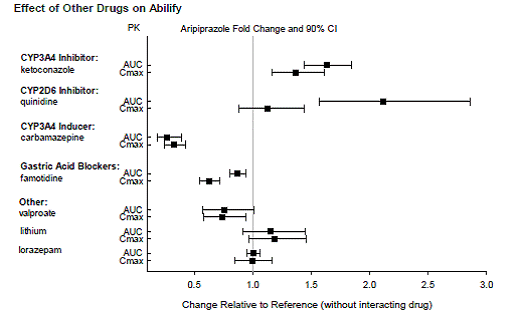
Figur 2: Effekterna av andra läkemedel på dehydro-aripiprazols farmakokinetik 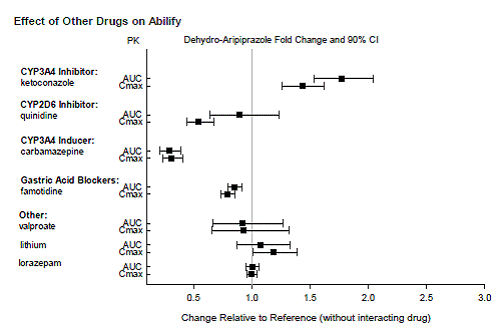
Effekterna av ABILIFY 15 mg på exponeringen av andra läkemedel sammanfattas i figur 3. En populations-PK-analys hos patienter med egentlig depression visade ingen väsentlig förändring i plasmakoncentrationer av fluoxetin (20 eller 40 mg/dag), paroxetin CR (37,5 eller 50 mg/dag), eller sertralin (100 eller 150 mg/dag) doserat till steady-state. Plasmakoncentrationerna av fluoxetin och norfluoxetin vid steady-state ökade med cirka 18 % respektive 36 %, och koncentrationerna av paroxetin minskade med cirka 27 %. Plasmakoncentrationerna av sertralin och desmetylsertralin vid steady-state ändrades inte väsentligt när dessa antidepressiva terapier administrerades samtidigt med aripiprazol.
Figur 3: Effekterna av ABILIFY 15 mg på farmakokinetiken för andra läkemedel 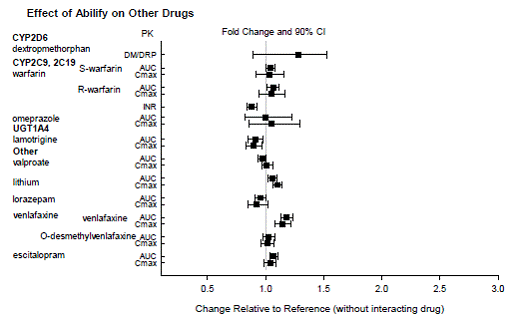
Studier i specifika populationer
Exponeringar av aripiprazol och dehydro-aripiprazol i specifika populationer sammanfattas i figur 4 respektive figur 5. Dessutom, hos pediatriska patienter (10 till 17 år) som administrerades med ABILIFY (20 mg till 30 mg), var den kroppsviktskorrigerade aripiprazolclearancen liknande den hos vuxna.
Figur 4: Effekter av inneboende faktorer på aripiprazols farmakokinetik 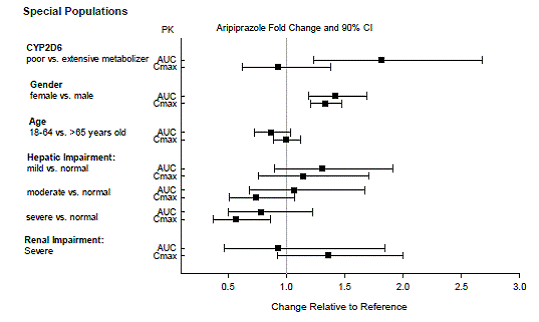
Figur 5: Effekter av inneboende faktorer på dehydro-aripiprazols farmakokinetik 
Intramuskulär administrering
två farmakokinetiska studier av aripiprazolinjektion administrerad intramuskulärt till friska försökspersoner var mediantiden till maximala plasmakoncentrationer 1 timme och 3 timmar. En 5 mg intramuskulär injektion av aripiprazol hade en absolut biotillgänglighet på 100 %. Den geometriska genomsnittliga maximala koncentrationen som uppnåddes efter en intramuskulär dos var i genomsnitt 19 % högre än Cmax för den orala tabletten. Medan den systemiska exponeringen under 24 timmar i allmänhet var likartad mellan aripiprazolinjektion som gavs intramuskulärt och efter oral tablettadministrering, var AUC för aripiprazol under de första 2 timmarna efter en intramuskulär injektion 90 % högre än AUC efter samma dos som en tablett. Hos stabila patienter med schizofreni eller schizoaffektiv störning var farmakokinetiken för aripiprazol efter intramuskulär administrering linjär över ett dosintervall på 1 mg till 45 mg. Även om metabolismen av aripiprazolinjektion inte utvärderades systematiskt, förväntas den intramuskulära administreringsvägen inte förändra de metaboliska vägarna.
Djurtoxikologi och/eller farmakologi
Aripiprazol producerade retinal degeneration hos albinoråttor i en 26-veckors kronisk toxicitetsstudie vid en dos på 60 mg/kg/dag och i en 2-årig karcinogenicitetsstudie vid doser på 40 och 60 mg/kg/dag som är 13 och 19 gånger MRHD på 30 mg/dag baserat på mg/m² kroppsyta. Utvärdering av näthinnan hos albinomöss och apor avslöjade inga tecken på retinal degeneration. Ytterligare studier för att ytterligare utvärdera mekanismen har inte utförts. Relevansen av detta fynd för mänsklig risk är okänd.
Kliniska studier
Effekten av de orala formuleringarna av ABILIFY (aripiprazol) fastställdes i följande adekvata och välkontrollerade studier:
- Fyra korttidsstudier och en underhållsstudie på vuxna patienter och en korttidsstudie på ungdomar (13-17 år) med schizofreni [se Kliniska studier ]
- Fyra korttidsstudier med monoterapi och en 6-veckors tilläggsstudie på vuxna patienter och en korttidsstudie i monoterapi på pediatriska patienter (åldrar 1017) med maniska eller blandade episoder [se Kliniska studier ]
- En underhållsprövning i monoterapi och i en kompletterande underhållsprövning på vuxna patienter med bipolär sjukdom I [se Kliniska studier ]
- Två korttidsstudier på vuxna patienter med MDD som hade ett otillräckligt svar på antidepressiv terapi under den aktuella episoden [se Kliniska studier ]
- Två korttidsstudier på pediatriska patienter (6-17 år) för behandling av irritabilitet i samband med autistisk störning [se Kliniska studier ]
- Två korttidsstudier på pediatriska patienter (6-18 år) med Tourettes sjukdom [se Kliniska studier ]
Effekten av den injicerbara formuleringen av ABILIFY (aripiprazol) fastställdes i följande adekvata och välkontrollerade studier:
- Tre 24-timmarsstudier på upprörda vuxna patienter med schizofreni eller maniska/blandade episoder av bipolär störning I [se Kliniska studier ]
Schizofreni
Vuxna
Effekten av ABILIFY 15 mg vid behandling av schizofreni utvärderades i fem korttidsstudier (4 veckor och 6 veckor), placebokontrollerade studier med akut återfallande slutenvårdspatienter som övervägande uppfyllde DSM-III/IV-kriterierna för schizofreni. Fyra av de fem försöken kunde skilja ABILIFY från placebo, men en studie, den minsta, gjorde det inte. Tre av dessa studier inkluderade också en aktiv kontrollgrupp bestående av antingen risperidon (en prövning) eller haloperidol (två prövningar), men de var inte utformade för att möjliggöra en jämförelse mellan ABILIFY 20 mg och de aktiva komparatorerna.
de fyra positiva studierna för ABILIFY 10 mg användes fyra primära mått för att bedöma psykiatriska tecken och symtom. Effekten utvärderades med hjälp av totalpoängen på skalan för positiva och negativa syndrom (PANSS). PANSS är en skala med 30 punkter som mäter positiva symtom på schizofreni (7 punkter), negativa symtom på schizofreni (7 punkter) och allmän psykopatologi (16 punkter), var och en bedömd på en skala från 1 (frånvarande) till 7 (extrem) ; totala PANSS-poäng varierar från 30 till 210. Clinical Global Impression (CGI)-bedömningen återspeglar intrycket av en skicklig observatör, som är fullt förtrogen med schizofreni, om patientens övergripande kliniska tillstånd.
en 4-veckors studie (n=414) som jämförde två fasta doser av ABILIFY (15 eller 30 mg/dag) med placebo, var båda doserna av ABILIFY 10 mg överlägsna placebo i PANSS totalpoäng (studie 1 i tabell 26), PANSS positiv subskala och CGI-svårighetspoäng. Dessutom var 15 mg dosen överlägsen placebo i PANSS negativa subskalan.
I en 4-veckors studie (n=404) som jämförde två fasta doser av ABILIFY (20 eller 30 mg/dag) med placebo, var båda doserna av ABILIFY överlägsna placebo i PANSS totalpoäng (studie 2 i tabell 26), PANSS positiv subskala, PANSS negativ subskala och CGI-allvarlighetspoäng.
I en 6-veckors studie (n=420) som jämförde tre fasta doser av ABILIFY (10, 15 eller 20 mg/dag) med placebo, var alla tre doser av ABILIFY överlägsna placebo i PANSS totalpoäng (studie 3 i tabell). 26), PANSS positiv subskala och PANSS negativ subskala.
en 6-veckors studie (n=367) som jämförde tre fasta doser av ABILIFY (2, 5 eller 10 mg/dag) med placebo, var 10 mg dosen av ABILIFY överlägsen placebo i PANSS totalpoäng (studie 4 i Tabell 26), studiens primära resultatmått. Doserna på 2 och 5 mg visade inte överlägsenhet gentemot placebo på det primära utfallsmåttet.
Effekten av 10, 15, 20 och 30 mg dagliga doser fastställdes således i två studier för varje dos. Bland dessa doser fanns det inga bevis för att de högre dosgrupperna gav någon fördel jämfört med den lägsta dosgruppen av dessa studier.
En undersökning av befolkningsundergrupper avslöjade inte några tydliga bevis för differentiell respons på grund av ålder, kön eller ras.
En långtidsstudie inkluderade 310 slutenvårdspatienter eller öppenvårdspatienter som uppfyller DSM-IV-kriterierna för schizofreni som, av historien, var symtomatiskt stabila på andra antipsykotiska läkemedel under perioder på 3 månader eller längre. Dessa patienter avbröts från sina antipsykotiska läkemedel och randomiserades till ABILIFY 15 mg/dag eller placebo under upp till 26 veckors observation för återfall. Återfall under den dubbelblinda fasen definierades som CGI-förbättringspoäng på ≥5 (minimalt sämre), poäng ≥5 (måttligt allvarlig) på fientlighets- eller samarbetsförmågan hos PANSS, eller ≥20 % ökning av PANSS totalpoäng. Patienter som fick ABILIFY 15 mg/dag fick en signifikant längre tid för återfall under de efterföljande 26 veckorna jämfört med de som fick placebo (studie 5 i figur 6).
Pediatriska patienter
Effekten av ABILIFY (aripiprazol) vid behandling av schizofreni hos pediatriska patienter (13 till 17 år) utvärderades i en 6-veckors placebokontrollerad studie av öppenvårdspatienter som uppfyllde DSM-IV-kriterierna för schizofreni och hade PANSS-poäng ≥70 vid baslinjen. I denna studie (n=302) som jämförde två fasta doser av ABILIFY (10 eller 30 mg/dag) med placebo, titrerades ABILIFY 15 mg med början från 2 mg/dag till måldosen på 5 dagar i behandlingsarmen på 10 mg/dag och inom 11 dagar i behandlingsarmen 30 mg/dag. Båda doserna av ABILIFY var överlägsna placebo i PANSS totalpoäng (studie 6 i tabell 26), studiens primära resultatmått. Dosen på 30 mg/dag visades inte vara mer effektiv än dosen på 10 mg/dag. Även om underhållseffekten hos pediatriska patienter inte har utvärderats systematiskt, kan underhållseffekten extrapoleras från vuxna data tillsammans med jämförelser av aripiprazols farmakokinetiska parametrar hos vuxna och pediatriska patienter.
Figur 6: Kaplan-Meier uppskattning av kumulativ andel patienter med återfall (schizofrenistudie 5) 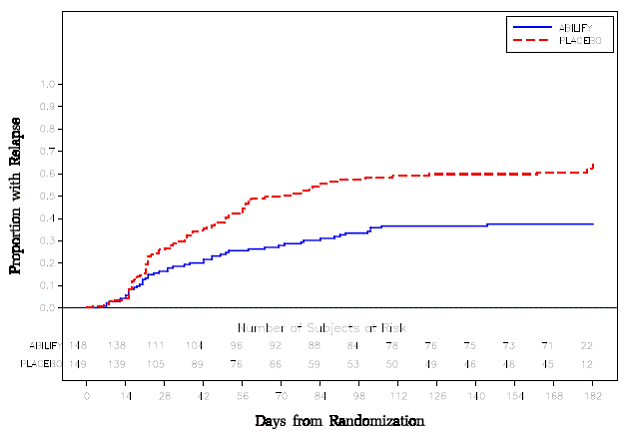
Bipolär sjukdom
Akut behandling av maniska och blandade episoder
Vuxna
Monoterapi
Effekten av ABILIFY 10 mg som monoterapi vid akut behandling av maniska episoder fastställdes i fyra 3-veckors placebokontrollerade studier på sjukhuspatienter som uppfyllde DSM-IV-kriterierna för bipolär störning I med maniska eller blandade episoder. Dessa studier inkluderade patienter med eller utan psykotiska drag och två av studierna inkluderade även patienter med eller utan snabbcykling.
Det primära instrumentet som användes för att bedöma maniska symtom var Young Mania Rating Scale (Y-MRS), en 11-punkts klinikerklassad skala som traditionellt används för att bedöma graden av manisk symptomatologi i ett intervall från 0 (inga maniska egenskaper) till 60 ( högsta poäng). Ett viktigt sekundärt instrument inkluderade Clinical Global Impression-Bipolar (CGI-BP) Scale.
de fyra positiva, 3-veckors, placebokontrollerade studierna (n=268; n=248; n=480; n=485) som utvärderade ABILIFY i ett intervall på 15 mg till 30 mg, en gång dagligen (med en startdos på 30 mg/dag i två studier och 15 mg/dag i två studier), var ABILIFY 20 mg överlägsen placebo när det gäller minskningen av Y-MRS totalpoäng (studier 1-4 i tabell 27) och CGI-BP-poäng för sjukdomens svårighetsgrad (mani). I de två studierna med en startdos på 15 mg/dag fick 48 % och 44 % av patienterna 15 mg/dag vid endpoint. I de två studierna med en startdos på 30 mg/dag fick 86 % och 85 % av patienterna 30 mg/dag vid endpoint.
Tilläggsterapi
Effekten av tilläggsmedlet ABILIFY med samtidig litium eller valproat vid behandling av maniska eller blandade episoder fastställdes i en 6-veckors, placebokontrollerad studie (n=384) med en 2-veckors inledande monoterapifas med humörstabilisator hos vuxna patienter som uppfyllde DSM-IV-kriterierna för bipolär störning I. Denna studie inkluderade patienter med maniska eller blandade episoder och med eller utan psykotiska egenskaper.
Patienterna inleddes med öppen märkning av litium (0,6 till 1,0 mEq/L) eller valproat (50 till 125 μg/ml) vid terapeutiska serumnivåer och höll sig på stabila doser i 2 veckor. I slutet av 2 veckor randomiserades patienter som visade otillräckligt svar (YMRS totalpoäng ≥16 och ≤25 % förbättring av Y-MRS totalpoäng) på litium eller valproat för att få antingen ABILIFY (15 mg/dag eller en ökning till 30) mg/dag så tidigt som dag 7) eller placebo som tilläggsbehandling med öppen litium eller valproat. Under den 6 veckor långa, placebokontrollerade fasen var tilläggsmedlet ABILIFY från 15 mg/dag med samtidig litium eller valproat (i ett terapeutiskt intervall av 0,6 till 1,0 mEq/L respektive 50 till 125 μg/ml) överlägsen litium eller valproat med tilläggsplacebo för att minska YMRS-totalpoängen (studie 5 i tabell 27) och CGI-BP-allvarlighetspoäng (mani). 71 procent av patienterna som samtidigt fick valproat och 62 % av patienterna som samtidigt fick litium fick 15 mg/dag vid 6 veckors slutpunkt.
Pediatriska patienter
Effekten av ABILIFY 15 mg vid behandling av bipolär störning I hos pediatriska patienter (10 till 17 år) utvärderades i en 4-veckors placebokontrollerad studie (n=296) med öppenvårdspatienter som uppfyllde DSM-IV-kriterierna för bipolär sjukdom. I störning maniska eller blandade episoder med eller utan psykotiska egenskaper och hade en Y-MRS-poäng ≥20 vid baslinjen. Denna dubbelblinda, placebokontrollerade studie jämförde två fasta doser av ABILIFY (10 eller 30 mg/dag) med placebo. ABILIFY 20 mg-dosen påbörjades med 2 mg/dag, som titrerades till 5 mg/dag efter 2 dagar, och till måldosen efter 5 dagar i 10 mg/dag-behandlingsarmen och efter 13 dagar i 30 mg/dag dagbehandlingsarm. Båda doserna av ABILIFY 10 mg var överlägsna placebo i förändring från baslinje till vecka 4 på Y-MRS totalpoäng (studie 6 i tabell 27).
Underhållsbehandling av bipolär sjukdom I
Monoterapi underhållsterapi
En underhållsstudie utfördes på vuxna patienter som uppfyller DSM-IV-kriterierna för bipolär störning I med en nyligen manisk eller blandad episod som hade stabiliserats på öppen ABILIFY 20 mg och som hade bibehållit ett kliniskt svar i minst 6 veckor. Den första fasen av denna studie var en öppen stabiliseringsperiod där slutenvårdspatienter och öppenvårdspatienter var kliniskt stabiliserade och sedan hölls på öppen ABILIFY (15 eller 30 mg/dag, med en startdos på 30 mg/dag) i minst 6 veckor i följd. Hundrasextioen polikliniska patienter randomiserades sedan på ett dubbelblindt sätt, till antingen samma dos av ABILIFY som de fick i slutet av stabiliserings- och underhållsperioden eller placebo och övervakades sedan med avseende på maniskt eller depressivt återfall. Under randomiseringsfasen var ABILIFY överlägset placebo i tid jämfört med antalet kombinerade affektiva återfall (maniska plus depressiva), det primära utfallsmåttet för denna studie (Studie 7 i figur 7). Totalt 55 humörhändelser observerades under den dubbelblinda behandlingsfasen. Nitton var från ABILIFY-gruppen och 36 från placebogruppen. Antalet observerade maniska episoder i ABILIFY 15 mg-gruppen (6) var färre än i placebogruppen (19), medan antalet depressiva episoder i ABILIFY-gruppen (9) var liknande det i placebogruppen (11). .
En undersökning av populationsundergrupper avslöjade inte några tydliga bevis för differentiell respons på grund av ålder och kön; dock fanns det otillräckligt antal patienter i var och en av de etniska grupperna för att adekvat bedöma skillnader mellan grupper.
Figur 7: Kaplan-Meier uppskattning av kumulativ andel patienter med återfall (bipolär studie 7) 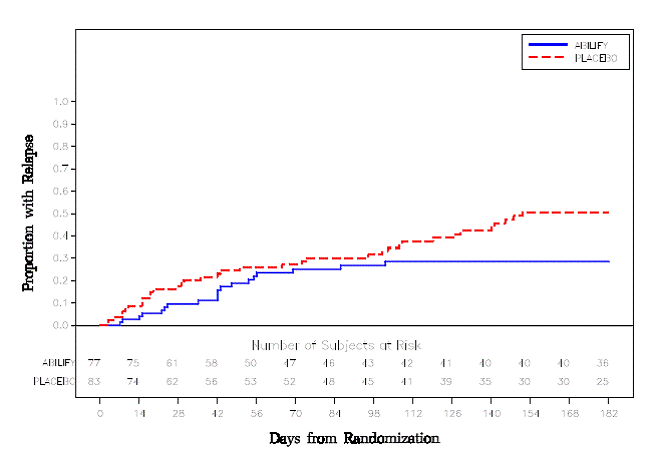
Kompletterande underhållsterapi
En kompletterande underhållsstudie utfördes på vuxna patienter som uppfyller DSMIV-kriterierna för bipolär störning I med en nyligen manisk eller blandad episod. Patienterna inleddes med öppen märkning av litium (0,6 till 1,0 mEq/L) eller valproat (50 till 125 μg/ml) vid terapeutiska serumnivåer och höll sig på stabila doser i 2 veckor. I slutet av 2 veckor fick patienter som visade otillräckligt svar (Y-MRS totalpoäng ≥16 och ≤35 % förbättring av Y-MRS totalpoäng) på litium eller valproat ABILIFY med en startdos på 15 mg/dag med alternativet att öka till 30 mg eller minska till 10 mg så tidigt som dag 4, som tilläggsbehandling med öppen litium eller valproat. Före randomisering behövde patienter på kombinationen av enkelblind ABILIFY och litium eller valproat bibehålla stabilitet (Y-MRS och MADRS totalpoäng ≤12) under 12 på varandra följande veckor. Trehundratrettiosju patienter randomiserades sedan på ett dubbelblindt sätt, till antingen samma dos av ABILIFY 20 mg de fick i slutet av stabiliseringsperioden eller placebo plus litium eller valproat och övervakades sedan med avseende på manisk, blandad eller depressivt återfall i högst 52 veckor. ABILIFY 15 mg var överlägset placebo på det primära effektmåttet, tiden från randomisering till återfall till någon humörhändelse (studie 8 i figur 8). En humörhändelse definierades som sjukhusvistelse för en manisk, blandad eller depressiv episod, studieavbrott på grund av bristande effekt åtföljd av Y-MRS-poäng >16 och/eller MADRS >16, eller SAE av förvärrad sjukdom åtföljd av Y- MRS-poäng >16 och/eller MADRS >16. Totalt 68 humörhändelser observerades under den dubbelblinda behandlingsfasen. Tjugofem var från ABILIFY 20 mg-gruppen och 43 från placebogruppen. Antalet observerade maniska episoder i ABILIFY 15 mg-gruppen (7) var färre än i placebogruppen (19), medan antalet depressiva episoder i ABILIFY-gruppen (14) var liknande det i placebogruppen (18) . Kaplan-Meier-kurvorna för tiden från randomisering till återfall till någon humörhändelse under den 52-veckors dubbelblinda behandlingsfasen för ABILIFY 10 mg och placebogrupper visas i figur 8.
Figur 8: Kaplan-Meier uppskattning av den kumulativa andelen patienter med återfall till någon humörhändelse (bipolär studie 8) 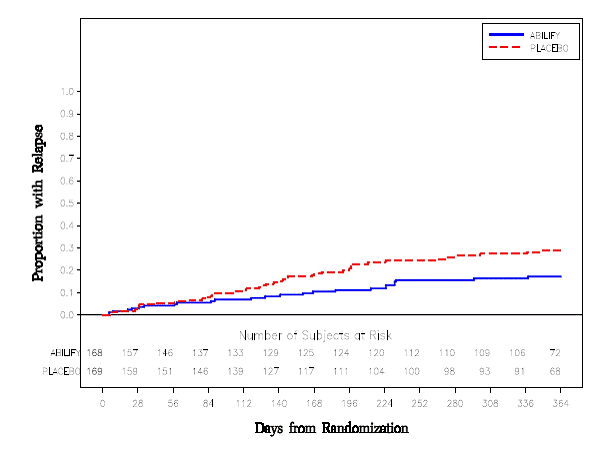
En undersökning av populationsundergrupper avslöjade inte några tydliga bevis för differentiell respons på grund av ålder och kön; dock fanns det otillräckligt antal patienter i var och en av de etniska grupperna för att adekvat bedöma skillnader mellan grupper.
Tilläggsbehandling av allvarlig depressiv sjukdom
Vuxna
Effekten av ABILIFY 15 mg vid tilläggsbehandling av egentlig depression (MDD) visades i två korttidsstudier (6 veckor), placebokontrollerade studier med vuxna patienter som uppfyller DSM-IV-kriterierna för MDD som hade haft ett otillräckligt svar på tidigare antidepressiv behandling (1 till 3 kurer) i den aktuella episoden och som också hade visat ett otillräckligt svar på 8 veckors prospektiv antidepressiv behandling (paroxetin med kontrollerad frisättning, venlafaxin förlängd frisättning, fluoxetin, escitalopram eller sertralin). Otillräckligt svar för prospektiv behandling definierades som mindre än 50 % förbättring på 17-komponentversionen av Hamilton Depression Rating Scale (HAMD17), minimal HAMD17-poäng på 14 och en Clinical Global Impressions Improvement-betyg som inte var bättre än minimal förbättring. Otillräckligt svar på tidigare behandling definierades som mindre än 50 % förbättring som uppfattades av patienten efter minst 6 veckors antidepressiv behandling vid eller över den minsta effektiva dosen.
Det primära instrumentet som användes för att bedöma depressiva symtom var Montgomery-Asberg Depression Rating Scale (MADRS), en 10-punkts klinikerklassad skala som användes för att bedöma graden av depressiv symptomatologi. Det sekundära nyckelinstrumentet var Sheehan Disability Scale (SDS), ett självskattat instrument med 3 artiklar som används för att bedöma effekten av depression på tre funktionsdomäner med varje objekt poängsatt från 0 (inte alls) till 10 (extrem).
I de två studierna (n=381, n=362) var ABILIFY 15 mg överlägsen placebo när det gäller att minska genomsnittliga MADRS-totalpoäng (Studier 1, 2 i Tabell 28). I en studie var ABILIFY också överlägsen placebo när det gäller att sänka den genomsnittliga SDS-poängen.
båda studierna fick patienterna ABILIFY 15 mg som tillägg till antidepressiva medel i en dos på 5 mg/dag. Baserat på tolerabilitet och effekt kan doserna justeras i steg om 5 mg, med en veckas mellanrum. Tillåtna doser var: 2, 5, 10, 15 mg/dag, och för patienter som inte fick potenta CYP2D6-hämmare fluoxetin och paroxetin, 20 mg/dag. Den genomsnittliga slutdosen vid slutpunkten för de två studierna var 10,7 och 11,4 mg/dag.
En undersökning av populationsundergrupper avslöjade inga tecken på differentiellt svar baserat på ålder, val av potentiellt antidepressivt läkemedel eller ras. När det gäller kön sågs en mindre genomsnittlig minskning av MADRS totalpoäng hos män än hos kvinnor.
Irritabilitet associerad med autistisk sjukdom
Pediatriska patienter
Effekten av ABILIFY (aripiprazol) vid behandling av irritabilitet i samband med autistisk störning fastställdes i två 8-veckors placebokontrollerade studier på pediatriska patienter (6 till 17 år) som uppfyllde DSM-IV-kriterierna för autistisk sjukdom och uppvisat beteenden som raserianfall, aggression, självskadebeteende eller en kombination av dessa problem. Över 75 % av dessa försökspersoner var under 13 år.
Effekten utvärderades med hjälp av två bedömningsskalor: Aberrant Behavior Checklist (ABC) och Clinical Global Impression-Improvement (CGI-I) skalan. Det primära utfallsmåttet i båda studierna var förändringen från baslinje till effektmått i subskalan Irritabilitet i ABC (ABC-I). ABC-I-subskalan mätte symtom på irritabilitet vid autistisk sjukdom.
Resultaten av dessa försök är följande:
en av de 8 veckor långa placebokontrollerade studierna fick barn och ungdomar med autistisk störning (n=98), i åldern 6 till 17 år, dagliga doser av placebo eller ABILIFY 2 till 15 mg/dag. ABILIFY, med början på 2 mg/dag med tillåten ökning upp till 15 mg/dag baserat på kliniskt svar, förbättrade signifikant poängen på ABC-I-subskalan och på CGI-I-skalan jämfört med placebo. Den genomsnittliga dagliga dosen av ABILIFY 10 mg i slutet av 8 veckors behandling var 8,6 mg/dag (studie 1 i tabell 29).
den andra 8-veckors placebokontrollerade studien på barn och ungdomar med autistisk störning (n=218), i åldern 6 till 17 år, tre fasta doser av ABILIFY (5 mg/dag, 10 mg/dag eller 15 mg/dag) dag) jämfördes med placebo. ABILIFY-doseringen började med 2 mg/dag och ökades till 5 mg/dag efter en vecka. Efter en andra vecka ökades den till 10 mg/dag för patienter i 10 och 15 mg dosarmarna, och efter en tredje vecka ökades den till 15 mg/dag i behandlingsarmen 15 mg/dag (Studie 2 i Tabell 29). Alla tre doserna av ABILIFY förbättrade signifikant poängen på ABC-I-subskalan jämfört med placebo.
Tourettes sjukdom
Pediatriska patienter
Effekten av ABILIFY (aripiprazol) vid behandling av Tourettes sjukdom fastställdes i en 8-veckors (7 till 17 års ålder) och en 10-veckors (6 till 18 års ålder), placebokontrollerade studier i pediatriska patienter (6 till 18 år) som uppfyllde DSM-IV-kriterierna för Tourettes sjukdom och hade en total Tic-poäng (TTS) ≥ 20 - 22 på Yale Global Tic Severity Scale (YGTSS). YGTSS är en fullt validerad skala designad för att mäta aktuell tic-allvarlighet. Effekten utvärderades med hjälp av två bedömningsskalor: 1) Total Tic-poäng (TTS) för YGTSS och 2) Clinical Global Impressions Scale for Tourettes syndrom (CGI-TS), ett sammanfattande mått som fastställts av kliniker som tar hänsyn till all tillgänglig patientinformation. Över 65 % av dessa patienter var under 13 år.
Det primära resultatmåttet i båda studierna var förändringen från baslinje till effektmått i TTS för YGTSS. Betygen för TTS är gjorda längs 5 olika dimensioner på en skala från 0 till 5 för motoriska och vokala tics vardera. Summering av dessa 10 poäng ger en TTS (dvs. 0-50).
Resultaten av dessa försök är följande:
den 8 veckor långa, placebokontrollerade studien med fast dos randomiserades barn och ungdomar med Tourettes sjukdom (n=133), i åldern 7 till 17 år, 1:1:1 till lågdos ABILIFY, hög dos ABILIFY 15mg, eller placebo. Måldoserna för grupperna med låg och hög dos ABILIFY 10 mg baserades på vikt. Patienter
Figur 9: Minsta kvadratiska medel för förändring från baslinje i YGTSS TTS per vecka (Tourettes sjukdomsstudie 1) 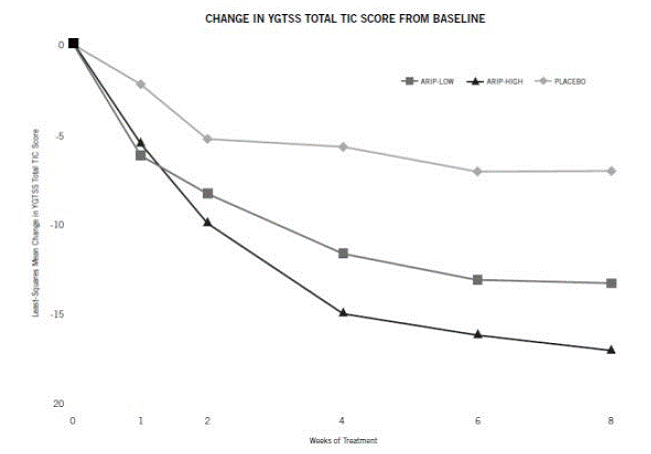
I den 10 veckor långa, placebokontrollerade studien med flexibel dos på barn och ungdomar med Tourettes sjukdom (n=61), i åldrarna 6 till 18 år, fick patienterna dagliga doser av placebo eller ABILIFY, med start på 2 mg/ dag med tillåten ökning upp till 20 mg/dag baserat på kliniskt svar. ABILIFY visade statistiskt signifikant förbättrade poäng på YGTSS TTS-skalan jämfört med placebo (Studie 2 i Tabell 30). Den genomsnittliga dagliga dosen av ABILIFY vid slutet av 10-veckors behandling var 6,54 mg/dag.
Agitation associerad med schizofreni eller bipolär mani
Effekten av intramuskulär ABILIFY för injektion för behandling av agitation fastställdes i tre korttidsstudier (24-timmars), placebokontrollerade prövningar på upprörda slutna patienter från två diagnostiska grupper: schizofreni och bipolär störning I (maniska eller blandade episoder, med eller utan psykotiska egenskaper). Var och en av studierna inkluderade en enda aktiv jämförelsebehandlingsarm av antingen haloperidolinjektion (schizofrenistudier) eller lorazepaminjektion (bipolär manistudie). Patienter kunde få upp till tre injektioner under 24-timmarsbehandlingsperioderna; dock kunde patienter inte få den andra injektionen förrän efter den initiala 2-timmarsperioden då det primära effektmåttet utvärderades. Patienter som inkluderades i prövningarna behövde: (1) bedömas av de kliniska utredarna som kliniskt upprörda och kliniskt lämpliga kandidater för behandling med intramuskulär medicin, och (2) uppvisa en nivå av agitation som nådde eller översteg ett tröskelvärde på ≥15 på de fem objekten som består av positiva och negativa syndromskala (PANSS) exciterade komponenten (dvs dålig impulskontroll, spänning, fientlighet, samarbetsförmåga och spänning) med minst två individuella objektpoäng ≥4 med ett 1-7 poängsystem (1) = frånvarande, 4 = måttlig, 7 = extrem). I studierna var den genomsnittliga PANSS Excited Component-poängen 19, med poäng från 15 till 34 (av ett maximalt betyg på 35), vilket tyder på övervägande måttliga nivåer av agitation med vissa patienter som upplever milda eller svåra nivåer av agitation. Det primära effektmått som användes för att bedöma agitationstecken och symtom i dessa studier var förändringen från baslinjen i PANSS Excited Component 2 timmar efter injektionen. En viktig sekundär åtgärd var Clinical Global Impression of Improvement (CGI-I)-skalan. Resultaten av försöken följer:
en placebokontrollerad studie på upprörda slutenvårdspatienter som övervägande uppfyller DSM-IV-kriterierna för schizofreni (n=350), utvärderades fyra fasta ABILIFY 20 mg injektionsdoser på 1 mg, 5,25 mg, 9,75 mg och 15 mg. 2 timmar efter injektionen var doserna 5,25 mg, 9,75 mg och 15 mg statistiskt överlägsna placebo i PANSS Excited Component (studie 1 i tabell 31) och på CGII-skalan.
I en andra placebokontrollerad studie på upprörda slutenvårdspatienter som till övervägande del uppfyller DSM-IV-kriterierna för schizofreni (n=445), utvärderades en fast ABILIFY 15 mg injektionsdos på 9,75 mg. 2 timmar efter injektionen var ABILIFY för injektion statistiskt överlägsen placebo i PANSS Excited Component (studie 2 i tabell 31) och på CGI-I-skalan.
en placebokontrollerad studie på upprörda slutenvårdspatienter som uppfyller DSMIV-kriterierna för bipolär störning I (manisk eller blandad) (n=291), utvärderades två fasta ABILIFY 10 mg injektionsdoser på 9,75 mg och 15 mg. 2 timmar efter injektionen var båda doserna statistiskt överlägsna placebo i PANSS Excited Component (Studie 3 i Tabell 31).
Undersökning av populationsundergrupper (ålder, ras och kön) avslöjade inte någon differentiell lyhördhet på basis av dessa undergrupper.
PATIENTINFORMATION
ABILIFY® (aripiprazol) Tabletter
ABILIFY DISCMELT® (aripiprazol) Oralt sönderfallande tabletter
ABILIFY® (aripiprazol) Oral lösning
ABILIFY® (aripiprazol) Injektion Endast för intramuskulär användning
Vilken är den viktigaste informationen jag borde veta om ABILIFY 20mg?
(För andra biverkningar, se även "Vilka är de möjliga biverkningarna av ABILIFY?")
Allvarliga biverkningar kan inträffa när du tar ABILIFY, inklusive:
- Ökad risk för dödsfall hos äldre patienter med demensrelaterad psykos: Läkemedel som ABILIFY 10mg kan öka risken för dödsfall hos äldre personer som har tappat kontakten med verkligheten (psykos) på grund av förvirring och minnesförlust (demens). ABILIFY är inte godkänt för behandling av patienter med demensrelaterad psykos.
- Risk för självmordstankar eller handlingar: Antidepressiva läkemedel, depression och andra allvarliga psykiska sjukdomar och självmordstankar eller -handlingar:
1. Antidepressiva läkemedel kan öka självmordstankar eller -handlingar hos vissa barn, tonåringar och unga vuxna under de första månaderna av behandlingen.
2. Depression och andra allvarliga psykiska sjukdomar är de viktigaste orsakerna till självmordstankar och -handlingar. Vissa människor kan ha en särskilt hög risk att få självmordstankar eller -handlingar. Dessa inkluderar personer som har (eller har en familjehistoria av) bipolär sjukdom (även kallad manodepressiv sjukdom) eller självmordstankar eller -handlingar.
3. Hur kan jag se efter och försöka förebygga självmordstankar och -handlingar hos mig själv eller en familjemedlem?
- Var uppmärksam på alla förändringar, särskilt plötsliga förändringar, i humör, beteenden, tankar eller känslor. Detta är mycket viktigt när ett antidepressivt läkemedel påbörjas eller när dosen ändras.
- Ring genast vårdgivaren för att rapportera nya eller plötsliga förändringar i humör, beteende, tankar eller känslor.
- Håll alla uppföljningsbesök hos vårdgivaren enligt schemat. Ring vårdgivaren mellan besöken vid behov, särskilt om du är orolig för symtom.
Ring en vårdgivare omedelbart om du eller din familjemedlem har något av följande symtom, särskilt om de är nya, värre eller oroar dig:
- tankar om självmord eller att dö
- försök att begå självmord
- ny eller värre depression
- ny eller värre ångest
- känner sig väldigt upprörd eller rastlös
- panikattacker
- sömnsvårigheter (sömnlöshet)
- ny eller värre irritabilitet
- agerar aggressivt, är arg eller våldsam
- agerar på farliga impulser
- en extrem ökning av aktivitet och prat (mani)
- andra ovanliga förändringar i beteende eller humör
Vad mer behöver jag veta om antidepressiva läkemedel?
- Sluta aldrig med ett antidepressivt läkemedel utan att först prata med en vårdgivare. Att plötsligt stoppa ett antidepressivt läkemedel kan orsaka andra symtom.
- Antidepressiva medel är läkemedel som används för att behandla depression och andra sjukdomar. Det är viktigt att diskutera alla risker med att behandla depression och även riskerna med att inte behandla den. Patienter och deras familjer eller andra vårdgivare bör diskutera alla behandlingsval med vårdgivaren, inte bara användningen av antidepressiva medel.
- Antidepressiva läkemedel har andra biverkningar. Prata med vårdgivaren om biverkningarna av det läkemedel som ordinerats till dig eller din familjemedlem.
- Antidepressiva läkemedel kan interagera med andra läkemedel. Känn till alla läkemedel som du eller din familjemedlem tar. Håll en lista över alla läkemedel för att visa vårdgivaren. Börja inte med nya läkemedel utan att först kontrollera med din vårdgivare.
- Inte alla antidepressiva läkemedel som skrivs ut för barn är FDA-godkända för användning till barn. Prata med ditt barns vårdgivare för mer information.
Vad är ABILIFY?
- ABILIFY 20mg orala tabletter, oralt sönderfallande tabletter och oral lösning är receptbelagda läkemedel som används för att behandla:
- Schizofreni
- maniska eller blandade episoder som inträffar med bipolär sjukdom I
- major depressive disorder (MDD) när ABILIFY 20mg används tillsammans med antidepressiva läkemedel
- irritabilitet i samband med autistisk störning
- Tourettes sjukdom
- ABILIFY Injection är ett receptbelagt läkemedel som används för att behandla:
- agitation i samband med schizofreni eller bipolär mani
Det är inte känt om ABILIFY 10mg är säkert eller effektivt för barn:
- under 13 år med schizofreni
- under 10 år med bipolär sjukdom I
- under 6 år med irritabilitet i samband med autistisk störning
- under 6 år med Tourettes sjukdom
Ta inte ABILIFY 20mg om du är allergisk mot aripiprazol eller något av innehållsämnena i ABILIFY. Se slutet av denna medicineringsguide för en komplett lista över ingredienser i ABILIFY.
Innan du tar ABILIFY 15mg, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du har eller haft:
- diabetes eller högt blodsocker hos dig eller din familj; din vårdgivare bör kontrollera ditt blodsocker innan du börjar med ABILIFY 10mg och även under behandlingen.
- anfall (kramper).
- lågt eller högt blodtryck.
- hjärtproblem eller stroke.
- graviditet eller planerar att bli gravid. Det är inte känt om ABILIFY kommer att skada ditt ofödda barn.
- Om du blir gravid medan du får ABILIFY 10 mg, prata med din vårdgivare om att registrera dig hos National Pregnancy Registry for Atypical Antipsychotics. Du kan registrera dig genom att ringa 1-866-961-2388 eller gå till http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- ammar eller planerar att amma. ABILIFY går över i din bröstmjölk. Prata med din vårdgivare om det bästa sättet att mata ditt barn om du får ABILIFY.
- lågt antal vita blodkroppar.
- fenylketonuri. ABILIFY DISCMELT Oralt sönderfallande tabletter innehåller fenylalanin.
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
ABILIFY och andra läkemedel kan påverka varandra och orsaka allvarliga biverkningar. ABILIFY kan påverka hur andra läkemedel fungerar, och andra läkemedel kan påverka hur ABILIFY verkar.
Din vårdgivare kan berätta för dig om det är säkert att ta ABILIFY tillsammans med dina andra läkemedel. Starta eller sluta inte med några läkemedel medan du tar ABILIFY utan att först prata med din läkare. Vet vilka mediciner du tar. Håll en lista över dina läkemedel för att visa din vårdgivare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta ABILIFY 20mg?
- Ta ABILIFY 10mg exakt som din läkare säger åt dig att ta det. Ändra inte dosen eller sluta ta ABILIFY själv.
- ABILIFY 20 mg kan tas med eller utan mat.
- ABILIFY tabletter ska sväljas hela.
- Om du missar en dos av ABILIFY 20 mg, ta den missade dosen så snart du kommer ihåg det. Om det nästan är dags för nästa dos, hoppa över den missade dosen och ta din nästa dos vid den vanliga tiden. Ta inte två doser av ABILIFY 10 mg samtidigt.
- Om du har ordinerats ABILIFY DISCMELT, ta det enligt följande:
- Öppna inte blisterförpackningen förrän du är redo att ta DISCMELT-tabletten.
- För att ta bort en DISCMELT-tablett, öppna förpackningen och dra av folien på blisterförpackningen för att exponera tabletten.
- Tryck inte tabletten genom folien eftersom det kan skada tabletten.
- Omedelbart efter att blistern öppnats, använd torra händer, ta bort tabletten och placera hela ABILIFY DISCMELT oralt sönderfallande tablett på tungan.
- Tablettsönderdelning sker snabbt i saliv. Det rekommenderas att ABILIFY 10mg DISCMELT tas utan vätska. Men om det behövs kan det tas med vätska.
- Försök inte att dela DISCMELT-tabletten.
- Om du tar för mycket ABILIFY, ring din vårdgivare eller giftkontrollcentral på 1-800-222-1222 omedelbart, eller gå till närmaste akutmottagning.
Vad ska jag undvika när jag tar ABILIFY 10mg?
- Kör inte bil, använd inte tunga maskiner eller gör andra farliga aktiviteter förrän du vet hur ABILIFY 10mg påverkar dig. ABILIFY 20mg kan göra dig dåsig.
- Undvik att bli överhettad eller uttorkad.
- Överträna inte.
- Vid varmt väder, håll dig inne på en sval plats om möjligt.
- Håll dig borta från solen. Bär inte för mycket eller tunga kläder.
- Drick mycket vatten.
Vilka är de möjliga biverkningarna av ABILIFY?
ABILIFY 10mg kan orsaka allvarliga biverkningar, inklusive:
- Se "Vad är den viktigaste informationen jag borde veta om ABILIFY 10mg?"
- Stroke hos äldre personer (cerebrovaskulära problem) som kan leda till döden
- Malignt neuroleptikasyndrom (NMS). Berätta genast för din vårdgivare om du har några eller alla av följande symtom: hög feber, stela muskler, förvirring, svettning, förändringar i puls, hjärtfrekvens och blodtryck. Dessa kan vara symtom på ett sällsynt och allvarligt tillstånd som kan leda till döden. Ring din vårdgivare omedelbart om du har något av dessa symtom.
- Okontrollerade kroppsrörelser (tardiv dyskinesi). ABILIFY kan orsaka rörelser som du inte kan kontrollera i ansiktet, tungan eller andra kroppsdelar. Tardiv dyskinesi kanske inte försvinner, även om du slutar att ta ABILIFY. Tardiv dyskinesi kan också börja efter att du slutat att ta ABILIFY.
- Problem med din ämnesomsättning såsom:
- Högt blodsocker (hyperglykemi) och diabetes. Blodsockerhöjningar kan inträffa hos vissa personer som tar ABILIFY. Extremt högt blodsocker kan leda till koma eller dödsfall. Om du har diabetes eller riskfaktorer för diabetes (som övervikt eller diabetes i familjen), bör din läkare kontrollera ditt blodsocker innan du börjar med ABILIFY och under din behandling.
Ring din vårdgivare om du har något av dessa symtom på högt blodsocker när du får ABILIFY:
- känner mig väldigt törstig
- behöver kissa mer än vanligt
- känner mig väldigt hungrig
- känna sig svag eller trött
- får ont i magen
- känna dig förvirrad, eller så luktar din andedräkt fruktig
- Ökade fettnivåer (kolesterol och triglycerider) i ditt blod.
- Viktökning. Du och din vårdgivare bör kontrollera din vikt regelbundet.
- Ovanliga drifter. Vissa personer som tar ABILIFY 15mg har haft ovanliga behov, såsom spel, hetsätning eller ätande som du inte kan kontrollera (tvångsmässigt), tvångsmässig shopping och sexuella drifter. Om du eller dina familjemedlemmar märker att du har ovanliga drifter eller beteenden, prata med din vårdgivare.
- Ortostatisk hypotoni (sänkt blodtryck). Yrsel eller svimning kan inträffa när man reser sig för snabbt från sittande eller liggande läge.
- Falls. ABILIFY kan göra dig sömnig eller yr, kan orsaka ett sänkt blodtryck när du byter position och kan bromsa ditt tänkande och din motorik, vilket kan leda till fall som kan orsaka frakturer eller andra skador.
- Lågt antal vita blodkroppar
- Kramper (kramper)
- Problem med kontroll av din kroppstemperatur, särskilt när du tränar mycket eller befinner dig i ett område som är mycket varmt. Det är viktigt för dig att dricka vatten för att undvika uttorkning. Se "Vad ska jag undvika när jag får ABILIFY 15mg?"
- Svårt att svälja som kan göra att mat eller vätska kommer ner i lungorna.
De vanligaste biverkningarna av ABILIFY 10 mg hos vuxna inkluderar:
- Illamående
- yrsel
- kräkningar
- ångest
- förstoppning
- sömnlöshet
- huvudvärk
- rastlöshet
- suddig syn
- övre luftvägssjukdom
- inre känsla av rastlöshet/behov av att röra sig (akatisi)
De vanligaste biverkningarna av ABILIFY hos barn inkluderar:
- känner sig sömnig
- sömnlöshet
- huvudvärk
- illamående
- kräkningar
- Täppt i näsan
- Trötthet
- viktökning
- ökad eller minskad aptit
- okontrollerade rörelser såsom rastlöshet, tremor
- ökad saliv eller dregling
- muskelstelhet
Dessa är inte alla möjliga biverkningar av ABILIFY.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara ABILIFY?
- Förvara ABILIFY 15 mg i rumstemperatur, mellan 68°F till 77°F (20°C till 25°C).
- Öppnade flaskor med ABILIFY 10 mg oral lösning kan användas i upp till 6 månader efter öppnandet, men inte efter utgångsdatumet på flaskan.
Förvara ABILIFY och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av ABILIFY
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte ABILIFY 20mg för ett tillstånd som det inte ordinerats för. Ge inte ABILIFY 20 mg till andra personer, även om de har samma symtom som du. Det kan skada dem. Du kan fråga din vårdgivare eller apotekspersonal om information om ABILIFY 10mg som är skriven för vårdpersonal.
Vilka är ingredienserna i ABILIFY?
Aktiv beståndsdel: aripiprazol
Inaktiva Ingredienser:
majsstärkelse, hydroxipropylcellulosa, laktosmonohydrat, magnesiumstearat och mikrokristallin cellulosa. Färgämnen inkluderar järnoxid (gul eller röd) och FD&C Blue No. 2 Aluminium Lake
ABILIFY 10mg DISCMELT oralt sönderfallande tabletter: acesulfamkalium, aspartam (som innehåller fenylalanin), kalciumsilikat, kroskarmellosnatrium, krospovidon, crème de vanilla (naturliga och artificiella smakämnen), magnesiumstearat, mikrokristallin cellulosa, kiseldioxid, vinsyra och xylitol. Färgämnen inkluderar järnoxid (gul eller röd) och FD&C Blue No. 2 Aluminium Lake
ABILIFY oral lösning: dinatriumedetat, fruktos (200 mg per ml), glycerin, dl-mjölksyra, metylparaben, propylenglykol, propylparaben, natriumhydroxid, sackaros (400 mg per ml) och renat vatten. Den orala lösningen är smaksatt med naturlig apelsinkräm och andra naturliga smakämnen
För mer information om ABILIFY gå till www.abilify.com eller ring 1-800-438-6055.
Denna medicineringsguide har godkänts av US Food and Drug Administration
