Geodon 40mg, 80mg, 20mg Ziprasidone Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Geodon och hur används det?
Geodon är ett receptbelagt läkemedel som används för att behandla symptomen på schizofreni, akut agitation med schizofreni och bipolär störning I. Geodon kan användas ensamt eller tillsammans med andra läkemedel.
Geodon 20mg tillhör en klass av läkemedel som kallas antipsykotika.
Det är inte känt om Geodon är säkert och effektivt hos barn.
Vilka är möjliga biverkningar av Geodon?
Geodon 20mg kan orsaka allvarliga biverkningar, inklusive:
- snabba eller bultande hjärtslag,
- fladdrande i ditt bröst,
- andnöd,
- plötslig yrsel,
- okontrollerade muskelrörelser i ansiktet (tugga, smälla på läpparna, rynka pannan, tungrörelser, blinka eller ögonrörelser),
- alla hudutslag,
- feber,
- munsår,
- hudsår,
- öm hals,
- hosta,
- problem att andas,
- ökad törst,
- ökad urinering
- torr mun,
- fruktig andedräkt lukt,
- mycket stela muskler,
- hög feber,
- svettas,
- agitation, och
- förvirring
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Geodon 40mg inkluderar:
- yrsel,
- dåsighet,
- svaghet,
- illamående,
- kräkningar,
- problem med att svälja,
- känner sig rastlös,
- skakningar,
- synproblem,
- rinnande näsa, och
- ny eller förvärrad hosta
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Prometrium. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
ÖKAD DÖDLIGHET HOS ÄLDRE PATIENTER MED DEMENSREATERAT PSYKOS
Äldre patienter med demensrelaterad psykos som behandlas med antipsykotiska läkemedel löper en ökad risk att dö. GEODON är inte godkänt för behandling av demensrelaterad psykos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
BESKRIVNING
GEODON 40 mg finns som kapslar (ziprasidonhydroklorid) för oral administrering och som injektion (ziprasidonmesylat) endast för intramuskulär användning. Ziprasidon är ett psykotropiskt medel som inte är kemiskt relaterat till fenotiazin eller butyrofenon antipsykotiska medel. Den har en molekylvikt på 412,94 (fri bas), med följande kemiska namn: 5-[2-[4-(1,2-bensisotiazol-3-yl)-1-piperazinyl]etyl]-6-klor-1 ,3-dihydro-2H-indol-2-on. Den empiriska formeln för C21H21ClN4OS (fri bas av ziprasidon) representerar följande strukturformel:
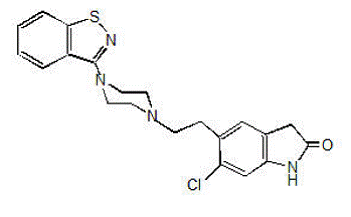
GEODON kapslar innehåller ett monohydroklorid, monohydratsalt av ziprasidon. Kemiskt sett är ziprasidonhydrokloridmonohydrat 5-[2-[4-(1,2-bensisotiazol-3-yl)-1-piperazinyl]etyl]-6-klor-1,3-dihydro-2H-indol-2-on monohydroklorid, monohydrat. Den empiriska formeln är C21H21ClN4OS• HCl• H2O och dess molekylvikt är 467,42. Ziprasidonhydrokloridmonohydrat är ett vitt till svagt rosa pulver.
GEODON 20 mg kapslar tillhandahålls för oral administrering i 20 mg (blå/vit), 40 mg (blå/blå), 60 mg (vit/vit) och 80 mg (blå/vit) kapslar. GEODON 40 mg kapslar innehåller ziprasidonhydrokloridmonohydrat, laktos, förgelatinerad stärkelse och magnesiumstearat.
GEODON för injektion innehåller en lyofiliserad form av ziprasidonmesylattrihydrat. Kemiskt sett är ziprasidonmesylattrihydrat 5-[2-[4-(1,2-bensisotiazol-3-yl)-1-piperazinyl]etyl]-6-klor-1,3-dihydro-2H-indol-2-on metansulfonat, trihydrat. Den empiriska formeln är C21H21ClN4OS • CH3SO3H • 3H2O och dess molekylvikt är 563,09.
GEODON 40 mg för injektion finns tillgängligt i en endosflaska som ziprasidonmesylat (20 mg ziprasidon/ml när det bereds enligt instruktionerna på etiketten) [se DOSERING OCH ADMINISTRERING ]. Varje ml ziprasidonmesylat för injektion (när den rekonstitueras) innehåller 20 mg ziprasidon och 4,7 mg metansulfonsyra solubiliserad med 294 mg sulfobutyleter-β-cyklodextrinnatrium (SBECD).
INDIKATIONER
GEODON är indicerat för behandling av schizofreni, som monoterapi för akut behandling av bipolär manisk eller blandad episod, och som tillägg till litium eller valproat för underhållsbehandling av bipolär sjukdom. GEODON intramuscular är indicerat för akut agitation hos schizofrena patienter. När man väljer bland de alternativa behandlingar som finns tillgängliga för det tillstånd som behöver behandling, bör förskrivaren överväga upptäckten av ziprasidons större förmåga att förlänga QT/QTc-intervallet jämfört med flera andra antipsykotiska läkemedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Förlängning av QTc-intervallet är i vissa andra läkemedel associerat med förmågan att orsaka arytmi av torsade de pointes-typ, en potentiellt dödlig polymorf ventrikulär takykardi och plötslig död. I många fall skulle detta leda till slutsatsen att andra droger bör prövas först. Huruvida ziprasidon kommer att orsaka torsade de pointes eller öka graden av plötslig död är ännu inte känt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Schizofreni
- GEODON är indicerat för behandling av schizofreni hos vuxna [se Kliniska studier ].
Bipolär störning I (akuta blandade eller maniska episoder och underhållsbehandling som tillägg till litium eller valproat)
- GEODON är indicerat som monoterapi för akut behandling av vuxna med maniska eller blandade episoder associerade med bipolär störning I [se Kliniska studier ].
- GEODON 40mg är indicerat som tillägg till litium eller valproat för underhållsbehandling av bipolär störning I hos vuxna [se Kliniska studier ].
Akut behandling av agitation vid schizofreni
- GEODON 40 mg intramuskulärt är indicerat för behandling av akut agitation hos schizofrena vuxna patienter för vilka behandling med ziprasidon är lämplig och som behöver intramuskulär antipsykotisk medicin för snabb kontroll av agitation [se Kliniska studier ].
Eftersom det inte finns någon erfarenhet av säkerheten vid intramuskulär administrering av ziprasidon till schizofrena patienter som redan tar oral ziprasidon, rekommenderas inte samtidig administrering.
DOSERING OCH ADMINISTRERING
Schizofreni
Val av dos
GEODON 40 mg kapslar ska ges i en initial daglig dos på 20 mg två gånger dagligen tillsammans med mat. Hos vissa patienter kan den dagliga dosen därefter justeras på basis av individuell klinisk status upp till 80 mg två gånger dagligen. Dosjusteringar, om indicerat, bör i allmänhet ske med minst 2 dagars intervall, eftersom steady-state uppnås inom 1 till 3 dagar. För att säkerställa användningen av den lägsta effektiva dosen bör patienterna vanligtvis observeras för förbättring i flera veckor innan dosjusteringar uppåt.
Effekt vid schizofreni visades i ett dosintervall på 20 mg till 100 mg två gånger dagligen i kortvariga, placebokontrollerade kliniska prövningar. Det fanns trender mot dossvar inom intervallet 20 mg till 80 mg två gånger dagligen, men resultaten var inte konsekventa. En ökning till en dos större än 80 mg två gånger dagligen rekommenderas generellt inte. Säkerheten för doser över 100 mg två gånger dagligen har inte utvärderats systematiskt i kliniska prövningar [se Kliniska studier ].
Underhållsbehandling
Även om det inte finns några bevis tillgängliga för att svara på frågan om hur länge en patient som behandlats med ziprasidon ska vara kvar på det, visade en underhållsstudie på patienter som hade varit symtomatiskt stabila och sedan randomiserades för att fortsätta ziprasidon eller byta till placebo en fördröjning i tid. till återfall för patienter som får GEODON [se Kliniska studier ]. Ingen ytterligare fördel har visats för doser över 20 mg två gånger dagligen. Patienter bör regelbundet utvärderas för att fastställa behovet av underhållsbehandling.
Bipolär störning I (akuta blandade eller maniska episoder och underhållsbehandling som tillägg till litium eller valproat)
Akut behandling av maniska eller blandade episoder
Dos Selection-Oral ziprasidon ska administreras med en initial daglig dos på 40 mg två gånger dagligen tillsammans med mat. Dosen kan sedan ökas till 60 mg eller 80 mg två gånger dagligen den andra behandlingsdagen och därefter justeras på basis av tolerans och effekt inom intervallet 40 mg–80 mg två gånger dagligen. I de kliniska prövningarna med flexibel dos var den administrerade genomsnittliga dagliga dosen cirka 120 mg [se Kliniska studier ].
Underhållsbehandling (som ett komplement till litium eller valproat)
Fortsätt behandlingen med samma dos som patienten initialt stabiliserades på, inom intervallet 40 mg–80 mg två gånger dagligen med mat. Patienter bör regelbundet utvärderas för att fastställa behovet av underhållsbehandling [se Kliniska studier ].
Akut behandling av agitation vid schizofreni
Intramuskulär dosering
Den rekommenderade dosen är 10 mg till 20 mg administrerad efter behov upp till en maximal dos på 40 mg per dag. Doser på 10 mg kan administreras varannan timme; doser på 20 mg kan administreras var fjärde timme upp till maximalt 40 mg/dag. Intramuskulär administrering av ziprasidon i mer än tre dagar i följd har inte studerats.
Om långtidsbehandling är indicerad ska orala ziprasidonhydrokloridkapslar ersätta den intramuskulära administreringen så snart som möjligt.
Eftersom det inte finns någon erfarenhet av säkerheten vid intramuskulär administrering av ziprasidon till schizofrena patienter som redan tar oral ziprasidon, rekommenderas inte samtidig administrering.
Ziprasidon intramuscular är endast avsett för intramuskulär användning och ska inte administreras intravenöst.
Intramuskulär förberedelse för administrering
GEODON för injektion (ziprasidonmesylat) ska endast administreras som intramuskulär injektion och ska inte administreras intravenöst. Endosflaskor kräver beredning före administrering.
Tillsätt 1,2 ml sterilt vatten för injektion till injektionsflaskan och skaka kraftigt tills allt läkemedel är upplöst. Varje ml rekonstituerad lösning innehåller 20 mg ziprasidon. För att administrera en 10 mg dos, dra upp 0,5 ml av den rekonstituerade lösningen. För att administrera en 20 mg dos, dra upp 1,0 ml av den rekonstituerade lösningen. Eventuell oanvänd del ska kasseras. Eftersom det inte finns något konserveringsmedel eller bakteriostatiskt medel i denna produkt, måste aseptisk teknik användas vid beredning av den slutliga lösningen. Detta läkemedel får inte blandas med andra läkemedel eller lösningsmedel än sterilt vatten för injektion. Parenterala läkemedelsprodukter bör inspekteras visuellt med avseende på partiklar och missfärgning före administrering, närhelst lösning och behållare tillåter.
HUR LEVERERAS
Doseringsformer och styrkor
GEODON kapslar är differentierade efter kapselns färg/storlek och är märkta i svart bläck med "Pfizer och ZDX [doseringsstyrka]" eller "Pfizer" och ett unikt nummer. GEODON 40 mg kapslar tillhandahålls för oral administrering i 20 mg (blå/vit), 40 mg (blå/blå), 60 mg (vit/vit) och 80 mg (blå/vit) kapslar. De levereras i följande styrkor och paketkonfigurationer:
GEODON för injektion finns tillgängligt i en endosflaska som ziprasidonmesylat (20 mg ziprasidon/ml när det bereds enligt anvisningarna på etiketten) [se DOSERING OCH ADMINISTRERING ]. Varje ml ziprasidonmesylat för injektion (när den rekonstitueras) ger en färglös till ljusrosa lösning som innehåller 20 mg ziprasidon och 4,7 mg metansulfonsyra solubiliserat med 294 mg sulfobutyleter-β-cyklodextrinnatrium (SBECD).
Förvaring Och Hantering
GEODON kapslar är differentierade efter kapselfärg/storlek och är märkta i svart bläck med "Pfizer och ZDX [dosstyrka]" eller med "Pfizer" och ett unikt nummer. GEODON 20 mg kapslar tillhandahålls för oral administrering i 20 mg (blå/vit), 40 mg (blå/blå), 60 mg (vit/vit) och 80 mg (blå/vit) kapslar. De levereras i följande styrkor och paketkonfigurationer:
Eller
GEODON kapslar ska förvaras vid 25°C (77°F); utflykter tillåtna till 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ].
GEODON 80 mg för injektion finns tillgänglig i en endosflaska som ziprasidonmesylat (20 mg ziprasidon/ml när den rekonstitueras enligt instruktionerna på etiketten) [se DOSERING OCH ADMINISTRERING ]. Varje ml ziprasidonmesylat för injektion (när den rekonstitueras) ger en färglös till ljusrosa lösning som innehåller 20 mg ziprasidon och 4,7 mg metansulfonsyra solubiliserat med 294 mg sulfobutyleter-β-cyklodextrinnatrium (SBECD).
GEODON 40mg för injektion ska förvaras vid 25°C (77°F); utflykter tillåtna till 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur i torr form. Skydda från ljus. Efter beredning kan GEODON 40 mg för injektion förvaras, skyddat från ljus, i upp till 24 timmar vid 15°C till 30°C (59°F till 86°F) eller upp till 7 dagar i kyl, 2°C till 8 °C (36°F till 46°F).
Distribuerat av: Roerig Division of Pfizer Inc, NY, NY 10017. Reviderad: okt 2020
BIEFFEKTER
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Kliniska prövningar för oralt ziprasidon inkluderade cirka 5700 patienter och/eller normala försökspersoner som exponerats för en eller flera doser ziprasidon. Av dessa 5700 var över 4800 patienter som deltog i effektivitetsstudier med flera doser, och deras erfarenhet motsvarade cirka 1831 patientår. Dessa patienter inkluderar: (1) 4331 patienter som deltog i flerdosstudier, huvudsakligen i schizofreni, vilket representerar ungefär 1698 patientår av exponering den 5 februari 2000; och (2) 472 patienter som deltog i bipolär manistudier, vilket representerade cirka 133 patientår av exponering. Ytterligare 127 patienter med bipolär sjukdom deltog i en långtidsstudie med underhållsbehandling som representerade cirka 74,7 patientår av exponering för ziprasidon. Tillstånden och varaktigheten av behandlingen med ziprasidon inkluderade öppna och dubbelblinda studier, slutenvårds- och öppenvårdsstudier samt korttids- och långtidsexponering.
Kliniska prövningar för intramuskulärt ziprasidon inkluderade 570 patienter och/eller normala försökspersoner som fick en eller flera injektioner av ziprasidon. Över 325 av dessa försökspersoner deltog i försök som involverade administrering av flera doser.
Biverkningar under exponering erhölls genom att frivilligt rapporterade biverkningar samlades in, såväl som resultat av fysiska undersökningar, vitala tecken, vikter, laboratorieanalyser, EKG och resultat av oftalmologiska undersökningar.
De angivna frekvenserna av biverkningar representerar andelen individer som åtminstone en gång upplevt en behandlingsuppkommande biverkning av den listade typen. En reaktion ansågs vara framträdande av behandling om den inträffade för första gången eller förvärrades under behandling efter baslinjeutvärdering.
Skadliga fynd observerade under kortsiktiga, placebokontrollerade försök med oralt Ziprasidon
Följande fynd är baserade på de kortsiktiga placebokontrollerade premarketingstudierna för schizofreni (en pool av två 6-veckors och två 4-veckors fastdosstudier) och bipolär mani (en pool med två 3-veckors flexibla doser försök) där ziprasidon administrerades i doser från 10 till 200 mg/dag.
Vanligt observerade biverkningar i kortsiktiga placebokontrollerade försök
Följande biverkningar var de vanligast observerade biverkningarna förknippade med användning av ziprasidon (incidens på 5 % eller mer) och som inte observerades vid en likvärdig incidens bland placebobehandlade patienter (ziprasidonincidens minst dubbelt så hög som för placebo):
Schizofreniförsök (se tabell 11)
- Sömnighet
- Luftvägsinfektion
Bipolära försök (se tabell 12)
- Sömnighet
- Extrapyramidala symtom som inkluderar följande biverkningstermer: extrapyramidalt syndrom, hypertoni, dystoni, dyskinesi, hypokinesi, tremor, förlamning och ryckningar. Ingen av dessa biverkningar inträffade individuellt med en incidens på mer än 10 % i bipolär manistudier.
- Yrsel som inkluderar biverkningstermerna yrsel och yrsel.
- Akatisia
- Onormal syn
- Asteni
- Kräkningar
Schizofreni
Biverkningar associerade med avbrytande av behandling i kortvariga, placebokontrollerade försök med oralt Ziprasidon
Ungefär 4,1 % (29/702) av ziprasidonbehandlade patienter i korttidsstudier, placebokontrollerade studier avbröt behandlingen på grund av en biverkning, jämfört med cirka 2,2 % (6/273) på placebo. Den vanligaste reaktionen i samband med avhopp var utslag, inklusive 7 avhopp för utslag bland ziprasidonpatienter (1 %) jämfört med inga placebopatienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Biverkningar som inträffar med en incidens av 2 % eller mer bland Ziprasidon-behandlade patienter i kortvariga, orala, placebokontrollerade försök
Tabell 11 räknar upp förekomsten, avrundad till närmaste procent, av behandlingsuppkomna biverkningar som inträffade under akut terapi (upp till 6 veckor) hos övervägande patienter med schizofreni, inklusive endast de reaktioner som inträffade hos 2 % eller fler av patienterna som behandlades med ziprasidon och för vilka incidensen hos patienter som behandlades med ziprasidon var högre än incidensen hos placebobehandlade patienter.
Dosberoende av biverkningar i kortsiktiga, fasta doser, placebokontrollerade försök
En analys av dosrespons i schizofreni 4-studiepoolen visade ett tydligt samband mellan biverkningar och dos för följande reaktioner: asteni, postural hypotoni, anorexi, muntorrhet, ökad salivutsöndring, artralgi, ångest, yrsel, dystoni, hypertoni, somnolens , tremor, rinit, hudutslag och onormal syn.
Extrapyramidala symtom (EPS)
Incidensen av rapporterad EPS (som inkluderade biverkningstermerna extrapyramidalt syndrom, hypertoni, dystoni, dyskinesi, hypokinesi, tremor, förlamning och ryckningar) för ziprasidon-behandlade patienter i de kortsiktiga, placebokontrollerade schizofrenistudierna var 14 % vs. 8 % för placebo. Objektivt insamlade data från dessa prövningar på Simpson-Angus Rating Scale (för EPS) och Barnes Akathisia Scale (för akatisi) visade i allmänhet ingen skillnad mellan ziprasidon och placebo.
Dystoni
Klasseffekt: Symtom på dystoni, långvariga onormala sammandragningar av muskelgrupper, kan förekomma hos känsliga individer under de första dagarna av behandlingen. Dystoniska symtom inkluderar: spasmer i nackmusklerna, som ibland utvecklas till täthet i halsen, sväljsvårigheter, andningssvårigheter och/eller utskjutande tunga. Även om dessa symtom kan uppträda vid låga doser, förekommer de oftare och med större svårighetsgrad med hög styrka och vid högre doser av första generationens antipsykotiska läkemedel. En förhöjd risk för akut dystoni observeras hos män och yngre åldersgrupper.
Vital Sign Changes
Ziprasidon är associerat med ortostatisk hypotoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
EKG-förändringar
Ziprasidon är associerat med en ökning av QTc-intervallet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. I schizofrenistudierna associerades ziprasidon med en genomsnittlig ökning av hjärtfrekvensen på 1,4 slag per minut jämfört med en minskning med 0,2 slag per minut bland placebopatienter.
Andra biverkningar som observerats under premarketingutvärderingen av oralt Ziprasidon
Följande är en lista över COSTART-termer som återspeglar behandlingsuppkomna biverkningar enligt definitionen i inledningen till avsnittet BIVERKNINGAR rapporterade av patienter som behandlats med ziprasidon i schizofrenistudier vid multipla doser >4 mg/dag i databasen med 3834 patienter. Alla rapporterade reaktioner är inkluderade utom de som redan listats i Tabell 11 eller någon annanstans i märkningen, de reaktionstermer som var så generella att de var oinformativa, reaktioner som bara rapporterats en gång och som inte hade en betydande sannolikhet att vara akut livshotande, reaktioner som är en del av den sjukdom som behandlas eller är på annat sätt vanliga som bakgrundsreaktioner, och reaktioner som anses osannolikt vara läkemedelsrelaterade. Det är viktigt att betona att även om de rapporterade reaktionerna inträffade under behandling med ziprasidon, så var de inte nödvändigtvis orsakade av det.
Biverkningar kategoriseras vidare efter kroppssystem och listas i ordning efter minskande frekvens enligt följande definitioner:
Frekventa - biverkningar som förekommer hos minst 1/100 patienter (≥1,0 % av patienterna) (endast de som inte redan är listade i de tabellerade resultaten från placebokontrollerade studier visas i denna lista);
Sällsynta - biverkningar som förekommer hos 1/100 till 1/1000 patienter (hos 0,1-1,0 % av patienterna)
Sällsynta - biverkningar som förekommer hos färre än 1/1000 patienter (
Kroppen som helhet
Frekvent buksmärta, influensasyndrom, feber, oavsiktligt fall, ansiktsödem, frossa, ljuskänslighetsreaktion, flanksmärta, hypotermi, motorfordonsolycka
Kardiovaskulära systemet
Frekvent takykardi, hypertoni, postural hypotoni
Sällsynt bradykardi, angina pectoris, förmaksflimmer
Sällsynt första gradens AV-block, grenblock, flebit, lungemboli, kardiomegali, hjärninfarkt, cerebrovaskulär olycka, djup tromboflebit, myokardit, tromboflebit
Matsmältningssystemet
Frekvent anorexi, kräkningar
Sällsynt rektal blödning, dysfagi, tungödem
Sällsynt tandköttsblödning, gulsot, fekal påverkan, ökad gamma-glutamyltranspeptidas, hematemes, kolestatisk gulsot, hepatit, hepatomegali, leukoplaki i munnen, fettleveravlagringar, melena
Endokrin
Sällsynt hypotyreos, hypertyreos, tyreoidit
Hemiska och lymfatiska systemet
Sällsynt anemi, ekkymos, leukocytos, leukopeni, eosinofili, lymfadenopati
Sällsynt trombocytopeni, hypokrom anemi, lymfocytos, monocytos, basofili, lymfödem, polycytemi, trombocytemi
Metaboliska och näringsmässiga störningar
Sällsynt törst, ökat transaminas, perifert ödem, hyperglykemi, ökat kreatinfosfokinas, ökat alkaliskt fosfatas, hyperkolesteremi, uttorkning, ökat mjölksyradehydrogenas, albuminuri, hypokalemi
Sällsynt ökad BUN, ökad kreatinin, hyperlipemi, hypokolesteremi, hyperkalemi, hypokloremi, hypoglykemi, hyponatremi, hypoproteinemi, minskad glukostolerans, gikt, hyperkloremi, hyperurikemi, hypokalcemi, hypoglykemisk reaktion, hypomagnesemi, ketos, respiratorisk alkalos,
Muskuloskeletala systemet
Frekvent myalgi
Sällsynt tenosynovit
Sällsynt myopati
Nervsystem
Frekvenstagitation, extrapyramidalt syndrom, tremor, dystoni, hypertoni, dyskinesi, fientlighet, ryckningar, parestesi, förvirring, yrsel, hypokinesi, hyperkinesi, onormal gång, okulogyrisk kris, hypestesi, ataxi, minnesförlust, kugghjulsstyvhet, dyironi, kugghjulsstyvhet, delironi, abstinenssyndrom, buccoglossalt syndrom, choreoatetosis, diplopi, inkoordination, neuropati
Sällsynt förlamning
Sällsynta myoklonus, nystagmus, torticollis, cirkumoral parestesi, opisthotonos, ökade reflexer, trismus
Andningssystem
Frekvent dyspné
Sällsynt lunginflammation, näsblod
Sällsynt hemoptys, laryngisism
Hud och bihang
Sällsynta makulopapulära utslag, urtikaria, alopeci, eksem, exfoliativ dermatit, kontaktdermatit, vesikulobullösa utslag
Särskilda sinnen
Frekvent svampdermatit
Sällsynt konjunktivit, torra ögon, tinnitus, blefarit, grå starr, fotofobi
Sällsynt ögonblödning, synfältsdefekt, keratit, keratokonjunktivit
Urogenitala systemet
Sällsynt impotens, onormal ejakulation, amenorré, hematuri, menorragi, laktation hos kvinnor, polyuri, urinretentionsmetrorragi, sexuell dysfunktion hos män, anorgasmi, glykosuri
Sällsynt gynekomasti, vaginal blödning, natturi, oliguri, kvinnlig sexuell dysfunktion, livmoderblödning
Bipolär sjukdom
Akut behandling av maniska eller blandade episoder
Biverkningar associerade med avbrytande av behandling på kort sikt, placebokontrollerade prövningar
Ungefär 6,5 % (18/279) av ziprasidonbehandlade patienter i korttidsstudier, placebokontrollerade studier avbröt behandlingen på grund av en biverkning, jämfört med cirka 3,7 % (5/136) på placebo. De vanligaste reaktionerna i samband med avhopp hos de ziprasidonbehandlade patienterna var akatisi, ångest, depression, yrsel, dystoni, hudutslag och kräkningar, med 2 avhopp för var och en av dessa reaktioner bland ziprasidonpatienter (1%) jämfört med en placebopatient vardera för dystoni och utslag (1%) och inga placebopatienter för de återstående biverkningarna.
Biverkningar som inträffar med en incidens av 2 % eller mer bland Ziprasidon-behandlade patienter i kortvariga, orala, placebokontrollerade försök
Tabell 12 räknar upp incidensen, avrundad till närmaste procent, av behandlingsuppkomna biverkningar som inträffade under akut behandling (upp till 3 veckor) hos patienter med bipolär mani, inklusive endast de reaktioner som inträffade hos 2 % eller fler av patienterna som behandlades med ziprasidon och för vilka incidensen hos patienter som behandlades med ziprasidon var högre än incidensen hos placebobehandlade patienter.
Utforskningar efter interaktioner på basis av kön avslöjade inga kliniskt betydelsefulla skillnader i förekomsten av biverkningar på grundval av denna demografiska faktor.
Intramuskulär Ziprasidon
Biverkningar som inträffar med en frekvens av 1 % eller mer bland Ziprasidon-behandlade patienter i korttidsförsök med intramuskulärt Ziprasidon
Tabell 13 räknar upp incidensen, avrundad till närmaste procent, av behandlingsuppkomna biverkningar som inträffade under akut behandling med intramuskulär ziprasidon hos 1 % eller fler av patienterna.
dessa studier var de vanligast observerade biverkningarna förknippade med användning av intramuskulär ziprasidon (incidens på 5 % eller mer) och observerades i en frekvens på intramuskulär ziprasidon (i de högre dosgrupperna) minst dubbelt så hög som för den lägsta intramuskulära ziprasidongruppen var huvudvärk (13 %), illamående (12 %) och somnolens (20 %).
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av GEODON efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Biverkningsrapporter som inte är listade ovan som har mottagits sedan marknadsintroduktionen inkluderar sällsynta förekomster av följande: Hjärtsjukdomar: Takykardi, torsade de pointes (i närvaro av flera störande faktorer), [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]; Störningar i matsmältningssystemet: Svullen tunga; Reproduktionssystemet och bröststörningar: Galactorrhea, priapism; Störningar i nervsystemet: Ansiktshäng, malignt neuroleptikasyndrom, serotonergt syndrom (enbart eller i kombination med serotonerga läkemedel), tardiv dyskinesi; Psykiatriska störningar: sömnlöshet, mani/hypomani; Hud och subkutan vävnad: Allergisk reaktion (såsom allergisk dermatit, angioödem, orofacialt ödem, urtikaria), utslag, läkemedelsreaktion med eosinofili och systemiska symtom (DRESS); Störningar i urogenitala systemet: Enures, urininkontinens; Vaskulära störningar: Postural hypotoni, synkope.
LÄKEMEDELSINTERAKTIONER
Läkemedels-läkemedelsinteraktioner kan vara farmakodynamiska (kombinerade farmakologiska effekter) eller farmakokinetiska (förändring av plasmanivåer). Riskerna med att använda ziprasidon i kombination med andra läkemedel har utvärderats enligt beskrivningen nedan. Alla interaktionsstudier har utförts med oralt ziprasidon. Baserat på den farmakodynamiska och farmakokinetiska profilen för ziprasidon kan möjliga interaktioner förväntas:
Metabolisk väg
Cirka två tredjedelar av ziprasidon metaboliseras via en kombination av kemisk reduktion med glutation och enzymatisk reduktion med aldehydoxidas. Det finns inga kända kliniskt relevanta hämmare eller inducerare av aldehydoxidas. Mindre än en tredjedel av ziprasidons metaboliska clearance medieras av cytokrom P450-katalyserad oxidation.
In vitro studier
En enzymhämningsstudie in vitro med användning av humana levermikrosomer visade att ziprasidon hade liten hämmande effekt på CYP1A2, CYP2C9, CYP2C19, CYP2D6 och CYP3A4 och därför sannolikt inte skulle störa metabolismen av läkemedel som primärt metaboliseras av dessa enzymer. Det finns liten potential för läkemedelsinteraktioner med ziprasidon på grund av förskjutning [se KLINISK FARMAKOLOGI ].
Farmakodynamiska interaktioner
Ziprasidon ska inte användas med något läkemedel som förlänger QT-intervallet [se KONTRAINDIKATIONER ].
Med tanke på de primära CNS-effekterna av ziprasidon bör försiktighet iakttas när det tas i kombination med andra centralt verkande läkemedel.
På grund av dess potential att inducera hypotoni kan ziprasidon förstärka effekten av vissa antihypertensiva medel.
Ziprasidon kan motverka effekterna av levodopa och dopaminagonister.
Farmakokinetiska interaktioner
Karbamazepin
Karbamazepin är en inducerare av CYP3A4; administrering av 200 mg två gånger dagligen under 21 dagar resulterade i en minskning med cirka 35 % av AUC för ziprasidon. Denna effekt kan vara större när högre doser karbamazepin administreras.
Ketokonazol
Ketokonazol, en potent hämmare av CYP3A4, i en dos av 400 mg dagligen i 5 dagar, ökade AUC och Cmax för ziprasidon med cirka 35-40%. Andra hämmare av CYP3A4 förväntas ha liknande effekter.
Cimetidin
Cimetidin i en dos på 800 mg dagligen under 2 dagar påverkade inte ziprasidons farmakokinetik.
Antacida
Samtidig administrering av 30 ml Maalox® och ziprasidon påverkade inte farmakokinetiken för ziprasidon.
Litium
Ziprasidon i en dos på 40 mg två gånger dagligen administrerat samtidigt med litium i en dos på 450 mg två gånger dagligen under 7 dagar påverkade inte steady-state-nivån eller renalt clearance av litium. Ziprasidon doserat som tillägg till litium i en underhållsstudie med bipolära patienter påverkade inte de genomsnittliga terapeutiska litiumnivåerna.
Orala preventivmedel
In vivo-studier har inte visat någon effekt av ziprasidon på farmakokinetiken för östrogen- eller progesteronkomponenter. Ziprasidon i en dos på 20 mg två gånger dagligen påverkade inte farmakokinetiken för samtidigt administrerade orala preventivmedel, etinylöstradiol (0,03 mg) och levonorgestrel (0,15 mg).
Dextrometorfan
I enlighet med in vitro-resultat visade en studie på normala friska frivilliga att ziprasidon inte förändrade metabolismen av dextrometorfan, ett CYP2D6-modellsubstrat, till dess huvudmetabolit, dextrorfan. Det fanns ingen statistiskt signifikant förändring i förhållandet mellan dextrometorfan och dextrorfan i urinen.
Valproat
En farmakokinetisk interaktion mellan ziprasidon och valproat är osannolik på grund av bristen på gemensamma metabola vägar för de två läkemedlen. Ziprasidon doserat som tillägg till valproat i en underhållsstudie med bipolära patienter påverkade inte genomsnittliga terapeutiska valproatnivåer.
Annan samtidig läkemedelsbehandling
Populationsfarmakokinetisk analys av schizofrena patienter inkluderade i kontrollerade kliniska prövningar har inte visat på några kliniskt signifikanta farmakokinetiska interaktioner med benstropin, propranolol eller lorazepam.
Matinteraktion
Den absoluta biotillgängligheten för en 20 mg dos under utfodring är cirka 60 %. Absorptionen av ziprasidon ökar upp till två gånger i närvaro av mat [se KLINISK FARMAKOLOGI ].
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Ökad dödlighet hos äldre patienter med demensrelaterad psykos
Äldre patienter med demensrelaterad psykos som behandlas med antipsykotiska läkemedel löper en ökad risk att dö. Analyser av 17 placebokontrollerade studier (modal varaktighet på 10 veckor), till stor del på patienter som tog atypiska antipsykotiska läkemedel, visade en risk för död hos läkemedelsbehandlade patienter på mellan 1,6 till 1,7 gånger risken för död hos placebobehandlade patienter. Under loppet av en typisk 10-veckors kontrollerad studie var dödsfrekvensen hos läkemedelsbehandlade patienter cirka 4,5 %, jämfört med en frekvens på cirka 2,6 % i placebogruppen.
Även om dödsorsakerna varierade, verkade de flesta av dödsfallen vara antingen kardiovaskulära (t.ex. hjärtsvikt, plötslig död) eller infektionssjukdomar (t.ex. lunginflammation). GEODON är inte godkänt för behandling av patienter med demensrelaterad psykos. [ser LÅDA VARNING , Cerebrovaskulära biverkningar, inklusive stroke, hos äldre patienter med demensrelaterad psykos ].
Cerebrovaskulära biverkningar, inklusive stroke, hos äldre patienter med demensrelaterad psykos
I placebokontrollerade studier på äldre personer med demens, hade patienter randomiserade till risperidon, aripiprazol och olanzapin en högre incidens av stroke och övergående ischemisk attack, inklusive dödlig stroke. GEODON är inte godkänt för behandling av patienter med demensrelaterad psykos [se LÅDA VARNING och Ökad dödlighet hos äldre patienter med demensrelaterad psykos ].
QT-förlängning och risk för plötslig död
Användning av Ziprasidon bör undvikas i kombination med andra läkemedel som är kända för att förlänga QTc-intervallet [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ]. Dessutom bör läkare vara uppmärksamma på identifiering av andra läkemedel som konsekvent har observerats för att förlänga QTc-intervallet. Sådana läkemedel bör inte förskrivas med ziprasidon. Ziprasidon bör också undvikas hos patienter med medfött långt QT-syndrom och hos patienter med en historia av hjärtarytmier [se KONTRAINDIKATIONER ].
En studie som direkt jämförde den QT/QTc-förlängande effekten av oral ziprasidon med flera andra läkemedel som är effektiva vid behandling av schizofreni utfördes på frivilliga patienter. I den första fasen av försöket erhölls EKG vid tidpunkten för maximal plasmakoncentration när läkemedlet administrerades ensamt. I den andra fasen av försöket erhölls EKG vid tidpunkten för maximal plasmakoncentration medan läkemedlet administrerades samtidigt med en hämmare av CYP4503A4-metabolismen av läkemedlet.
den första fasen av studien beräknades medelförändringen i QTc från baslinjen för varje läkemedel, med hjälp av en provbaserad korrigering som tar bort effekten av hjärtfrekvensen på QT-intervallet. Den genomsnittliga ökningen av QTc från baslinjen för ziprasidon varierade från cirka 9 till 14 msek högre än för fyra av jämförelseläkemedlen (risperidon, olanzapin, quetiapin och haloperidol), men var cirka 14 msek mindre än förlängningen som observerades för tioridazin.
I den andra fasen av studien förstärktes inte effekten av ziprasidon på QTc-längden av närvaron av en metabol hämmare (ketokonazol 200 mg två gånger dagligen).
placebokontrollerade studier ökade oralt ziprasidon QTc-intervallet jämfört med placebo med cirka 10 msek vid den högsta rekommenderade dagliga dosen på 160 mg. I kliniska prövningar med oral ziprasidon avslöjade elektrokardiogrammen från 2/2988 (0,06 %) patienter som fick GEODON 80 mg och 1/440 (0,23 %) patienter som fick placebo QTc-intervall som översteg den potentiellt kliniskt relevanta tröskeln på 500 msek. Hos de ziprasidonbehandlade patienterna antydde inget av fallen en roll för ziprasidon. En patient hade en historia av förlängd QTc och en screeningmätning på 489 msek; QTc var 503 msek under ziprasidonbehandling. Den andra patienten hade ett QTc på 391 msek i slutet av behandlingen med ziprasidon och vid byte till tioridazin upplevde QTc-mätningar på 518 och 593 msek.
Vissa läkemedel som förlänger QT/QTc-intervallet har associerats med uppkomsten av torsade de pointes och med plötslig oförklarlig död. Förhållandet mellan QT-förlängning och torsade de pointes är tydligast för större ökningar (20 msek och mer), men det är möjligt att mindre QT/QTc-förlängningar också kan öka risken, eller öka den hos känsliga individer. Även om torsade de pointes inte har observerats i samband med användningen av ziprasidon i premarketingstudier och erfarenheten är för begränsad för att utesluta en ökad risk, har det förekommit sällsynta rapporter efter marknadsföring (i närvaro av flera störande faktorer) [se NEGATIVA REAKTIONER ].
En studie som utvärderade den QT/QTc-förlängande effekten av intramuskulär ziprasidon, med intramuskulärt haloperidol som kontroll, utfördes på frivilliga patienter. I studien erhölls EKG vid tidpunkten för maximal plasmakoncentration efter två injektioner av ziprasidon (20 mg och sedan 30 mg) eller haloperidol (7,5 mg och sedan 10 mg) med fyra timmars mellanrum. Observera att en 30 mg dos av intramuskulär ziprasidon är 50 % högre än den rekommenderade terapeutiska dosen. Den genomsnittliga förändringen i QTc från baslinjen beräknades för varje läkemedel med hjälp av en provbaserad korrigering som tar bort effekten av hjärtfrekvens på QT-intervallet. Den genomsnittliga ökningen av QTc från baslinjen för ziprasidon var 4,6 msek efter den första injektionen och 12,8 msek efter den andra injektionen. Den genomsnittliga ökningen av QTc från baslinjen för haloperidol var 6,0 msek efter den första injektionen och 14,7 msek efter den andra injektionen. I denna studie hade inga patienter ett QTc-intervall som översteg 500 msek.
Liksom med andra antipsykotiska läkemedel och placebo har plötsliga oförklarade dödsfall rapporterats hos patienter som tar ziprasidon i rekommenderade doser. Erfarenheterna från förmarknadsföring av ziprasidon avslöjade ingen förhöjd risk för dödlighet för ziprasidon jämfört med andra antipsykotiska läkemedel eller placebo, men exponeringsgraden var begränsad, särskilt för de läkemedel som används som aktiva kontroller och placebo. Ziprasidons större förlängning av QTc-längden jämfört med flera andra antipsykotiska läkemedel höjer dock möjligheten att risken för plötslig död kan vara större för ziprasidon än för andra tillgängliga läkemedel för behandling av schizofreni. Denna möjlighet måste beaktas vid beslut mellan alternativa läkemedelsprodukter [se INDIKATIONER ].
Vissa omständigheter kan öka risken för uppkomsten av torsade de pointes och/eller plötslig död i samband med användning av läkemedel som förlänger QTc-intervallet, inklusive (1) bradykardi; (2) hypokalemi eller hypomagnesemi; (3) samtidig användning av andra läkemedel som förlänger QTc-intervallet; och (4) förekomst av medfödd förlängning av QT-intervallet.
Det rekommenderas att patienter som övervägs för ziprasidonbehandling och som löper risk för betydande elektrolytrubbningar, särskilt hypokalemi, har baseline-mätningar av kalium och magnesium i serum. Hypokalemi (och/eller hypomagnesemi) kan öka risken för QT-förlängning och arytmi. Hypokalemi kan bero på diuretikabehandling, diarré och andra orsaker. Patienter med lågt serumkalium och/eller magnesium bör fyllas på med dessa elektrolyter innan behandlingen fortsätter. Det är viktigt att regelbundet övervaka serumelektrolyter hos patienter för vilka diuretikabehandling introduceras under ziprasidonbehandling. Ihållande förlängda QTc-intervall kan också öka risken för ytterligare förlängning och arytmi, men det är inte klart att rutinmässiga screening-EKG-åtgärder är effektiva för att upptäcka sådana patienter. Snarare bör ziprasidon undvikas hos patienter med anamnes på betydande kardiovaskulär sjukdom, t.ex. QT-förlängning, nyligen genomförd akut hjärtinfarkt, okompenserad hjärtsvikt eller hjärtarytmi. Ziprasidon ska avbrytas hos patienter som visar sig ha ihållande QTc-mätningar >500 msek.
För patienter som tar ziprasidon och som upplever symtom som kan indikera förekomsten av torsade de pointes, t.ex. yrsel, hjärtklappning eller synkope, bör förskrivaren initiera ytterligare utvärdering, t.ex. Holter-övervakning kan vara användbar.
Malignt neuroleptikasyndrom (NMS)
Ett potentiellt dödligt symtomkomplex som ibland kallas malignt neuroleptikasyndrom (NMS) har rapporterats i samband med administrering av antipsykotiska läkemedel. Kliniska manifestationer av NMS är hyperpyrexi, muskelstelhet, förändrad mental status och tecken på autonom instabilitet (oregelbunden puls eller blodtryck, takykardi, diafores och hjärtrytmrubbningar). Ytterligare tecken kan vara förhöjt kreatininfosfokinas, myoglobinuri (rabdomyolys) och akut njursvikt.
Den diagnostiska utvärderingen av patienter med detta syndrom är komplicerad. För att komma fram till en diagnos är det viktigt att utesluta fall där den kliniska presentationen inkluderar både allvarlig medicinsk sjukdom (t.ex. lunginflammation, systemisk infektion etc.) och obehandlade eller otillräckligt behandlade extrapyramidala tecken och symtom (EPS). Andra viktiga överväganden i differentialdiagnosen inkluderar central antikolinerg toxicitet, värmeslag, läkemedelsfeber och primär patologi i centrala nervsystemet (CNS).
Hanteringen av NMS bör innefatta: (1) omedelbart utsättande av antipsykotiska läkemedel och andra läkemedel som inte är nödvändiga för samtidig behandling; (2) intensiv symtomatisk behandling och medicinsk övervakning; och (3) behandling av eventuella samtidiga allvarliga medicinska problem för vilka specifika behandlingar finns tillgängliga. Det finns ingen allmän enighet om specifika farmakologiska behandlingsregimer för NMS.
Om en patient behöver antipsykotisk läkemedelsbehandling efter återhämtning från NMS, bör det potentiella återinförandet av läkemedelsbehandling noggrant övervägas. Patienten bör övervakas noggrant, eftersom återfall av NMS har rapporterats.
Allvarliga kutana biverkningar
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) har rapporterats vid exponering för Ziprasidon. DRESS består av en kombination av tre eller flera av följande: kutan reaktion (såsom hudutslag eller exfoliativ dermatit), eosinofili, feber, lymfadenopati och en eller flera systemiska komplikationer såsom hepatit, nefrit, pneumonit, myokardit och perikardit. KLÄNNING är ibland ödesdigert. Sluta använda ziprasidon om du misstänker DRESS.
Andra allvarliga kutana biverkningar
Andra allvarliga kutana biverkningar, såsom Stevens-Johnsons syndrom, har rapporterats vid exponering för ziprasidon. Allvarliga kutana biverkningar är ibland dödliga. Avbryt ziprasidon om allvarliga kutana biverkningar misstänks.
Tardiv dyskinesi
Ett syndrom av potentiellt irreversibla, ofrivilliga, dyskinetiska rörelser kan utvecklas hos patienter som genomgår behandling med antipsykotiska läkemedel. Även om prevalensen av syndromet verkar vara högst bland äldre, särskilt äldre kvinnor, är det omöjligt att förlita sig på prevalensuppskattningar för att förutsäga, vid inledningen av antipsykotisk behandling, vilka patienter som sannolikt kommer att utveckla syndromet. Huruvida antipsykotiska läkemedel skiljer sig i deras potential att orsaka tardiv dyskinesi är okänt.
Risken för att utveckla tardiv dyskinesi och sannolikheten att den blir irreversibel tros öka när behandlingstiden och den totala kumulativa dosen av antipsykotiska läkemedel som ges till patienten ökar. Syndromet kan dock utvecklas, även om det är mycket mindre vanligt, efter relativt korta behandlingsperioder vid låga doser.
Det finns ingen känd behandling för etablerade fall av tardiv dyskinesi, även om syndromet kan försvinna, delvis eller helt, om antipsykotisk behandling avbryts. Antipsykotisk behandling i sig kan dock undertrycka (eller delvis undertrycka) tecknen och symtomen på syndromet och kan därigenom eventuellt maskera den underliggande processen. Effekten som symtomatisk suppression har på det långvariga förloppet av syndromet är okänd.
Mot bakgrund av dessa överväganden bör ziprasidon förskrivas på ett sätt som med största sannolikhet minimerar förekomsten av tardiv dyskinesi. Kronisk antipsykotisk behandling bör i allmänhet reserveras för patienter som lider av en kronisk sjukdom som (1) är känd för att svara på antipsykotiska läkemedel, och (2) för vilka alternativa, lika effektiva, men potentiellt mindre skadliga behandlingar inte är tillgängliga eller lämpliga. Hos patienter som behöver kronisk behandling bör den minsta dosen och den kortaste behandlingstiden som ger ett tillfredsställande kliniskt svar eftersträvas. Behovet av fortsatt behandling bör omprövas med jämna mellanrum.
Om tecken och symtom på tardiv dyskinesi uppträder hos en patient som behandlas med ziprasidon, bör utsättning av läkemedel övervägas. Vissa patienter kan dock behöva behandling med ziprasidon trots förekomsten av syndromet.
Metaboliska förändringar
Atypiska antipsykotiska läkemedel har associerats med metabola förändringar som kan öka kardiovaskulär/cerebrovaskulär risk. Dessa metaboliska förändringar inkluderar hyperglykemi, dyslipidemi och kroppsviktsökning. Medan alla läkemedel i klassen har visat sig ge vissa metaboliska förändringar, har varje läkemedel sin egen specifika riskprofil.
Hyperglykemi och diabetes mellitus
Hyperglykemi och diabetes mellitus, i vissa fall extrema och förknippade med ketoacidos eller hyperosmolär koma eller död, har rapporterats hos patienter som behandlats med atypiska antipsykotika. Det har förekommit få rapporter om hyperglykemi eller diabetes hos patienter som behandlats med GEODON. Även om färre patienter har behandlats med GEODON, är det inte känt om denna mer begränsade erfarenhet är den enda anledningen till att sådana rapporter är få. Bedömning av sambandet mellan atypisk antipsykotisk användning och glukosavvikelser kompliceras av möjligheten av en ökad bakgrundsrisk för diabetes mellitus hos patienter med schizofreni och den ökande incidensen av diabetes mellitus i den allmänna befolkningen. Med tanke på dessa konfounders är förhållandet mellan atypisk antipsykotisk användning och hyperglykemirelaterade biverkningar inte helt klarlagt. Exakta riskuppskattningar för hyperglykemirelaterade biverkningar hos patienter som behandlas med atypiska antipsykotika finns inte tillgängliga.
Patienter med en fastställd diagnos av diabetes mellitus som påbörjas med atypiska antipsykotika bör övervakas regelbundet för försämrad glukoskontroll. Patienter med riskfaktorer för diabetes mellitus (t.ex. fetma, familjehistoria av diabetes) som påbörjar behandling med atypiska antipsykotika bör genomgå fastande blodsockertest i början av behandlingen och regelbundet under behandlingen. Alla patienter som behandlas med atypiska antipsykotika bör övervakas för symtom på hyperglykemi inklusive polydipsi, polyuri, polyfagi och svaghet. Patienter som utvecklar symtom på hyperglykemi under behandling med atypiska antipsykotika bör genomgå fasteblodsockertest. I vissa fall har hyperglykemi försvunnit när det atypiska antipsykotiska medlet avbröts; vissa patienter krävde dock fortsatt antidiabetisk behandling trots att det misstänkta läkemedlet avbröts.
Sammanslagna data från korttidsstudier med placebokontrollerad schizofreni och bipolär sjukdom presenteras i tabellerna 1-4. Observera att för de flexibla dosstudierna vid både schizofreni och bipolär sjukdom, kategoriseras varje individ som att ha fått antingen låg (20-40 mg BID) eller hög (60-80 mg BID) dos baserat på patientens modala dagliga dos. I tabellerna som visar kategoriska förändringar är procenttalen (kolumnen %) beräknade som 100x(n/N).

I långtidsstudier (minst 1 år), placebokontrollerade, flexibla dosstudier vid schizofreni, var den genomsnittliga förändringen från baslinjen i slumpmässig glukos för ziprasidon 20-40 mg två gånger dagligen -3,4 mg/dL (N=122); för ziprasidon var 60-80 mg två gånger dagligen +1,3 mg/dL (N=10); och för placebo var +0,3 mg/dL (N=71).
Dyslipidemi
Oönskade förändringar i lipider har observerats hos patienter som behandlats med atypiska antipsykotika. Sammanslagna data från korttidsstudier med placebokontrollerad schizofreni och bipolär sjukdom presenteras i tabellerna 5-8.
långtidsstudier (minst 1 år), placebokontrollerade, flexibla dosstudier vid schizofreni, var den genomsnittliga förändringen från baslinjen i slumpmässiga triglycerider för ziprasidon 20-40 mg två gånger dagligen +26,3 mg/dL (N=15); för ziprasidon var 60-80 mg två gånger dagligen -39,3 mg/dL (N=10); och för placebo var +12,9 mg/dL (N=9). I långtidsstudier (minst 1 år), placebokontrollerade, flexibla dosstudier vid schizofreni var den genomsnittliga förändringen från baslinjen i slumpmässigt totalt kolesterol för ziprasidon 20-40 mg två gånger dagligen +2,5 mg/dL (N=14); för ziprasidon var 60-80 mg BID -19,7 mg/dL (N=10); och för placebo var -28,0 mg/dL (N=9).
Viktökning
Viktökning har observerats vid atypisk antipsykotisk användning. Övervakning av vikt rekommenderas. Sammanslagna data från korttids, placebokontrollerade studier av schizofreni och bipolär sjukdom presenteras i tabellerna 9-10.
långtidsstudier (minst 1 år), placebokontrollerade, flexibla dosstudier vid schizofreni, var den genomsnittliga förändringen från baslinjevikten för ziprasidon 20-40 mg två gånger dagligen -2,3 kg (N=124); för ziprasidon var 60-80 mg två gånger dagligen +2,5 kg (N=10); och för placebo var -2,9 kg (N=72). I samma långtidsstudier var andelen försökspersoner med ≥ 7 % viktökning från baslinjen för ziprasidon 20-40 mg två gånger dagligen 5,6 % (N=124); för ziprasidon var 60-80 mg två gånger dagligen 20,0 % (N=10) och för placebo 5,6 % (N=72). I en långtidsstudie (minst 1 år), placebokontrollerad, fast dosstudie av schizofreni, var den genomsnittliga förändringen från baslinjevikten för ziprasidon 20 mg två gånger dagligen -2,6 kg (N=72); för ziprasidon var 40 mg två gånger dagligen -3,3 kg (N=69); för ziprasidon var 80 mg två gånger dagligen -2,8 kg (N=70) och för placebo var -3,8 kg (N=70). I samma långtidsstudie med fast dos av schizofreni var andelen försökspersoner med ≥ 7 % viktökning från baslinjen för ziprasidon 20 mg två gånger dagligen 5,6 % (N=72); för ziprasidon var 40 mg två gånger dagligen 2,9 % (N=69); för ziprasidon var 80 mg två gånger dagligen 5,7 % (N=70) och för placebo var 2,9 % (N=70).
Schizofreni
Andelen patienter som uppfyller ett viktökningskriterium på ≥ 7 % av kroppsvikten jämfördes i en pool av fyra 4- och 6-veckors placebokontrollerade kliniska schizofrenistudier, vilket avslöjade en statistiskt signifikant högre incidens av viktökning för ziprasidon (10 % ) jämfört med placebo (4%). En medianviktsökning på 0,5 kg observerades hos ziprasidonpatienter jämfört med ingen medianviktsförändring hos placebopatienter. I denna uppsättning kliniska prövningar rapporterades viktökning som en biverkning hos 0,4 % respektive 0,4 % av ziprasidon- respektive placebopatienter. Under långtidsbehandling med ziprasidon visade en kategorisering av patienter vid baslinjen på basis av kroppsmassaindex (BMI) den största genomsnittliga viktökningen och den högsta förekomsten av kliniskt signifikant viktökning (> 7 % av kroppsvikten) hos patienter med låg BMI (27). Det var en genomsnittlig viktökning på 1,4 kg för de patienter med ett "lågt" BMI vid baslinjen, ingen genomsnittlig förändring för patienter med ett "normalt" BMI och en genomsnittlig viktminskning på 1,3 kg för patienter som gick in i programmet med ett "högt" BMI.
Bipolär sjukdom
Under en 6-månaders placebokontrollerad bipolär underhållsstudie på vuxna med ziprasidon som tillägg till litium eller valproat, var incidensen av kliniskt signifikant viktökning (≥ 7 % av kroppsvikten) under den dubbelblinda perioden 5,6 % för både ziprasidon och placebobehandlingsgrupper som fullföljde de 6 månadernas observation för återfall. Tolkning av dessa fynd bör ta hänsyn till att endast patienter som adekvat tolererade ziprasidon gick in i den dubbelblinda fasen av studien och att det förekom betydande bortfall under den öppna fasen.
Utslag
premarketingstudier med ziprasidon utvecklade cirka 5 % av patienterna hudutslag och/eller urtikaria, med avbrytande av behandlingen i cirka en sjättedel av dessa fall. Förekomsten av utslag var relaterad till dosen av ziprasidon, även om fyndet också kan förklaras av den längre exponeringstiden hos patienter med högre dos. Flera patienter med utslag hade tecken och symtom på associerad systemisk sjukdom, t.ex. förhöjda WBC. De flesta patienter förbättrades omedelbart med tilläggsbehandling med antihistaminer eller steroider och/eller efter utsättning av ziprasidon, och alla patienter som upplevde dessa reaktioner rapporterades vara helt återställda. Vid uppkomst av utslag för vilka en alternativ etiologi inte kan identifieras, ska ziprasidon sättas ut.
Ortostatisk hypotension
Ziprasidon kan inducera ortostatisk hypotoni associerad med yrsel, takykardi och, hos vissa patienter, synkope, särskilt under den initiala dostitreringsperioden, vilket troligen återspeglar dess α1-adrenerga antagonistegenskaper. Synkope rapporterades hos 0,6 % av patienterna som behandlades med ziprasidon.
Ziprasidon ska användas med särskild försiktighet till patienter med känd hjärt-kärlsjukdom (historia av hjärtinfarkt eller ischemisk hjärtsjukdom, hjärtsvikt eller överledningsstörningar), cerebrovaskulär sjukdom eller tillstånd som skulle kunna predisponera patienter för hypotoni (dehydrering, hypovolemi och behandling med antihypertensiva läkemedel). mediciner).
Falls
Antipsykotiska läkemedel (som inkluderar GEODON) kan orsaka somnolens, postural hypotoni och motorisk och sensorisk instabilitet, vilket kan leda till fall och följaktligen frakturer eller andra skador. För patienter med sjukdomar, tillstånd eller mediciner som kan förvärra dessa effekter, slutföra fallriskbedömningar vid inledande av antipsykotisk behandling och återkommande för patienter på långvarig antipsykotisk behandling.
Leukopeni, Neutropeni och Agranulocytos
I kliniska prövningar och erfarenheter efter marknadsföring har händelser av leukopeni/neutropeni rapporterats tidsmässigt relaterade till antipsykotiska medel. Agranulocytos (inklusive dödsfall) har också rapporterats.
Möjliga riskfaktorer för leukopeni/neutropeni inkluderar redan existerande lågt antal vita blodkroppar (WBC) och historia av läkemedelsinducerad leukopeni/neutropeni. Patienter med redan existerande lågt WBC eller en historia av läkemedelsinducerad leukopeni/neutropeni bör få sitt fullständiga blodvärde (CBC) övervakat ofta under de första månaderna av behandlingen och bör avbryta GEODON vid första tecken på minskning av WBC i frånvaro andra orsaksfaktorer.
Patienter med neutropeni bör övervakas noggrant med avseende på feber eller andra symtom eller tecken på infektion och behandlas omedelbart om sådana symtom eller tecken uppstår. Patienter med svår neutropeni (absolut neutrofilantal
Anfall
Under kliniska prövningar inträffade anfall hos 0,4 % av patienterna som behandlades med ziprasidon. Det fanns förvirrande faktorer som kan ha bidragit till förekomsten av anfall i många av dessa fall. Som med andra antipsykotiska läkemedel bör ziprasidon användas med försiktighet till patienter med anamnes på anfall eller med tillstånd som potentiellt sänker anfallströskeln, t.ex. Alzheimers demens. Tillstånd som sänker anfallströskeln kan vara vanligare i en befolkning på 65 år eller äldre.
Dysfagi
Esofageal dysmotilitet och aspiration har associerats med användning av antipsykotiska läkemedel. Aspirationspneumoni är en vanlig orsak till sjuklighet och dödlighet hos äldre patienter, särskilt de med avancerad Alzheimers demens. Ziprasidon och andra antipsykotiska läkemedel ska användas med försiktighet hos patienter med risk för aspirationspneumoni [se LÅDA VARNING ].
Hyperprolaktinemi
Som med andra läkemedel som motverkar dopamin D2-receptorer, höjer ziprasidon prolaktinnivåerna hos människor. Ökade prolaktinnivåer observerades också i djurstudier med denna förening och var associerade med en ökning av bröstkörtelneoplasi hos möss; en liknande effekt observerades inte hos råttor [se Icke-klinisk toxikologi ]. Vävnadsodlingsexperiment indikerar att ungefär en tredjedel av humana bröstcancer är prolaktinberoende in vitro, en faktor av potentiell betydelse om förskrivning av dessa läkemedel övervägs hos en patient med tidigare upptäckt bröstcancer. Varken kliniska studier eller epidemiologiska studier genomförda hittills har visat ett samband mellan kronisk administrering av denna klass av läkemedel och tumörbildning hos människor; den tillgängliga bevisningen anses vara för begränsad för att vara avgörande vid denna tidpunkt.
Även om störningar som galaktorré, amenorré, gynekomasti och impotens har rapporterats med prolaktinhöjande substanser, är den kliniska betydelsen av förhöjda serumprolaktinnivåer okänd för de flesta patienter. Långvarig hyperprolaktinemi i samband med hypogonadism kan leda till minskad bentäthet.
Potential för kognitiv och motorisk funktionsnedsättning
Somnolens var en vanlig rapporterad biverkning hos patienter som behandlades med ziprasidon. I de 4- och 6-veckors placebokontrollerade studierna rapporterades somnolens hos 14 % av patienterna som fick ziprasidon jämfört med 7 % av placebopatienterna. Somnolens ledde till utsättning av behandlingen hos 0,3 % av patienterna i korttids kliniska prövningar. Eftersom ziprasidon har potential att försämra omdöme, tänkande eller motorik, bör patienter varnas för att utföra aktiviteter som kräver mental vakenhet, såsom att köra ett motorfordon (inklusive bilar) eller använda farliga maskiner tills de är rimligen säkra på att ziprasidonbehandling inte fungerar påverka dem negativt.
Priapism
Ett fall av priapism rapporterades i premarketingdatabasen. Även om sambandet mellan reaktionen och användning av ziprasidon inte har fastställts, har andra läkemedel med alfa-adrenerga blockerande effekter rapporterats inducera priapism, och det är möjligt att ziprasidon delar denna kapacitet. Allvarlig priapism kan kräva kirurgiskt ingrepp.
Reglering av kroppstemperatur
Även om det inte rapporterats med ziprasidon i premarketingstudier, har störningar i kroppens förmåga att sänka kroppstemperaturen tillskrivits antipsykotiska medel. Lämplig vård rekommenderas vid förskrivning av ziprasidon till patienter som kommer att uppleva tillstånd som kan bidra till en höjning av kroppstemperaturen, t.ex. ansträngande träning, exponering för extrem värme, samtidig medicinering med antikolinerg aktivitet eller uttorkning.
Självmord
Möjligheten till ett självmordsförsök är inneboende i psykotisk sjukdom eller bipolär sjukdom, och noggrann övervakning av högriskpatienter bör åtfölja läkemedelsbehandling. Recept för ziprasidon bör skrivas ut för den minsta mängd kapslar som överensstämmer med god patienthantering för att minska risken för överdosering.
Patienter med samtidiga sjukdomar
Klinisk erfarenhet av ziprasidon hos patienter med vissa samtidiga systemiska sjukdomar är begränsad [se Användning i specifika populationer ].
Ziprasidon har inte utvärderats eller använts i någon nämnvärd omfattning hos patienter med en nyligen anamnes på hjärtinfarkt eller instabil hjärtsjukdom. Patienter med dessa diagnoser uteslöts från kliniska studier före marknadsföring. På grund av risken för QTc-förlängning och ortostatisk hypotoni med ziprasidon, bör försiktighet iakttas hos hjärtpatienter. [ser QT-förlängning och risk för plötslig död, ortostatisk hypotoni ].
Laboratorietester
Patienter som övervägs för ziprasidonbehandling och som löper risk för betydande elektrolytrubbningar bör ha baseline-mätningar av kalium och magnesium i serum. Lågt serumkalium och magnesium bör ersättas innan behandlingen påbörjas. Patienter som påbörjas med diuretika under behandling med Ziprasidon behöver periodisk övervakning av serumkalium och magnesium. Ziprasidon bör avbrytas hos patienter som visar sig ha ihållande QTc-mätningar >500 msek [se QT-förlängning och risk för plötslig död ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION ).
Administrationsinformation för kapslar
Råda patienter att ta GEODON kapslar hela. Öppna, krossa eller tugga inte kapslarna. Instruera patienterna att ta GEODON kapslar med mat för optimal absorption. Absorptionen av ziprasidon ökar upp till två gånger i närvaro av mat [se DOSERING OCH ADMINISTRERING , LÄKEMEDELSINTERAKTIONER , och KLINISK FARMAKOLOGI ].
QTc-förlängning
Rekommendera patienter att informera sina vårdgivare om följande: Historik om QT-förlängning; nyligen akut hjärtinfarkt; okompenserad hjärtsvikt; förskrivning av andra läkemedel som har visat QT-förlängning; risk för betydande elektrolytavvikelser; och historia av hjärtarytmi [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Instruera patienterna att rapportera uppkomsten av tillstånd som utsätter dem för risk för betydande elektrolytrubbningar, särskilt hypokalemi, inklusive men inte begränsat till initiering av diuretikabehandling eller långvarig diarré. Instruera dessutom patienterna att rapportera symtom som yrsel, hjärtklappning eller synkope till förskrivaren [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Allvarliga kutana biverkningar
Instruera patienterna att så snart som möjligt rapportera till sin vårdgivare alla tecken eller symtom som kan vara associerade med läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) eller med allvarliga kutana biverkningar, såsom Stevens-Johnsons syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Graviditet
Rekommendera gravida kvinnor att meddela sin vårdgivare om de blir gravida eller tänker bli gravida under behandling med GEODON. Informera patienter om att GEODON kan orsaka extrapyramidala symtom och/eller abstinenssymtom (agitation, hypertoni, hypotoni, tremor, somnolens, andnöd och ätstörningar) hos en nyfödd. Informera patienter om att det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för GEODON under graviditeten [se Användning i specifika populationer ].
Laktation
Rekommendera ammande kvinnor som använder GEODON 20mg för att övervaka spädbarn med avseende på överdriven sedering, irritabilitet, dålig matning och extrapyramidala symtom (skakningar och onormala muskelrörelser) och att söka läkarvård om de märker dessa tecken [se Användning i specifika populationer ].
Infertilitet
Informera kvinnor med reproduktionspotential att GEODON 80 mg kan försämra fertiliteten på grund av en ökning av serumprolaktinnivåerna. Effekterna på fertiliteten är reversibla [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Livstidsstudier av karcinogenicitet utfördes med ziprasidon på Long Evans-råttor och CD-1-möss. Ziprasidon administrerades under 24 månader i kosten i doser på 2, 6 eller 12 mg/kg/dag till råttor och 50, 100 eller 200 mg/kg/dag till möss (0,1 till 0,6 och 1 till 5 gånger maximal rekommenderad humandos (MRHD) på 200 mg/dag baserat på mg/m2 kroppsyta respektive). I råttstudien fanns det inga tecken på en ökad förekomst av tumörer jämfört med kontroller. Hos hanmöss fanns ingen ökning av förekomsten av tumörer i förhållande till kontroller. Hos honmöss fanns dosrelaterade ökningar av förekomsten av hypofysadenom och karcinom och bröstkörteladenokarcinom vid alla testade doser (50 till 200 mg/kg/dag eller 1 till 5 gånger MRHD baserat på mg/m2 kropp ytarea). Proliferativa förändringar i hypofysen och bröstkörtlarna hos gnagare har observerats efter kronisk administrering av andra antipsykotiska medel och anses vara prolaktinmedierade. Ökning av serumprolaktin observerades i en 1-månads dietstudie på möss av honkön, men inte hanar, med 100 och 200 mg/kg/dag (eller 2,5 och 5 gånger MRHD baserat på mg/m2 kroppsyta). Ziprasidon hade ingen effekt på serumprolaktin hos råttor i en 5-veckors koststudie vid de doser som användes i karcinogenicitetsstudien. Relevansen för human risk av fynden av prolaktinmedierade endokrina tumörer hos gnagare är okänd [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Mutagenes
Ziprasidon testades i Ames bakteriell mutationsanalysen, in vitro analysen av genmutation av muslymfom för däggdjursceller, analysen in vitro av kromosomavvikelser i humana lymfocyter och in vivo analysen av kromosomavvikelser i benmärg hos mus. Det fanns ett reproducerbart mutagent svar i Ames-analysen i en stam av S. typhimurium i frånvaro av metabolisk aktivering. Positiva resultat erhölls i både in vitro analys av däggdjurscellsgenmutation och in vitro kromosomavvikelseanalys i humana lymfocyter.
Nedsättning av fertilitet
Ziprasidon har visat sig öka tiden till kopulation hos Sprague-Dawley-råttor i två fertilitetsstudier och tidig embryonal utvecklingsstudier vid doser på 10 till 160 mg/kg/dag (0,5 till 8 gånger MRHD på 200 mg/dag baserat på mg/m2 kropp ytarea). Fertiliteten minskade med 160 mg/kg/dag (8 gånger MRHD baserat på mg/m2 kroppsyta). Det fanns ingen effekt på fertiliteten vid 40 mg/kg/dag (2 gånger MRHD baserat på mg/m2 kroppsyta). Effekten på fertiliteten verkade vara hos honan eftersom fertiliteten inte försämrades när män som fick 160 mg/kg/dag (8 gånger MRHD baserat på mg/m2 kroppsyta) parades med obehandlade honor.
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för atypiska antipsykotika, inklusive GEODON 40 mg, under graviditeten. Sjukvårdsleverantörer uppmuntras att registrera patienter genom att kontakta National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller online på http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Risksammanfattning
Nyfödda som exponerats för antipsykotiska läkemedel, inklusive GEODON, under tredje trimestern löper risk för extrapyramidala och/eller abstinenssymtom efter förlossningen (se Kliniska överväganden ). Övergripande tillgängliga data från publicerade epidemiologiska studier av gravida kvinnor som exponerats för ziprasidon har inte fastställt en läkemedelsrelaterad risk för allvarliga fosterskador, missfall eller ogynnsamma resultat hos modern eller foster (se Data ). Det finns risker för modern i samband med obehandlad schizofreni eller bipolär störning I och med exponering för antipsykotika, inklusive GEODON, under graviditet (se Kliniska överväganden ).
djurstudier orsakade administrering av ziprasidon till dräktiga råttor och kaniner under organogenes utvecklingstoxicitet vid doser liknande rekommenderade humandoser och var teratogent hos kaniner vid 3 gånger den maximala rekommenderade humana dosen (MRHD). Råttor som exponerats för ziprasidon under dräktighet och laktation uppvisade ökad perinatal ungadödlighet och försenad neurobeteendemässig och funktionell utveckling hos avkomman vid doser lägre än eller liknande terapeutiska doser hos människor (se Data ).
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för de angivna populationerna är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 till 4 % respektive 15 till 20 %.
Kliniska överväganden
Sjukdomsrelaterad risk för modern och/eller embryo/foster
Det finns risk för modern från obehandlad schizofreni eller bipolär störning I, inklusive ökad risk för återfall, sjukhusvistelse och självmord. Schizofreni och bipolär störning I är förknippade med ökade negativa perinatala utfall, inklusive för tidig födsel. Det är inte känt om detta är ett direkt resultat av sjukdomen eller andra komorbida faktorer.
Fetala/neonatala biverkningar
Extrapyramidala och/eller abstinenssymtom, inklusive agitation, hypertoni, hypotoni, tremor, somnolens, andningsbesvär och ätstörningar har rapporterats hos nyfödda som exponerats för antipsykotiska läkemedel, inklusive GEODON, under graviditetens tredje trimester. Dessa symtom har varierat i svårighetsgrad. Övervaka nyfödda för extrapyramidala och/eller abstinenssymtom och hantera symtomen på lämpligt sätt. Vissa nyfödda återhämtade sig inom timmar eller dagar utan specifik behandling; andra krävde långvarig sjukhusvistelse.
Data
Mänskliga data
Publicerade data från observationsstudier, födelseregister och fallrapporter om användning av atypiska antipsykotika under graviditeten visar inte ett tydligt samband med antipsykotika och större fosterskador. En retrospektiv kohortstudie från en Medicaid-databas med 9258 kvinnor som exponerats för antipsykotika under graviditeten indikerade inte en övergripande ökad risk för allvarliga fosterskador.
Djurdata
När ziprasidon administrerades till dräktiga kaniner under organogenesperioden observerades en ökad förekomst av fostrets strukturella abnormiteter (ventrikulära septumdefekter och andra kardiovaskulära missbildningar och njurförändringar) vid en dos av 30 mg/kg/dag (3 gånger MRHD) på 200 mg/dag baserat på mg/m2 kroppsyta). Det fanns inga bevis som tydde på att dessa utvecklingseffekter var sekundära till maternell toxicitet. Utvecklingsdosen utan effekt var 10 mg/kg/dag (motsvarande MRHD baserat på en mg/m2 kroppsyta). Hos råttor observerades embryofetal toxicitet (minskad fostervikt, försenad benbildning av skelettet) efter administrering av 10 till 160 mg/kg/dag (0,5 till 8 gånger MRHD baserat på mg/m2 kroppsyta) under organogenesen eller under hela graviditeten, men det fanns inga tecken på teratogenicitet. Doser på 40 och 160 mg/kg/dag (2 och 8 gånger MRHD baserat på mg/m2 kroppsyta) var associerade med maternell toxicitet. Utvecklingsdosen utan effekt är 5 mg/kg/dag (0,2 gånger MRHD baserat på mg/m2 kroppsyta).
Det var en ökning av antalet ungar födda döda och en minskning av postnatal överlevnad under de första 4 dagarna av laktationen bland avkommor till honråttor som behandlades under dräktighet och laktation med doser på 10 mg/kg/dag (0,5 gånger MRHD-baserade på mg/m2 kroppsyta) eller mer. Avkommans utvecklingsförseningar (minskad valpvikt) och funktionsnedsättning i neurobeteende (ögonöppningsluft) observerades vid doser på 5 mg/kg/dag (0,2 gånger MRHD baserat på mg/m2 kroppsyta) eller mer. Ingen effektnivå fastställdes för dessa effekter.
Laktation
Risksammanfattning
Begränsade data från en publicerad fallrapport indikerar förekomst av ziprasidon i bröstmjölk. Även om det inte finns några rapporter om negativa effekter på ett ammat spädbarn som exponerats för ziprasidon via bröstmjölk, finns det rapporter om överdriven sedering, irritabilitet, dålig matning och extrapyramidala symtom (skakningar och onormala muskelrörelser) hos spädbarn som exponerats för andra atypiska antipsykotika genom bröstet. mjölk (se Kliniska överväganden ). Det finns ingen information om effekterna av ziprasidon på mjölkproduktionen. Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av GEODON och eventuella negativa effekter på det ammade barnet från GEODON 20 mg eller från moderns underliggande tillstånd.
Kliniska överväganden
Spädbarn som exponeras för GEODON bör övervakas för överdriven sedering, irritabilitet, dålig matning och extrapyramidala symtom (skakningar och onormala muskelrörelser).
Kvinnor Och Hanar Av Reproduktionspotential
Infertilitet
Kvinnor
Baserat på den farmakologiska effekten av ziprasidon (D2-antagonism) kan behandling med GEODON 40 mg resultera i en ökning av serumprolaktinnivåerna, vilket kan leda till en reversibel minskning av fertiliteten hos kvinnor med reproduktionspotential [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Icke-klinisk toxikologi ].
Pediatrisk användning
Säkerheten och effektiviteten av ziprasidon hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Av det totala antalet försökspersoner i kliniska studier av ziprasidon var 2,4 procent 65 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre försökspersoner, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas. Icke desto mindre bör förekomsten av flera faktorer som kan öka det farmakodynamiska svaret på ziprasidon, eller orsaka sämre tolerans eller ortostas, leda till övervägande av en lägre startdos, långsammare titrering och noggrann övervakning under den initiala doseringsperioden för vissa äldre patienter.
Ziprasidon intramuskulärt har inte utvärderats systematiskt hos äldre patienter (65 år och äldre).
Nedsatt njurfunktion
Eftersom ziprasidon är höggradigt metaboliserat, med mindre än 1 % av läkemedlet utsöndrat oförändrat, är det osannolikt att enbart nedsatt njurfunktion har någon större inverkan på ziprasidons farmakokinetik. Farmakokinetiken för ziprasidon efter 8 dagar med 20 mg två gånger dagligen var likartad bland försökspersoner med olika grader av nedsatt njurfunktion (n=27) och försökspersoner med normal njurfunktion, vilket indikerar att dosjustering baserat på graden av nedsatt njurfunktion inte krävs . Ziprasidon avlägsnas inte genom hemodialys.
Intramuskulärt ziprasidon har inte utvärderats systematiskt hos äldre patienter eller hos patienter med nedsatt lever- eller njurfunktion. Eftersom hjälpämnet cyklodextrin elimineras genom njurfiltrering, bör ziprasidon intramuskulärt administreras med försiktighet till patienter med nedsatt njurfunktion [se KLINISK FARMAKOLOGI ].
Nedsatt leverfunktion
Eftersom ziprasidon elimineras väsentligt av levern, förväntas närvaron av nedsatt leverfunktion öka AUC för ziprasidon; en multipeldosstudie med 20 mg två gånger dagligen i 5 dagar på försökspersoner (n=13) med kliniskt signifikant (Childs-Pugh klass A och B) cirros visade en ökning av AUC 0-12 på 13 % och 34 % hos Childs- Pugh klass A respektive B jämfört med en matchad kontrollgrupp (n=14). En halveringstid på 7,1 timmar observerades hos personer med cirros jämfört med 4,8 timmar i kontrollgruppen.
Ålder och kön effekter
en flerdosstudie (8 dagars behandling) som involverade 32 försökspersoner fanns ingen skillnad i farmakokinetiken för ziprasidon mellan män och kvinnor eller mellan äldre (>65 år) och unga (18 till 45 år) försökspersoner. Dessutom har populationsfarmakokinetisk utvärdering av patienter i kontrollerade studier inte visat några tecken på kliniskt signifikanta ålders- eller könsrelaterade skillnader i farmakokinetiken för ziprasidon. Dosjusteringar för ålder eller kön rekommenderas därför inte.
Rökning
Baserat på in vitro-studier med humana leverenzymer är ziprasidon inte ett substrat för CYP1A2; rökning bör därför inte ha någon effekt på farmakokinetiken för ziprasidon. I överensstämmelse med dessa in vitro-resultat har populationsfarmakokinetisk utvärdering inte avslöjat några signifikanta farmakokinetiska skillnader mellan rökare och icke-rökare.
ÖVERDOS
Mänsklig erfarenhet
premarketingstudier som involverade fler än 5400 patienter och/eller normala försökspersoner, dokumenterades oavsiktlig eller avsiktlig överdosering av oral ziprasidon hos 10 patienter. Alla dessa patienter överlevde utan följdsjukdomar. Hos patienten som tog den största bekräftade mängden, 3 240 mg, var de enda symptomen som rapporterades minimal sedering, sluddrigt tal och övergående hypertoni (200/95).
Biverkningar som rapporterats vid överdosering av ziprasidon inkluderade extrapyramidala symtom, somnolens, tremor och ångest. [ser NEGATIVA REAKTIONER ]
Hantering av överdosering
Vid akut överdosering, etablera och upprätthåll en luftväg och säkerställ tillräcklig syresättning och ventilation. Intravenös åtkomst bör etableras och magsköljning (efter intubation, om patienten är medvetslös) och administrering av aktivt kol tillsammans med ett laxermedel bör övervägas. Möjligheten för förtrubbning, anfall eller dystonisk reaktion i huvud och hals efter överdosering kan skapa en risk för aspiration med inducerad kräkning.
Kardiovaskulär övervakning bör påbörjas omedelbart och bör innefatta kontinuerlig elektrokardiografisk övervakning för att upptäcka möjliga arytmier. Om antiarytmisk terapi ges, medför disopyramid, prokainamid och kinidin en teoretisk risk för additiva QT-förlängande effekter som kan vara additiva till ziprasidons.
Hypotoni och cirkulationskollaps bör behandlas med lämpliga åtgärder såsom intravenös vätska. Om sympatomimetiska medel används för vaskulärt stöd ska adrenalin och dopamin inte användas, eftersom betastimulering i kombination med α1-antagonism associerad med ziprasidon kan förvärra hypotoni. På liknande sätt är det rimligt att förvänta sig att de alfa-adrenergblockerande egenskaperna hos bretylium kan vara additiv till de hos ziprasidon, vilket resulterar i problematisk hypotoni.
Vid svåra extrapyramidala symtom bör antikolinerga läkemedel ges. Det finns ingen specifik motgift mot ziprasidon och det är inte dialyserbart. Möjligheten av flera droginblandning bör övervägas. Noggrann medicinsk övervakning och övervakning bör fortsätta tills patienten återhämtar sig.
KONTRAINDIKATIONER
QT-förlängning
På grund av ziprasidons dosrelaterade förlängning av QT-intervallet och det kända sambandet mellan dödliga arytmier med QT-förlängning av vissa andra läkemedel, är ziprasidon kontraindicerat:
- hos patienter med en känd historia av QT-förlängning (inklusive kongenitalt långt QT-syndrom)
- hos patienter med nyligen akut hjärtinfarkt
- hos patienter med okompenserad hjärtsvikt
Farmakokinetiska/farmakodynamiska studier mellan ziprasidon och andra läkemedel som förlänger QT-intervallet har inte utförts. En additiv effekt av ziprasidon och andra läkemedel som förlänger QT-intervallet kan inte uteslutas. Därför ska ziprasidon inte ges tillsammans med:
- dofetilid, sotalol, kinidin, andra klass Ia- och III-antiarytmika, mesoridazin, tioridazin, klorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, moxifloxacin, halofantrin, meflokin, pentamidin, dovolimoxid, prometylacetat, levolimacetat, levolimacetat, levolimacetat, levolimacetat.
- andra läkemedel som har visat QT-förlängning som en av sina farmakodynamiska effekter och som har denna effekt beskriven i den fullständiga förskrivningsinformationen som en kontraindikation eller en varning i ruta eller fetstil [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Överkänslighet
Ziprasidon är kontraindicerat hos personer med känd överkänslighet mot produkten.
KLINISK FARMAKOLOGI
Handlingsmekanism
Verkningsmekanismen för ziprasidon vid behandling av de listade indikationerna kan medieras genom en kombination av dopamin typ 2 (D2) och serotonin typ 2 (5HT2) antagonism.
Farmakodynamik
Ziprasidon binder med relativt hög affinitet till dopamin D2 och D3, serotonin 5HT2A, 5HT2C, 5HT1A, 5HT1D och α1-adrenerga receptorer (Ki s på 4,8, 7,2, 0,4, 1,3, 3,1, 0, n resp. och med måttlig affinitet till histamin Hl-receptorn (Ki=47 nM). Ziprasidon är en antagonist vid D2-, 5HT2A- och 5HT1D-receptorerna och en agonist vid 5HT1A-receptorn. Ziprasidon hämmade synaptiskt återupptag av serotonin och noradrenalin. Ingen märkbar affinitet uppvisades för andra testade receptor/bindningsställen, inklusive den kolinerga muskarina receptorn (IC50 >1 μM).
Farmakokinetik
Oral farmakokinetik
Ziprasidons aktivitet beror främst på moderläkemedlet. Multipeldosfarmakokinetiken för ziprasidon är dosproportionell inom det föreslagna kliniska dosintervallet, och ziprasidonackumulering är förutsägbar vid multipel dosering. Eliminering av ziprasidon sker huvudsakligen via levermetabolism med en genomsnittlig terminal halveringstid på cirka 7 timmar inom det föreslagna kliniska dosintervallet. Steady-state-koncentrationer uppnås inom en till tre dagar efter dosering. Det genomsnittliga skenbara systemiska clearance är 7,5 ml/min/kg. Ziprasidon kommer sannolikt inte att störa metabolismen av läkemedel som metaboliseras av cytokrom P450-enzymer.
Absorption
Ziprasidon absorberas väl efter oral administrering och når maximala plasmakoncentrationer inom 6 till 8 timmar. Den absoluta biotillgängligheten för en 20 mg dos under utfodring är cirka 60 %. Absorptionen av ziprasidon ökar upp till två gånger i närvaro av mat.
Distribution
Ziprasidon har en genomsnittlig skenbar distributionsvolym på 1,5 l/kg. Det är mer än 99 % bundet till plasmaproteiner, binder främst till albumin och α1-syraglykoprotein. In vitro plasmaproteinbindningen av ziprasidon förändrades inte av warfarin eller propranolol, två starkt proteinbundna läkemedel, inte heller förändrade ziprasidon bindningen av dessa läkemedel i human plasma. Således är risken för läkemedelsinteraktioner med ziprasidon på grund av förskjutning minimal.
Metabolism och eliminering
Ziprasidon metaboliseras i stor utsträckning efter oral administrering med endast en liten mängd som utsöndras i urinen (
Intramuskulär farmakokinetik
Systemisk biotillgänglighet
Biotillgängligheten för ziprasidon administrerat intramuskulärt är 100 %. Efter intramuskulär administrering av engångsdoser uppträder maximala serumkoncentrationer vanligtvis cirka 60 minuter efter dosering eller tidigare och den genomsnittliga halveringstiden (T½) varierar från två till fem timmar. Exponeringen ökar på ett dosrelaterat sätt och efter tre dagars intramuskulär dosering observeras liten ackumulering.
Metabolism och eliminering
Även om metabolismen och elimineringen av im-ziprasidon inte har utvärderats systematiskt, förväntas inte den intramuskulära administreringsvägen förändra de metaboliska vägarna.
Kliniska studier
Schizofreni
Effekten av oral ziprasidon vid behandling av schizofreni utvärderades i 5 placebokontrollerade studier, 4 korttidsstudier (4 och 6 veckor) och en underhållsstudie. Alla studier var på vuxna slutenvårdspatienter, av vilka de flesta uppfyllde DSM III-R-kriterierna för schizofreni. Varje studie inkluderade 2 till 3 fasta doser ziprasidon samt placebo. Fyra av de 5 försöken kunde skilja ziprasidon från placebo; en korttidsstudie gjorde det inte. Även om en engångsarm med fast dos av haloperidol inkluderades som en jämförande behandling i en av de tre korttidsstudierna, var denna enda studie otillräcklig för att ge en tillförlitlig och giltig jämförelse mellan ziprasidon och haloperidol.
Flera instrument användes för att bedöma psykiatriska tecken och symtom i dessa studier. Brief Psychiatric Rating Scale (BPRS) och Positive and Negative Syndrome Scale (PANSS) är båda inventeringar av allmän psykopatologi med flera artiklar som vanligtvis används för att utvärdera effekterna av läkemedelsbehandling vid schizofreni. BPRS-psykosklustret (konceptuell desorganisering, hallucinatoriskt beteende, misstänksamhet och ovanligt tankeinnehåll) anses vara en särskilt användbar undergrupp för att bedöma aktivt psykotiska schizofrena patienter. En andra allmänt använd bedömning, Clinical Global Impression (CGI), återspeglar intrycket av en skicklig observatör, fullt förtrogen med manifestationerna av schizofreni, om patientens övergripande kliniska tillstånd. Dessutom användes Skalan för att bedöma negativa symtom (SANS) för att bedöma negativa symtom i en studie.
Resultaten av de orala Ziprasidonförsöken vid schizofreni följer
- en 4-veckors, placebokontrollerad studie (n=139) som jämförde 2 fasta doser ziprasidon (20 och 60 mg två gånger dagligen) med placebo, var endast 60 mg dosen överlägsen placebo på BPRS totalpoäng och CGI svårighetsgrad Göra. Denna grupp med högre dos var inte överlägsen placebo på BPRS-psykosklustret eller på SANS.
- I en 6-veckors, placebokontrollerad studie (n=302) som jämförde 2 fasta doser ziprasidon (40 och 80 mg två gånger dagligen) med placebo, var båda dosgrupperna överlägsna placebo på BPRS-totalpoängen, BPRS-psykosklustret, CGI-svårighetspoängen och PANSS totala och negativa subskalepoäng. Även om 80 mg två gånger dagligen hade en numerärt större effekt än 40 mg två gånger dagligen, var skillnaden inte statistiskt signifikant.
- en 6-veckors, placebokontrollerad studie (n=419) som jämförde 3 fasta doser ziprasidon (20, 60 och 100 mg två gånger dagligen) med placebo, var alla tre dosgrupperna överlägsna placebo på PANSS totalpoäng, BPRS-totalpoäng, BPRS-psykosklustret och CGI-allvarlighetspoäng. Endast gruppen 100 mg två gånger dagligen var överlägsen placebo på PANSS negativa subskala. Det fanns inga tydliga bevis för ett dos-responssamband inom dosintervallet 20 mg två gånger dagligen till 100 mg två gånger dagligen.
- I en 4-veckors, placebokontrollerad studie (n=200) som jämförde 3 fasta doser ziprasidon (5, 20 och 40 mg två gånger dagligen), var ingen av dosgrupperna statistiskt överlägsen placebo på något av intressena resultat.
- En studie genomfördes på stabila kroniska eller subkroniska (CGI-S ≤5 vid baslinjen) schizofrena slutenvårdspatienter (n=294) som hade varit inlagda på sjukhus i minst två månader. Efter en 3-dagars enkelblind placebo-inkörning randomiserades försökspersonerna till en av 3 fasta doser av ziprasidon (20 mg, 40 mg eller 80 mg två gånger dagligen) eller placebo och observerades för återfall. Patienterna observerades för "förestående psykotiskt återfall", definierat som CGI-förbättringspoäng på ≤6 (mycket sämre eller mycket sämre) och/eller poäng ≤6 (måttligt svår) på fientlighets- eller bristande samarbetsförmåga i PANSS två på varandra följande dagar . Ziprasidon var signifikant överlägset placebo i tid till återfall, utan någon signifikant skillnad mellan de olika dosgrupperna. Det fanns inte tillräckligt med data för att undersöka populationsundergrupper baserat på ålder och ras. Undersökning av populationsundergrupper baserade på kön avslöjade inte någon differentiell respons.
Bipolär störning I (akuta blandade eller maniska episoder och underhållsbehandling som tillägg till litium eller valproat)
Akut manisk och blandad episod associerad med bipolär sjukdom I
Effekten av ziprasidon fastställdes i 2 placebokontrollerade, dubbelblinda, 3-veckors monoterapistudier på patienter som uppfyller DSM-IV-kriterierna för bipolär störning I, manisk eller blandad episod med eller utan psykotiska egenskaper. Primära värderingsinstrument som användes för att bedöma maniska symtom i dessa försök var: (1) Mania Rating Scale (MRS), som är härledd från Schema för Affective Disorders and Schizophrenia-Change Version (SADS-CB) med objekt grupperade som Manic Syndrome subskalan (förhöjt humör, mindre behov av sömn, överdriven energi, överdriven aktivitet, grandiositet), subskalan Beteende och idéer (irritabilitet, motorisk hyperaktivitet, accelererat tal, racing tankar, dåligt omdöme) och nedsatt insikt; och (2) Clinical Global Impression-Severity of Illness Scale (CGI-S), som användes för att bedöma den kliniska betydelsen av behandlingssvar.
Resultaten av de orala ziprasidonstudierna vid bipolär sjukdom I hos vuxna, manisk/blandad episod följer: i en 3-veckors placebokontrollerad studie (n=210) var ziprasidondosen 40 mg två gånger dagligen på dag 1 och 80 mg två gånger dagligen på dag 2. Titrering inom intervallet 40-80 mg två gånger dagligen (i steg om 20 mg två gånger dagligen) tillåts under hela studien. Ziprasidon var signifikant effektivare än placebo när det gällde att minska MRS-totalpoängen och CGI-S-poängen. Den genomsnittliga dagliga dosen av ziprasidon i denna studie var 132 mg. I en andra 3-veckors placebokontrollerad studie (n=205), var dosen av ziprasidon 40 mg två gånger dagligen på dag 1. Titrering inom intervallet 40-80 mg två gånger dagligen (i steg om 20 mg två gånger dagligen) tillåts under studietiden (med början dag 2). Ziprasidon var signifikant effektivare än placebo när det gällde att minska MRS-totalpoängen och CGI-S-poängen. Den genomsnittliga dagliga dosen av ziprasidon i denna studie var 112 mg.
Underhållsterapi
Effekten av ziprasidon som tilläggsbehandling till litium eller valproat vid underhållsbehandling av bipolär störning I fastställdes i en placebokontrollerad studie på patienter som uppfyllde DSM-IV-kriterierna för bipolär störning I. Studien inkluderade patienter vars senaste episod var manisk eller blandad, med eller utan psykotiska egenskaper. I den öppna fasen behövde patienterna stabiliseras på ziprasidon plus litium eller valproinsyra i minst 8 veckor för att kunna randomiseras. I den dubbelblinda randomiserade fasen fortsatte patienterna behandlingen med litium eller valproinsyra och randomiserades till att få antingen ziprasidon (administrerat två gånger dagligen totalt 80 mg till 160 mg per dag) eller placebo. I allmänhet fortsatte patienterna i underhållsfasen med samma dos som de stabiliserades på under stabiliseringsfasen. Det primära effektmåttet i den här studien var tiden för att återkomma en stämningsepisod (manisk, blandad eller deprimerad episod) som krävde intervention, vilket definierades som något av följande: avbrytande av behandlingen på grund av en stämningsepisod, klinisk intervention för en stämningsepisod (t.ex. initiering av medicinering eller sjukhusvistelse), eller Mania Rating Scale-poäng ≥ 18 eller en MADRS-poäng ≥18 (vid 2 på varandra följande bedömningar med högst 10 dagars mellanrum). Totalt 584 försökspersoner behandlades under den öppna stabiliseringsperioden. Under den dubbelblinda randomiseringsperioden behandlades 127 patienter med ziprasidon och 112 patienter behandlades med placebo. Ziprasidon var överlägset placebo när det gällde att öka tiden tills det återkommer en stämningsepisod. De typer av återfall som observerades inkluderade depressiva, maniska och blandade episoder. Depressiva, maniska och blandade episoder stod för 53 %, 34 % respektive 13 % av det totala antalet återfall i studien.
Akut behandling av agitation vid schizofreni
Effekten av intramuskulär ziprasidon vid behandling av upprörda schizofrena patienter fastställdes i två korttids, dubbelblinda försök med schizofrena försökspersoner som av utredarna ansågs vara "akut upprörda" och i behov av IM antipsykotisk medicin. Dessutom krävdes patienterna att ha en poäng på 3 eller mer på minst 3 av följande punkter i PANSS: ångest, spänning, fientlighet och spänning. Effekten utvärderades genom analys av arean under kurvan (AUC) i Behavioral Activity Rating Scale (BARS) och Clinical Global Impression (CGI) svårighetsgrad. BARS är en sjugradig skala med poäng från 1 (svår eller oförmögen att väcka) till 7 (våldsam, kräver återhållsamhet). Patienter' poängen på BARS vid baslinjen var mestadels 5 (tecken på öppen aktivitet [fysisk eller verbal], lugnar ner sig med instruktioner) och som fastställts av utredarna, uppvisade en grad av agitation som motiverade intramuskulär terapi. Det fanns få patienter med högre betyg än 5 på BARS, eftersom de mest allvarligt upprörda patienterna i allmänhet inte kunde ge informerat samtycke för deltagande i kliniska prövningar före marknadsföring.
Båda studierna jämförde högre doser av ziprasidon intramuskulärt med en kontrolldos på 2 mg. I en studie var den högre dosen 20 mg, som kunde ges upp till 4 gånger under studiens 24 timmar, med mellandosintervall på inte mindre än 4 timmar. I den andra studien var den högre dosen 10 mg, som kunde ges upp till 4 gånger under studiens 24 timmar, med mellandosintervall på minst 2 timmar.
Resultaten av de intramuskulära Ziprasidonförsöken följer
PATIENTINFORMATION
GEODON® Kapslar (ziprasidon)
Information för patienter som tar GEODON eller deras vårdgivare
Denna sammanfattning innehåller viktig information om GEODON. Det är inte menat att ersätta din läkares instruktioner. Läs denna information noggrant innan du tar GEODON. Fråga din läkare eller apotekspersonal om du inte förstår någon av denna information eller om du vill veta mer om GEODON.
Vad är GEODON 80mg?
GEODON är en typ av receptbelagd medicin som kallas psykofarmaka, även känd som ett atypiskt antipsykotiskt medel. GEODON kan användas för att behandla symtom på schizofreni och akuta maniska eller blandade episoder i samband med bipolär sjukdom. GEODON 80mg kan också användas som underhållsbehandling av bipolär sjukdom när den läggs till litium eller valproat.
Vem ska ta GEODON 20mg?
Endast din läkare kan veta om GEODON är rätt för dig. GEODON 20 mg kan förskrivas till dig om du har schizofreni eller bipolär sjukdom.
Symtom på schizofreni kan inkludera:
- höra röster, se saker eller känna saker som inte finns där (hallucinationer)
- föreställningar som inte är sanna (vanföreställningar)
- ovanlig misstänksamhet (paranoia)
- bli tillbakadragen från familj och vänner
Symtom på maniska eller blandade episoder av bipolär sjukdom kan inkludera:
- extremt högt eller irriterat humör
- ökad energi, aktivitet och rastlöshet
- racing tankar eller prata mycket snabbt
- lätt distraherad
- lite sömnbehov
Om du visar ett svar på GEODON 40 mg kan dina symtom förbättras. Om du fortsätter att ta GEODON 40 mg är chansen mindre att dina symtom återkommer. Sluta inte ta kapslarna även när du känner dig bättre utan att först diskutera det med din läkare.
Det är också viktigt att komma ihåg att GEODON 40 mg kapslar ska tas med mat.
Vilken är den viktigaste säkerhetsinformationen jag bör veta om GEODON 20mg?
GEODON är inte godkänt för behandling av patienter med demensrelaterad psykos. Äldre patienter med diagnosen psykos relaterad till demens som behandlas med antipsykotika löper en ökad risk att dö jämfört med patienter som behandlas med placebo (ett sockerpiller).
GEODON är ett effektivt läkemedel för att behandla symptomen på schizofreni och de maniska eller blandade episoderna av bipolär sjukdom. En potentiell bieffekt är dock att den kan förändra hur den elektriska strömmen i ditt hjärta fungerar mer än vissa andra droger. Förändringen är liten och det är inte känt om detta kommer att vara skadligt, men vissa andra läkemedel som orsakar denna typ av förändring har i sällsynta fall orsakat farliga hjärtrytmavvikelser. På grund av detta ska GEODON endast användas efter att din läkare har övervägt denna risk för GEODON mot riskerna och fördelarna med andra tillgängliga läkemedel för behandling av schizofreni eller bipolär manisk och blandad episod.
Din risk för farliga förändringar i hjärtrytmen kan öka om du tar vissa andra läkemedel och om du redan har vissa onormala hjärtsjukdomar. Därför är det viktigt att du berättar för din läkare om alla andra läkemedel du tar, inklusive receptfria läkemedel, kosttillskott och växtbaserade läkemedel. Du måste också berätta för din läkare om eventuella hjärtproblem du har eller har haft.
Vem bör INTE ta GEODON 40mg?
Äldre patienter med diagnosen psykos relaterad till demens. GEODON är inte godkänt för behandling av dessa patienter.
Allt som kan öka risken för en hjärtrytmavvikelse bör undvikas. Ta därför inte GEODON 80mg om:
- Du har vissa hjärtsjukdomar, till exempel långt QT-syndrom, en nyligen inträffad hjärtinfarkt, allvarlig hjärtsvikt eller vissa oregelbundenheter i hjärtrytmen (diskutera detaljerna med din läkare)
- Du tar för närvarande mediciner som inte bör tas i kombination med ziprasidon, till exempel dofetilid, sotalol, kinidin, andra klass Ia och III antiarytmika, mesoridazin, tioridazin, klorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, mfloxiantrinacin, halofoxiantrinacin meflokin, pentamidin, arseniktrioxid, levometadylacetat, dolasetronmesylat, probukol eller takrolimus.
Vad du ska berätta för din läkare innan du börjar med GEODON
Endast din läkare kan avgöra om GEODON är rätt för dig. Innan du börjar med GEODON, var noga med att berätta för din läkare om du:
- har haft problem med hur ditt hjärta slår eller någon hjärtrelaterad sjukdom eller sjukdom
- någon familjehistoria av hjärtsjukdomar, inklusive nyligen genomförd hjärtinfarkt
- har haft problem med svimning eller yrsel
- tar eller nyligen har tagit några receptbelagda läkemedel
- tar några receptfria läkemedel som du kan köpa utan recept, inklusive naturläkemedel/växtbaserade läkemedel
- har haft några problem med din lever
- är gravid, kan vara gravid eller planerar att bli gravid
- ammar eller planerar att amma
- är allergiska mot något läkemedel
- någonsin haft en allergisk reaktion mot ziprasidon eller något av övriga innehållsämnen i GEODON 20 mg kapslar. Fråga din läkare eller apotekspersonal om en lista över dessa ingredienser
- har låga nivåer av kalium eller magnesium i blodet
Din läkare kanske vill att du ska ta ytterligare laboratorietester för att se om GEODON 40mg är en lämplig behandling för dig.
GEODON och andra läkemedel
Det finns vissa mediciner som kan vara osäkra att använda när du tar GEODON, och det finns vissa mediciner som kan påverka hur väl GEODON 40mg fungerar. Medan du är på GEODON, kontrollera med din läkare innan du börjar med några nya receptbelagda eller receptfria läkemedel, inklusive naturliga/växtbaserade läkemedel.
Hur du tar GEODON
- Ta endast GEODON enligt anvisningar från din läkare.
- Svälj GEODON kapslar hela. Tugga, krossa eller öppna inte kapslarna.
- Ta GEODON 40mg kapslar med mat.
- Det är bäst att ta GEODON 80 mg vid samma tidpunkt varje dag.
- GEODON 80mg kan ta några veckor att fungera. Det är viktigt att ha tålamod.
- Ändra inte din dos eller sluta ta din medicin utan din läkares godkännande.
- Kom ihåg att fortsätta ta dina kapslar, även när du mår bättre.
Möjliga biverkningar
Eftersom dessa problem kan innebära att du har en hjärtrytmavvikelse, kontakta din läkare OMEDELBART om du:
- Svimma eller förlora medvetandet
- Känn en förändring i hur ditt hjärta slår (hjärtklappning)
Vanliga biverkningar av GEODON inkluderar följande och bör även diskuteras med din läkare om de uppstår:
- Känner mig ovanligt trött eller sömnig
- Illamående eller orolig mage
- Förstoppning
- Yrsel
- Rastlöshet
- Onormala muskelrörelser, inklusive tremor, shuffling och okontrollerade ofrivilliga rörelser
- Diarre
- Utslag
- Ökad hosta/rinnande näsa
Om du får några biverkningar som berör dig, tala med din läkare. Det är särskilt viktigt att berätta för din läkare om du har diarré, kräkningar eller någon annan sjukdom som kan göra att du tappar vätska. Din läkare kanske vill kontrollera ditt blod för att försäkra dig om att du har rätt mängd viktiga salter efter sådana sjukdomar.
För en lista över alla biverkningar som har rapporterats, fråga din läkare eller apotekspersonal om bipacksedeln för GEODON Professional.
Vad man ska göra för en överdos
I händelse av en överdos, ring din läkare eller giftcentral direkt eller gå till närmaste akutmottagning.
Annan viktig säkerhetsinformation
Ett allvarligt tillstånd som kallas malignt neuroleptikasyndrom (NMS) kan uppstå med alla antipsykotiska läkemedel inklusive GEODON. Tecken på NMS inkluderar mycket hög feber, stela muskler, skakningar, förvirring, svettning eller ökad hjärtfrekvens och blodtryck. NMS är en sällsynt men allvarlig biverkning som kan vara dödlig. Tala därför om för din läkare om du upplever något av dessa symtom.
Fördröjd läkemedelsreaktion som kallas läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) kan uppstå med ziprasidon. Tecken på KLÄDNING kan vara hudutslag, feber och svullna lymfkörtlar. Andra allvarliga kutana biverkningar (SCAR), såsom Stevens-Johnsons syndrom kan uppstå med ziprasidon. Tecken på Stevens-Johnsons syndrom kan vara utslag med blåsor som kan innefatta sår i munnen, hudavfall, feber och målliknande fläckar i huden. KLÄNNING och andra ÄRR är ibland dödliga; Tala därför omedelbart om för din läkare om du upplever något av dessa symtom.
Biverkningar relaterade till högt blodsocker (hyperglykemi), ibland allvarliga, har rapporterats hos patienter som behandlats med atypiska antipsykotika. Det har förekommit få rapporter om hyperglykemi eller diabetes hos patienter som behandlats med GEODON, och det är inte känt om GEODON är associerat med dessa reaktioner. Patienter som behandlas med ett atypiskt antipsykotiskt läkemedel bör övervakas med avseende på symtom på hyperglykemi.
Yrsel orsakad av ett blodtrycksfall kan uppstå med GEODON, särskilt när du först börjar ta detta läkemedel eller när dosen höjs. Om detta händer, var noga med att inte stå upp för snabbt och prata med din läkare om problemet.
Innan du tar GEODON, tala om för din läkare om du
- är gravid eller planerar att bli gravid.
- Om du blir gravid medan du får GEODON 80mg, prata med din vårdgivare om att registrera dig hos National Pregnancy Registry for Atypical Antipsychotics. Du kan registrera dig genom att ringa 1-866-961-2388 eller gå till http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- ammar eller planerar att amma. GEODON 40 mg kan passera över i din bröstmjölk. Prata med din vårdgivare om det bästa sättet att mata ditt barn om du får GEODON.
Eftersom GEODON 80mg kan orsaka sömnighet, var försiktig när du använder maskiner eller kör ett motorfordon.
Eftersom mediciner av samma läkemedelsklass som GEODON kan störa kroppens förmåga att anpassa sig till värme, är det bäst att undvika situationer som involverar hög temperatur eller luftfuktighet.
Det är bäst att undvika att konsumera alkoholhaltiga drycker när du tar GEODON.
Ring din läkare omedelbart om du tar mer än den mängd GEODON som din läkare har ordinerat.
GEODON har inte visat sig vara säkert eller effektivt vid behandling av barn och tonåringar under 18 år.
Förvara GEODON 80mg och alla läkemedel utom räckhåll för barn.
Hur GEODON ska förvaras
Förvara GEODON 20 mg kapslar i rumstemperatur (59°F till 86°F eller 15°C till 30°C).
För mer information om GEODON
Detta ark är bara en sammanfattning. GEODON 20mg är ett receptbelagt läkemedel och endast din läkare kan avgöra om det är rätt för dig. Om du har några frågor eller vill ha mer information om GEODON, tala med din läkare eller apotekspersonal. Du kan också besöka www.geodon.com.
Den här produktens märkning kan ha uppdaterats. För den senaste förskrivningsinformationen, besök www.pfizer.com
