Behandling vid depression: Celexa 10mg, 20mg Citalopram Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Celexa och hur används det?
Celexa är ett receptbelagt läkemedel som används för att behandla symtom på depression. Celexa kan användas ensamt eller tillsammans med andra läkemedel.
Celexa 20mg tillhör en klass av läkemedel som kallas antidepressiva, SSRI.
Vilka är de möjliga biverkningarna av Celexa?
Celexa kan orsaka allvarliga biverkningar inklusive:
- yrsel,
- suddig syn,
- tunnelseende,
- ögonsmärta eller svullnad,
- ser glorier runt ljus,
- huvudvärk med bröstsmärtor och svår yrsel,
- svimning,
- snabba eller bultande hjärtslag,
- mycket stela (styva) muskler,
- feber eller hög feber,
- svettas,
- förvirring,
- skakningar,
- agitation,
- hallucinationer,
- överaktiva reflexer,
- illamående,
- kräkningar,
- diarre,
- förlust av koordination,
- huvudvärk,
- sluddrigt tal,
- allvarlig svaghet och
- känner sig ostadig
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Celexa 20mg inkluderar:
- minnesproblem,
- svårt att koncentrera sig,
- huvudvärk,
- dåsighet,
- torr mun,
- öka svettning,
- domningar eller stickningar,
- ökad aptit,
- illamående,
- diarre,
- gas,
- snabba hjärtslag,
- känner sig skakig,
- sömnproblem (sömnlöshet),
- känner mig trött,
- förkylningssymtom (täppt näsa, nysningar, ont i halsen),
- viktförändringar och
- svårt att få orgasm
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Celexa. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Suicidalitet och antidepressiva läkemedel
Antidepressiva läkemedel ökade risken jämfört med placebo för suicidtänkande och suicidalitet (suicidalitet) hos barn, ungdomar och unga vuxna i korttidsstudier av egentlig depression (MDD) och andra psykiatriska störningar. Alla som överväger att använda Celexa eller något annat antidepressivt medel hos ett barn, ungdom eller ung vuxen måste balansera denna risk med det kliniska behovet. Korttidsstudier visade ingen ökning av risken för suicidalitet med antidepressiva läkemedel jämfört med placebo hos vuxna efter 24 års ålder; det fanns en minskning av risken med antidepressiva läkemedel jämfört med placebo hos vuxna 65 år och äldre. Depression och vissa andra psykiatriska störningar är i sig förknippade med ökad risk för självmord. Patienter i alla åldrar som påbörjas med antidepressiv behandling bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet eller ovanliga beteendeförändringar. Familjer och vårdgivare bör informeras om behovet av noggrann observation och kommunikation med förskrivaren. Celexa 10mg är inte godkänt för användning hos pediatriska patienter. (Se VARNINGAR: Klinisk försämring och självmordsrisk, PATIENTINFORMATION och FÖRSIKTIGHETSÅTGÄRDER: Pediatrisk användning.)
BESKRIVNING
Celexa® (citalopram HBr) är en oralt administrerad selektiv serotoninåterupptagshämmare (SSRI) med en kemisk struktur som inte är relaterad till den hos andra SSRI eller tricykliska, tetracykliska eller andra tillgängliga antidepressiva medel. Citalopram HBr är ett racemiskt bicykliskt ftalanderivat betecknat (±)-1-(3-dimetylaminopropyl)-1-(4-fluorfenyl)-1,3-dihydroisobensofuran-5-karbonitril, HBr med följande strukturformel:
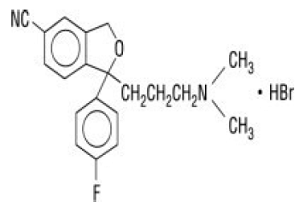
Molekylformeln är C20H22BrFN2O och dess molekylvikt är 405,35.
Citalopram HBr förekommer som ett fint, vitt till benvitt pulver. Citalopram HBr är svårlösligt i vatten och lösligt i etanol.
Celexa (citalopramhydrobromid) är endast tillgänglig i tablettdoseringsform.
Celexa 10 mg är filmdragerade, ovala tabletter som innehåller citalopram HBr i styrkor motsvarande 10 mg citaloprambas. Celexa 20 mg och 40 mg är filmdragerade, ovala tabletter med skåra som innehåller citalopram HBr i styrkor motsvarande 20 mg eller 40 mg citaloprambas. Tabletterna innehåller även följande inaktiva ingredienser: kopolyvidon, majsstärkelse, korskarmellosnatrium, glycerin, laktosmonohydrat, magnesiumstearat, hypromellos, mikrokristallin cellulosa, polyetylenglykol och titandioxid. Järnoxider används som färgämnen i de beige (10 mg) och rosa (20 mg) tabletterna.
INDIKATIONER
CELEXA 20 mg är indicerat för behandling av egentlig depression (MDD) hos vuxna [se Kliniska studier ].
DOSERING OCH ADMINISTRERING
Rekommenderad dosering
Administrera CELEXA en gång dagligen, med eller utan mat, i en initial dos på 20 mg en gång dagligen, med en ökning till en maximal dos på 40 mg en gång dagligen med ett intervall på minst en vecka.
Doser över 40 mg en gång dagligen rekommenderas inte på grund av risken för QT-förlängning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Screen för bipolär sjukdom innan du startar CELEXA
Innan behandling med CELEXA 20 mg eller annat antidepressivt läkemedel påbörjas, screena patienter för personlig eller familjehistoria av bipolär sjukdom, mani eller hypomani [Se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Rekommenderad dosering för specifika populationer
Den maximala rekommenderade dosen av CELEXA 10 mg för patienter som är äldre än 60 år, patienter med nedsatt leverfunktion och för CYP2C19 dåliga metaboliserare är 20 mg en gång dagligen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , KLINISK FARMAKOLOGI ].
Dosändringar vid samtidig användning av CYP2C19-hämmare
Den maximala rekommenderade dosen av CELEXA 20 mg när den används samtidigt med en CYP2C19-hämmare är 20 mg en gång dagligen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
Byta patienter till eller från ett monoaminoxidashämmande antidepressivt medel
Det måste gå minst 14 dagar mellan utsättande av en monoaminoxidashämmare (MAO-hämmare) antidepressivt läkemedel och påbörjande av behandling med CELEXA. Omvänt måste det gå minst 14 dagar efter att CELEXA avslutats innan man påbörjar ett antidepressivt läkemedel mot MAO-hämmare [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Att avbryta behandlingen med CELEXA
Biverkningar kan uppstå vid utsättande av CELEXA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Minska gradvis dosen istället för att sluta abrupt med CELEXA när det är möjligt.
HUR LEVERERAS
Doseringsformer och styrkor
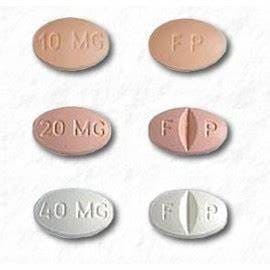
CELEXA 10 mg tabletter finns som:
- 10 mg: beige, oval med "FP" tryckt på ena sidan, "10 mg" tryckt på andra sidan
- 20 mg: rosa, oval, skårad med "F" stämplad på vänster sida av skårlinjen och "P" stämplad på höger sida av skårlinjen, "20 mg" stämplad på sidan utan skåror
- 40 mg: vit, oval, skårad med "F" stämplad på vänster sida av skårlinjen och "P" stämplad på höger sida av skårlinjen, "40 mg" stämplad på sidan utan skåror
CELEXA (citalopram) tabletter levereras enligt följande:
Förvaring Och Hantering
CELEXA 10 mg tabletter ska förvaras vid 20-25°C (68 till 77°F); utflykter tillåtna mellan 15 och 30°C (59-86°F) [se USP-kontrollerad rumstemperatur ].
Distribuerat av: Allergan USA, Inc. Reviderad: feb 2022
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Överkänslighetsreaktioner [se KONTRAINDIKATIONER ]
- Självmordstankar och -beteenden hos ungdomar och unga vuxna [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- QT-förlängning och torsade de pointes [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ökad risk för blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Aktivering av mani eller hypomani [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Utsättningssyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Stängningsvinkelglaukom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hyponatremi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Sexuell dysfunktion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i klinisk praxis.
Säkerheten för CELEXA 20 mg inkluderade exponeringar för citalopram hos patienter och/eller friska försökspersoner från 3 olika grupper av studier: 429 friska försökspersoner i klinisk farmakologi/farmakokinetiska studier; 4 422 exponeringar från patienter i kontrollerade och okontrollerade kliniska prövningar, motsvarande cirka 1 370 patientexponeringsår. Det fanns dessutom över 19 000 exponeringar från mestadels öppna europeiska eftermarknadsföringsstudier. Tillstånden och behandlingstiden med CELEXA 10 mg varierade mycket och inkluderade (i överlappande kategorier) öppna och dubbelblinda studier, slutenvårds- och öppenvårdsstudier, studier med fasta doser och dostitrering samt korttids- och långtidsexponering .
Biverkningar i samband med avbrytande av behandlingen
Bland 1 063 patienter med MDD som fick CELEXA 10 mg i doser från 10 mg till 80 mg en gång dagligen i placebokontrollerade studier på upp till 6 veckors varaktighet, avbröt 16 % behandlingen på grund av en biverkning, jämfört med 8 % av 446 patienter får placebo. De biverkningar som är förknippade med utsättning (dvs. förknippade med utsättning hos minst 1 % av CELEXA-behandlade patienter i en takt som är minst dubbelt så stor som placebo) visas i tabell 2.
Tabell 3 räknar upp förekomsten av biverkningar som inträffade bland 1 063 patienter med MDD som fick CELEXA 20 mg i doser från 10 mg till 80 mg en gång dagligen i placebokontrollerade studier med en varaktighet på upp till 6 veckor.
Den vanligaste biverkningen som inträffade hos CELEXA-behandlade patienter med en incidens på 5 % eller mer och minst dubbelt så stor hos placebopatienter var ejakulationsstörning (främst utlösningsfördröjning) hos manliga patienter (se tabell 3).
Dosberoende biverkningar
Det potentiella sambandet mellan dosen av CELEXA 10 mg och förekomsten av biverkningar undersöktes i en studie med fast dos på patienter med MDD som fick placebo eller CELEXA 10 mg, 20 mg 40 mg eller 60 mg (1,5 gånger den maximala rekommenderade dosen) . Ett positivt dossvar (p
Manlig och kvinnlig sexuell dysfunktion med SSRI
Även om förändringar i sexuell lust, sexuell prestation och sexuell tillfredsställelse ofta förekommer som manifestationer av en psykiatrisk störning, kan de också vara en konsekvens av SSRI-behandling. Tillförlitliga uppskattningar av förekomsten och svårighetsgraden av ogynnsamma upplevelser som involverar sexuell lust, prestation och tillfredsställelse är dock svåra att få, delvis på grund av att patienter och vårdgivare kan vara ovilliga att diskutera dem. Följaktligen kan uppskattningar av förekomsten av ogynnsam sexuell upplevelse och prestation som nämns i märkningen underskatta deras faktiska förekomst.
Tabell 4 visar förekomsten av sexuella biverkningar som rapporterats av minst 2 % av manliga patienter som tar CELEXA 20 mg i en pool av placebokontrollerade kliniska prövningar på patienter med depression.
Hos kvinnliga deprimerade patienter som fick CELEXA 20 mg var den rapporterade incidensen av minskad libido och anorgasmi 1,3 % (n=638 kvinnor) respektive 1,1 % (n=252 kvinnor).
Viktförändringar
Patienter som behandlats med CELEXA i kontrollerade studier upplevde en viktminskning på cirka 0,5 kg jämfört med ingen förändring för placebopatienter.
EKG-förändringar
I en grundlig QT-studie visade sig CELEXA vara associerad med en dosberoende ökning av QTc-intervallet.
Elektrokardiogram från grupperna CELEXA (N=802) och placebo (N=241) jämfördes med avseende på extremvärden definierade som försökspersoner med QTc-förändringar över 60 msek från baslinjen eller absoluta värden över 500 msek efter dos, och försökspersoner med hjärtfrekvensökningar till över 100 slag per minut eller minskar till mindre än 50 slag per minut med en förändring på 25 % från baslinjen (takykardisk respektive bradykardisk extremvärde). I CELEXA-gruppen hade 1,9 % av patienterna en förändring från baslinjen i QTcF >60 msek jämfört med 1,2 % av patienterna i placebogruppen. Ingen av patienterna i placebogruppen hade efter dos QTcF >500 msek jämfört med 0,5 % av patienterna i CELEXA 10 mg-gruppen. Incidensen av takykardiska extremvärden var 0,5 % i CELEXA-gruppen och 0,4 % i placebogruppen. Incidensen av bradykardiska extremvärden var 0,9 % i CELEXA 10 mg-gruppen och 0,4 % i placebogruppen.
Andra biverkningar som observerats under premarketingutvärderingen av CELEXA
Följande lista över biverkningar inkluderar inte reaktioner som är: 1) inkluderade i tabell 3 eller någon annanstans i märkningen, 2) för vilka en läkemedelsorsak var avlägsen, 3) som var så generella att de inte var informativa, och de som endast förekommer i en patient.
Biverkningar kategoriseras efter kroppssystem och listas i ordning efter minskande frekvens enligt följande definitioner: frekventa biverkningar är de som inträffar vid ett eller flera tillfällen hos minst 1/100 patienter; sällsynta biverkningar är de som inträffar hos mindre än 1/100 patienter till 1/1000 patienter; sällsynta biverkningar är de som inträffar hos färre än 1/1000 patienter.
Kardiovaskulär - Frekventa: takykardi, postural hypotoni, hypotoni. Sällsynta: hypertoni, bradykardi, ödem (extremiteter), angina pectoris, extrasystoler, hjärtsvikt, rodnad, hjärtinfarkt, cerebrovaskulär olycka, myokardischemi. Sällsynta: övergående ischemisk attack, flebit, förmaksflimmer, hjärtstillestånd, grenblock.
Störningar i centrala och perifera nervsystemet - frekventa: parestesi, migrän. Sällsynta: hyperkinesi, svindel, hypertoni, extrapyramidal störning, benkramper, ofrivilliga muskelsammandragningar, hypokinesi, neuralgi, dystoni, onormal gång, hypoestesi, ataxi. Sällsynta: onormal koordination, hyperestesi, ptos, stupor.
Endokrina störningar -Sällsynt: hypotyreos, struma, gynekomasti.
Gastrointestinala störningar -Frekvent: ökad saliv, flatulens. Sällsynt: gastrit, gastroenterit, stomatit, utslag, hemorrojder, dysfagi, tandgnissling, gingivit, esofagit. Sällsynta: kolit, magsår, kolecystit, kolelitiasis, duodenalsår, gastroesofageal reflux, glossit, gulsot, divertikulit, rektal blödning, hicka.
Allmänt - Sällsynt : värmevallningar, stelhet, alkoholintolerans, synkope, influensaliknande symtom. Sällsynt: hösnuva.
Hemiska och lymfatiska sjukdomar -Sällsynta: purpura, anemi, näsblod, leukocytos, leukopeni, lymfadenopati. Sällsynta: lungemboli, granulocytopeni, lymfocytos, lymfopeni, hypokrom anemi, koagulationsstörning, gingival blödning.
Metaboliska och näringsmässiga störningar -Frekvent: minskad vikt, ökad vikt. Sällsynt: ökade leverenzymer, törst, torra ögon, ökat alkaliskt fosfatas, onormal glukostolerans. Sällsynta: bilirubinemi, hypokalemi, fetma, hypoglykemi, hepatit, uttorkning.
Muskuloskeletala systemet -Sällsynta: artrit, muskelsvaghet, skelettsmärta. Sällsynta: bursit, osteoporos.
Psykiatriska störningar -Frekventa: försämrad koncentration, minnesförlust, apati, depression, ökad aptit, förvärrad depression, självmordsförsök, förvirring. Sällan: ökad libido, aggressiv reaktion, paroniri, drogberoende, depersonalisering, hallucinationer, eufori, psykotisk depression, vanföreställning, paranoid reaktion, emotionell labilitet, panikreaktion, psykos. Sällsynt: katatonisk reaktion, melankoli.
Reproduktionsstörningar/kvinna* -Frekventa: amenorré. Sällsynt: galaktorré, bröstsmärtor, bröstförstoring, vaginal blödning. (*% endast baserat på kvinnliga ämnen: 2955)
Störningar i andningsorganen - Frekvent: hosta. Sällsynt: bronkit, dyspné, lunginflammation. Sällsynta: astma, laryngit, bronkospasm, pneumonit, ökad sputum.
Hud- och bihangssjukdomar - Vanliga: utslag, klåda. Sällsynt: ljuskänslighetsreaktion, urtikaria, akne, missfärgning av huden, eksem, alopeci, dermatit, torr hud, psoriasis. Sällsynta: hypertrichosis, minskad svettning, melanos, keratit, cellulit, pruritus ani.
Särskilda sinnen - Frekvent: onormalt boende, smakperversion. Sällsynt: tinnitus, konjunktivit, ögonsmärta. Sällsynta: mydriasis, fotofobi, diplopi, onormal tårbildning, grå starr, smakförlust.
Störningar i urinvägarna - Vanliga: polyuri. Sällsynt: miktionsfrekvens, urininkontinens, urinretention, dysuri. Sällsynta: ansiktsödem, hematuri, oliguri, pyelonefrit, njursten, njursmärta.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av citalopram, racematet eller escitalopram, S-enantiomeren av citalopram efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Blod- och lymfsystemet: hemolytisk anemi, trombocytopeni, minskat protrombin
Hjärtsjukdomar: torsade de pointes, ventrikulär arytmi, QT-förlängd
Endokrina störningar: hyperprolaktinemi
Ögonstörningar: stängningsvinkelglaukom
Gastrointestinala störningar: gastrointestinala blödningar, pankreatit
Allmänna störningar och administrativa villkor på webbplatsen: abstinenssyndrom
Lever och gallvägar: levernekros
Immunsystemets störningar: anafylaxi, allergisk reaktion
Muskuloskeletala och bindvävssjukdomar: rabdomyolys
Störningar i nervsystemet: grand mal-konvulsioner, myoklonus, koreoatetos, dyskinesi, akatisi, nystagmus
Graviditet, Puerperium och perinatala tillstånd: spontan abort
Psykiatriska störningar: delirium
Njur- och urinvägsstörningar: akut njursvikt
Reproduktionssystemet och bröststörningar: priapism
Hud och subkutan vävnad: Stevens Johnsons syndrom, epidermal nekrolys, angioödem, erythema multiforme, ekkymos
Vaskulära sjukdomar: trombos
LÄKEMEDELSINTERAKTIONER
Tabell 5 visar kliniskt viktiga läkemedelsinteraktioner med CELEXA.
Narkotikamissbruk och beroende
Kontrollerad substans
CELEXA (citalopram HBr) är inte en kontrollerad substans.
Missbruk
Djurstudier tyder på att risken för missbruk av CELEXA 20 mg är låg. CELEXA har inte systematiskt studerats på människor för dess potential för missbruk, tolerans eller fysiskt beroende. Den kliniska erfarenheten av CELEXA före marknadsföringen avslöjade inget läkemedelssökande beteende. Dessa observationer var dock inte systematiska och det är inte möjligt att, utifrån denna begränsade erfarenhet, förutsäga i vilken utsträckning ett CNS-aktivt läkemedel kommer att missbrukas, avledas och/eller missbrukas när det väl marknadsförts. Följaktligen bör vårdgivare noggrant utvärdera CELEXA 20 mg-patienter med avseende på drogmissbruk och följa dessa patienter noggrant, observera dem för tecken på missbruk eller missbruk (t.ex. utveckling av tolerans, ökningar av dosen, drogsökande beteende).
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Självmordstankar och -beteende hos ungdomar och unga vuxna
poolade analyser av placebokontrollerade prövningar av antidepressiva läkemedel (SSRI och andra antidepressiva klasser) som inkluderade cirka 77 000 vuxna patienter och 4 500 pediatriska patienter, var förekomsten av självmordstankar och självmordsbeteenden hos antidepressiva patienter i åldern 24 år och yngre än hos placebobehandlade patienter. Det fanns avsevärd variation i risk för självmordstankar och självmordsbeteenden bland droger, men det fanns en ökad risk identifierad hos unga patienter för de flesta droger som studerades. Det fanns skillnader i absolut risk för självmordstankar och -beteenden över de olika indikationerna, med den högsta förekomsten hos patienter med MDD. Skillnaderna mellan läkemedel och placebo i antalet fall av självmordstankar och -beteenden per 1000 behandlade patienter anges i tabell 1.
Det är okänt om risken för självmordstankar och självmordsbeteenden hos barn, ungdomar och unga vuxna sträcker sig till långvarig användning, dvs. längre än fyra månader. Det finns dock betydande bevis från placebokontrollerade underhållsstudier på vuxna med MDD för att antidepressiva läkemedel fördröjer återkommande depression och att depression i sig är en riskfaktor för självmordstankar och självmordsbeteenden.
Övervaka alla patienter som behandlas med antidepressiva medel för klinisk försämring och uppkomst av självmordstankar och -beteenden, särskilt under de första månaderna av läkemedelsbehandling och vid tidpunkter med dosförändringar. Rådgiv familjemedlemmar eller vårdgivare till patienter att övervaka beteendeförändringar och varna vårdgivaren. Överväg att ändra den terapeutiska regimen, inklusive eventuellt avbrytande av CELEXA, hos patienter vars depression är ihållande värre eller som upplever framväxande självmordstankar eller -beteenden.
QT-förlängning och Torsade De Pointes
CELEXA orsakar dosberoende QTc-förlängning, en EKG-avvikelse som har associerats med Torsade de Pointes (TdP), ventrikulär takykardi och plötslig död, som alla har observerats i postmarketingrapporter för citalopram [se NEGATIVA REAKTIONER ].
På grund av risken för QTc-förlängning vid högre CELEXA 20 mg doser, rekommenderas att CELEXA inte ges i doser över 40 mg en gång dagligen [se DOSERING OCH ADMINISTRERING , KLINISK FARMAKOLOGI ].
CELEXA bör undvikas hos patienter med medfödda långt QT-syndrom, bradykardi, hypokalemi eller hypomagnesemi, nyligen genomförd akut hjärtinfarkt eller okompenserad hjärtsvikt om inte fördelarna uppväger riskerna för en viss patient. CELEXA bör också undvikas hos patienter som tar andra läkemedel som förlänger QTc-intervallet [se LÄKEMEDELSINTERAKTIONER ]. Sådana läkemedel inkluderar klass 1A (t.ex. kinidin, prokainamid) eller klass III (t.ex. amiodaron, sotalol) antiarytmiska läkemedel, antipsykotiska läkemedel (t.ex. klorpromazin, tioridazin), antibiotika (t.ex. gatifloxacin, moxifloxacin) eller någon annan klass av läkemedel känt för att förlänga QTc-intervallet (t.ex. pentamidin, levometadylacetat, metadon).
Citalopramdosen bör begränsas i vissa populationer. Den maximala dosen bör begränsas till 20 mg en gång dagligen hos patienter som är dåliga CYP2C19-metaboliserare eller de patienter som samtidigt får cimetidin eller annan CYP2C19-hämmare, eftersom högre citalopramexponering kan förväntas. Den maximala dosen bör också begränsas till 20 mg en gång dagligen hos patienter med nedsatt leverfunktion och till patienter som är äldre än 60 år på grund av förväntad högre exponering [se DOSERING OCH ADMINISTRERING , LÄKEMEDELSINTERAKTIONER , Användning i specifika populationer , KLINISK FARMAKOLOGI ].
Elektrolyt- och/eller EKG-övervakning rekommenderas under vissa omständigheter. Patienter som övervägs för behandling med CELEXA 20 mg och som löper risk för betydande elektrolytrubbningar bör ha baslinjemätningar av serumkalium och magnesium med periodisk övervakning. Hypokalemi (och/eller hypomagnesemi) kan öka risken för QTc-förlängning och arytmi, och bör korrigeras innan behandlingen påbörjas och övervakas regelbundet. EKG-övervakning rekommenderas till patienter för vilka användning av CELEXA 10 mg inte rekommenderas om inte fördelarna klart överväger riskerna för en viss patient (se ovan ). Dessa inkluderar de patienter med de hjärttillstånd som anges ovan och de som tar andra läkemedel som kan förlänga QTc-intervallet.
Avbryt CELEXA 10 mg hos patienter som visar sig ha ihållande QTc-mätningar >500 ms. Om patienter som tar CELEXA upplever symtom som kan indikera förekomsten av hjärtarytmier, t.ex. yrsel, hjärtklappning eller synkope, bör förskrivaren initiera ytterligare utvärdering, inklusive hjärtövervakning.
Serotonin syndrom
SSRI, inklusive CELEXA 20 mg, kan utlösa serotonergt syndrom, ett potentiellt livshotande tillstånd. Risken ökar vid samtidig användning av andra serotonerga läkemedel (inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadol, tryptofan, buspiron, amfetamin och johannesört) och med läkemedel som försämrar metabolismen av serotonin, dvs. MAO-hämmare [se KONTRAINDIKATIONER , LÄKEMEDELSINTERAKTIONER ]. Serotonergt syndrom kan också uppstå när dessa läkemedel används ensamma. Symtom på serotonergt syndrom noterades hos 0,1 % av MDD-patienterna som behandlades med CELEXA 20 mg i kliniska prövningar före marknadsföring.
Tecken och symtom på serotonergt syndrom kan inkludera förändringar i mental status (t.ex. agitation, hallucinationer, delirium och koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, yrsel, diafores, rodnad, hypertermi), neuromuskulära symtom (t.ex. tremor, stelhet, myoklonus, hyperreflexi, inkoordination), kramper och gastrointestinala symtom (t.ex. illamående, kräkningar, diarré).
Samtidig användning av CELEXA och MAO-hämmare är kontraindicerad. Inled inte heller CELEXA 20 mg hos en patient som behandlas med MAO-hämmare såsom linezolid eller intravenös metylenblått. Inga rapporter involverade administrering av metylenblått på andra sätt (såsom orala tabletter eller lokal vävnadsinjektion). Om det är nödvändigt att påbörja behandling med en MAO-hämmare såsom linezolid eller intravenös metylenblått hos en patient som tar CELEXA 10 mg, avbryt CELEXA 20 mg innan behandling med MAO-hämmaren påbörjas [se KONTRAINDIKATIONER , LÄKEMEDELSINTERAKTIONER ].
Övervaka alla patienter som tar CELEXA 20 mg för uppkomsten av serotonergt syndrom. Avbryt behandlingen med CELEXA och eventuella samtidiga serotonerga medel omedelbart om ovanstående symtom uppträder, och påbörja stödjande symtomatisk behandling. Om samtidig användning av CELEXA med andra serotonerga läkemedel är kliniskt motiverad, informera patienterna om den ökade risken för serotonergt syndrom och övervaka symtomen.
Ökad risk för blödning
Läkemedel som interfererar med hämning av serotoninåterupptag, inklusive CELEXA 20 mg, ökar risken för blödningar. Samtidig användning av acetylsalicylsyra, icke-steroida antiinflammatoriska läkemedel (NSAIDS), andra trombocythämmande läkemedel, warfarin och andra antikoagulantia kan öka denna risk. Fallrapporter och epidemiologiska studier (fallkontroll och kohortdesign) har visat ett samband mellan användning av läkemedel som stör serotoninåterupptaget och förekomsten av gastrointestinala blödningar. Blödningshändelser relaterade till läkemedel som stör serotoninåterupptaget har varierat från ekkymos, hematom, näsblod och petekier till livshotande blödningar.
Informera patienter om den ökade risken för blödning i samband med samtidig användning av CELEXA 20 mg och trombocythämmande medel eller antikoagulantia. För patienter som tar warfarin, övervaka noggrant det internationella normaliserade förhållandet [se LÄKEMEDELSINTERAKTIONER ].
Aktivering av mani eller hypomani
Hos patienter med bipolär sjukdom kan behandling av en depressiv episod med CELEXA eller annat antidepressivt medel utlösa en blandad/manisk episod. I kontrollerade kliniska prövningar exkluderades patienter med bipolär sjukdom; symtom på mani eller hypomani rapporterades dock hos 0,1 % av de odiagnostiserade patienterna som behandlades med CELEXA. Innan behandling med CELEXA 10 mg påbörjas, screena patienterna för eventuell personlig eller familjehistoria av bipolär sjukdom, mani eller hypomani [se DOSERING OCH ADMINISTRERING ].
Utsättningssyndrom
Biverkningar efter utsättning av serotonerga antidepressiva läkemedel, särskilt efter abrupt utsättning, inkluderar: illamående, svettning, dysforiskt humör, irritabilitet, agitation, yrsel, känselrubbningar (t.ex. parestesi, såsom elektriska stötar), tremor, ångest, förvirring, huvudvärk, slöhet, emotionell labilitet, sömnlöshet, hypomani, tinnitus och anfall. En gradvis minskning av dosen snarare än abrupt utsättning rekommenderas när så är möjligt [se DOSERING OCH ADMINISTRERING ].
Anfall
CELEXA 20 mg har inte utvärderats systematiskt hos patienter med krampanfall. Patienter med en historia av anfall exkluderades från kliniska studier. I kliniska prövningar av CELEXA 20 mg inträffade anfall hos 0,3 % av patienterna som behandlades med CELEXA (en frekvens på en patient per 98 års exponering) och 0,5 % av patienterna som behandlades med placebo (en frekvens på en patient per 50 års exponering). CELEXA 10 mg ska förskrivas med försiktighet till patienter med krampanfall.
Vinkelstängd glaukom
Pupillutvidgningen som uppstår efter användning av många antidepressiva läkemedel, inklusive CELEXA, kan utlösa en vinkelattack hos en patient med anatomiskt smala vinklar som inte har en patenterad iridektomi. Undvik användning av antidepressiva medel, inklusive CELEXA, hos patienter med obehandlade anatomiskt smala vinklar.
Hyponatremi
Hyponatremi kan uppstå som ett resultat av behandling med SSRI, inklusive CELEXA. Fall av serumnatrium lägre än 110 mmol/L har rapporterats. Tecken och symtom på hyponatremi inkluderar huvudvärk, koncentrationssvårigheter, minnesstörning, förvirring, svaghet och ostadighet, vilket kan leda till fall. Tecken och symtom förknippade med mer allvarliga och/eller akuta fall har inkluderat hallucinationer, synkope, anfall, koma, andningsstopp och dödsfall. I många fall verkar denna hyponatremi vara resultatet av syndromet med olämplig antidiuretisk hormonsekretion (SIADH).
Hos patienter med symtomatisk hyponatremi, avbryt CELEXA och sätt in lämplig medicinsk intervention. Äldre patienter, patienter som tar diuretika och de som är utarmade kan löpa större risk att utveckla hyponatremi med SSRI [se Användning i specifika populationer ].
Sexuell dysfunktion
Användning av SSRI, inklusive CELEXA, kan orsaka symtom på sexuell dysfunktion [se NEGATIVA REAKTIONER ]. Hos manliga patienter kan SSRI-användning resultera i försening eller ejakulationssvikt, minskad libido och erektil dysfunktion. Hos kvinnliga patienter kan användning av SSRI resultera i minskad libido och försenad eller utebliven orgasm.
Det är viktigt för förskrivare att fråga om sexuell funktion innan CELEXA påbörjas och att fråga specifikt om förändringar i sexuell funktion under behandlingen, eftersom sexuell funktion kanske inte spontant rapporteras. När man utvärderar förändringar i sexuell funktion är det viktigt att få en detaljerad historia (inklusive tidpunkten för symtomdebut) eftersom sexuella symtom kan ha andra orsaker, inklusive den underliggande psykiatriska störningen. Diskutera potentiella hanteringsstrategier för att stödja patienter i att fatta välgrundade beslut om behandling.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ).
Självmordstankar och -beteenden
Råda patienter och vårdgivare att leta efter uppkomsten av suicidalitet, särskilt tidigt under behandlingen och när dosen justeras upp eller ner, och instruera dem att rapportera sådana symtom till vårdgivaren [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
QT-förlängning och Torsade De Pointes
Rekommendera patienter att omedelbart rådfråga sin vårdgivare om de känner sig svimma, tappar medvetandet eller har hjärtklappning. Instruera patienterna att informera sin vårdgivare att de tar CELEXA innan de tar några nya läkemedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
Serotonin syndrom
Varna patienter för risken för serotonergt syndrom, särskilt vid samtidig användning av CELEXA 20 mg med andra serotonerga läkemedel inklusive triptaner, tricykliska antidepressiva medel, fentanyl, litium, tramadol, tryptofan, buspiron, amfetamin, johannesört och med läkemedel som försämrar metabolismen av serotonin (särskilt MAO-hämmare, både de som är avsedda att behandla psykiatriska störningar och även andra, såsom linezolid). Instruera patienter att kontakta sin vårdgivare eller rapportera till akuten om de upplever tecken eller symtom på serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
Ökad risk för blödning
Informera patienterna om samtidig användning av CELEXA 10mg med acetylsalicylsyra, NSAID, andra trombocythämmande läkemedel, warfarin eller andra antikoagulantia eftersom den kombinerade användningen har associerats med en ökad risk för blödning. Råda patienter att informera sin vårdgivare om de tar eller planerar att ta några receptbelagda eller receptfria läkemedel som ökar risken för blödning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Aktivering av mani eller hypomani
Råda patienter och deras vårdgivare att observera efter tecken på aktivering av mani/hypomani och instruera dem att rapportera sådana symtom till vårdgivaren [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Utsättningssyndrom
Rekommendera patienterna att inte abrupt avbryta behandlingen med CELEXA och att diskutera eventuella nedtrappningsprogram med sin vårdgivare. Informera patienterna om att biverkningar kan uppstå när CELEXA 20 mg sätts ut [Se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sexuell dysfunktion
Informera patienter om att användning av CELEXA kan orsaka symtom på sexuell dysfunktion hos både manliga och kvinnliga patienter. Informera patienter om att de bör diskutera eventuella förändringar i sexuell funktion och potentiella hanteringsstrategier med sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Graviditet
- Råda patienter att meddela sin vårdgivare om de blir gravida eller tänker bli gravida under behandling med CELEXA [se Användning i specifika populationer ].
- Informera patienter om att CELEXA-användning sent i graviditeten kan leda till en ökad risk för neonatala komplikationer som kräver långvarig sjukhusvistelse, andningsstöd, sondmatning och/eller ihållande pulmonell hypertoni hos nyfödda (PPHN) [se Användning i specifika populationer ].
- Informera kvinnor om att det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för citalopram under graviditeten [se Användning i specifika populationer ].
Laktation
Rekommendera ammande kvinnor att övervaka spädbarn för överdriven sedering, rastlöshet, agitation, dålig matning och dålig viktökning och att söka läkarvård om de märker dessa tecken [se Användning i specifika populationer ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Citalopram ökade förekomsten av tunntarmscancer hos råttor som behandlats i 24 månader med doser på 8 och 24 mg/kg/dag i kosten, vilket är cirka 2 respektive 6 gånger den maximala rekommenderade humandosen (MRHD) på 40 mg, respektive, baserat på mg/m² kroppsyta. En no-effect level (NOEL) för detta fynd fastställdes inte.
Citalopram ökade inte förekomsten av tumörer hos möss som behandlats under 18 månader vid doser upp till 240 mg/kg/dag i kosten, vilket är cirka 30 gånger MRDH på 40 mg baserat på mg/m² kroppsyta.
Mutagenes
Citalopram var mutagent i in vitro bakteriell omvänd mutationsanalys (Ames-test) i 2 av 5 bakteriestammar (Salmonella TA98 och TA1537) i frånvaro av metabolisk aktivering. Det var klastogent i in vitro lungcellsanalysen av kinesisk hamster för kromosomavvikelser i närvaro och frånvaro av metabolisk aktivering. Citalopram var inte mutagent i in vitro analysen av däggdjur framåt genmutation (HPRT) i muslymfomceller eller i in vitro/in vivo analys av oplanerad DNA-syntes (UDS) i råttlever. Det var inte klastogent i in vitro-kromosomavvikelseanalysen i humana lymfocyter eller i två in vivo-musmikronukleusanalyser.
Nedsättning av fertilitet
Citalopram administrerades oralt till hon- och hanråttor i doser på 32, 48 och 72 mg/kg/dag före och under hela parningen och fortsatt till dräktighet. Dessa doser är cirka 8, 12 och 17 gånger MRHD på 40 mg baserat på mg/m² kroppsyta. Parning och fertilitet minskade vid doser ≥ 32 mg/kg/dag, vilket är cirka 8 gånger MRHD.
Dräktighetslängden ökade med 48 mg/kg/dag, vilket är ungefär 12 gånger MRHD.
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsutfall hos kvinnor som exponerats för antidepressiva läkemedel under graviditeten. Vårdgivare uppmuntras att registrera patienter genom att ringa National Pregnancy Registry for Antidepressants på 1-844-405-6185 eller besöka online på https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Risksammanfattning
Tillgängliga data från publicerade epidemiologiska studier och rapporter efter marknadsföring med användning av citalopram under graviditet har inte fastställt en ökad risk för allvarliga fosterskador eller missfall. Publicerade studier visade att citalopramnivåerna i både navelsträngsblod och fostervatten liknar de som observerats i moderns serum. Det finns risker för ihållande pulmonell hypertoni hos nyfödda (PPHN) (se Data ) och/eller dålig neonatal anpassning med exponering för selektiva serotoninåterupptagshämmare (SSRI), inklusive CELEXA, under graviditet. Det finns också risker förknippade med obehandlad depression under graviditeten (se Kliniska överväganden ).
I reproduktionsstudier på djur orsakade citalopram ogynnsamma embryo-/fostereffekter vid doser som orsakade maternell toxicitet (se Data ).
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i de kliniskt erkända graviditeterna 2 % till 4 % respektive 15 % till 20 %.
Kliniska överväganden
Sjukdomsrelaterad risk för mödrar och/eller embryon/foster
Kvinnor som slutar använda antidepressiva läkemedel under graviditeten är mer benägna att uppleva ett återfall av allvarlig depression än kvinnor som fortsätter med antidepressiva. Detta fynd kommer från en prospektiv longitudinell studie av 201 gravida kvinnor med en historia av allvarlig depressiv sjukdom som var euthymic och tog antidepressiva i början av graviditeten. Tänk på risken för obehandlad depression när du avbryter eller byter behandling med antidepressiv medicin under graviditet och efter förlossningen.
Fetala/neonatala biverkningar
Nyfödda som exponerats för CELEXA och andra SSRI-läkemedel sent i tredje trimestern har utvecklat komplikationer som kräver långvarig sjukhusvistelse, andningsstöd och sondmatning. Sådana komplikationer kan uppstå omedelbart efter leverans. Rapporterade kliniska fynd har inkluderat andnöd, cyanos, apné, kramper, temperaturinstabilitet, ätsvårigheter, kräkningar, hypoglykemi, hypotoni, hypertoni, hyperreflexi, tremor, skakningar, irritabilitet och konstant gråt. Dessa fynd överensstämmer med antingen en direkt toxisk effekt av SSRI eller möjligen ett läkemedelsavbrottssyndrom. Det bör noteras att den kliniska bilden i vissa fall överensstämmer med serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Data
Mänskliga data
Exponering under sen graviditet för SSRI kan ha en ökad risk för ihållande pulmonell hypertoni hos nyfödda (PPHN). PPHN förekommer hos 1-2 av 1 000 levande födda i den allmänna befolkningen och är associerat med betydande neonatal morbiditet och mortalitet.
Djurdata
Citalopram administrerades oralt till dräktiga råttor under organogenesperioden i doser på 32, 56 och 112 mg/kg/dag, vilket är cirka 8, 14 och 27 gånger den maximala rekommenderade humandosen (MRHD) på 40 mg, baserat på på mg/m² kroppsyta. Citalopram orsakade maternell toxicitet av CNS kliniska tecken och minskad viktökning vid 112 mg/kg/dag, vilket är 27 gånger MRHD. Vid denna maternellt toxiska dos minskade citalopram embryot/fostertillväxt och överlevnad och ökade fosteravvikelser (inklusive kardiovaskulära och skelettdefekter). No observed adverse effect level (NOAEL) för maternell och embryofetal toxicitet är 56 mg/kg/dag, vilket är ungefär 14 gånger MRHD.
Citalopram administrerades oralt till dräktiga kaniner under organogenesperioden i doser upp till 16 mg/kg/dag, vilket är ungefär 8 gånger MRHD på 40 mg, baserat på mg/m² kroppsyta. Ingen maternell eller embryofetal toxicitet observerades. NOAEL för maternell och embryofetal toxicitet är 16 mg/kg/dag, vilket är ungefär 8 gånger MRHD.
Citalopram administrerades oralt till gravida råttor under sen dräktighet och laktationsperioder i doser på 4,8, 12,8 och 32 mg/kg/dag, vilket är ungefär 1, 3 och 8 gånger MRHD på 40 mg, baserat på mg/m² kropp ytarea. Citalopram ökade avkommans dödlighet under de första 4 dagarna av födseln och minskade avkommans tillväxt vid 32 mg/kg/dag, vilket är ungefär 8 gånger MRHD. NOAEL för utvecklingstoxicitet är 12,8 mg/kg/dag, vilket är ungefär 3 gånger MRHD. I en separat studie sågs liknande effekter på avkommans dödlighet och tillväxt när moderdjur behandlades under hela dräktigheten och tidig laktation med doser ≥ 24 mg/kg/dag, vilket är ungefär 6 gånger MRHD. En NOAEL fastställdes inte i den studien.
Laktation
Risksammanfattning
Data från den publicerade litteraturen rapporterar förekomsten av citalopram i modersmjölk vid relativa spädbarnsdoser som sträcker sig mellan 0,7 till 9,4 % av den viktjusterade dosen hos modern och ett förhållande mellan mjölk och plasma mellan 0,78 och 4,3. Det finns rapporter om ammade spädbarn som exponerats för citalopram som upplevt irritabilitet, rastlöshet, överdriven somnolens, minskad matning och viktminskning (se Kliniska överväganden ). Det finns ingen information om effekterna av citalopram på mjölkproduktionen.
De utvecklingsmässiga och hälsomässiga fördelarna med amning bör beaktas tillsammans med moderns kliniska behov av CELEXA 20 mg och eventuella negativa effekter på det ammade barnet från CELEXA 20 mg eller från det underliggande moderns tillståndet.
Kliniska överväganden
Övervaka ammande spädbarn för biverkningar, såsom irritabilitet, rastlöshet, överdriven somnolens, minskad matning och viktminskning.
Pediatrisk användning
Säkerheten och effekten av CELEXA har inte fastställts hos pediatriska patienter. Två placebokontrollerade studier på 407 pediatriska patienter med MDD har utförts med CELEXA 20 mg, och data var inte tillräckliga för att stödja användning hos pediatriska patienter.
Antidepressiva medel ökar risken för suicidtankar och självmordsbeteenden hos pediatriska patienter [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Minskad aptit och viktminskning har observerats i samband med användning av SSRI hos pediatriska patienter.
Geriatrisk användning
Av 4422 patienter i kliniska studier med CELEXA 20 mg var 1357 60 och över, 1034 var 65 och över och 457 var 75 och över. I två farmakokinetiska studier ökade citalopram AUC med 23 % respektive 30 % hos försökspersoner ≥ 60 år jämfört med yngre försökspersoner, och dess halveringstid ökade med 30 % respektive 50 % [se KLINISK FARMAKOLOGI ]. Därför är den maximala rekommenderade dosen för patienter 60 år och äldre lägre än yngre patienter [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
SSRI, inklusive CELEXA, har associerats med fall av kliniskt signifikant hyponatremi hos äldre patienter, som kan löpa större risk för denna biverkning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt leverfunktion
Ökad exponering för citalopram förekommer hos patienter med nedsatt leverfunktion. Den maximala rekommenderade dosen av CELEXA 10 mg är lägre hos patienter med nedsatt leverfunktion [se DOSERING OCH ADMINISTRERING , KLINISK FARMAKOLOGI ].
ÖVERDOS
Följande har rapporterats vid överdosering av Celexa tabletter:
- Kramper, som kan vara försenade, och förändrad mental status inklusive koma.
- Kardiovaskulär toxicitet, som kan vara fördröjd, inklusive QRS- och QTc-intervallförlängning, omfattande komplexa takyarytmier och torsade de pointes. Hypertoni ses vanligast, men kan sällan se hypotoni ensam eller tillsammans med alkohol.
- Serotonergt syndrom (patienter med en överdosering av flera läkemedel med andra proserotonerga läkemedel kan ha en högre risk).
Långvarig hjärtövervakning rekommenderas vid intag av överdosering av Celexa på grund av risken för arytmier. Gastrointestinal dekontaminering med aktivt kol bör övervägas hos patienter som uppträder tidigt efter en Celexa 10 mg överdos. Överväg att kontakta ett giftcenter (1-800-221-2222) eller en medicinsk toxikolog för ytterligare rekommendationer för överdosering.
KONTRAINDIKATIONER
CELEXA är kontraindicerat till patienter:
- tar, eller inom 14 dagar efter att man avslutat, MAO-hämmare (inklusive MAO-hämmare som linezolid eller intravenös metylenblått) på grund av en ökad risk för serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
- tar pimozid på grund av risken för QT-förlängning [se LÄKEMEDELSINTERAKTIONER ].
- med känd överkänslighet mot citalopram eller någon av de inaktiva ingredienserna i CELEXA. Reaktioner har inkluderat angioödem och anafylaxi [se NEGATIVA REAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Verkningsmekanismen för citalopram är oklar, men antas vara relaterad till förstärkning av serotonerg aktivitet i det centrala nervsystemet (CNS) till följd av dess hämning av CNS-neuronalt återupptag av serotonin (5-HT).
Farmakodynamik
In vitro och in vivo studier på djur tyder på att citalopram är en selektiv serotoninåterupptagshämmare (SSRI) med minimala effekter på noradrenalin (NE) och dopamin (DA) neuronalt återupptag.
Citalopram har ingen eller mycket låg affinitet för 5-HT1A, 5-HT2A, dopamin D1 och D2, α1-, α2- och β-adrenerga, histamin H1, gamma-aminosmörsyra (GABA), muskarina kolinerga och bensodiazepinreceptorer.
Hjärtets elektrofysiologi
Individuellt korrigerat QTc (QTcNi) intervall utvärderades i en randomiserad, placebo och aktiv (moxifloxacin 400 mg) kontrollerad cross-over, eskalerande multipeldosstudie på 119 friska försökspersoner. Den maximala medelskillnaden (övre gränsen för 95 % ensidigt konfidensintervall) från placebo var 8,5 (10,8) och 18,5 (21,0) msek för 20 mg respektive 60 mg (1,5 gånger den rekommenderade maximala dosen) citalopram. Baserat på det etablerade exponerings-responssambandet är den förutsagda QTcNi-förändringen från placebo (övre gräns av 95 % ensidigt konfidensintervall) under Cmax för dosen 40 mg 12,6 (14,3) msek [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Farmakokinetik
Citaloprams farmakokinetik för enkel- och flerdos är linjär och dosproportionell i ett dosintervall på 10 till 40 mg/dag. Biotransformation av citalopram är huvudsakligen lever, med en genomsnittlig terminal halveringstid på cirka 35 timmar. Med dosering en gång dagligen uppnås steady state plasmakoncentrationer inom cirka en vecka. Vid steady state förväntas graden av ackumulering av citalopram i plasma, baserat på halveringstiden, vara 2,5 gånger de plasmakoncentrationer som observerats efter en engångsdos.
Absorption
Efter en oral engångsdos (40 mg tablett) av citalopram uppnås toppnivåer i blodet efter cirka 4 timmar. Den absoluta biotillgängligheten av citalopram var cirka 80 % i förhållande till en intravenös dos, och absorptionen påverkas inte av föda.
Distribution
Distributionsvolymen för citalopram är cirka 12 L/kg och bindningen av citalopram (CT), demetylcitalopram (DCT) och didemetylcitalopram (DDCT) till humana plasmaproteiner är cirka 80 %.
Eliminering
Ämnesomsättning
Citalopram metaboliseras till demetylcitalopram (DCT), didemetylcitalopram (DDCT), citalopram-N-oxid och ett deaminerat propionsyraderivat. Hos människor är oförändrat citalopram den dominerande föreningen i plasma. Vid steady state är koncentrationerna av citaloprams metaboliter, DCT och DDCT, i plasma ungefär hälften respektive en tiondel av moderläkemedlet. In vitro-studier visar att citalopram är minst 8 gånger mer potent än dess metaboliter i hämningen av serotoninåterupptag, vilket tyder på att de utvärderade metaboliterna sannolikt inte bidrar signifikant till de antidepressiva effekterna av citalopram.
In vitro-studier med humana levermikrosomer visade att CYP3A4 och CYP2C19 är de primära isozymerna som är involverade i N-demetyleringen av citalopram.
Exkretion
Efter intravenös administrering av citalopram var andelen läkemedel som återfanns i urinen som citalopram och DCT cirka 10 % respektive 5 %. Det systemiska clearance av citalopram var 330 ml/min, med cirka 20 % av det på grund av renalt clearance.
Specifika populationer
Geriatriska patienter
Citaloprams farmakokinetik hos försökspersoner ≥ 60 år jämfördes med yngre försökspersoner i två normala frivilliga studier. I en endosstudie ökade citaloprams AUC och halveringstid hos försökspersoner ≥ 60 år med 30 % respektive 50 %, medan de i en flerdosstudie ökade med 23 % respektive 30 %. ser DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , Användning i specifika populationer ].
Manliga Och Kvinnliga Patienter
I tre farmakokinetiska studier (totalt N=32) var AUC för citalopram hos kvinnor en och en halv till två gånger högre än hos män. Denna skillnad observerades inte i fem andra farmakokinetiska studier (totalt N=114). I kliniska studier sågs inga skillnader i steady state serumnivåer av citalopram mellan män (N=237) och kvinnor (N=388). Det fanns inga könsskillnader i farmakokinetiken för DCT och DDCT.
Patienter med nedsatt leverfunktion
Citalopram oral clearance minskade med 37 % och halveringstiden fördubblades hos patienter med nedsatt leverfunktion jämfört med normala försökspersoner [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , Användning i specifika populationer ].
Patienter med nedsatt njurfunktion
Hos patienter med lätt till måttligt nedsatt njurfunktion minskade oralt clearance av citalopram med 17 % jämfört med normala försökspersoner. Ingen dosjustering rekommenderas för sådana patienter. Ingen information finns tillgänglig om farmakokinetiken för citalopram hos patienter med gravt nedsatt njurfunktion (kreatininclearance
CYP2C19 Dåliga metaboliserare
Hos CYP2C19 dåliga metaboliserare ökade citalopram steady state Cmax och AUC med 68 % respektive 107 % [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
CYP2D6 Dåliga metaboliserare
Citaloprams steady state-nivåer var inte signifikant olika hos låga metaboliserare och omfattande metaboliserare av CYP2D6.
Läkemedelsinteraktionsstudier
In vitro-enzymhämningsdata avslöjade inte en hämmande effekt av citalopram på CYP3A4, -2C9 eller -2E1, men antydde att det är en svag hämmare av CYP1A2, -2D6 och -2C19. Citalopram skulle förväntas ha liten hämmande effekt på in vivo-metabolism medierad av dessa enzymer. In vivo-data för att lösa denna fråga är dock begränsade.
CYP3A4- och CYP2C19-hämmare
Eftersom CYP3A4 och CYP2C19 är de primära enzymerna som är involverade i metabolismen av citalopram, förväntas det att potenta hämmare av CYP3A4 (t.ex. ketokonazol, itrakonazol och makrolidantibiotika) och hämmare av CYP2C19 (t.ex. omeprazol) kan minska clearancen av cimetidin. citalopram. Samtidig administrering av citalopram och den potenta CYP3A4-hämmaren ketokonazol påverkade dock inte farmakokinetiken för citalopram signifikant. 20 mg/dag är den maximala rekommenderade citalopramdosen för patienter som samtidigt tar cimetidin eller annan CYP2C19-hämmare, på grund av risken för QT-förlängning [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Cimetidin
Hos försökspersoner som hade fått 21 dagar med 40 mg/dag CELEXA 10 mg, resulterade kombinerad administrering av 400 mg cimetidin två gånger dagligen i 8 dagar i en ökning av citalopram AUC och Cmax med 43 % respektive 39 % [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
CYP2D6-hämmare
Samtidig administrering av ett läkemedel som hämmar CYP2D6 med citalopram kommer sannolikt inte att ha kliniskt signifikanta effekter på citaloprams metabolism, baserat på studieresultaten hos CYP2D6-fattiga metaboliserare.
Digoxin
Hos försökspersoner som hade fått 21 dagar med 40 mg/dag CELEXA 20 mg, påverkade kombinerad administrering av CELEXA och digoxin (engångsdos på 1 mg) inte farmakokinetiken för varken citalopram eller digoxin signifikant.
Litium
Samtidig administrering av CELEXA (40 mg/dag i 10 dagar) och litium (30 mmol/dag i 5 dagar) hade ingen signifikant effekt på farmakokinetiken för citalopram eller litium.
Pimozide
en kontrollerad studie var en engångsdos av pimozid 2 mg administrerad samtidigt med citalopram 40 mg givet en gång dagligen i 11 dagar associerad med en genomsnittlig ökning av QTc-värden på cirka 10 msek jämfört med pimozid givet ensamt. Citalopram förändrade inte medel-AUC eller Cmax för pimozid. Mekanismen för denna farmakodynamiska interaktion är inte känd [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Teofyllin
Kombinerad administrering av CELEXA (40 mg/dag i 21 dagar) och CYP1A2-substratet teofyllin (engångsdos på 300 mg) påverkade inte farmakokinetiken för teofyllin. Effekten av teofyllin på farmakokinetiken för citalopram har inte utvärderats.
Warfarin
Administrering av 40 mg/dag CELEXA under 21 dagar påverkade inte farmakokinetiken för warfarin, ett CYP3A4-substrat. Protrombintiden ökade med 5 %, vars kliniska betydelse är okänd.
Karbamazepin
Kombinerad administrering av CELEXA (40 mg/dag i 14 dagar) och karbamazepin (titrerat till 400 mg/dag i 35 dagar) påverkade inte signifikant farmakokinetiken för karbamazepin, ett CYP3A4-substrat. Även om bottennivåer av citalopram i plasma var opåverkade, med tanke på de enzyminducerande egenskaperna hos karbamazepin, bör möjligheten att karbamazepin kan öka clearance av citalopram övervägas om de två läkemedlen ges samtidigt.
Triazolam
Kombinerad administrering av CELEXA (titrerat till 40 mg/dag i 28 dagar) och CYP3A4-substratet triazolam (engångsdos på 0,25 mg) påverkade inte farmakokinetiken för varken citalopram eller triazolam signifikant.
Ketokonazol
Kombinerad administrering av CELEXA (40 mg) och ketokonazol (200 mg) minskade Cmax och AUC för ketokonazol med 21 % respektive 10 % och påverkade inte farmakokinetiken för citalopram signifikant.
Metoprolol
Administrering av 40 mg/dag CELEXA 20 mg under 22 dagar resulterade i en tvåfaldig ökning av plasmanivåerna av den betaadrenerga blockeraren metoprolol. Ökade plasmanivåer av metoprolol har associerats med minskad kardioselektivitet. Samtidig administrering av CELEXA 10 mg och metoprolol hade inga kliniskt signifikanta effekter på blodtryck eller hjärtfrekvens.
Imipramin och andra tricykliska antidepressiva medel (TCA)
In vitro-studier tyder på att citalopram är en relativt svag hämmare av CYP2D6. Samtidig administrering av CELEXA (40 mg/dag i 10 dagar) med TCA imipramin (engångsdos på 100 mg), ett substrat för CYP2D6, påverkade inte signifikant plasmakoncentrationerna av imipramin eller citalopram. Koncentrationen av imipraminmetaboliten desipramin ökade dock med cirka 50 %. Den kliniska betydelsen av desipraminförändringen är okänd.
Djurtoxikologi och/eller farmakologi
Näthinneförändringar hos råttor
Patologiska förändringar (degeneration/atrofi) observerades i näthinnan hos albinoråttor i den 2-åriga karcinogenicitetsstudien med citalopram. Det fanns en ökning av både incidensen och svårighetsgraden av retinal patologi hos både han- och honråttor som fick 80 mg/kg/dag, vilket är cirka 19 gånger MRHD på 40 mg baserat på mg/m² kroppsyta. Liknande fynd fanns inte hos råttor som behandlats under två år med dosen 24 mg/kg/dag, hos möss som behandlats i 18 månader i doser upp till 240 mg/kg/dag, eller hos hundar som behandlats under ett år med doser upp till 20 mg/kg/dag, vilket är cirka 6, 29 respektive 17 gånger MRHD, baserat på mg/m² kroppsyta.
Ytterligare studier för att undersöka mekanismen för denna patologi har inte utförts, och den potentiella betydelsen av denna effekt hos människor har inte fastställts.
Kliniska studier
Effekten av CELEXA som behandling för egentlig depression fastställdes i två placebokontrollerade studier (med 4 till 6 veckors varaktighet) på vuxna polikliniska patienter (åldrar 18-66) som uppfyller DSM-III- eller DSM-III-R-kriterierna för svår depression. störning (MDD) (Studier 1 och 2).
Studie 1, en 6-veckors studie där patienterna fick fasta CELEXA 10 mg doser på 10 mg, 20 mg, 40 mg och 60 mg dagligen, visade att CELEXA 40 dagligen och 60 mg dagligen (1,5 gånger den maximala rekommenderade dagliga dosen) var effektiv mätt med Hamilton Depression Rating Scale (HAMD) totalpoäng, det primära effektmåttet. HAMD-17 är en klinikerklassad skala med 17 punkter som används för att bedöma svårighetsgraden av depressiva symtom. Poäng på HAMD-17 sträcker sig från 0 till 52, med högre poäng tyder på svårare depression. Denna studie visade ingen tydlig effekt av 10 mg och 20 mg dagliga doserna, och 60 mg dagliga dosen var inte mer effektiv än 40 mg daglig dos. På grund av risken för QTc-förlängning och ventrikulära arytmier är den maximala rekommenderade dosen av CELEXA 10 mg 40 mg en gång dagligen.
studie 2, en 4-veckors, placebokontrollerad studie på patienter med MDD, var startdosen 20 mg dagligen, följt av titrering till den maximalt tolererade dosen eller en maximal dos på 80 mg dagligen (2 gånger den maximala rekommenderade dagliga dosen ). Patienter som behandlats med CELEXA 20 mg visade statistiskt signifikant större förbättring än placebopatienter på HAMD-totalpoängen, det primära effektmåttet. I ytterligare tre placebokontrollerade studier på patienter med MDD var skillnaden i behandlingssvar mellan patienter som fick CELEXA och patienter som fick placebo inte statistiskt signifikant.
två långtidsstudier randomiserades patienter med MDD som hade svarat på CELEXA 10 mg under en första 6 eller 8 veckors akut behandling till fortsatt behandling med CELEXA 10 mg eller placebo. I en studie fick patienterna fasta doser av CELEXA 20 mg eller 40 mg dagligen och i den andra studien fick patienterna flexibla doser av CELEXA 20 mg dagligen till 60 mg dagligen (1,5 gånger den maximala rekommenderade dagliga dosen). I båda studierna upplevde patienter som fick fortsatt CELEXA-behandling statistiskt signifikant lägre återfallsfrekvenser under de efterföljande 6 månaderna jämfört med de som fick placebo. I studien med fast dos var den minskade frekvensen av återfall av depression liknande hos patienter som fick 20 mg eller 40 mg dagligen av CELEXA. På grund av risken för QTc-förlängning och ventrikulära arytmier är den maximala rekommenderade dosen av CELEXA 20 mg 40 mg en gång dagligen.
Analyser av sambandet mellan behandlingsresultat och ålder, kön och ras antydde inte någon differentiell respons på basis av dessa patientegenskaper.
PATIENTINFORMATION
CELEXA® (Suh-leks-uh) (citalopram) Tabletter, för oral användning
Vilken är den viktigaste informationen jag borde veta om CELEXA?
CELEXA 20mg kan orsaka allvarliga biverkningar, inklusive:
- Ökad risk för självmordstankar och -handlingar. CELEXA 10mg och andra antidepressiva läkemedel kan öka självmordstankar och -handlingar hos vissa barn, ungdomar och unga vuxna speciellt under de första månaderna av behandlingen eller när dosen ändras. CELEXA ska inte användas till barn.
- Depression och andra psykiska sjukdomar är de viktigaste orsakerna till självmordstankar och -handlingar.
Hur kan jag se efter och försöka förebygga självmordstankar och -handlingar hos mig själv eller en familjemedlem?
- Var uppmärksam på alla förändringar, särskilt plötsliga förändringar i humör, beteende, tankar eller känslor, eller om du utvecklar självmordstankar eller -handlingar. Detta är mycket viktigt när ett antidepressivt läkemedel påbörjas eller när dosen ändras.
- Ring din vårdgivare direkt för att rapportera nya eller plötsliga förändringar i humör, beteende, tankar eller känslor.
- Håll alla uppföljningsbesök hos din vårdgivare som planerat. Ring din vårdgivare mellan besöken vid behov, särskilt om du är orolig för symtom.
Ring din vårdgivare eller få akut medicinsk hjälp omedelbart om du eller din familjemedlem har något av följande symtom, särskilt om de är nya, värre eller oroar dig:
- tankar om självmord eller att dö
- ny eller värre depression
- känner sig väldigt upprörd eller rastlös
- sömnsvårigheter (sömnlöshet)
- agerar aggressivt, är arg eller våldsam
- en extrem ökning av aktivitet eller prat (mani)
- försök att begå självmord
- ny eller värre ångest
- agerar på farliga impulser
- panikattacker
- ny eller värre irritabilitet
- andra ovanliga förändringar i beteende eller humör
Vad är CELEXA?
CELEXA 10mg är ett receptbelagt läkemedel som används för att behandla en viss typ av depression som kallas Major Depressive Disorder (MDD) hos vuxna.
Det är inte känt om CELEXA 10mg är säkert och effektivt för barn.
Vem ska inte ta CELEXA?
Ta inte CELEXA om du:
- ta en monoaminoxidashämmare (MAO-hämmare)
- har slutat ta en MAO-hämmare under de senaste 14 dagarna
- behandlas med antibiotikumet linezolid eller intravenöst metylenblått
- ta pimozid
- är allergisk mot citalopram eller något av innehållsämnena i CELEXA. Se slutet av denna medicinguide för en komplett lista över ingredienser i CELEXA.
Fråga din vårdgivare eller apotekspersonal om du är osäker på om du tar en MAO-hämmare, inklusive MAO-hämmare som linezolid eller intravenös metylenblått.
Börja inte ta en MAO-hämmare på minst 14 dagar efter att du avslutat behandlingen med CELEXA.
Innan du tar CELEXA, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har eller har en familjehistoria av självmord, depression, bipolär sjukdom, mani eller hypomani
- har en onormal hjärtrytm som kallas QT-förlängning
- har eller haft hjärtproblem, inklusive hjärtinfarkt, hjärtsvikt, onormal hjärtrytm eller långt QT-syndrom
- har låga nivåer av kalium, magnesium eller natrium i blodet
- har eller haft blödningsproblem
- har eller haft kramper (kramper)
- har högt tryck i ögat (glaukom)
- har eller haft njur- eller leverproblem
- är gravid eller planerar att bli gravid. CELEXA 20 mg kan skada ditt ofödda barn. Att ta CELEXA sent under graviditeten kan leda till en ökad risk för vissa problem hos ditt nyfödda barn. Prata med din vårdgivare om riskerna och fördelarna med att behandla depression under graviditeten.
- Berätta omedelbart för din vårdgivare om du blir gravid eller tror att du kan vara gravid under behandling med CELEXA.
- Det finns ett graviditetsregister för kvinnor som exponeras för CELEXA under graviditeten. Syftet med registret är att samla in information om hälsan hos kvinnor som exponerats för CELEXA och deras barn. Om du blir gravid under behandling med CELEXA 10 mg, prata med din vårdgivare om att registrera dig hos National Pregnancy Registry for Antidepressants. Du kan registrera dig genom att ringa 1-844-405-6185 eller besöka online på https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- ammar eller planerar att amma. Det är inte känt om CELEXA går över i din bröstmjölk. Prata med din vårdgivare om det bästa sättet att mata ditt barn under behandlingen med CELEXA.
- Om du ammar under behandling med CELEXA 20 mg, kontakta din vårdgivare omedelbart om ditt barn utvecklar sömnighet eller krångel, eller inte äter eller går upp i vikt.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
CELEXA 10 mg och andra läkemedel kan påverka varandra och orsaka allvarliga biverkningar. CELEXA kan påverka hur andra läkemedel fungerar och andra läkemedel kan påverka hur CELEXA fungerar.
Berätta särskilt för din vårdgivare om du tar:
- läkemedel som används för att behandla migränhuvudvärk som kallas triptaner
- tricykliska antidepressiva medel
- fentanyl
- litium
- tramadol
- tryptofan
- buspiron
- amfetamin
- Johannesört
- läkemedel som kan påverka blodets koagulering såsom aspirin, icke-steroida antiinflammatoriska läkemedel (NSAID) och warfarin
- diuretika
- metadon
- gatifloxacin eller moxifloxacin
- läkemedel som används för att kontrollera din hjärtfrekvens eller rytm (antiarytmika)
- läkemedel som används för att behandla humör, ångest, psykotiska störningar eller tankestörningar, inklusive selektiva serotoninåterupptagshämmare (SSRI) och serotonin noradrenalin återupptagshämmare (SNRI)
Fråga din vårdgivare om du inte är säker på om du tar något av dessa läkemedel. Din vårdgivare kan berätta för dig om det är säkert att ta CELEXA 10 mg tillsammans med dina andra läkemedel.
Starta eller sluta inte med några andra läkemedel under behandling med CELEXA utan att först prata med din läkare. Om du plötsligt slutar med CELEXA kan du få allvarliga biverkningar. Ser, "Vilka är de möjliga biverkningarna av CELEXA?"
Vet vilka mediciner du tar. Håll en lista över dem att visa för din vårdgivare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta CELEXA 10mg?
- Ta CELEXA 20mg exakt som din läkare säger åt dig att ta det. Ändra inte din dos eller sluta ta CELEXA utan att först prata med din läkare.
- Din vårdgivare kan behöva ändra dosen av CELEXA tills det är rätt dos för dig.
- Ta CELEXA 1 gång varje dag med eller utan mat.
- Om du tar för mycket CELEXA 20mg, ring din vårdgivare eller giftkontrollcentral på 1-800-222-1222, eller gå till närmaste akutmottagning direkt.
Vilka är de möjliga biverkningarna av CELEXA 20mg?
CELEXA kan orsaka allvarliga biverkningar, inklusive:
- Ser, "Vad är den viktigaste informationen jag borde veta om CELEXA?"
- Hjärtrytmproblem. CELEXA kan orsaka en allvarlig förändring i ditt hjärtslag (en snabb eller oregelbunden hjärtrytm) som kan orsaka dödsfall. Berätta omedelbart för din vårdgivare om du känner dig svimfärdig eller svimmar, eller om du har en förändring i ditt hjärtslag.
- Serotonergt syndrom. Att ta CELEXA kan orsaka ett potentiellt livshotande problem som kallas serotonergt syndrom. Risken för att utveckla serotonergt syndrom ökar när CELEXA 20 mg tas tillsammans med vissa andra läkemedel. Ser, "Vem ska inte ta CELEXA?" Ring din vårdgivare eller gå till närmaste akutmottagning direkt om du har något av följande tecken och symtom på serotonergt syndrom:
- agitation
- se eller höra saker som inte är verkliga (hallucinationer)
- förvirring
- koma
- snabb hjärtslag
- blodtrycksförändringar
- yrsel
- svettas
- spolning
- hög kroppstemperatur (hypertermi)
- skakningar, stela muskler eller muskelryckningar
- förlust av koordination
- anfall
- illamående, kräkningar, diarré
- Ökad risk för blödning. Att ta CELEXA 20 mg tillsammans med acetylsalicylsyra, icke-steroida antiinflammatoriska läkemedel (NSAID), warfarin eller blodförtunnande medel kan öka denna risk. Berätta omedelbart för din vårdgivare om eventuella ovanliga blödningar eller blåmärken.
- Maniska episoder. Maniska episoder kan inträffa hos personer med bipolär sjukdom som tar CELEXA. Symtom kan inkludera:
- kraftigt ökad energi
- svåra sömnproblem
- racing tankar
- hänsynslöst beteende
- ovanligt storslagna idéer
- överdriven lycka eller irritabilitet
- prata mer eller snabbare än vanligt
- Utsättningssyndrom. Om du plötsligt stoppar CELEXA 20 mg kan du få allvarliga biverkningar. Din vårdgivare kanske vill minska din dos långsamt. Symtom kan inkludera:
- illamående
- svettas
- förändringar i ditt humör
- huvudvärk
- irritabilitet och agitation
- trötthet
- yrsel
- problem med att sova
- känsla av elektrisk stöt (parestesi)
- hypomani
- ångest
- ringningar i öronen (tinnitus)
- förvirring
- anfall
- Kramper (kramper).
- Ögonproblem (stängningsvinkelglaukom). Många antidepressiva läkemedel, inklusive CELEXA, kan orsaka en viss typ av ögonproblem som kallas förslutningsvinkelglaukom. Ring din vårdgivare om du har förändringar i din syn eller ögonsmärta.
- Låga natriumnivåer i ditt blod (hyponatremi). Låga natriumnivåer i ditt blod kan vara allvarliga och kan orsaka dödsfall. Äldre människor kan löpa större risk för detta. Berätta omedelbart för din vårdgivare om du får några tecken eller symtom på låga natriumnivåer i blodet under behandling med CELEXA. Tecken och symtom på låga natriumnivåer i ditt blod kan vara:
- huvudvärk
- koncentrationssvårigheter
- minnesförändringar
- förvirring
- svaghet och ostadighet på fötterna som kan leda till fall
I allvarliga eller mer plötsliga fall inkluderar tecken och symtom:
-
- hallucinationer (att se eller höra saker som inte är verkliga)
- svimning
- anfall
- koma
- att sluta andas
- död
- Sexuella problem (dysfunktion). Att ta selektiva serotoninåterupptagshämmare (SSRI), inklusive CELEXA, kan orsaka sexuella problem.
Symtom hos män kan inkludera:
- Försenad utlösning eller oförmåga att få utlösning
- Minskad sexlust
- Problem att få eller behålla erektion
Symtom hos kvinnor kan inkludera:
- Minskad sexlust
- Försenad orgasm eller oförmåga att få orgasm
Tala med din vårdgivare om du utvecklar några förändringar i din sexuella funktion eller om du har några frågor eller funderingar kring sexuella problem under behandling med DRIZALMA SPRINKLE. Det kan finnas behandlingar som din vårdgivare kan föreslå.
Den vanligaste biverkningen av CELEXA är fördröjd ejakulation.
Dessa är inte alla möjliga biverkningar av CELEXA.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara CELEXA?
- Förvara CELEXA i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
- Förvara CELEXA 20 mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av CELEXA
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte CELEXA 20 mg för ett tillstånd som det inte ordinerats för. Ge inte CELEXA till andra personer, även om de har samma symtom som du har. Det kan skada dem. Du kan fråga din vårdgivare eller apotekspersonal om information om CELEXA som är skriven för vårdpersonal.
Vilka är ingredienserna i CELEXA?
Aktiv beståndsdel: citalopramhydrobromid
Inaktiva Ingredienser: kopolyvidon, majsstärkelse, korskarmellosnatrium, glycerin, laktosmonohydrat, magnesiumstearat, hypromellos, mikrokristallin cellulosa, polyetylenglykol, titandioxid och järndioxid för färgning.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
