Voltaren 100mg, 50mg Diclofenac Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Voltaren och hur används det?
Voltaren används för att behandla symtom på smärta i samband med reumatoid artrit, artros, ankyloserande spondylit, dysmenorré och mild till måttlig smärta. Voltaren 100mg kan användas ensamt eller tillsammans med andra läkemedel.
Voltaren tillhör en klass av läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID).
Vilka är de möjliga biverkningarna av Voltaren 50mg?
Voltaren kan orsaka allvarliga biverkningar inklusive:
- huvudvärk,
- hunger,
- svettas,
- irritabilitet,
- yrsel,
- illamående,
- snabb puls,
- känner sig orolig eller skakig,
- domningar eller stickningar i händer, armar, ben eller fötter,
- svaghet i dina armar, händer, ben eller fötter,
- brännande smärta i armar, händer, ben eller fötter,
- allvarliga humör- eller beteendeförändringar,
- nervositet,
- förvirring,
- agitation,
- paranoia,
- hallucinationer,
- minnesproblem,
- koncentrationssvårigheter,
- tankar på självmord,
- senor bristning,
- plötslig smärta,
- svullnad,
- blåmärken,
- ömhet,
- styvhet,
- rörelseproblem,
- ett knäppande eller knäppande ljud i någon av dina leder,
- svåra magsmärtor,
- diarré som är vattnig eller blodig,
- fladdrande i ditt bröst,
- andnöd,
- hudutslag,
- andningsproblem,
- kramper (kramper),
- svår huvudvärk,
- synproblem,
- smärta bakom dina ögon,
- ont i övre magen,
- aptitlöshet,
- mörk urin,
- lerfärgade pallar, och
- gulfärgning av huden eller ögonen (gulsot)
et medicinsk hjälp omedelbart, om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Voltaren inkluderar:
- dålig matsmältning,
- gas,
- magont,
- illamående,
- kräkningar,
- diarre,
- förstoppning,
- huvudvärk,
- yrsel,
- dåsighet,
- Täppt i näsan,
- klåda,
- ökad svettning,
- ökat blodtryck och
- svullnad eller smärta i dina armar eller ben
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Voltaren. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
HEPATOTOXICITET, HJÄRTTOXICITET, EMBRYO-FETAL TOXICITET
Kardiovaskulära trombotiska händelser
- Icke-steroida antiinflammatoriska läkemedel (NSAID) orsakar en ökad risk för allvarliga kardiovaskulära trombotiska händelser, inklusive hjärtinfarkt och stroke, som kan vara dödlig. Denna risk kan uppstå tidigt i behandlingen och kan öka med användningstiden (se VARNINGAR).
- VOLTAREN® är kontraindicerat vid kranskärlsbypassoperationer (CABG) (se KONTRAINDIKATIONER, VARNINGAR).
Gastrointestinal blödning, sårbildning och perforering
- NSAID orsakar en ökad risk för allvarliga gastrointestinala (GI) biverkningar inklusive blödning, sårbildning och perforering av magen eller tarmarna, vilket kan vara dödligt. Dessa händelser kan inträffa när som helst under användning och utan varningssymptom. Äldre patienter och patienter med en tidigare historia av magsår och/eller GI-blödning löper större risk för allvarliga GI-händelser. (se VARNINGAR).
BESKRIVNING
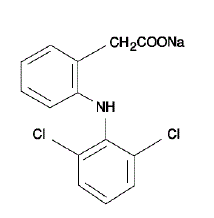
VOLTAREN® (diklofenaknatrium enterodragerade tabletter) är ett bensen-ättiksyraderivat. VOLTAREN 50 mg finns som tabletter med fördröjd frisättning (enterisk dragerade) om 75 mg (ljusrosa) för oral administrering. Diklofenaknatrium är ett vitt eller svagt gulaktigt kristallint pulver och är svårlösligt i vatten vid 25°C. Det kemiska namnet är 2-[(2,6-diklorfenyl)amino]bensenättiksyra, mononatriumsalt. Molekylvikten är 318,14. Dess molekylformel är C14H10Cl2NNaO2, och den har följande strukturformel
De inaktiva ingredienserna i VOLTAREN inkluderar: hydroxipropylmetylcellulosa, järnoxid, laktos, magnesiumstearat, metakrylsyrasampolymer, mikrokristallin cellulosa, polyetylenglykol, povidon, propylenglykol, natriumhydroxid, natriumstärkelseglykolat, talk, titandioxid.
INDIKATIONER
Överväg noga de potentiella fördelarna och riskerna med VOLTAREN® (diklofenaknatrium enterodragerade tabletter) och andra behandlingsalternativ innan du bestämmer dig för att använda VOLTAREN. Använd den lägsta effektiva dosen för den kortaste varaktigheten som överensstämmer med individuella patientbehandlingsmål (se VARNINGAR ; Gastrointestinala blödningar , Sårbildning , och Perforering ).
VOLTAREN indikeras:
- för lindring av tecken och symtom på artros
- för lindring av tecken och symtom på reumatoid artrit
- för akut eller långvarig användning för att lindra tecken och symtom på ankyloserande spondylit
DOSERING OCH ADMINISTRERING
Överväg noga de potentiella fördelarna och riskerna med VOLTAREN® (diklofenaknatrium enterodragerade tabletter) och andra behandlingsalternativ innan du bestämmer dig för att använda VOLTAREN. Använd den lägsta effektiva dosen för den kortaste varaktigheten som överensstämmer med individuella patientbehandlingsmål (se VARNINGAR ; Gastrointestinal blödning, sårbildning och perforering ).
Efter att ha observerat svaret på initial behandling med VOLTAREN 100 mg, bör dosen och frekvensen justeras för att passa en individuell patients behov.
För lindring av artros är den rekommenderade dosen 100 till 150 mg/dag i uppdelade doser (50 mg två gånger om dagen eller tre gånger om dagen, eller 75 mg två gånger om dagen).
För lindring av reumatoid artrit är den rekommenderade dosen 150 till 200 mg/dag i uppdelade doser (50 mg tre gånger om dagen. eller fyra gånger om dagen, eller 75 mg två gånger om dagen.).
För lindring av ankyloserande spondylit är den rekommenderade dosen 100 till 125 mg/dag, administrerad som 25 mg fyra gånger om dagen, med en extra 25 mg dos vid sänggåendet vid behov.
Olika formuleringar av diklofenak [VOLTAREN® (diklofenaknatrium enterodragerade tabletter); VOLTAREN®ÂXR (diklofenaknatrium tabletter med förlängd frisättning); CATAFLAM® (diklofenakkalium tabletter med omedelbar frisättning)] är inte nödvändigtvis bioekvivalenta även om milligramstyrkan är densamma.
HUR LEVERERAS
VOLTAREN® (diklofenaknatrium enterodragerade tabletter) - 75 mg
Ljusrosa, bikonvexa, triangulära, enterodragerade tabletter (märkta med "VOLTAREN 75" på ena sidan med svart bläck)
100 flaskor NDC 0028-0264-01
Förvara i rumstemperatur 20°C till 25°C (68°F till 77°F); utflykter tillåtna mellan 15°C och 30°C (59°F och 86°F) [se USP-kontrollerad rumstemperatur ].
Skydda mot fukt. Fördela i tät behållare (USP).
Distribuerat av: Novartis Pharmaceuticals Corporation East Hanover, NJ 07936. Reviderad: apr 2021
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Kardiovaskulära trombotiska händelser (se VARNINGAR )
- GI-blödning, sår och perforering (se VARNINGAR )
- Hepatotoxicitet (se VARNINGAR )
- Hypertoni (se VARNINGAR )
- Hjärtsvikt och ödem (se VARNINGAR )
- Njurtoxicitet och hyperkalemi (se VARNINGAR )
- Anafylaktiska reaktioner (se VARNINGAR )
- Allvarliga hudreaktioner (se VARNINGAR )
- Hematologisk toxicitet (se VARNINGAR )
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Hos patienter som tar VOLTAREN® (diklofenaknatrium enterodragerade tabletter) eller andra NSAID, är de vanligaste rapporterade biverkningarna som inträffar hos cirka 1 % till 10 % av patienterna: Gastrointestinala upplevelser, inklusive: buksmärtor, förstoppning, diarré, dyspepsi, flatulens, grov blödning/perforation, halsbränna, illamående, mag-/duodenalsår och kräkningar.
Onormal njurfunktion, anemi, yrsel, ödem, förhöjda leverenzymer, huvudvärk, ökad blödningstid, klåda, utslag och tinnitus. Ytterligare negativa upplevelser som rapporteras ibland inkluderar:
Kroppen som helhet: feber, infektion, sepsis
Kardiovaskulära systemet: kongestiv hjärtsvikt, högt blodtryck, takykardi, synkope
Matsmältningssystemet: muntorrhet, esofagit, mag-/peptiska sår, gastrit, gastrointestinala blödningar, glossit, hematemes, hepatit, gulsot
Hemiska och lymfatiska systemet: ekkymos, eosinofili, leukopeni, melena, purpura, rektal blödning, stomatit, trombocytopeni
Metaboliskt och näringsmässigt: viktförändringar
Nervsystem: ångest, asteni, förvirring, depression, drömavvikelser, dåsighet, sömnlöshet, sjukdomskänsla, nervositet, parestesi, somnolens, skakningar, yrsel
Andningssystem: astma, dyspné
Hud och bihang: alopeci, ljuskänslighet, ökad svettning
Särskilda sinnen: suddig syn
Urogenitala systemet: cystit, dysuri, hematuri, interstitiell nefrit, oliguri/polyuri, proteinuri, njursvikt
Andra biverkningar som förekommer sällan är:
Kroppen som helhet: anafylaktiska reaktioner, aptitförändringar, död
Kardiovaskulära systemet: arytmi, hypotoni, hjärtinfarkt, hjärtklappning, vaskulit
Matsmältningssystemet: kolit, utslag, fulminant hepatit med och utan gulsot, leversvikt, levernekros, pankreatit
Hemiska och lymfatiska systemet: agranulocytos, hemolytisk anemi, aplastisk anemi, lymfadenopati, pancytopeni
Metaboliskt och näringsmässigt: hyperglykemi
Nervsystem: kramper, koma, hallucinationer, hjärnhinneinflammation
Andningssystem: andningsdepression, lunginflammation
Hud och bihang: angioödem, toxisk epidermal nekrolys, erythema multiforme, exfoliativ dermatit, Stevens-Johnsons syndrom, urtikaria
Särskilda sinnen: konjunktivit, hörselnedsättning
ÖVERDOS
Symtom efter akuta NSAID-överdoseringar har vanligtvis begränsats till slöhet, dåsighet, illamående, kräkningar och epigastrisk smärta, som i allmänhet har varit reversibla med stödbehandling. Gastrointestinal blödning har inträffat. Hypertoni, akut njursvikt, andningsdepression och koma har förekommit, men var sällsynta (se VARNINGAR ; Kardiovaskulära trombotiska händelser, gastrointestinala blödningar, sårbildning och hypertoni, njurtoxicitet och hyperkalemi ).
Hantera patienter med symtomatisk och stödjande vård efter en överdosering av NSAID. Det finns inga specifika motgift. Överväg kräkning och/eller aktivt kol (60 till 100 gram hos vuxna, 1 till 2 gram per kg kroppsvikt hos pediatriska patienter) och/eller osmotisk katartisk hos symtomatiska patienter som ses inom fyra timmar efter intag eller hos patienter med en stor överdos ( 5 till 10 gånger den rekommenderade dosen). Påtvingad diures, alkalinisering av urin, hemodialys eller hemoperfusion kanske inte är användbara på grund av hög proteinbindning.
För ytterligare information om överdoseringsbehandling, kontakta en giftkontrollcentral (1-800-222-1222).
LÄKEMEDELSINTERAKTIONER
Se tabell 2 för kliniskt signifikanta läkemedelsinteraktioner med diklofenak.
VARNINGAR
Kardiovaskulära trombotiska händelser
Kliniska prövningar av flera COX-2 selektiva och icke-selektiva NSAID med en varaktighet på upp till 3 år har visat en ökad risk för allvarliga kardiovaskulära (CV) trombotiska händelser, inklusive hjärtinfarkt (MI) och stroke, som kan vara dödlig. Baserat på tillgängliga data är det oklart att risken för CV-trombotiska händelser är liknande för alla NSAID. Den relativa ökningen av allvarliga CV-trombotiska händelser jämfört med baslinjen till följd av NSAID-användning tycks vara liknande hos de med och utan känd CV-sjukdom eller riskfaktorer för CV-sjukdom. Patienter med känd CV-sjukdom eller riskfaktorer hade dock en högre absolut incidens av alltför allvarliga CV-trombotiska händelser, på grund av deras ökade baslinjefrekvens. Vissa observationsstudier fann att denna ökade risk för allvarliga CV-trombotiska händelser började redan under de första veckorna av behandlingen. Ökningen av CV-trombotisk risk har observerats mest konsekvent vid högre doser.
För att minimera den potentiella risken för en negativ CV-händelse hos NSAID-behandlade patienter, använd den lägsta effektiva dosen under kortast möjliga varaktighet. Läkare och patienter bör vara uppmärksamma på utvecklingen av sådana händelser, under hela behandlingsförloppet, även i frånvaro av tidigare CV-symtom. Patienter bör informeras om symtomen på allvarliga CV-händelser och de åtgärder som ska vidtas om de inträffar.
Det finns inga konsekventa bevis för att samtidig användning av aspirin minskar den ökade risken för allvarliga CV-trombotiska händelser i samband med NSAID-användning. Samtidig användning av aspirin och ett NSAID, såsom diklofenak, ökar risken för allvarliga gastrointestinala (GI) händelser (se VARNINGAR ; Gastrointestinala blödningar , Sårbildning , och Perforering ).
Status efter kranskärlsbypassoperation (CABG).
Två stora, kontrollerade, kliniska prövningar av ett COX-2-selektivt NSAID för behandling av smärta under de första 10 till 14 dagarna efter CABG-operation fann en ökad incidens av hjärtinfarkt och stroke. NSAID är kontraindicerade vid CABG (se KONTRAINDIKATIONER ).
Patienter efter MI
Observationsstudier utförda i det danska nationella registret har visat att patienter som behandlats med NSAID under perioden efter MI löpte ökad risk för reinfarkt, CV-relaterad död och dödlighet av alla orsaker med början under den första behandlingsveckan. I samma kohort var incidensen av dödsfall under det första året efter MI 20 per 100 personår hos NSAID-behandlade patienter jämfört med 12 per 100 personår hos icke-NSAID-exponerade patienter. Även om den absoluta dödsfrekvensen minskade något efter det första året efter MI, kvarstod den ökade relativa risken för död hos NSAID-användare under åtminstone de kommande fyra åren av uppföljning.
Undvik användning av VOLTAREN hos patienter med nyligen infekterad hjärtinfarkt, såvida inte fördelarna förväntas uppväga risken för återkommande CV-trombotiska händelser. Om VOLTAREN används till patienter med nyligen hjärtinfarkt, övervaka patienterna för tecken på hjärtischemi.
Gastrointestinal blödning, sårbildning och perforering
NSAID, inklusive diklofenak, orsakar allvarliga gastrointestinala (GI) biverkningar, inklusive inflammation, blödning, sårbildning och perforering av matstrupen, magen, tunntarmen eller tjocktarmen, vilket kan vara dödligt. Dessa allvarliga biverkningar kan inträffa när som helst, med eller utan varningssymtom, hos patienter som behandlas med NSAID. Endast en av fem patienter, som utvecklar en allvarlig övre GI-biverkning under NSAID-behandling, är symtomatisk. Övre gastrointestinala sår, grov blödning eller perforation orsakad av NSAID förekom hos cirka 1 % av patienterna som behandlades under 3 till 6 månader och hos cirka 2 % till 4 % av patienterna som behandlades under ett år. Men även korttidsbehandling är inte utan risk.
Riskfaktorer för GI-blödning, sårbildning och perforering
Patienter med magsår och/eller gastrointestinala blödningar i anamnesen som använder NSAID hade en mer än 10 gånger ökad risk för att utveckla en gastrointestinala blödning jämfört med patienter utan dessa riskfaktorer. Andra faktorer som ökar risken för GI-blödning hos patienter som behandlas med NSAID inkluderar längre behandling med NSAID, samtidig användning av orala kortikosteroider, aspirin, antikoagulantia eller selektiva serotoninåterupptagshämmare (SSRI); rökning, användning av alkohol, högre ålder och dåligt allmänt hälsotillstånd. De flesta rapporter om dödliga gastrointestinala händelser efter marknadsföring inträffade hos äldre eller försvagade patienter. Dessutom löper patienter med avancerad leversjukdom och/eller koagulopati en ökad risk för GI-blödning.
Strategier för att MINIMERA GI-riskerna hos NSAID-behandlade patienter
- Använd den lägsta effektiva dosen under kortast möjliga varaktighet.
- Undvik administrering av mer än ett NSAID åt gången
- Undvik användning till patienter med högre risk om inte fördelarna förväntas uppväga den ökade risken för blödning. För sådana patienter, såväl som de med aktiv GI-blödning, överväg alternativa terapier än NSAID.
- Var uppmärksam på tecken och symtom på magsår och blödning under NSAID-behandling.
- Om en allvarlig GI-biverkning misstänks, initiera omedelbart utvärdering och behandling och avbryt VOLTAREN 50 mg tills en allvarlig GI-biverkning är utesluten.
- Vid samtidig användning av lågdos acetylsalicylsyra för hjärtprofylax, övervaka patienterna noggrannare för tecken på GI-blödning (se FÖRSIKTIGHETSÅTGÄRDER ; Läkemedelsinteraktioner ).
Hepatotoxicitet
I kliniska prövningar av diklofenak-innehållande produkter observerades betydelsefulla förhöjningar (dvs. mer än 3 gånger den övre normalgränsen [ULN]) av aspartataminotransferas (ASAT) (även känd som SGOT) hos cirka 2 % av cirka 5700 patienter vid någon tid under diklofenakbehandling (alaninaminotransferas [ALT] mättes inte i alla studier).
en stor, öppen, kontrollerad studie med 3700 patienter behandlade med oralt diklofenaknatrium under 2 till 6 månader, övervakades patienterna först efter 8 veckor och 1200 patienter övervakades igen efter 24 veckor. Meningsfulla förhöjningar av ALAT och/eller ASAT inträffade hos cirka 4 % av patienterna och inkluderade markanta förhöjningar (större än 8 gånger ULN) hos cirka 1 % av de 3700 patienterna. I den öppna studien observerades en högre incidens av borderline (mindre än 3 gånger ULN), måttlig (3 till 8 gånger ULN) och markant (större än 8 gånger ULN) förhöjningar av ALAT eller ASAT hos patienter får diklofenak jämfört med andra NSAID. Förhöjda transaminaser sågs oftare hos patienter med artros än hos patienter med reumatoid artrit.
Nästan alla betydelsefulla förhöjningar av transaminaser upptäcktes innan patienterna blev symtomatiska. Onormala tester inträffade under de första 2 månaderna av behandling med diklofenak hos 42 av de 51 patienterna i alla studier som utvecklade markanta transaminashöjningar.
I rapporter efter marknadsföring har fall av läkemedelsinducerad levertoxicitet rapporterats under den första månaden och i vissa fall de första 2 månaderna av behandlingen, men kan inträffa när som helst under behandling med diklofenak. Övervakning efter marknadsföring har rapporterat fall av allvarliga leverreaktioner, inklusive levernekros, gulsot, fulminant hepatit med och utan gulsot och leversvikt. Några av dessa rapporterade fall resulterade i dödsfall eller levertransplantation.
en europeisk retrospektiv populationsbaserad, fallkontrollerad studie associerades 10 fall av diklofenakassocierad läkemedelsinducerad leverskada med nuvarande användning jämfört med utebliven användning av diklofenak med en statistiskt signifikant 4-faldigt justerad oddskvot för leverskada. I denna speciella studie, baserat på ett totalt antal av 10 fall av leverskada i samband med diklofenak, ökade den justerade oddskvoten ytterligare med kvinnligt kön, doser på 150 mg eller mer och användningstid i mer än 90 dagar.
Läkare bör mäta transaminaser vid baslinjen och regelbundet hos patienter som får långtidsbehandling med diklofenak, eftersom allvarlig levertoxicitet kan utvecklas utan en prodrom av särskiljande symtom. De optimala tidpunkterna för att göra de första och efterföljande transaminasmätningarna är inte kända. Baserat på data från kliniska prövningar och erfarenheter efter marknadsföring, bör transaminaser övervakas inom 4 till 8 veckor efter påbörjad behandling med diklofenak. Allvarliga leverreaktioner kan dock uppstå när som helst under behandling med diklofenak.
Om onormala leverprover kvarstår eller förvärras, om kliniska tecken och/eller symtom som överensstämmer med leversjukdom utvecklas, eller om systemiska manifestationer uppstår (t.ex. eosinofili, utslag, buksmärtor, diarré, mörk urin, etc.), ska VOLTAREN sättas ut omedelbart .
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, diarré, klåda, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om kliniska tecken och symtom som överensstämmer med leversjukdom utvecklas, eller om systemiska manifestationer uppstår (t.ex. eosinofili, hudutslag, etc.), avbryt VOLTAREN omedelbart och utför en klinisk utvärdering av patienten.
För att minimera den potentiella risken för en ogynnsam leverrelaterad händelse hos patienter som behandlas med VOLTAREN, använd den lägsta effektiva dosen under kortast möjliga varaktighet. Iaktta försiktighet när du förskriver VOLTAREN 100 mg tillsammans med läkemedel som är kända för att vara potentiellt hepatotoxiska (t.ex. paracetamol, antibiotika, antiepileptika).
Hypertoni
NSAID, inklusive VOLTAREN 100 mg, kan leda till ny uppkomst av hypertoni eller försämring av redan existerande hypertoni, vilka båda kan bidra till den ökade incidensen av CV-händelser. Patienter som tar angiotensinomvandlande enzym (ACE)-hämmare, tiaziddiuretika eller loopdiuretika kan ha försämrat svar på dessa behandlingar när de tar NSAID (se FÖRSIKTIGHETSÅTGÄRDER ; LÄKEMEDELSINTERAKTIONER ).
Övervaka blodtrycket (BP) under inledning av NSAID-behandling och under hela behandlingen.
Hjärtsvikt och ödem
Coxib och traditionella NSAID Trialists' Collaboration-metaanalys av randomiserade kontrollerade studier visade en ungefär 2-faldig ökning av sjukhusvistelse för hjärtsvikt hos COX-2 selektivt behandlade patienter och icke-selektiva NSAID-behandlade patienter jämfört med placebobehandlade patienter. I en dansk National Register-studie av patienter med hjärtsvikt ökade NSAID-användning risken för hjärtinfarkt, sjukhusvistelse för hjärtsvikt och död.
Dessutom har vätskeretention och ödem observerats hos vissa patienter som behandlats med NSAID. Användning av diklofenak kan dämpa CV-effekterna av flera terapeutiska medel som används för att behandla dessa medicinska tillstånd (t.ex. diuretika, ACE-hämmare eller angiotensinreceptorblockerare [ARB]) (se LÄKEMEDELSINTERAKTIONER ).
Undvik användning av VOLTAREN hos patienter med allvarlig hjärtsvikt om inte fördelarna förväntas uppväga risken för förvärrad hjärtsvikt. Om VOLTAREN 50 mg används till patienter med allvarlig hjärtsvikt, övervaka patienterna för tecken på förvärrad hjärtsvikt.
Njurtoxicitet och hyperkalemi
Njurtoxicitet
Långvarig administrering av NSAID har resulterat i njurpapillär nekros och annan njurskada.
Njurtoxicitet har också setts hos patienter hos vilka njurprostaglandiner har en kompensatorisk roll i upprätthållandet av njurperfusion. Hos dessa patienter kan administrering av ett NSAID orsaka en dosberoende minskning av prostaglandinbildningen och, i andra hand, i njurblodflödet, vilket kan utlösa tydlig njurdekompensation. Patienter med störst risk för denna reaktion är de med nedsatt njurfunktion, uttorkning, hypovolemi, hjärtsvikt, leverdysfunktion, de som tar diuretika och ACE-hämmare eller ARB och äldre. Avbrytande av NSAID-behandling följs vanligtvis av återhämtning till förbehandlingstillstånd.
Ingen information finns tillgänglig från kontrollerade kliniska studier angående användning av VOLTAREN 100 mg hos patienter med avancerad njursjukdom. Njureffekterna av VOLTAREN 50 mg kan påskynda utvecklingen av njurdysfunktion hos patienter med redan existerande njursjukdom.
Korrekt volymstatus hos dehydrerade eller hypovolemiska patienter innan VOLTAREN påbörjas. Övervaka njurfunktionen hos patienter med nedsatt njur- eller leverfunktion, hjärtsvikt, uttorkning eller hypovolemi under användning av VOLTAREN (se LÄKEMEDELSINTERAKTIONER ). Undvik användning av VOLTAREN hos patienter med avancerad njursjukdom såvida inte fördelarna förväntas uppväga risken för försämrad njurfunktion. Om VOLTAREN 50 mg används till patienter med avancerad njursjukdom, övervaka patienterna för tecken på försämrad njurfunktion.
Hyperkalemi
Ökning av serumkaliumkoncentrationen, inklusive hyperkalemi, har rapporterats vid användning av NSAID, även hos vissa patienter utan nedsatt njurfunktion. Hos patienter med normal njurfunktion har dessa effekter tillskrivits ett tillstånd av hyporeninemisk-hypoaldosteronism.
Anafylaktiska reaktioner
Diklofenak har associerats med anafylaktiska reaktioner hos patienter med och utan känd överkänslighet mot diklofenak och hos patienter med aspirinkänslig astma (se KONTRAINDIKATIONER , VARNINGAR ; Förvärring av astma relaterad till aspirinkänslighet ).
Förvärring av astma relaterad till aspirinkänslighet
En delpopulation av patienter med astma kan ha aspirinkänslig astma, vilket kan innefatta kronisk rhinosinusit komplicerad av näspolyper; allvarlig, potentiellt dödlig bronkospasm; och/eller intolerans mot aspirin och andra NSAID. Eftersom korsreaktivitet mellan acetylsalicylsyra och andra NSAID har rapporterats hos sådana aspirinkänsliga patienter, är VOLTAREN 100 mg kontraindicerat hos patienter med denna form av acetylsalicylsyrakänslighet (se KONTRAINDIKATIONER ). När VOLTAREN 100 mg används till patienter med redan existerande astma (utan känd acetylsalicylsyrakänslighet), övervaka patienterna med avseende på förändringar i tecken och symtom på astma.
Allvarliga hudreaktioner
NSAID, inklusive diklofenak, kan orsaka allvarliga hudbiverkningar, såsom exfoliativ dermatit, Stevens-Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN), som kan vara dödlig. Dessa allvarliga händelser kan inträffa utan förvarning. Informera patienterna om tecken och symtom på allvarliga hudreaktioner och att avbryta användningen av VOLTAREN vid första uppkomsten av hudutslag eller andra tecken på överkänslighet. VOLTAREN är kontraindicerat hos patienter med tidigare allvarliga hudreaktioner på NSAID (se KONTRAINDIKATIONER ).
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) har rapporterats hos patienter som tar NSAID, såsom VOLTAREN. Några av dessa händelser har varit dödliga eller livshotande. DRESS ger vanligtvis, men inte uteslutande, feber, hudutslag, lymfadenopati och/eller svullnad i ansiktet. Andra kliniska manifestationer kan inkludera hepatit, nefrit, hematologiska abnormiteter, myokardit eller myosit. Ibland kan symtom på DRESS likna en akut virusinfektion. Eosinofili är ofta närvarande. Eftersom denna störning är variabel i sin presentation, kan andra organsystem som inte noteras här vara inblandade. Det är viktigt att notera att tidiga manifestationer av överkänslighet, såsom feber eller lymfadenopati, kan förekomma även om utslag inte är uppenbara. Om sådana tecken eller symtom finns, avbryt behandlingen med VOLTAREN 50 mg och utvärdera patienten omedelbart.
Fostertoxicitet
För tidig stängning av Fetal Ductus Arteriosus
Undvik användning av NSAID, inklusive VOLTAREN 50 mg, hos gravida kvinnor vid cirka 30 veckors graviditet och senare. NSAID, inklusive VOLTAREN 50 mg, ökar risken för för tidig stängning av fetal ductus arteriosus vid ungefär denna graviditetsålder.
Oligohydramnios/neonatal njurfunktionsnedsättning
Användning av NSAID, inklusive VOLTAREN, vid ungefär 20 veckors graviditet eller senare under graviditeten kan orsaka fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. Dessa negativa utfall ses i genomsnitt efter dagar till veckors behandling, även om oligohydramnios sällan har rapporterats så snart som 48 timmar efter NSAID-start. Oligohydramnios är ofta, men inte alltid, reversibel när behandlingen avbryts. Komplikationer av långvariga oligohydramnios kan till exempel inkludera lemkontrakturer och försenad lungmognad. I vissa fall efter marknadsföringen av nedsatt njurfunktion hos nyfödda krävdes invasiva procedurer, såsom utbytestransfusion eller dialys.
Om NSAID-behandling är nödvändig mellan cirka 20 veckor och 30 veckors graviditet, begränsa användningen av VOLTAREN till lägsta effektiva dos och kortast möjliga varaktighet. Överväg ultraljudsövervakning av fostervatten om behandlingen med VOLTAREN 50 mg sträcker sig längre än 48 timmar. Avbryt behandlingen med VOLTAREN 100 mg om oligohydramnios uppstår och följ upp enligt klinisk praxis (se FÖRSIKTIGHETSÅTGÄRDER ; Graviditet ).
Hematologisk toxicitet
Anemi har förekommit hos NSAID-behandlade patienter. Detta kan bero på ockult eller grov blodförlust, vätskeretention eller en ofullständigt beskriven effekt på erytropoes. Om en patient som behandlas med VOLTAREN har några tecken eller symtom på anemi, övervaka hemoglobin eller hematokrit.
NSAID, inklusive VOLTAREN 100 mg, kan öka risken för blödningar. Samsjukliga tillstånd, såsom koagulationsrubbningar, samtidig användning av warfarin, andra antikoagulantia, trombocythämmande medel (t.ex. aspirin), serotoninåterupptagshämmare (SSRI) och serotonin noradrenalin återupptagshämmare (SNRI) kan öka denna risk. Övervaka dessa patienter för tecken på blödning (se LÄKEMEDELSINTERAKTIONER ).
FÖRSIKTIGHETSÅTGÄRDER
Allmän
VOLTAREN® (diklofenaknatrium enterodragerade tabletter) kan inte förväntas ersätta kortikosteroider eller behandla kortikosteroidinsufficiens. Plötsligt utsättande av kortikosteroider kan leda till att sjukdomen förvärras. Patienter på långvarig kortikosteroidbehandling bör få sin terapi avtrappad långsamt om ett beslut fattas om att avbryta kortikosteroider och patienten bör observeras noggrant för eventuella tecken på biverkningar, inklusive binjurebarksvikt och exacerbation av symtom på artrit.
Den farmakologiska aktiviteten av VOLTAREN 50 mg för att minska feber och inflammation kan minska användbarheten av dessa diagnostiska tecken för att upptäcka komplikationer av förmodade icke-infektiösa, smärtsamma tillstånd.

Information för patienter
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ) som medföljer varje utskrivet recept. Informera patienter, familjer eller deras vårdgivare om följande information innan behandling med VOLTAREN påbörjas och med jämna mellanrum under pågående behandling.
Kardiovaskulära trombotiska händelser
Rekommendera patienter att vara uppmärksamma på symtom på kardiovaskulära trombotiska händelser, inklusive bröstsmärtor, andnöd, svaghet eller sluddrigt tal, och att omedelbart rapportera något av dessa symtom till sin vårdgivare (se VARNINGAR ; Kardiovaskulära trombotiska händelser ).
Gastrointestinal blödning, sårbildning och perforering
Råda patienter att rapportera symtom på sår och blödningar, inklusive epigastrisk smärta, dyspepsi, melena och hematemes till sin vårdgivare. Vid samtidig användning av lågdos aspirin för hjärtprofylax, informera patienterna om den ökade risken för tecken och symtom på gastrointestinala blödningar (se VARNING ; Gastrointestinala blödningar , Sårbildning , och Perforering ).
Hepatotoxicitet
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, klåda, diarré, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om dessa inträffar, instruera patienterna att sluta med VOLTAREN 50 mg och omedelbart söka medicinsk behandling (se VARNINGAR ; Hepatotoxicitet ).
Hjärtsvikt och ödem
Rekommendera patienter att vara uppmärksamma på symtom på kronisk hjärtsvikt, inklusive andnöd, oförklarlig viktökning eller ödem och att kontakta sin vårdgivare om sådana symtom uppstår (se VARNINGAR ; Hjärtsvikt och ödem ).
Anafylaktiska reaktioner
Informera patienterna om tecknen på en anafylaktisk reaktion (t.ex. andningssvårigheter, svullnad i ansikte eller hals). Instruera patienterna att söka omedelbar akut hjälp om dessa inträffar (se VARNINGAR ; Anafylaktiska reaktioner ).
Allvarliga hudreaktioner, inklusive KLÄNNING
Rekommendera patienter att sluta med VOLTAREN 50 mg omedelbart om de utvecklar någon typ av utslag eller feber och kontakta sin vårdgivare så snart som möjligt (se VARNINGAR ; Allvarliga hudreaktioner ).
Kvinnlig fertilitet
Informera kvinnor med reproduktionspotential som önskar graviditet att NSAID, inklusive VOLTAREN 50 mg, kan vara associerade med en reversibel försening av ägglossningen (se FÖRSIKTIGHETSÅTGÄRDER ; Karcinogenes, Mutagenes, Nedsatt fertilitet ).
Fostertoxicitet
Informera gravida kvinnor att undvika användning av VOLTAREN och andra NSAID, med början vid 30:e graviditetsvecka på grund av risken för för tidig stängning av fetal ductus arteriosus. Om behandling med VOLTAREN behövs för en gravid kvinna mellan ca 20 och 30 graviditetsvecka, informera henne om att hon kan behöva övervakas för oligohydramnios, om behandlingen fortsätter längre än 48 timmar. (ser VARNINGAR ; Fostertoxicitet , FÖRSIKTIGHETSÅTGÄRDER , Graviditet ).
Undvik samtidig användning av NSAID
Informera patienterna om att samtidig användning av VOLTAREN 50 mg och andra NSAID eller salicylater (t.ex. diflunisal, salsalat) inte rekommenderas på grund av den ökade risken för gastrointestinal toxicitet och liten eller ingen ökning av effekt (se VARNINGAR ; Gastrointestinala blödningar , Sårbildning , och Perforering och läkemedelsinteraktioner ). Varna patienter om att NSAID kan finnas i "receptfria" läkemedel för behandling av förkylningar, feber eller sömnlöshet.
Användning av NSAID och lågdos aspirin
Informera patienterna att inte använda lågdos acetylsalicylsyra samtidigt med VOLTAREN förrän de pratat med sin vårdgivare (se LÄKEMEDELSINTERAKTIONER ).
Maskering av inflammation och feber
VOLTARENs farmakologiska aktivitet för att minska inflammation och eventuellt feber kan minska användbarheten av diagnostiska tecken för att upptäcka infektioner.
Laboratorieövervakning
Eftersom allvarlig GI-blödning, levertoxicitet och njurskada kan uppstå utan varningssymtom eller tecken, överväg att övervaka patienter på långvarig NSAID-behandling med en CBC och en kemiprofil med jämna mellanrum (se VARNINGAR ; Gastrointestinala blödningar , Sårbildning och perforering , och Hepatotoxicitet ).
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Långtidsstudier av karcinogenicitet på råttor som fått diklofenaknatrium upp till 2 mg/kg/dag (cirka 0,1 gånger den maximala rekommenderade humandosen (MRHD) av VOLTAREN 50 mg, 200 mg/dag, baserat på kroppsyta (BSA) jämförelse) har visat ingen signifikant ökning av tumörincidensen. En 2-årig karcinogenicitetsstudie utförd på möss som använder diklofenaknatrium i doser upp till 0,3 mg/kg/dag (cirka 0,007 gånger MRHD baserat på BSA-jämförelse) hos män och 1 mg/kg/dag (ungefär 0,02 gånger MRHD baserat på BSA-jämförelse) hos kvinnor avslöjade inte någon onkogen potential.
Mutagenes
Diklofenaknatrium visade inte mutagen aktivitet i in vitro punktmutationsanalyser i däggdjurs (muslymfom) och mikrobiella (jäst, Ames) testsystem och var icke-mutagen i flera in vitro och in vivo tester på däggdjur, inklusive dominanta letala och manliga germinala epiteliala kromosomstudier i möss, och nucleus anomali och kromosomala aberrationsstudier hos kinesiska hamstrar.
Nedsättning av fertilitet
Diklofenaknatrium administrerat till han- och honråttor med 4 mg/kg/dag (ungefär 0,2 gånger MRHD baserat på BSA-jämförelse) påverkade inte fertiliteten.
Baserat på verkningsmekanismen kan användningen av prostaglandinmedierade NSAID, inklusive VOLTAREN 100 mg, fördröja eller förhindra bristning av äggstocksfolliklar, vilket har associerats med reversibel infertilitet hos vissa kvinnor. Publicerade djurstudier har visat att administrering av prostaglandinsynteshämmare har potential att störa prostaglandinmedierad follikelruptur som krävs för ägglossning. Små studier på kvinnor som behandlats med NSAID har också visat en reversibel försening av ägglossningen. Överväg utsättande av NSAID, inklusive VOLTAREN 100 mg, hos kvinnor som har svårt att bli gravida eller som genomgår utredning av infertilitet.
Graviditet
Risksammanfattning
Användning av NSAID, inklusive VOLTAREN, kan orsaka för tidig stängning av fetal ductus arteriosus och fosterns njurfunktion som leder till oligohydramnios och, i vissa fall, neonatal njurfunktionsnedsättning. På grund av dessa risker, begränsa dosen och varaktigheten av VOLTAREN-användning mellan cirka 20 och 30 graviditetsveckor, och undvik VOLTAREN-användning vid cirka 30 veckors graviditet och senare under graviditeten (se VARNINGAR ; Fostertoxicitet ).
För tidig stängning av Fetal Ductus Arteriosus
Användning av NSAID, inklusive VOLTAREN 100 mg, vid cirka 30 veckors graviditet eller senare under graviditeten ökar risken för för tidig stängning av fosterets ductus arteriosus.
Oligohydramnios/neonatal njurfunktionsnedsättning
Användning av NSAID vid ungefär 20 veckors graviditet eller senare under graviditeten har associerats med fall av fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning.
Det finns inga adekvata och välkontrollerade studier av VOLTAREN 100 mg på gravida kvinnor.
Data från observationsstudier angående potentiella embryo-foster risker för NSAID-användning hos kvinnor under graviditetens första eller andra trimester är inte övertygande.
reproduktionsstudier på djur observerades inga tecken på teratogenicitet hos möss, råttor eller kaniner som gavs diklofenak under organogenesperioden i doser upp till cirka 0,5, 0,5 respektive 1 gånger den maximala rekommenderade humana dosen (MRHD) av VOLTAREN. , 200 mg/dag, trots förekomsten av maternell och fostertoxicitet vid dessa doser (se Data ).
Baserat på publicerade djurdata har prostaglandiner visat sig ha en viktig roll i endometrievaskulär permeabilitet, blastocystimplantation och decidualisering. I djurstudier resulterade administrering av prostaglandinsynteshämmare, såsom diklofenak, i ökad förlust före och efter implantation. Prostaglandiner har också visat sig ha en viktig roll i fostrets njurutveckling. I publicerade djurstudier har prostaglandinsynteshämmare rapporterats försämra njurutvecklingen när de administreras i kliniskt relevanta doser.
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den eller de indikerade populationerna är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Kliniska överväganden
Fetala/neonatala biverkningar
För tidig stängning av Fetal Ductus Arteriosus:
Undvik användning av NSAID hos kvinnor vid ca 30 veckors graviditet och senare under graviditeten, eftersom NSAID, inklusive VOLTAREN, kan orsaka för tidig stängning av fostergången ductus arteriosus (se VARNINGAR ; Fostertoxicitet ).
Oligohydramnios/neonatal njurfunktionsnedsättning:
Om ett NSAID är nödvändigt vid ungefär 20 veckors graviditet eller senare under graviditeten, begränsa användningen till lägsta effektiva dos och kortast möjliga varaktighet. Om behandling med VOLTAREN 50 mg sträcker sig längre än 48 timmar, överväg att övervaka med ultraljud för oligohydramnios. Om oligohydramnios uppstår, avbryt behandlingen med VOLTAREN och följ upp enligt klinisk praxis (se VARNINGAR ; Fostertoxicitet ).
Data
Mänskliga data
För tidig stängning av Fetal Ductus Arteriosus:
Publicerad litteratur rapporterar att användning av NSAID vid cirka 30 veckors graviditet och senare i graviditeten kan orsaka för tidig stängning av fostergången arteriosus.
Oligohydramnios/neonatal njurfunktionsnedsättning:
Publicerade studier och rapporter efter marknadsföring beskriver moderns NSAID-användning vid cirka 20 veckors graviditet eller senare under graviditeten i samband med fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. Dessa negativa utfall ses i genomsnitt efter dagar till veckors behandling, även om oligohydramnios sällan har rapporterats så snart som 48 timmar efter NSAID-start. I många fall, men inte alla, var minskningen av fostervatten övergående och reversibel när läkemedlet upphörde. Det har förekommit ett begränsat antal fallrapporter av maternell NSAID-användning och neonatal njurfunktion utan oligohydramnios, av vilka några var irreversibla. Vissa fall av neonatal njurdysfunktion krävde behandling med invasiva procedurer, såsom utbytestransfusion eller dialys.
Metodologiska begränsningar av dessa eftermarknadsföringsstudier och rapporter inkluderar bristen på en kontrollgrupp; begränsad information om dos, varaktighet och tidpunkt för läkemedelsexponering; och samtidig användning av andra läkemedel. Dessa begränsningar utesluter upprättande av en tillförlitlig uppskattning av risken för ogynnsamma foster- och neonatala utfall vid användning av moders NSAID. Eftersom de publicerade säkerhetsdata om neonatala resultat mestadels involverade prematura spädbarn, är generaliserbarheten av vissa rapporterade risker för fullgångna spädbarn som exponerats för NSAID genom modern användning osäker.
Djurdata
Reproduktions- och utvecklingsstudier på djur visade att administrering av diklofenaknatrium under organogenes inte producerade teratogenicitet trots induktion av maternell toxicitet och fostertoxicitet hos möss vid orala doser upp till 20 mg/kg/dag (ungefär 0,5 gånger den maximala rekommenderade humana dosen [MRHD] ] av VOLTAREN, 200 mg/dag, baserat på kroppsyta (BSA) jämförelse), och hos råttor och kaniner vid orala doser upp till 10 mg/kg/dag (ungefär 0,5 respektive 1 gånger MRHD baserat på BSA jämförelse). I en studie där gravida råttor administrerades oralt 2 eller 4 mg/kg diklofenak (0,1 och 0,2 gånger MRHD baserat på BSA) från dräktighetsdag 15 till och med digivningsdag 21, noterades signifikant maternell toxicitet (peritonit, mortalitet). Dessa maternellt toxiska doser var associerade med dystoki, förlängd graviditet, minskad fostervikt och tillväxt och minskad fosteröverlevnad. Diklofenak har visat sig passera placentabarriären hos möss, råttor och människor.
Arbetskraft eller leverans
Det finns inga studier på effekterna av VOLTAREN under förlossningen eller förlossningen. I djurstudier hämmar NSAID, inklusive diklofenak, prostaglandinsyntesen, orsakar försenad förlossning och ökar förekomsten av dödfödsel.
Ammande mödrar
Risksammanfattning
Baserat på tillgängliga data kan diklofenak förekomma i bröstmjölk. Utvecklings- och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av VOLTAREN och eventuella negativa effekter på det ammade barnet från VOLTAREN 100 mg eller från det underliggande moderns tillståndet.
Data
En kvinna som behandlades oralt med ett diklofenaksalt, 150 mg/dag, hade en mjölkdiklofenaknivå på 100 mcg/L, motsvarande en spädbarnsdos på cirka 0,03 mg/kg/dag. Diklofenak kunde inte detekteras i bröstmjölk hos 12 kvinnor som använde diklofenak (efter antingen 100 mg/dag oralt i 7 dagar eller en intramuskulär engångsdos på 50 mg administrerad omedelbart efter förlossningen).
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Äldre patienter, jämfört med yngre patienter, löper större risk för NSAID-relaterade allvarliga kardiovaskulära, gastrointestinala och/eller renala biverkningar. Om den förväntade nyttan för den äldre patienten uppväger dessa potentiella risker, börja doseringen i den nedre delen av doseringsintervallet och övervaka patienterna med avseende på biverkningar (se VARNINGAR ; Kardiovaskulära trombotiska händelser , Gastrointestinala Blödning, sårbildning och perforering, levertoxicitet, njurtoxicitet och hyperkalemi, FÖRSIKTIGHETSÅTGÄRDER; Laboratorieövervakning).
Diklofenak är känt för att väsentligen utsöndras via njurarna, och risken för biverkningar av detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen (se KLINISK FARMAKOLOGI , NEGATIVA REAKTIONER ).
ÖVERDOS
Ingen information tillhandahållen
KONTRAINDIKATIONER
VOLTAREN® är kontraindicerat för följande patienter:
- Känd överkänslighet (t.ex. anafylaktiska reaktioner och allvarliga hudreaktioner) mot diklofenak eller någon del av läkemedelsprodukten (se VARNINGAR ; Anafylaktiska reaktioner , Allvarliga hudreaktioner ).
- Anamnes med astma, urtikaria eller andra reaktioner av allergisk typ efter att ha tagit acetylsalicylsyra eller andra NSAID. Allvarliga, ibland dödliga, anafylaktiska reaktioner på NSAID har rapporterats hos sådana patienter (se VARNINGAR ; Anafylaktisk reaktion , Förvärring av astma relaterad till aspirinkänslighet ).
- I samband med kranskärlsbypassoperation (CABG) (se VARNINGAR ; Kardiovaskulära trombotiska händelser ).
KLINISK FARMAKOLOGI
Handlingsmekanism
Diklofenak har smärtstillande, antiinflammatoriska och febernedsättande egenskaper.
Verkningsmekanismen för VOLTAREN 100 mg, liksom andra NSAID, är inte helt klarlagd men involverar hämning av cyklooxygenas (COX-1 och COX-2).
Diklofenak är en potent hämmare av prostaglandinsyntes in vitro. Diklofenakkoncentrationer som uppnåtts under behandlingen har gett in vivo effekter. Prostaglandiner sensibiliserar afferenta nerver och potentierar verkan av bradykinin för att inducera smärta i djurmodeller. Prostaglandiner är mediatorer av inflammation. Eftersom diklofenak är en hämmare av prostaglandinsyntes, kan dess verkningsmekanism bero på en minskning av prostaglandiner i perifera vävnader.
Farmakokinetik
Absorption
Diklofenak absorberas till 100 % efter oral administrering jämfört med intravenös (IV) administrering mätt som urinåtervinning. På grund av first-pass metabolism är dock endast cirka 50 % av den absorberade dosen systemiskt tillgänglig (se tabell 1). Mat har ingen signifikant effekt på graden av diklofenakabsorption. Det finns dock vanligtvis en fördröjning i början av absorptionen med 1 till 4,5 timmar och en minskning av maximala plasmanivåer på mindre än 20 %.
Distribution
Den skenbara distributionsvolymen (V/F) av diklofenaknatrium är 1,4 l/kg.
Diklofenak är mer än 99 % bundet till humana serumproteiner, främst till albumin. Serumproteinbindningen är konstant över koncentrationsintervallet (0,15 till 105 mcg/ml) som uppnås med rekommenderade doser.
Diklofenak diffunderar in i och ut ur ledvätskan. Diffusion in i leden sker när plasmanivåerna är högre än de i ledvätskan, varefter processen vänds och ledvätskenivåerna är högre än plasmanivåerna. Det är inte känt om diffusion in i leden spelar en roll för effektiviteten av diklofenak.
Eliminering
Ämnesomsättning
Fem diklofenakmetaboliter har identifierats i human plasma och urin. Metaboliterna inkluderar 4'Âhydroxi-, 5-hydroxi-, 3'-hydroxi-, 4',5-dihydroxi- och 3'-hydroxi-4'-metoxi-diklofenak. Den huvudsakliga diklofenakmetaboliten, 4'-hydroxi-diklofenak, har mycket svag farmakologisk aktivitet. Bildningen av 4’Âhydroxidiklofenak förmedlas främst av CYP2C9. Både diklofenak och dess oxidativa metaboliter genomgår glukuronidering eller sulfatering följt av gallutsöndring. Acylglukuronidering medierad av UGT2B7 och oxidation medierad av CYP2C8 kan också spela en roll i diklofenakmetabolismen. CYP3A4 är ansvarigt för bildningen av mindre metaboliter, 5-hydroxi- och 3’-hydroxi-diklofenak. Hos patienter med nedsatt njurfunktion var maximala koncentrationer av metaboliterna 4'-hydroxi- och 5-hydroxi-diklofenak cirka 50 % och 4 % av modersubstansen efter oral engångsdosering jämfört med 27 % och 1 % hos normala friska försökspersoner.
Exkretion
Diklofenak elimineras genom metabolism och efterföljande urin- och gallutsöndring av glukuroniden och metaboliternas sulfatkonjugat. Lite eller inget fritt oförändrat diklofenak utsöndras i urinen. Cirka 65 % av dosen utsöndras i urinen och cirka 35 % i gallan som konjugat av oförändrad diklofenak plus metaboliter. Eftersom renal eliminering inte är en signifikant elimineringsväg för oförändrad diklofenak, är dosjustering hos patienter med mild till måttlig njurdysfunktion inte nödvändig. Den terminala halveringstiden för oförändrad diklofenak är cirka 2 timmar.
Särskilda populationer
Pediatrisk
Farmakokinetiken för VOLTAREN har inte undersökts hos pediatriska patienter.
Lopp
Farmakokinetiska skillnader på grund av ras har inte identifierats.
Nedsatt leverfunktion
Levermetabolismen står för nästan 100 % av elimineringen av VOLTAREN 100 mg, så patienter med leversjukdom kan behöva minskade doser av VOLTAREN 50 mg jämfört med patienter med normal leverfunktion.
Nedsatt njurfunktion
Diklofenaks farmakokinetik har undersökts hos personer med njurinsufficiens. Inga skillnader i farmakokinetiken för diklofenak har upptäckts i studier av patienter med nedsatt njurfunktion. Hos patienter med nedsatt njurfunktion (inulinclearance 60 till 90, 30 till 60 och mindre än 30 ml/min; N = 6 i varje grupp) var värdena för area under kurvan (AUC) och eliminationshastighet jämförbara med de hos friska försökspersoner .
Studier av läkemedelsinteraktioner
Vorikonazol
Vid samtidig administrering med vorikonazol (hämmare av CYP2C9, 2C19 och 3A4 enzym), ökade Cmax och AUC för diklofenak med 114 % respektive 78 % (se LÄKEMEDELSINTERAKTIONER ).
Aspirin
När NSAID administrerades med acetylsalicylsyra reducerades proteinbindningen av NSAID, även om clearance av fritt NSAID inte förändrades. Den kliniska betydelsen av denna interaktion är inte känd. Se tabell 2 för kliniskt signifikanta läkemedelsinteraktioner mellan NSAID och acetylsalicylsyra (se LÄKEMEDELSINTERAKTIONER ).
PATIENTINFORMATION
Läkemedelsguide
VOLTAREN® (Vowl-tar-uhn) (diklofenaknatrium) dragerade tabletter
Vilken är den viktigaste informationen jag borde veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?
NSAID kan orsaka allvarliga biverkningar, inklusive:
- Ökad risk för hjärtinfarkt eller stroke som kan leda till döden. Denna risk kan inträffa tidigt i behandlingen och kan öka:
- med ökande doser av NSAID
- med längre användning av NSAID
Ta inte NSAID precis före eller efter en hjärtoperation som kallas "kransartär bypassgraft (CABG)." Undvik att ta NSAID efter en nyligen inträffad hjärtinfarkt, såvida inte din läkare säger åt dig att göra det. Du kan ha en ökad risk för en ny hjärtinfarkt om du tar NSAID-preparat efter en nyligen genomförd hjärtinfarkt.
- Ökad risk för blödningar, sår och revor (perforering) i matstrupen (slangen som leder från munnen till magen), magen och tarmarna:
- när som helst under användning
- utan varningssymtom
- som kan orsaka dödsfall
Risken för att få ett sår eller blödning ökar med:
- tidigare anamnes på magsår, eller blödning från magen eller tarmen vid användning av NSAID
- tar läkemedel som kallas "kortikosteroider", "antikoagulantia", "SSRI" eller "SNRI"
- ökande doser av NSAID
- längre användning av NSAID
- rökning
- dricker alkohol
- äldre ålder
- dålig hälsa
- avancerad leversjukdom
- blödningsproblem
NSAID bör endast användas:
- precis som föreskrivet
- vid lägsta möjliga dos för din behandling
- för den kortaste tiden som behövs
Vad är NSAID?
NSAID används för att behandla smärta och rodnad, svullnad och värme (inflammation) från medicinska tillstånd, såsom olika typer av artrit, mensvärk och andra typer av kortvarig smärta.
Vem bör inte ta NSAID?
Ta inte NSAID:
- om du haft en astmaanfall, nässelfeber eller annan allergisk reaktion med acetylsalicylsyra eller andra NSAID-preparat.
- precis före eller efter bypassoperation.
Innan du tar NSAID, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har lever- eller njurproblem
- har högt blodtryck
- har astma
- är gravid eller planerar att bli gravid. Om du tar NSAID vid ungefär 20 veckors graviditet eller senare kan det skada ditt ofödda barn. Om du behöver ta NSAID i mer än 2 dagar när du är mellan 20 och 30 veckor av graviditeten, kan din läkare behöva övervaka mängden vätska i livmodern runt ditt barn. Du ska inte ta NSAID efter cirka 30 veckors graviditet.
- ammar eller planerar att amma.
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda eller receptfria läkemedel, vitaminer eller växtbaserade kosttillskott. NSAID och vissa andra läkemedel kan interagera med varandra och orsaka allvarliga biverkningar. Börja inte ta något nytt läkemedel utan att först prata med din läkare.
Vilka är de möjliga biverkningarna av NSAID?
NSAID kan orsaka allvarliga biverkningar, inklusive:
Se "Vad är den viktigaste informationen jag borde veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?"
- nytt eller värre högt blodtryck
- hjärtsvikt
- leverproblem, inklusive leversvikt
- njurproblem, inklusive njursvikt
- låga röda blodkroppar (anemi)
- livshotande hudreaktioner
- livshotande allergiska reaktioner
- Andra biverkningar av NSAID inkluderar: magsmärtor, förstoppning, diarré, gaser, halsbränna, illamående, kräkningar, yrsel
Få akut hjälp omedelbart om du har något av följande symtom:
- andnöd eller andningssvårigheter
- bröstsmärta
- svaghet i en del eller sida av din kropp
- sluddrigt tal
- svullnad i ansikte eller hals
Sluta ta ditt NSAID och ring din vårdgivare omedelbart om du får något av följande symtom:
- illamående
- spy blod
- tröttare eller svagare än vanligt
- diarre
- klåda
- det finns blod i din tarmrörelse eller så är det svart och klibbigt som tjära
- din hud eller ögon ser gula ut
- matsmältningsbesvär eller magsmärtor
- influensaliknande symtom
- ovanlig viktökning
- hudutslag eller blåsor med feber
- svullnad av armar och ben, händer och fötter
Om du tar för mycket av ditt NSAID, ring din vårdgivare eller få medicinsk hjälp omedelbart.
Dessa är inte alla möjliga biverkningar av NSAID. För mer information, fråga din vårdgivare eller apotekspersonal om NSAID. Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA1088
Annan information om NSAID.
- Aspirin är ett NSAID-läkemedel men det ökar inte risken för hjärtinfarkt. Aspirin kan orsaka blödningar i hjärnan, magen och tarmarna. Aspirin kan också orsaka sår i magen och tarmarna.
- Vissa NSAID-preparat säljs i lägre doser utan recept (receptfria). Prata med din vårdgivare innan du använder receptfria NSAIDs i mer än 10 dagar.
Allmän information om säker och effektiv användning av NSAID.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte NSAID för ett tillstånd som det inte ordinerats för. Ge inte NSAID till andra människor, även om de har samma symtom som du har. Det kan skada dem.
Om du vill ha mer information om NSAID, prata med din vårdgivare. Du kan fråga din apotekspersonal eller vårdgivare om information om NSAID som är skriven för vårdpersonal.
Denna medicineringsguide har godkänts av US Food and Drug Administration. Reviderad: april 2021
