Imuran 50mg, 25mg Azathioprine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Imuran och hur används det?
Imuran 25mg är ett receptbelagt läkemedel som används för att behandla symtomen på reumatoid artrit och som förebyggande av avstötning av transplantat. Imuran kan användas ensamt eller tillsammans med andra läkemedel.
Imuran 25mg tillhör en klass av läkemedel som kallas DMARD, immunmodulatorer; Immunsuppressiva medel.
Vilka är de möjliga biverkningarna av Imuran?
Imuran 25mg kan orsaka allvarliga biverkningar inklusive:
- feber,
- svullna körtlar,
- kroppssmärtor,
- nattsvettningar,
- mår inte bra,
- blek hud,
- utslag,
- lätta blåmärken eller blödningar,
- kalla händer och fötter,
- yrsel,
- andnöd,
- smärta i övre delen av magen som kan sprida sig till axeln,
- känna sig mätt efter att ha ätit en liten mängd,
- viktminskning,
- tecken på infektion (feber, frossa, svaghet, influensasymptom, ont i halsen, hosta, smärta eller sveda när du kissar),
- kraftigt illamående,
- kräkningar,
- diarre,
- snabba hjärtslag,
- mörk urin, och
- gulfärgning av huden eller ögonen (gulsot)
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Imuran 50mg inkluderar:
- illamående,
- diarre,
- magont,
- håravfall och
- hudutslag
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Imuran. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
Malignitet
Kronisk immunsuppression med IMURAN, en purin-antimetabolit, ökar risken för malignitet hos människor. Rapporter om malignitet inkluderar lymfom efter transplantation och hepatospleniskt T-cellslymfom (HSTCL) hos patienter med inflammatorisk tarmsjukdom. Läkare som använder detta läkemedel bör vara mycket förtrogna med denna risk såväl som med den mutagena potentialen för både män och kvinnor och med möjliga hematologiska toxiciteter. Läkare bör informera patienter om risken för malignitet med IMURAN. Ser VARNINGAR .
BESKRIVNING
IMURAN (azatioprin), en immunsuppressiv antimetabolit, finns tillgänglig i tablettform för oral administrering. Varje tablett med skåror innehåller 50 mg azatioprin och de inaktiva ingredienserna laktos, magnesiumstearat, potatisstärkelse, povidon och stearinsyra.
Azatioprin är kemiskt 6-[(1-metyl-4-nitro-lH-imidazol-5-yl)tio]-1H-purin. Strukturformeln för azatioprin är:
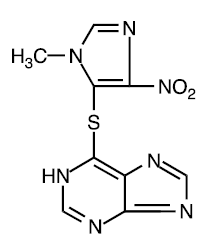
Det är ett imidazolylderivat av 6-merkaptopurin och många av dess biologiska effekter liknar moderföreningens.
Azatioprin är olösligt i vatten, men kan lösas med tillsats av en molekvivalent alkali. Azatioprin är stabilt i lösning vid neutralt eller surt pH men hydrolys till merkaptopurin sker i överskott av natriumhydroxid (0,1N), särskilt vid uppvärmning. Omvandling till merkaptopurin sker också i närvaro av sulfhydrylföreningar såsom cystein, glutation och vätesulfid.
INDIKATIONER
IMURAN är indicerat som ett komplement för att förhindra avstötning vid njurhomotransplantation. Det är också indicerat för behandling av aktiv reumatoid artrit för att minska tecken och symtom.
Renal homotransplantation
IMURAN är indicerat som ett komplement för att förhindra avstötning vid njurhomotransplantation. Erfarenhet av över 16 000 transplantationer visar en 5-årig patientöverlevnad på 35 % till 55 %, men detta är beroende av donator, matchning för HLA-antigener, anti-donator eller anti-B-cell alloantigen antikropp och andra variabler. Effekten av IMURAN på dessa variabler har inte testats i kontrollerade studier.
Reumatoid artrit
IMURAN är indicerat för behandling av aktiv reumatoid artrit (RA) för att minska tecken och symtom. Aspirin, icke-steroida antiinflammatoriska läkemedel och/eller lågdos glukokortikoider kan fortsätta under behandling med IMURAN. Den kombinerade användningen av IMURAN 25 mg med sjukdomsmodifierande antireumatiska läkemedel (DMARDs) har inte studerats för vare sig ökad nytta eller oväntade biverkningar. Användning av IMURAN med dessa medel kan inte rekommenderas.
DOSERING OCH ADMINISTRERING
TPMT-TEST KAN INTE ERSÄTTNING MOT KOMPLETT BLODANTAL (CBC) MONITORERING HOS PATIENTER SOM MOTTAGAR IMURAN. TPMT-genotypning eller fenotypning kan användas för att identifiera patienter med frånvarande eller reducerad TPMT-aktivitet. Patienter med låg eller frånvarande TPMT-aktivitet löper en ökad risk att utveckla allvarlig, livshotande myelotoxicitet från IMURAN om konventionella doser ges. Läkare kan överväga alternativa terapier för patienter som har låg eller frånvarande TPMT-aktivitet (homozygot för icke-funktionella alleler). IMURAN 25 mg ska administreras med försiktighet till patienter med en icke-funktionell allel (heterozygot) som löper risk för minskad TPMT-aktivitet som kan leda till toxicitet om konventionella doser ges. Dosreduktion rekommenderas till patienter med nedsatt TPMT-aktivitet. Tidig utsättning av läkemedel kan övervägas hos patienter med onormala CBC-resultat som inte svarar på dosreduktion.
Renal homotransplantation
Den dos av IMURAN 50 mg som krävs för att förhindra avstötning och minimera toxicitet kommer att variera med individuella patienter; detta kräver noggrann hantering. Initialdosen är vanligtvis 3 till 5 mg/kg dagligen, med början vid transplantationstillfället. IMURAN ges vanligtvis som en daglig dos på dagen för, och i en minoritet av fallen 1 till 3 dagar före, transplantationen. Dosminskning till underhållsnivåer på 1 till 3 mg/kg dagligen är vanligtvis möjlig. Dosen av IMURAN 50 mg bör inte ökas till toxiska nivåer på grund av hot om avstötning. Avbrytande av behandlingen kan vara nödvändigt för allvarlig hematologisk eller annan toxicitet, även om avstötning av homotransplantatet kan vara en följd av drogabstinens.
Reumatoid artrit
IMURAN 50 mg ges vanligtvis dagligen. Initialdosen bör vara cirka 1,0 mg/kg (50 till 100 mg) ges som engångsdos eller två gånger dagligen. Dosen kan ökas med början efter 6 till 8 veckor och därefter stegvis med 4 veckors intervall, om det inte finns några allvarliga toxiciteter och om det initiala svaret är otillfredsställande. Dosökningar bör vara 0,5 mg/kg dagligen, upp till en maximal dos på 2,5 mg/kg per dag. Terapeutisk respons inträffar efter flera veckors behandling, vanligtvis 6 till 8; en adekvat prövning bör vara minst 12 veckor. Patienter som inte förbättrats efter 12 veckor kan anses vara refraktära. IMURAN 50 mg kan fortsätta under lång tid hos patienter med kliniskt svar, men patienterna bör övervakas noggrant och gradvis dosreduktion bör försökas för att minska risken för toxicitet.
Underhållsbehandling bör vara vid lägsta effektiva dos, och dosen som ges kan sänkas gradvis med förändringar på 0,5 mg/kg eller cirka 25 mg dagligen var 4:e vecka medan övrig behandling hålls konstant. Den optimala underhållstiden IMURAN 50 mg har inte fastställts. IMURAN kan avbrytas abrupt, men fördröjda effekter är möjliga.
Används vid nedsatt njurfunktion
Relativt oliguriska patienter, särskilt de med tubulär nekros under den omedelbara postkadaveriska transplantationsperioden, kan ha fördröjd clearance av IMURAN eller dess metaboliter, kan vara särskilt känsliga för detta läkemedel och ges vanligtvis lägre doser.
Förfaranden för korrekt hantering och kassering av detta immunsuppressiva antimetabolitläkemedel bör övervägas. Flera riktlinjer i detta ämne har publicerats.25-31 Det finns ingen allmän enighet om att alla de procedurer som rekommenderas i riktlinjerna är nödvändiga eller lämpliga.
HUR LEVERERAS
50 mg överlappande cirkelformade, gula till benvita tabletter med skåra märkta med ”IMURAN” och ”50” på varje tablett; flaska 100 ( NDC 65483-590-10).
Förvara vid 15° till 25°C (59° till 77°F) på en torr plats och skydda mot ljus.
REFERENSER
25. Rekommendationer för säker hantering av parenterala antineoplastiska läkemedel. Washington, DC: Säkerhetsavdelningen; Clinical Center Pharmacy Department och Cancer Nursing Services, National Institute of Health; 1992. US Department of Health and Human Services. Public Health Service Publication NIH 92-2621.
26. AMA Council on Scientific Affairs. Riktlinjer för hantering av parenterala antineoplaster. JAMA. 1985; 253:15901592.
27. Nationell utredningskommission om cytotoxisk exponering. Rekommendationer för hantering av cellgifter. 1987. Tillgänglig från Louis P. Jeffrey, ordförande, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Clinical Oncological Society of Australia. Riktlinjer och rekommendationer för säker hantering av antineoplastiska medel. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Säker hantering av kemoterapeutiska medel: en rapport från Mount Sinai Medical Center. CA Cancer J för läkare. 1983; 33:258-263.
30. American Society of Hospital Pharmacists. ASHP teknisk assistansbulletin om hantering av cellgifter och farliga läkemedel. Am J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. OSHA Work-Practice riktlinjer för personal som arbetar med cytotoxiska (antineoplastiska) läkemedel. Am J Hosp Pharm, 1996; 43:1193-1204.
Tillverkad av Pharmaceutics International, Inc. Hunt Valley, MD 21031 för Prometheus Laboratories Inc. San Diego, CA 92121. Reviderad: feb 2014
BIEFFEKTER
De huvudsakliga och potentiellt allvarliga toxiska effekterna av IMURAN är hematologiska och gastrointestinala. Riskerna för sekundär infektion och malignitet är också betydande (se VARNINGAR ). Frekvensen och svårighetsgraden av biverkningarna beror på dosen och varaktigheten av IMURAN samt på patientens underliggande sjukdom eller samtidiga behandlingar. Incidensen av hematologiska toxiciteter och neoplasi hos grupper av mottagare av njurhomograft är signifikant högre än i studier som använder IMURAN 25 mg för reumatoid artrit. Den relativa incidensen i kliniska studier sammanfattas nedan:
Hematologiska
Leukopeni och/eller trombocytopeni är dosberoende och kan förekomma sent under behandlingen med IMURAN. Dosminskning eller tillfälligt utsättande kan resultera i att dessa toxiciteter upphävs. Infektion kan förekomma som en sekundär manifestation av benmärgssuppression eller leukopeni, men förekomsten av infektion vid njurhomotransplantation är 30 till 60 gånger högre än vid reumatoid artrit. Anemier, inklusive makrocytisk anemi och/eller blödning har rapporterats.
TPMT-genotypning eller fenotypning kan hjälpa till att identifiera patienter med låg eller frånvarande TPMT-aktivitet (homozygot för icke-funktionella alleler) som löper ökad risk för allvarlig, livshotande myelosuppression från IMURAN. Ser KLINISK FARMAKOLOGI , VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER : Laboratorietester . Död i samband med pancytopeni har rapporterats hos patienter med frånvarande TPMT-aktivitet som får azatioprin.6,20
Gastrointestinala
Illamående och kräkningar kan förekomma under de första månaderna av behandlingen med IMURAN 50 mg och förekom hos cirka 12 % av 676 patienter med reumatoid artrit. Frekvensen av magbesvär kan ofta minskas genom administrering av läkemedlet i uppdelade doser och/eller efter måltid. Hos vissa patienter kan dock illamående och kräkningar vara allvarliga och kan åtföljas av symtom som diarré, feber, sjukdomskänsla och myalgi (se FÖRSIKTIGHETSÅTGÄRDER ). Kräkningar med buksmärtor kan förekomma i sällsynta fall med en överkänslig pankreatit. Det är känt att levertoxicitet som manifesteras genom förhöjda serumalkaliska fosfataser, bilirubin och/eller serumtransaminaser inträffar efter användning av azatioprin, främst hos allotransplantatmottagare. Levertoxicitet har varit ovanligt (mindre än 1%) hos patienter med reumatoid artrit. Levertoxicitet efter transplantation inträffar oftast inom 6 månader efter transplantation och är i allmänhet reversibel efter avbrott i IMURAN. En sällsynt, men livshotande leverveno-ocklusiv sjukdom associerad med kronisk administrering av azatioprin har beskrivits hos transplanterade patienter och hos en patient som får IMURAN för panuveit.21,22,23 Periodisk mätning av serumtransaminaser, alkaliskt fosfatas och bilirubin är indicerat för tidig upptäckt av levertoxicitet. Om leverveno-ocklusiv sjukdom misstänks kliniskt ska IMURAN sättas ut permanent.
Andra
Ytterligare lågfrekventa biverkningar har rapporterats. Dessa inkluderar hudutslag, alopeci, feber, artralgi, diarré, steatorré, negativ kvävebalans, reversibel interstitiell pneumonit, hepatospleniskt T-cellslymfom (se VARNINGAR – Malignitet ), och Sweets syndrom (akut febril neutrofil dermatos).
LÄKEMEDELSINTERAKTIONER
Använd med Allopurinol
En av vägarna för inaktivering av azatioprin hämmas av allopurinol. Patienter som får IMURAN 50 mg och allopurinol samtidigt bör minska dosen av IMURAN 50 mg till cirka 1/3 till 1/4 av den vanliga dosen. Det rekommenderas att ytterligare dosreduktion eller alternativa behandlingar övervägs för patienter med låg eller frånvarande TPMT-aktivitet som får IMURAN 50 mg och allopurinol eftersom både TPMT- och XO-inaktiveringsvägar påverkas. Ser KLINISK FARMAKOLOGI , VARNINGAR , FÖRSIKTIGHETSÅTGÄRDER : Laboratorietester och NEGATIVA REAKTIONER avsnitt.
Använd med aminosalicylater
Det finns in vitro bevis för att aminosalicylatderivat (t.ex. sulfasalazin, mesalazin eller olsalazin) hämmar TPMT-enzymet. Samtidig användning av dessa medel och IMURAN 50 mg bör ske med försiktighet.
Använd tillsammans med andra medel som påverkar myelopoes
Läkemedel som kan påverka leukocytproduktionen, inklusive cotrimoxazol, kan leda till överdriven leukopeni, särskilt hos njurtransplanterade.
Använd med angiotensin-konverterande enzymhämmare
Användning av angiotensinomvandlande enzymhämmare för att kontrollera hypertoni hos patienter på azatioprin har rapporterats inducera anemi och svår leukopeni.
Använd med Warfarin
IMURAN kan hämma den antikoagulerande effekten av warfarin.
Använd med ribavirin
Användning av ribavirin för hepatit C hos patienter som får azatioprin har rapporterats inducera allvarlig pancytopeni och kan öka risken för azatioprinrelaterad myelotoxicitet. Inosinmonofosfatdehydrogenas (IMDH) krävs för en av azatioprins metaboliska vägar. Ribavirin är känt för att hämma IMDH, vilket leder till ackumulering av en azatioprinmetabolit, 6-metyltioionosinmonofosfat (6MTITP), som är associerad med myelotoxicitet (neutropeni, trombocytopeni och anemi). Patienter som får azatioprin tillsammans med ribavirin bör ha fullständiga blodvärden, inklusive trombocytantal, övervakat varje vecka under den första månaden, två gånger i månaden under den andra och tredje månaden av behandlingen, sedan en gång i månaden eller oftare om dos- eller annan behandlingsändring är nödvändig.
REFERENSER
6. Data på fil, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Azatioprin-inducerad myelosuppression hos tiopurinmetyltransferasbristpatienter med hjärttransplantationer. Lansett. 1993; 341:436.
21. Läs AE, Wiesner RH, LaBrecque DR, et al. Levervenoocklusiv sjukdom associerad med njurtransplantation och azatioprinbehandling. Ann Intern Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azatioprin och leverveno-ocklusiv sjukdom hos njurtransplanterade patienter. Gastroenterologi. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Veno-ocklusiv sjukdom i levern hos patienter som får immunsuppressiv terapi. Virchows Arch A Pathol Anat Histol. 1982; 395:245-256.
VARNINGAR
Malignitet
Patienter som får immunsuppressiva medel, inklusive IMURAN 50 mg, löper ökad risk att utveckla lymfom och andra maligniteter, särskilt i huden. Läkare bör informera patienter om risken för malignitet med IMURAN. Som vanligt för patienter med ökad risk för hudcancer bör exponering för solljus och ultraviolett ljus begränsas genom att bära skyddskläder och använda ett solskyddsmedel med hög skyddsfaktor.
Efter transplantation
Njurtransplanterade patienter är kända för att ha en ökad risk för malignitet, främst hudcancer och retikulumcells- eller lymfomatösa tumörer. Risken för lymfom efter transplantation kan öka hos patienter som får aggressiv behandling med immunsuppressiva läkemedel, inklusive IMURAN. Därför bör immunsuppressiv läkemedelsbehandling upprätthållas på de lägsta effektiva nivåerna.
Reumatoid artrit
Information finns tillgänglig om risken för malignitet vid användning av IMURAN 50 mg vid reumatoid artrit (se NEGATIVA REAKTIONER ). Det har inte varit möjligt att definiera den exakta risken för malignitet på grund av IMURAN. Data tyder på att risken kan vara förhöjd hos patienter med reumatoid artrit, men lägre än för njurtransplanterade patienter. Akut myelogen leukemi samt solida tumörer har dock rapporterats hos patienter med reumatoid artrit som har fått IMURAN.
Inflammatorisk tarmsjukdom
Fall av hepatospleniskt T-cellslymfom (HSTCL), en sällsynt typ av T-cellslymfom, har rapporterats efter marknadsföring hos patienter som behandlats med IMURAN. Dessa fall har haft ett mycket aggressivt sjukdomsförlopp och har varit dödliga. Majoriteten av de rapporterade fallen har inträffat hos patienter med Crohns sjukdom eller ulcerös kolit och majoriteten var hos ungdomar och unga vuxna män. Några av patienterna behandlades med IMURAN som monoterapi och några hade fått samtidig behandling med en TNFα-blockerare vid eller före diagnosen. Säkerheten och effekten av IMURAN 25 mg för behandling av Crohns sjukdom och ulcerös kolit har inte fastställts.
Cytopenier
Allvarlig leukopeni, trombocytopeni, anemier inklusive makrocytisk anemi och/eller pancytopeni kan förekomma hos patienter som behandlas med IMURAN. Allvarlig benmärgsdämpning kan också förekomma. Patienter med intermediär tiopurin S-metyltransferas (TPMT) aktivitet kan löpa en ökad risk för myelotoxicitet om de får konventionella doser av IMURAN. Patienter med låg eller frånvarande TPMT-aktivitet löper en ökad risk att utveckla allvarlig, livshotande myelotoxicitet om de får konventionella doser av IMURAN. TPMT-genotypning eller fenotypning kan hjälpa till att identifiera patienter som löper en ökad risk att utveckla IMURAN 50 mg toxicitet.2-9 (se FÖRSIKTIGHETSÅTGÄRDER : Laboratorietester ). Hematologiska toxiciteter är dosrelaterade och kan vara allvarligare hos njurtransplanterade patienter vars homotransplantat genomgår avstötning. Det föreslås att patienter på IMURAN har fullständiga blodvärden, inklusive trombocytantal, varje vecka under den första månaden, två gånger i månaden under den andra och tredje månaden av behandlingen, sedan en gång i månaden eller oftare om dosändringar eller andra behandlingsändringar är nödvändiga. Fördröjd hematologisk suppression kan förekomma. Omedelbar minskning av dosen eller tillfälligt uttag av läkemedlet kan vara nödvändigt om det finns ett snabbt fall i eller ihållande lågt antal leukocyter, eller andra tecken på benmärgsdepression. Leukopeni korrelerar inte med terapeutisk effekt; därför bör dosen inte ökas avsiktligt för att sänka antalet vita blodkroppar.
Allvarliga infektioner
Patienter som får immunsuppressiva medel, inklusive Imuran 25 mg, löper ökad risk för bakteriella, virus-, svamp-, protozoala och opportunistiska infektioner, inklusive reaktivering av latenta infektioner. Dessa infektioner kan leda till allvarliga, inklusive dödliga utfall.
Progressiv multifokal leukoencefalopati
Fall av JC-virusassocierad infektion som resulterar i progressiv multifokal leukoencefalopati (PML), ibland dödlig, har rapporterats hos patienter som behandlats med immunsuppressiva medel, inklusive Imuran. Riskfaktorer för PML inkluderar behandling med immunsuppressiva terapier och nedsatt immunförsvar. Överväg diagnosen PML hos alla patienter som uppvisar nya neurologiska manifestationer och överväg konsultation med en neurolog som kliniskt indicerat. Överväg att minska mängden immunsuppression hos patienter som utvecklar PML. Hos transplanterade patienter, överväg risken som den minskade immunsuppressionen utgör för transplantatet.
Effekt på spermier hos djur
IMURAN har rapporterats orsaka tillfällig depression i spermatogenes och minskning av spermiers livsduglighet och spermieantal hos möss vid doser 10 gånger den humana terapeutiska dosen;10 en minskad andel fertila parningar inträffade när djur fick 5 mg/kg.11
Graviditet
Graviditetskategori D
IMURAN kan orsaka fosterskador när det ges till en gravid kvinna. IMURAN 50mg ska inte ges under graviditet utan noggrann avvägning av risk kontra nytta. När så är möjligt ska användning av IMURAN till gravida patienter undvikas. Detta läkemedel bör inte användas för behandling av reumatoid artrit hos gravida kvinnor.12
IMURAN är teratogent hos kaniner och möss när det ges i doser som motsvarar den mänskliga dosen (5 mg/kg dagligen). Avvikelser innefattade skelettmissbildningar och viscerala anomalier.11
Begränsade immunologiska och andra avvikelser har förekommit hos ett fåtal spädbarn födda av mottagare av njurtransplantat på IMURAN. I en detaljerad fallrapport 13 noterades lymfopeni, minskade IgG- och IgM-nivåer, CMV-infektion och en minskad tymusskugga hos ett spädbarn till en mamma som fick 150 mg azatioprin och 30 mg prednison dagligen under hela graviditeten. Efter 10 veckor var de flesta funktioner normaliserade. DeWitte et al rapporterade pancytopeni och allvarlig immunbrist hos ett prematurt barn vars mamma fick 125 mg azatioprin och 12,5 mg prednison dagligen.14 Det har publicerats två rapporter om onormala fysiska fynd. Williamson och Karp beskrev ett spädbarn som fötts med preaxial polydaktyli vars mamma fick azatioprin 200 mg dagligen och prednison 20 mg varannan dag under graviditeten.15 Tallent et al beskrev ett spädbarn med en stor myelomeningocele i den övre ländryggen, bilaterala dislocerade höfter och bilaterala höfter. talipes equinovarus. Fadern var på långtidsbehandling med azatioprin.16
Nytta mot risk måste vägas noggrant före användning av IMURAN hos patienter med reproduktionspotential. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Om detta läkemedel används under graviditet eller om patienten blir gravid medan du tar detta läkemedel, bör patienten informeras om den potentiella faran för fostret. Kvinnor i fertil ålder bör rådas att undvika att bli gravida.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
En gastrointestinal överkänslighetsreaktion kännetecknad av kraftigt illamående och kräkningar har rapporterats. Dessa symtom kan också åtföljas av diarré, hudutslag, feber, sjukdomskänsla, myalgi, förhöjda leverenzymer och ibland hypotoni. Symtom på gastrointestinal toxicitet utvecklas oftast inom de första veckorna av behandlingen med IMURAN 25 mg och är reversibla vid utsättande av läkemedlet. Reaktionen kan återkomma inom några timmar efter återutsättning med en engångsdos av IMURAN.
Laboratorietester
Övervakning av fullständigt blodvärde (CBC).
Patienter som tar IMURAN 25 mg bör ha fullständiga blodvärden, inklusive trombocytantal, en gång i veckan under den första månaden, två gånger i månaden under den andra och tredje månaden av behandlingen, sedan en gång i månaden eller oftare om dosändringar eller andra behandlingsändringar är nödvändiga.
TPMT-testning
Det rekommenderas att man överväger antingen genotyp- eller fenotyppatienter för TPMT. Fenotypning och genotypningsmetoder är kommersiellt tillgängliga. De vanligaste icke-funktionella allelerna associerade med minskade nivåer av TPMT-aktivitet är TPMT*2, TPMT*3A och TPMT*3C. Patienter med två icke-funktionella alleler (homozygot) har låg eller frånvarande TPMT-aktivitet och de med en icke-funktionell allel (heterozygot) har intermediär aktivitet. Exakt fenotypning (TPMT-aktivitet av röda blodkroppar) är inte möjliga hos patienter som nyligen har fått blodtransfusioner. TPMT-testning kan också övervägas hos patienter med onormala CBC-resultat som inte svarar på dosreduktion. Att avbryta behandlingen tidigt hos dessa patienter är tillrådligt. TPMT-TEST KAN INTE ERSÄTTNING MOT KOMPLETT BLODANTAL (CBC) MONITORERING HOS PATIENTER SOM MOTTAGAR IMURAN. Ser KLINISK FARMAKOLOGI , VARNINGAR , NEGATIVA REAKTIONER och DOSERING OCH ADMINISTRERING avsnitt.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Ser VARNINGAR sektion.
Graviditet
Teratogena effekter
Graviditetskategori D. Ser VARNINGAR sektion.
Ammande mödrar
Användning av IMURAN 25 mg till ammande mödrar rekommenderas inte. Azatioprin eller dess metaboliter överförs i låga nivåer, både transplacentalt och i bröstmjölk.17,18,19 På grund av potentialen för tumörframkallande egenskaper som visas för azatioprin, bör ett beslut fattas om att avbryta amningen eller avbryta läkemedlet, med beaktande av drogens betydelse för modern.
Pediatrisk användning
Säkerhet och effekt av azatioprin hos pediatriska patienter har inte fastställts.
REFERENSER
2. Weinshilboum R. Tiopurin farmakogenetik: kliniska och molekylära studier av tiopurinmetyltransferas. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Tiopurin S-metyltransferas-genlokuset - implikationer för klinisk farmakogenomik. Farmakogenomik. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopeni relaterad till azatioprin - en enzymbrist orsakad av en vanlig genetisk polymorfism: en recension. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Minskad tiopurinmetyltransferasaktivitet och utveckling av biverkningar av azatioprinbehandling hos patienter med reumatoid artrit. Artrit Rheum. 1998; 41:18581866.
6. Data på fil, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekylär diagnos av tiopurin S-metyltransferasbrist: genetisk grund för azatioprin- och merkaptopurinintolerans. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Tiopurinmetyltransferas genotyp förutsäger behandlingsbegränsande allvarlig toxicitet från azatioprin. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevansen av tiopurinmetyltransferasstatus hos reumatologiska patienter som får azatioprin. Reumatologi. 2004; 43:13-18.
10. Clark JM. Mutageniciteten av azatioprin hos möss, Drosophila melanogaster och Neurospora crassa. Mutat Res. 1975; 28:87-99.
11. Data på fil, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Graviditet efter njurtransplantation. Ann Intern Med. 1975; 82:113-114. Redaktionella anmärkningar.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Effekter på nyfödda av prednison och azatioprin som administreras till modern under graviditeten. J Pediatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Neonatal pancytopeni och svår kombinerad immunbrist i samband med antenatal administrering av azatioprin och prednison. J Pediatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Azatioprin teratogenicitet: genomgång av litteraturen och fallrapporten. Obstet Gynecol. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Födelseskador hos barn till manlig mottagare av njurtransplantation. JAMA. 1970; 211: 1854-1855.
17. Data på fil, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunsuppression under graviditet: överföring av azatioprin och dess metaboliter från modern till fostret. Am J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Amning efter njurtransplantation. Transplantation Proc. 1982; 14: 605-609.
ÖVERDOS
De orala LD50-värdena för engångsdoser av IMURAN 50 mg till möss och råttor är 2500 mg/kg respektive 400 mg/kg. Mycket stora doser av denna antimetabolit kan leda till märghypoplasi, blödning, infektion och död. Cirka 30 % av IMURAN är bundet till serumproteiner, men cirka 45 % avlägsnas under en 8-timmars hemodialys.24 Ett enstaka fall har rapporterats av en njurtransplanterad patient som fick i sig en engångsdos på 7500 mg IMURAN. De omedelbara toxiska reaktionerna var illamående, kräkningar och diarré, följt av mild leukopeni och milda avvikelser i leverfunktionen. Antalet vita blodkroppar, SGOT och bilirubin återgick till det normala 6 dagar efter överdosen.
KONTRAINDIKATIONER
IMURAN 25 mg ska inte ges till patienter som har visat överkänslighet mot läkemedlet. IMURAN ska inte användas för behandling av reumatoid artrit hos gravida kvinnor. Patienter med reumatoid artrit som tidigare behandlats med alkylerande medel (cyklofosfamid, klorambucil, melfalan eller andra) kan ha en oöverkomlig risk för malignitet om de behandlas med IMURAN.
REFERENSER
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Farmakokinetik för azatioprin under hemodialys. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
KLINISK FARMAKOLOGI
Azatioprin absorberas väl efter oral administrering. Maximal serumradioaktivitet inträffar 1 till 2 timmar efter oral 35S-azatioprin och avtar med en halveringstid på 5 timmar. Detta är inte en uppskattning av halveringstiden för azatioprin i sig, utan är sönderfallshastigheten för alla 35S-innehållande metaboliter av läkemedlet. På grund av omfattande metabolism är endast en bråkdel av radioaktiviteten närvarande som azatioprin. Vanliga doser producerar blodnivåer av azatioprin och av merkaptopurin som härrör från det, vilka är låga ( ÖVERDOSERING .
Azatioprin metaboliseras till 6-merkaptopurin (6-MP). Båda föreningarna elimineras snabbt från blodet och oxideras eller metyleras i erytrocyter och lever; ingen azatioprin eller merkaptopurin kan detekteras i urinen efter 8 timmar. Aktivering av 6-merkaptopurin sker via hypoxantin-guanin-fosforibosyltransferas (HGPRT) och en serie multienzymatiska processer som involverar kinaser för att bilda 6-tioguanin-nukleotider (6-TGN) som huvudmetaboliter (se Metabolismschema i figur 1 ). Azatioprins cytotoxicitet beror delvis på inkorporeringen av 6-TGN i DNA.
6-MP genomgår två stora inaktiveringsvägar (Figur 1). En är tiolmetylering, som katalyseras av enzymet tiopurin S-metyltransferas (TPMT), för att bilda den inaktiva metaboliten metyl-6-MP (6-MeMP). TPMT-aktivitet kontrolleras av en genetisk polymorfism.1,2,3 För kaukasier och afroamerikaner ärver cirka 10 % av befolkningen en icke-funktionell TPMT-allel (heterozygot) som ger intermediär TPMT-aktivitet, och 0,3 % ärver två TPMT-icke-funktionella alleler (homozygota) för låg eller frånvarande TPMT-aktivitet. Icke-funktionella alleler är mindre vanliga hos asiater. TPMT-aktivitet korrelerar omvänt med 6-TGN-nivåer i erytrocyter och förmodligen andra hematopoetiska vävnader, eftersom dessa celler har försumbar xantinoxidas (involverad i den andra inaktiveringsvägen) aktiviteter, vilket lämnar TPMT-metylering som den enda inaktiveringsvägen. Patienter med intermediär TPMT-aktivitet kan löpa ökad risk för myelotoxicitet om de får konventionella doser av IMURAN. Patienter med låg eller frånvarande TPMT-aktivitet löper en ökad risk att utveckla allvarlig, livshotande myelotoxicitet om de får konventionella doser av IMURAN.4-9 TPMT genotypning eller fenotypning (röda blodkroppar TPMT-aktivitet) kan hjälpa till att identifiera patienter som har en ökad risk för att utveckla IMURAN 25 mg toxicitet.2,3,7,8,9 Exakt fenotypning (TPMT-aktivitet av röda blodkroppar) är inte möjliga hos patienter som nyligen har fått blodtransfusioner. Ser VARNINGAR , FÖRSIKTIGHETSÅTGÄRDER : LÄKEMEDELSINTERAKTIONER , FÖRSIKTIGHETSÅTGÄRDER : Laboratorietester och NEGATIVA REAKTIONER avsnitt.
Figur 1 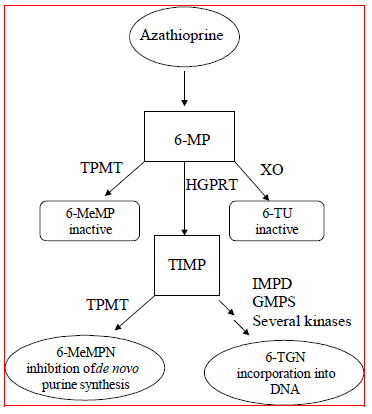 Figur 1. Metabolismväg för azatioprin: konkurrerande vägar resulterar i inaktivering av TPMT eller XO, eller inkorporering av cytotoxiska nukleotider i DNA.
Figur 1. Metabolismväg för azatioprin: konkurrerande vägar resulterar i inaktivering av TPMT eller XO, eller inkorporering av cytotoxiska nukleotider i DNA.
GMPS: Guanosinmonofosfatsyntetas; HGPRT: Hypoxantin-guanin-fosforibosyl-transferas; IMPD: Inosinmonofosfatdehydrogenas; MeMP: Metylmerkaptopurin; MeMPN: Metylmerkaptopurinukleotid; TGN: Tioguaninnukleotider; TIMP: Tioinosinmonofosfat; TPMT: Tiopurin S-metyltransferas; TU tioursyra; XO: Xantinoxidas (anpassad från Pharmacogenomics 2002; 3:89-98; och Cancer Res 2001; 61:5810-5816.)
En annan inaktiveringsväg är oxidation, som katalyseras av xantinoxidas (XO) för att bilda 6-tiourinsyra. Hämningen av xantinoxidas hos patienter som får allopurinol (ZYLOPRIM®) är grunden för den azatioprindosreduktion som krävs hos dessa patienter (se FÖRSIKTIGHETSÅTGÄRDER : LÄKEMEDELSINTERAKTIONER ). Proportionerna av metaboliter är olika hos individuella patienter, och detta förklarar förmodligen varierande storlek och varaktighet av läkemedelseffekter. Renalt clearance är förmodligen inte viktigt för att förutsäga biologisk effektivitet eller toxicitet, även om dosreduktion tillämpas hos patienter med dålig njurfunktion.
Homografts överlevnad
Användningen av azatioprin för hämning av renal homograftavstötning är väl etablerad, mekanismen/mekanismerna för denna verkan är något oklara. Läkemedlet undertrycker överkänslighet av cellmedierad typ och orsakar varierande förändringar i antikroppsproduktionen. Undertryckande av T-cellseffekter, inklusive ablation av T-cellsundertryckning, är beroende av det tidsmässiga förhållandet till antigenisk stimulans eller engraftment. Detta medel har liten effekt på etablerade transplantatavstötningar eller sekundära svar.
Förändringar i specifika immunsvar eller immunologiska funktioner hos transplantationsmottagare är svåra att specifikt relatera till immunsuppression av azatioprin. Dessa patienter har subnormala svar på vacciner, lågt antal T-celler och onormal fagocytos av perifera blodceller, men deras mitogena svar, serumimmunoglobuliner och sekundära antikroppssvar är vanligtvis normala.
Immuninflammatoriskt svar
Azatioprin undertrycker sjukdomsmanifestationer såväl som underliggande patologi i djurmodeller av autoimmun sjukdom. Till exempel reduceras svårighetsgraden av adjuvant artrit av azatioprin.
Mekanismerna för att azatioprin påverkar autoimmuna sjukdomar är inte kända. Azatioprin är immunsuppressivt, fördröjda överkänslighets- och cellulära cytotoxicitetstester undertrycks i högre grad än antikroppssvar. I råttmodellen av adjuvant artrit har azatioprin visat sig hämma lymfkörtelhyperplasin, som föregår början av tecknen på sjukdomen. Både de immunsuppressiva och terapeutiska effekterna i djurmodeller är dosrelaterade. Azatioprin anses vara ett långsamt verkande läkemedel och effekterna kan kvarstå efter att läkemedlet har avbrutits.
REFERENSER
1. Lennard L. Den kliniska farmakologin av 6-merkaptopurin. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Tiopurin farmakogenetik: kliniska och molekylära studier av tiopurinmetyltransferas. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Tiopurin S-metyltransferas-genlokuset - implikationer för klinisk farmakogenomik. Farmakogenomik. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopeni relaterad till azatioprin - en enzymbrist orsakad av en vanlig genetisk polymorfism: en recension. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Minskad tiopurinmetyltransferasaktivitet och utveckling av biverkningar av azatioprinbehandling hos patienter med reumatoid artrit. Artrit Rheum. 1998; 41:18581866.
6. Data på fil, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekylär diagnos av tiopurin S-metyltransferasbrist: genetisk grund för azatioprin- och merkaptopurinintolerans. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Tiopurinmetyltransferas genotyp förutsäger behandlingsbegränsande allvarlig toxicitet från azatioprin. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevansen av tiopurinmetyltransferasstatus hos reumatologiska patienter som får azatioprin. Reumatologi. 2004; 43:13-18.
PATIENTINFORMATION
Patienter som påbörjas med IMURAN bör informeras om nödvändigheten av periodiska blodvärden medan de får läkemedlet och bör uppmuntras att rapportera alla ovanliga blödningar eller blåmärken till sin läkare. De ska informeras om risken för infektion medan de får IMURAN och uppmanas att rapportera tecken och symtom på infektion till sin läkare. Noggranna doseringsinstruktioner bör ges till patienten, särskilt när IMURAN administreras i närvaro av nedsatt njurfunktion eller samtidigt med allopurinol (se LÄKEMEDELSINTERAKTIONER underavsnitt och DOSERING OCH ADMINISTRERING ). Patienter bör informeras om de potentiella riskerna med användning av IMURAN 50 mg under graviditet och under amningsperioden. Den ökade risken för malignitet efter behandling med IMURAN bör förklaras för patienten.
