Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Neurontin och hur används det?
Neurontin 400mg är ett receptbelagt läkemedel som används för att behandla symptomen på nervsmärta och kramper. Neurontin kan användas ensamt eller tillsammans med andra läkemedel.
Neurontin är ett GABA-analogt, antiepileptiskt läkemedel.
Det är inte känt om Neurontin är säkert och effektivt hos barn yngre än 3 år.
Vilka är de möjliga biverkningarna av Neurontin 400mg?
Neurontin kan orsaka allvarliga biverkningar inklusive:
- ökade anfall
- allvarlig svaghet eller trötthet
- problem med balans eller muskelrörelser
- ont i övre magen
- bröstsmärta
- ny eller förvärrad hosta med feber
- problem att andas
- svår stickningar eller domningar
- snabba ögonrörelser
- lite eller ingen urinering
- smärtsamt eller svårt att urinera
- svullnad i dina fötter eller vrister
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Neurontin inkluderar:
- huvudvärk
- yrsel
- dåsighet
- trötthet
- svullnad i händer eller fötter
- problem med dina ögon
- koordinationsproblem
- De vanligaste biverkningarna av Neurontin 600mg hos barn inkluderar:
- feber
- illamående
- kräkningar
- förändringar i beteende
- minnesproblem
- koncentrationssvårigheter
- agerar rastlöst, fientligt eller aggressivt
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Neurontin. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
Den aktiva ingrediensen i NEURONTIN kapslar, tabletter och oral lösning är gabapentin, som har det kemiska namnet 1-(aminometyl)cyklohexanättiksyra.
Molekylformeln för gabapentin är C9H17NO2 och molekylvikten är 171,24. Strukturformeln för gabapentin är:
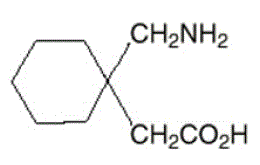
Gabapentin är ett vitt till benvitt kristallint fast ämne med ett pKa1 på 3,7 och ett pKa2 på 10,7. Det är fritt lösligt i vatten och både basiska och sura vattenlösningar. Logaritmen för fördelningskoefficienten (noktanol/0,05M fosfatbuffert) vid pH 7,4 är –1,25.
Varje Neurontin 100 mg kapsel innehåller 100 mg, 300 mg eller 400 mg gabapentin och följande inaktiva ingredienser: laktos, majsstärkelse, talk, gelatin, titandioxid, FD&C Blue No. 2, gul järnoxid (endast 300 mg och 400 mg) och röd järnoxid (endast 400 mg).
Varje Neurontin-tablett innehåller 600 mg eller 800 mg gabapentin och följande inaktiva ingredienser: poloxamer 407, copovidon, majsstärkelse, magnesiumstearat, hydroxipropylcellulosa, talk och candelillavax
Neurontin oral lösning innehåller 250 mg gabapentin per 5 ml (50 mg per ml) och följande inaktiva ingredienser: glycerin, xylitol, renat vatten och artificiell sval jordgubbsanisarom.
INDIKATIONER
NEURONTIN® är indicerat för:
- Hantering av postherpetisk neuralgi hos vuxna
- Tilläggsterapi vid behandling av partiella anfall, med och utan sekundär generalisering, hos vuxna och pediatriska patienter 3 år och äldre med epilepsi
DOSERING OCH ADMINISTRERING
Dosering för postherpetisk neuralgi
Hos vuxna med postherpetisk neuralgi kan NEURONTIN initieras på dag 1 som en engångsdos på 300 mg, på dag 2 som 600 mg/dag (300 mg två gånger om dagen) och på dag 3 som 900 mg/dag (300 mg tre). gånger om dagen). Dosen kan därefter titreras upp efter behov för smärtlindring till en dos på 1800 mg/dag (600 mg tre gånger om dagen). I kliniska studier visades effekt över ett dosintervall från 1800 mg/dag till 3600 mg/dag med jämförbara effekter över hela dosintervallet; i dessa kliniska studier visades dock inte den ytterligare fördelen med att använda doser över 1800 mg/dag.
Dosering för epilepsi med partiella anfall
Patienter 12 år och äldre
Startdosen är 300 mg tre gånger om dagen. Den rekommenderade underhållsdosen av NEURONTIN är 300 mg till 600 mg tre gånger om dagen. Doser upp till 2400 mg/dag har tolererats väl i kliniska långtidsstudier. Doser på 3600 mg/dag har också administrerats till ett litet antal patienter under en relativt kort varaktighet och har tolererats väl. Administrera NEURONTIN tre gånger om dagen med 300 mg eller 400 mg kapslar, eller 600 mg eller 800 mg tabletter. Den maximala tiden mellan doserna bör inte överstiga 12 timmar.
Pediatriska patienter i åldern 3 till 11 år
Startdosintervallet är 10 mg/kg/dag till 15 mg/kg/dag, givet i tre uppdelade doser, och den rekommenderade underhållsdosen uppnås genom upptitrering under en period av cirka 3 dagar. Den rekommenderade underhållsdosen av NEURONTIN till patienter i åldern 3 till 4 år är 40 mg/kg/dag, givet i tre uppdelade doser. Den rekommenderade underhållsdosen av NEURONTIN 100 mg till patienter i åldern 5 till 11 år är 25 mg/kg/dag till 35 mg/kg/dag, givet i tre uppdelade doser. NEURONTIN 300 mg kan administreras som oral lösning, kapsel eller tablett, eller genom att använda kombinationer av dessa formuleringar. Doser upp till 50 mg/kg/dag har tolererats väl i en långtidsstudie. Det maximala tidsintervallet mellan doserna bör inte överstiga 12 timmar.
Dosjustering hos patienter med nedsatt njurfunktion
Dosjustering för patienter 12 år och äldre med nedsatt njurfunktion eller som genomgår hemodialys rekommenderas enligt följande (se doseringsrekommendationer ovan för effektiva doser för varje indikation):
TABELL 1: NEURONTIN-dosering baserad på njurfunktion
Kreatininclearance (CLCr) är svårt att mäta i öppenvård. Hos patienter med stabil njurfunktion kan kreatininclearance uppskattas någorlunda väl genom att använda ekvationen av Cockcroft och Gault:
Användningen av NEURONTIN hos patienter yngre än 12 år med nedsatt njurfunktion har inte studerats.
Dosering hos äldre
Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos och dosen bör justeras baserat på kreatininclearance-värden hos dessa patienter.
Administrationsinformation
Administrera NEURONTIN oralt med eller utan mat.
NEURONTIN 100 mg kapslar ska sväljas hela med vatten.
Informera patienterna om att om de delar upp den skårade tabletten 600 mg eller 800 mg NEURONTIN för att administrera en halv tablett, ska de ta den oanvända halva tabletten som nästa dos. Halva tabletter som inte har använts inom 28 dagar efter att den skårade tabletten delats ska kasseras.
Om NEURONTIN-dosen reduceras, avbryts eller ersätts med en alternativ medicin, bör detta göras gradvis under minst 1 vecka (en längre period kan behövas enligt förskrivarens bedömning).
HUR LEVERERAS
Doseringsformer och styrkor
Kapslar
- 100 mg: vita hårda gelatinkapslar märkta med "PD" på kroppen och "Neurontin/100 mg" på locket
- 300 mg: gula hårda gelatinkapslar tryckta med "PD" på kroppen och "Neurontin/300 mg" på locket
- 400 mg: orange hårda gelatinkapslar tryckta med "PD" på kroppen och "Neurontin/400 mg" på locket
Tabletter
- 600 mg: vita elliptiska filmdragerade tabletter med skåra präglade med "NT" och "16" på ena sidan
- 800 mg: vita elliptiska filmdragerade tabletter med skåra präglade med "NT" och "26" på ena sidan
Oral lösning
- 250 mg per 5 ml (50 mg per ml), klar färglös till svagt gul lösning
Förvaring Och Hantering
NEURONTIN (gabapentin) kapslar, tabletter och oral lösning tillhandahålls enligt följande:
100 mg kapslar
Vita hårda gelatinkapslar tryckta med "PD" på kroppen och "Neurontin/100 mg" på locket; tillgänglig i:
100 flaskor: NDC 0071-0803-24
300 mg kapslar
Gula hårda gelatinkapslar tryckta med "PD" på kroppen och "Neurontin/300 mg" på locket; tillgänglig i:
100 flaskor: NDC 0071-0805-24 Enhetsdos 50 s: NDC 0071-0805-40
400 mg kapslar
Orange hårda gelatinkapslar tryckta med "PD" på kroppen och "Neurontin/400 mg" på locket; tillgänglig i:
100 flaskor: NDC 0071-0806-24 Enhetsdos 50 s: NDC 0071-0806-40
600 mg tabletter
Vita elliptiska filmdragerade tabletter med skåra präglade med "NT" och "16" på ena sidan; tillgänglig i:
100 flaskor: NDC 0071-0513-24
800 mg tabletter
Vita elliptiska filmdragerade tabletter med skåra präglade med "NT" och "26" på ena sidan; tillgänglig i:
100 flaskor: NDC 0071-0401-24
250 mg per 5 ml oral lösning
Klar färglös till svagt gul lösning; varje 5 ml oral lösning innehåller 250 mg gabapentin; tillgänglig i:
Glasflaskor innehållande 470 ml: NDC 0071-2012-23 Flaskor innehållande 470 ml: NDC 0071-2012-44
Förvara NEURONTIN 400 mg tabletter och kapslar vid 25°C (77°F); utflykter tillåtna mellan 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ].
Förvara NEURONTIN oral lösning i kylskåp, 2°C till 8°C (36°F till 46°F).
Distribuerat av: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Reviderad: Dec 2020
BIEFFEKTER
Följande allvarliga biverkningar diskuteras mer i detalj i andra avsnitt:
- Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)/multiorganöverkänslighet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anafylaxi och angioödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Somnolens/Sedation och Yrsel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Abstinens Utlöst anfall, Status Epilepticus [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Suicidalt beteende och idéer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Andningsdepression [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Neuropsykiatriska biverkningar (pediatriska patienter i åldern 3 till 12 år) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Plötslig och oförklarlig död hos patienter med epilepsi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Postherpetisk neuralgi
De vanligaste biverkningarna förknippade med användning av NEURONTIN hos vuxna, som inte setts i motsvarande frekvens bland placebobehandlade patienter, var yrsel, somnolens och perifert ödem.
de 2 kontrollerade studierna med postherpetisk neuralgi avbröt 16 % av de 336 patienter som fick NEURONTIN och 9 % av de 227 patienter som fick placebo behandlingen på grund av en biverkning. De biverkningar som oftast ledde till utsättning hos patienter som behandlats med NEURONTIN var yrsel, somnolens och illamående.
Tabell 3 listar biverkningar som inträffade hos minst 1 % av NEURONTIN-behandlade patienter med postherpetisk neuralgi som deltog i placebokontrollerade studier och som var numeriskt vanligare i NEURONTIN-gruppen än i placebogruppen.
TABELL 3: Biverkningar i poolade placebokontrollerade försök vid postherpetisk neuralgi
Andra reaktioner hos mer än 1 % av patienterna men lika eller oftare i placebogruppen inkluderade smärta, tremor, neuralgi, ryggsmärta, dyspepsi, dyspné och influensasyndrom.
Det fanns inga kliniskt viktiga skillnader mellan män och kvinnor i typen och förekomsten av biverkningar. Eftersom det fanns få patienter vars ras rapporterades som annan än vit, finns det inte tillräckligt med data för att stödja ett påstående om fördelningen av biverkningar per ras.
Epilepsi med partiella anfall (tilläggsterapi)
De vanligaste biverkningarna med NEURONTIN 300 mg i kombination med andra antiepileptika hos patienter >12 år, som inte setts i motsvarande frekvens bland placebobehandlade patienter, var somnolens, yrsel, ataxi, trötthet och nystagmus.
De vanligaste biverkningarna med NEURONTIN i kombination med andra antiepileptika hos pediatriska patienter i åldern 3 till 12 år, som inte ses i samma frekvens bland placebobehandlade patienter, var virusinfektion, feber, illamående och/eller kräkningar, somnolens och fientlighet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Cirka 7 % av de 2074 patienterna >12 år och cirka 7 % av de 449 pediatriska patienterna i åldern 3 till 12 år som fick NEURONTIN i premarketing kliniska prövningar avbröt behandlingen på grund av en biverkning. De biverkningar som oftast förknippades med abstinens hos patienter >12 år var somnolens (1,2 %), ataxi (0,8 %), trötthet (0,6 %), illamående och/eller kräkningar (0,6 %) och yrsel (0,6 %). . De biverkningar som oftast förknippas med abstinens hos pediatriska patienter var emotionell labilitet (1,6 %), fientlighet (1,3 %) och hyperkinesi (1,1 %).
Tabell 4 listar biverkningar som inträffade hos minst 1 % av NEURONTIN-behandlade patienter >12 år med epilepsi som deltog i placebokontrollerade studier och som var numeriskt vanligare i NEURONTIN-gruppen. I dessa studier lades antingen NEURONTIN 300 mg eller placebo till patientens nuvarande antiepileptikabehandling.
TABELL 4: Biverkningar i poolade placebokontrollerade tilläggsförsök hos epilepsipatienter >12 år gamla
Bland de biverkningar som inträffade med en incidens på minst 10 % hos NEURONTIN-behandlade patienter, verkade somnolens och ataxi uppvisa ett positivt dos-responssamband.
Den totala förekomsten av biverkningar och de typer av biverkningar som sågs var likartad bland män och kvinnor som behandlades med NEURONTIN. Incidensen av biverkningar ökade något med stigande ålder hos patienter som behandlades med antingen NEURONTIN eller placebo. Eftersom endast 3 % av patienterna (28/921) i placebokontrollerade studier identifierades som icke-vita (svarta eller andra), finns det otillräckliga data för att stödja ett påstående om fördelningen av biverkningar efter ras.
Tabell 5 listar biverkningar som inträffade hos minst 2 % av NEURONTIN-behandlade patienter i åldern 3 till 12 år med epilepsi som deltog i placebokontrollerade studier, och som var numeriskt vanligare i NEURONTIN-gruppen.
TABELL 5: Biverkningar i en placebokontrollerad tilläggsprövning på pediatriska epilepsipatienter i åldern 3 till 12 år
Andra reaktioner hos mer än 2 % av pediatriska patienter 3 till 12 år men lika eller oftare i placebogruppen inkluderade: faryngit, övre luftvägsinfektion, huvudvärk, rinit, kramper, diarré, anorexi, hosta och otitis media.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av NEURONTIN efter marknadsföring. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Lever och gallvägar: gulsot
Undersökningar: förhöjt kreatinkinas, förhöjda leverfunktionstester
Metabolism och näringsstörningar: hyponatremi
Muskuloskeletala och bindvävssjukdomar: rabdomyolys
Störningar i nervsystemet: rörelsestörning
Psykiatriska störningar: agitation
Reproduktionssystemet och bröststörningar: bröstförstoring, förändringar i libido, ejakulationsrubbningar och anorgasmi
Hud och subkutan vävnad: angioödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], bullös pemfigoid, erythema multiforme, Stevens-Johnsons syndrom.
Det finns rapporter efter marknadsföringen av livshotande eller dödlig andningsdepression hos patienter som tar NEURONTIN med opioider eller andra CNS-dämpande medel, eller i samband med underliggande andningsförsämring [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Biverkningar efter abrupt utsättning av gabapentin har också rapporterats. De vanligast rapporterade reaktionerna var ångest, sömnlöshet, illamående, smärta och svettning.
LÄKEMEDELSINTERAKTIONER
Opioider
Andningsdepression och sedering, som ibland leder till dödsfall, har rapporterats efter samtidig administrering av gabapentin och opioider (t.ex. morfin, hydrokodon, oxikodon, buprenorfin) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hydrokodon
Samtidig administrering av NEURONTIN 300 mg och hydrokodon minskar exponeringen av hydrokodon [se KLINISK FARMAKOLOGI ]. Potentialen för förändring av hydrokodonexponering och effekt bör övervägas när NEURONTIN 100 mg påbörjas eller avbryts hos en patient som tar hydrokodon.
Morfin
När gabapentin administreras med morfin ska patienter observeras för tecken på CNS-depression, såsom somnolens, sedering och andningsdepression [se KLINISK FARMAKOLOGI ].
Andra antiepileptika
Gabapentin metaboliseras inte nämnvärt och stör inte heller metabolismen av vanliga antiepileptika som administreras samtidigt [se KLINISK FARMAKOLOGI ].
Maalox® (aluminiumhydroxid, magnesiumhydroxid)
Den genomsnittliga biotillgängligheten för gabapentin minskade med cirka 20 % vid samtidig användning av ett antacidum (Maalox) innehållande magnesium- och aluminiumhydroxider. Det rekommenderas att gabapentin tas minst 2 timmar efter administrering av Maalox [se KLINISK FARMAKOLOGI ].
Interaktioner med läkemedel/laboratorietest
Eftersom falskt positiva värden rapporterades med Ames N-Multistix SG dipstick-testet för urinprotein när gabapentin sattes till andra antiepileptika, rekommenderas den mer specifika sulfosalicylsyrautfällningsproceduren för att fastställa förekomsten av urinprotein.
Narkotikamissbruk och beroende
Kontrollerad substans
Gabapentin är inte ett planerat läkemedel.
Missbruk
Missbruk är avsiktlig, icke-terapeutisk användning av ett läkemedel, även en gång, för dess önskvärda psykologiska eller fysiologiska effekter. Missbruk är avsiktlig användning, i terapeutiska syften, av ett läkemedel av en individ på ett annat sätt än vad som ordinerats av en vårdgivare eller för vilken det inte ordinerats.
Gabapentin uppvisar inte affinitet för bensodiazepin-, opioid- (mu, delta eller kappa) eller cannabinoid 1-receptorställen. Missbruk och missbruk av Gabapentin har rapporterats efter marknadsföring och publicerad litteratur. De flesta av de individer som beskrivs i dessa rapporter hade en historia av polysubstansmissbruk. Några av dessa individer tog högre än rekommenderade doser av gabapentin för icke godkänd användning. När du förskriver NEURONTIN, utvärdera noggrant patienterna med avseende på en historia av drogmissbruk och observera dem med avseende på tecken och symtom på missbruk eller missbruk av gabapentin (t.ex. självdosupptrappning och drogsökande beteende). Missbrukspotentialen för gabapentin har inte utvärderats i humanstudier.
Beroende
Fysiskt beroende är ett tillstånd som utvecklas som ett resultat av fysiologisk anpassning som svar på upprepad droganvändning, manifesterad av abstinenssymptom efter abrupt avbrott eller en betydande dosreduktion av ett läkemedel. Det finns sällsynta rapporter efter marknadsföring om individer som upplever abstinenssymtom kort efter att ha avbrutit högre doser av gabapentin än rekommenderade för att behandla sjukdomar för vilka läkemedlet inte är godkänt. Sådana symtom inkluderade agitation, desorientering och förvirring efter plötslig utsättning av gabapentin som försvann efter återstart med gabapentin. Beroendepotentialen för gabapentin har inte utvärderats i humanstudier.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)/multiorganöverkänslighet
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS), även känd som multiorganöverkänslighet, har inträffat med NEURONTIN. Vissa av dessa reaktioner har varit dödliga eller livshotande. DRESS uppvisar vanligtvis, men inte uteslutande, feber, hudutslag och/eller lymfadenopati, i samband med andra organsysteminblandning, såsom hepatit, nefrit, hematologiska avvikelser, myokardit eller myosit som ibland liknar en akut virusinfektion. Eosinofili är ofta närvarande. Denna störning är variabel i sitt uttryck, och andra organsystem som inte noteras här kan vara inblandade.
Det är viktigt att notera att tidiga manifestationer av överkänslighet, såsom feber eller lymfadenopati, kan förekomma även om utslag inte är uppenbara. Om sådana tecken eller symtom finns ska patienten utvärderas omedelbart. NEURONTIN bör avbrytas om en alternativ etiologi för tecknen eller symtomen inte kan fastställas.
Anafylaxi och angioödem
NEURONTIN kan orsaka anafylaxi och angioödem efter den första dosen eller när som helst under behandlingen. Tecken och symtom i rapporterade fall har inkluderat andningssvårigheter, svullnad av läppar, svalg och tunga och hypotoni som kräver akut behandling. Patienter bör instrueras att avbryta behandlingen med NEURONTIN 300 mg och omedelbart söka läkarvård om de upplever tecken eller symtom på anafylaxi eller angioödem.
Effekter på att köra och använda tunga maskiner
Patienter som tar NEURONTIN ska inte köra bil förrän de har fått tillräcklig erfarenhet för att bedöma om NEURONTIN 100 mg försämrar deras förmåga att köra bil. Körförmågasstudier utförda med en prodrug av gabapentin (gabapentin enacarbil tablett, förlängd frisättning) indikerar att gabapentin kan orsaka betydande försämring av körningen. Förskrivare och patienter bör vara medvetna om att patienter' förmåga att bedöma sin egen körförmåga, liksom deras förmåga att bedöma graden av somnolens orsakad av NEURONTIN, kan vara ofullkomlig. Varaktigheten av nedsatt körning efter påbörjad behandling med NEURONTIN 300 mg är okänd. Huruvida försämringen är relaterad till somnolens [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ] eller andra effekter av NEURONTIN är okänd.
Dessutom, eftersom NEURONTIN 300 mg orsakar somnolens och yrsel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ], bör patienter rådas att inte använda komplexa maskiner förrän de har fått tillräcklig erfarenhet av NEURONTIN för att bedöma om NEURONTIN 300 mg försämrar deras förmåga att utföra sådana uppgifter.
Somnolens/Sedation Och Yrsel
Under de kontrollerade epilepsistudierna på patienter äldre än 12 år som fick doser av NEURONTIN 100 mg upp till 1800 mg dagligen, rapporterades somnolens, yrsel och ataxi i en högre frekvens hos patienter som fick NEURONTIN jämfört med placebo: dvs. 19 % i läkemedel mot 9 % i placebo för somnolens, 17 % i läkemedel mot 7 % i placebo för yrsel och 13 % i läkemedel mot 6 % i placebo för ataxi. I dessa studier var somnolens, ataxi och trötthet vanliga biverkningar som ledde till utsättning av NEURONTIN hos patienter äldre än 12 år, med 1,2 %, 0,8 % respektive 0,6 % som avbröt för dessa händelser.
Under de kontrollerade studierna på patienter med postherpetisk neuralgi rapporterades somnolens och yrsel i en högre frekvens jämfört med placebo hos patienter som fick NEURONTIN, i doser upp till 3600 mg per dag: dvs 21 % hos NEURONTIN-behandlade patienter jämfört med 5 % hos placebobehandlade patienter för somnolens och 28 % hos NEURONTIN-behandlade patienter jämfört med 8 % hos placebobehandlade patienter för yrsel. Yrsel och somnolens var bland de vanligaste biverkningarna som ledde till utsättning av NEURONTIN.
Patienter bör noggrant observeras för tecken på depression av centrala nervsystemet (CNS), såsom somnolens och sedering, när NEURONTIN 400 mg används tillsammans med andra läkemedel med lugnande egenskaper på grund av potentiell synergi. Dessutom kan patienter som behöver samtidig behandling med morfin uppleva ökade gabapentinkoncentrationer och kan behöva dosjustering [se LÄKEMEDELSINTERAKTIONER ].
Abstinens Utlöst anfall, Status Epilepticus
Antiepileptika bör inte abrupt avbrytas på grund av risken för ökad anfallsfrekvens.
I de placebokontrollerade epilepsistudierna på patienter >12 år var incidensen av status epilepticus hos patienter som fick NEURONTIN 0,6 % (3 av 543) jämfört med 0,5 % hos patienter som fick placebo (2 av 378). Bland de 2074 patienter >12 år som behandlades med NEURONTIN 300 mg i alla epilepsistudier (kontrollerade och okontrollerade), hade 31 (1,5 %) status epilepticus. Av dessa hade 14 patienter ingen tidigare historia av status epilepticus, vare sig före behandling eller medan de fick andra mediciner. Eftersom adekvata historiska data inte finns tillgängliga är det omöjligt att säga om behandling med NEURONTIN är associerad med en högre eller lägre frekvens av status epilepticus än vad som förväntas inträffa i en liknande population som inte behandlas med NEURONTIN.
Suicidalt beteende och idéer
Antiepileptika (AED), inklusive NEURONTIN 100 mg, ökar risken för självmordstankar eller självmordsbeteende hos patienter som tar dessa läkemedel för alla indikationer. Patienter som behandlas med någon AED för alla indikationer bör övervakas med avseende på uppkomsten eller försämringen av depression, självmordstankar eller -beteende och/eller några ovanliga förändringar i humör eller beteende.
Sammanslagna analyser av 199 placebokontrollerade kliniska prövningar (mono- och tilläggsterapi) av 11 olika hjärtstartare visade att patienter som randomiserades till en av hjärtmedicinerna hade ungefär dubbelt så stor risk (justerad relativ risk 1,8, 95 % CI:1,2, 2,7) för suicidalism. tänkande eller beteende jämfört med patienter randomiserade till placebo. I dessa studier, som hade en medianbehandlingstid på 12 veckor, var den uppskattade förekomsten av suicidalt beteende eller självmordstankar bland 27 863 AED-behandlade patienter 0,43 %, jämfört med 0,24 % bland 16 029 placebobehandlade patienter, vilket motsvarar en ökning med cirka en fall av suicidalt tänkande eller beteende för varje 530 behandlade patienter. Det förekom fyra självmord hos läkemedelsbehandlade patienter i försöken och ingen hos placebotbehandlade patienter, men antalet är för litet för att tillåta någon slutsats om läkemedelseffekt på självmord.
Den ökade risken för självmordstankar eller självmordsbeteende med AED observerades så tidigt som en vecka efter påbörjad läkemedelsbehandling med AED och kvarstod under den utvärderade behandlingen. Eftersom de flesta prövningar som ingick i analysen inte sträckte sig längre än 24 veckor kunde risken för självmordstankar eller självmordsbeteende längre än 24 veckor inte bedömas.
Risken för självmordstankar eller självmordsbeteende var generellt konsekvent bland drogerna i de analyserade uppgifterna. Upptäckten av ökad risk med hjärtstartare med olika verkningsmekanismer och över en rad olika indikationer tyder på att risken gäller alla hjärtstartare som används för alla indikationer. Risken varierade inte nämnvärt beroende på ålder (5–100 år) i de analyserade kliniska prövningarna. Tabell 2 visar absolut och relativ risk per indikation för alla utvärderade hjärtstartare.
TABELL 2: Risk per indikation för antiepileptika i den sammanslagna analysen
Den relativa risken för självmordstankar eller självmordsbeteende var högre i kliniska prövningar för epilepsi än i kliniska prövningar för psykiatriska eller andra tillstånd, men de absoluta riskskillnaderna var likartade för epilepsi och psykiatriska indikationer.
Alla som överväger att förskriva NEURONTIN 100mg eller någon annan AED måste balansera risken för självmordstankar eller självmordsbeteende med risken för obehandlad sjukdom. Epilepsi och många andra sjukdomar som AED ordineras för är i sig förknippade med sjuklighet och dödlighet och en ökad risk för självmordstankar och självmordsbeteende. Om självmordstankar och självmordsbeteende dyker upp under behandlingen måste förskrivaren överväga om uppkomsten av dessa symtom hos en given patient kan vara relaterad till den sjukdom som behandlas.
Patienter, deras vårdgivare och familjer bör informeras om att AED ökar risken för självmordstankar och självmordsbeteende och bör informeras om behovet av att vara uppmärksam på uppkomsten eller förvärringen av tecken och symtom på depression, eventuella ovanliga förändringar i humör eller beteende. , eller uppkomsten av självmordstankar, beteenden eller tankar om självskada. Beteende som ger anledning till oro bör omedelbart rapporteras till vårdgivare.
Andningsdepression
Det finns bevis från fallrapporter, humanstudier och djurstudier som associerar gabapentin med allvarlig, livshotande eller dödlig andningsdepression när det administreras samtidigt med CNS-depressiva medel, inklusive opioider, eller i samband med underliggande andningsförsämring. När beslut fattas att samtidigt förskriva NEURONTIN 100 mg med ett annat CNS-dämpande medel, särskilt en opioid, eller att förskriva NEURONTIN 100 mg till patienter med underliggande andningssvikt, övervaka patienterna med avseende på symtom på andningsdepression och sedering, och överväg att påbörja NEURONTIN med en låg dos . Hanteringen av andningsdepression kan innefatta noggrann observation, stödjande åtgärder och minskning eller utsättande av CNS-depressiva medel (inklusive NEURONTIN).
Neuropsykiatriska biverkningar (pediatriska patienter i åldern 3 till 12 år)
Användning av gabapentin hos pediatriska patienter med epilepsi i åldern 3 till 12 år är associerad med förekomsten av CNS-relaterade biverkningar. De mest betydande av dessa kan klassificeras i följande kategorier: 1) emotionell labilitet (främst beteendeproblem), 2) fientlighet, inklusive aggressiva beteenden, 3) tankestörning, inklusive koncentrationsproblem och förändringar i skolprestationer, och 4) hyperkinesi ( främst rastlöshet och hyperaktivitet). Bland de gabapentinbehandlade patienterna var de flesta av reaktionerna milda till måttliga i intensitet.
kontrollerade kliniska epilepsistudier på pediatriska patienter i åldern 3 till 12 år var förekomsten av dessa biverkningar: emotionell labilitet 6 % (gabapentinbehandlade patienter) mot 1,3 % (placebobehandlade patienter); fientlighet 5,2% mot 1,3%; hyperkinesi 4,7% mot 2,9%; och tankestörning 1,7 % mot 0 %. En av dessa reaktioner, en rapport om fientlighet, ansågs allvarlig. Avbrytande av gabapentinbehandling inträffade hos 1,3 % av patienterna som rapporterade känslomässig labilitet och hyperkinesi och 0,9 % av gabapentinbehandlade patienter rapporterade fientlighet och tankestörning. En placebobehandlad patient (0,4%) drog sig tillbaka på grund av emotionell labilitet.
Tumörframkallande potential
I en oral karcinogenicitetsstudie ökade gabapentin förekomsten av pankreas acinarcelltumörer hos råttor [se Icke-klinisk toxikologi ]. Den kliniska betydelsen av detta fynd är okänd. Klinisk erfarenhet under utvecklingen av gabapentins premarketing ger inga direkta sätt att bedöma dess potential för att inducera tumörer hos människor.
I kliniska studier av tilläggsterapi vid epilepsi omfattande 2 085 patientår av exponering hos patienter >12 år, rapporterades nya tumörer hos 10 patienter (2 bröst, 3 hjärnor, 2 lungor, 1 binjure, 1 icke-Hodgkin' s lymfom, 1 endometriekarcinom in situ) och redan existerande tumörer förvärrades hos 11 patienter (9 hjärnor, 1 bröst, 1 prostata) under eller upp till 2 år efter avslutad behandling med NEURONTIN. Utan kunskap om bakgrundsincidensen och recidiv i en liknande population som inte behandlats med NEURONTIN 100 mg är det omöjligt att veta om incidensen som ses i denna kohort påverkas eller inte påverkas av behandlingen.
Plötslig och oförklarlig död hos patienter med epilepsi
Under utvecklingen av NEURONTIN 400 mg före marknadsföringen, registrerades 8 plötsliga och oförklarade dödsfall bland en kohort av 2203 epilepsipatienter som behandlades (2103 patientår av exponering) med NEURONTIN.
Några av dessa kan representera anfallsrelaterade dödsfall där anfallet inte observerades, t.ex. på natten. Detta motsvarar en incidens på 0,0038 dödsfall per patientår. Även om denna frekvens överstiger den som förväntas i en frisk population matchad för ålder och kön, ligger den inom intervallet för uppskattningar för förekomsten av plötsliga oförklarade dödsfall hos patienter med epilepsi som inte får NEURONTIN (från 0,0005 för den allmänna epileptikerpopulationen till 0,003 för epilepsipatienter en klinisk prövningspopulation som liknar den i NEURONTIN-programmet, till 0,005 för patienter med refraktär epilepsi). Huruvida dessa siffror är betryggande eller väcker ytterligare oro beror följaktligen på jämförbarheten av populationerna som rapporterats till NEURONTIN-kohorten och noggrannheten hos de uppskattningar som tillhandahålls.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ).
Administrationsinformation
Informera patienterna om att NEURONTIN tas oralt med eller utan mat. Informera patienterna om att om de delar upp den skårade 600 mg eller 800 mg tabletten för att administrera en halv tablett, ska de ta den oanvända halva tabletten som nästa dos. Rekommendera patienter att kassera halvtabletter som inte har använts inom 28 dagar efter att den skårade tabletten delas.
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)/multiorganöverkänslighet
Innan behandling med NEURONTIN påbörjas, instruera patienterna att utslag eller andra tecken eller symtom på överkänslighet (såsom feber eller lymfadenopati) kan förebåda en allvarlig medicinsk händelse och att patienten omedelbart ska rapportera en sådan händelse till en läkare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anafylaxi och angioödem
Råda patienter att avbryta behandlingen med NEURONTIN 300 mg och söka läkarvård om de utvecklar tecken eller symtom på anafylaxi eller angioödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Yrsel och somnolens och effekter på att köra bil och använda tunga maskiner
Informera patienter om att NEURONTIN 100 mg kan orsaka yrsel, somnolens och andra symtom och tecken på CNS-depression. Andra läkemedel med lugnande egenskaper kan öka dessa symtom. Följaktligen, även om patienter' förmågan att fastställa sin funktionsnedsättning kan vara opålitlig, råd dem att varken köra bil eller använda andra komplexa maskiner förrän de har fått tillräcklig erfarenhet av NEURONTIN för att bedöma om det påverkar deras mentala och/eller motoriska prestanda negativt eller inte. Informera patienterna om att det inte är känt hur länge denna effekt varar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Suicidalt tänkande och beteende
Informera patienten, deras vårdgivare och familjer om att AED, inklusive NEURONTIN, kan öka risken för självmordstankar och självmordsbeteende. Informera patienter om behovet av att vara uppmärksam på uppkomsten eller försämringen av symtom på depression, eventuella ovanliga förändringar i humör eller beteende, eller uppkomsten av självmordstankar, beteenden eller tankar om självskada. Instruera patienter att omedelbart rapportera oroande beteenden till vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Andningsdepression
Informera patienter om risken för andningsdepression. Inkludera information om att risken är störst för dem som samtidigt använder CNS-depressiva medel (som opioidanalgetika) eller de med underliggande andningsnedsättning. Lär patienter hur man känner igen andningsdepression och råd dem att omedelbart söka läkarvård om det inträffar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Använd under graviditet
Instruera patienter att meddela sin läkare om de blir gravida eller avser att bli gravida under behandlingen, och att meddela sin läkare om de ammar eller avser att amma under behandlingen [se Användning i specifika populationer ].
Uppmuntra patienter att registrera sig i NAAED:s graviditetsregister om de blir gravida. Detta register samlar information om säkerheten för antiepileptika under graviditet. För att registrera sig kan patienter ringa det avgiftsfria numret 1-888-233-2334 [se Användning i specifika populationer ].
Den här produktens märkning kan ha uppdaterats. För den senaste förskrivningsinformationen, besök www.pfizer.com.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Gabapentin administrerades oralt till möss och råttor i 2-åriga karcinogenicitetsstudier. Inga tecken på läkemedelsrelaterad karcinogenicitet observerades hos möss som behandlats i doser upp till 2000 mg/kg/dag. Vid 2000 mg/kg var plasmaexponeringen för gabapentin (AUC) hos möss ungefär 2 gånger den hos människor vid MRHD på 3600 mg/dag. Hos råttor upptäcktes ökningar av incidensen av pankreatisk acinarcelladenom och karcinom hos hanråttor som fick den högsta dosen (2000 mg/kg), men inte vid doser på 250 eller 1000 mg/kg/dag. Vid 1000 mg/kg var plasmaexponeringen för gabapentin (AUC) hos råttor cirka 5 gånger högre än hos människor vid MRHD.
Studier utformade för att undersöka mekanismen för gabapentin-inducerad pankreaskarcinogenes hos råttor indikerar att gabapentin stimulerar DNA-syntesen i pankreatiska acinära celler från råtta in vitro och därför kan verka som en tumörpromotor genom att förstärka mitogen aktivitet. Det är inte känt om gabapentin har förmågan att öka cellproliferation i andra celltyper eller hos andra arter, inklusive människor.
Mutagenes
Gabapentin visade inte mutagent eller genotoxisk potential in vitro (Ames-test, HGPRT framåtmutationsanalys i kinesisk hamster-lungceller) och in vivo (kromosomavvikelse och mikronukleustest i benmärg hos kinesisk hamster, mikrokärna hos mus, oplanerad DNA-syntes i råttas hepatocyter) analyser.
Nedsättning av fertilitet
Inga negativa effekter på fertilitet eller reproduktion observerades hos råttor vid doser upp till 2000 mg/kg. Vid 2000 mg/kg är plasmaexponeringen för gabapentin (AUC) hos råttor cirka 8 gånger högre än hos människor vid MRHD.
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för antiepileptika (AED), såsom NEURONTIN 300 mg, under graviditeten. Uppmuntra kvinnor som tar NEURONTIN under graviditeten att registrera sig i North American Antiepileptic Drug (NAAED) Pregnancy Registry genom att ringa det avgiftsfria numret 1-888-233-2334 eller besöka http://www.aedpregnancyregistry.org/.
Risksammanfattning
Det finns inga adekvata data om utvecklingsriskerna förknippade med användning av NEURONTIN hos gravida kvinnor. I icke-kliniska studier på möss, råttor och kaniner var gabapentin utvecklingstoxiskt (ökade fostrets skelett- och viscerala abnormiteter och ökad embryofetal mortalitet) när det administrerades till dräktiga djur i doser liknande eller lägre än de som används kliniskt [se Data ].
den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 till 4 % respektive 15 till 20 %. Bakgrundsrisken för stora fosterskador och missfall för den indikerade populationen är okänd.
Data
Djurdata
När gravida möss fick orala doser av gabapentin (500, 1000 eller 3000 mg/kg/dag) under organogenesperioden observerades embryofetal toxicitet (ökad incidens av skelettvariationer) vid de två högsta doserna. Ingen effektdos för embryofetal utvecklingstoxicitet hos möss (500 mg/kg/dag) är mindre än den maximala rekommenderade humandosen (MRHD) på 3600 mg på basis av kroppsyta (mg/m²).
I studier där råttor fick orala doser av gabapentin (500 till 2000 mg/kg/dag) under graviditeten observerades negativ effekt på avkommans utveckling (ökad förekomst av hydroureter och/eller hydronefros) vid alla doser. Den lägsta testade dosen liknar MRHD på mg/m² basis.
När dräktiga kaniner behandlades med gabapentin under organogenesperioden observerades en ökning av embryofetal dödlighet vid alla testade doser (60, 300 eller 1500 mg/kg). Den lägsta testade dosen är lägre än MRHD på mg/m² basis.
I en publicerad studie administrerades gabapentin (400 mg/kg/dag) genom intraperitoneal injektion till neonatala möss under den första postnatala veckan, en period av synaptogenes hos gnagare (motsvarande graviditetens sista trimester hos människor). Gabapentin orsakade en markant minskning av neuronal synapsbildning i hjärnan hos intakta möss och onormal neuronal synapsbildning i en musmodell för synaptisk reparation. Gabapentin har in vitro visats störa aktiviteten hos α2δ-subenheten av spänningsaktiverade kalciumkanaler, en receptor involverad i neuronal synaptogenes. Den kliniska betydelsen av dessa fynd är okänd.
Laktation
Risksammanfattning
Gabapentin utsöndras i modersmjölk efter oral administrering. Effekterna på det ammade barnet och på mjölkproduktionen är okända. De utvecklingsmässiga och hälsomässiga fördelarna med amning bör övervägas tillsammans med moderns kliniska behov av NEURONTIN och eventuella negativa effekter på det ammade barnet från NEURONTIN eller från det underliggande moderns tillståndet.
Pediatrisk användning
Säkerhet och effektivitet för NEURONTIN 600 mg vid behandling av postherpetisk neuralgi hos pediatriska patienter har inte fastställts.
Säkerhet och effektivitet som tilläggsbehandling vid behandling av partiella anfall hos pediatriska patienter under 3 år har inte fastställts [se Kliniska studier ].
Geriatrisk användning
Det totala antalet patienter som behandlades med NEURONTIN i kontrollerade kliniska prövningar på patienter med postherpetisk neuralgi var 336, varav 102 (30 %) var 65 till 74 år och 168 (50 %) var 75 år och äldre. Det fanns en större behandlingseffekt hos patienter 75 år och äldre jämfört med yngre patienter som fick samma dos. Eftersom gabapentin nästan uteslutande elimineras genom renal utsöndring, kan den större behandlingseffekt som observerats hos patienter ≥75 år vara en konsekvens av ökad gabapentinexponering för en given dos som är ett resultat av en åldersrelaterad minskning av njurfunktionen. Andra faktorer kan dock inte uteslutas. Typerna och förekomsten av biverkningar var likartade i alla åldersgrupper förutom perifert ödem och ataxi, som tenderade att öka i incidens med åldern.
Kliniska studier av NEURONTIN vid epilepsi inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarade annorlunda än yngre försökspersoner. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
Detta läkemedel är känt för att väsentligen utsöndras via njurarna, och risken för toxiska reaktioner på detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos och dosen bör justeras baserat på kreatininclearance-värden hos dessa patienter [se DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , och KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
Dosjustering hos vuxna patienter med nedsatt njurfunktion är nödvändig [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ]. Pediatriska patienter med njurinsufficiens har inte studerats.
Dosjustering hos patienter som genomgår hemodialys är nödvändig [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
ÖVERDOS
Tecken på akut toxicitet hos djur inkluderade ataxi, ansträngd andning, ptos, sedering, hypoaktivitet eller excitation.
Akuta orala överdoser av NEURONTIN 300 mg har rapporterats. Symtomen har inkluderat dubbelseende, tremor, sluddrigt tal, dåsighet, förändrad mental status, yrsel, letargi och diarré. Dödlig andningsdepression har rapporterats med NEURONTIN 400 mg överdosering, enbart och i kombination med andra CNS-dämpande medel.
Gabapentin kan avlägsnas genom hemodialys.
Om överexponering inträffar, ring din giftkontrollcentral på 1-800-222-1222.
KONTRAINDIKATIONER
NEURONTIN är kontraindicerat hos patienter som har visat överkänslighet mot läkemedlet eller dess ingredienser.
KLINISK FARMAKOLOGI
Handlingsmekanism
De exakta mekanismerna genom vilka gabapentin producerar sin analgetiska och antiepileptiska verkan är okända. Gabapentin är strukturellt besläktat med signalsubstansen gamma-aminosmörsyra (GABA) men har ingen effekt på GABA-bindning, upptag eller nedbrytning. In vitro-studier har visat att gabapentin binder med hög affinitet till α2δ-subenheten av spänningsaktiverade kalciumkanaler; dock är sambandet mellan denna bindning och de terapeutiska effekterna av gabapentin okänt.
Farmakokinetik
Alla farmakologiska effekter efter administrering av gabapentin beror på aktiviteten hos moderföreningen; gabapentin metaboliseras inte nämnvärt hos människor.
Oral biotillgänglighet
Gabapentins biotillgänglighet är inte dosproportionell; dvs när dosen ökas minskar biotillgängligheten. Biotillgängligheten för gabapentin är cirka 60 %, 47 %, 34 %, 33 % och 27 % efter 900, 1200, 2400, 3600 respektive 4800 mg/dag givet i 3 uppdelade doser. Mat har endast en liten effekt på hastigheten och graden av absorption av gabapentin (14 % ökning av AUC och Cmax).
Distribution
Mindre än 3 % av gabapentin cirkulerar bundet till plasmaprotein. Den skenbara distributionsvolymen för gabapentin efter 150 mg intravenös administrering är 58±6 L (medelvärde ±SD). Hos patienter med epilepsi var steady-state predose (Cmin)-koncentrationer av gabapentin i cerebrospinalvätska cirka 20 % av motsvarande plasmakoncentrationer.
Eliminering
Gabapentin elimineras från den systemiska cirkulationen genom renal utsöndring som oförändrat läkemedel. Gabapentin metaboliseras inte nämnvärt hos människor.
Gabapentins eliminationshalveringstid är 5 till 7 timmar och är oförändrad av dos eller efter upprepad dosering. Gabapentins eliminationshastighetskonstant, plasmaclearance och renalt clearance är direkt proportionella mot kreatininclearance. Hos äldre patienter och hos patienter med nedsatt njurfunktion är plasmaclearance av gabapentin reducerad. Gabapentin kan avlägsnas från plasma genom hemodialys.
Specifika populationer
Ålder
Effekten av ålder studerades hos försökspersoner 20–80 år. Synbar oral clearance (CL/F) av gabapentin minskade när åldern ökade, från cirka 225 ml/min hos personer under 30 år till cirka 125 ml/min hos personer över 70 år. Renalt clearance (CLr) och CLr justerat för kroppsyta minskade också med åldern; nedgången i njurclearance av gabapentin med åldern kan dock till stor del förklaras av nedgången i njurfunktionen. [ser DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Kön
Även om ingen formell studie har utförts för att jämföra farmakokinetiken för gabapentin hos män och kvinnor, verkar det som om de farmakokinetiska parametrarna för män och kvinnor är likartade och att det inte finns några signifikanta könsskillnader.
Lopp
Farmakokinetiska skillnader på grund av ras har inte studerats. Eftersom gabapentin huvudsakligen utsöndras via njurarna och det inte finns några viktiga rasskillnader i kreatininclearance, förväntas inte farmakokinetiska skillnader på grund av ras.
Pediatrisk
Gabapentins farmakokinetik bestämdes hos 48 pediatriska försökspersoner mellan 1 månad och 12 år efter en dos på cirka 10 mg/kg. Maximala plasmakoncentrationer var likartade över hela åldersgruppen och inträffade 2 till 3 timmar efter dosering. I allmänhet uppnådde pediatriska försökspersoner mellan 1 månad och
En populationsfarmakokinetisk analys utfördes på 253 pediatriska försökspersoner mellan 1 månad och 13 år. Patienterna fick 10 till 65 mg/kg/dag tre gånger om dagen. Skenbart oralt clearance (CL/F) var direkt proportionellt mot kreatininclearance och detta förhållande var liknande efter en engångsdos och vid steady-state. Högre orala clearance-värden observerades hos barn
Dessa farmakokinetiska data indikerar att den effektiva dagliga dosen hos pediatriska patienter med epilepsi i åldrarna 3 och 4 år bör vara 40 mg/kg/dag för att uppnå genomsnittliga plasmakoncentrationer liknande de som uppnås hos patienter 5 år och äldre som får gabapentin i 30 mg/dag. kg/dag [se DOSERING OCH ADMINISTRERING ].
Vuxna patienter med nedsatt njurfunktion
Försökspersoner (N=60) med nedsatt njurfunktion (genomsnittligt kreatininclearance varierande från 13–114 ml/min) gavs enstaka 400 mg orala doser av gabapentin. Den genomsnittliga halveringstiden för gabapentin varierade från cirka 6,5 timmar (patienter med kreatininclearance >60 ml/min) till 52 timmar (kreatininclearance 60 ml/min). grupp) till cirka 10 ml/min ( DOSERING OCH ADMINISTRERING och Användning i specifika populationer ]. Pediatriska patienter med njurinsufficiens har inte studerats.
Hemodialys
en studie på anuriska vuxna försökspersoner (N=11) var den skenbara eliminationshalveringstiden för gabapentin på dagar utan dialys cirka 132 timmar; under dialys reducerades den skenbara halveringstiden för gabapentin till 3,8 timmar. Hemodialys har således en signifikant effekt på eliminering av gabapentin hos anuriska patienter [se DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Leversjukdom
Eftersom gabapentin inte metaboliseras har ingen studie utförts på patienter med nedsatt leverfunktion.
Läkemedelsinteraktioner
In vitro studier
In vitro-studier har utförts för att undersöka potentialen hos gabapentin att hämma de viktigaste cytokrom P450-enzymerna (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 och CYP3A4) som medierar läkemedels- och xenobiotisk selektiv metabolism av läkemedel och xenobiotiska preparat med hjälp av isomobiotisk livermarkör. . Endast vid den högsta testade koncentrationen (171 mcg/ml; 1 mM) observerades en liten grad av hämning (14 % till 30 %) av isoformen CYP2A6. Ingen hämning av någon av de andra testade isoformerna observerades vid gabapentinkoncentrationer upp till 171 mcg/ml (ungefär 15 gånger C vid 3600 mg/dag) av isoform CYP2A6 som observerades. Ingen hämning av någon av de andra testade isoformerna observerades vid gabapentinkoncentrationer upp till 171 mcg/ml (ungefär 15 gånger Cmax vid 3600 mg/dag).
In vivo studier
Läkemedelsinteraktionsdata som beskrivs i detta avsnitt erhölls från studier som involverade friska vuxna och vuxna patienter med epilepsi.
fenytoin
en studie (400 mg) och multipeldos (400 mg tre gånger dagligen) av NEURONTIN 400 mg på epileptiska patienter (N=8) som höll på fenytoinmonoterapi i minst 2 månader, hade gabapentin ingen effekt på dalgången vid steady-state plasmakoncentrationer av fenytoin och fenytoin hade ingen effekt på gabapentins farmakokinetik.
Karbamazepin
Steady-state dalplasma karbamazepin och karbamazepin 10, 11 epoxidkoncentrationer påverkades inte av samtidig administrering av gabapentin (400 mg tre gånger dagligen; N=12). På samma sätt var gabapentins farmakokinetik oförändrad av karbamazepinadministrering.
Valproinsyra
De genomsnittliga dalkoncentrationerna av valproinsyra i serum vid steady-state före och under samtidig administrering av gabapentin (400 mg tre gånger dagligen; N=17) var inte olika och inte heller gabapentins farmakokinetiska parametrar påverkades av valproinsyra.
Fenobarbital
Uppskattningar av steady-state farmakokinetiska parametrar för fenobarbital eller gabapentin (300 mg tre gånger dagligen; N=12) är identiska oavsett om läkemedlen ges ensamma eller tillsammans.
Naproxen
Samtidig administrering (N=18) av naproxennatriumkapslar (250 mg) med NEURONTIN (125 mg) verkar öka mängden gabapentin som absorberas med 12 % till 15 %. Gabapentin hade ingen effekt på naproxens farmakokinetiska parametrar. Dessa doser är lägre än de terapeutiska doserna för båda läkemedlen. Omfattningen av interaktionen inom de rekommenderade dosintervallen för något av läkemedlen är inte känd.
Hydrokodon
Samtidig administrering av NEURONTIN (125 till 500 mg; N=48) minskar Cmax- och AUC-värdena för hydrokodon (10 mg; N=50) på ett dosberoende sätt jämfört med administrering av enbart hydrokodon; Cmax- och AUC-värdena är 3 % till 4 % lägre efter administrering av 125 mg NEURONTIN respektive 21 % till 22 % lägre efter administrering av 500 mg NEURONTIN. Mekanismen för denna interaktion är okänd. Hydrokodon ökar gabapentins AUC-värden med 14 %. Omfattningen av interaktionen vid andra doser är inte känd.
Morfin
En litteraturartikel rapporterade att när en 60 mg morfinkapsel med kontrollerad frisättning administrerades 2 timmar före en 600 mg NEURONTIN-kapsel (N=12), ökade medel-AUC för gabapentin med 44 % jämfört med gabapentin administrerat utan morfin. Morfins farmakokinetiska parametervärden påverkades inte av administrering av NEURONTIN 2 timmar efter morfin. Omfattningen av interaktionen vid andra doser är inte känd.
Cimetidin
närvaro av 300 mg cimetidin fyra gånger om dagen (N=12) minskade det genomsnittliga skenbara orala clearance av gabapentin med 14 % och kreatininclearance minskade med 10 %. Således verkade cimetidin förändra den renala utsöndringen av både gabapentin och kreatinin, en endogen markör för njurfunktion. Denna lilla minskning av utsöndringen av gabapentin med cimetidin förväntas inte vara av klinisk betydelse. Effekten av gabapentin på cimetidin utvärderades inte.
Oralt preventivmedel
Baserat på AUC och halveringstid var flerdosfarmakokinetiska profiler av noretindron och etinylöstradiol efter administrering av tabletter innehållande 2,5 mg noretindronacetat och 50 mikrogram etinylöstradiol likartade med och utan samtidig administrering av gabapentin (400 mg tre gånger dagligen; N=13). Cmax för noretindron var 13 % högre när det gavs samtidigt med gabapentin; denna interaktion förväntas inte vara av klinisk betydelse.
Antacida (Maalox®) (aluminiumhydroxid, magnesiumhydroxid)
Antacida (Maalox®) innehållande magnesium- och aluminiumhydroxider minskade den genomsnittliga biotillgängligheten av gabapentin (N=16) med cirka 20 %. Denna minskning av biotillgängligheten var cirka 10 % när gabapentin administrerades 2 timmar efter Maalox.
Probenecid
Probenecid är en blockerare av renal tubulär sekretion. Gabapentins farmakokinetiska parametrar utan och med probenecid var jämförbara. Detta indikerar att gabapentin inte genomgår renal tubulär sekretion via den väg som blockeras av probenecid.
Kliniska studier
Postherpetisk neuralgi
NEURONTIN utvärderades för hantering av postherpetisk neuralgi (PHN) i två randomiserade, dubbelblinda, placebokontrollerade, multicenterstudier. Intent-to-treat-populationen (ITT) bestod av totalt 563 patienter med smärta i mer än 3 månader efter läkning av herpes zoster hudutslag (tabell 6).
TABELL 6. Kontrollerade PHN-studier: Varaktighet, doser och antal patienter
Varje studie inkluderade en 7- eller 8-veckors dubbelblind fas (3 eller 4 veckors titrering och 4 veckors fast dos). Patienterna inledde behandlingen med titrering till maximalt 900 mg/dag gabapentin under 3 dagar. Doserna skulle sedan titreras i steg om 600 till 1200 mg/dag med 3 till 7 dagars intervall till måldosen under 3 till 4 veckor. Patienterna registrerade sin smärta i en daglig dagbok med hjälp av en 11-punkts numerisk smärtskala från 0 (ingen smärta) till 10 (värsta möjliga smärta). En genomsnittlig smärtpoäng under baslinjen på minst 4 krävdes för randomisering. Analyser utfördes med användning av ITT-populationen (alla randomiserade patienter som fick minst en dos studiemedicin).
Båda studierna visade effekt jämfört med placebo vid alla testade doser.
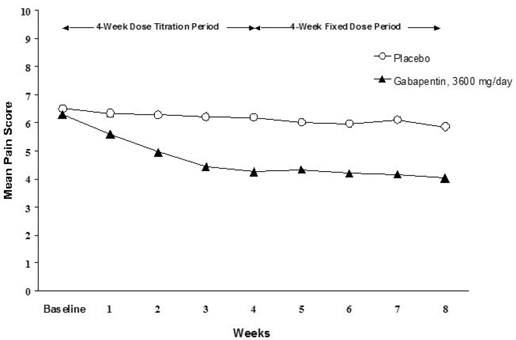
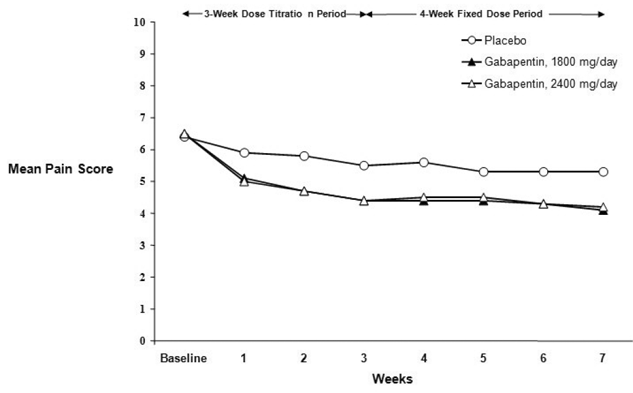
Minskningen av veckomedelvärden för smärtpoäng sågs vid vecka 1 i båda studierna och bibehölls till slutet av behandlingen. Jämförbara behandlingseffekter observerades i alla aktiva behandlingsarmar. Farmakokinetisk/farmakodynamisk modellering gav bekräftande bevis på effekt över alla doser. Figurerna 1 och 2 visar smärtintensitetspoäng över tid för studier 1 och 2.
Figur 1. Veckomedelvärde för smärtpoäng (observerade fall i ITT-population): Studie 1
Figur 2. Veckomedelvärde för smärtpoäng (observerade fall i ITT-population): Studie 2
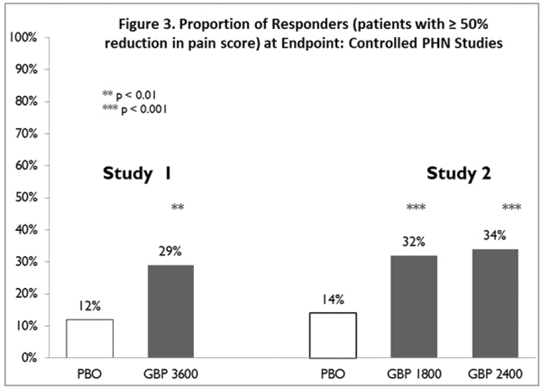
Andelen responders (de patienter som rapporterade minst 50 % förbättring av endpoint-smärtpoäng jämfört med baslinjen) beräknades för varje studie (Figur 3).
Figur 3. Andel svarspersoner (patienter med ≥50 % minskning av smärtpoäng) vid endpoint: kontrollerade PHN-studier
Epilepsi för partiella anfall (tilläggsterapi)
Effektiviteten av NEURONTIN 400 mg som tilläggsbehandling (som tilläggs till andra antiepileptika) har fastställts i multicenter placebokontrollerade, dubbelblinda, parallellgruppsstudier på vuxna och pediatriska patienter (3 år och äldre) med refraktära partiella anfall.
Bevis på effektivitet erhölls i tre studier utförda på 705 patienter (ålder 12 år och äldre) och en studie utförd på 247 pediatriska patienter (3 till 12 år gamla). De inkluderade patienterna hade en historia av minst 4 partiella anfall per månad trots att de fick ett eller flera antiepileptika på terapeutiska nivåer och observerades på sin etablerade antiepileptikabehandling under en 12-veckors baslinjeperiod (6 veckor i studien av pediatriska läkemedel). patienter). Hos patienter som fortsätter att ha minst 2 (eller 4 i vissa studier) anfall per månad, lades NEURONTIN 300 mg eller placebo till den befintliga behandlingen under en 12-veckors behandlingsperiod. Effektiviteten bedömdes primärt på basis av procenten av patienterna med 50 % eller mer minskning av anfallsfrekvensen från baslinje till behandling ("svarsfrekvensen") och ett härlett mått som kallas responskvot, ett mått på förändring definierat som (T - B)/(T + B), där B är patientens baslinjeanfallsfrekvens och T är patientens anfallsfrekvens under behandling. Svarsförhållandet är fördelat inom intervallet -1 till +1. Ett nollvärde indikerar ingen förändring medan fullständig eliminering av anfall skulle ge ett värde på -1; ökade beslagsfrekvenser skulle ge positiva värden. En svarskvot på -0,33 motsvarar en 50% minskning av anfallsfrekvensen. Resultaten nedan är för alla partiella anfall i avsikt-att-behandla (alla patienter som fått några behandlingsdoser) i varje studie, om inte annat anges.
En studie jämförde NEURONTIN 1200 mg/dag i tre uppdelade doser med placebo. Svarsfrekvensen var 23 % (14/61) i NEURONTIN 600 mg-gruppen och 9 % (6/66) i placebogruppen; skillnaden mellan grupperna var statistiskt signifikant. Responskvoten var också bättre i NEURONTIN-gruppen (-0,199) än i placebogruppen (-0,044), en skillnad som också uppnådde statistisk signifikans.
En andra studie jämförde primärt NEURONTIN 1200 mg/dag, i tre uppdelade doser (N=101), med placebo (N=98). Ytterligare mindre doseringsgrupper för NEURONTIN 300 mg (600 mg/dag, N=53; 1800 mg/dag, N=54) studerades också för information om dosrespons. Svarsfrekvensen var högre i gruppen NEURONTIN 1200 mg/dag (16 %) än i placebogruppen (8 %), men skillnaden var inte statistiskt signifikant. Svarsfrekvensen vid 600 mg (17 %) var inte heller signifikant högre än för placebo, men svarsfrekvensen i 1800 mg-gruppen (26 %) var statistiskt signifikant överlägsen placebofrekvensen. Responsförhållandet var bättre i gruppen NEURONTIN 1200 mg/dag (-0,103) än i placebogruppen (-0,022); men denna skillnad var inte heller statistiskt signifikant (p = 0,224). Ett bättre svar sågs i gruppen NEURONTIN 600 mg/dag (-0,105) och 1800 mg/dag-gruppen (-0,222) än i 1200 mg/dag-gruppen, där 1800 mg/dag-gruppen uppnådde statistisk signifikans jämfört med placebo grupp.
En tredje studie jämförde NEURONTIN 900 mg/dag i tre uppdelade doser (N=111) och placebo (N=109). Ytterligare en NEURONTIN 1200 mg/dag-dosgrupp (N=52) gav dos-responsdata. En statistiskt signifikant skillnad i svarsfrekvens sågs i gruppen NEURONTIN 900 mg/dag (22 %) jämfört med placebogruppen (10 %). Responskvoten var också statistiskt signifikant överlägsen i NEURONTIN 900 mg/dag-gruppen (-0,119) jämfört med den i placebogruppen (-0,027), liksom svarskvoten i 1200 mg/dag NEURONTIN (-0,184) jämfört med placebo.
Analyser utfördes också i varje studie för att undersöka effekten av NEURONTIN 300 mg på att förhindra sekundärt generaliserade tonisk-kloniska anfall. Patienter som upplevde ett sekundärt generaliserat tonisk-kloniskt anfall i antingen baslinjen eller under behandlingsperioden i alla tre placebokontrollerade studier inkluderades i dessa analyser. Det fanns flera jämförelser av svarskvoter som visade en statistiskt signifikant fördel för NEURONTIN jämfört med placebo och gynnsamma trender för nästan alla jämförelser.
Analys av svarsfrekvens med kombinerade data från alla tre studierna och alla doser (N=162, NEURONTIN; N=89, placebo) visade också en signifikant fördel för NEURONTIN jämfört med placebo när det gäller att minska frekvensen av sekundärt generaliserade tonisk-kloniska anfall.
två av de tre kontrollerade studierna användes mer än en dos NEURONTIN. Inom varje studie visade resultaten inte ett konsekvent ökat svar på dosen. Men om man ser över studierna är en trend mot ökad effekt med ökande dos uppenbar (se figur 4).
Figur 4. Svarsfrekvens hos patienter som får NEURONTIN 600 mg uttryckt som en skillnad från placebo efter dos och studie: Studier av tilläggsterapi på patienter ≥12 år med partiella anfall
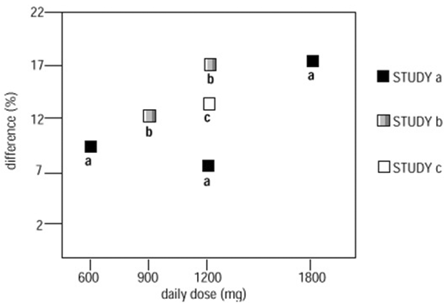
I figuren är behandlingseffektens storlek, mätt på Y-axeln i termer av skillnaden i andelen gabapentin- och placebotilldelade patienter som uppnår en 50 % eller mer minskning av anfallsfrekvensen från baslinjen, mot den dagliga dosen av gabapentin som administreras. (X-axeln).
Även om ingen formell analys efter kön har utförts, visar uppskattningar av svar (Response Ratio) härledda från kliniska prövningar (398 män, 307 kvinnor) att det inte finns några viktiga könsskillnader. Det fanns inget konsekvent mönster som tydde på att ålder hade någon effekt på svaret på NEURONTIN. Det fanns otillräckligt antal patienter av andra raser än kaukasiska för att möjliggöra en jämförelse av effektiviteten bland rasgrupper.
En fjärde studie på pediatriska patienter i åldern 3 till 12 år jämförde 25 –35 mg/kg/dag NEURONTIN (N=118) med placebo (N=127). För alla partiella anfall i intention-to-treat-populationen var svarskvoten statistiskt signifikant bättre för NEURONTIN-gruppen (-0,146) än för placebogruppen (-0,079). För samma population skilde sig svarsfrekvensen för NEURONTIN (21 %) inte signifikant från placebo (18 %).
En studie på pediatriska patienter i åldern 1 månad till 3 år jämförde 40 mg/kg/dag NEURONTIN (N=38) med placebo (N=38) hos patienter som fick minst ett marknadsfört antiepileptika och hade minst ett partiellt anfall under screeningsperioden (inom 2 veckor före baslinjen). Patienterna hade upp till 48 timmars baslinje och upp till 72 timmars dubbelblind video EEG-övervakning för att registrera och räkna förekomsten av anfall. Det fanns inga statistiskt signifikanta skillnader mellan behandlingarna i vare sig svarsförhållandet eller svarsfrekvensen.
PATIENTINFORMATION
NEURONTIN (Neu ron' tenn) (Gabapentin) Kapslar, tabletter och oral lösning
Vilken är den viktigaste informationen jag borde veta om NEURONTIN?
Sluta inte ta NEURONTIN 300 mg utan att först prata med din läkare.
Att plötsligt stoppa NEURONTIN kan orsaka allvarliga problem.
NEURONTIN 400mg kan orsaka allvarliga biverkningar inklusive:
1. Självmordstankar. Liksom andra antiepileptika kan NEURONTIN 100 mg orsaka självmordstankar eller självmordshandlingar hos ett mycket litet antal personer, cirka 1 av 500.
Ring en vårdgivare omedelbart om du har något av dessa symtom, särskilt om de är nya, värre eller oroar dig:
- tankar om självmord eller att dö
- försök att begå självmord
- ny eller värre depression
- ny eller värre ångest
- känner sig upprörd eller rastlös
- panikattacker
- sömnsvårigheter (sömnlöshet)
- ny eller värre irritabilitet
- agerar aggressivt, är arg eller våldsam
- agerar på farliga impulser
- en extrem ökning av aktivitet och prat (mani)
- andra ovanliga förändringar i beteende eller humör
Hur kan jag se efter tidiga symtom på självmordstankar och -handlingar?
- Var uppmärksam på alla förändringar, särskilt plötsliga förändringar, i humör, beteenden, tankar eller känslor.
- Håll alla uppföljningsbesök hos din vårdgivare som planerat.
Ring din vårdgivare mellan besöken vid behov, särskilt om du är orolig för symtom.
Sluta inte ta NEURONTIN utan att först prata med en vårdgivare.
- Att plötsligt stoppa NEURONTIN 100mg kan orsaka allvarliga problem. Att plötsligt stoppa ett anfallsläkemedel hos en patient som har epilepsi kan orsaka anfall som inte slutar (status epilepticus).
- Självmordstankar eller -handlingar kan orsakas av andra saker än mediciner. Om du har självmordstankar eller självmordshandlingar kan din vårdgivare söka efter andra orsaker.
2. Förändringar i beteende och tänkande - Att använda NEURONTIN 100 mg hos barn 3 till 12 år kan orsaka känslomässiga förändringar, aggressivt beteende, koncentrationsproblem, rastlöshet, förändringar i skolprestationer och hyperaktivitet.
3. NEURONTIN kan orsaka allvarliga eller livshotande allergiska reaktioner som kan påverka din hud eller andra delar av din kropp som din lever eller blodkroppar. Detta kan leda till att du blir inlagd på sjukhus eller att du slutar med NEURONTIN. Du kan eller kanske inte har utslag med en allergisk reaktion orsakad av NEURONTIN. Ring en vårdgivare omedelbart om du har något av följande symtom:
- hudutslag
- nässelfeber
- svårt att andas
- feber
- svullna körtlar som inte går över
- svullnad av ansikte, läppar, hals eller tunga
- gulfärgning av huden eller ögonvitorna
- ovanliga blåmärken eller blödningar
- allvarlig trötthet eller svaghet
- oväntad muskelsmärta
- frekventa infektioner
Dessa symtom kan vara de första tecknen på en allvarlig reaktion. En vårdgivare bör undersöka dig för att avgöra om du ska fortsätta att ta NEURONTIN.
4. Allvarliga andningsproblem. Allvarliga andningsproblem kan uppstå när NEURONTIN tas tillsammans med andra läkemedel som kan orsaka svår sömnighet eller minskad medvetenhet, eller när det tas av någon som redan har andningsproblem. Se upp för ökad sömnighet eller minskad andning när du börjar med NEURONTIN 300 mg eller när dosen höjs. Få hjälp direkt om andningsproblem uppstår.
Vad är NEURONTIN 400mg?
NEURONTIN 400mg är ett receptbelagt läkemedel som används för att behandla:
- Smärta från skadade nerver (postherpetisk smärta) som följer på läkning av bältros (ett smärtsamt utslag som kommer efter en herpes zoster-infektion) hos vuxna.
- Partiella anfall när de tas tillsammans med andra läkemedel hos vuxna och barn 3 år och äldre med anfall.
Vem ska inte ta NEURONTIN?
Ta inte NEURONTIN om du är allergisk mot gabapentin eller något av övriga innehållsämnen i NEURONTIN. Se slutet av denna medicineringsguide för en komplett lista över ingredienser i NEURONTIN.
Vad ska jag berätta för min vårdgivare innan jag tar NEURONTIN 300mg?
Innan du tar NEURONTIN 400 mg, berätta för din läkare om du:
- har eller har haft njurproblem eller är på hemodialys
- har eller har haft depression, humörproblem eller självmordstankar eller -beteende
- har diabetes
- har andningsproblem
- är gravid eller planerar att bli gravid. Det är inte känt om NEURONTIN kan skada ditt ofödda barn. Berätta omedelbart för din läkare om du blir gravid medan du tar NEURONTIN. Du och din vårdgivare kommer att bestämma om du ska ta NEURONTIN 100 mg medan du är gravid. Graviditetsregistret: Om du blir gravid medan du tar NEURONTIN, prata med din vårdgivare om att registrera dig hos North American Antiepileptic Drug (NAAED) Pregnancy Registry. Syftet med detta register är att samla in information om säkerheten för antiepileptika under graviditet. Du kan registrera dig i det här registret genom att ringa 1-888-233-2334.
- ammar eller planerar att amma. NEURONTIN kan passera över i bröstmjölken. Du och din vårdgivare bör bestämma hur du ska mata ditt barn medan du tar NEURONTIN.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Berätta särskilt för din vårdgivare om du tar något opioid smärtstillande läkemedel (som oxikodon), mediciner mot ångest (som lorazepam) eller sömnlöshet (som zolpidem) eller andra läkemedel som gör dig sömnig.
Du kan ha större risk för yrsel, sömnighet eller andningsproblem om dessa läkemedel tas tillsammans med NEURONTIN.
Att ta NEURONTIN 100 mg tillsammans med vissa andra läkemedel kan orsaka biverkningar eller påverka hur väl de fungerar. Starta eller sluta inte med andra läkemedel utan att prata med din läkare.
Vet vilka mediciner du tar. Håll en lista över dem och visa den för din vårdgivare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta NEURONTIN 400mg?
- Ta NEURONTIN exakt som ordinerats. Din vårdgivare kommer att tala om för dig hur mycket NEURONTIN 600 mg du ska ta.
- Ändra inte din dos av NEURONTIN utan att prata med din läkare.
- Om du tar NEURONTIN tabletter och bryter en tablett på mitten, ska den oanvända halvan av tabletten tas vid nästa schemalagda dos. Halva tabletter som inte har använts inom 28 dagar efter att de har brutits ska slängas.
- Ta NEURONTIN kapslar med vatten.
- NEURONTIN tabletter kan tas med eller utan mat. Om du tar ett antacidum som innehåller aluminium och magnesium, såsom Maalox®, Mylanta®, Gelusil®, Gaviscon® eller Di-Gel®, bör du vänta minst 2 timmar innan du tar din nästa dos av NEURONTIN. Om du tar för mycket NEURONTIN 600mg, ring din vårdgivare eller ditt lokala giftkontrollcenter direkt på 1-800-222-1222.
Vad ska jag undvika när jag tar NEURONTIN?
- Drick inte alkohol eller ta andra läkemedel som gör dig sömnig eller yr medan du tar NEURONTIN utan att först prata med din läkare. Att ta NEURONTIN 600 mg tillsammans med alkohol eller droger som orsakar sömnighet eller yrsel kan göra din sömnighet eller yrsel värre.
- Kör inte bil, använd inte tunga maskiner eller gör andra farliga aktiviteter förrän du vet hur NEURONTIN 100 mg påverkar dig. NEURONTIN 600mg kan bromsa ditt tänkande och din motorik.
Vilka är de möjliga biverkningarna av NEURONTIN 300mg?
NEURONTIN 100mg kan orsaka allvarliga biverkningar inklusive:
Ser "Vilken är den viktigaste informationen jag borde veta om NEURONTIN?"
- problem med att köra medan du använder NEURONTIN. Se "Vad jag bör undvika när jag tar Neurontin 600mg?"
- sömnighet och yrsel, vilket kan öka förekomsten av oavsiktlig skada, inklusive fall
- De vanligaste biverkningarna av NEURONTIN 100mg inkluderar:
- bristande samordning
- virusinfektion
- känner sig dåsig
- illamående och kräkningar
- svårt att prata
- darrning
- svullnad, vanligtvis av ben och fötter
- känner mig trött
- feber
- ryckiga rörelser
- svårigheter med koordination
- dubbel syn
- ovanliga ögonrörelser
Berätta för din vårdgivare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av NEURONTIN. För mer information, fråga din vårdgivare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara NEURONTIN?
- Förvara NEURONTIN 400 mg kapslar och tabletter mellan 68°F till 77°F (20°C till 25°C).
- Förvara NEURONTIN 400 mg oral lösning i kylskåp mellan 36°F till 46°F (2°C till 8°C).
Förvara NEURONTIN 600mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av NEURONTIN
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte NEURONTIN 300mg för ett tillstånd som det inte ordinerats för. Ge inte NEURONTIN till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna medicinguide sammanfattar den viktigaste informationen om NEURONTIN. Om du vill ha mer information, prata med din vårdgivare. Du kan fråga din vårdgivare eller apotekspersonal om information om NEURONTIN 100mg som är skriven för vårdpersonal.
För mer information gå till http://www.pfizer.com eller ring 1-800-438-1985.
Vilka är ingredienserna i NEURONTIN 400mg?
Aktiv beståndsdel: gabapentin
Inaktiva ingredienser i kapslarna: laktos, majsstärkelse, talk, gelatin, titandioxid och FD&C Blue No. 2.
Kapselskalet på 300 mg innehåller också: gul järnoxid.
Kapselskalet på 400 mg innehåller också: röd järnoxid och gul järnoxid.
Inaktiva ingredienser i tabletterna: poloxamer 407, copovidon, majsstärkelse, magnesiumstearat, hydroxipropylcellulosa, talk och candelillavax
Inaktiva ingredienser i oral lösning: glycerin, xylitol, renat vatten och artificiell smak.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
