Celebrex 100mg, 200mg Celecoxib Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Celebrex 100mg och hur används det?
Celebrex 200mg är ett receptbelagt läkemedel som används för att behandla symtom på akut smärta eller inflammation. Celebrex kan användas ensamt eller tillsammans med andra mediciner.
Celebrex 100mg tillhör en klass av läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID).
Det är inte känt om Celebrex är säkert och effektivt för barn yngre än 2 år.
Vilka är de möjliga biverkningarna av Celebrex 100mg?
Celebrex 200mg kan orsaka allvarliga biverkningar inklusive:
- svullnad,
- snabb viktökning,
- andnöd,
- blodig eller tjäraktig avföring,
- hosta upp blod eller kräks som ser ut som kaffesump,
- illamående,
- magsmärtor i övre högra sidan,
- klåda,
- trötthet,
- mörk urin,
- gulfärgning av huden eller ögonen (gulsot),
- lite eller ingen urinering,
- svullnad i dina fötter eller vrister,
- känner mig trött,
- blek hud,
- yrsel, och
- kalla händer och fötter
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Celebrex inkluderar:
- magont,
- halsbränna,
- gas,
- diarre,
- förstoppning,
- illamående,
- kräkningar,
- svullnad i händer eller fötter,
- yrsel, en
- d
- förkylningssymtom (täppt näsa, nysningar, ont i halsen)
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Celebrex. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
RISK FÖR ALLVARLIGA HJÄRT- OCH Gastrointestinala HÄNDELSER
Kardiovaskulära trombotiska händelser
- Icke-steroida antiinflammatoriska läkemedel (NSAID) orsakar en ökad risk för allvarliga kardiovaskulära trombotiska händelser, inklusive hjärtinfarkt och stroke, som kan vara dödlig. Denna risk kan uppstå tidigt i behandlingen och kan öka med användningstiden. [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
- CELEBREX är kontraindicerat vid kranskärlsbypassoperationer (CABG). [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
Gastrointestinal blödning, sårbildning och perforering
- NSAID orsakar en ökad risk för allvarliga gastrointestinala (GI) biverkningar inklusive blödning, sårbildning och perforering av magen eller tarmarna, vilket kan vara dödligt. Dessa händelser kan inträffa när som helst under användning och utan varningssymptom. Äldre patienter och patienter med tidigare anamnes på magsår och/eller GI-blödning löper större risk för allvarliga (GI) händelser. [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER]
BESKRIVNING
CELEBREX (celecoxib) kapsel är ett icke-steroid antiinflammatoriskt läkemedel, tillgängligt som kapslar innehållande 50 mg, 100 mg, 200 mg och 400 mg celecoxib för oral administrering. Det kemiska namnet är 4-[5-(4-metylfenyl)-3-(trifluormetyl)-1H-pyrazol-1-yl]bensensulfonamid och är en diarylsubstituerad pyrazol. Molekylvikten är 381,38. Dess molekylformel är C17H14F3N3O2S, och den har följande kemiska struktur:
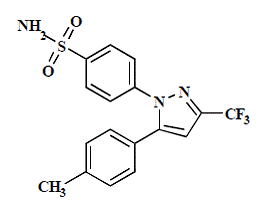
Celecoxib är ett vitt till benvitt pulver med ett pKa på 11,1 (sulfonamiddel). Celecoxib är hydrofobt (log P är 3,5) och är praktiskt taget olösligt i vattenhaltiga medier vid fysiologiskt pH-område.
De inaktiva ingredienserna i CELEBREX 200mg inkluderar: kroskarmellosnatrium, ätbart bläck, gelatin, laktosmonohydrat, magnesiumstearat, povidon och natriumlaurylsulfat.
INDIKATIONER
CELEBREX är indikerat
Artros (OA)
För hantering av tecken och symtom på OA [se Kliniska studier ].
Reumatoid artrit (RA)
För hantering av tecken och symtom på RA [se Kliniska studier ].
Juvenil reumatoid artrit (JRA)
För hantering av tecken och symtom på JRA hos patienter 2 år och äldre [se Kliniska studier ].
Ankyloserande spondylit (AS)
För hantering av tecken och symtom på AS [se Kliniska studier ].
Akut smärta
För hantering av akut smärta hos vuxna [se Kliniska studier ].
Primär dysmenorré
För hantering av primär dysmenorré [se Kliniska studier ].
DOSERING OCH ADMINISTRERING
Allmänna doseringsanvisningar
Överväg noga de potentiella fördelarna och riskerna med CELEBREX och andra behandlingsalternativ innan du bestämmer dig för att använda CELEBREX. Använd den lägsta effektiva dosen för den kortaste varaktigheten förenlig med individuella patientbehandlingsmål [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Dessa doser kan ges utan hänsyn till tidpunkten för måltiderna.
Artros
För artrose är dosen 200 mg per dag administrerad som engångsdos eller som 100 mg två gånger dagligen.
Reumatoid artrit
För RA är dosen 100 mg till 200 mg två gånger dagligen.
Juvenil reumatoid artrit
För JRA är doseringen för pediatriska patienter (ålder 2 år och äldre) baserad på vikt. För patienter ≥10 kg till ≤25 kg är den rekommenderade dosen 50 mg två gånger dagligen. För patienter >25 kg är den rekommenderade dosen 100 mg två gånger dagligen.
För patienter som har svårt att svälja kapslar kan innehållet i en CELEBREX-kapsel läggas till äppelmos. Hela kapselinnehållet töms försiktigt på en jämn tesked kall eller rumstempererad äppelmos och intas omedelbart med vatten. Det strödda kapselinnehållet på äppelmos är stabilt i upp till 6 timmar under kylda förhållanden (2°C till 8°C/35°F till 45°F).
Ankyloserande spondylit
För AS är dosen av CELEBREX 200 mg dagligen i enstaka (en gång per dag) eller uppdelade (två gånger per dag) doser. Om ingen effekt observeras efter 6 veckor kan en prövning med 400 mg dagligen vara värt besväret. Om ingen effekt observeras efter 6 veckor på 400 mg dagligen är ett svar inte troligt och alternativa behandlingsalternativ bör övervägas.
Hantering av akut smärta och behandling av primär dysmenorré
För behandling av akut smärta och behandling av primär dysmenorré är dosen initialt 400 mg, följt av ytterligare en dos på 200 mg vid behov den första dagen. På efterföljande dagar är den rekommenderade dosen 200 mg två gånger dagligen vid behov.
Särskilda populationer
Nedsatt leverfunktion
Hos patienter med måttligt nedsatt leverfunktion (Child-Pugh klass B), minska dosen med 50 %. Användning av CELEBREX 100 mg till patienter med gravt nedsatt leverfunktion rekommenderas inte [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , Användning i specifika populationer , och KLINISK FARMAKOLOGI ].
Dåliga metaboliserare av CYP2C9-substrat
Hos vuxna patienter som är kända eller misstänks vara dåliga CYP2C9-metaboliserare baserat på genotyp eller tidigare historia/erfarenhet av andra CYP2C9-substrat (såsom warfarin, fenytoin), påbörja behandlingen med hälften av den lägsta rekommenderade dosen.
Hos patienter med JRA som är kända eller misstänks vara dåliga CYP2C9-metaboliserare, överväg att använda alternativa behandlingar [se Använd i specifika populationer och KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
CELEBREX (celecoxib) kapslar:
50 mg vit, med omvänd tryckt vitt på det röda bandet på kroppen och locket med markeringarna 7767 på locket och 50 på kroppen.
100 mg vit, med omvänd tryckt vitt på det blåa bandet på kroppen och locket med markeringarna 7767 på locket och 100 på kroppen.
200 mg vit, med omvänd tryckt vitt på guldband med markeringar 7767 på locket och 200 på kroppen.
400 mg vit, med omvänd tryckt vitt på grönt band med markeringar 7767 på locket och 400 på kroppen.
Förvaring Och Hantering
CELEBREX (celecoxib) 50 mg kapslarna är vita, med omvänd tryckt vitt på det röda bandet på kroppen och locket med markeringarna 7767 på locket och 50 på kroppen, levereras som:
CELEBREX (celecoxib) 100 mg kapslarna är vita, med omvänd tryckt vitt på det blåa bandet på kroppen och locket med markeringarna 7767 på locket och 100 på kroppen, levereras som:
CELEBREX (celecoxib) 200 mg kapslarna är vita, med omvänd tryckt vitt på guldband med markeringar 7767 på locket och 200 på kroppen, levereras som:
CELEBREX (celecoxib) 400 mg kapslarna är vita, med omvänd tryckt vitt på grönt band med markeringar 7767 på theca och 400 på kroppen, levereras som:
Lagring
Förvara i rumstemperatur 20°C till 25°C (68°F till 77°F); utflykter tillåtna mellan 15°C till 30°C (59°F till 86°F) [se USP-kontrollerad rumstemperatur ].
Distribuerat av: GD Searle LLC, Division of Pfizer Inc, NY, NY 10017. Reviderad: apr 2021
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Kardiovaskulära trombotiska händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- GI-blödning, sårbildning och perforering [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hypertoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hjärtsvikt och ödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Njurtoxicitet och hyperkalemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anafylaktiska reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarliga hudreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hematologisk toxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken. Biverkningsinformationen från kliniska prövningar ger dock en grund för att identifiera de biverkningar som verkar vara relaterade till läkemedelsanvändning och för att uppskatta antalet.
Av de CELEBREX-behandlade patienterna i de kontrollerade kliniska prövningarna före marknadsföring var cirka 4 250 patienter med artrose, cirka 2 100 patienter med RA och cirka 1 050 patienter med postoperativ smärta. Mer än 8 500 patienter fick en total daglig dos av CELEBREX 200 mg på 200 mg (100 mg två gånger dagligen eller 200 mg en gång dagligen) eller mer, inklusive fler än 400 behandlade med 800 mg (400 mg två gånger dagligen). Cirka 3 900 patienter fick CELEBREX i dessa doser i 6 månader eller mer; cirka 2 300 av dessa har fått det i 1 år eller mer och 124 av dessa har fått det i 2 år eller mer.
Pre-Marketing kontrollerade artritförsök
Tabell 1 listar alla biverkningar, oavsett orsakssamband, som inträffade hos ≥2 % av patienterna som fick CELEBREX 100 mg från 12 kontrollerade studier utförda på patienter med OA eller RA som inkluderade en placebo och/eller en positiv kontrollgrupp. Eftersom dessa 12 prövningar var av olika varaktighet och patienter i prövningarna kanske inte har exponerats under samma tidsperiod, fångar dessa procentsatser inte upp kumulativa förekomster.
I placebo- eller aktivkontrollerade kliniska prövningar var avbrottsfrekvensen på grund av biverkningar 7,1 % för patienter som fick CELEBREX och 6,1 % för patienter som fick placebo. Bland de vanligaste orsakerna till att behandlingen avbröts på grund av biverkningar i CELEBREX-behandlingsgrupperna var dyspepsi och buksmärtor (angivna som orsaker till att behandlingen avbröts hos 0,8 % respektive 0,7 % av CELEBREX-patienterna). Bland patienter som fick placebo avbröt 0,6 % behandlingen på grund av dyspepsi och 0,6 % avbröt på grund av buksmärtor.
Följande biverkningar inträffade hos 0,1 % till 1,9 % av patienterna som behandlades med CELEBREX (100 mg till 200 mg två gånger dagligen eller 200 mg en gång dagligen):
Gastrointestinala: Förstoppning, divertikulit, dysfagi, eruktion, esofagit, gastrit, gastroenterit, gastroesofageal reflux, hemorrojder, hiatal bråck, melena, muntorrhet, stomatit, tenesmus, kräkningar
Kardiovaskulär: Förvärrad hypertoni, angina pectoris, kranskärlssjukdom, hjärtinfarkt
Allmän: Överkänslighet, allergisk reaktion, bröstsmärta, cysta NOS, ödem generaliserat, ansiktsödem, trötthet, feber, värmevallningar, influensaliknande symtom, smärta, perifer smärta
Centrala, perifera nervsystemet: Benkramper, hypertoni, hypoestesi, migrän, parestesi, svindel
Hörsel och vestibulär: Dövhet, tinnitus
Puls och rytm: Hjärtklappning, takykardi
Lever och gallvägar: Leverenzym ökat (inklusive SGOT ökat, SGPT ökat)
Metaboliskt och näringsmässigt: blodureakväve (BUN) ökat, kreatinfosfokinas (CPK) ökat, hyperkolesterolemi, hyperglykemi, hypokalemi, NPN ökat, kreatinin ökat, alkaliskt fosfatas ökat, viktökning
Muskuloskeletala: Artralgi, artros, myalgi, synovit, tendinit
Trombocyter (blödning eller koagulering): Ekkymos, näsblod, trombocytemi,
Psykiatrisk: Anorexi, ångest, ökad aptit, depression, nervositet, somnolens
Hemic: Anemi
Andningsvägar: Bronkit, bronkospasm, förvärrad bronkospasm, hosta, dyspné, laryngit, lunginflammation
Hud och bihang: Alopeci, dermatit, ljuskänslighetsreaktion, klåda, erytematösa utslag, makulopapulära utslag, hudsjukdom, torr hud, ökad svettning, urtikaria
Störningar på applikationsstället: Cellulit, dermatitkontakt
Urin: Albuminuri, cystit, dysuri, hematuri, miktionsfrekvens, njursten
Följande allvarliga biverkningar (kausalitet ej utvärderad) inträffade hos
Kardiovaskulär: Synkope, kongestiv hjärtsvikt, ventrikelflimmer, lungemboli, cerebrovaskulär olycka, perifer kallbrand, tromboflebit
Gastrointestinala: Tarmobstruktion, tarmperforation, gastrointestinal blödning, kolit med blödning, esofagusperforation, pankreatit, ileus
Allmän: Sepsis, plötslig död
Lever och gallvägar: Kolelithiasis
Hemisk och lymfatisk: Trombocytopeni
Nervös: Ataxi, självmord [se LÄKEMEDELSINTERAKTIONER ]
Njur: Akut njursvikt
Celecoxib Long Term Arthritis Safety Study
[ser Kliniska studier ]
Hematologiska händelser: Incidensen av kliniskt signifikanta minskningar av hemoglobin (>2 g/dL) var lägre hos patienter som fick CELEBREX 400 mg två gånger dagligen (0,5 %) jämfört med patienter på antingen diklofenak 75 mg två gånger dagligen (1,3 %) eller ibuprofen 800 mg tre gånger dagligen 1,9 %. Den lägre incidensen av händelser med CELEBREX bibehölls med eller utan användning av aspirin [se KLINISK FARMAKOLOGI ].
Uttag/allvarliga biverkningar: Kaplan-Meier kumulativa frekvenser vid 9 månader för utsättningar på grund av biverkningar för CELEBREX 100 mg, diklofenak och ibuprofen var 24 %, 29 % respektive 26 %. Frekvensen för allvarliga biverkningar (dvs. orsakade sjukhusvistelse eller ansågs vara livshotande eller på annat sätt medicinskt signifikant), oavsett orsakssamband, var inte olika mellan behandlingsgrupperna (8 %, 7 % respektive 8 %).
Studie av juvenil reumatoid artrit
en 12-veckors, dubbelblind, aktivt kontrollerad studie, behandlades 242 JRA-patienter i åldern 2 till 17 år med celecoxib eller naproxen; 77 JRA-patienter behandlades med celecoxib 3 mg/kg två gånger dagligen, 82 patienter behandlades med celecoxib 6 mg/kg två gånger dagligen och 83 patienter behandlades med naproxen 7,5 mg/kg två gånger dagligen. De vanligast förekommande (≥5 %) biverkningarna hos celecoxibbehandlade patienter var huvudvärk, feber (pyrexi), smärta i övre delen av buken, hosta, nasofaryngit, buksmärtor, illamående, artralgi, diarré och kräkningar. De vanligast förekommande (≥5%) biverkningarna för naproxenbehandlade patienter var huvudvärk, illamående, kräkningar, feber, smärta i övre delen av buken, diarré, hosta, buksmärtor och yrsel (tabell 2). Jämfört med naproxen hade celecoxib i doser på 3 och 6 mg/kg två gånger dagligen ingen observerbar skadlig effekt på tillväxt och utveckling under loppet av den 12 veckor långa dubbelblinda studien. Det fanns ingen väsentlig skillnad i antalet kliniska exacerbationer av uveit eller systemiska egenskaper hos JRA bland behandlingsgrupperna.
en 12-veckors öppen förlängning av den dubbelblinda studien som beskrivs ovan, behandlades 202 JRA-patienter med celecoxib 6 mg/kg två gånger dagligen. Incidensen av biverkningar liknade den som observerades under den dubbelblinda studien; inga oväntade biverkningar av klinisk betydelse uppstod.
Andra förhandsgodkännandestudier
Biverkningar från studier av ankyloserande spondylit
Totalt 378 patienter behandlades med CELEBREX 200 mg i placebo- och aktivkontrollerade AS-studier. Doser upp till 400 mg en gång dagligen studerades. De typer av biverkningar som rapporterades i AS-studierna liknade de som rapporterades i OA/RA-studierna.
Biverkningar från analgesi och dysmenorréstudier
Cirka 1 700 patienter behandlades med CELEBREX 200 mg i analgesi- och dysmenorréstudier. Alla patienter i smärtstudier efter oral kirurgi fick en enda dos studiemedicin. Doser upp till 600 mg/dag av CELEBREX 200 mg studerades i primär dysmenorré och smärtstudier efter ortopedisk kirurgi. Typerna av biverkningar i analgesi- och dysmenorréstudierna liknade de som rapporterades i artritstudier. Den enda ytterligare biverkning som rapporterades var post-dental extraktion alveolär osteit (torr socket) i smärtstudierna efter oral kirurgi.
APC- och PreSAP-försöken
Biverkningar från långvariga, placebokontrollerade polypförebyggande studier
Exponeringen för CELEBREX i APC- och PreSAP-studierna var 400 mg till 800 mg dagligen i upp till 3 år [se Kliniska studier ].
Vissa biverkningar inträffade hos högre procentandel av patienterna än i artritstudierna före marknadsföringen (behandlingslängd upp till 12 veckor; se Biverkningar från CELEBREX 200 mg kontrollerade artritstudier före marknadsföring ovan). De biverkningar för vilka dessa skillnader hos patienter behandlade med CELEBREX var större jämfört med artritstudierna före marknadsföringen var följande:
Följande ytterligare biverkningar inträffade hos ≥0,1 % och
Störningar i nervsystemet: Cerebral infarkt
Ögonbesvär: Glaskroppen flyter, konjunktival blödning
Öra och labyrint: Labyrintit
Hjärtsjukdomar: Angina instabil, aortaklaffinkompetens, kransartär ateroskleros, sinusbradykardi, ventrikulär hypertrofi
Vaskulära störningar: Djup ventrombos
Reproduktionssystemet och bröststörningar: Cystor på äggstockarna
Undersökningar: Kalium i blodet ökade, blodnatrium ökade, blodtestosteron minskade
Skador, förgiftning och procedurkomplikationer: Epikondylit, senruptur
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av CELEBREX efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att tillförlitligt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering
Kardiovaskulär: Vaskulit, djup ventrombos
Allmän: Anafylaktoid reaktion, angioödem
Lever och gallvägar: Levernekros, hepatit, gulsot, leversvikt
Hemisk och lymfatisk: Agranulocytos, aplastisk anemi, pancytopeni, leukopeni
Metaboliskt: Hypoglykemi, hyponatremi
Nervös: Aseptisk meningit, ageusi, anosmi, dödlig intrakraniell blödning
Njur: Interstitiell nefrit
LÄKEMEDELSINTERAKTIONER
Se tabell 3 för kliniskt signifikanta läkemedelsinteraktioner med celecoxib.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Kardiovaskulära trombotiska händelser
Kliniska prövningar av flera cyklooxygenas-2 (COX-2) selektiva och icke-selektiva NSAID med en varaktighet på upp till tre år har visat en ökad risk för allvarliga kardiovaskulära (CV) trombotiska händelser, inklusive hjärtinfarkt (MI) och stroke, som kan vara dödlig. Baserat på tillgängliga data är det oklart att risken för CV-trombotiska händelser är liknande för alla NSAID. Den relativa ökningen av allvarliga CV-trombotiska händelser jämfört med baslinjen till följd av NSAID-användning tycks vara liknande hos de med och utan känd CV-sjukdom eller riskfaktorer för CV-sjukdom. Patienter med känd CV-sjukdom eller riskfaktorer hade dock en högre absolut incidens av alltför allvarliga CV-trombotiska händelser, på grund av deras ökade baslinjefrekvens. Vissa observationsstudier fann att denna ökade risk för allvarliga CV-trombotiska händelser började redan under de första veckorna av behandlingen. Ökningen av CV-trombotisk risk har observerats mest konsekvent vid högre doser.
APC-studien (Adenoma Prevention with Celecoxib) fanns det ungefär en trefaldig ökad risk för det sammansatta effektmåttet kardiovaskulär död, hjärtinfarkt eller stroke för behandlingsarmarna CELEBREX 400 mg två gånger dagligen och CELEBREX 200 mg två gånger dagligen jämfört med placebo. Ökningen i båda dosgrupperna för celecoxib jämfört med placebobehandlade patienter berodde huvudsakligen på en ökad incidens av hjärtinfarkt [se Kliniska studier ].
En randomiserad kontrollerad studie med titeln Prospective Randomized Evaluation of Celecoxib Integrated Safety vs. Ibuprofen Or Naproxen (PRECISION) genomfördes för att bedöma den relativa kardiovaskulära trombotiska risken för en COX-2-hämmare, celecoxib, jämfört med de icke-selektiva NSAID-preparaten naproxen och ibuprofenen. Celecoxib 100 mg två gånger dagligen var inte sämre än naproxen 375 till 500 mg två gånger dagligen och ibuprofen 600 till 800 mg tre gånger dagligen för den sammansatta endpointen för antiplatelet Trialists' Collaboration (APTC), som består av kardiovaskulär död (inklusive hemorragisk död), icke-fatal hjärtinfarkt och icke-fatal stroke [se Kliniska studier ].
För att minimera den potentiella risken för en negativ CV-händelse hos NSAID-behandlade patienter, använd den lägsta effektiva dosen under kortast möjliga varaktighet. Läkare och patienter bör vara uppmärksamma på utvecklingen av sådana händelser, under hela behandlingsförloppet, även i frånvaro av tidigare CV-symtom. Patienter bör informeras om symtomen på allvarliga CV-händelser och de åtgärder som ska vidtas om de inträffar.
Det finns inga konsekventa bevis för att samtidig användning av aspirin minskar den ökade risken för allvarliga CV-trombotiska händelser i samband med NSAID-användning. Samtidig användning av aspirin och ett NSAID, såsom celecoxib, ökar risken för allvarliga gastrointestinala (GI) händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Status efter kranskärlsbypassoperation (CABG).
Två stora, kontrollerade kliniska prövningar av ett COX-2-selektivt NSAID för behandling av smärta under de första 10 till 14 dagarna efter CABG-kirurgi fann en ökad incidens av hjärtinfarkt och stroke. NSAID är kontraindicerade vid CABG [se KONTRAINDIKATIONER ].
Patienter efter MI
Observationsstudier utförda i det danska nationella registret har visat att patienter som behandlats med NSAID under perioden efter MI löpte ökad risk för reinfarkt, CV-relaterad död och dödlighet av alla orsaker med början under den första behandlingsveckan. I samma kohort var incidensen av dödsfall under det första året efter MI 20 per 100 personår hos NSAID-behandlade patienter jämfört med 12 per 100 personår hos icke-NSAID-exponerade patienter. Även om den absoluta dödsfrekvensen minskade något efter det första året efter MI, kvarstod den ökade relativa risken för död hos NSAID-användare under åtminstone de kommande fyra åren av uppföljning.
Undvik användningen av CELEBREX 100 mg till patienter med nyligen hjärtinfarkt såvida inte fördelarna förväntas uppväga risken för återkommande CV-trombotiska händelser. Om CELEBREX används till patienter med nyligen hjärtinfarkt, övervaka patienterna för tecken på hjärtischemi.
Gastrointestinal blödning, sårbildning och perforering
NSAID, inklusive celecoxib orsakar allvarliga gastrointestinala (GI) biverkningar inklusive inflammation, blödning, sårbildning och perforering av matstrupen, magen, tunntarmen eller tjocktarmen, vilket kan vara dödligt. Dessa allvarliga biverkningar kan inträffa när som helst, med eller utan varningssymtom, hos patienter som behandlas med CELEBREX. Endast en av fem patienter som utvecklar en allvarlig övre GI-biverkning på NSAID-behandling är symtomatisk. Övre gastrointestinala sår, grov blödning eller perforation orsakad av NSAID förekom hos cirka 1 % av patienterna som behandlades under 3 till 6 månader och hos cirka 2 % till 4 % av patienterna som behandlades under ett år. Men även kortvarig NSAID-behandling är inte utan risk.
Riskfaktorer för GI-blödning, sårbildning och perforering
Patienter med magsår i anamnesen och/eller gastrointestinala blödningar som använde NSAID hade en mer än 10 gånger ökad risk för att utveckla en gastrointestinala blödning jämfört med patienter utan dessa riskfaktorer. Andra faktorer som ökar risken för GI-blödning hos patienter som behandlas med NSAID inkluderar längre varaktighet av NSAID-behandling; samtidig användning av orala kortikosteroider, trombocythämmande läkemedel (såsom aspirin), antikoagulantia; eller selektiva serotoninåterupptagshämmare (SSRI); rökning; användning av alkohol; äldre ålder; och dåligt allmänt hälsotillstånd. De flesta rapporter om dödliga GI-händelser efter marknadsföring inträffade hos äldre eller försvagade patienter. Dessutom löper patienter med avancerad leversjukdom och/eller koagulopati en ökad risk för GI-blödning.
Frekvensen av komplicerade och symtomatiska sår var 0,78 % efter nio månader för alla patienter i CLASS-studien och 2,19 % för subgruppen på lågdos ASA. Patienter 65 år och äldre hade en incidens på 1,40 % vid nio månader, 3,06 % när de också tog ASA [se Kliniska studier ].
Strategier för att minimera GI-riskerna hos NSAID-behandlade patienter
- Använd den lägsta effektiva dosen under kortast möjliga varaktighet.
- Undvik administrering av mer än ett NSAID åt gången.
- Undvik användning till patienter med högre risk om inte fördelarna förväntas uppväga den ökade risken för blödning. För sådana patienter, såväl som de med aktiv GI-blödning, överväg alternativa terapier än NSAID.
- Var uppmärksam på tecken och symtom på magsår och blödning under NSAID-behandling.
- Om en allvarlig GI-biverkning misstänks, initiera omedelbart utvärdering och behandling och avbryt CELEBREX 200 mg tills en allvarlig GI-biverkning är utesluten.
- Vid samtidig användning av lågdos acetylsalicylsyra för hjärtprofylax, övervaka patienterna noggrannare för tecken på GI-blödning [se LÄKEMEDELSINTERAKTIONER ].
Hepatotoxicitet
Förhöjningar av ALAT eller ASAT (tre eller fler gånger den övre normalgränsen [ULN]) har rapporterats hos cirka 1 % av NSAID-behandlade patienter i kliniska prövningar. Dessutom har sällsynta, ibland dödliga, fall av allvarlig leverskada, inklusive fulminant hepatit, levernekros och leversvikt rapporterats.
Förhöjningar av ALAT eller ASAT (mindre än tre gånger ULN) kan förekomma hos upp till 15 % av patienterna som behandlas med NSAID inklusive celecoxib.
I kontrollerade kliniska prövningar av CELEBREX 200 mg var incidensen av borderlinehöjningar (större än eller lika med 1,2 gånger och mindre än 3 gånger den övre normalgränsen) av leverassocierade enzymer 6 % för CELEBREX och 5 % för placebo, och cirka 0,2 % av patienterna som tog CELEBREX och 0,3 % av patienterna som fick placebo hade märkbara förhöjningar av ALAT och ASAT.
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, diarré, klåda, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om kliniska tecken och symtom som överensstämmer med leversjukdom utvecklas, eller om systemiska manifestationer uppstår (t.ex. eosinofili, hudutslag), avbryt CELEBREX omedelbart och utför en klinisk utvärdering av patienten.
Hypertoni
NSAID, inklusive CELEBREX 200 mg, kan leda till ny uppkomst av hypertoni eller förvärring av redan existerande hypertoni, vilka båda kan bidra till den ökade incidensen av CV-händelser. Patienter som tar angiotensinkonverterande enzym (ACE)-hämmare, tiaziddiuretika eller loopdiuretika kan ha försämrat svar på dessa behandlingar när de tar NSAID [se LÄKEMEDELSINTERAKTIONER ].
Ser Kliniska studier för ytterligare blodtrycksdata för CELEBREX.
Övervaka blodtrycket (BP) under inledning av NSAID-behandling och under hela behandlingen.
Hjärtsvikt och ödem
Coxib och traditionella NSAID-försökare' Samarbetsmetaanalys av randomiserade kontrollerade studier visade en ungefär tvåfaldig ökning av sjukhusvistelser för hjärtsvikt hos COX-2 selektivt behandlade patienter och icke-selektiva NSAID-behandlade patienter jämfört med placebobehandlade patienter. I en dansk National Register-studie av patienter med hjärtsvikt ökade NSAID-användning risken för hjärtinfarkt, sjukhusvistelse för hjärtsvikt och död.
Dessutom har vätskeretention och ödem observerats hos vissa patienter som behandlats med NSAID. Användning av celecoxib kan dämpa CV-effekterna av flera terapeutiska medel som används för att behandla dessa medicinska tillstånd (t.ex. diuretika, ACE-hämmare eller angiotensinreceptorblockerare [ARB]) [se LÄKEMEDELSINTERAKTIONER ].
I CLASS-studien [se Kliniska studier ], Kaplan-Meier kumulativa frekvenser vid 9 månader av perifera ödempatienter på CELEBREX 400 mg två gånger dagligen (4 och 2 gånger de rekommenderade OA- respektive RA-doserna), ibuprofen 800 mg tre gånger dagligen och diklofenak 75 mg två gånger dagligen var 4,5 %, 6,9 % respektive 4,7 %.
Undvik användning av CELEBREX 200 mg till patienter med allvarlig hjärtsvikt om inte fördelarna förväntas uppväga risken för förvärrad hjärtsvikt. Om CELEBREX 100 mg används till patienter med allvarlig hjärtsvikt, övervaka patienterna för tecken på förvärrad hjärtsvikt.
Njurtoxicitet och hyperkalemi
Njurtoxicitet
Långvarig administrering av NSAID har resulterat i njurpapillär nekros och annan njurskada.
Njurtoxicitet har också setts hos patienter hos vilka njurprostaglandiner har en kompensatorisk roll i upprätthållandet av njurperfusion. Hos dessa patienter kan administrering av ett NSAID orsaka en dosberoende minskning av prostaglandinformationen och, i andra hand, i njurblodflödet, vilket kan utlösa tydlig njurdekompensation. Patienter med störst risk för denna reaktion är de med nedsatt njurfunktion, uttorkning, hypovolemi, hjärtsvikt, leverdysfunktion, de som tar diuretika, ACE-hämmare eller ARB och äldre. Avbrytande av NSAID-behandling följs vanligtvis av återhämtning till förbehandlingstillstånd.
Ingen information finns tillgänglig från kontrollerade kliniska studier angående användning av CELEBREX 100 mg hos patienter med avancerad njursjukdom. Njureffekterna av CELEBREX kan påskynda utvecklingen av njurdysfunktion hos patienter med redan existerande njursjukdom.
Korrekt volymstatus hos dehydrerade eller hypovolemiska patienter innan CELEBREX påbörjas. Övervaka njurfunktionen hos patienter med nedsatt njur- eller leverfunktion, hjärtsvikt, uttorkning eller hypovolemi under användning av CELEBREX [se LÄKEMEDELSINTERAKTIONER ]. Undvik användning av CELEBREX 200 mg till patienter med avancerad njursjukdom såvida inte fördelarna förväntas uppväga risken för försämrad njurfunktion. Om CELEBREX 200 mg används till patienter med avancerad njursjukdom, övervaka patienterna för tecken på försämrad njurfunktion.
Hyperkalemi
Ökning av serumkaliumkoncentrationen, inklusive hyperkalemi, har rapporterats vid användning av NSAID, även hos vissa patienter utan nedsatt njurfunktion. Hos patienter med normal njurfunktion har dessa effekter tillskrivits tillståndet ahyporeninemisk-hypoaldosteronism.
Anafylaktiska reaktioner
Celecoxib har associerats med anafylaktiska reaktioner hos patienter med och utan känd överkänslighet mot celecoxib och hos patienter med aspirinkänslig astma. Celebrex 200mg är en sulfonamid och både NSAID och sulfonamider kan orsaka allergiska reaktioner inklusive anafylaktiska symtom och livshotande eller mindre allvarliga astmatiska episoder hos vissa känsliga personer [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sök akut hjälp om någon anafylaktisk reaktion inträffar.
Förvärring av astma relaterad till aspirinkänslighet
En subpopulation av patienter med astma kan ha aspirinkänslig astma som kan innefatta kronisk rhinosinusit komplicerad av näspolyper; allvarlig, potentiellt dödlig bronkospasm; och/eller intolerans mot aspirin och andra NSAID. Eftersom korsreaktivitet mellan acetylsalicylsyra och andra NSAID har rapporterats hos sådana aspirinkänsliga patienter, är CELEBREX kontraindicerat hos patienter med denna form av aspirinkänslighet [se KONTRAINDIKATIONER ]. När CELEBREX används till patienter med redan existerande astma (utan känd acetylsalicylsyrakänslighet), övervaka patienterna med avseende på förändringar i tecken och symtom på astma.
Allvarliga hudreaktioner
Allvarliga hudreaktioner har inträffat efter behandling med Celebrex 200 mg, inklusive erythema multiforme, exfoliativ dermatit, Stevens-Johnsons syndrom (SJS), toxisk epidermal nekrolys (TEN), läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) och akut generaliserad exantematös pustulos AGEP). Dessa allvarliga händelser kan inträffa utan förvarning och kan vara dödliga.
Informera patienterna om tecken och symtom på allvarliga hudreaktioner och att avbryta användningen av CELEBREX 100 mg vid första uppkomsten av hudutslag eller andra tecken på överkänslighet. CELEBREX 200 mg är kontraindicerat till patienter med tidigare allvarliga hudreaktioner på NSAID [se KONTRAINDIKATIONER ].
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) har rapporterats hos patienter som tar NSAID såsom CELEBREX. Några av dessa händelser har varit dödliga eller livshotande. DRESS ger vanligtvis, men inte uteslutande, feber, hudutslag, lymfadenopati och/eller svullnad i ansiktet. Andra kliniska manifestationer kan inkludera hepatit, nefrit, hematologiska abnormiteter, myokardit eller myosit. Ibland kan symtom på DRESS likna en akut virusinfektion. Eosinofili är ofta närvarande. Eftersom denna störning är variabel i sin presentation, kan andra organsystem som inte noteras här vara inblandade. Det är viktigt att notera att tidiga manifestationer av överkänslighet, såsom feber eller lymfadenopati, kan förekomma även om utslag inte är uppenbara. Om sådana tecken eller symtom finns, avbryt CELEBREX 200 mg och utvärdera patienten omedelbart.
Fostertoxicitet
För tidig stängning av Fetal Ductus Arteriosus
Undvik användning av NSAID, inklusive CELEBREX 100 mg, hos gravida kvinnor vid cirka 30 veckors graviditet och senare. NSAID, inklusive CELEBREX, ökar risken för för tidig stängning av fetal ductus arteriosus vid ungefär denna graviditetsålder.
Oligohydramnios/neonatal njurfunktionsnedsättning
Användning av NSAID, inklusive CELEBREX, vid cirka 20 veckors graviditet eller senare under graviditeten kan orsaka fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. Dessa negativa utfall ses i genomsnitt efter dagar till veckors behandling, även om oligohydramnios sällan har rapporterats så snart som 48 timmar efter NSAID-start. Oligohydramnios är ofta, men inte alltid, reversibel när behandlingen avbryts. Komplikationer av långvariga oligohydramnios kan till exempel inkludera lemkontrakturer och försenad lungmognad. I vissa fall efter marknadsföring av nedsatt njurfunktion hos nyfödda krävdes invasiva procedurer såsom utbytestransfusion eller dialys.
Om NSAID-behandling är nödvändig mellan cirka 20 veckor och 30 veckors graviditet, begränsa användningen av CELEBREX till lägsta effektiva dos och kortast möjliga varaktighet. Överväg ultraljudsövervakning av fostervatten om behandlingen med CELEBREX sträcker sig längre än 48 timmar. Avbryt CELEBREX om oligohydramnios uppstår och följ upp enligt klinisk praxis[se Användning i specifika populationer ].
Hematologisk toxicitet
Anemi har förekommit hos NSAID-behandlade patienter. Detta kan bero på ockult eller grov blodförlust, vätskeretention eller en ofullständigt beskriven effekt på erytropoes. Om en patient som behandlas med CELEBREX har några tecken eller symtom på anemi, övervaka hemoglobin eller hematokrit.
I kontrollerade kliniska prövningar var incidensen av anemi 0,6 % med CELEBREX och 0,4 % med placebo. Patienter på långtidsbehandling med CELEBREX 200 mg bör få sitt hemoglobin eller hematokrit kontrollerat om de uppvisar några tecken eller symtom på anemi eller blodförlust.
NSAID, inklusive CELEBREX 100 mg, kan öka risken för blödningar. Samsjukliga tillstånd som koagulationsrubbningar eller samtidig användning av warfarin, andra antikoagulantia, trombocythämmande läkemedel (t.ex. aspirin), SSRI och serotonin noradrenalin återupptagshämmare (SNRI) kan öka denna risk. Övervaka dessa patienter för tecken på blödning [se LÄKEMEDELSINTERAKTIONER ].
Maskering av inflammation och feber
Den farmakologiska aktiviteten av CELEBREX 100 mg för att minska inflammation, och eventuellt feber, kan minska användbarheten av diagnostiska tecken för att upptäcka infektioner.
Laboratorieövervakning
Eftersom allvarlig GI-blödning, levertoxicitet och njurskada kan uppstå utan varningssymtom eller tecken, överväg att övervaka patienter på långvarig NSAID-behandling med en CBC och en kemiprofil regelbundet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
kontrollerade kliniska prövningar förekom förhöjd BUN oftare hos patienter som fick CELEBREX jämfört med patientens son placebo. Denna laboratorieavvikelse sågs även hos patienter som fick jämförande NSAID i dessa studier. Den kliniska betydelsen av denna abnormitet har inte fastställts.
Disseminerad intravaskulär koagulation (DIC)
På grund av risken för spridd intravaskulär koagulation vid användning av CELEBREX 200 mg hos pediatriska patienter med systemisk debut JRA, övervaka patienter för tecken och symtom på onormal koagulering eller blödning, och informera patienter och deras vårdgivare att rapportera symtom så snart som möjligt.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ) som medföljer varje utskrivet recept. Informera patienter, familjer eller deras vårdgivare om följande information innan behandlingen med CELEBREX påbörjas och med jämna mellanrum under pågående terapi.
Kardiovaskulära trombotiska händelser
Rekommendera patienter att vara uppmärksamma på symtom på kardiovaskulära trombotiska händelser, inklusive bröstsmärtor, andnöd, svaghet eller sluddrigt tal, och att omedelbart rapportera något av dessa symtom till sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Gastrointestinal blödning, sårbildning och perforering
Rekommendera patienter att rapportera symtom på sår och blödningar, inklusive epigastriasmärta, dyspepsi, melena och hematemes till sin vårdgivare. Vid samtidig användning av lågdos aspirin för hjärtprofylax, informera patienterna om den ökade risken för och tecknen och symtomen på gastrointestinala blödningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hepatotoxicitet
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, slöhet, klåda, diarré gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om dessa inträffar, instruera patienterna att sluta med CELEBREX 200 mg och omedelbart söka medicinsk behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , Användning i specifika populationer ].
Hjärtsvikt och ödem
Rekommendera patienter att vara uppmärksamma på symtom på kronisk hjärtsvikt inklusive andnöd, oförklarlig viktökning eller ödem och att kontakta sin vårdgivare om sådana symtom uppstår [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anafylaktiska reaktioner
Informera patienterna om tecknen på en anafylaktisk reaktion (t.ex. andningssvårigheter, svullnad i ansikte eller hals). Instruera patienter att söka omedelbar akut hjälp om dessa inträffar [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Allvarliga hudreaktioner, inklusive KLÄNNING
Rekommendera patienter att sluta ta CELEBREX 100 mg omedelbart om de utvecklar någon typ av hudutslag eller feber och att kontakta sin vårdgivare så snart som möjligt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kvinnlig fertilitet
Informera kvinnor med reproduktionspotential som önskar graviditet som NSAID, inklusive CELEBREX 200 mg, kan vara förknippade med är versibel försening av ägglossningen [se Användning i specifika populationer ].
Fostertoxicitet
Informera gravida kvinnor att undvika användning av CELEBREX och andra NSAID-preparat från och med 30:e graviditetsveckan på grund av risken för för tidig stängning av fetal ductus arteriosus. Om behandling med CELEBREX 200 mg behövs för en gravid kvinna mellan cirka 20 till 30 veckors graviditet, informera henne om att hon kan behöva övervakas för oligohydramnios, om behandlingen fortsätter längre än 48 timmar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Undvik samtidig användning av NSAID
Informera patienterna om att samtidig användning av CELEBREX och andra NSAID eller salicylater (t.ex. diflunisal, salsalat) inte rekommenderas på grund av den ökade risken för gastrointestinal toxicitet och liten eller ingen ökning av effekt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ]. Varna patienter om att NSAID kan finnas i "receptfria" läkemedel för behandling av förkylningar, feber eller sömnlöshet.
Användning av NSAID och lågdos aspirin
Informera patienterna att inte använda lågdos acetylsalicylsyra samtidigt med CELEBREX 200 mg förrän de pratat med sin vårdgivare [se LÄKEMEDELSINTERAKTIONER ].
Den här produktens märkning kan ha uppdaterats. För den senaste förskrivningsinformationen, besök www.pfizer.com.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Celecoxib var inte cancerframkallande hos Sprague-Dawley-råttor som fick orala doser upp till 200 mg/kg för hanar och 10 mg/kg för honor (ungefär 2 till 4 gånger den mänskliga exponeringen mätt med AUC0-24 vid 200 mg två gånger dagligen ) eller hos möss som fått orala doser upp till 25 mg/kg för män och 50 mg/kg för honor (ungefär lika med mänsklig exponering mätt med AUC0-24 vid 200 mg två gånger dagligen) i två år.
Mutagenes
Celecoxib var inte mutagent i ett Ames-test och en mutationsanalys i ovarieceller från kinesisk hamster (CHO), och inte heller klastogen i en kromosomavvikelseanalys i CHO-celler och ett mikrokärntest in vivo i benmärg hos råtta.
Nedsättning av fertilitet
Celecoxib hade ingen effekt på manlig eller kvinnlig fertilitet eller manlig reproduktion hos råttor vid orala doser upp till 600 mg/kg/dag (ungefär 11 gånger human exponering vid 200 mg två gånger dagligen baserat på AUC0-24). Vid ≥50 mg/kg/dag (ungefär 6 gånger human exponering baserat på AUC0-24 vid 200 mg två gånger dagligen) förelåg en ökad preimplantationsförlust.
Användning i specifika populationer
Graviditet
Risksammanfattning
Användning av NSAID, inklusive CELEBREX 200 mg, kan orsaka för tidig stängning av fostrets ductus arteriosus och fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. På grund av dessa risker, begränsa dosen och varaktigheten av CELEBREX 200 mg mellan cirka 20 och 30 veckors graviditet och undvika CELEBREX-användning vid cirka 30 veckors graviditet och senare under graviditeten (se Kliniska överväganden, data ).
För tidig stängning av Fetal Ductus Arteriosus
Användning av NSAID, inklusive CELEBREX, vid cirka 30 veckors graviditet eller senare under graviditeten ökar risken för för tidig stängning av fostergången arteriosus.
Oligohydramnios/neonatal njurfunktionsnedsättning
Användning av NSAID vid ungefär 20 veckors graviditet eller senare under graviditeten har associerats med fall av fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning.
Data från observationsstudier angående andra potentiella embryo-fosterrisker vid användning av NSAID hos kvinnor under graviditetens första eller andra trimester är inte övertygande. I reproduktionsstudier på djur observerades embryo-fosterdöd och en ökning av diafragmabråck hos råttor som administrerades celecoxib dagligen under organogenesperioden vid orala doser cirka 6 gånger den maximala rekommenderade humana dosen (MRHD) på 200 mg två gånger dagligen. Dessutom observerades strukturella abnormiteter (t.ex. septumdefekter, revben sammansmälta, bröstbenen sammansmälta och bröstbenen missformade) hos kaniner som fick dagliga orala doser av celecoxib under organogenesperioden vid ungefär 2 gånger MRHD (se Data ). Baserat på djurdata har prostaglandiner visat sig ha en viktig roll i endometrievaskulär permeabilitet, blastocystimplantation och decidualisering. I djurstudier resulterade administrering av prostaglandinsynteshämmare såsom celecoxib i ökad förlust före och efter implantation. Prostaglandiner har också visat sig ha en viktig roll i fostrets njurutveckling. I publicerade djurstudier har prostaglandinsynteshämmare rapporterats försämra njurutvecklingen när de administreras i kliniskt relevanta doser.
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Kliniska överväganden
Fetala/neonatala biverkningar
För tidig stängning av Fetal Ductus Arteriosus
Undvik användning av NSAID hos kvinnor vid ungefär 30 veckors graviditet och senare i graviditeten, eftersom NSAID, inklusive CELEBREX 200 mg, kan orsaka för tidig stängning av fosterets ductus arteriosus (se Data ).
Oligohydramnios/neonatal njurfunktionsnedsättning:
Om ett NSAID är nödvändigt vid ungefär 20 veckors graviditet eller senare under graviditeten, begränsa användningen till lägsta effektiva dos och kortast möjliga varaktighet. Om behandlingen med CELEBREX sträcker sig längre än 48 timmar, överväg att övervaka med ultraljud för oligohydramnios. Om oligohydramnios uppstår, avbryt CELEBREX och följ upp enligt klinisk praxis (se Data ).
Arbetskraft eller leverans
Det finns inga studier på effekterna av CELEBREX under förlossning eller förlossning. I djurstudier hämmar NSAID, inklusive celecoxib, prostaglandinsyntesen, orsakar försenad förlossning och ökar förekomsten av dödfödsel.
Data
Mänskliga data
Tillgängliga data fastställer inte närvaron eller frånvaron av utvecklingstoxicitet relaterad till användningen av CELEBREX.
För tidig stängning av Fetal Ductus Arteriosus
Publicerad litteratur rapporterar att användning av NSAID vid cirka 30 veckors graviditet och senare i graviditeten kan orsaka för tidig stängning av fostergången arteriosus.
Oligohydramnios/neonatal njurfunktionsnedsättning
Publicerade studier och rapporter efter marknadsföring beskriver moderns NSAID-användning vid ungefär 20 veckors graviditet eller senare under graviditeten i samband med fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. Dessa negativa utfall ses i genomsnitt efter dagar till veckors behandling, även om oligohydramnios sällan har rapporterats så snart som 48 timmar efter NSAID-start. I många fall, men inte alla, var minskningen av fostervatten övergående och reversibel när läkemedlet upphörde. Det har förekommit ett begränsat antal fallrapporter av maternell NSAID-användning och neonatal njurfunktion utan oligohydramnios, av vilka några var irreversibla. Vissa fall av neonatal njurdysfunktion krävde behandling med invasiva procedurer, såsom utbytestransfusion eller dialys.
Metodologiska begränsningar för dessa studier och rapporter efter marknadsföring inkluderar bristen på en kontrollgrupp; begränsad information om dos, varaktighet och tidpunkt för läkemedelsexponering; och samtidig användning av andra läkemedel. Dessa begränsningar utesluter upprättande av en tillförlitlig uppskattning av risken för ogynnsamma foster- och neonatala utfall vid användning av moders NSAID. Eftersom de publicerade säkerhetsdata om neonatala resultat mestadels involverade prematura spädbarn, är generaliserbarheten av vissa rapporterade risker för fullgångna spädbarn som exponerats för NSAID genom modern användning osäker.
Djurdata
Celecoxib i orala doser ≥150 mg/kg/dag (cirka 2 gånger den mänskliga exponeringen vid 200 mg två gånger dagligen mätt med AUC0–24), orsakade en ökad förekomst av ventrikulära septumdefekter, en sällsynt händelse och fosterförändringar, som t.ex. revbenen smälter ihop, bröstbenen smälter ihop och bröstbenen missformas när kaniner behandlades under hela organogenesen. En dosberoende ökning av indiafragmatiska bråck observerades när råttor gavs celecoxib i orala doser ≥30 mg/kg/dag (ungefär 6 gånger human exponering baserat på AUC 0–24 vid 200 mg två gånger dagligen för RA) under hela organogenesen. Hos råttor resulterade exponering för celecoxib under tidig embryonal utveckling i förluster före implantation och efter implantation vid orala doser ≥50 mg/kg/dag (ungefär 6 gånger mänsklig exponering baserat på AUC 0–24 vid 200 mg två gånger dagligen för RA).
Celecoxib gav inga tecken på försenad förlossning eller förlossning vid orala doser upp till 100 mg/kg hos råttor (ungefär 7 gånger mänsklig exponering mätt med AUC 0–24 vid 200 mg två gånger dagligen). Effekterna av CELEBREX på förlossningen och förlossningen hos gravida kvinnor är okända.
Laktation
Risksammanfattning
Begränsade data från 3 publicerade rapporter som omfattade totalt 12 ammande kvinnor visade låga nivåer av CELEBREX i bröstmjölk. Den beräknade genomsnittliga dagliga spädbarnsdosen var 10 till 40 mikrogram/kg/dag, mindre än 1 % av den viktbaserade terapeutiska dosen för ett tvåårigt barn. En rapport om två ammade spädbarn 17 och 22 månader gamla visade inga biverkningar. Försiktighet bör iakttas när CELEBREX 100 mg ges till en ammande kvinna. De utvecklingsmässiga och hälsomässiga fördelarna med amning bör övervägas tillsammans med moderns kliniska behov av CELEBREX och eventuella negativa effekter på det ammade barnet från CELEBREX 200 mg eller från det underliggande moderns tillståndet.
Kvinnor Och Hanar Av Reproduktionspotential
Infertilitet
Kvinnor
Baserat på verkningsmekanismen kan användningen av prostaglandinmedierade NSAID, inklusive CELEBREX, fördröja eller förhindra bristning av äggstocksfolliklar, vilket har associerats med reversibel infertilitet hos vissa kvinnor. Publicerade djurstudier har visat att administrering av prostaglandinsynteshämmare har potential att störa prostaglandinmedierad follikelruptur som krävs för ägglossning. Små studier på kvinnor som behandlats med NSAID har också visat en reversibel försening av ägglossningen. Överväg utsättande av NSAID, inklusive CELEBREX 200 mg, hos kvinnor som har svårt att bli gravida eller som genomgår utredning av infertilitet.
Pediatrisk användning
CELEBREX 200mg är godkänt för lindring av tecknen och symtomen på juvenil reumatoid artrit hos patienter 2 år och äldre. Säkerhet och effekt har inte studerats efter sex månader hos barn. Den långvariga kardiovaskulära toxiciteten hos barn som exponerats för CELEBREX 100 mg har inte utvärderats och det är okänt om riskerna på lång sikt kan likna den som ses hos vuxna som exponerats för CELEBREX eller andra COX-2 selektiva och icke-selektiva NSAID [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och Kliniska studier ].
Användningen av celecoxib hos patienter i åldern 2 till 17 år med pauciartikulär, polyartikulär JRA eller hos patienter med systemisk debut JRA studerades i en 12-veckors, dubbelblind, aktivt kontrollerad, farmakokinetisk, säkerhets- och effektstudie, med en 12 veckors öppen förlängning. Celecoxib har inte studerats hos patienter under 2 år, hos patienter med kroppsvikt mindre än 10 kg (22 lbs) och hos patienter med aktiva systemiska egenskaper. Patienter med systemisk debut JRA (utan aktiva systemiska egenskaper) verkar löpa risk för utveckling av onormala koagulationslaboratorietester. Hos vissa patienter med systemisk debut JRA var både celecoxib och naproxen associerade med mild förlängning av aktiverad partiell tromboplastintid (APTT) men inte protrombintid (PT). När NSAID-preparat inklusive celecoxib används hos patienter med systemisk debut JRA, övervaka patienter med avseende på tecken och symtom på onormal koagulering eller blödning, på grund av risken för disseminerad intravaskulär koagulation. Patienter med systemisk debut JRA bör övervakas med avseende på utveckling av onormala koagulationstester [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER , Djurtoxikologi , Kliniska studier ].
Alternativa terapier för behandling av JRA bör övervägas hos pediatriska patienter som identifierats vara CYP2C9 dåliga metaboliserare [se Dåliga metaboliserare av CYP2C9-substrat ].
Geriatrisk användning
Äldre patienter, jämfört med yngre patienter, löper större risk för NSAID-relaterade allvarliga kardiovaskulära, gastrointestinala och/eller renala biverkningar. Om den förväntade fördelen för den äldre patienten uppväger dessa potentiella risker, börja doseringen i den nedre delen av doseringsintervallet och övervaka patienterna för biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Av det totala antalet patienter som fick CELEBREX 100 mg i förhandsgodkännande av kliniska prövningar var mer än 3 300 65–74 år gamla, medan cirka 1 300 ytterligare patienter var 75 år och äldre. Inga väsentliga skillnader i effektivitet observerades mellan dessa försökspersoner och yngre försökspersoner. I kliniska studier som jämförde njurfunktion mätt med GFR, BUN och kreatinin, och trombocytfunktion mätt med blödningstid och trombocytaggregation, var resultaten inte olika mellan äldre och unga frivilliga. Men som med andra NSAID, inklusive de som selektivt hämmar COX-2, har det förekommit fler spontana rapporter efter marknadsföring av dödliga gastrointestinala händelser och akut njursvikt hos äldre än hos yngre patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt leverfunktion
Den rekommenderade dagliga dosen av CELEBREX kapslar till patienter med måttligt nedsatt leverfunktion (Child-Pugh klass B) bör minskas med 50 %. Användning av CELEBREX till patienter med gravt nedsatt leverfunktion rekommenderas inte [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
CELEBREX rekommenderas inte till patienter med grav njurinsufficiens [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Dåliga metaboliserare av CYP2C9-substrat
Till patienter som är kända eller misstänks vara dåliga CYP2C9-metaboliserare (dvs. CYP2C9*3/*3), baserat på genotyp eller tidigare historia/erfarenhet av andra CYP2C9-substrat (såsom warfarin, fenytoin), administrera CELEBREX 200 mg med början med hälften av det lägsta rekommenderad dos. Alternativ behandling bör övervägas hos JRA-patienter som identifierats vara CYP2C9-fattiga metaboliserare [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
ÖVERDOS
Symtom efter akuta NSAID-överdoseringar har vanligtvis begränsats till slöhet, dåsighet, illamående, kräkningar och epigastrismärta, som i allmänhet har varit reversibla med stödbehandling. Gastrointestinal blödning har inträffat. Hypertoni, akut njursvikt, andningsdepression och koma har förekommit, men var sällsynta [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Inga överdoser av CELEBREX 200 mg rapporterades under kliniska prövningar. Doser upp till 2400 mg/dag i upp till 10 dagar hos 12 patienter resulterade inte i allvarlig toxicitet. Ingen information finns tillgänglig angående avlägsnande av celecoxib genom hemodialys, men baserat på dess höga grad av plasmaproteinbindning (>97 %) är det osannolikt att dialys kommer att vara användbar vid överdosering.
Hantera patienter med symtomatisk och stödjande vård efter en överdosering av NSAID. Det finns inga specifika motgift. Överväg kräkningar och/eller aktivt kol (60 till 100 gram hos vuxna, 1 till 2 gram per kg kroppsvikt hos pediatriska patienter) och/eller osmotisk katartisk hos symtomatiska patienter som ses inom fyra timmar efter intag eller hos patienter med en stor överdosering ( 5 till 10 gånger den rekommenderade dosen). Påtvingad diures, alkalinisering av urin, hemodialys eller hemoperfusion kanske inte är användbara på grund av hög proteinbindning.
För ytterligare information om överdoseringsbehandling kontakta en giftkontrollcentral (1-800-222-1222).
KONTRAINDIKATIONER
CELEBREX är kontraindicerat hos följande patienter:
- Känd överkänslighet (t.ex. anafylaktiska reaktioner och allvarliga hudreaktioner) mot celecoxib, alla komponenter i läkemedelsprodukten [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Anamnes med astma, urtikaria eller andra reaktioner av allergisk typ efter att ha tagit acetylsalicylsyra eller andra NSAID. Allvarliga, ibland dödliga, anafylaktiska reaktioner på NSAID har rapporterats hos sådana patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Vid CABG-kirurgi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Hos patienter som har visat allergiska reaktioner mot sulfonamider [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Celecoxib har smärtstillande, antiinflammatoriska och febernedsättande egenskaper.
Verkningsmekanismen för CELEBREX 100 mg tros bero på hämning av prostaglandinsyntesen, främst via hämning av COX-2.
Celecoxib är en potent hämmare av prostaglandinsyntes in vitro. Celecoxib-koncentrationer som uppnåtts under behandlingen har gett in vivo-effekter. Prostaglandiner sensibiliserar afferenta nerver och potentierar verkan av bradykinin för att inducera smärta i djurmodeller. Prostaglandiner är mediatorer av inflammation. Eftersom celecoxib är en hämmare av prostaglandinsyntesen kan dess verkningsmekanism bero på en minskning av prostaglandiner i perifera vävnader.
Farmakodynamik
Blodplättar
kliniska prövningar med normala frivilliga försökspersoner hade CELEBREX vid engångsdoser upp till 800 mg och multipla doser på 600 mg två gånger dagligen i upp till 7 dagar (högre än rekommenderade terapeutiska doser) ingen effekt på minskning av trombocytaggregation eller ökad blödningstid. På grund av sin brist på trombocyteffekter är CELEBREX 100mg inte en ersättning för aspirin för kardiovaskulär profylax. Det är inte känt om det finns några effekter av CELEBREX på trombocyter som kan bidra till den ökade risken för allvarliga kardiovaskulära trombotiska biverkningar i samband med användning av CELEBREX.
Vätskeretention
Hämning av PGE2-syntes kan leda till natrium- och vattenretention genom ökad reabsorption i den tjocka uppåtgående slingan av njurmärgen av Henle och kanske andra segment av det distala nefronet. I uppsamlingskanalerna tycks PGE2 hämma vattenreabsorptionen genom att motverka effekten av antidiuretiskt hormon.
Farmakokinetik
Celecoxib uppvisar en dosproportionell ökning av exponeringen efter oral administrering upp till 200 mg två gånger dagligen och mindre än proportionell ökning vid högre doser. Den har omfattande distribution och hög proteinbindning. Det metaboliseras primärt av CYP2C9 med en halveringstid på cirka 11 timmar.
Absorption
Maximala plasmanivåer av celecoxib inträffar cirka 3 timmar efter en oral dos. Under fasta är både maximala plasmanivåer (Cmax) och area under kurvan (AUC) ungefär dosproportionella upp till 200 mg två gånger dagligen; vid högre doser är det mindre än proportionella ökningar av Cmax och AUC (se Mateffekter ). Absoluta biotillgänglighetsstudier har inte utförts. Vid upprepad dosering uppnås steady-state tillstånd på eller före dag 5. De farmakokinetiska parametrarna för celecoxib i en grupp friska försökspersoner visas i tabell 4.
Mateffekter
När CELEBREX 200 mg kapslar togs tillsammans med en måltid med hög fetthalt, försenades maximala plasmanivåer i cirka 1 till 2 timmar med en ökning av total absorption (AUC) på 10 % till 20 %. Under fasta, vid doser över 200 mg, är det mindre än en proportionell ökning av Cmax och AUC, vilket tros bero på läkemedlets låga löslighet i vattenhaltiga medier.
Samtidig administrering av CELEBREX och ett antacida innehållande aluminium och magnesium resulterade i en minskning av plasmakoncentrationen av celecoxib med en minskning på 37 % av Cmax och 10 % i AUC. CELEBREX, i doser upp till 200 mg två gånger dagligen, kan administreras utan hänsyn till tidpunkten för måltider. Högre doser (400 mg två gånger dagligen) bör administreras tillsammans med mat för att förbättra absorptionen.
Hos friska vuxna frivilliga var den totala systemiska exponeringen (AUC) av celecoxib likvärdig när celecoxib administrerades som intakt kapsel eller kapselinnehåll stänkt på äppelmos. Det fanns inga signifikanta förändringar i Cmax, Tmax eller t½ efter administrering av kapselinnehållet på äppelmos [se DOSERING OCH ADMINISTRERING ].
Distribution
Hos friska försökspersoner är celecoxib starkt proteinbundet (~97%) inom det kliniska dosintervallet. In vitro-studier indikerar att celecoxib främst binder till albumin och, i mindre utsträckning, α-syraglykoprotein. Den skenbara distributionsvolymen vid steady state (V/F) är cirka 400 L, vilket tyder på omfattande distribution i vävnaderna. Celecoxib är inte företrädesvis bundet till röda blodkroppar.
Eliminering
Ämnesomsättning
Celecoxibs metabolism medieras främst via CYP2C9. Tre metaboliter, en primär alkohol, motsvarande karboxylsyra och dess glukuronidkonjugat, har identifierats i human plasma. Dessa metaboliter är inaktiva som COX-1- eller COX-2-hämmare.
Exkretion
Celecoxib elimineras huvudsakligen genom levermetabolism med lite (
Specifika populationer
Geriatrisk
Vid steady state hade äldre försökspersoner (över 65 år) 40 % högre Cmax och 50 % högre AUC jämfört med unga försökspersoner. Hos äldre kvinnor är Cmax och AUC för celecoxib högre än för äldre män, men dessa ökningar beror främst på lägre kroppsvikt hos äldre kvinnor. Dosjustering hos äldre är i allmänhet inte nödvändig. Men för patienter som väger mindre än 50 kg i kroppsvikt, påbörja behandlingen med den lägsta rekommenderade dosen [se Användning i specifika populationer ].
Pediatrisk
Steady-state farmakokinetiken för celecoxib administrerat som en oral prövningssuspension utvärderades hos 152 JRA-patienter i åldern 2 till 17 år som vägde ≥10 kg med pauciartikulär eller polyartikulär JRA och hos patienter med systemisk JRA. Populationsfarmakokinetisk analys indikerade att det orala clearance (ojusterat för kroppsvikt) av celecoxib ökar mindre än proportionellt mot ökande vikt, med 10 kg och 25 kg patienter som förutspås ha 40 % respektive 24 % lägre clearance, jämfört med en 70 kg vuxen RA patient.
Administrering två gånger dagligen av 50 mg kapslar till JRA-patienter som väger ≥12 till ≤25 kg och 100 mg kapslar till JRA-patienter som väger >25 kg bör uppnå plasmakoncentrationer liknande de som observerats i en klinisk prövning som visade celecoxibs non-inferiority till naproxen 7,5 mg/kg två gånger dagligen [se DOSERING OCH ADMINISTRERING ]. Celecoxib har inte studerats på JRA-patienter under 2 år, hos patienter med kroppsvikt mindre än 10 kg (22 lbs), eller längre än 24 veckor.
Lopp
Metaanalys av farmakokinetiska studier har föreslagit en cirka 40 % högre AUC för celecoxib hos svarta jämfört med kaukasier. Orsaken och den kliniska betydelsen av detta fynd är okänd.
Nedsatt leverfunktion
En farmakokinetisk studie på försökspersoner med mild (Child-Pugh klass A) och måttlig (Child-Pugh klass B) nedsatt leverfunktion har visat att steady-state AUC för celecoxib ökar med cirka 40 % respektive 180 %, över vad som ses hos frisk kontroll. ämnen. Därför bör den rekommenderade dagliga dosen av CELEBREX kapslar minskas med cirka 50 % hos patienter med måttligt (Child-Pugh klass B) nedsatt leverfunktion. Patienter med gravt nedsatt leverfunktion (Child-Pugh klass C) har inte studerats. Användning av CELEBREX till patienter med gravt nedsatt leverfunktion rekommenderas inte [se DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Nedsatt njurfunktion
en korsstudiejämförelse var AUC för celecoxib cirka 40 % lägre hos patienter med kronisk njurinsufficiens (GFR35–60 ml/min) än hos patienter med normal njurfunktion. Inget signifikant samband hittades mellan GFR och celecoxib-clearance. Patienter med allvarlig njurinsufficiens har inte studerats. I likhet med andra NSAID rekommenderas inte CELEBREX 200mg till patienter med allvarlig njurinsufficiens [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Läkemedelsinteraktionsstudier
In vitro-studier indikerar att celecoxib inte är en hämmare av cytokrom P450 2C9, 2C19 eller 3A4.
In vivo-studier har visat följande:
Aspirin
När NSAID administrerades med acetylsalicylsyra reducerades proteinbindningen av NSAID, även om clearance av fritt NSAID inte förändrades. Den kliniska betydelsen av denna interaktion är inte känd. Se tabell 3 för kliniskt signifikanta läkemedelsinteraktioner mellan NSAID och aspirin [se LÄKEMEDELSINTERAKTIONER ].
Litium
en studie utförd på friska försökspersoner ökade genomsnittliga steady-state litiumplasmanivåer med cirka 17 % hos försökspersoner som fick litium 450 mg två gånger dagligen med CELEBREX 200 mg två gånger dagligen jämfört med försökspersoner som enbart fick litium[se] LÄKEMEDELSINTERAKTIONER ].
Flukonazol
Samtidig administrering av flukonazol i 200 mg en gång dagligen resulterade i en tvåfaldig ökning av plasmakoncentrationen av celecoxib. Denna ökning beror på hämningen av celecoxibmetabolismen via P450 2C9 av flukonazol [se LÄKEMEDELSINTERAKTIONER ].
Andra droger
Effekterna av celecoxib på farmakokinetiken och/eller farmakodynamiken för glyburid, ketokonazol, [se LÄKEMEDELSINTERAKTIONER ], fenytoin och tolbutamid har studerats in vivo och kliniskt viktiga interaktioner har inte hittats.
Farmakogenomik
CYP2C9-aktivitet är reducerad hos individer med genetiska polymorfismer som leder till minskad enzymaktivitet, såsom de som är homozygota för CYP2C9*2 och CYP2C9*3 polymorfismer. Begränsade data från 4 publicerade rapporter som inkluderade totalt 8 försökspersoner med den homozygota genotypen CYP2C9*3/*3 visade systemiska nivåer av celecoxib som var 3 till 7 gånger högre hos dessa försökspersoner jämfört med försökspersoner med CYP2C9*1/*1 eller * I/*3 genotyper. Farmakokinetiken för celecoxib har inte utvärderats hos personer med andra CYP2C9-polymorfismer, såsom *2, *5, *6, *9 och *11. Det uppskattas att frekvensen av den homozygota *3/*3 genotypen är 0,3 % till 1,0 % i olika etniska grupper [se DOSERING OCH ADMINISTRERING , Användning i specifika populationer ].
Djurtoxikologi
En ökning av incidensen av bakgrundsfynd av spermatocele med eller utan sekundära förändringar såsom epididymalhy pospermia samt minimal till lätt utvidgning av seminiferösa tubuli sågs hos juvenila råtta. Dessa reproduktionsfynd, även om de uppenbarligen var behandlingsrelaterade, ökade inte i incidens eller svårighetsgrad med dosen och kan tyda på en förvärring av ett spontant tillstånd. Liknande reproduktionsfynd observerades inte i studier på unga eller vuxna hundar eller hos vuxna råttor som behandlats med celecoxib. Den kliniska betydelsen av denna observation är okänd.
Kliniska studier
Artros
CELEBREX 200mg har visat signifikant minskning av ledvärk jämfört med placebo. CELEBREX utvärderades för behandling av tecknen och symtomen på artrose i knä och höft i placebo- och aktivkontrollerade kliniska prövningar på upp till 12 veckor. Hos patienter med artros, resulterade behandling med CELEBREX 100 mg två gånger dagligen eller 200 mg en gång dagligen i förbättring av WOMAC (Western Ontario och McMaster Universities) artrosindex, en sammansättning av smärta, stelhet och funktionella mått vid artros. I tre 12-veckorsstudier av smärta som åtföljer OA-utbrott, gav CELEBREX 100 mg doser på 100 mg två gånger dagligen och 200 mg två gånger dagligen signifikant minskning av smärta inom 24 till 48 timmar efter påbörjad dosering. Vid doser på 100 mg två gånger dagligen eller 200 mg två gånger dagligen visades effekten av CELEBREX 200 mg vara liknande den för naproxen 500 mg två gånger dagligen. Doser på 200 mg två gånger dagligen gav ingen ytterligare fördel utöver den som ses med 100 mg två gånger dagligen. En total daglig dos på 200 mg har visat sig vara lika effektiv oavsett om den administreras som 100 mg två gånger dagligen eller 200 mg en gång dagligen.
Reumatoid artrit
CELEBREX har visat signifikant minskning av ledömhet/smärta och ledsvullnad jämfört med placebo. CELEBREX 100 mg utvärderades för behandling av tecken och symtom på RA i placebo- och aktivkontrollerade kliniska prövningar på upp till 24 veckor. CELEBREX visade sig vara överlägset placebo i dessa studier, med hjälp av ACR20 Responder Index, en sammansättning av kliniska, laboratorie- och funktionella mätningar vid RA. CELEBREX-doser på 100 mg två gånger dagligen och 200 mg två gånger dagligen var likartade i effektivitet och båda var jämförbara med naproxen 500 mg två gånger dagligen.
Även om CELEBREX 100 mg två gånger dagligen och 200 mg två gånger dagligen gav liknande total effekt, fick vissa patienter ytterligare nytta av dosen 200 mg två gånger dagligen. Doser på 400 mg två gånger dagligen gav ingen ytterligare fördel utöver den som ses med 100 mg till 200 mg två gånger dagligen.
Juvenil reumatoid artrit (NCT00652925)
en 12-veckors, randomiserad, dubbelblind aktiv-kontrollerad, parallellgrupps-, multicenter, non-inferiority-studie, patienter från 2 år till 17 år med pauciartikulär, polyartikulär JRA eller systemisk debut JRA (med för närvarande inaktiva systemiska egenskaper ), fick en av följande behandlingar: celecoxib 3 mg/kg (till maximalt 150 mg) två gånger dagligen; celecoxib 6 mg/kg (till maximalt 300 mg) två gånger dagligen; eller naproxen 7,5 mg/kg (till maximalt 500 mg) två gånger dagligen. Svarsfrekvensen baserades på JRA Definition of Improvement som är större än eller lika med 30 % (JRA DOI 30), som är en sammansättning av kliniska, laboratoriemässiga och funktionella mått på JRA. JRA DOI 30-svarsfrekvensen vid vecka 12 var 69 %, 80 % och 67 % i behandlingsgrupperna med celecoxib 3 mg/kg två gånger dagligen, celecoxib 6 mg/kg två gånger dagligen och naproxen 7,5 mg/kg två gånger dagligen.
Effekten och säkerheten av CELEBREX 100 mg för JRA har inte studerats längre än sex månader. Den långvariga kardiovaskulära toxiciteten hos barn som exponerats för CELEBREX 200 mg har inte utvärderats och det är okänt om den långsiktiga risken kan likna den som ses hos vuxna exponerade för CELEBREX 100 mg eller andra COX-2 selektiva och icke-selektiva NSAID [ ser LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Ankyloserande spondylit
CELEBREX utvärderades på AS-patienter i två placebo- och aktivkontrollerade kliniska prövningar på 6 och 12 veckor. CELEBREX vid doser på 100 mg två gånger dagligen, 200 mg en gång dagligen och 400 mg en gång dagligen visade sig vara statistiskt överlägsen placebo i dessa studier för alla tre co-primära effektmått som bedömer global smärtintensitet (Visual Analogue Scale), global sjukdomsaktivitet (Visual Analogue Scale) och funktionsnedsättning (Bath Ankylosing Spondylit Functional Index). I den 12 veckor långa studien fanns det ingen skillnad i omfattningen av förbättringen mellan 200 mg och 400 mg CELEBREX 200 mg doserna i en jämförelse av genomsnittlig förändring från baslinjen, men det var en större andel patienter som svarade på CELEBREX 400 mg, 53 %, än till CELEBREX 200 mg, 44 %, med användning av Assessment in Ankylosing Spondylit response criteria (ASAS20). ASAS 20 definierar en responder som en förbättring från baslinjen på minst 20 % och en absolut förbättring på minst 10 mm, på en 0 mm till 100 mm skala, i minst tre av de fyra följande domänerna: patientens globala smärta, badankyloserande spondylit Funktionsindex och inflammation. Svarsanalysen visade inte heller någon förändring i svarsfrekvensen utöver 6 veckor.
Analgesi, inklusive primär dysmenorré
I akuta analgetiska modeller av postoral kirurgismärta, postortopedisk kirurgisk smärta och primär dysmenorré, lindrade CELEBREX 100 mg smärta som bedömdes av patienter som måttlig till svår. Enstaka doser [se DOSERING OCH ADMINISTRERING ] av CELEBREX 200 mg gav smärtlindring inom 60 minuter.
Försök med kardiovaskulära resultat: Prospektiv randomiserad utvärdering av Celecoxib Integrated Safety vs. Ibuprofen eller Naproxen (PRECISION; NCT00346216)
Design
PRECISION-studien var en dubbelblind randomiserad kontrollerad studie av kardiovaskulär säkerhet hos OA- och RA-patienter med eller med hög risk för kardiovaskulär sjukdom som jämförde celecoxib med naproxen och ibuprofen. Patienterna randomiserades till en startdos på 100 mg två gånger dagligen av celecoxib, 600 mg tre gånger dagligen av ibuprofen eller 375 mg två gånger dagligen av naproxen, med möjlighet att eskalera dosen efter behov för smärtbehandling. Baserat på märkta doser kunde OA-patienter som randomiserades till celecoxib inte dosen eskalera.
Den primära endpointen, antiblodplättsförsökarna' Collaboration (APTC) komposit, var en oberoende bedömd sammansättning av kardiovaskulär död (inklusive hemorragisk död), icke-fatal hjärtinfarkt och icke-dödlig stroke med 80 % förmåga att utvärdera icke-underlägsenhet. Alla patienter ordinerades öppen esomeprazol (20–40 mg) för gastroskydd. Behandlingsrandomisering stratifierades genom baslinjeanvändning av lågdos aspirin.
Dessutom gjordes en 4-månaders delstudie som utvärderade effekterna av de tre läkemedlen på blodtrycket mätt med ambulatorisk övervakning.
Resultat
Bland försökspersoner med artrose eskalerade endast 0,2 % (17/7259) celecoxib till dosen 200 mg två gånger dagligen, medan 54,7 % (3946/7208) eskalerade ibuprofen till 800 mg tre gånger dagligen och 54,8 % (3937/717 napro)eskalerade till 500 mg två gånger dagligen. Bland försökspersoner med RA eskalerade 55,7 % (453/813) celecoxib till dosen 200 mg två gånger dagligen, 56,5 % (470/832) eskalerade ibuprofen till 800 mg tre gånger dagligen och 54,6 % (432/791) ökade till naproxen. 500 mg två gånger dagligen dos; dock stod RA-populationen för endast 10% av försökspopulationen.
Eftersom relativt få celecoxibpatienter totalt (5,8 % [470/8072]) ökade dosen till 200 mg två gånger dagligen, är resultaten från PRECISION-studien inte lämpliga för att bestämma den relativa CV-säkerheten för celecoxib vid 200 mg två gånger dagligen jämfört med ibuprofen och naproxen vid de doser som tas.
Primär slutpunkt
Försöket hade två fördefinierade analyspopulationer:
- Intent-to-treat population (ITT): Består av alla randomiserade försökspersoner som följs i maximalt 30 månader
- Modifierad Intent-to-treat-population (mITT): Består av alla randomiserade försökspersoner som fick minst en dos av studieläkemedel och som hade minst ett besök efter baslinjen följt tills det tidigare av behandlingen avbryts plus 30 dagar eller 43 månader
Celecoxib, vid dosen 100 mg två gånger dagligen, jämfört med antingen naproxen eller ibuprofen vid de intagna doserna, uppfyllde alla fyra förspecificerade icke-underlägsenhetskriterier (p
De primära analysresultaten för ITT och mITT beskrivs i Tabell 5.
ITT-analyspopulationen under 30 månader var dödligheten av alla orsaker 1,6 % i celecoxibgruppen, 1,8 % i ibuprofengruppen och 2,0 % i naproxengruppen.
Ambulatorisk blodtrycksövervakning (ABPM) Delstudie
I understudien PRECISION-ABPM, bland de totalt 444 analyserbara patienterna vid månad 4, sänkte celecoxib doserat med 100 mg två gånger dagligen det genomsnittliga 24-timmarssystoliska blodtrycket (SBP) med 0,3 mmHg, medan ibuprofen och naproxen vid de intagna doserna ökade medel 24-timmars SBP med 3,7 respektive 1,6 mmHg. Dessa förändringar resulterade i en statistiskt signifikant och kliniskt betydelsefull skillnad på 3,9 mmHg (p=0,0009) mellan celecoxib och ibuprofen och en icke-statistiskt signifikant skillnad på 1,8 (p=0,119) mmHg mellan celecoxib och naproxen.
Specialstudier
Adenomatösa polypförebyggande studier (NCT00005094 och NCT00141193)
Kardiovaskulär säkerhet utvärderades i två randomiserade, dubbelblinda, placebokontrollerade, treåriga studier som involverade patienter med sporadiska adenomatösa polyper behandlade med CELEBREX: APC-studien (Adenoma Prevention with Celecoxib) och PreSAP-studien (Prevention of Spontaneous Adenomatous Polyps) . I APC-studien fanns en dosrelaterad ökning av den sammansatta endpointen (bedömd) kardiovaskulär död, hjärtinfarkt eller stroke med celecoxib jämfört med placebo under 3 års behandling. PreSAP-studien visade inte en statistiskt signifikant ökad risk för samma sammansatta effektmått (bedömd):
- APC-studien var riskkvoterna jämfört med placebo för en sammansatt endpoint (bedömd) kardiovaskulär död, hjärtinfarkt eller stroke 3,4 (95 % CI 1,4 – 8,5) med celecoxib 400 mg två gånger dagligen och 2,8 (95 % CI 1,1 – 7,2) med celecoxib 200 mg två gånger dagligen. Kumulativa frekvenser för detta sammansatta effektmått under 3 år var 3,0% (20/671 försökspersoner) respektive 2,5% (17/685 försökspersoner), jämfört med 0,9% (6/679 försökspersoner) med placebobehandling. Ökningen i båda dosgrupperna för celecoxib jämfört med placebobehandlade patienter berodde huvudsakligen på en ökad incidens av hjärtinfarkt.
- I PreSAP-studien var riskkvoten för samma sammansatta effektmått (bedömd) 1,2 (95 % KI 0,6 – 2,4) med celecoxib 400 mg en gång dagligen jämfört med placebo. Kumulativa frekvenser för detta sammansatta effektmått under 3 år var 2,3 % (21/933 försökspersoner) respektive 1,9 % (12/628 försökspersoner).
Kliniska prövningar av andra COX-2 selektiva och icke-selektiva NSAID med upp till tre års varaktighet har visat en ökad risk för allvarliga kardiovaskulära trombotiska händelser, hjärtinfarkt och stroke, som kan vara dödlig. Som ett resultat anses alla NSAID-preparat vara potentiellt associerade med denna risk.
Celecoxib långvarig artrit säkerhetsstudie (KLASS)
Detta var en prospektiv, långsiktig studie med säkerhetsresultat som genomfördes efter marknadsföring på cirka 5 800 OA-patienter och 2 200 RA-patienter. Patienterna fick CELEBREX 400 mg två gånger dagligen (4- och 2-faldigt de rekommenderade OA- respektive RA-doserna), ibuprofen 800 mg tre gånger dagligen eller diklofenak 75 mg två gånger dagligen (vanliga terapeutiska doser). Medianexponeringen för CELEBREX (n = 3 987) och diklofenak (n = 1 996) var 9 månader medan ibuprofen (n = 1 985) var 6 månader. Det primära effektmåttet för denna utfallsstudie var förekomsten av komplicerade sår (gastrointestinal blödning, perforation eller obstruktion). Patienterna fick ta samtidig lågdos (≤ 325 mg/dag) aspirin (ASA) för kardiovaskulär profylax (ASA-undergrupper: CELEBREX, n = 882; diklofenak, n = 445; ibuprofen, n = 412). Skillnader i incidensen av komplicerade sår mellan CELEBREX 200 mg och den kombinerade gruppen av ibuprofen och diklofenak var inte statistiskt signifikanta.
Patienter som fick CELEBREX och samtidig lågdos ASA (N=882) fick 4 gånger högre frekvens av komplicerade sår jämfört med de som inte fick ASA (N=3105). Kaplan-Meier-frekvensen för komplicerade sår efter 9 månader var 1,12 % jämfört med 0,32 % för de som fick lågdos ASA respektive de som inte fick ASA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
De uppskattade kumulativa frekvenserna vid 9 månader av komplicerade och symtomatiska sår för patienter som behandlats med CELEBREX 400 mg två gånger dagligen beskrivs i Tabell 7. Tabell 7 visar också resultat för patienter yngre än eller äldre än 65 år. Skillnaden i doser mellan CELEBREX 200 mg enbart och CELEBREX 100 mg med ASA-grupper kan bero på den högre risken för GI-händelser hos ASA-användare.
Hos ett litet antal patienter med en anamnes på sårsjukdom var frekvensen av komplicerade och symtomatiska sår hos patienter som tog CELEBREX 100 mg enbart eller CELEBREX 100 mg med ASA 2,56 % (n=243) respektive 6,85 % (n=91) vid 48 veckor. Dessa resultat kan förväntas hos patienter med en tidigare historia av sårsjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Kardiovaskulära säkerhetsresultat utvärderades också i CLASS-studien. Kaplan-Meier kumulativa frekvenser för utredare rapporterade allvarliga kardiovaskulära tromboemboliska biverkningar (inklusive hjärtinfarkt, lungemboli, djup ventrombos, instabil angina, övergående ischemiska attacker och ischemiska cerebrovaskulära olyckor) visade inga skillnader mellan behandling med CELEFEN, iprolofenmex, eller iprolofenmex. grupper. De kumulativa frekvenserna hos alla patienter efter nio månader för CELEBREX, diklofenak och ibuprofen var 1,2 %, 1,4 % respektive 1,1 %. Den kumulativa andelen av icke-ASA-användare vid nio månader i var och en av de tre behandlingsgrupperna var mindre än 1 %. De kumulativa frekvenserna för hjärtinfarkt hos icke-ASA-användare vid nio månader i var och en av de tre behandlingsgrupperna var mindre än 0,2 %. Det fanns ingen placebogrupp i CLASS-studien, vilket begränsar möjligheten att avgöra om de tre testade läkemedlen inte hade någon ökad risk för CV-händelser eller om de alla ökade risken i liknande grad. I CLASS-studien visade Kaplan-Meier kumulativa frekvenser vid 9 månader av perifert ödem hos patienter som fick CELEBREX 400 mg två gånger dagligen (4- och 2-faldigt de rekommenderade OA- respektive RA-doserna), ibuprofen 800 mg tre gånger dagligen och diklofenak 75 mg två gånger dagligen var 4,5 %, 6,9 % respektive 4,7 %. Frekvensen av hypertoni från CLASS-studien i CELEBREX-, ibuprofen- och diklofenakbehandlade patienter var 2,4 %, 4,2 % respektive 2,5 %.
Endoskopiska studier
Korrelationen mellan fynden av korttidsendoskopiska studier med CELEBREX och den relativa förekomsten av kliniskt signifikanta allvarliga övre GI-händelser vid långvarig användning har inte fastställts. Allvarliga kliniskt signifikanta blödningar från övre GI har observerats hos patienter som fått CELEBREX 100 mg i kontrollerade och öppna prövningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Kliniska studier ].
En randomiserad, dubbelblind studie på 430 RA-patienter genomfördes där en endoskopisk undersökning utfördes efter 6 månader. Incidensen av endoskopiska sår hos patienter som tog CELEBREX 200 mg två gånger dagligen var 4 % jämfört med 15 % för patienter som tog diklofenak SR 75 mg två gånger dagligen. CELEBREX var dock inte statistiskt annorlunda än diklofenak för kliniskt relevanta GI-resultat i CLASS-studien [se Kliniska studier ].
Förekomsten av endoskopiska sår studerades i två 12-veckors placebokontrollerade studier på 2157 patienter med artrose och RA där baseline-endoskopier inte visade några sår. Det fanns inget dossamband för förekomsten av gastro duodenalsår och dosen av CELEBREX (50 mg till 400 mg två gånger dagligen). Incidensen för naproxen 500 mg två gånger dagligen var 16,2 % och 17,6 % i de två studierna, för placebo var 2,0 % och 2,3 %, och för alla doser av CELEBREX varierade incidensen mellan 2,7 %–5,9 %. Det har inte gjorts några stora kliniska utfallsstudier för att jämföra kliniskt relevanta GI-utfall med CELEBREX och naproxen.
I de endoskopiska studierna tog cirka 11 % av patienterna aspirin (≤ 325 mg/dag). I CELEBREX-grupperna verkade frekvensen av endoskopiska sår vara högre hos aspirinanvändare än hos icke-användare. Den ökade frekvensen av sår hos dessa acetylsalicylsyraanvändare var dock mindre än de endoskopiska sårfrekvenserna som observerades i de aktiva jämförelsegrupperna, med eller utan aspirin.
PATIENTINFORMATION
Läkemedelsguide för icke-steroida antiinflammatoriska läkemedel (NSAID)
Vilken är den viktigaste informationen jag bör veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?
NSAID kan orsaka allvarliga biverkningar, inklusive:
- Ökad risk för hjärtinfarkt eller stroke som kan leda till döden. Denna risk kan inträffa tidigt i behandlingen och kan öka:
- med ökande doser av NSAID
- med längre användning av NSAID
Ta inte NSAID precis före eller efter en hjärtoperation som kallas "kransartär bypassgraft (CABG)." Undvik att ta NSAID efter en nyligen inträffad hjärtinfarkt, såvida inte din läkare säger åt dig att göra det. Du kan ha en ökad risk för en ny hjärtinfarkt om du tar NSAID-preparat efter en nyligen genomförd hjärtinfarkt.
- Ökad risk för blödningar, sår och revor (perforering) i matstrupen (slangen som leder från munnen till magen), magen och tarmarna:
- när som helst under användning
- utan varningssymtom
- som kan orsaka dödsfall
- Risken för att få ett sår eller blödning ökar med:
- tidigare anamnes på magsår, eller blödning från magen eller tarmen vid användning av NSAID
- tar läkemedel som kallas "kortikosteroider", "trombocythämmande läkemedel", "antikoagulantia", "SSRI" eller "SNRI"
- ökande doser av NSAID
- längre användning av NSAID
- rökning
- dricker alkohol
- äldre ålder
- dålig hälsa
- avancerad leversjukdom
- blödningsproblem
- NSAID bör endast användas:
- precis som föreskrivet
- vid lägsta möjliga dos för din behandling
- för den kortaste tiden som behövs
Vad är NSAID?
NSAID används för att behandla smärta och rodnad, svullnad och värme (inflammation) från medicinska tillstånd som olika typer av artrit, mensvärk och andra typer av kortvarig smärta.
Vem bör inte ta NSAID?
Ta inte NSAID:
- om du har haft en astmaanfall, nässelfeber eller annan allergisk reaktion med acetylsalicylsyra eller andra NSAID-preparat.
- precis före eller efter bypassoperation.
Innan du tar NSAID, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har lever- eller njurproblem
- har högt blodtryck
- har astma
- är gravid eller planerar att bli gravid. Om du tar NSAID vid ungefär 20 veckors graviditet eller senare kan det skada ditt ofödda barn. Om du behöver ta NSAID i mer än 2 dagar när du är mellan 20 och 30 veckor av graviditeten, kan din läkare behöva övervaka mängden vätska i livmodern runt ditt barn. Du ska inte ta NSAID efter cirka 30 veckors graviditet
- ammar eller planerar att amma.
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda eller receptfria läkemedel, vitaminer eller växtbaserade kosttillskott. NSAID och vissa andra läkemedel kan interagera med varandra och orsaka allvarliga biverkningar. Börja inte ta något nytt läkemedel utan att först prata med din läkare.
Vilka är de möjliga biverkningarna av NSAID?
NSAID kan orsaka allvarliga biverkningar, inklusive:
Se " Vilken är den viktigaste informationen jag bör veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?
- nytt eller värre högt blodtryck
- hjärtsvikt
- leverproblem inklusive leversvikt
- njurproblem inklusive njursvikt
- låga röda blodkroppar (anemi)
- livshotande hudreaktioner
- livshotande allergiska reaktioner
Andra biverkningar av NSAID inkluderar: magsmärtor, förstoppning, diarré, gaser, halsbränna, illamående, kräkningar och yrsel.
Få akut hjälp omedelbart om du får något av följande symtom:
- andnöd eller andningssvårigheter
- bröstsmärta
- svaghet i en del eller sida av din kropp
- sluddrigt tal
- svullnad i ansikte eller hals
Sluta ta ditt NSAID och ring din vårdgivare omedelbart om du får något av följande symtom:
- illamående
- tröttare eller svagare än vanligt
- diarre
- klåda
- din hud eller ögon ser gula ut
- matsmältningsbesvär eller magsmärtor
- influensaliknande symtom
- spy blod
- det finns blod i din tarmrörelse eller så är det svart och klibbigt som tjära
- ovanlig viktökning
- hudutslag eller blåsor med feber
- svullnad av armar, ben, händer och fötter
Om du tar för mycket av ditt NSAID, ring din vårdgivare eller få medicinsk hjälp omedelbart.
Dessa är inte alla möjliga biverkningar av NSAID. För mer information, fråga din vårdgivare eller apotekspersonal om NSAID.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Annan information om NSAID
- Aspirin är ett NSAID men det ökar inte risken för hjärtinfarkt. Aspirin kan orsaka blödningar i hjärnan, magen och tarmarna. Aspirin kan också orsaka sår i magen och tarmarna.
- Vissa NSAID-preparat säljs i lägre doser utan recept (receptfria). Prata med din vårdgivare innan du använder receptfria NSAIDs i mer än 10 dagar.
Allmän information om säker och effektiv användning av NSAID
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte NSAID för ett tillstånd som det inte ordinerats för. Ge inte NSAID till andra människor, även om de har samma symtom som du har. Det kan skada dem.
Om du vill ha mer information om NSAID, prata med din vårdgivare. Du kan fråga din apotekspersonal eller vårdgivare om information om NSAID som är skriven för vårdpersonal.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
