Maxalt 5mg, 10mg Rizatriptan Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Maxalt och hur används det?
Maxalt är ett receptbelagt läkemedel som används för att behandla symptomen på migränhuvudvärk. Maxalt 10mg kan användas ensamt eller tillsammans med andra läkemedel.
Maxalt tillhör en klass av läkemedel som kallas serotonin 5-HT-receptoragonister; Antimigränmedel.
Det är inte känt om Maxalt 5mg är säkert och effektivt för barn yngre än 6 år.
Vilka är de möjliga biverkningarna av Maxalt?
Maxalt kan orsaka allvarliga biverkningar inklusive:
- plötslig och svår magsmärta,
- blodig diarré,
- kall känsla,
- domningar i dina fötter och händer,
- svår huvudvärk,
- suddig syn,
- dunkar i nacken eller öronen,
- bröstsmärtor eller tryck,
- smärta sprider sig till din käke eller axel,
- illamående,
- svettas,
- agitation,
- hallucinationer,
- feber,
- huttrar,
- snabb puls,
- muskelstelhet,
- ryckningar,
- förlust av koordination,
- illamående,
- förlust av koordination,
- kräkningar,
- diarre,
- plötslig domningar eller svaghet (särskilt på ena sidan av kroppen),
- plötslig svår huvudvärk,
- sluddrigt tal, och
- problem med syn eller balans
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Maxalt inkluderar:
- yrsel,
- dåsighet,
- känner mig trött och
- smärta eller tryckkänsla i halsen eller bröstet
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Maxalt. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
MAXALT 10 mg innehåller rizatriptanbensoat, en selektiv 5-hydroxitryptamin1B/1D (5-HT1B/1D) receptoragonist.
Rizatriptanbensoat beskrivs kemiskt som: N,N-dimetyl-5-(1H-1,2,4-triazol-1-ylmetyl)-1Hindol-3-etanaminmonobensoat och dess strukturformel är:
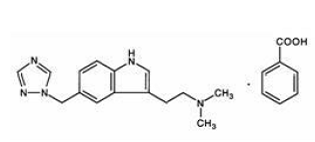
Dess empiriska formel är C15H19N5•C7H6O2, vilket representerar en molekylvikt för den fria basen på 269,4. Rizatriptanbensoat är ett vitt till benvitt, kristallint fast ämne som är lösligt i vatten vid cirka 42 mg per ml (uttryckt som fri bas) vid 25°C.
MAXALT 5 mg tabletter och MAXALT-MLT oralt sönderfallande tabletter finns tillgängliga för oral administrering i styrkorna 5 och 10 mg (motsvarande 7,265 mg respektive 14,53 mg av bensoatsaltet). Varje komprimerad tablett innehåller följande inaktiva ingredienser: laktosmonohydrat, mikrokristallin cellulosa, förgelatinerad stärkelse, järnoxid (röd) och magnesiumstearat. Varje lyofiliserad oralt sönderfallande tablett innehåller följande inaktiva ingredienser: gelatin, mannitol, glycin, aspartam och pepparmintsmak.
INDIKATIONER
MAXALT® och MAXALT-MLT® är indicerade för akut behandling av migrän med eller utan aura hos vuxna och pediatriska patienter 6 till 17 år gamla.
Användningsbegränsningar
- MAXALT ska endast användas om en klar diagnos av migrän har fastställts. Om en patient inte har något svar på den första migränattacken som behandlas med MAXALT 10 mg, bör diagnosen migrän omprövas innan MAXALT 5 mg administreras för att behandla efterföljande attacker.
- MAXALT 10mg är inte indicerat för behandling av hemiplegisk eller basilär migrän [se KONTRAINDIKATIONER ].
- MAXALT 10mg är inte indicerat för att förebygga migränattacker.
- Säkerhet och effektivitet för MAXALT 5 mg har inte fastställts för klusterhuvudvärk.
DOSERING OCH ADMINISTRERING
Doseringsinformation hos vuxna
Den rekommenderade startdosen av MAXALT är antingen 5 mg eller 10 mg för akut behandling av migrän hos vuxna. Dosen på 10 mg kan ge en större effekt än dosen på 5 mg, men kan ha en större risk för biverkningar [se Kliniska studier ].
Omdosering hos vuxna
Även om effektiviteten av en andra dos eller efterföljande doser inte har fastställts i placebokontrollerade studier, om migränhuvudvärken återkommer, kan en andra dos ges 2 timmar efter den första dosen. Den maximala dagliga dosen bör inte överstiga 30 mg under någon 24-timmarsperiod. Säkerheten för att behandla i genomsnitt mer än fyra huvudvärk under en 30-dagarsperiod har inte fastställts.
Doseringsinformation hos pediatriska patienter (ålder 6 till 17 år)
Dosering till pediatriska patienter baseras på patientens kroppsvikt. Den rekommenderade dosen av MAXALT 10 mg är 5 mg för patienter som väger mindre än 40 kg (88 lb) och 10 mg för patienter som väger 40 kg (88 lb) eller mer.
Effekten och säkerheten av behandling med mer än en dos av MAXALT inom 24 timmar hos pediatriska patienter i åldern 6 till 17 år har inte fastställts.
Administrering av MAXALT-MLT oralt sönderfallande tabletter
För MAXALT-MLT oralt desintegrerande tabletter är administrering med vätska inte nödvändig. Oralt sönderfallande tabletter är förpackade i en blisterförpackning i en yttre aluminiumpåse och patienter ska inte ta bort blisterförpackningen från den yttre påsen förrän strax före dosering. Blisterförpackningen ska sedan öppnas med torra händer och den oralt sönderfallande tabletten placeras på tungan, där den löses upp och sväljs med saliven.
Dosjustering för patienter på propranolol
Vuxna patienter
Till vuxna patienter som tar propranolol rekommenderas endast 5 mg dosen av MAXALT 5 mg, upp till maximalt 3 doser under en 24-timmarsperiod (15 mg) [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Pediatriska patienter
För pediatriska patienter som väger 40 kg (88 lb) eller mer, som tar propranolol, rekommenderas endast en engångsdos på 5 mg MAXALT (maximal dos på 5 mg under en 24-timmarsperiod). MAXALT ska inte förskrivas till propranololbehandlade pediatriska patienter som väger mindre än 40 kg (88 lb) [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
MAXALT tabletter
- mg tabletter är ljusrosa, kapselformade, komprimerade tabletter märkta MRK på ena sidan och 266 på den andra.
- 10 mg tabletter är ljusrosa, kapselformade, komprimerade tabletter märkta MAXALT 5 mg på ena sidan och MRK 267 på den andra.
MAXALT-MLT oralt sönderfallande tabletter
- 5 mg oralt sönderfallande tabletter är vita till benvita, runda lyofiliserade tabletter präglade med en modifierad triangel på ena sidan.
- 10 mg oralt sönderfallande tabletter är vita till benvita, runda lyofiliserade tabletter präglade med en modifierad fyrkant på ena sidan.
Förvaring Och Hantering
nr 3732 - MAXALT Tabletter, 5 mg , är ljusrosa, kapselformade, komprimerade tabletter kodade
MRK på ena sidan och 266 på den andra:
NDC 0006-0266-18, kartong med 18 tabletter.
nr 3733 - MAXALT 5mg tabletter, 10 mg , är ljusrosa, kapselformade, komprimerade tabletter kodade MAXALT 10mg på ena sidan och MRK 267 på den andra:
NDC 0006-0267-18, kartong med 18 tabletter.
nr 3800 - MAXALT-MLT oralt sönderfallande tabletter, 5 mg är vita till benvita, runda lyofiliserade oralt sönderfallande tabletter präglade med en modifierad triangel på ena sidan och mäter 10,0-11,5 mm (sida-till-sida) med pepparmintsmak. Varje oralt sönderfallande tablett är individuellt förpackad i en blisterförpackning inuti en aluminiumpåse (påse). De levereras enligt följande:
NDC 0006-3800-18, 6 x användningsenhetsväska med 3 oralt sönderfallande tabletter (totalt 18 tabletter).
nr 3801 - MAXALT-MLT oralt sönderfallande tabletter, 10 mg , är vita till benvita, runda lyofiliserade oralt sönderfallande tabletter präglade med en modifierad fyrkant på ena sidan och mäter 12,0-13,8 mm (sida-till-sida) med pepparmintsmak. Varje oralt sönderfallande tablett är individuellt förpackad i en blisterförpackning inuti en aluminiumpåse (påse). De levereras enligt följande:
NDC 0006-3801-18, 6 x användningsenhetsväska med 3 oralt sönderfallande tabletter (totalt 18 tabletter).
Lagring
Förvara MAXALT 5mg tabletter i rumstemperatur, 15°C-30°C (59°F-86°F).
Förvara MAXALT-MLT oralt desintegrerande tabletter i rumstemperatur, 15°C-30°C (59°F-86°F).
Distribueras av: Merck Sharp & Dohme Corp., ett dotterbolag till MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Reviderad: oktober 2019
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Myokardischemi, hjärtinfarkt och Prinzmetals kärlkramp [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Arytmier [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Bröst-, hals-, nacke- och/eller käksmärta/täthet/tryck [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Cerebrovaskulära händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Andra vasospasmreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Överanvändning av läkemedel Huvudvärk [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Serotoninsyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Ökning av blodtrycket [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Erfarenhet av kliniska prövningar
Eftersom kliniska studier utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska studierna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska studierna av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Vuxna
Incidens i kontrollerade kliniska prövningar
Biverkningar av MAXALT utvärderades i kontrollerade kliniska prövningar som inkluderade över 3700 vuxna patienter som fick enstaka eller flera doser av MAXALT tabletter. De vanligaste biverkningarna under behandling med MAXALT (≥5 % i båda behandlingsgrupperna och fler än placebo) var asteni/trötthet, somnolens, smärta/tryckskänsla och yrsel. Dessa biverkningar verkade vara dosrelaterade.
Tabell 1 listar biverkningarna (incidens ≥2 % och högre än placebo) efter en engångsdos av MAXALT 5 mg hos vuxna.
Frekvensen av biverkningar i kliniska prövningar ökade inte när upp till tre doser togs inom 24 timmar. Biverkningsfrekvensen var också oförändrad vid samtidig användning av läkemedel som vanligtvis tas för migränprofylax (inklusive propranolol), p-piller eller smärtstillande medel. Incidensen av biverkningar påverkades inte av ålder eller kön. Det fanns otillräckliga data för att bedöma effekten av ras på förekomsten av biverkningar.
Andra händelser som observerats i samband med administrationen av MAXALT hos vuxna
följande avsnitt presenteras frekvenser av mindre vanliga rapporterade biverkningar som inte rapporterades i andra avsnitt av märkningen. Eftersom rapporterna inkluderar händelser som observerats i öppna studier, kan MAXALT 5 mgs roll i deras orsakssamband inte fastställas tillförlitligt. Dessutom begränsar variabiliteten i samband med rapportering av biverkningar, den terminologi som används för att beskriva biverkningar, värdet på de kvantitativa frekvensuppskattningarna som tillhandahålls. Händelsefrekvenser beräknas som antalet patienter som använde MAXALT och rapporterade en händelse dividerat med det totala antalet patienter som exponerats för MAXALT (N=3716). Alla rapporterade händelser inträffade med en incidens ≥1 %, eller tros vara rimligt associerade med användningen av läkemedlet. Händelser klassificeras vidare inom kroppssystemkategorier och räknas upp i ordning efter minskande frekvens med hjälp av följande definitioner: frekventa biverkningar är de som definieras som de som inträffar hos minst (>)1/100 patienter; sällsynta biverkningar är de som inträffar hos 1/100 till 1/1000 patienter; och sällsynta biverkningar är de som förekommer hos färre än 1/1000 patienter.
Allmän: Sällsynt var ansiktsödem. Sällsynta var synkope och ödem/svullnad.
Atypiska förnimmelser: Varma förnimmelser var ofta.
Kardiovaskulär: Vanligt förekom hjärtklappning. Sällsynta var takykardi, kalla extremiteter och bradykardi.
Matsmältningskanalen: Ofta förekom diarré och kräkningar. Sällsynt förekom dyspepsi, tungödem och utspänd buk.
Muskuloskeletala: Sällan förekom muskelsvaghet, stelhet, myalgi och muskelkramper/spasmer.
Neurologisk/psykiatrisk: Vanliga var hypoestesi, eufori och tremor. Sällsynta var svindel, sömnlöshet, förvirring/desorientering, onormal gång, minnesförsämring och agitation.
Andningsvägar: Ofta var dyspné. Sällsynt var farynxödem.
Särskilda sinnen: Sällan förekom dimsyn och tinnitus. Sällsynt var ögonsvullnad.
Hud och hudbihang: Frekvent var rodnad. Sällan förekom svettning, klåda, utslag och nässelutslag. Sällsynt var erytem, värmevallningar.
Biverkningsprofilen som sågs med MAXALT-MLT oralt sönderfallande tabletter liknade den som sågs med MAXALT 10 mg tabletter.
Pediatriska patienter 6 till 17 års ålder
Incidens i kontrollerade kliniska prövningar hos pediatriska patienter
Biverkningar av MAXALT-MLT utvärderades i en kontrollerad klinisk prövning i akut behandling av migrän (studie 7) som omfattade totalt 1382 pediatriska patienter i åldern 6-17 år, av vilka 977 (72%) administrerade minst en dos av studiebehandling (MAXALT-MLT och/eller placebo) [se Kliniska studier ]. Incidensen av biverkningar som rapporterats för pediatriska patienter i den akuta kliniska prövningen var liknande hos patienter som fick MAXALT som de som fick placebo. Biverkningsmönstret hos pediatriska patienter förväntas vara liknande det hos vuxna.
Andra händelser som observerats i samband med administrering av MAXALT-MLT hos pediatriska patienter
följande avsnitt presenteras frekvensen av mindre vanliga rapporterade biverkningar. Eftersom rapporterna inkluderar händelser som observerats i öppna studier, kan MAXALT-MLT:s roll i deras orsakssamband inte fastställas tillförlitligt. Dessutom begränsar variabiliteten i samband med rapportering av biverkningar, den terminologi som används för att beskriva biverkningar, värdet på de kvantitativa frekvensuppskattningarna som tillhandahålls.
Händelsefrekvenser beräknas som antalet pediatriska patienter i åldern 6 till 17 år som använde MAXALT-MLT och rapporterade en händelse dividerat med det totala antalet patienter som exponerats för MAXALT-MLT (N=1068). Alla rapporterade händelser inträffade med en incidens ≥1 %, eller tros vara rimligt associerade med användningen av läkemedlet. Händelser klassificeras vidare inom systemorganklass och räknas upp i ordning efter minskande frekvens med hjälp av följande definitioner: frekventa biverkningar är de som inträffar hos (>)1/100 pediatriska patienter; sällsynta biverkningar är de som inträffar hos 1/100 till 1/1000 pediatriska patienter; och sällsynta biverkningar är de som förekommer hos färre än 1/1000 patienter.
Allmän: Ofta var trötthet.
Öron- och labyrintsjukdomar: Sällsynt var hypoakusis.
Gastrointestinala störningar: Ofta var bukbesvär.
Störningar i nervsystemet: Sällsynta var onormal koordination, störning i uppmärksamhet och presynkope.
Psykiatriska störningar: Sällsynt var hallucinationer.
Erfarenhet efter marknadsföring
Följande avsnitt räknar upp potentiellt viktiga biverkningar som har inträffat i klinisk praxis och som har rapporterats spontant till olika övervakningssystem. De uppräknade händelserna inkluderar alla utom de som redan är listade i andra avsnitt av märkningen eller de som är för allmänna för att vara informativa. Eftersom rapporterna citerar händelser som rapporterats spontant från världsomspännande erfarenheter efter marknadsföring, kan frekvensen av händelser och rollen av MAXALT 5 mg i deras orsakssamband inte fastställas tillförlitligt.
Neurologisk/psykiatrisk: Beslag.
Allmän: Allergiska tillstånd inklusive anafylaxi/anafylaktoid reaktion, angioödem, väsande andning och toxisk epidermal nekrolys [se KONTRAINDIKATIONER ].
Särskilda sinnen: Dysgeusi.
LÄKEMEDELSINTERAKTIONER
Propranolol
Dosen av MAXALT 5 mg bör justeras hos propranololbehandlade patienter, eftersom propranolol har visats öka plasma-AUC för rizatriptan med 70 % [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
Ergotinnehållande droger
Ergotinnehållande läkemedel har rapporterats orsaka förlängda vasospastiska reaktioner. Eftersom dessa effekter kan vara additiva, är användning av läkemedel som innehåller ergotamin eller ergottyp (som dihydroergotamin eller metysergid) och MAXALT 5 mg inom 24 timmar kontraindicerat [se KONTRAINDIKATIONER ].
Andra 5-HT1-agonister
Eftersom deras vasospastiska effekter kan vara additiv, är samtidig administrering av MAXALT 10 mg och andra 5-HT1-agonister inom 24 timmar efter varandra kontraindicerat [se KONTRAINDIKATIONER ].
SSRI/SNRI och serotonergt syndrom
Fall av serotonergt syndrom har rapporterats vid samtidig administrering av triptaner och selektiva serotoninåterupptagshämmare (SSRI) eller serotonin noradrenalin återupptagshämmare (SNRI) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Monoaminoxidashämmare
MAXALT är kontraindicerat hos patienter som tar MAO-A-hämmare och icke-selektiva MAO-hämmare. En specifik MAO-A-hämmare ökade den systemiska exponeringen av rizatriptan och dess metabolit [se KONTRAINDIKATIONER och KLINISK FARMAKOLOGI ].
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Myokardischemi, hjärtinfarkt och Prinzmetals kärlkramp
MAXALT ska inte ges till patienter med ischemisk eller vasospastisk kranskärlssjukdom. Det har förekommit sällsynta rapporter om allvarliga hjärtbiverkningar, inklusive akut hjärtinfarkt, som inträffat inom några timmar efter administrering av MAXALT. Vissa av dessa reaktioner inträffade hos patienter utan känd kranskärlssjukdom (CAD). 5-HT1-agonister, inklusive MAXALT 5mg, kan orsaka kranskärlskärlspasm (Prinzmetals kärlkramp), även hos patienter utan en historia av CAD.
Triptannaiva patienter som har flera kardiovaskulära riskfaktorer (t.ex. ökad ålder, diabetes, högt blodtryck, rökning, fetma, stark familjehistoria av CAD) bör genomgå en kardiovaskulär utvärdering innan de får MAXALT. Om det finns tecken på CAD eller kranskärlspasm, ska MAXALT inte administreras [se KONTRAINDIKATIONER ]. För patienter som har en negativ kardiovaskulär utvärdering bör administrering av den första MAXALT-dosen övervägas i en medicinskt övervakad miljö och att utföra ett elektrokardiogram (EKG) omedelbart efter administrering av MAXALT 10 mg. Periodisk kardiovaskulär utvärdering bör övervägas hos intermittenta långtidsanvändare av MAXALT som har kardiovaskulära riskfaktorer.
Arytmier
Livshotande störningar av hjärtrytmen, inklusive ventrikulär takykardi och ventrikelflimmer som leder till döden, har rapporterats inom några timmar efter administrering av 5-HT1-agonister. Avbryt behandlingen med MAXALT 10 mg om dessa störningar uppstår.
Bröst-, hals-, nacke- och/eller käksmärta/täthet/tryck
Liksom med andra 5-HT1-agonister uppträder känslan av täthet, smärta, tryck och tyngd i precordium, hals, nacke och käke ofta efter behandling med MAXALT 5 mg och är vanligtvis icke-hjärtat. Om man misstänker ett hjärtursprung bör patienterna dock utvärderas. Patienter som visat sig ha CAD och de med Prinzmetals variant angina bör inte få 5-HT1-agonister.
Cerebrovaskulära händelser
Cerebral blödning, subaraknoidal blödning och stroke har förekommit hos patienter som behandlats med 5-HT1-agonister, och vissa har resulterat i dödsfall. I ett antal fall verkar det vara möjligt att de cerebrovaskulära händelserna var primära, eftersom 5-HT1-agonisten hade administrerats i den felaktiga tron att de upplevda symtomen var en följd av migrän, när de inte var det. Patienter med migrän kan också löpa ökad risk för vissa cerebrovaskulära händelser (t.ex. stroke, blödning, övergående ischemisk attack). Avbryt behandlingen med MAXALT om en cerebrovaskulär händelse inträffar.
Som med andra akuta migränterapier bör man vara försiktig för att utesluta andra potentiellt allvarliga neurologiska tillstånd innan huvudvärk behandlas hos patienter som inte tidigare diagnostiserats som migränpatienter och hos migränpatienter som uppvisar atypiska symtom. MAXALT ska inte ges till patienter med stroke eller övergående ischemisk attack i anamnesen [se KONTRAINDIKATIONER ].
Andra vasospasmreaktioner
5-HT1-agonister, inklusive MAXALT, kan orsaka icke-koronära vasospastiska reaktioner, såsom perifer vaskulär ischemi, gastrointestinal vaskulär ischemi och infarkt (med buksmärtor och blodig diarré), mjältinfarkt och Raynauds syndrom. Hos patienter som upplever symtom eller tecken som tyder på icke-koronar vasospasmreaktion efter användning av någon 5-HT1-agonist, bör den misstänkta vasospasmreaktionen uteslutas innan de får ytterligare MAXALT 10 mg doser.
Rapporter om övergående och permanent blindhet och betydande partiell synförlust har rapporterats vid användning av 5-HT1-agonister. Eftersom synstörningar kan vara en del av en migränattack, har ett orsakssamband mellan dessa händelser och användningen av 5-HT1-agonister inte klarlagts.
Överanvändning av mediciner Huvudvärk
Överanvändning av akuta migränläkemedel (t.ex. ergotamin, triptaner, opioider eller en kombination av läkemedel i 10 eller fler dagar per månad) kan leda till förvärring av huvudvärk (huvudvärk för överanvändning av läkemedel). Överanvändningshuvudvärk kan visa sig som migränliknande daglig huvudvärk, eller som en markant ökning av frekvensen av migränattacker. Avgiftning av patienter, inklusive utsättande av de överanvända läkemedlen, och behandling av abstinensbesvär (vilket ofta inkluderar en övergående försämring av huvudvärk) kan vara nödvändiga.
Serotonin syndrom
Serotonergt syndrom kan förekomma med triptaner, inklusive MAXALT 10 mg, särskilt vid samtidig administrering med selektiva serotoninåterupptagshämmare (SSRI), serotonin noradrenalin återupptagshämmare (SNRI), tricykliska antidepressiva medel (TCA) och MAO-hämmare [se LÄKEMEDELSINTERAKTIONER ]. Symtom på serotonergt syndrom kan innefatta förändringar i mental status (t.ex. agitation, hallucinationer, koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, hypertermi), neuromuskulära avvikelser (t.ex. hyperreflexi, inkoordination) och/eller gastrointestinala symtom (t.ex. illamående) , kräkningar, diarré). Uppkomsten av symtom kan inträffa inom några minuter till timmar efter att man fått en ny eller en större dos av en serotonerg medicin. Behandling med MAXALT ska avbrytas om man misstänker serotonergt syndrom [se LÄKEMEDELSINTERAKTIONER och PATIENTINFORMATION ].
Ökning av blodtrycket
Signifikant förhöjt blodtryck, inklusive hypertensiv kris med akut försämring av organsystem, har rapporterats i sällsynta fall hos patienter med och utan tidigare hypertoni som fått 5-HT1-agonister, inklusive MAXALT. Hos friska unga vuxna manliga och kvinnliga patienter som fick maximala doser av MAXALT (10 mg varannan timme för 3 doser), observerades lätt blodtryckshöjning (cirka 2-3 mmHg). MAXALT är kontraindicerat hos patienter med okontrollerad hypertoni [se KONTRAINDIKATIONER ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION ).
Risk för myokardischemi och/eller infarkt, Prinzmetals kärlkramp, andra vasospasmrelaterade händelser och cerebrovaskulära händelser
Informera patienterna om att MAXALT kan orsaka allvarliga kardiovaskulära biverkningar såsom hjärtinfarkt eller stroke. Även om allvarliga kardiovaskulära händelser kan inträffa utan varningssymtom, bör patienter vara uppmärksamma på tecken och symtom på bröstsmärtor, andnöd, svaghet, sluddrigt tal och bör be om medicinsk rådgivning när de observerar några indikativa tecken eller symtom. Patienterna bör informeras om vikten av denna uppföljning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Serotonin syndrom
Patienter bör varnas för risken för serotonergt syndrom vid användning av MAXALT 10 mg eller andra triptaner, särskilt vid kombinerad användning med selektiva serotoninåterupptagshämmare (SSRI) eller serotonin noradrenalin återupptagshämmare (SNRI) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER , och KLINISK FARMAKOLOGI ].
Graviditet
Informera patienterna om att MAXALT inte ska användas under graviditet om inte den potentiella nyttan motiverar den potentiella risken för fostret [se Användning i specifika populationer ].
Laktation
Råda patienter att meddela sin vårdgivare om de ammar eller planerar att amma [se Användning i specifika populationer ].
Förmåga att utföra komplexa uppgifter
Eftersom migrän eller behandling med MAXALT 10 mg kan orsaka somnolens och yrsel, instruera patienterna att utvärdera deras förmåga att utföra komplexa uppgifter under migränattacker och efter administrering av MAXALT.
Överanvändning av mediciner Huvudvärk
Informera patienter om att användning av akuta migränläkemedel i 10 eller fler dagar per månad kan leda till en förvärring av huvudvärk och uppmuntra patienterna att registrera huvudvärkfrekvens och droganvändning (t.ex. genom att föra huvudvärksdagbok) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hantering av oralt sönderfallande tablettpaket
Instruera patienterna att inte ta bort blistern från den yttre aluminiumpåsen förrän de är redo att använda den oralt sönderfallande tabletten inuti [se DOSERING OCH ADMINISTRERING ].
Patienter med fenylketonuri
Informera patienter med fenylketonuri att MAXALT-MLT oralt sönderfallande tabletter innehåller fenylalanin (en komponent i aspartam). Varje 5 mg oralt sönderfallande tablett innehåller 1,1 mg fenylalanin och varje 10 mg oralt sönderfallande tablett innehåller 2,1 mg fenylalanin [se Användning i specifika populationer ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Orala karcinogenicitetsstudier av rizatriptan utfördes på möss (100 veckor) och råttor (106 veckor) i doser på upp till 125 mg/kg/dag. Det fanns inga tecken på en ökning av tumörincidensen relaterad till rizatriptan hos någon av arterna. Plasmaexponeringen (AUC) vid den högsta testade dosen var cirka 150 (möss) och 240 gånger (råttor) den hos människor vid den maximala rekommenderade humandosen (MRHD) på 30 mg/dag.
Mutagenes
Rizatriptan var varken mutagent eller klastogent i en rad genetiska toxicitetsstudier in vitro och in vivo, inklusive: mikrobiell mutagenes (Ames) analys, in vitro analys av däggdjurscellmutagenes och kromosomavvikelser, och in vivo analys av kromosomavvikelser på mus.
Nedsättning av fertilitet
Oral administrering av rizatriptan (0, 2, 10 eller 100 mg/kg/dag) till honråttor före och under parning och under hela dräktigheten och laktationen resulterade inte i någon effekt på fertiliteten; dock observerades förändrad brunstcyklicitet och förseningar i tid till parning vid den högsta testade dosen. Plasmaexponeringen vid dosen utan effekt (10 mg/kg/dag) för reproduktionstoxicitet var cirka 15 gånger den hos människor vid MRHD.
Oral administrering av rizatriptan (0, 5, 35 eller 250 mg/kg/dag) till hanråttor före och under parning resulterade inte i någon försämring av fertiliteten eller reproduktionsförmågan. Plasmaexponeringen (AUC) vid den högsta testade dosen var cirka 550 gånger den hos människor vid MRHD.
Användning i specifika populationer
Graviditet
Risksammanfattning
Tillgängliga humandata om användning av MAXALT hos gravida kvinnor är inte tillräckliga för att dra slutsatser om läkemedelsrelaterade risker för allvarliga fosterskador och missfall.
djurstudier observerades utvecklingstoxicitet efter oral administrering av rizatriptan under graviditet (minskad fostrets kroppsvikt hos råttor) eller under hela graviditeten och laktationen (ökad mortalitet, minskad kroppsvikt och nedsatt neurobeteende hos råttavkommor) vid moderns plasmaexponeringar som är större än förväntas vid terapeutiska doser hos människor [se Djurdata ].
I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och för missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %. Den rapporterade frekvensen av större fosterskador bland förlossningar till kvinnor med migrän varierar från 2,2 % till 2,9 % och den rapporterade frekvensen av missfall var 17 %, vilket liknar frekvensen som rapporterats hos kvinnor utan migrän.
Kliniska överväganden
Sjukdomsrelaterad risk för mödrar och/eller embryo/foster
Hos kvinnor med migrän finns det en ökad risk för ogynnsamma perinatala utfall hos modern, inklusive havandeskapsförgiftning och graviditetshypertoni.
Data
Mänskliga data
Graviditetsregistret för MAXALT identifierade inte något mönster av medfödda anomalier eller andra negativa födelseresultat under perioden 1998 till 2018. Bristen på identifiering av något mönster bör dock ses med försiktighet, eftersom antalet prospektiva rapporter med resultatinformation var låg och gav inte tillräcklig kraft för att upptäcka en ökad risk för individuella fosterskador i samband med användningen av MAXALT. Dessutom fanns det betydande förluster av uppföljning i de framtida graviditetsrapporterna, vilket ytterligare komplicerade denna bedömning av ett samband mellan MAXALT och alla mönster av medfödda anomalier eller andra ogynnsamma födelseresultat.
en studie med data från Svenska medicinska födelseregistret jämfördes levande födslar till kvinnor som rapporterade att de använt triptaner eller ergoter under graviditeten med kvinnor som inte gjorde det. Av de 157 förlossningarna med exponering för rizatriptan under första trimestern föddes 7 spädbarn med missbildningar (relativ risk 1,01 [95 % KI: 0,40 till 2,08]). En studie som använder länkade data från Medical Birth Registry of Norway till den norska receptdatabasen jämförde graviditetsresultat hos kvinnor som löste in recept på triptaner under graviditeten, såväl som en jämförelsegrupp för migränsjukdomar som löste in recept på triptaner endast före graviditeten, jämfört med en befolkningskontrollgrupp. Av de 310 kvinnor som löste in recept på rizatriptan under första trimestern hade 10 spädbarn med allvarliga medfödda missbildningar (OR 1,03 [95 % KI: 0,55 till 1,93]), medan för de 271 kvinnor som löste in recept på rizatriptan före, men inte under , graviditet, hade 12 spädbarn med allvarliga medfödda missbildningar (OR 1,48 [95 % KI: 0,83 till 2,64]), var och en jämfört med populationsjämförelsegruppen.
Djurdata
När rizatriptan (0, 2, 10 eller 100 mg/kg/dag) administrerades oralt till dräktiga råttor under hela organogenesen, observerades en minskning av fostrets kroppsvikt vid de högsta testade doserna. Vid mellandosen (10 mg/kg/dag), som var en dos utan effekt för biverkningar på embryofetal utveckling, var plasmaexponeringen (AUC) cirka 15 gånger högre än hos människor vid den maximala rekommenderade humandosen (MRHD) på 30 mg/dag. När rizatriptan (0, 5, 10 eller 50 mg/kg/dag) administrerades oralt till dräktiga kaniner under hela organogenesen observerades inga negativa fostereffekter. Plasmaexponeringen (AUC) vid den högsta testade dosen var 115 gånger den hos människor vid MRHD. Placenta överföring av läkemedel till fostret påvisades hos båda arterna.
Oral administrering av rizatriptan (0, 2, 10 eller 100 mg/kg/dag) till honråttor före och under parning och fortsättning under hela dräktigheten och laktationen resulterade i minskad kroppsvikt hos avkomma från födseln och under hela laktationen överhuvudtaget utom den lägsta dostestad (2 mg/kg/dag). Plasmaexponering (AUC) vid dosen utan effekt (2 mg/kg/dag) för biverkningar på postnatal utveckling liknade den hos människor vid MRHD.
Oral administrering av rizatriptan (0, 5, 100 eller 250 mg/kg/dag) under hela organogenesen och laktationen resulterade i neonatal dödlighet, minskad kroppsvikt (som kvarstod i vuxen ålder) och försämrad neurobeteendefunktion hos avkomman överhuvudtaget utom den lägsta dosen testat. Plasmaexponeringen (AUC) vid dosen utan effekt för biverkningar på postnatal utveckling (5 mg/kg/dag) var cirka 8 gånger den hos människor vid MRHD.
Laktation
Risksammanfattning
Det finns inga data om förekomsten av rizatriptan eller några aktiva metaboliter i bröstmjölk, eller om effekterna av rizatriptan på det ammade barnet eller på mjölkproduktionen.
Rizatriptan utsöndrades i råttmjölk, med nivåer i mjölk ungefär 6 gånger högre än i moderns plasma.
Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av MAXALT eller MAXALT-MLT och eventuella negativa effekter på det ammade barnet från MAXALT eller MAXALT-MLT eller från det underliggande moderns tillståndet.
Data
Efter oral administrering av rizatriptan till lakterande råttor i en dos av 100 mg/kg/dag översteg läkemedelskoncentrationerna av rizatriptan i mjölkprover maternal plasmakoncentration av läkemedel med ungefär 6 gånger.
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter under 6 år har inte fastställts. Effekten och säkerheten av MAXALT 5 mg vid akut behandling av migrän hos patienter i åldern 6 till 17 år fastställdes i en adekvat och välkontrollerad studie [se Kliniska studier ].
Incidensen av biverkningar som rapporterades för pediatriska patienter i den akuta kliniska prövningen var liknande hos patienter som fick MAXALT 5 mg som de som fick placebo. Biverkningsmönstret hos pediatriska patienter förväntas vara liknande det hos vuxna.
Geriatrisk användning
Kliniska studier av MAXALT 5 mg inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter.
Även om farmakokinetiken för rizatriptan var likartad hos äldre (ålder ≥65 år) och hos yngre vuxna (n=17), bör dosval för äldre patienter i allmänhet vara försiktigt, med början i den nedre delen av dosintervallet. Detta återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
Geriatriska patienter som har andra kardiovaskulära riskfaktorer (t.ex. diabetes, högt blodtryck, rökning, fetma, stark familjehistoria av kranskärlssjukdom) bör genomgå en kardiovaskulär utvärdering innan de får MAXALT [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Patienter med fenylketonuri
Oralt sönderfallande tabletter innehåller fenylalanin (en komponent i aspartam). De oralt sönderfallande tabletterna på 5 och 10 mg innehåller 1,1 respektive 2,1 mg fenylalanin.
ÖVERDOS
Inga överdoser av MAXALT rapporterades under kliniska prövningar på vuxna.
Vissa vuxna patienter som fick 40 mg MAXALT 5 mg antingen en engångsdos eller som två doser med ett 2-timmars mellandosintervall hade yrsel och somnolens.
I en klinisk farmakologisk studie där 12 vuxna försökspersoner fick MAXALT 5 mg, i totala kumulativa doser på 80 mg (givna inom fyra timmar), upplevde två av försökspersonerna synkope, yrsel, bradykardi inklusive tredje gradens AV-block, kräkningar och/eller inkontinens .
I den öppna långtidsstudien, som involverade 606 behandlade pediatriska migränpatienter i åldern 12 till 17 år (varav 432 behandlades i minst 12 månader), tog 151 patienter (25 %) två 10 mg doser av MAXALT-MLT inom en 24-timmarsperiod. Biverkningar för 3 av dessa patienter inkluderade obehag i buken, trötthet och dyspné.
Baserat på farmakologin för MAXALT 10 mg kan dessutom hypertoni eller myokardischemi inträffa efter överdosering. Gastrointestinal dekontaminering (dvs magsköljning följt av aktivt kol) bör övervägas hos patienter som misstänks för en överdos med MAXALT. Klinisk och elektrokardiografisk övervakning bör fortsätta i minst 12 timmar, även om kliniska symtom inte observeras.
Effekterna av hemo- eller peritonealdialys på serumkoncentrationer av rizatriptan är okända.
KONTRAINDIKATIONER
MAXALT 5mg är kontraindicerat för patienter med:
- Ischemisk kranskärlssjukdom (angina pectoris, historia av hjärtinfarkt eller dokumenterad tyst ischemi), eller annan betydande underliggande hjärt-kärlsjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Kranskärlspasm inklusive Prinzmetals angina [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Anamnes med stroke eller övergående ischemisk attack (TIA) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Perifer kärlsjukdom (PVD) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Ischemisk tarmsjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Okontrollerad hypertoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Nylig användning (dvs. inom 24 timmar) av en annan 5-HT1-agonist, läkemedel som innehåller ergotamin eller läkemedel av ergottyp (som dihydroergotamin eller metysergid) [se LÄKEMEDELSINTERAKTIONER ].
- Hemiplegisk eller basilär migrän [se INDIKATIONER ].
- Samtidig administrering eller nyligen avbruten behandling (dvs. inom 2 veckor) av en MAO-A-hämmare [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
- Överkänslighet mot rizatriptan eller något av hjälpämnena (angioödem och anafylaxi) [se NEGATIVA REAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Rizatriptan binder med hög affinitet till humana klonade 5-HT1B/1D-receptorer. MAXALT 10mg utövar förmodligen sin terapeutiska effekt vid behandling av migränhuvudvärk genom att binda till 5-HT1B/1D-receptorer som finns på intrakraniella blodkärl och sensoriska nerver i trigeminussystemet.
Farmakokinetik
Absorption
Rizatriptan absorberas fullständigt efter oral administrering. Den genomsnittliga orala absoluta biotillgängligheten för MAXALT 10 mg tablett är cirka 45 %, och genomsnittliga maximala plasmakoncentrationer (Cmax) nås inom cirka 1-1,5 timmar (Tmax). Förekomsten av migränhuvudvärk verkade inte påverka absorptionen eller farmakokinetiken för rizatriptan. Mat har ingen signifikant effekt på biotillgängligheten av rizatriptan men fördröjer tiden för att nå maximal koncentration med en timme. I kliniska prövningar administrerades MAXALT 10 mg utan hänsyn till mat.
Biotillgängligheten och Cmax för rizatriptan var liknande efter administrering av MAXALT-tabletter och MAXALT-MLT oralt sönderfallande tabletter, men absorptionshastigheten är något långsammare med MAXALT-MLT, med Tmax försenat med upp till 0,7 timmar. AUC för rizatriptan är cirka 30 % högre hos kvinnor än hos män. Ingen ackumulering inträffade vid upprepad dosering.
Distribution
Den genomsnittliga distributionsvolymen är cirka 140 liter hos manliga försökspersoner och 110 liter hos kvinnor. Rizatriptan är minimalt bundet (14%) till plasmaproteiner.
Ämnesomsättning
Den primära vägen för rizatriptanmetabolism är via oxidativ deaminering av monoaminoxidas-A (MAO-A) till indolättiksyrametaboliten, som inte är aktiv vid 5-HT1B/1D-receptorn. N-monodesmetyl-rizatriptan, en metabolit med aktivitet liknande den hos moderföreningen vid 5-HT1B/1D-receptorn, bildas i mindre grad. Plasmakoncentrationer av N-monodesmetyl-rizatriptan är cirka 14 % av modersubstansens koncentrationer, och det elimineras i liknande hastighet. Andra mindre metaboliter, N-oxiden, 6-hydroxiföreningen och sulfatkonjugatet av 6-hydroximetaboliten är inte aktiva vid 5-HT1B/1D-receptorn.
Eliminering
Den totala radioaktiviteten av den administrerade dosen som återfanns under 120 timmar i urin och avföring var 82 % respektive 12 %, efter en enstaka 10 mg oral administrering av 14C-rizatriptan. Efter oral administrering av 14C-rizatriptan stod rizatriptan för cirka 17 % av den cirkulerande plasmaradioaktiviteten. Cirka 14 % av en oral dos utsöndras i urinen som oförändrat rizatriptan medan 51 % utsöndras som indolättiksyrametabolit, vilket tyder på betydande första passage-metabolism.
Plasmahalveringstiden för rizatriptan hos män och kvinnor är i genomsnitt 2-3 timmar.
Cytokrom P450 Isoformer
Rizatriptan är inte en hämmare av aktiviteten hos human levercytokrom P450 isoformerna 3A4/5, 1A2, 2C9, 2C19 eller 2E1; rizatriptan är en kompetitiv hämmare (Ki=1400 nM) av cytokrom P450 2D6, men endast vid höga, kliniskt irrelevanta koncentrationer.
Särskilda populationer
Geriatrisk
Rizatriptans farmakokinetik hos friska äldre frivilliga frivilliga utan migrän (ålder 65-77 år) liknade den hos yngre frivilliga utan migrän (ålder 18-45 år).
Pediatrisk
Farmakokinetiken för rizatriptan bestämdes hos pediatriska migränpatienter i åldern 6 till 17 år. Exponeringar efter administrering av engångsdos av 5 mg MAXALT-MLT till pediatriska patienter som väger 20-39 kg (44-87 lb) eller 10 mg MAXALT-MLT till pediatriska patienter som väger ≥40 kg (88 lb) liknade de som observerades efter engångsdos administrering av 10 mg MAXALT-MLT till vuxna.
Kön
Medelvärdet för AUC0-∞ och Cmax för rizatriptan (10 mg oralt) var cirka 30 % respektive 11 % högre hos kvinnor jämfört med män, medan Tmax inträffade vid ungefär samma tidpunkt.
Nedsatt leverfunktion
Efter oral administrering till patienter med nedsatt leverfunktion orsakad av mild till måttlig alkoholisk levercirros, var plasmakoncentrationerna av rizatriptan liknande hos patienter med mild leverinsufficiens jämfört med en kontrollgrupp av patienter med normal leverfunktion; Plasmakoncentrationerna av rizatriptan var cirka 30 % högre hos patienter med måttlig leverinsufficiens.
Nedsatt njurfunktion
Hos patienter med nedsatt njurfunktion (kreatininclearance 10-60 ml/min/1,73 m2) var AUC0-∞ för rizatriptan inte signifikant annorlunda än hos patienter med normal njurfunktion. Hos hemodialyspatienter (kreatininclearance
Lopp
Farmakokinetiska data visade inga signifikanta skillnader mellan afroamerikanska och kaukasiska försökspersoner.
Läkemedelsinteraktioner
[Se även LÄKEMEDELSINTERAKTIONER ]
Monoaminoxidashämmare
Rizatriptan metaboliseras huvudsakligen via monoaminoxidas, A-subtyp (MAO-A). Plasmakoncentrationer av rizatriptan kan ökas av läkemedel som är selektiva MAO-A-hämmare (t.ex. moklobemid) eller icke-selektiva MAO-hämmare [typ A och B] (t.ex. isokarboxazid, fenelzin, tranylcypromin och pargylin). I en läkemedelsinteraktionsstudie, när MAXALT 10 mg administrerades till försökspersoner (n=12) som fick samtidig behandling med den selektiva, reversibla MAO-A-hämmaren, moklobemid 150 mg tid, förekom en genomsnittlig ökning av rizatriptans AUC och Cmax på 119 % och 41 % respektive; och AUC för den aktiva N-monodesmetylmetaboliten av rizatriptan ökade med mer än 400 %. Interaktionen skulle förväntas vara större med irreversibla MAO-hämmare. Ingen farmakokinetisk interaktion förväntas hos patienter som får selektiva MAO-B-hämmare [se KONTRAINDIKATIONER och LÄKEMEDELSINTERAKTIONER ].
Propranolol
en studie av samtidig administrering av propranolol 240 mg/dag och en engångsdos av rizatriptan 10 mg till friska vuxna försökspersoner (n=11), ökade den genomsnittliga plasma-AUC för rizatriptan med 70 % under administrering av propranolol och en fyrfaldig ökning observerades i ett ämne. AUC för den aktiva N-monodesmetylmetaboliten av rizatriptan påverkades inte av propranolol [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ].
Nadolol/Metoprolol
I en läkemedelsinteraktionsstudie utvärderades effekterna av flera doser av nadolol 80 mg eller metoprolol 100 mg var 12:e timme på farmakokinetiken för en engångsdos på 10 mg rizatriptan hos friska försökspersoner (n=12). Inga farmakokinetiska interaktioner observerades.
Paroxetin
I en studie av interaktionen mellan den selektiva serotoninåterupptagshämmaren (SSRI) paroxetin 20 mg/dag i två veckor och en engångsdos av MAXALT 10 mg hos friska försökspersoner (n=12), varken plasmakoncentrationerna av rizatriptan eller dess säkerhetsprofil påverkades av paroxetin [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER , och PATIENTINFORMATION ].
Orala preventivmedel
en studie av samtidig administrering av ett oralt preventivmedel under 6 dagars administrering av MAXALT (10-30 mg/dag) hos friska kvinnliga frivilliga (n=18), påverkade inte rizatriptan plasmakoncentrationerna av etinylöstradiol eller noretindron.
Kliniska studier
Vuxna
Effekten av MAXALT 5 mg tabletter fastställdes i fyra multicenter, randomiserade, placebokontrollerade studier. Patienter som ingick i dessa studier var främst kvinnor (84 %) och kaukasiska (88 %), med en medelålder på 40 år (intervall från 18 till 71). Patienterna instruerades att behandla en måttlig till svår huvudvärk. Huvudvärksvar, definierat som en minskning av måttlig eller svår huvudvärksmärta till ingen eller mild huvudvärksmärta, bedömdes i upp till 2 timmar (studie 1) eller upp till 4 timmar efter dosering (studier 2, 3 och 4). Associerade symtom på illamående, fotofobi och fonofobi och bibehållande av respons upp till 24 timmar efter dosering utvärderades. En andra dos av MAXALT 10 mg tabletter tilläts 2 till 24 timmar efter dosering för behandling av återkommande huvudvärk i studie 1 och 2. Ytterligare analgetika och/eller antiemetika tilläts 2 timmar efter initial behandling för räddning i alla fyra studierna.
alla studier var andelen patienter som uppnådde huvudvärksvar 2 timmar efter behandling signifikant högre hos patienter som fick antingen MAXALT 5 eller 10 mg jämfört med dem som fick placebo. I en separat studie skilde sig inte doser på 2,5 mg från placebo. Doser större än 10 mg var associerade med en ökad förekomst av biverkningar. Resultaten från de fyra kontrollerade studierna är sammanfattade i tabell 2.
Jämförelser av läkemedelsprestanda baserat på resultat från olika kliniska prövningar är kanske inte tillförlitliga. Eftersom studier utförs vid olika tidpunkter, med olika urval av patienter, av olika utredare, med olika kriterier och/eller olika tolkningar av samma kriterier, under olika förhållanden (dos, doseringsregim, etc.), kvantitativa uppskattningar av behandlingssvar och tidpunkten för svar kan förväntas variera avsevärt från studie till studie.
Den uppskattade sannolikheten för att uppnå ett initialt huvudvärksvar inom 2 timmar efter behandling i poolade studier 1, 2, 3 och 4 visas i figur 1.
Figur 1: Uppskattad sannolikhet för att uppnå ett initialt huvudvärksvar med 2 timmar i poolade studier 1, 2, 3 och 4* 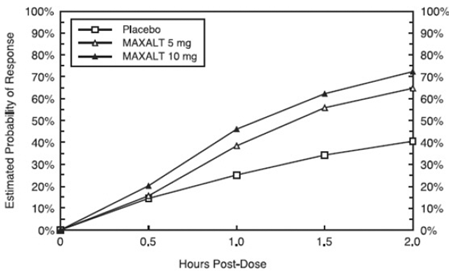
För patienter med migränassocierad fotofobi, fonofobi och illamående vid baslinjen, var det en minskad förekomst av dessa symtom efter administrering av MAXALT jämfört med placebo.
Två till 24 timmar efter den initiala dosen av studiebehandlingen fick patienterna använda ytterligare behandling för smärtsvar i form av en andra dos av studiebehandling eller annan medicin. Den uppskattade sannolikheten för att patienter tar en andra dos eller annan medicin mot migrän under de 24 timmarna efter den initiala dosen av studiebehandlingen sammanfattas i figur 2.
Figur 2: Uppskattad sannolikhet för patienter som tar en andra dos av MAXALT 10 mg tabletter eller annan medicin mot migrän under de 24 timmarna efter den initiala dosen av studiebehandlingen i poolade studier 1, 2, 3 och 4* 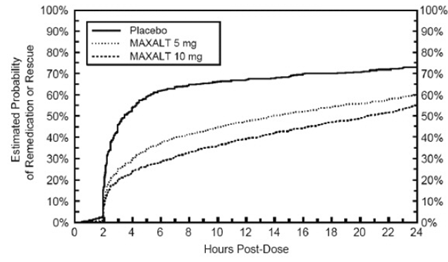
Effektiviteten påverkades inte av närvaron av aura; av patientens kön eller ålder; eller genom samtidig användning av vanliga migränprofylaktiska läkemedel (t.ex. betablockerare, kalciumkanalblockerare, tricykliska antidepressiva) eller orala preventivmedel. I ytterligare två liknande studier påverkades effekten opåverkad av förhållandet till mens. Det fanns otillräckliga data för att bedöma effekten av ras på effekten.
MAXALT-MLT oralt sönderfallande tabletter
Effekten av MAXALT-MLT fastställdes i två multicenter, randomiserade, placebokontrollerade studier som liknade utformningen av studierna med MAXALT tabletter (studierna 5 och 6). Patienterna instruerades att behandla en måttlig till svår huvudvärk. Patienter som behandlades i dessa studier var främst kvinnor (88 %) och kaukasiska (95 %), med en medelålder på 42 år (intervall 18-72).
båda studierna var andelen patienter som uppnådde huvudvärksvar 2 timmar efter behandling signifikant högre hos patienter som fick antingen MAXALT-MLT 5 eller 10 mg jämfört med de som fick placebo. Resultaten från studierna 5 och 6 är sammanfattade i tabell 3.
Den uppskattade sannolikheten för att uppnå ett initialt huvudvärksvar 2 timmar efter behandling med MAXALT-MLT i poolade studier 5 och 6 visas i figur 3.
Figur 3: Uppskattad sannolikhet för att uppnå ett initialt huvudvärksvar med MAXALT-MLT med 2 timmar i poolade studier 5 och 6* 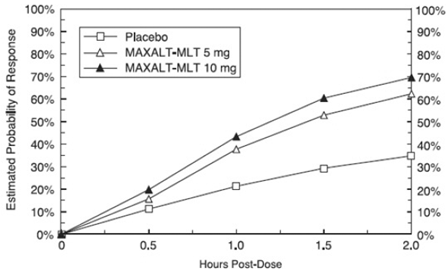
För patienter med migränassocierad fotofobi och fonofobi vid baslinjen, var det en minskad incidens av dessa symtom efter administrering av MAXALT-MLT jämfört med placebo.
Två till 24 timmar efter den initiala dosen av studiebehandlingen fick patienterna använda ytterligare behandling för smärtsvar i form av en andra dos av studiebehandling eller annan medicin. Den uppskattade sannolikheten för att patienter tar en andra dos eller annan medicin mot migrän under 24 timmar efter den initiala dosen av studiebehandlingen sammanfattas i figur 4.
Figur 4: Uppskattad sannolikhet för patienter som tar en andra dos av MAXALT-MLT eller annan medicin mot migrän under de 24 timmarna efter den initiala dosen av studiebehandlingen i poolade studier 5 och 6* 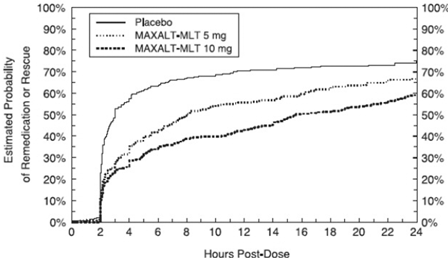
Pediatriska patienter 6 till 17 års ålder
Effekten av MAXALT-MLT hos pediatriska patienter 6 till 17 år utvärderades i en multicenter, randomiserad, dubbelblind, placebokontrollerad, klinisk parallellgruppsstudie (Studie 7). Patienterna måste ha minst 6 månaders historia av migränanfall (med eller utan aura) som vanligtvis varade i 3 timmar eller mer (när de inte behandlades). Patientpopulationen har historiskt sett inte svarat på NSAID och acetaminofenterapi.
Patienterna instruerades att behandla en enstaka migränattack med huvudvärksmärta av måttlig till svår intensitet. Behandlingsfasen av studien hade två steg. Steg 1 användes för att identifiera placebo-icke-svarare, som sedan gick in i steg 2, där patienter randomiserades till MAXALT-MLT eller placebo. Med en viktbaserad doseringsstrategi fick patienter som vägde 20 kg till
Medelåldern för den studerade patientpopulationen var 13 år. Sextioen procent av patienterna var kaukasiska och femtiosex procent av patienterna var kvinnor. Andelen patienter som uppnådde det primära effektmåttet utan huvudvärksmärta 2 timmar efter behandling var signifikant högre hos patienter som fick MAXALT-MLT, jämfört med de som fick placebo (33 % jämfört med 24 %). Resultaten från studie 7 sammanfattas i tabell 4.
Den observerade andelen pediatriska patienter som inte uppnår huvudvärksmärta inom 2 timmar efter initial behandling med MAXALT-MLT visas i figur 5.
Figur 5: Observerad procentandel av patienter som inte rapporterade huvudvärksmärta 2 timmar efter dos i studie 7 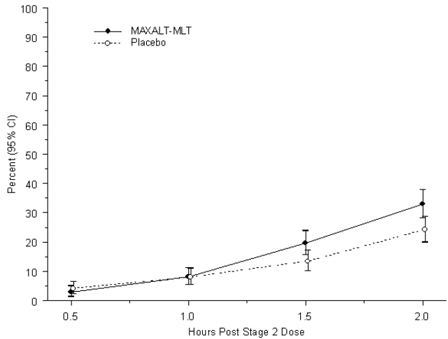
Prevalensen av de explorativa endpoints av frånvaro av migränrelaterade symtom (illamående, fotofobi och fonofobi) 2 timmar efter att ha tagit dosen var inte statistiskt signifikant olika mellan patienter som fick MAXALT-MLT och de som fick placebo.
PATIENTINFORMATION
MAXALT® (max-awlt)
MAXALT-MLT® (rizatriptanbensoat) Tabletter och oralt sönderfallande tabletter
Läs denna patientinformation innan du börjar ta MAXALT® och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling.
Om inget annat anges gäller informationen i denna patientinformation för både MAXALT 10 mg tabletter och MAXALT-MLT® oralt sönderfallande tabletter.
Vad är MAXALT?
MAXALT är ett receptbelagt läkemedel som tillhör en klass av läkemedel som kallas triptaner. MAXALT finns som en traditionell tablett (MAXALT) och som en oralt sönderfallande tablett (MAXALT-MLT).
MAXALT 5mg och MAXALT-MLT används för att behandla migränattacker med eller utan aura hos vuxna och hos barn 6 till 17 år.
MAXALT 5mg ska inte användas för att förhindra migränattacker.
MAXALT är inte för behandling av hemiplegisk eller basilär migrän.
Det är inte känt om MAXALT är säkert och effektivt för behandling av klusterhuvudvärk.
Det är inte känt om det är säkert och effektivt att ta mer än 1 dos MAXALT på 24 timmar för barn 6 till 17 år.
Det är inte känt om MAXALT är säkert och effektivt för barn under 6 år.
Vem ska inte ta MAXALT?
Ta inte MAXALT om du:
- har eller har haft hjärtproblem
- har eller har haft en stroke eller en övergående ischemisk attack (TIA)
- har eller har haft problem med blodkärlen inklusive ischemisk tarmsjukdom
- har okontrollerat högt blodtryck
- har tagit andra Triptan-läkemedel under de senaste 24 timmarna
- har tagit mediciner som innehåller ergot de senaste 24 timmarna
- har hemiplegisk eller basilär migrän
- ta monoaminoxidas (MAO)-hämmare eller har tagit en MAO-hämmare inom de senaste 2 veckorna
- är allergisk mot rizatriptanbensoat eller något av innehållsämnena i MAXALT. Se slutet av denna bipacksedel för en komplett lista över ingredienser i MAXALT.
Tala med din läkare innan du tar detta läkemedel om du har något av ovanstående tillstånd eller om du är osäker på om du tar något av dessa läkemedel.
Vad ska jag berätta för min läkare innan jag tar MAXALT?
Innan du tar MAXALT, berätta för din läkare om du:
- har eller har haft hjärtproblem, högt blodtryck, bröstsmärtor eller andnöd
- har några riskfaktorer för hjärtproblem eller blodkärlsproblem som:
- högt blodtryck
- högt kolesterol
- rökning
- fetma
- diabetes
- familjehistoria med hjärtproblem
- du är postmenopausal
- du är en man över 40
- har fenylketonuri (PKU). MAXALT-MLT oralt sönderfallande tabletter innehåller fenylalanin.
- har njur- eller leverproblem
- har något annat medicinskt tillstånd
- är gravid eller planerar att bli gravid. Det är inte känt om MAXALT kommer att skada ditt ofödda barn. Om du blir gravid medan du tar MAXALT 5mg, prata med din läkare.
- ammar eller planerar att amma. Det är inte känt om MAXALT 10 mg går över i din bröstmjölk. Tala med din läkare om det bästa sättet att mata ditt barn om du tar MAXALT.
Berätta för din läkare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
MAXALT 10 mg och andra läkemedel kan påverka varandra och orsaka biverkningar. MAXALT kan påverka hur andra läkemedel fungerar, och andra läkemedel kan påverka hur MAXALT 5mg fungerar.
Tala särskilt om för din läkare om du tar:
- läkemedel som innehåller propranolol som Inderal®, Inderal® LA eller Innopran® XL
- läkemedel som används för att behandla humörstörningar, inklusive selektiva serotoninåterupptagshämmare (SSRI) eller serotonin-noradrenalinåterupptagshämmare (SNRI).
Fråga din läkare eller apotekspersonal om en lista över dessa läkemedel om du är osäker.
Vet vilka mediciner du tar. Håll en lista över dem för att visa din läkare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta MAXALT?
- Ta MAXALT exakt som din läkare säger åt dig att ta det.
- Din läkare kommer att tala om för dig hur mycket MAXALT 5 mg du ska ta och när du ska ta det.
- För att ta MAXALT-MLT:
- Lämna MAXALT-MLT oralt sönderfallande tabletter i förpackningen tills du är redo att ta den. När du är redo att ta det:
- Ta bort blistern från foliepåsen. Tryck inte den oralt sönderfallande MAXALT-MLT tabletten genom blistern.
- Dra av blisterförpackningen med torra händer och placera den oralt sönderfallande MAXALT-MLT-tabletten på tungan. Tabletten kommer att lösas upp och sväljas med din saliv. Ingen vätska behövs för att ta den oralt sönderfallande tabletten.
- Lämna MAXALT-MLT oralt sönderfallande tabletter i förpackningen tills du är redo att ta den. När du är redo att ta det:
- Om din huvudvärk kommer tillbaka efter din första MAXALT 10 mg dos:
- För vuxna: en andra dos kan tas 2 timmar efter den första dosen. Ta inte mer än 30 mg MAXALT under en 24-timmarsperiod (ta till exempel inte mer än 3 10-mg tabletter under en 24-timmarsperiod).
- För barn 6 till 17 år: Det är inte känt om det är säkert och effektivt att ta mer än 1 dos MAXALT 5 mg på 24 timmar. Tala med din läkare om vad du ska göra om din huvudvärk inte försvinner eller kommer tillbaka.
- Om du tar för mycket MAXALT 5 mg, ring din läkare eller gå till närmaste akutmottagning direkt.
Vad ska jag undvika när jag tar MAXALT?
MAXALT 5mg kan orsaka yrsel, svaghet eller svimning. Om du har dessa symtom, kör inte bil, använd inte maskiner eller gör något som kräver att du är uppmärksam.
Vilka är de möjliga biverkningarna av MAXALT 5mg?
MAXALT 5mg kan orsaka allvarliga biverkningar. Ring din läkare eller gå till närmaste akutmottagning omedelbart om du tror att du har några av de allvarliga biverkningarna av MAXALT inklusive:
- hjärtattack. Symtom på hjärtinfarkt kan inkludera:
- obehag i bröstet i mitten av bröstet som varar i mer än några minuter eller som försvinner och kommer tillbaka
- obehag i bröstet som känns som obehagligt tryck, klämning, fullhet eller smärta
- smärta eller obehag i armar, rygg, nacke, käke eller mage
- andnöd med eller utan obehag i bröstet
- bryta ut i kallsvettning
- illamående eller kräkningar
- känner sig yr
- stroke. Symtom på en stroke kan innefatta följande plötsliga symtom:
- domningar eller svaghet i ansikte, arm eller ben, särskilt på ena sidan av kroppen
- förvirring, problem med att tala eller förstå
- problem med att se på ena eller båda dina ögon
- problem med att gå, yrsel, förlust av balans eller koordination
- svår huvudvärk utan känd orsak
- problem med blodkärlen. Symtom på problem med blodkärlen kan vara:
- magont
- blodig diarré
- synproblem
- kyla och domningar i händer och fötter
- serotonergt syndrom. Ett tillstånd som kallas serotonergt syndrom kan inträffa när Triptan-läkemedel som MAXALT tas tillsammans med vissa andra läkemedel. Symtom på serotonergt syndrom kan inkludera:
- agitation
- hallucinationer
- koma
- snabba hjärtslag
- snabba förändringar i ditt blodtryck
- ökad kroppstemperatur
- muskelspasm
- förlust av koordination
- illamående, kräkningar eller diarré
- ökat blodtryck.
De vanligaste biverkningarna av MAXALT hos vuxna inkluderar:
- känner sig sömnig eller trött
- smärta eller tryck i bröstet eller halsen
- yrsel
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Om du tar MAXALT 10 mg för ofta kan detta leda till att du får kronisk huvudvärk. I sådana fall bör du kontakta din läkare, eftersom du kan behöva sluta ta MAXALT.
Dessa är inte alla möjliga biverkningar av MAXALT. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA1088.
Hur ska jag förvara MAXALT?
- Förvara MAXALT i rumstemperatur mellan 59°F till 86°F (15°C till 30°C).
- Kasta säkert medicin som är inaktuell eller inte längre behövs.
Förvara MAXALT 10mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av MAXALT.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte MAXALT för ett tillstånd som det inte har ordinerats för. Ge inte MAXALT till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna patientinformationsbroschyr sammanfattar den viktigaste informationen om MAXALT. Om du vill ha mer information, prata med din läkare. Du kan fråga din apotekspersonal eller läkare om information om MAXALT som är skriven för vårdpersonal.
För mer information, gå till www.maxalt.com.
Vilka är ingredienserna i MAXALT?
Aktiv ingrediens i MAXALT 10 mg och MAXALT-MLT oralt sönderfallande tabletter:
rizatriptanbensoat.
Inaktiva ingredienser i MAXALT: laktosmonohydrat, mikrokristallin cellulosa, förgelatinerad stärkelse, järnoxid (röd) och magnesiumstearat.
Inaktiva ingredienser i MAXALT-MLT oralt sönderfallande tabletter: gelatin, mannitol, glycin, aspartam och pepparmynta.
MAXALT-MLT oralt sönderfallande tabletter innehåller aspartam, en källa till fenylalanin.
Fenylketonurik:
MAXALT-MLT oralt sönderfallande tabletter 5 mg innehåller 1,1 mg fenylalanin. MAXALT-MLT oralt sönderfallande tabletter 10 mg innehåller 2,1 mg fenylalanin.
Denna patientinformation har godkänts av US Food and Drug Administration.
