Imitrex 100mg, 25mg, 50mg Sumatriptan Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Imitrex 25mg och hur används det?
Imitrex 100mg är ett receptbelagt läkemedel som används för att behandla symptomen på migränhuvudvärk och klusterhuvudvärk. Imitrex kan användas ensamt eller tillsammans med andra läkemedel.
Imitrex 50mg är ett antimigränmedel, seratonin 5-HT-receptoragonist.
Det är inte känt om Imitrex 50 mg är säkert och effektivt för barn yngre än 18 år och användning rekommenderas inte för geriatriska patienter.
Vilka är de möjliga biverkningarna av Imitrex 50mg?
Imitrex 25mg kan orsaka allvarliga biverkningar inklusive:
- plötslig, kraftig magsmärta,
- diarré med eller utan närvaro av blod,
- svår bröstsmärta,
- smärta i käken eller axeln,
- andnöd,
- oregelbundna hjärtslag,
- anfall (kramper),
- kramper i benen,
- domningar eller stickningar i dina ben eller fötter,
- brännande smärta i dina ben eller fötter,
- kall känsla i dina ben eller fötter,
- färgförändringar i dina ben eller fötter,
- smärta i höften,
- illamående,
- kräkningar,
- svettas eller frossa,
- agitation,
- hallucinationer,
- feber,
- muskelstelhet,
- förlust av koordination,
- plötslig domningar eller svaghet på ena sidan av kroppen,
- sluddrigt tal,
- svårt att se,
- dålig balans, och
- plötslig svår huvudvärk
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Imitrex inkluderar:
- smärta eller täthet i bröstet, halsen eller käken,
- tryck i någon del av din kropp,
- domningar eller stickningar,
- känna sig varm eller kall,
- yrsel,
- dåsighet,
- svaghet,
- obehaglig smak efter att ha använt näsmedicinen,
- smärta, sveda, domningar eller stickningar i näsan eller halsen efter att ha använt näsmedicinen, och
- rinnande eller tilltäppt näsa efter att ha använt näsmedicinen
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Imitrex. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
IMITREX 50 mg injektion innehåller sumatriptansuccinat, en selektiv 5-HT1B/1D-receptoragonist. Sumatriptansuccinat är kemiskt betecknat som 3-[2-(dimetylamino)etyl]-N-metyl-indol5-metansulfonamidsuccinat (1:1), och det har följande struktur:
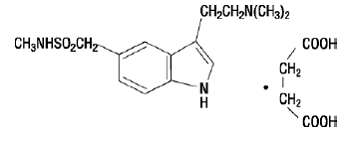
Den empiriska formeln är C14H21N3O2S•C4H6O4, vilket representerar en molekylvikt på 413,5. Sumatriptansuccinat är ett vitt till benvitt pulver som är lättlösligt i vatten och i saltlösning.
IMITREX injektion är en klar, färglös till ljusgul, steril, icke-pyrogen lösning för subkutan injektion. Varje 0,5 ml IMITREX injektionslösning 8 mg/ml innehåller 4 mg sumatriptan (bas) som succinatsalt och 3,8 mg natriumklorid, USP in Water for Injection, USP. Varje 0,5 ml IMITREX injektionslösning 12 mg/ml innehåller 6 mg sumatriptan (bas) som succinatsalt och 3,5 mg natriumklorid, USP in Water for Injection, USP. pH-intervallet för båda lösningarna är cirka 4,2 till 5,3. Osmolaliteten för båda injektionerna är 291 mOsmol.
INDIKATIONER
IMITREX® Injection är indicerat till vuxna för (1) akut behandling av migrän, med eller utan aura, och (2) akut behandling av klusterhuvudvärk.
Användningsbegränsningar
- Använd endast om en tydlig diagnos av migrän eller klusterhuvudvärk har fastställts. Om en patient inte har något svar på den första migränanfallen eller klusterhuvudvärk som behandlades med IMITREX 50 mg injektion, ompröva diagnosen innan IMITREX Injection administreras för att behandla eventuella efterföljande attacker.
- IMITREX Injection är inte indicerat för att förebygga migrän eller klusterhuvudvärkattacker.
DOSERING OCH ADMINISTRERING
Doseringsinformation
Den maximala rekommenderade engångsdosen för vuxna av IMITREX 25 mg injektion för akut behandling av migrän eller klusterhuvudvärk är 6 mg injicerat subkutant. För behandling av migrän, om biverkningar är dosbegränsande, kan lägre doser (1 mg till 5 mg) användas [se Kliniska studier ]. För behandling av klusterhuvudvärk har effekten av lägre doser inte fastställts.
Den maximala kumulativa dosen som kan ges inom 24 timmar är 12 mg, två 6 mg injektioner åtskilda med minst 1 timme. En andra dos på 6 mg bör endast övervägas om något svar på en första injektion observerades.
Administrering med IMITREX STATdose Pen®
En autoinjektoranordning (IMITREX 25 mg STATdose Pen) finns tillgänglig för användning med 4 mg och 6 mg förfyllda sprutpatroner. Med den här enheten penetrerar nålen cirka 1/4 tum (5 till 6 mm). Injektionen är avsedd att ges subkutant och intramuskulär eller intravaskulär leverans måste undvikas. Instruera patienterna om korrekt användning av IMITREX 100 mg STATdose Pen och hänvisa dem till injektionsställen med tillräcklig hud och subkutan tjocklek för att passa nålens längd.
Administrering av andra doser av IMITREX än 4 eller 6 mg
Till patienter som får andra doser än 4 mg eller 6 mg, använd en 6 mg endosflaska; använd inte IMITREX 50mg STATdose Pen. Inspektera injektionsflaskan visuellt för partiklar och missfärgning före administrering. Använd inte om partiklar och missfärgningar noteras.
HUR LEVERERAS
Doseringsformer och styrkor
- Injektion: 4 mg och 6 mg endos förfyllda sprutpatroner för användning med IMITREX STATdose Pen.
- Injektion: 6 mg endosflaska.
Förvaring Och Hantering
IMITREX 100mg injektion innehåller sumatriptan (bas) som succinatsalt och levereras som en klar, färglös till blekgul, steril, icke-pyrogen lösning enligt följande:
Förfylld spruta och/eller autoinjektorpenna
Varje förpackning innehåller en patientinformation och en patientinstruktionsbroschyr.
IMITREX 100 mg STATdose System®, 4 mg , innehållande 1 IMITREX 25 mg STATdospenna, 2 förfyllda endossprutor och 1 väska ( NDC 0173-0739-00).
IMITREX 100 mg STATdoseringssystem, 6 mg innehållande 1 IMITREX STATdospenna, 2 förfyllda endossprutor och 1 väska ( NDC 0173-0479-00).
Två 4 mg endos förfyllda sprutor patroner för användning med IMITREX STATdose System ( NDC 0173-0739-02).
Två 6 mg endos förfyllda sprutor patroner för användning med IMITREX 25mg STATdose System ( NDC 0173-0478-00).
Endosflaska
IMITREX 25 mg injektionsflaska för engångsdos (6 mg/0,5 ml) i kartonger innehållande 5 injektionsflaskor ( NDC 01730449-02).
Förvara mellan 2° och 30°C (36° och 86°F). Skydda från ljus.
GlaxoSmithKline, Research Triangle Park, NC 27709
BIEFFEKTER
Följande allvarliga biverkningar beskrivs nedan och på andra ställen i märkningen:
- Myokardischemi, hjärtinfarkt och Prinzmetals angina [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Arytmier [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Smärta/trånghet/tryck i bröstet, halsen, nacken och/eller käken [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Cerebrovaskulära händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Andra vasospasmreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överanvändning av läkemedelshuvudvärk [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ökning av blodtrycket [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighetsreaktioner [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kramper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i praktiken.
Migrän huvudvärk
Tabell 1 listar biverkningar som inträffade i 2 amerikanska placebokontrollerade kliniska prövningar på migränpatienter (studier 2 och 3) efter antingen en engångsdos på 6 mg av IMITREX 100 mg injektion eller placebo. Endast reaktioner som inträffade med en frekvens på 2 % eller mer i grupper behandlade med IMITREX Injection 6 mg och som inträffade med en frekvens som var högre än placebogruppen är inkluderade i Tabell 1.
Incidensen av biverkningar i kontrollerade kliniska prövningar påverkades inte av patienternas kön eller ålder. Det fanns otillräckliga data för att bedöma effekten av ras på förekomsten av biverkningar.
Hortons huvudvärk
I de kontrollerade kliniska prövningarna som utvärderade effekten av IMITREX 50 mg injektion som behandling för klusterhuvudvärk (studier 4 och 5), upptäcktes inga nya signifikanta biverkningar som inte redan hade identifierats i prövningar av IMITREX 100 mg hos patienter med migrän.
Sammantaget var frekvensen av biverkningar som rapporterades i studierna av klusterhuvudvärk generellt sett lägre än i migränstudierna. Undantag inkluderar rapporter om parestesi (5 % IMITREX, 0 % placebo), illamående och kräkningar (4 % IMITREX, 0 % placebo) och bronkospasm (1 % IMITREX 50 mg, 0 % placebo).
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av IMITREX 50 mg tabletter, IMITREX nässpray och IMITREX 50 mg injektion efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Kardiovaskulär
Hypotoni, hjärtklappning.
Neurologiska
Dystoni, tremor.
LÄKEMEDELSINTERAKTIONER
Ergotinnehållande droger
Ergotinnehållande läkemedel har rapporterats orsaka förlängda vasospastiska reaktioner. Eftersom dessa effekter kan vara additiva, är användning av läkemedel som innehåller ergotamin eller ergottyp (som dihydroergotamin eller metysergid) och IMITREX 25 mg injektion inom 24 timmar efter varandra kontraindicerat.
Monoaminoxidas-A-hämmare
MAO-A-hämmare ökar den systemiska exponeringen 2 gånger. Därför är användningen av IMITREX Injection hos patienter som får MAO-A-hämmare kontraindicerat [se KLINISK FARMAKOLOGI ].
Andra 5-HT1-agonister
Eftersom deras vasospastiska effekter kan vara additiv, är samtidig administrering av IMITREX Injection och andra 5-HT1-agonister (t.ex. triptaner) kontraindicerat inom 24 timmar efter varandra.
Selektiva serotoninåterupptagshämmare/serotonin noradrenalin återupptagshämmare och serotonergt syndrom
Fall av serotonergt syndrom har rapporterats vid samtidig administrering av triptaner och SSRI, SNRI, TCA och MAO-hämmare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Myokardischemi, hjärtinfarkt och Prinzmetals kärlkramp
Användningen av IMITREX Injection är kontraindicerad hos patienter med ischemisk eller vasospastisk CAD. Det har förekommit sällsynta rapporter om allvarliga hjärtbiverkningar, inklusive akut hjärtinfarkt, som inträffat inom några timmar efter administrering av IMITREX Injection. Vissa av dessa reaktioner inträffade hos patienter utan känd CAD. IMITREX 100mg injektion kan orsaka kranskärlskärlspasm (Prinzmetals angina), även hos patienter utan en historia av CAD.
Utför en kardiovaskulär utvärdering av triptannaiva patienter som har flera kardiovaskulära riskfaktorer (t.ex. ökad ålder, diabetes, högt blodtryck, rökning, fetma, stark familjehistoria av CAD) innan de får IMITREX-injektion. Om det finns tecken på CAD eller kranskärlspasm, är IMITREX 100 mg injektion kontraindicerat. För patienter med flera kardiovaskulära riskfaktorer som har en negativ kardiovaskulär utvärdering, överväg att administrera den första dosen av IMITREX Injection i en medicinskt övervakad miljö och att utföra ett elektrokardiogram (EKG) omedelbart efter administrering av IMITREX Injection. För sådana patienter, överväg periodisk kardiovaskulär utvärdering hos intermittenta långtidsanvändare av IMITREX 100 mg injektion.
Arytmier
Livshotande störningar av hjärtrytmen, inklusive ventrikulär takykardi och ventrikelflimmer som leder till döden, har rapporterats inom några timmar efter administrering av 5-HT1-agonister. Avbryt IMITREX-injektion om dessa störningar uppstår. IMITREX Injection är kontraindicerat hos patienter med Wolff-Parkinson-Whites syndrom eller arytmier i samband med andra hjärtöverledningsstörningar.
Bröst-, hals-, nacke- och/eller käksmärta/täthet/tryck
Känslor av täthet, smärta, tryck och tyngd i precordium, hals, nacke och käke uppstår vanligtvis efter behandling med IMITREX Injection och är vanligtvis icke-hjärtat. Utför dock en hjärtutvärdering om dessa patienter löper hög hjärtrisk. Användningen av IMITREX Injection är kontraindicerad hos patienter med CAD och de med Prinzmetals variant angina.
Cerebrovaskulära händelser
Cerebral blödning, subaraknoidal blödning och stroke har förekommit hos patienter som behandlats med 5-HT1-agonister, och vissa har resulterat i dödsfall. I ett antal fall förefaller det möjligt att de cerebrovaskulära händelserna var primära, eftersom 5-HT1-agonisten hade administrerats i den felaktiga övertygelsen att de upplevda symtomen var en följd av migrän när de inte var det. Patienter med migrän kan också löpa ökad risk för vissa cerebrovaskulära händelser (t.ex. stroke, blödning, TIA). Avbryt IMITREX-injektion om en cerebrovaskulär händelse inträffar.
Innan du behandlar huvudvärk hos patienter som inte tidigare diagnostiserats med migrän eller klusterhuvudvärk eller hos patienter som uppvisar atypiska symtom, uteslut andra potentiellt allvarliga neurologiska tillstånd. IMITREX Injection är kontraindicerat hos patienter med stroke eller TIA i anamnesen.
Andra vasospasmreaktioner
IMITREX 25 mg injektion kan orsaka icke-koronära vasospastiska reaktioner, såsom perifer vaskulär ischemi, gastrointestinal vaskulär ischemi och infarkt (med buksmärtor och blodig diarré), mjältinfarkt och Raynauds syndrom. Hos patienter som upplever symtom eller tecken som tyder på icke-koronar vasospasmreaktion efter användning av någon 5-HT1-agonist, uteslut en vasospastisk reaktion innan de får ytterligare IMITREX-injektioner.
Rapporter om övergående och permanent blindhet och betydande partiell synförlust har rapporterats vid användning av 5-HT1-agonister. Eftersom synstörningar kan vara en del av en migränattack, har ett orsakssamband mellan dessa händelser och användningen av 5-HT1-agonister inte klarlagts.
Överanvändning av mediciner Huvudvärk
Överanvändning av akuta migränläkemedel (t.ex. ergotamin, triptaner, opioider eller kombinationer av dessa läkemedel i 10 eller fler dagar per månad) kan leda till förvärring av huvudvärk (huvudvärk för överanvändning av läkemedel). Överanvändningshuvudvärk kan visa sig som migränliknande daglig huvudvärk, eller som en markant ökning av frekvensen av migränattacker. Avgiftning av patienter, inklusive utsättande av de överanvända läkemedlen, och behandling av abstinensbesvär (vilket ofta inkluderar en övergående försämring av huvudvärk) kan vara nödvändiga.
Serotonin syndrom
Serotonergt syndrom kan förekomma med IMITREX Injection, särskilt vid samtidig administrering med selektiva serotoninåterupptagshämmare (SSRI), serotonin noradrenalin återupptagshämmare (SNRI), tricykliska antidepressiva (TCA) och MAO-hämmare [se LÄKEMEDELSINTERAKTIONER ]. Symtom på serotonergt syndrom kan inkludera förändringar i mental status (t.ex. agitation, hallucinationer, koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, hypertermi), neuromuskulära avvikelser (t.ex. hyperreflexi, inkoordination) och/eller gastrointestinala symtom (t.ex. illamående, kräkningar, diarré). Symtomdebuten inträffar vanligtvis inom några minuter till timmar efter att man fått en ny eller en större dos av en serotonerg medicin. Avbryt IMITREX-injektion om serotonergt syndrom misstänks.
Ökning av blodtrycket
Signifikant förhöjning av blodtrycket, inklusive hypertensiv kris med akut försämring av organsystem, har rapporterats i sällsynta fall hos patienter som behandlats med 5-HT1-agonister, inklusive patienter utan hypertoni i anamnesen. Övervaka blodtrycket hos patienter som behandlas med IMITREX. IMITREX Injection är kontraindicerat hos patienter med okontrollerad hypertoni.
Anafylaktiska/anafylaktoida reaktioner
Anafylaktiska/anafylaktoida reaktioner har inträffat hos patienter som fått IMITREX. Sådana reaktioner kan vara livshotande eller dödliga. I allmänhet är det mer sannolikt att anafylaktiska reaktioner på läkemedel uppstår hos individer med en historia av känslighet för flera allergener. IMITREX 50 mg injektion är kontraindicerat hos patienter med en historia av överkänslighetsreaktioner mot IMITREX.
Anfall
Kramper har rapporterats efter administrering av IMITREX. Vissa har förekommit hos patienter med antingen en historia av anfall eller samtidiga tillstånd som predisponerar för anfall. Det finns också rapporter om patienter där inga sådana predisponerande faktorer är uppenbara. IMITREX Injection ska användas med försiktighet till patienter med epilepsi i anamnesen eller tillstånd associerade med en sänkt anfallströskel.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION och bruksanvisning ).
Risk för myokardischemi och/eller infarkt, Prinzmetals kärlkramp, andra vasospasmrelaterade händelser, arytmier och cerebrovaskulära händelser
Informera patienterna om att IMITREX 50 mg injektion kan orsaka allvarliga kardiovaskulära biverkningar såsom hjärtinfarkt eller stroke. Även om allvarliga kardiovaskulära händelser kan inträffa utan varningssymtom, bör patienter vara uppmärksamma på tecken och symtom på bröstsmärtor, andfåddhet, oregelbunden hjärtrytm, signifikant ökning av blodtrycket, svaghet och talsvaghet, och bör be om medicinsk rådgivning om några indikativa tecken eller symtom observeras. Informera patienter om vikten av denna uppföljning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anafylaktiska/anafylaktoida reaktioner
Informera patienter om att anafylaktiska/anafylaktoida reaktioner har inträffat hos patienter som får IMITREX 100 mg injektion. Sådana reaktioner kan vara livshotande eller dödliga. I allmänhet är det mer sannolikt att anafylaktiska reaktioner på läkemedel uppstår hos personer med en historia av känslighet för flera allergener [se KONTRAINDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Samtidig användning med andra triptaner eller ergotmediciner
Informera patienter om att användning av IMITREX 50 mg injektion inom 24 timmar efter en annan triptan eller ett läkemedel av ergottyp (inklusive dihydroergotamin eller metysergid) är kontraindicerat [se KONTRAINDIKATIONER , LÄKEMEDELSINTERAKTIONER ].
Serotonin syndrom
Varna patienter för risken för serotonergt syndrom vid användning av IMITREX Injection eller andra triptaner, särskilt vid kombinerad användning med SSRI, SNRI, TCA och MAO-hämmare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ].
Överanvändning av mediciner Huvudvärk
Informera patienter om att användning av akuta migränläkemedel under 10 eller fler dagar per månad kan leda till en förvärring av huvudvärk och uppmuntra patienter att registrera huvudvärkfrekvens och droganvändning (t.ex. genom att föra huvudvärksdagbok) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Graviditet
Informera patienterna om att IMITREX 25mg Injection inte ska användas under graviditet om inte den potentiella nyttan motiverar den potentiella risken för fostret [se Användning i specifika populationer ].
Ammande mödrar
Råda patienter att meddela sin vårdgivare om de ammar eller planerar att amma [se Användning i specifika populationer ].
Förmåga att utföra komplexa uppgifter
Behandling med IMITREX 25 mg injektion kan orsaka somnolens och yrsel; instruera patienterna att utvärdera deras förmåga att utföra komplexa uppgifter efter administrering av IMITREX 25 mg injektion.
Hur man använder IMITREX 100mg Injection
Ge patienterna instruktioner om korrekt användning av IMITREX 100mg Injection om de själv kan administrera IMITREX 50mg Injection i medicinskt oövervakade situationer.
Informera patienterna om att nålen i IMITREX STATdose Pen penetrerar cirka 1/4 tum (5 till 6 mm). Informera patienterna om att injektionen är avsedd att ges subkutant och att intramuskulär eller intravaskulär tillförsel bör undvikas. Instruera patienterna att använda injektionsställen med tillräcklig hud och subkutan tjocklek för att passa nålens längd.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
karcinogenicitetsstudier på mus och råtta där sumatriptan administrerades oralt i 78 veckor respektive 104 veckor i doser upp till 160 mg/kg/dag (den högsta dosen hos råtta minskade från 360 mg/kg/dag under vecka 21 ). Den högsta dosen till möss och råttor var cirka 130 och 260 gånger den enstaka MRHD på 6 mg administrerat subkutant på en mg/m²-basis. Det fanns inga bevis hos någon av arterna på en ökning av tumörer relaterade till administrering av sumatriptan.
Mutagenes
Sumatriptan var negativ i in vitro-analyser (bakteriell omvänd mutation [Ames], gencellsmutation i kinesisk hamster V79/HGPRT, kromosomavvikelse i humana lymfocyter) och in vivo (råttas mikrokärna).
Nedsatt fertilitet
När sumatriptan administrerades som subkutan injektion till han- och honråttor före och under hela parningsperioden, fanns det inga tecken på nedsatt fertilitet vid doser upp till 60 mg/kg/dag eller cirka 100 gånger den mänskliga engångsdosen på 6 mg på en mg/m² bas. När sumatriptan (5, 50, 500 mg/kg/dag) administrerades oralt till han- och honråttor före och under hela parningsperioden, var det en behandlingsrelaterad minskning av fertiliteten sekundärt till en minskning av parning hos djur som behandlades med doser mer än 5 mg/kg/dag. Det är inte klart om detta fynd berodde på en effekt på män eller kvinnor eller båda.
Användning i specifika populationer
Graviditet
Graviditetskategori C
Det finns inga adekvata och välkontrollerade studier av IMITREX 50 mg injektion på gravida kvinnor. I utvecklingstoxicitetsstudier på råttor och kaniner var oral administrering av sumatriptan till dräktiga djur associerad med embryodödlighet, fosteravvikelser och ungar dödlighet. Vid intravenös administrering till dräktiga kaniner var sumatriptan embryoletalt. IMITREX 100mg Injection ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Oral administrering av sumatriptan till dräktiga råttor under organogenesperioden resulterade i en ökad förekomst av abnormiteter i fostrets blodkärl (cervikotorakal och navel). Den högsta dosen utan effekt för embryofetal utvecklingstoxicitet i frekvenser var 60 mg/kg/dag, eller cirka 100 gånger den maximala rekommenderade engångsdosen för människa (MRHD) på 6 mg administrerad subkutant på mg/m² basis. Oral administrering av sumatriptan till dräktiga kaniner under organogenesperioden resulterade i ökade incidenser av embryodödlighet och fetala cervikotorakala vaskulära och skelettavvikelser. Intravenös administrering av sumatriptan till dräktiga kaniner under organogenesperioden resulterade i en ökad incidens av embryodödlighet. De högsta orala och intravenösa doserna utan effekt för utvecklingstoxicitet hos kaniner var 15 och 0,75 mg/kg/dag, eller cirka 50 respektive 2 gånger den enstaka MRHD på 6 mg administrerad subkutant på mg/m²-basis.
Oral administrering av sumatriptan till råttor före och under hela graviditeten resulterade i embryofetal toxicitet (minskad kroppsvikt, minskad förbening, ökad förekomst av skelettavvikelser). Den högsta dosen utan effekt var 50 mg/kg/dag, eller cirka 80 gånger den enstaka MRHD på 6 mg administrerat subkutant på mg/m²-basis. Hos avkommor till dräktiga råttor som behandlats oralt med sumatriptan under organogenesen sågs en minskning av valpöverlevnaden. Den högsta dosen utan effekt för denna effekt var 60 mg/kg/dag, eller cirka 100 gånger den enstaka MRHD på 6 mg administrerat subkutant på mg/m²-basis. Oral behandling av dräktiga råttor med sumatriptan under den senare delen av dräktigheten och under hela laktationen resulterade i en minskning av valpöverlevnaden. Den högsta dosen utan effekt för detta fynd var 100 mg/kg/dag, eller cirka 160 gånger den enstaka MRHD på 6 mg administrerat subkutant på mg/m² basis.
Ammande mödrar
Sumatriptan utsöndras i modersmjölk efter subkutan administrering. Spädbarns exponering för sumatriptan kan minimeras genom att undvika amning i 12 timmar efter behandling med IMITREX 50 mg injektion.
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts. IMITREX 100mg Injection rekommenderas inte för användning till patienter yngre än 18 år.
Två kontrollerade kliniska studier utvärderade IMITREX nässpray (5 till 20 mg) hos 1 248 pediatriska migränpatienter i åldern 12 till 17 år som behandlade en enda attack. Studierna fastställde inte effekten av IMITREX nässpray jämfört med placebo vid behandling av migrän hos pediatriska patienter. Biverkningar som observerats i dessa kliniska prövningar liknade till sin natur de som rapporterats i kliniska prövningar på vuxna.
Fem kontrollerade kliniska prövningar (2 prövningar med en enda attack, 3 prövningar med flera attacker) som utvärderade oral IMITREX (25 till 100 mg) på pediatriska patienter i åldern 12 till 17 år inkluderade totalt 701 pediatriska migränpatienter. Dessa studier fastställde inte effekten av oral IMITREX 25 mg jämfört med placebo vid behandling av migrän hos pediatriska patienter. Biverkningar som observerats i dessa kliniska prövningar liknade till sin natur de som rapporterats i kliniska prövningar på vuxna. Frekvensen av alla biverkningar hos dessa patienter verkade vara både dos- och åldersberoende, med yngre patienter som rapporterade reaktioner vanligare än äldre pediatriska patienter.
Erfarenheter efter marknadsföringen visar att allvarliga biverkningar har inträffat i den pediatriska populationen efter användning av subkutan, oral och/eller intranasal IMITREX. Dessa rapporter inkluderar reaktioner som liknar dem som rapporterats sällan hos vuxna, inklusive stroke, synförlust och dödsfall. En hjärtinfarkt har rapporterats hos en 14-årig man efter användning av oral IMITREX; kliniska tecken uppträdde inom 1 dag efter läkemedelsadministrering. Kliniska data för att fastställa frekvensen av allvarliga biverkningar hos pediatriska patienter som kan få subkutan, oral eller intranasal IMITREX finns för närvarande inte tillgängliga.
Geriatrisk användning
Kliniska prövningar av IMITREX 100 mg injektion inkluderade inte tillräckligt antal patienter 65 år och äldre för att avgöra om de svarar annorlunda än yngre patienter. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion och samtidig sjukdom eller annan läkemedelsbehandling.
En kardiovaskulär utvärdering rekommenderas för geriatriska patienter som har andra kardiovaskulära riskfaktorer (t.ex. diabetes, högt blodtryck, rökning, fetma, stark familjehistoria av CAD) innan de får IMITREX-injektion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
ÖVERDOS
Koronar vasospasm observerades efter intravenös administrering av IMITREX 50 mg injektion [se KONTRAINDIKATIONER ]. Överdoser förväntas från djurdata (hundar vid 0,1 g/kg, råttor vid 2 g/kg) för att möjligen orsaka kramper, tremor, inaktivitet, erytem i extremiteterna, minskad andningsfrekvens, cyanos, ataxi, mydriasis, reaktioner på injektionsstället ( avskalning, håravfall och skorvbildning) och förlamning.
Elimineringshalveringstiden för sumatriptan är cirka 2 timmar [se KLINISK FARMAKOLOGI ]; Därför bör övervakning av patienter efter överdosering med IMITREX Injection fortsätta i minst 10 timmar eller medan symtom eller tecken kvarstår.
Det är okänt vilken effekt hemodialys eller peritonealdialys har på serumkoncentrationerna av sumatriptan.
KONTRAINDIKATIONER
IMITREX Injection är kontraindicerat hos patienter med:
- Ischemisk kranskärlssjukdom (CAD) (angina pectoris, historia av hjärtinfarkt eller dokumenterad tyst ischemi) eller kranskärlspasm, inklusive Prinzmetals angina [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Wolff-Parkinson-Whites syndrom eller arytmier associerade med andra hjärtaccessoriska överledningsstörningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Anamnes med stroke eller transient ischemisk attack (TIA) eller historia av hemiplegisk eller basilär migrän eftersom dessa patienter löper en högre risk för stroke [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Perifer kärlsjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Ischemisk tarmsjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Okontrollerad hypertoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Nylig användning (dvs. inom 24 timmar) av läkemedel som innehåller ergotamin, läkemedel av ergotamintyp (som dihydroergotamin eller metysergid) eller annan 5-hydroxitryptamin1 (5-HT1) agonist [se LÄKEMEDELSINTERAKTIONER ].
- Samtidig administrering av en monoaminoxidas (MAO)-A-hämmare eller nyligen (inom 2 veckor) användning av en MAO-A-hämmare [se LÄKEMEDELSINTERAKTIONER , KLINISK FARMAKOLOGI ].
- Överkänslighet mot IMITREX (angioödem och anafylaxi sett) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Svårt nedsatt leverfunktion [se KLINISK FARMAKOLOGI ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Sumatriptan binder med hög affinitet till humana klonade 5-HT1B/1D-receptorer. Sumatriptan utövar förmodligen sina terapeutiska effekter vid behandling av migrän och klusterhuvudvärk genom agonisteffekter vid 5-HT1B/1D-receptorerna på intrakraniella blodkärl och sensoriska nerver i trigeminussystemet, vilket resulterar i kranialkärlskonstriktion och hämning av pro-inflammatorisk neuropeptid släpp.
Farmakodynamik
Blodtryck
Signifikant förhöjt blodtryck, inklusive hypertensiv kris, har rapporterats hos patienter med och utan tidigare hypertoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Perifera (små) artärer
Hos friska frivilliga (N = 18) kunde en studie som utvärderade effekterna av sumatriptan på perifer (små kärl) arteriell reaktivitet inte upptäcka en kliniskt signifikant ökning av perifert motstånd.
Hjärtfrekvens
Övergående ökningar av blodtrycket som observerats hos vissa patienter i kliniska prövningar som utfördes under sumatriptans utveckling som behandling för migrän åtföljdes inte av några kliniskt signifikanta förändringar i hjärtfrekvensen.
Farmakokinetik
Absorption och biotillgänglighet
Biotillgängligheten av sumatriptan via subkutan injektion till 18 friska manliga försökspersoner var 97 % ± 16 % av den som erhölls efter intravenös injektion.
Efter en enstaka 6 mg subkutan manuell injektion i deltoideusområdet av armen hos 18 friska män (ålder: 24 ± 6 år, vikt: 70 kg), var den maximala serumkoncentrationen (Cmax) av sumatriptan (medelvärde ± standardavvikelse) 74 ± 15 ng/ml och tiden till toppkoncentration (Tmax) var 12 minuter efter injektion (intervall: 5 till 20 minuter). I detta försök gav samma dos som injicerades subkutant i låret ett Cmax på 61 ± 15 ng/ml genom manuell injektion jämfört med 52 ± 15 ng/ml med autoinjektortekniker. Tmax eller absorberad mängd förändrades inte signifikant av vare sig injektionsstället eller tekniken.
Distribution
Proteinbindningen, bestämd genom jämviktsdialys över koncentrationsintervallet 10 till 1 000 ng/ml är låg, cirka 14 % till 21 %. Effekten av sumatriptan på proteinbindningen av andra läkemedel har inte utvärderats.
Efter en 6-mg subkutan injektion i deltoideusområdet av armen hos 9 män (medelålder: 33 år, medelvikt: 77 kg) var distributionsvolymen centrala avdelningen för sumatriptan 50 ± 8 liter och distributionshalveringstiden var 15 ± 2 minuter.
Ämnesomsättning
In vitro-studier med humana mikrosomer tyder på att sumatriptan metaboliseras av MAO, främst A-isoenzymet. Det mesta av en radiomärkt dos av sumatriptan som utsöndras i urinen är huvudmetaboliten indolättiksyra (IAA) eller IAA-glukuronid, som båda är inaktiva.
Eliminering
Efter en subkutan engångsdos på 6 mg utsöndrades 22 % ± 4 % i urinen som oförändrat sumatriptan och 38 % ± 7 % som IAA-metaboliten.
Efter en 6-mg subkutan injektion i deltoideusområdet i armen var det systemiska clearance av sumatriptan 1 194 ± 149 ml/min och den terminala halveringstiden var 115 ± 19 minuter.
Specifika populationer
Ålder
Farmakokinetiken för sumatriptan hos äldre (medelålder: 72 år, 2 män och 4 kvinnor) och hos personer med migrän (medelålder: 38 år, 25 män och 155 kvinnor) liknade den hos friska manliga försökspersoner (medelålder: 30 år).
Nedsatt leverfunktion
Effekten av mild till måttlig leversjukdom på farmakokinetiken för subkutant administrerat sumatriptan har utvärderats. Det fanns inga signifikanta skillnader i farmakokinetiken för subkutant administrerat sumatriptan hos måttligt nedsatt leverfunktion jämfört med friska kontroller. Farmakokinetiken för subkutant administrerat sumatriptan hos patienter med gravt nedsatt leverfunktion har inte studerats. Användningen av IMITREX Injection i denna population är kontraindicerad [se KONTRAINDIKATIONER ].
Lopp
Det systemiska clearance och Cmax för subkutant sumatriptan var likartade hos svarta (n = 34) och kaukasiska (n = 38) friska manliga försökspersoner.
Läkemedelsinteraktionsstudier
Monoaminoxidas-A-hämmare
ett försök med 14 friska kvinnor minskade förbehandling med en MAO-A-hämmare clearance av subkutan sumatriptan, vilket resulterade i en 2-faldig ökning av arean under sumatriptans plasmakoncentration-tid-kurva (AUC), motsvarande en ökning med 40 %. i eliminationshalveringstid.
Djurtoxikologi och/eller farmakologi
Opaciteter i hornhinnan
Hundar som fick oral sumatriptan utvecklade korneala opaciteter och defekter i hornhinneepitel. Korneala opaciteter sågs vid den lägsta testade dosen, 2 mg/kg/dag, och var närvarande efter 1 månads behandling. Defekter i hornhinnans epitel noterades i en 60-veckors studie. Tidigare undersökningar för dessa toxiciteter har inte utförts och ingen effektdoser fastställdes; den relativa plasmaexponeringen vid den lägsta testade dosen var dock ungefär 3 gånger den mänskliga exponeringen efter en 6 mg subkutan dos.
Kliniska studier
Migrän
kontrollerade kliniska prövningar som inkluderade fler än 1 000 patienter under migränattacker som upplevde måttlig eller svår smärta och 1 eller fler av symtomen som räknas upp i Tabell 3, började lindring så tidigt som 10 minuter efter en 6 mg IMITREX 50 mg injektion. Lägre doser av IMITREX 100 mg injektion kan också visa sig vara effektiva, även om andelen patienter som fick adekvat lindring minskade och latensen till denna lindring är större med lägre doser.
I studie 1 jämfördes 6 olika doser av IMITREX 100 mg injektion (n = 30 varje grupp) med placebo (n = 62), i en engångsattack, parallellgruppsdesign, visade sig dos-responssambandet vara som visas i tabell 2.
2 randomiserade, placebokontrollerade kliniska prövningar av IMITREX 25 mg injektion 6 mg på 1 104 patienter med måttlig eller svår migränsmärta (Studier 2 och 3), började lindringarna mindre än 10 minuter. Lindring av huvudvärk, definierad som en minskning av smärta från svår eller måttligt svår till mild eller ingen huvudvärk, uppnåddes hos 70 % av patienterna inom 1 timme efter en subkutan engångsdos på 6 mg av IMITREX Injection. Cirka 82 % och 65 % av patienterna som behandlades med IMITREX 6 mg hade huvudvärklindring och var smärtfria inom 2 timmar.
Tabell 3 visar 1- och 2-timmars effektresultat för IMITREX-injektion 6 mg i studier 2 och 3.
IMITREX 100mg Injection lindrade också fotofobi, fonofobi (ljudkänslighet), illamående och kräkningar i samband med migränanfall. Liknande effekt sågs när patienterna själv administrerade IMITREX 50 mg injektion med IMITREX 100 mg STATdose Pen.
Effekten av IMITREX Injection påverkades inte av om migränen var associerad med aura eller inte, attackens varaktighet, kön eller ålder på patienten eller samtidig användning av vanliga migränprofylaktiska läkemedel (t.ex. betablockerare).
Hortons huvudvärk
Effekten av IMITREX Injection vid akut behandling av klusterhuvudvärk visades i 2 randomiserade, dubbelblinda, placebokontrollerade, 2-periods crossover-studier (Studier 4 och 5). Patienter i åldern 21 till 65 år inkluderades och instruerades att behandla en måttlig till mycket svår huvudvärk inom 10 minuter efter debut. Lindring av huvudvärk definierades som en minskning av svårighetsgraden av huvudvärken till mild eller ingen smärta. I båda studierna var andelen individer som fick lindring efter 10 eller 15 minuter signifikant större bland patienter som fick 6 mg IMITREX Injection jämfört med dem som fick placebo (se tabell 4).
En uppskattning av den kumulativa sannolikheten för att en patient med klusterhuvudvärk ska få lindring efter att ha behandlats med antingen IMITREX 25 mg injektion eller placebo visas i figur 1.
Figur 1: Tid till lindring av klusterhuvudvärk från Injectiona 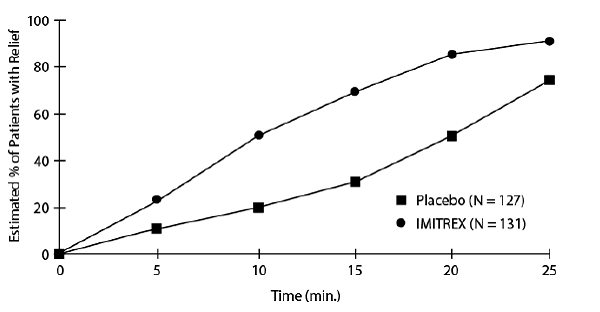
aFiguren använder Kaplan-Meier (produktgräns) Survivorship Plot. Patienter som tog räddningsmedicin censurerades efter 15 minuter.
Plottet konstruerades med data från patienter som antingen upplevde lindring eller som inte behövde (begära) räddningsmedicin inom en period av 2 timmar efter behandlingen. Som en konsekvens härleds data i diagrammet från endast en delmängd av de 258 behandlade huvudvärkarna (räddningsmedicin krävdes för 52 av de 127 placebobehandlade huvudvärkarna och 18 av de 131 huvudvärkarna som behandlades med IMITREX 50 mg injektion).
Andra data tyder på att behandling med IMITREX 25 mg injektion inte är associerad med en ökning av tidigt återkommande huvudvärk och har liten effekt på förekomsten av senare uppträdande huvudvärk (dvs de som inträffar efter 2, men före 18 eller 24 timmar).
PATIENTINFORMATION
IMITREX® (IM-i-trex) (sumatriptansuccinat) Injektion
Läs denna patientinformation innan du börjar ta IMITREX och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling.
Vilken är den viktigaste informationen jag borde veta om IMITREX?
IMITREX kan orsaka allvarliga biverkningar, inklusive:
Hjärtinfarkt och andra hjärtproblem. Hjärtproblem kan leda till döden.
Sluta ta IMITREX 25 mg och få akut medicinsk hjälp omedelbart om du har något av följande symtom på hjärtinfarkt:
- obehag i mitten av bröstet som varar i mer än några minuter, eller som försvinner och kommer tillbaka
- svår trånghet, smärta, tryck eller tyngd i bröstet, halsen, nacken eller käken
- smärta eller obehag i armar, rygg, nacke, käke eller mage
- andnöd med eller utan obehag i bröstet
- bryta ut i kallsvettning
- illamående eller kräkningar
- känner sig yr
IMITREX är inte för personer med riskfaktorer för hjärtsjukdom om inte en hjärtundersökning görs och inte visar några problem. Du har en högre risk för hjärtsjukdom om du:
- har högt blodtryck
- har höga kolesterolvärden
- rök
- är överviktiga
- har diabetes
- har en familjehistoria av hjärtsjukdomar
Vad är IMITREX?
IMITREX Injection är ett receptbelagt läkemedel som används för att behandla akut migränhuvudvärk med eller utan aura och akut klusterhuvudvärk hos vuxna som har diagnostiserats med migrän eller klusterhuvudvärk.
IMITREX 50mg används inte för att behandla andra typer av huvudvärk som hemiplegisk (som gör att du inte kan röra dig på ena sidan av kroppen) eller basilär (sällsynt form av migrän med aura) migrän.
IMITREX 100mg används inte för att förebygga eller minska antalet migrän eller klusterhuvudvärk du har.
Det är inte känt om IMITREX 100mg är säkert och effektivt för barn under 18 år.
Vem bör inte ta IMITREX 100mg?
Ta inte IMITREX 50 mg om du har:
- hjärtproblem eller en historia av hjärtproblem
- förträngning av blodkärl till dina ben, armar, mage eller njurar (perifer kärlsjukdom)
- okontrollerat högt blodtryck
- allvarliga leverproblem
- hemiplegisk migrän eller basilär migrän. Om du inte är säker på om du har dessa typer av migrän, fråga din vårdgivare.
- haft en stroke, övergående ischemiska attacker (TIA) eller problem med din blodcirkulation
- tagit något av följande läkemedel under de senaste 24 timmarna:
- almotriptan (AXERT®)
- eletriptan (RELPAX®)
- frovatriptan (FROVA®)
- naratriptan (AMERGE®)
- rizatriptan (MAXALT®, MAXALT-MLT®)
- sumatriptan och naproxen (TREXIMET®)
- ergotaminer (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihydroergotamin (DHE 45®, MIGRANAL®) Fråga din vårdgivare om du är osäker på om din medicin är listad ovan.
- allergi mot sumatriptan eller något av innehållsämnena i IMITREX. Se slutet av denna bipacksedel för en komplett lista över ingredienser i IMITREX.
Vad ska jag berätta för min vårdgivare innan jag tar IMITREX?
Innan du tar IMITREX, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har högt blodtryck
- har högt kolesterol
- har diabetes
- rök
- är överviktiga
- har hjärtproblem eller familjehistoria med hjärtproblem eller stroke
- har njurproblem
- har leverproblem
- har haft epilepsi eller anfall
- inte använder effektiv preventivmedel
- bli gravid medan du tar IMITREX
- ammar eller planerar att amma. IMITREX 25 mg passerar över i din bröstmjölk och kan skada ditt barn. Prata med din vårdgivare om det bästa sättet att mata ditt barn om du tar IMITREX.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
IMITREX och vissa andra läkemedel kan påverka varandra och orsaka allvarliga biverkningar.
Berätta särskilt för din vårdgivare om du tar antidepressiva läkemedel som heter:
- selektiva serotoninåterupptagshämmare (SSRI)
- serotonin noradrenalin återupptagshämmare (SNRI)
- tricykliska antidepressiva medel (TCA)
- monoaminoxidashämmare (MAO-hämmare)
Fråga din vårdgivare eller apotekspersonal om en lista över dessa läkemedel om du är osäker.
Vet vilka mediciner du tar. Håll en lista över dem för att visa din vårdgivare eller apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta IMITREX 100mg?
- Vissa personer bör ta sin första dos av IMITREX 25 mg på sin vårdgivares kontor eller i annan medicinsk miljö. Fråga din vårdgivare om du ska ta din första dos i en medicinsk miljö.
- Använd IMITREX 50mg exakt som din läkare säger åt dig att använda det.
- Din vårdgivare kan ändra din dos. Ändra inte din dos utan att först prata med din läkare.
- För vuxna är den vanliga dosen en injektion som ges precis under huden.
- Du bör ge en injektion så snart symtomen på din huvudvärk börjar, men den kan ges när som helst under en migrän eller en anfallshuvudvärk.
- Om du inte fick någon lättnad efter den första injektionen, ge inte en andra injektion utan att först prata med din läkare.
- Om din huvudvärk kommer tillbaka eller om du bara får en viss lindring efter din första injektion, kan du ta en andra injektion 1 timme efter den första injektionen, men inte tidigare.
- Ta inte mer än 12 mg under en 24-timmarsperiod.
- Om du använder för mycket IMITREX 25mg, ring din vårdgivare eller gå till närmaste akutmottagning direkt.
- Du bör skriva ner när du har huvudvärk och när du tar IMITREX så att du kan prata med din vårdgivare om hur IMITREX 25 mg fungerar för dig.
Vad ska jag undvika när jag tar IMITREX?
IMITREX kan orsaka yrsel, svaghet eller dåsighet. Om du har dessa symtom, kör inte bil, använd inte maskiner eller gör något där du behöver vara uppmärksam.
Vilka är de möjliga biverkningarna av IMITREX 25mg?
IMITREX kan orsaka allvarliga biverkningar. Se "Vad är den viktigaste informationen jag borde veta om IMITREX?"
Dessa allvarliga biverkningar inkluderar:
- förändringar i färg eller känsla i dina fingrar och tår (Raynauds syndrom)
- mag- och tarmproblem (gastrointestinala och koloniska ischemiska händelser). Symtom på gastrointestinala och koloniska ischemiska händelser inkluderar:
- plötslig eller svår magsmärta
- ont i magen efter måltid
- viktminskning
- illamående eller kräkningar
- förstoppning eller diarré
- blodig diarré
- feber
- problem med blodcirkulationen till dina ben och fötter (perifer vaskulär ischemi). Symtom på perifer vaskulär ischemi inkluderar:
- kramper och smärta i dina ben eller höfter
- känsla av tyngd eller stramhet i benmusklerna
- brännande eller värkande smärta i dina fötter eller tår när du vilar
- domningar, stickningar eller svaghet i benen
- kall känsla eller färgförändringar i 1 eller båda benen eller fötterna
- nässelutslag (kliande bulor); svullnad av din tunga, mun eller svalg
- medicin överanvändning huvudvärk. Vissa personer som använder för många IMITREX 100 mg-injektioner kan ha värre huvudvärk (överanvändningshuvudvärk). Om din huvudvärk blir värre kan din läkare besluta att avbryta behandlingen med IMITREX.
- serotonergt syndrom. Serotonergt syndrom är ett sällsynt men allvarligt problem som kan inträffa hos personer som använder IMITREX, särskilt om IMITREX 50 mg används tillsammans med antidepressiva läkemedel som kallas SSRI eller SNRI. Ring din vårdgivare omedelbart om du har något av följande symtom på serotonergt syndrom:
- mentala förändringar som att se saker som inte finns där (hallucinationer), agitation eller koma
- snabba hjärtslag
- förändringar i blodtrycket
- hög kroppstemperatur
- strama muskler
- problem med att gå
- anfall. Kramper har förekommit hos personer som tagit IMITREX och som aldrig har haft anfall tidigare. Prata med din vårdgivare om din chans att få anfall medan du tar IMITREX.
De vanligaste biverkningarna av IMITREX 50mg Injection inkluderar:
- smärta eller rodnad på injektionsstället
- stickningar eller domningar i fingrar eller tår
- yrsel
- varm, varm, brännande känsla i ansiktet (rodnad)
- obehag eller stelhet i nacken
- känner sig svag, dåsig eller trött
Berätta för din vårdgivare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av IMITREX. För mer information, fråga din vårdgivare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara IMITREX Injection?
- Förvara IMITREX mellan 36°F till 86°F (2°C till 30°C).
- Förvara din medicin borta från ljus.
- Förvara din medicin i förpackningen eller väskan som medföljer.
Förvara IMITREX och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av IMITREX
Läkemedel skrivs ibland ut för andra ändamål än de som anges i patientinformationsbroschyrerna. Använd inte IMITREX för ett tillstånd som det inte har ordinerats för. Ge inte IMITREX 25 mg till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna patientinformationsbroschyr sammanfattar den viktigaste informationen om IMITREX. Om du vill ha mer information, prata med din vårdgivare. Du kan be din vårdgivare eller apotekspersonal om information om IMITREX som är skriven för vårdpersonal.
För mer information, gå till www.gsk.com eller ring 1-888-825-5249.
Vilka är ingredienserna i IMITREX Injection?
Aktiv ingrediens: sumatriptansuccinat
Inaktiva ingredienser: natriumklorid, vatten för injektionsvätskor
Denna patientinformation och bruksanvisning har godkänts av US Food and Drug Administration.
Bruksanvisning för patienten
IMITREX STAT dossystem
Läs denna bruksanvisning för patienten innan du börjar använda IMITREX STATdose System. Det kan komma ny information. Denna information ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling. Du och din vårdgivare bör prata om IMITREX 25mg Injection när du börjar ta det och vid regelbundna kontroller.
Förvara IMITREX STATdose System utom räckhåll för barn.
Innan du använder IMITREX STATdose System
När du först öppnar IMITREX 25mg STATdose System-lådan, finns kassettförpackningen och IMITREX STATdose Pen® redan i bärväskan för din bekvämlighet.
Det gråa och blåa Bärväska används för att förvara den oladdade pennan och patronförpackningen när de inte används.
De Patronpaket rymmer 2 st individuellt förseglade Sprutpatroner Varje sprutampull rymmer 1 dos av IMITREX® (sumatriptansuccinat) injektion. Patronförpackningen för styrkan på 4 mg av detta läkemedel är gul och patronförpackningen för styrkan på 6 mg är blå (enligt bilden). Påfyllningskassetter finns tillgängliga.
Det gråa och blåa Penna används för att automatiskt injicera 1 dos läkemedel från en sprutampull. Rör inte vid Blå knapp tills du har tryckt pennan mot huden för att ge en dos. Om du trycker på den vid något annat tillfälle kan du förlora en dos. De Säkerhetsspärr förhindrar att pennan avfyras av misstag tills du är redo. Pennan fungerar bara när du skjuter ner den grå delen av cylindern till den blå delen. Kontrollera alltid att den vita primerstaven inte sticker ut från änden av pennan (som visas i figur B) innan du laddar en ny sprutkassett. Om det sticker ut kommer du att förlora den dosen.
Hur man laddar IMITREX STATdose Pen
Ladda inte pennan förrän du är redo att ge dig själv en injektion. Rör inte den blå knappen ovanpå pennan (se figur A) medan du laddar pennan.
Bild A 
Bild B 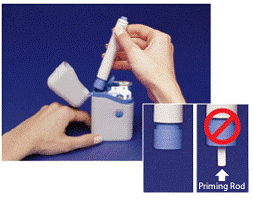
1. Öppna locket på bärväskan. De manipuleringssäkra förseglingarna över de 2 sprutpatronerna är märkta "A" och "B" (se Figur A infälld ).
Använd alltid sprutpatronen märkt "A" före den märkt "B" för att hjälpa dig hålla reda på dina doser. Använd inte om någon av förseglingarna är brutna eller saknas när du först öppnar bärväskan.
2. Riv av en av de manipuleringssäkra tätningarna (se Bild A ). Kasta bort förseglingen. Öppna locket över sprutpatronen.
3. Håll pennan i åsarna upptill. Ta ut pennan ur väskan (se Bild B ).
Kontrollera att den vita primerstaven inte sticker ut från pennans nedre ände (se Figur B infälld ). Om den sticker ut, sätt tillbaka pennan i bärväskan och tryck ned ordentligt tills du känner att den klickar. Ta ut pennan ur bärväskan.
Bild C 
4. Lägg pennan i patronförpackningen. Vrid den åt höger (medurs) tills den inte kommer att vrida mer (cirka ett halvt varv) (se Bild C ).
5. Håll den laddade pennan i åsarna och dra den rakt ut (se Bild D ). Du kan behöva dra hårt i pennan, men detta är normalt. Tryck inte på den blå knappen ännu.
Bild D 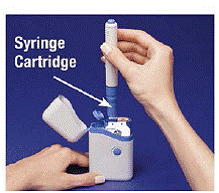
Pennan är nu redo att användas. Låt bli sätt tillbaka den laddade pennan i bärväskan eftersom det kommer att skada nålen.
Hur du använder IMITREX STAT dose Pen för att ta din medicin
Innan du injicerar din medicin, välj ett område med ett fettskikt (se figur E eller figur F). Fråga din vårdgivare om du har frågor om var du ska injicera din medicin.
För att förbereda det hudområde där IMITREX ska injiceras, torka av injektionsstället med en spritservett. Rör inte detta område igen innan du ger injektionen.
Figur E eller Figur F Figur G 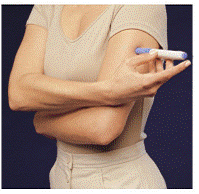
6. Utan att trycka på den blå knappen, tryck den laddade pennan stadigt mot huden så att den grå cylindern glider ned mot den blå sektionen som håller sprutpatronen (se Bild D ). (Detta frigör säkerhetsspärren som förhindrar att pennan avfyras av misstag tills du är redo.)
7. Tryck på den blå knappen. Håll pennan stilla minst 5 sekunder . Om pennan tas bort från huden för tidigt kommer inte all medicin att komma ut.
8 Efter 5 sekunder , ta försiktigt bort pennan från huden. Nålen kommer att visas (se Bild G ). Rör inte vid nålen.
Hur man laddar ur IMITREX STAT dose Pen efter att ha tagit din medicin
Direkt efter att du tagit en dos med pennan måste du lämna tillbaka den använda sprutpatronen till patronförpackningen.
Figur H Figur I och Figur J 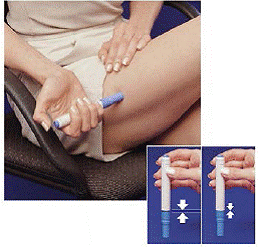
9. Tryck ner pennan i den tomma sidan av patronförpackningen så långt det går (se Bild H ).
10. Vrid pennan åt vänster (moturs) ungefär ett halvt varv tills den frigörs från sprutpatronen (se Figur I ).
11. Dra ut den tomma pennan ur patronförpackningen (se Bild J ).
Eftersom pennan nu har använts kommer den vita primingsstaven att sticka ut från pennans nedre ände (se Bild J ).
12. Stäng locket till patronförpackningen över den använda sprutpatronen. När de använda sprutpatronerna är isatta på rätt sätt är patronförpackningen ett skyddsfodral för engångsbruk som hjälper dig att undvika nålstick och använda sprutorna på rätt sätt.
13. Sätt tillbaka pennan i bärväskan och tryck ner den ordentligt tills du känner att den klickar. Stäng locket till bärväskan. Detta gör pennan redo för nästa användning.
Om locket inte går att stänga, tryck ner pennan tills du känner att den klickar. Stäng sedan locket.
Hur man tar ut ett använt patronpaket
Efter att båda sprutpatronerna har använts, ta ut patronförpackningen ur bärväskan. Återanvänd eller återvinn aldrig en sprutkassett.
Figur K Figur L 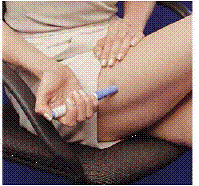
14. Öppna locket till bärväskan.
15. Håll i bärväskan med en hand och tryck på de 2 knapparna på vardera sidan av bärväskan (se Bild K ).
16. Dra försiktigt ut patronförpackningen med den andra handen (se Bild L ).
17. Kasta kassettförpackningen eller kassera den enligt instruktioner från din läkare. Det kan finnas särskilda statliga och lokala lagar för kassering av använda nålar och sprutor. Förvara alltid utom räckhåll för barn.
Så här sätter du i ett nytt patronpaket
Figur M Figur N och Figur O 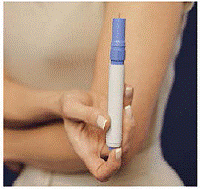
18. Ta ut den nya patronförpackningen ur kartongen. Ta inte av de manipuleringssäkra tätningarna (se figur M).
19. Lägg patronpaketet i bärväskan. Skjut ner den mjukt (se Bild N ).
20. Patronpaketet klickar på plats när de två knapparna syns genom hålen i bärväskan (se Bild O ). Stäng locket.
Denna patientinformation och bruksanvisning har godkänts av US Food and Drug Administration.
