Smärtstillande: Lioresal 10mg, 25mg Baclofen Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Lioresal 10mg Intrathecal och hur används det?
Lioresal Intrathecal är ett receptbelagt läkemedel som används för att behandla symtom på spasticitet. Lioresal Intrathecal kan användas ensamt eller tillsammans med andra läkemedel.
Lioresal Intrathecal tillhör en klass av läkemedel som kallas skelettmuskelavslappnande medel.
Det är inte känt om Lioresal Intrathecal är säkert och effektivt för barn yngre än 12 år.
Vilka är de möjliga biverkningarna av Lioresal 25mg Intrathecal?
Lioresal 10mg Intrathecal kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- svår dåsighet,
- svag eller ytlig andning,
- förvirring,
- hallucinationer,
- klåda, stickningar eller ryckningar i händer, armar, fötter eller ben,
- feber och
- beslag
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Lioresal 25mg Intrathecal inkluderar:
- dåsighet,
- yrsel,
- svaghet,
- trötthet,
- huvudvärk,
- sömnproblem (sömnlöshet),
- illamående,
- förstoppning och
- kissa oftare än vanligt
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Lioresal Intrathecal. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Plötsligt avbrytande av intratekalt baklofen, oavsett orsak, har resulterat i följdsjukdomar som inkluderar hög feber, förändrad mental status, överdriven rebound spasticitet och muskelstelhet, som i sällsynta fall har utvecklats till rabdomyolys, multipel organsystemsvikt och död.
Förebyggande av abrupt utsättande av intratekalt baklofen kräver noggrann uppmärksamhet vid programmering och övervakning av infusionssystemet, schemaläggning och procedurer för påfyllning samt pumplarm. Patienter och vårdgivare bör informeras om vikten av att hålla schemalagda påfyllningsbesök och bör utbildas om de tidiga symtomen på baklofenabstinens. Särskild uppmärksamhet bör ges till patienter med uppenbar risk (t.ex. ryggmärgsskador vid T-6 eller högre, kommunikationssvårigheter, anamnese med abstinenssymtom från oralt eller intratekalt baklofen). Se den tekniska manualen för det implanterbara infusionssystemet för ytterligare information om postimplantatläkare och patient (se VARNINGAR ).
BESKRIVNING
LIORESAL INTRATHECAL (baklofeninjektion) är ett muskelavslappnande och antispastiskt medel. Dess kemiska namn är 4-amino-3-(4-klorfenyl) butansyra, och dess strukturformel är:
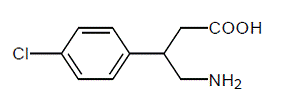
Baklofen är ett vitt till benvitt, luktfritt eller praktiskt taget luktfritt kristallint pulver, med en molekylvikt på 213,66. Det är svagt lösligt i vatten, mycket svagt lösligt i metanol och olösligt i kloroform.
LIORESAL INTRATHECAL är en steril, pyrogenfri, isotonisk lösning fri från antioxidanter, konserveringsmedel eller andra potentiellt neurotoxiska tillsatser endast indicerade för intratekal administrering. Läkemedlet är stabilt i lösning vid 37°C och kompatibelt med CSF. Varje milliliter LIORESAL INTRATHECAL innehåller baklofen USP 50 mcg, 500 mcg eller 2000 mcg och natriumklorid 9 mg i vatten för injektion; pH-intervallet är 5,0 - 7,0. Varje ampull är ENDAST avsedd för ENSANVÄNDNING. Kassera eventuell oanvänd del. AUTOKLAVERA INTE.
INDIKATIONER
LIORESAL 10mg INTRATHECAL (baklofeninjektion) är indicerat för behandling av svår spasticitet. Patienter bör först svara på en screeningdos av intratekal baklofen innan långtidsinfusion övervägs via en implanterbar pump. För spasticitet av ryggmärgsursprung, bör kronisk infusion av LIORESAL INTRATHECAL via en implanterbar pump reserveras för patienter som inte svarar på oral baklofenbehandling, eller de som upplever outhärdliga CNS-biverkningar vid effektiva doser. Patienter med spasticitet på grund av traumatisk hjärnskada bör vänta minst ett år efter skadan innan långvarig intratekal baklofenbehandling övervägs. LIORESAL INTRATHECAL är avsedd för intratekal användning i enstaka bolustestdoser (via spinalkateter eller lumbalpunktion) och, för kronisk användning, endast i implanterbara pumpar som godkänts av FDA specifikt för administrering av LIORESAL INTRATHECAL i det intratekala utrymmet.
Spasticitet av ryggmärgsursprung
Bevis som stöder effekten av LIORESAL INTRATHECAL erhölls i randomiserade, kontrollerade undersökningar som jämförde effekterna av antingen en enstaka intratekal dos eller en tre dagars intratekal infusion av LIORESAL INTRATHECAL med placebo hos patienter med svår spasticitet och spasmer på grund av antingen ryggmärgstrauma eller multipla skleros. LIORESAL 10 mg INTRATHECAL var överlägset placebo på båda de huvudsakliga utfallsmåtten som användes: förändring från baslinjen i Ashworth-bedömningen av spasticitet och frekvensen av spasmer.
Spasticitet av cerebralt ursprung
Effekten av LIORESAL INTRATHECAL undersöktes i tre kontrollerade kliniska prövningar; två inskrivna patienter med cerebral pares och en inskrivna patienter med spasticitet på grund av tidigare hjärnskada. Den första studien, en randomiserad kontrollerad cross-over-studie av 51 patienter med cerebral pares, gav starka, statistiskt signifikanta resultat; LIORESAL INTRATHECAL var överlägsen placebo när det gällde att minska spasticiteten mätt med Ashworth-skalan. En andra cross-over-studie genomfördes på 11 patienter med spasticitet till följd av hjärnskada. Trots den lilla urvalsstorleken gav studien en nästan signifikant teststatistik (p= 0,066) och gav riktade gynnsamma resultat. Den senaste studien gav dock inte data som kunde analyseras tillförlitligt.
LIORESAL 10 mg INTRATEKAL terapi kan anses vara ett alternativ till destruktiva neurokirurgiska ingrepp. Före implantation av en enhet för kronisk intratekal infusion av LIORESAL 10 mg INTRATHECAL måste patienterna visa ett svar på LIORESAL 10 mg INTRATHECAL i en screeningstudie (se DOSERING OCH ADMINISTRERING ).
DOSERING OCH ADMINISTRERING
Se tillverkarens manual för den implanterbara pumpen som är godkänd för intratekal infusion för specifika instruktioner och försiktighetsåtgärder för programmering av pumpen och/eller påfyllning av behållaren. Det finns olika pumpar med varierande reservoarvolymer och det finns olika påfyllningssatser tillgängliga. Det är viktigt att vara bekant med alla dessa produkter för att kunna välja lämplig påfyllningssats för just den pump som används.
Screeningsfas
Före pumpimplantation och initiering av kronisk infusion av LIORESAL INTRATHECAL (baklofeninjektion), måste patienter visa ett positivt kliniskt svar på en LIORESAL INTRATHECAL bolusdos administrerad intratekalt i en screeningstudie. Screeningstudien använder LIORESAL INTRATHECAL i en koncentration av 50 mcg/ml. En 1 ml ampull (50 mcg/ml) finns tillgänglig för användning i screeningförsöket. Screeningsproceduren är som följer. En initial bolus innehållande 50 mikrogram i en volym av 1 milliliter administreras i det intratekala utrymmet genom barbotage under en period av minst en minut. Patienten observeras under de efterföljande 4 till 8 timmarna. Ett positivt svar består av en signifikant minskning av muskeltonus och/eller frekvens och/eller svårighetsgrad av spasmer. Om det initiala svaret är mindre än önskat, kan en andra bolusinjektion ges 24 timmar efter den första. Den andra screeningbolusdosen består av 75 mikrogram i 1,5 milliliter. Återigen bör patienten observeras i ett intervall på 4 till 8 timmar. Om svaret fortfarande är otillräckligt kan en slutlig bolusscreeningsdos på 100 mikrogram i 2 milliliter administreras 24 timmar senare.
Pediatriska patienter
Startdosen för screening för pediatriska patienter är densamma som för vuxna patienter, dvs. 50 mikrogram. För mycket små patienter kan dock en screeningdos på 25 mikrogram testas först. Patienter som inte svarar på en 100 mikrogram intratekal bolus bör inte anses vara kandidater för en implanterad pump för kronisk infusion.
Dostitreringsperiod efter implantatet
För att bestämma den initiala totala dagliga dosen av LIORESAL INTRATHECAL efter implantation bör screeningsdosen som gav positiv effekt fördubblas och administreras under en 24-timmarsperiod, såvida inte effekten av bolusdosen bibehölls i mer än 8 timmar, då Om den dagliga startdosen bör vara screeningsdosen som ges under en 24-timmarsperiod. Inga dosökningar ska ges under de första 24 timmarna (dvs tills steady state uppnåtts).
Vuxna patienter med spasticitet av ryggmärgsursprung
Efter de första 24 timmarna, för vuxna patienter, bör den dagliga dosen ökas långsamt med 10-30 % steg och endast en gång var 24:e timme, tills önskad klinisk effekt uppnås.
Vuxna patienter med spasticitet av cerebralt ursprung
Efter de första 24 timmarna ska den dagliga dosen ökas långsamt med 5-15 % endast en gång var 24:e timme, tills önskad klinisk effekt uppnås.
Pediatriska patienter
Efter de första 24 timmarna ska den dagliga dosen ökas långsamt med 5-15 % endast en gång var 24:e timme, tills önskad klinisk effekt uppnås. Om det inte finns ett väsentligt kliniskt svar på ökningar av den dagliga dosen, kontrollera att pumpen fungerar korrekt och att katetern är öppen. Patienter måste övervakas noggrant i en fullt utrustad och bemannad miljö under screeningsfasen och dostitreringsperioden omedelbart efter implantation. Återupplivningsutrustning bör vara omedelbart tillgänglig för användning vid livshotande eller outhärdliga biverkningar.
Underhållsterapi
Spasticitet hos patienter med ryggmärgsursprung
Det kliniska målet är att bibehålla muskeltonus så nära normal som möjligt, och att minimera frekvensen och svårighetsgraden av spasmer i möjligaste mån, utan att framkalla oacceptabla biverkningar. Mycket ofta behöver underhållsdosen justeras under de första månaderna av behandlingen medan patienterna anpassar sig till förändringar i livsstil på grund av att spasticitet lindras. Under periodiska påfyllningar av pumpen kan den dagliga dosen ökas med 10-40 %, men inte mer än 40 %, för att upprätthålla adekvat symtomkontroll. Den dagliga dosen kan minskas med 10-20 % om patienter upplever biverkningar. De flesta patienter kräver gradvisa ökningar av dosen över tid för att bibehålla optimalt svar under kronisk behandling. Ett plötsligt stort behov av dosupptrappning tyder på en kateterkomplikation (dvs kateterveck eller förskjutning).
Underhållsdosering för långtidskontinuerlig infusion av LIORESAL 10 mg INTRATHECAL (baklofeninjektion) har varierat från 12 mikrogram/dag till 2003 mikrogram/dag, med de flesta patienter adekvat bibehållen på 300 mikrogram till 800 mikrogram per dag. Det finns begränsad erfarenhet av dagliga doser över 1000 mikrogram/dag. Bestämning av den optimala dosen LIORESAL INTRATEKAL kräver individuell titrering. Den lägsta dosen med optimalt svar bör användas.
Spasticitet hos patienter med cerebralt ursprung
Det kliniska målet är att bibehålla muskeltonus så nära normal som möjligt och att minimera frekvensen och svårighetsgraden av spasmer så långt det är möjligt, utan att framkalla oacceptabla biverkningar, eller att titrera dosen till önskad grad av muskeltonus för optimala funktioner. Mycket ofta behöver underhållsdosen justeras under de första månaderna av behandlingen medan patienterna anpassar sig till förändringar i livsstil på grund av att spasticiteten lindras. Under periodiska påfyllningar av pumpen kan den dagliga dosen ökas med 5-20 %, men inte mer än 20 %, för att bibehålla adekvat symtomkontroll. Den dagliga dosen kan minskas med 10-20 % om patienter upplever biverkningar. Många patienter kräver gradvis ökning av dosen över tid för att bibehålla optimalt svar under kronisk behandling. Ett plötsligt stort behov av dosupptrappning tyder på en kateterkomplikation (dvs kateterveck eller förskjutning).
Underhållsdosering för långtidskontinuerlig infusion av LIORESAL 25 mg INTRATHECAL (baklofeninjektion) har varierat från 22 mikrogram/dag till 1400 mikrogram/dag, med de flesta patienter tillräckligt upprätthållna på 90 mikrogram till 703 mikrogram per dag. I kliniska prövningar behövde endast 3 av 150 patienter dagliga doser över 1000 mikrogram/dag.
Pediatriska patienter
Använd samma doseringsrekommendationer för patienter med spasticitet av cerebralt ursprung. Pediatriska patienter under 12 år verkade kräva en lägre daglig dos i kliniska prövningar. Den genomsnittliga dagliga dosen för patienter under 12 år var 274 mikrogram/dag, med ett intervall på 24 till 1199 mikrogram/dag. Dosbehovet för pediatriska patienter över 12 år verkar inte skilja sig från det för vuxna patienter. Bestämning av den optimala dosen LIORESAL INTRATEKAL kräver individuell titrering. Den lägsta dosen med optimalt svar bör användas.
Potentiellt behov av dosjusteringar vid kronisk användning
Under långtidsbehandling blir cirka 5 % (28/627) av patienterna refraktära mot ökande doser. Det finns inte tillräcklig erfarenhet för att ge bestämda rekommendationer för toleransbehandling; denna "tolerans" har dock ibland behandlats på sjukhus med en "läkemedelssemester" bestående av en gradvis minskning av LIORESAL 25 mg INTRATHECAL under en period på 2 till 4 veckor och byte till alternativa metoder för spasticitetsbehandling. Efter "läkemedelssemestern" kan LIORESAL INTRATHECAL återupptas vid den initiala kontinuerliga infusionsdosen.
Stabilitet
Parenterala läkemedelsprodukter bör inspekteras med avseende på partiklar och missfärgning före administrering, närhelst lösning och behållare tillåter.
Leveransspecifikationer
Den specifika koncentrationen som ska användas beror på den totala dagliga dosen som krävs samt pumpens leveranshastighet. LIORESAL 10mg INTRATHECAL kan kräva utspädning vid användning med vissa implanterbara pumpar. Se tillverkarens manual för specifika rekommendationer.
Förberedelseinstruktion
Undersökning
Använd endast 1 mL screeningampullen (50 mcg/ml) för bolusinjektion i subaraknoidalutrymmet. För en bolusdos på 50 mcg, använd 1 ml av screeningampullen. Använd 1,5 mL 50 mcg/ml baklofeninjektion för en 75 mcg bolusdos. För den maximala screeningsdosen på 100 mcg, använd 2 mL 50 mcg/ml baklofeninjektion (2 screeningampuller).
Underhåll
För patienter som kräver andra koncentrationer än 500 mcg/ml eller 2000 mcg/ml, LIORESAL INTRATHECAL måste spädas ut .
LIORESAL 10mg INTRATEKAL måste spädas ut med sterilt konserveringsmedelsfritt natriumklorid för injektion, USP
Leveransregimen
LIORESAL 10mg INTRATHECAL administreras oftast i ett kontinuerligt infusionsläge omedelbart efter implantation. För de patienter som implanterats med programmerbara pumpar som har uppnått relativt tillfredsställande kontroll vid kontinuerlig infusion, kan ytterligare fördelar uppnås med mer komplexa scheman för LIORESAL INTRATHECAL-tillförsel. Till exempel kan patienter som har ökade spasmer på natten behöva en 20 % ökning av sin infusionshastighet per timme. Ändringar i flödeshastigheten bör programmeras att starta två timmar före tidpunkten för önskad klinisk effekt.
HUR LEVERERAS
LIORESAL INTRATHECAL (baklofeninjektion) är förpackad i ampuller för engångsbruk som innehåller 0,05 mg/1 mL (50 mcg/ml), 10 mg/20 mL (500 mcg/mL), 10 mg/5 mL (2000 mcg/ml) eller 40 mg/20 mL ( 2000 mcg/ml) levereras enligt följande:
Screeningsdos (modell 8563s): fem ampuller som vardera innehåller 0,05 mg/1 ml (50 mcg/ml) ( NDC 70257-562-55).
LIORESAL INTRATHECAL (baklofeninjektion) Refill Kit Varje påfyllningssats innehåller den angivna mängden LIORESAL INTRATHECAL, ett läkemedelsberedningskit, ett pumppåfyllningssats med tillbehör som är kompatibla med Medtronic SynchroMed® infusionssystem och tillhörande instruktioner.
Modell 8561 : en ampull innehållande 10 mg/20 mL (500 mcg/mL) ( NDC 70257-560-01).
Modell 8562 : två ampuller, var och en innehåller 10 mg/5 mL (2000 mcg/mL) ( NDC 70257-561-02).
Modell 8564 : en ampull innehållande 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-01).
Modell 8565 : två ampuller, var och en innehåller 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-02).
Modell 8566 : två ampuller, var och en innehåller 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-02).
Lagring
Kräver inte kylning.
Förvara inte över 86°F (30°C).
Frys inte.
Värmesterilisera inte.
Distribuerat av: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Reviderad: Jan 2019
BIEFFEKTER
Spasticitet av ryggmärgsursprung - kliniska studier
Vanligtvis observerat hos patienter med spasticitet av spinalt ursprung
I kliniska prövningar före och efter marknadsföring var de vanligast observerade biverkningarna i samband med användning av LIORESAL 25 mg INTRATHECAL (baklofeninjektion) som inte sågs i en likvärdig incidens bland placebobehandlade patienter: somnolens, yrsel, illamående, hypotoni, huvudvärk, kramper och hypotoni.
I samband med avbrytande av behandling
8/474 patienter med spasticitet av ryggmärgsursprung som fick långtidsinfusion av LIORESAL 25 mg INTRATHECAL i kliniska studier före och efter marknadsföring i USA avbröt behandlingen på grund av biverkningar. Dessa inkluderar: pumpfickainfektioner (3), meningit (2), såravfall (1), gynekologiska myom (1) och pumpövertryck (1) med okända, om några, följdsjukdomar. Elva patienter som utvecklade koma sekundärt till överdosering fick sin behandling tillfälligt avbruten, men alla återupptogs därefter och ansågs därför inte vara riktiga avbrott.
Dödsfall
Ser VARNINGAR .
Förekomst i kontrollerade försök
Erfarenhet av LIORESAL INTRATHECAL (baklofeninjektion) erhållen i parallella, placebokontrollerade, randomiserade studier ger endast en begränsad grund för att uppskatta förekomsten av biverkningar eftersom studierna var av mycket kort varaktighet (upp till tre dagars infusion) och endast involverade en totalt 63 patienter. Följande händelser inträffade bland de 31 patienter som fick LIORESAL INTRATHECAL (baklofeninjektion) i två randomiserade, placebokontrollerade studier: hypotoni (2), yrsel (2), huvudvärk (2), dyspné (1). Inga biverkningar rapporterades bland de 32 patienter som fick placebo i dessa studier.
Händelser som observerats under utvärderingen av LIORESAL INTRATHECAL före och efter marknadsföring
Biverkningar associerade med användning av LIORESAL 25 mg INTRATHECAL återspeglar erfarenheter från 576 patienter som följdes prospektivt i USA. De fick LIORESAL INTRATHECAL under perioder på en dag (screening) (N = 576) till över åtta år (underhåll) (N = 10). Den vanliga screeningbolusdosen som administrerades före pumpimplantation i dessa studier var vanligtvis 50 mikrogram. Underhållsdosen varierade från 12 mcg till 2003 mcg per dag. På grund av upplevelsens öppna, okontrollerade karaktär kan ett orsakssamband mellan observerade händelser och administrering av LIORESAL INTRATHECAL inte tillförlitligt bedömas i många fall och många av de rapporterade biverkningarna är kända för att inträffa i samband med de underliggande tillstånd som behandlas. Icke desto mindre verkar många av de vanligare rapporterade reaktionerna - hypotoni, somnolens, yrsel, parestesi, illamående/kräkningar och huvudvärk - tydligt läkemedelsrelaterade.
Biverkningar som rapporterats under alla amerikanska studier (både kontrollerade och okontrollerade) visas i följande tabell. Åtta av 474 patienter som fick kronisk infusion via implanterade pumpar hade biverkningar som ledde till att långtidsbehandlingen avbröts i studierna före och efter marknadsföringen.
FÖREKOMST AV VANLIGASTE (≥1 %) BIVERKNINGAR HOS PATIENTER MED SPASTICITET AV SPINALT URSPRUNG I PROSPECTIVT ÖVERVAKADE KLINISKA FÖRSÖK
Utöver de vanligare (1 % eller fler) biverkningar som rapporterats hos de prospektivt följt 576 inhemska patienter i studier före och efter marknadsföring, har erfarenhet från ytterligare 194 patienter exponerade för LIORESAL 25 mg INTRATHECAL (baklofeninjektion) från utländska studier. rapporterats. Följande biverkningar, som inte beskrivs i tabellen, och ordnade i fallande frekvens, och klassificerade efter kroppssystem, rapporterades:
Nervsystem: Onormal gång, tänkande onormalt, tremor, minnesförlust, ryckningar, vasodilitation, cerebrovaskulär olycka, nystagmus, personlighetsstörning, psykotisk depression, cerebral ischemi, emotionell labilitet, eufori, hypertoni, ileus, drogberoende, inkoordination, paranoid reaktion och ptos.
Matsmältningssystemet: Flatulens, dysfagi, dyspepsi och gastroenterit.
Kardiovaskulär: Postural hypotoni, bradykardi, hjärtklappning, synkope, ventrikulär arytmi, djup tromboflebit, blekhet och takykardi.
Andningsvägar: Andningsstörning, aspirationspneumoni, hyperventilation, lungemboli och rinit.
Urogenital: Hematuri och njursvikt.
Hud och bihang: Alopeci och svettning.
Metaboliska och näringsmässiga störningar: Viktminskning, albuminuri, uttorkning och hyperglykemi.
Särskilda sinnen: Onormal syn, abnormitet av boende, fotofobi, smakförlust och tinnitus.
Kroppen som helhet: Självmord, bristande läkemedelseffekt, buksmärtor, hypotermi, nackstelhet, bröstsmärtor, frossa, ansiktsödem, influensasyndrom och överdosering.
Hemiska och lymfatiska systemet: Anemi.
Spasticitet av cerebralt ursprung - kliniska studier
Vanligt observerad
I kliniska prövningar före marknadsintroduktion inkluderade de vanligaste observerade biverkningarna i samband med användning av LIORESAL 25 mg INTRATHECAL (baklofeninjektion) som inte sågs i en motsvarande incidens bland placebobehandlade patienter: agitation, förstoppning, somnolens, leukocytos, frossa, urinvägar retention och hypotoni.
I samband med avbrytande av behandling
Nio av 211 patienter som fick LIORESAL INTRATHECAL i pre-marketing kliniska studier i USA avbröt långtidsinfusionen på grund av biverkningar i samband med intratekal behandling.
De nio biverkningarna som ledde till utsättning av behandlingen var: infektion (3), CSF-läckor (2), meningit (2), dränering (1) och ohanterlig bålkontroll (1).
Dödsfall
Tre dödsfall, varav ingen tillskrevs LIORESAL 10 mg INTRATHECAL, rapporterades hos patienter i kliniska prövningar som involverade patienter med spasticitet av cerebralt ursprung. Ser Varningar för andra dödsfall som rapporterats hos patienter med spinal spasticitet .
Förekomst i kontrollerade försök
Erfarenhet av LIORESAL INTRATHECAL (baklofeninjektion) erhållen i parallella, placebokontrollerade, randomiserade studier ger endast en begränsad grund för att uppskatta förekomsten av biverkningar eftersom studierna omfattade totalt 62 patienter som exponerades för en enstaka 50 mikrogram intratekal bolus. Följande händelser inträffade bland de 62 patienter som fick LIORESAL 10 mg INTRATHECAL i två randomiserade, placebokontrollerade prövningar som involverade patienter med cerebral pares respektive huvudskada: agitation, förstoppning, somnolens, leukocytos, illamående, kräkningar, nystagmus, urinretention, frossa hypotoni.
Händelser som observerats under utvärderingen av LIORESAL 25mg INTRATHECAL före marknadsföringen
Biverkningar associerade med användningen av LIORESAL INTRATHECAL återspeglar erfarenheter från totalt 211 amerikanska patienter med spasticitet av cerebralt ursprung, av vilka 112 var pediatriska patienter (under 16 år vid inskrivningen). De fick LIORESAL INTRATHECAL under perioder av en dag (screening) (N=211) till 84 månader (underhåll) (N=1). Den vanliga screeningbolusdosen som administrerades före pumpimplantation i dessa studier var 50-75 mikrogram. Underhållsdosen varierade från 22 mcg till 1400 mcg per dag. Doser som används i denna patientpopulation för långtidsinfusion är i allmänhet lägre än de som krävs för patienter med spasticitet av ryggmärgsursprung.
På grund av upplevelsens öppna, okontrollerade karaktär kan ett orsakssamband mellan observerade händelser och administreringen av LIORESAL INTRATHECAL inte tillförlitligt bedömas i många fall. Icke desto mindre verkar många av de vanligare rapporterade reaktionerna - somnolens, yrsel, huvudvärk, illamående, hypotoni, hypotoni och koma - tydligt läkemedelsrelaterade.
De vanligaste (≥1%) biverkningarna som rapporterats under alla kliniska prövningar visas i följande tabell. Nio patienter avbröt långtidsbehandlingen på grund av biverkningar.
FÖREKOMST AV VANLIGASTE (≥ 1 %) BIVERKNINGAR HOS PATIENTER MED SPASTICITET AV CEREBRAL URSPRUNG I PROSPECTIVT ÖVERVAKADE KLINISKA FÖRSÖK
De vanligare (1 % eller fler) biverkningar som rapporterats hos de prospektivt följda 211 patienter som exponerats för LIORESAL 25 mg INTRATHECAL (baklofeninjektion) har rapporterats. I den totala kohorten rapporterades följande biverkningar, inte beskrivna i tabellen och ordnade i fallande frekvens, och klassificerade efter kroppssystem:
Nervsystem: Akatisi, ataxi, förvirring, depression, opisthotonos, amnesi, ångest, hallucinationer, hysteri, sömnlöshet, nystagmus, personlighetsstörning, minskade reflexer och vasodilitation.
Matsmältningssystemet: Dysfagi, fekal inkontinens, gastrointestinala blödningar och tungstörning.
Kardiovaskulär: Bradykardi.
Andningsvägar: Apné, dyspné och hyperventilation.
Urogenital: Onormal ejakulation, njursten, oliguri och vaginit.
Hud och bihang: Utslag, svettning, håravfall, kontakteksem och hudsår.
Särskilda sinnen: Onormalt boende.
Kroppen som helhet: Död, feber, buksmärtor, karcinom, sjukdomskänsla och hypotermi.
Hemiska och lymfatiska systemet: Leukocytos och petekialutslag.
Erfarenhet efter marknadsföring
Följande biverkningar har rapporterats efter användning av LIORESAL INTRATHECAL efter godkännande. Eftersom dessa händelser rapporteras frivilligt från en population av osäker storlek är det inte möjligt att på ett tillförlitligt sätt uppskatta deras frekvens.
Muskuloskeletala
Debut av skolios eller försämring av en redan existerande skolios har rapporterats.
Urogenital
Sexuell dysfunktion hos män och kvinnor, inklusive minskad libido och orgasmdysfunktion, har rapporterats. Erektil dysfunktion hos män har också rapporterats. Priapism har rapporterats efter utsättning av baklofen.
LÄKEMEDELSINTERAKTIONER
Det finns otillräcklig systematisk erfarenhet av användning av LIORESAL INTRATHECAL i kombination med andra läkemedel för att förutsäga specifika läkemedelsinteraktioner. Interaktioner som tillskrivs den kombinerade användningen av LIORESAL INTRATHECAL och epiduralt morfin inkluderar hypotoni och dyspné.
VARNINGAR
LIORESAL INTRATHECAL är för användning vid intratekala enstaka bolusinjektioner (via en kateter placerad i det lumbala intratekala utrymmet eller injektion genom lumbalpunktion) och i implanterbara pumpar som är godkända av FDA specifikt för intratekal administrering av baklofen. På grund av risken för potentiellt livshotande CNS-depression, kardiovaskulär kollaps och/eller andningssvikt måste läkare utbildas på adekvat sätt i kronisk intratekal infusionsbehandling.
Pumpsystemet ska inte implanteras förrän patientens svar på bolus LIORESAL 10 mg INTRATHECAL-injektion har utvärderats adekvat. Utvärdering (bestående av ett screeningförfarande: se DOSERING OCH ADMINISTRERING kräver att LIORESAL 25 mg INTRATHECAL administreras i det intratekala utrymmet via en kateter eller lumbalpunktion. På grund av riskerna förknippade med screeningproceduren och justeringen av dosen efter pumpimplantation, måste dessa faser utföras i en medicinskt övervakad och adekvat utrustad miljö enligt instruktionerna i avsnittet Dosering och administrering.
Återupplivningsutrustning bör finnas tillgänglig.
Efter kirurgisk implantation av pumpen, särskilt under de inledande faserna av pumpanvändning, bör patienten övervakas noggrant tills det är säkert att patientens svar på infusionen är acceptabelt och någorlunda stabilt.
Vid varje tillfälle som pumpens doseringshastighet och/eller koncentrationen av LIORESAL INTRATHECAL (baklofeninjektion) i behållaren justeras, krävs noggrann medicinsk övervakning tills det är säkert att patientens svar på infusionen är acceptabelt och någorlunda stabilt.
Det är obligatoriskt att patienten, alla patientvårdare och de läkare som ansvarar för patienten får adekvat information om riskerna med detta behandlingssätt. All medicinsk personal och vårdgivare bör instrueras i 1) tecken och symtom på överdosering, 2) procedurer som ska följas vid överdosering och 3) korrekt hemvård av pumpen och införingsstället.
Överdos
Tecken på överdosering kan dyka upp plötsligt eller smygande. Akut massiv överdos kan uppträda som koma. Mindre plötsliga och/eller mindre allvarliga former av överdosering kan uppträda med tecken på dåsighet, yrsel, yrsel, somnolens, andningsdepression, kramper, rostral progression av hypotoni och medvetslöshet som går över till koma. Skulle överdosering förefalla sannolikt ska patienten omedelbart föras till sjukhus för bedömning och tömning av pumpbehållaren. I fall som hittills rapporterats har överdosering i allmänhet varit relaterad till pumpfel, oavsiktlig subkutan injektion eller doseringsfel. (Ser Överdosering av läkemedel Symtom och behandling .)
Extrem försiktighet måste iakttas vid fyllning av en FDA-godkänd implanterbar pump. Sådana pumpar bör endast fyllas på genom reservoarpåfyllningsseptumet. Oavsiktlig injektion i den subkutana vävnaden kan inträffa om reservoarpåfyllningsseptumet inte nås ordentligt. Vissa pumpar är också utrustade med en kateteråtkomstport som ger direkt åtkomst till den intratekala katetern. Direkt injektion i denna kateteröppning eller oavsiktlig injektion i den subkutana vävnaden kan orsaka en livshotande överdos.
Uttag
Plötsligt utsättande av intratekalt baklofen, oavsett orsak, har resulterat i följdsjukdomar som inkluderade hög feber, förändrad mental status, överdriven rebound spasticitet och muskelstelhet som i sällsynta fall utvecklats till rabdomyolys, multipel organsystemsvikt och död. Under de första 9 åren av erfarenhet efter marknadsföring rapporterades 27 fall av utsättning tillfälligt relaterade till upphörande av baklofenbehandling; sex patienter dog. I de flesta fall uppträdde abstinenssymptom inom timmar till några dagar efter avbrott i baklofenbehandlingen. Vanliga orsaker till plötsligt avbrott av intratekal baklofenterapi var fel på katetern (särskilt frånkoppling), låg volym i pumpbehållaren och slutet på pumpbatteriets livslängd; mänskliga fel kan ha spelat en orsaks- eller bidragande roll i vissa fall. Fall av intratekal massa i spetsen av den implanterade katetern som leder till abstinenssymtom har också rapporterats, de flesta av dem involverar apotekskomponerade smärtstillande tillsatser (se FÖRSIKTIGHETSÅTGÄRDER ).
Förebyggande av abrupt utsättande av intratekalt baklofen kräver noggrann uppmärksamhet vid programmering och övervakning av infusionssystemet, schemaläggning och procedurer för påfyllning samt pumplarm. Patienter och vårdgivare bör informeras om vikten av att hålla schemalagda påfyllningsbesök och bör utbildas om de tidiga symtomen på baklofenabstinens.
Alla patienter som får intratekal baklofenbehandling löper potentiell risk för utsättning. Tidiga symtom på utsättning av baklofen kan inkludera återgång av baslinjespasticitet, klåda, hypotoni och parestesier. Priapism kan utvecklas eller återkomma om behandlingen med intratekal baklofen avbryts. Vissa kliniska egenskaper hos det avancerade intratekala baklofenabstinenssyndromet kan likna autonom dysreflexi, infektion (sepsis), malign hypertermi, neuroleptika-malignt syndrom eller andra tillstånd associerade med ett hypermetaboliskt tillstånd eller utbredd rabdomyolys.
Snabb, noggrann diagnos och behandling på akutmottagning eller intensivvård är viktigt för att förhindra det potentiellt livshotande centrala nervsystemet och systemiska effekter av intratekalt baklofenabstinens. Den föreslagna behandlingen för abstinens av intratekal baklofen är återställande av intratekalt baklofen vid eller nära samma dos som innan behandlingen avbröts. Men om återställandet av intratekal leverans försenas, kan behandling med GABA-ergiska agonistläkemedel såsom oralt eller enteralt baklofen eller orala, enterala eller intravenösa bensodiazepiner förhindra potentiellt dödliga följdsjukdomar. Enbart oralt eller enteralt baklofen bör inte förlitas på för att stoppa utvecklingen av intratekalt baklofenabstinens.
Kramper har rapporterats under överdosering och vid utsättning av LIORESAL 25 mg INTRATHECAL såväl som hos patienter som hålls på terapeutiska doser av LIORESAL INTRATHECAL.
Dödsfall
Spasticitet av ryggmärgsursprung
Det rapporterades 16 dödsfall bland de 576 amerikanska patienter som behandlades med LIORESAL 10 mg INTRATHECAL (baklofeninjektion) i studier före och efter marknadsföring som utvärderades i december 1992. Eftersom dessa patienter behandlades under okontrollerade kliniska miljöer är det omöjligt att definitivt avgöra vad roll, om någon, LIORESAL INTRATHECAL spelade i deras död.
Som grupp var patienterna som dog relativt unga (medelåldern var 47 med ett intervall från 25 till 63), men majoriteten led av svår spasticitet av många års varaktighet, var nonambulatoriska, hade olika medicinska komplikationer som lunginflammation, urinvägar infektioner och decubiti, och/eller hade fått flera samtidiga mediciner. En genomgång från fall till fall av det kliniska förloppet för de 16 patienter som dog kunde inte avslöja några unika tecken, symtom eller laboratorieresultat som skulle tyda på att behandling med LIORESAL INTRATHECAL orsakade deras död. Två patienter dog plötsligt och oväntat inom 2 veckor efter pumpimplantation och en patient dog oväntat efter screening.
En patient, en 44-årig man med MS, dog på sjukhus den andra dagen efter pumpimplantation. En obduktion visade allvarlig fibros i koronarledningssystemet. En andra patient, en 52-årig kvinna med MS och en historia av en hjärtinfarkt i sämre väggar, hittades död i sängen 12 dagar efter pumpimplantation, 2 timmar efter att ha haft dokumenterade normala vitala tecken. En obduktion avslöjade lungstockning och bilaterala pleurautgjutningar. Det är omöjligt att avgöra om LIORESAL INTRATHECAL bidrog till dessa dödsfall. Den tredje patienten genomgick tre baklofenscreeningsförsök. Hans medicinska historia inkluderade SCI, aspirationspneumoni, septisk chock, disseminerad intravaskulär koagulopati, svår metabolisk acidos, levertoxicitet och status epilepticus. Tolv dagar efter screening (han implanterades inte) upplevde han återigen status epilepticus med efterföljande betydande neurologisk försämring. Baserat på tidigare instruktioner vidtogs inte extraordinära återupplivningsåtgärder och patienten dog.
Spasticitet av cerebralt ursprung
Det inträffade tre dödsfall bland de 211 patienter som behandlades med LIORESAL INTRATHECAL i pre-marketingstudier i mars 1996. Dessa dödsfall tillskrevs inte behandlingen.
Överinfusion
Tillförsel av mer läkemedelsvolym än den programmerade hastigheten (överinfusion) kan resultera i oväntad överdos eller utsättning orsakad av tidig tömning av pumpbehållaren. Se tillverkarens pumphandbok och instruktioner för påfyllning av behållaren.
FÖRSIKTIGHETSÅTGÄRDER
Barn ska ha tillräcklig kroppsmassa för att rymma den implanterbara pumpen för kronisk infusion. Se pumptillverkarens manual för specifika rekommendationer.
Säkerhet och effektivitet hos pediatriska patienter under 4 år har inte fastställts.
Undersökning
Patienter bör vara infektionsfria före screeningstudien med LIORESAL INTRATHECAL (baklofeninjektion) eftersom närvaron av en systemisk infektion kan störa en bedömning av patientens svar på bolus LIORESAL 10 mg INTRATHECAL.
Pumpimplantation
Patienter bör vara infektionsfria före pumpimplantation eftersom närvaron av infektion kan öka risken för kirurgiska komplikationer. Dessutom kan en systemisk infektion komplicera doseringen.
Pumpdosjustering och titrering
Hos de flesta patienter kommer det att vara nödvändigt att öka dosen gradvis över tiden för att bibehålla effektiviteten; ett plötsligt behov av betydande dosökning indikerar vanligtvis en kateterkomplikation (dvs kateterveck eller förskjutning).
Påfyllning av behållare måste utföras av fullt utbildad och kvalificerad personal enligt anvisningarna från pumptillverkaren. Oavsiktlig injektion i den subkutana vävnaden kan inträffa om reservoarpåfyllningsseptumet inte nås ordentligt. Subkutan injektion kan resultera i symtom på en systemisk överdos eller tidig utarmning av reservoaren. Påfyllningsintervall bör beräknas noggrant för att förhindra utarmning av reservoaren, eftersom detta skulle resultera i återgång av allvarlig spasticitet och eventuellt abstinenssymptom.
Strikt aseptisk teknik vid fyllning krävs för att undvika bakteriell kontaminering och allvarlig infektion. En observationsperiod som är lämplig för den kliniska situationen bör följa varje påfyllning eller manipulering av läkemedelsreservoaren.
Extrem försiktighet måste iakttas vid fyllning av en FDA-godkänd implanterbar pump utrustad med en injektionsport som ger direkt åtkomst till den intratekala katetern. Direkt injektion i katetern genom kateterns åtkomstport kan orsaka en livshotande överdos.
Ytterligare överväganden angående dosjustering
Det kan vara viktigt att titrera dosen för att bibehålla en viss grad av muskeltonus och tillåta enstaka spasmer att: 1) hjälpa till att stödja cirkulationsfunktionen, 2) eventuellt förhindra bildandet av djup ventrombos, 3) optimera aktiviteter i det dagliga livet och enkel vård .
Förutom i överdosrelaterade nödfall, bör dosen av LIORESAL 25 mg INTRATHECAL vanligtvis minskas långsamt om läkemedlet avbryts av någon anledning.
Ett försök bör göras att avbryta samtidig oral antispasticitetsmedicin för att undvika eventuell överdos eller negativa läkemedelsinteraktioner, antingen före screening eller efter implantation och påbörjande av kronisk LIORESAL INTRATEKAL infusion. Minskning och utsättande av orala antispasmotika bör göras långsamt och med noggrann övervakning av läkaren. Plötslig minskning eller utsättning av samtidig behandling med antispastika bör undvikas.
Dåsighet
Dåsighet har rapporterats hos patienter på LIORESAL INTRATHECAL. Patienter bör varnas för användning av bilar eller andra farliga maskiner och aktiviteter som görs farliga på grund av minskad vakenhet. Patienter bör också varnas för att de centrala nervsystemets dämpande effekter av LIORESAL INTRATHECAL (baklofeninjektion) kan vara additiva till effekterna av alkohol och andra CNS-dämpande medel.
Intratekal mässa
Fall av intratekal massa i spetsen av den implanterade katetern har rapporterats, de flesta av dem involverar apotekskompounderade analgetiska tillsatser. De vanligaste symtomen förknippade med intratekal massa är: 1) minskat terapeutiskt svar (förvärrad spasticitet, återgång av spasticitet när tidigare väl kontrollerad, abstinenssymtom, dålig respons på eskalerande doser eller frekventa eller stora dosökningar), 2) smärta, 3) neurologiskt underskott/dysfunktion. Läkare bör övervaka patienter på intraspinalbehandling noggrant med avseende på nya neurologiska tecken eller symtom. Hos patienter med nya neurologiska tecken eller symtom som tyder på en intratekal massa, överväg en neurokirurgisk konsultation, eftersom många av symtomen på inflammatorisk massa inte är olik de symtom som upplevs av patienter med svår spasticitet från sin sjukdom. I vissa fall kan ett avbildningsförfarande vara lämpligt för att bekräfta eller utesluta diagnosen av en intratekal massa.
Försiktighetsåtgärder i speciella patientpopulationer
Noggrann dostitrering av LIORESAL 10mg INTRATHECAL behövs när spasticitet är nödvändig för att upprätthålla en upprätt hållning och balans i rörelse eller när spasticitet används för att uppnå optimal funktion och vård.
Patienter som lider av psykotiska störningar, schizofreni eller förvirringstillstånd bör behandlas försiktigt med LIORESAL INTRATHECAL och hållas under noggrann övervakning, eftersom exacerbationer av dessa tillstånd har observerats vid oral administrering.
LIORESAL INTRATHECAL ska användas med försiktighet till patienter med en historia av autonom dysreflexi. Närvaron av nociceptiva stimuli eller abrupt utsättande av LIORESAL 10 mg INTRATHECAL (baklofeninjektion) kan orsaka en autonom dysreflexisk episod.
Eftersom LIORESAL huvudsakligen utsöndras oförändrat via njurarna, bör det ges med försiktighet till patienter med nedsatt njurfunktion och det kan vara nödvändigt att minska dosen.
Laboratorietester
Inga specifika laboratorietester anses nödvändiga för behandling av patienter på LIORESAL INTRATHECAL.
Karcinogenes, mutagenes och försämring av fertilitet
Ingen ökning av tumörer sågs hos råttor som fick baklofen oralt under två år. Adekvata genotoxicitetsanalyser av baklofen har inte utförts.
Graviditet
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. I djurstudier hade baklofen negativa effekter på embryofetal utveckling när det administrerades oralt till gravida råttor. LIORESAL 25mg INTRATHECAL ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Baklofen som gavs oralt ökade förekomsten av fosterstrukturella abnormiteter (omphaloceles) hos råttor. Minskning av födointag och kroppsviktsökning observerades i fördämningarna. Fetala strukturella abnormiteter observerades inte hos möss eller kaniner
Ammande mödrar
Hos mödrar som behandlas med oral LIORESAL (baklofen USP) i terapeutiska doser går den aktiva substansen över i mjölken. Det är inte känt om detekterbara nivåer av läkemedel finns i mjölk från ammande mödrar som får LIORESAL 25 mg INTRATHECAL. Som en allmän regel bör omvårdnad utföras medan en patient får LIORESAL 25 mg INTRATHECAL endast om den potentiella nyttan motiverar de potentiella riskerna för barnet.
Pediatrisk användning
Barn ska ha tillräcklig kroppsmassa för att rymma den implanterbara pumpen för kronisk infusion. Se pumptillverkarens manual för specifika rekommendationer.
Säkerhet och effektivitet hos pediatriska patienter under 4 år har inte fastställts.
Överväganden baserade på erfarenhet av oral LIORESAL (baklofen USP)
En dosrelaterad ökning av incidensen av ovariecystor observerades hos honråttor som behandlades kroniskt med oral LIORESAL. Ovariella cystor har hittats genom palpation hos cirka 4 % av patienterna med multipel skleros som behandlades med oral LIORESAL 25 mg i upp till ett år. I de flesta fall försvann dessa cystor spontant medan patienterna fortsatte att få läkemedlet. Ovariella cystor uppskattas uppstå spontant hos cirka 1 % till 5 % av den normala kvinnliga populationen.
ÖVERDOS
Särskild uppmärksamhet måste ägnas åt att känna igen tecken och symtom på överdosering, särskilt under den initiala screening- och dostitreringsfasen av behandlingen, men även under återintroduktion av LIORESAL INTRATHECAL efter en period av avbrott i behandlingen.
Symtom på LIORESAL INTRATEKAL överdosering
Dåsighet, yrsel, yrsel, somnolens, andningsdepression, hypotermi, kramper, rostral progression av hypotoni och förlust av medvetande som utvecklas till koma på upp till 72 timmar. varaktighet. I de flesta rapporterade fallen var koma reversibel utan följdsjukdomar efter att läkemedlet avbröts. Symtom på LIORESAL 25 mg INTRATEKAL överdosering rapporterades hos en känslig vuxen patient efter att ha fått en 25 mikrogram intratekal bolus.
Behandlingsförslag för överdosering
Det finns ingen specifik motgift för behandling av överdoser av LIORESAL INTRATHECAL (baklofeninjektion); dock bör följande steg normalt vidtas:
Om lumbalpunktion inte är kontraindicerat, bör man överväga att ta upp 30-40 ml CSF för att minska CSF-baklofenkoncentrationen.
KONTRAINDIKATIONER
Överkänslighet mot baklofen. LIORESAL INTRATHECAL rekommenderas inte för intravenös, intramuskulär, subkutan eller epidural administrering.
KLINISK FARMAKOLOGI
Den exakta verkningsmekanismen för baklofen som ett muskelavslappnande medel och antispasticitetsmedel är inte helt klarlagd. Baklofen hämmar både monosynaptiska och polysynaptiska reflexer på ryggradsnivå, möjligen genom att minska excitatorisk neurotransmittorfrisättning från primära afferenta terminaler, även om effekter på supraspinala ställen också kan förekomma och bidra till dess kliniska effekt. Baklofen är en strukturell analog till den hämmande signalsubstansen gamma-aminosmörsyra (GABA), och kan utöva sina effekter genom stimulering av GABAB-receptorsubtypen.
När LIORESAL INTRATHECAL införs direkt i det intratekala utrymmet kan effektiva CSF-koncentrationer uppnås med resulterande plasmakoncentrationer 100 gånger lägre än de som inträffar vid oral administrering.
Hos människor, såväl som hos djur, har baklofen visat sig ha allmänna CNS-depressiva egenskaper, vilket indikeras av framställning av sedering med tolerans, somnolens, ataxi och andnings- och kardiovaskulär depression.
Farmakodynamik av LIORESAL INTRATEKAL
Intratekal bolus
Vuxna patienter
Verkan börjar vanligtvis en halvtimme till en timme efter en intratekal bolus. Maximal spasmolytisk effekt ses cirka fyra timmar efter dosering och effekterna kan vara fyra till åtta timmar. Debut, maximal respons och verkningslängd kan variera med individuella patienter beroende på dos och symtomens svårighetsgrad.
Pediatriska patienter
Debut, maximal respons och verkningslängd liknar de som ses hos vuxna patienter.
Kontinuerlig infusion
LIORESAL 25mg INTRATHECALs antispastiska verkan ses först 6 till 8 timmar efter påbörjad kontinuerlig infusion. Maximal aktivitet observeras inom 24 till 48 timmar.
Kontinuerlig infusion
Ingen ytterligare information finns tillgänglig för pediatriska patienter.
Farmakokinetiken för LIORESAL 25mg INTRATEKAL
Farmakokinetiken för CSF-clearance av LIORESAL 25 mg INTRATHECAL beräknad från intratekala bolusstudier eller kontinuerliga infusionsstudier approximerar CSF-omsättningen, vilket tyder på att eliminering sker genom bulkflödesborttagning av CSF.
Intratekal bolus
Efter en lumbal bolusinjektion av 50 eller 100 mikrogram LIORESAL 10 mg INTRATHECAL hos sju patienter var den genomsnittliga halveringstiden för CSF-eliminering 1,51 timmar under de första fyra timmarna och den genomsnittliga CSF-clearancen var cirka 30 ml/timme.
Kontinuerlig infusion
Genomsnittlig CSF-clearance för LIORESAL 10 mg INTRATHECAL (baklofeninjektion) var cirka 30 ml/timme i en studie som involverade tio patienter på kontinuerlig intratekal infusion. Samtidiga plasmakoncentrationer av baklofen under intratekal administrering förväntas vara låga (0-5 ng/ml).
Begränsade farmakokinetiska data tyder på att en lumbal-cisternal koncentrationsgradient på cirka 4:1 etableras längs neuroaxeln under baklofeninfusion. Detta är baserat på samtidig CSF-provtagning via cisternal och lumbal kran hos 5 patienter som erhåller kontinuerlig baklofeninfusion på ländnivå vid doser som är associerade med terapeutisk effekt; variationen mellan patienterna var stor. Gradienten ändrades inte av position.
Sex pediatriska patienter (ålder 8-18 år) som fick kontinuerlig intratekal baklofeninfusion i doser på 77-400 mikrogram/dag hade plasmanivåer av baklofen nära eller under 10 ng/ml.
PATIENTINFORMATION
PrLIORESAL Intrathecal (baklofen) Injektion 0,05 mg/ml, 0,5 mg/ml och 2 mg/ml
Endast för intratekal injektion och infusion
Denna broschyr är del III av en tredelad "Produktmonografi" som publicerades när LIORESAL IT godkändes för försäljning i Kanada och är utformad speciellt för konsumenter. Denna bipacksedel är en sammanfattning och kommer inte att berätta allt om LIORESAL 10mg IT. Kontakta din läkare eller apotekspersonal om du har några frågor om läkemedlet.
OM DEN HÄR MEDICINEN
Vad medicinen används för:
LIORESAL 25mg Intrathecal tillhör en grupp läkemedel som kallas muskelavslappnande medel. Det används för att minska och lindra överdriven stelhet och/eller spasmer som uppstår vid olika sjukdomar som till exempel multipel skleros, sjukdomar eller skador i ryggmärgen och vissa hjärnsjukdomar.
Vad den gör:
Lösningen injiceras eller infunderas i vätskeutrymmet runt ryggmärgen med hjälp av en speciell pump som implanteras under huden på din buk. Från pumpen levereras en konstant mängd av lösningen till vätskeutrymmet runt ryggmärgen genom ett litet rör.
På grund av den gynnsamma effekten på muskelsammandragningar och den åtföljande smärtlindringen, förbättrar LIORESAL Intrathecal din rörlighet och din förmåga att hantera dina dagliga aktiviteter utan hjälp. LIORESAL 25mg hjälper dig också att få mer nytta av sjukgymnastik.
När det inte ska användas:
Du ska inte behandlas med LIORESALIT om du:
- är allergisk (överkänslig) mot LIORESAL 25mg Intrathecal eller något av övriga innehållsämnen i LIORESAL 10mg Intrathecal listade nedan.
Vad är den medicinska ingrediensen:
baklofen.
Vilka icke-medicinska ingredienser är:
LIORESAL 25mg IT innehåller: natriumklorid och vatten för injektionsvätskor
Vilka doseringsformer finns det i:
LIORESAL 25 mg intratekal (baklofeninjektion) 0,05 mg/ml: Varje 1 ml ampull innehåller 0,05 mg baklofen för intratekal administrering.
LIORESAL Intratekal (baklofeninjektion) 0,5 mg/ml: Varje 20 ml ampull innehåller 10 mg baklofen för intratekal administrering.
LIORESAL 25 mg intratekal (baklofeninjektion) 2 mg/ml: Varje 5 ml ampull innehåller 10 mg baklofen för intratekal administrering.
VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER
LIORESAL 10mg Intrathecal är lämplig för många, men inte alla, patienter med muskelspasmer.
INNAN du använder LIORESAL 25mgIT, tala med din läkare eller apotekspersonal om du:
- har någon form av infektion
- har Parkinsons sjukdom eller vissa psykiska sjukdomar åtföljda av förvirring
- har epilepsi (kramper)
- har diabetes
- någonsin haft hjärtproblem
- någonsin haft njurproblem
- har andningsproblem
- har akut smärta i magen eller tarmen
- har stört blodcirkulationen i din hjärna
- har någonsin upplevt plötsliga episoder av högt blodtryck, ångest, överdriven svettning, "gåskött", bultande huvudvärk och ovanligt långsam hjärtrytm på grund av en överreaktion av ditt nervsystem på stimuli såsom utvidgning av urinblåsan och tarmen, hudirritation och smärta
Om något av detta gäller dig kanske din läkare inte vill ge dig detta läkemedel eller kanske vill vidta särskilda försiktighetsåtgärder. Om du inte har berättat för din läkare om någon av dessa saker, berätta för honom/henne innan du påbörjar LIORESAL 25 mg intratekal behandling.
Om du tror att du kan vara allergisk, fråga din läkare om råd.
Köra och använda maskiner: LIORESAL Intrathecal kan få dig att känna dig sömnig eller yr. Var försiktig när du kör bil eller använder en maskin eller gör saker som kräver noggrann uppmärksamhet tills du känner dig normal igen.
INTERAKTIONER MED DENNA LÄKEMEDEL
Tala om för din läkare eller apotekspersonal om du tar eller nyligen har tagit andra läkemedel, inklusive växtbaserade och receptfria läkemedel (receptfria). Vissa andra läkemedel kan interagera med LIORESAL 10mgIT. Din läkare kan ändra doseringen eller ibland sluta med något av läkemedlen. Detta är särskilt viktigt för följande läkemedel:
- andra läkemedel mot ditt spastiska tillstånd
- läkemedel mot Parkinsons sjukdom
- läkemedel mot epilepsi
- läkemedel som används för att behandla humörstörningar som antidepressiva medel och litium
- läkemedel mot högt blodtryck
- andra läkemedel som påverkar njuren, t.ex. ibuprofen
- opiater för smärtlindring
- mediciner som används för att hjälpa dig att sova eller lugna dig
- läkemedel som bromsar det centrala nervsystemet, t.ex. antihistaminer och lugnande medel (vissa av dessa kan köpas receptfritt)
Berätta alltid för din läkare eller sjuksköterska om alla läkemedel du tar. Det betyder mediciner du har köpt själv samt mediciner på recept från din läkare.
Var försiktig om du dricker alkoholhaltiga drycker under behandling med LIORESAL 25mg Intrathecal eftersom du kan känna dig mer sömnig eller yr än vanligt.
KORREKT ANVÄNDNING AV DETTA LÄKEMEDEL
Vanlig dos
LIORESAL Intrathecal kan endast ges av erfarna läkare som använder speciell medicinsk utrustning. Du kommer att behöva stanna på sjukhus, åtminstone i början av behandlingen.
Din läkare kommer att injicera en liten mängd LIORESAL Intrathecal i din ryggmärg för att se om det förbättrar dina muskelspasmer. Om den gör det kommer en speciell pump att implanteras under huden. Pumpen ger dig en liten mängd medicin hela tiden.
Det kan ta flera dagar att ta reda på vilken mängd läkemedel som passar dig bäst, din läkare kommer att hålla ett öga på dig under denna tid.
Efter det kommer din läkare fortfarande att vilja träffa dig regelbundet för att kontrollera dina framsteg och se till att din pump fungerar bra.
DET ÄR AV YTSTA VIKTIGT ATT TILLÄMPNINGAR FÖR ÅTERFYLLNING AV PUMPEN HÅLLS, ANNARS KAN SPASMAR ÅTERKOMMA FÖR ATT DU INTE FÅR EN HÖG TILLGÄNGLIG DOS AV LIORESAL INTRATHEKAL. MUSKELSPASTICITET KANSKE INTE FÖRBÄTTRAS ELLER KAN FÖRVÄRRE SOM RESULTAT.
Om muskelspasticiteten inte förbättras eller om du börjar få spasmer igen, antingen gradvis eller plötsligt, kontakta din läkare omedelbart.
Se pumptillverkarens litteratur för information om korrekt hemvård av pumpen och införingsplatsen.
Övervakning under behandling med LIORESAL 10mg Intrathecal
Du kommer att övervakas noga i en fullt utrustad och bemannad miljö under screeningsfasen och dostitreringsperioden omedelbart efter pumpimplantation. Du kommer regelbundet att utvärderas för dina dosbehov, för möjliga biverkningar eller tecken på infektion. Leveranssystemets funktion kommer också att kontrolleras.
Graviditet och amning
Du bör tala om för din läkare om du är gravid eller planerar att bli gravid eftersom LIORESAL 25mg Intrathecal inte ska användas under graviditet eller om du ammar. Fråga din läkare eller apotekspersonal om råd innan du tar något läkemedel.
Din läkare kommer att diskutera med dig den potentiella risken med att ta LIORESAL 25mg Intrathecal under graviditet.
Läkaren kommer att avgöra om du kan få LIORESAL 10mg Intrathecal i dessa speciella situationer. Endast mycket små mängder LIORESAL 10 mg passerar över i bröstmjölken. Fråga din läkare om du vill amma.
Överdos
Vid överdosering av läkemedel, kontakta omedelbart en läkare, akutmottagning på sjukhus eller regional Giftkontrollcentral, även om det inte finns några symtom.
Tecken på överdosering kan uppträda plötsligt eller smygande, t.ex. genom att pumpen inte fungerar. Det är mycket viktigt att du och de som tar hand om dig känner igen tecken på överdosering. Om du upplever något eller en kombination av följande symtom, tala om för din läkare utan dröjsmål eftersom mängden läkemedel du får kan vara för hög:
- ovanlig muskelsvaghet (för lite muskeltonus)
- sömnighet
- yrsel eller yrsel
- överdriven salivutsöndring
- illamående eller kräkningar
- andningssvårigheter, kramper eller medvetslöshet
- onormal låg kroppstemperatur
Missad dos
Att plötsligt stoppa LIORESAL 10mg Intrathecal kan resultera i allvarliga medicinska problem och har i sällsynta fall varit dödlig.
Tecken på att din pump inte fungerar som den ska eller att den inte levererar rätt mängd medicin inkluderar en ökning eller återgång av spasticitet, klåda, lågt blodtryck, yrsel, stickningar, hög feber, förändrad mental status och muskelstelhet eller ny muskelsvaghet eller förlamning. Det är viktigt att genast berätta för din läkare om du upplever något av ovanstående symtom.
BIVERKNINGAR OCH VAD MAN GÖR ÅT DEM
Som med alla läkemedel kan patienter som behandlas med LIORESAL 25 mg Intrathecal uppleva vissa biverkningar, även om alla inte får dem. Dessa inträffar oftare i början av behandlingen under din sjukhusvistelse, men de kan också inträffa senare och bör kontrolleras med din läkare.
Väldigt vanligt: Dåsighet, muskelsvaghet
Allmänning: Känsla av ångest, lugnande och trötthet (utmattning), svaghet i benen, stelhet i musklerna, yrsel/yrsel, huvudvärk, sömnighet, illamående och/eller kräkningar, stickningar i händer och fötter, sömnlöshet, sluddrigt tal, lunginflammation , svaghet, frossa, trötthet, smärta, muntorrhet, hudutslag och/eller klåda, svullnad av anklar, fötter eller underben, svullna ansikte, ovanlig nervositet eller rastlöshet, förvirring/desorientering, förstoppning, diarré, nedsatt aptit, överdriven salivutsöndring, feber/frysning, urinvägsproblem, sexuella svårigheter.
Ovanlig: Humör eller mentala förändringar, paranoia, känsla av extrem lycka (eufori), förlust av muskelkoordination (ataxi), onormalt låg kroppstemperatur, minnesförlust, kontinuerliga okontrollerbara ögonrörelser, nedsatt smaksinne, svårigheter att svälja, buksmärtor, håravfall, överdriven svettning.
Sällsynt: Rastlöshet, onormalt långsam andningshastighet.
Tala om för din läkare om du märker någon annan effekt. Vissa biverkningar kan vara associerade med leveranssystemet.
ALLVARLIGA BIVERKNINGAR, HUR OFTA HÄNDER DE OCH VAD MAN GÖR ÅT DEM
Detta är inte en komplett lista över biverkningar. För eventuella oväntade effekter när du tar LIORESAL IT kontakta din läkare eller apotekspersonal.
HUR MAN FÖRVARAR DEN
Förvara LIORESAL 10mg IT-ampuller mellan 15-30°C (skydda mot värme). Frys inte. Värmesterilisera inte.
Förvara alla läkemedel utom syn- och räckhåll för barn.
Detta läkemedel skrivs ut för ditt specifika medicinska problem och endast för ditt eget bruk. Ge inte till andra människor.
Använd inte föråldrade läkemedel. Kassera dem på ett säkert sätt utom räckhåll för barn eller ta dem till din apotekspersonal som kommer att kassera dem åt dig.
RAPPORTERA MISSTÄNKTA BIVERKNINGAR
Du kan rapportera alla misstänkta biverkningar i samband med användningen av hälsoprodukter till Canada Vigilance Program på något av följande tre sätt:
- Rapportera online på www.healthcanada.gc.ca/medeffect
- Ring avgiftsfritt på 1-866-234-2345
- Fyll i ett rapporteringsformulär för Kanada Vigilance och:
- Faxa avgiftsfritt till 1-866-678-6789, eller
- Maila till: Canada Vigilance Program, Health Canada, Postal Locator 0701E, Ottawa, Ontario, K1A 0K9
Portobetalda etiketter, Canada Vigilance Reporting Form och riktlinjer för biverkningsrapportering finns tillgängliga på MedEffect™ Canadas webbplats på www.healthcanada.gc.ca/medeffect.
NOTERA: Om du behöver information om hantering av biverkningar, kontakta din läkare. Canada Vigilance Program ger ingen medicinsk rådgivning.
MER INFORMATION
Detta dokument plus den fullständiga produktmonografin, förberedd för hälso- och sjukvårdspersonal, kan hittas på: http://www.novartis.ca eller genom att kontakta sponsorn, Novartis Pharmaceuticals Canada Inc, på: 1-800-363-8883
