Zovirax 200mg, 400mg, 800mg Acyclovir Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Zovirax 800mg och hur används det?
Zovirax är ett receptbelagt läkemedel som används för att behandla symtom på munsår (Herpes Labialis) och Genital Herpes. Zovirax 800 mg kan användas ensamt eller tillsammans med andra läkemedel.
Zovirax 400mg tillhör en klass av läkemedel som kallas Antivirals, Topical.
Det är inte känt om Zovirax 200 mg är säkert och effektivt för barn yngre än 12 år.
Vilka är de möjliga biverkningarna av Zovirax 800mg?
Zovirax 200 mg kan orsaka allvarliga biverkningar inklusive:
- lätta blåmärken eller blödningar,
- lila eller röda spetsiga fläckar under huden,
- lite eller ingen urinering,
- smärtsam eller svår urinering,
- svullnad i dina fötter eller vrister,
- känner mig trött och
- andnöd
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Zovirax inkluderar:
- illamående,
- kräkningar,
- diarre,
- allmän dålig känsla,
- huvudvärk och
- munsmärta när du använder en acyklovir buckal tablett
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Zovirax. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
SAMMANFATTNING PRODUKTINFORMATION
Drog substans
Riktigt namn: acyklovir
Kemiskt namn: 9-[(2-hydroxietoxi)metyl]guanin
Annat namn: acykloguanosin
Molekylär formel: C8H11N503
Molekylär massa: 225.2 Strukturformel:
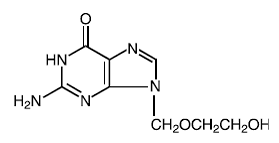
Fysikalisk-kemiska egenskaper: Acyclovir är ett vitt, kristallint pulver med en maximal löslighet i vatten på 1,3 mg/ml vid 25°C.
INDIKATIONER
Indikationer och klinisk användning
ZOVIRAX® (acyklovir) är indicerat för följande tillstånd:
- Behandling av initiala episoder av herpes genitalis.
- Dämpning av ovanligt frekventa återfall av herpes genitalis (6 eller fler episoder per år).
- Akut behandling av herpes zoster (bältros) och varicella (vattkoppor).
Resultaten av kliniska studier tyder på att vissa patienter med återkommande genital herpes kan dra klinisk nytta av administrering av oral ZOVIRAX® om de tas vid första tecknet på en förestående episod. De som mest sannolikt kommer att gynnas är patienter som upplever svåra, långvariga återfall; sådan intermittent terapi kan vara mer lämplig än suppressiv terapi när dessa återfall är sällsynta.
Tidig behandling av akut herpes zoster (bältros) hos immunkompetenta individer med oral ZOVIRAX® resulterade i minskad virusutsöndring; minskad tid till läkning; mindre spridning; och lindring av akut smärta.
Behandling av varicella (vattkoppor) hos immunkompetenta patienter med oral ZOVIRAX® minskade det totala antalet lesioner, accelererade progressionen av lesioner till skorp- och läktstadierna och minskade antalet återstående hypopigmenterade lesioner. Dessutom minskade ZOVIRAX® feber och konstitutionella symtom i samband med vattkoppor.
Den profylaktiska användningen av acyklovir vid vattkoppor har inte fastställts.
Geriatrik (≥ 65 år): Användning i den geriatriska populationen kan vara associerad med skillnader i säkerhet på grund av åldersrelaterade förändringar i njurfunktionen och en kort diskussion finns i lämpliga avsnitt (se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ).
Pediatrik ( Inga data finns tillgängliga.
DOSERING OCH ADMINISTRERING
Doseringsöverväganden
- Doseringen av ZOVIRAX® (aciklovir) bör reduceras hos patienter med nedsatt njurfunktion.
- Behandlingen bör inledas så snart som möjligt efter diagnosen vattkoppor eller herpes zoster, eller vid första tecken eller symtom på ett utbrott av genital herpes.
- Rekommenderad dos och användningstid beror på indikationen.
Rekommenderad dos och dosjustering
Behandling av initial infektion av Herpes Genitalis: 200 mg (en 200 mg tablett eller en tesked suspension [5 ml]) var 4:e timme, 5 gånger dagligen, totalt 1 g dagligen i 10 dagar. Behandlingen bör inledas så tidigt som möjligt efter att tecken och symtom har uppstått.
Undertryckande terapi för återkommande herpes genitalis
Den initiala rekommenderade dosen är 200 mg (en 200 mg tablett eller en tesked suspension [5 ml]) tre gånger dagligen. Detta kan ökas om genombrott sker upp till en dos på en 200 mg tablett eller en tesked [5 ml] suspension, fem gånger dagligen. Vid behov kan en dos på 400 mg (två 200 mg tabletter eller två teskedar suspension [10 ml]) givet två gånger dagligen övervägas. Regelbunden omvärdering av behovet av terapi rekommenderas.
Administrering av ZOVIRAX® för intermittent behandling är 200 mg (en 200 mg tablett eller en tesked [5 ml] suspension) var 4:e timme 5 gånger dagligen i 5 dagar. Behandlingen bör inledas vid de tidigaste tecknen eller symtomen (prodrom) på återfall.
Behandling av Herpes Zoster
800 mg oral ZOVIRAX®, var 4:e timme, 5 gånger dagligen i 7 till 10 dagar. Behandlingen ska påbörjas inom 72 timmar efter att lesionerna har börjat. I kliniska prövningar uppstod den största fördelen när behandlingen påbörjades inom 48 timmar efter att lesionerna började.
Behandling av vattkoppor
20 mg/kg (inte överstiga 800 mg) oralt, 4 gånger dagligen i 5 dagar. Behandlingen ska påbörjas inom 24 timmar efter att utslag har uppstått.
Patienter med akut eller kronisk njurfunktionsnedsättning
Försiktighet tillråds vid administrering av acyklovir till patienter med nedsatt njurfunktion. Tillräcklig hydrering bör upprätthållas.
Omfattande farmakokinetiska studier har slutförts efter intravenösa acyklovirinfusioner hos patienter med nedsatt njurfunktion.
Baserat på dessa studier rekommenderas dosjusteringar i Tabell 5 för genital herpes och herpes zoster indikationer.
Hemodialys
För patienter som behöver hemodialys är den genomsnittliga plasmahalveringstiden för acyklovir under hemodialys cirka 5 timmar. Detta resulterar i en 60%-ig minskning av plasmakoncentrationerna efter en sextimmars dialysperiod. Därför bör patientens doseringsschema anpassas så att ytterligare en dos ges efter varje dialys.
Peritonealdialys
Ingen tilläggsdos verkar vara nödvändig efter justering av doseringsintervallet.
Missad dos
Om en dos av ZOVIRAX® missas, bör patienten rådas att ta den så snart han/hon kommer ihåg det och sedan fortsätta med nästa dos med rätt tidsintervall.
HUR LEVERERAS
Förvaring och stabilitet
ZOVIRAX® tabletter ska förvaras i kontrollerad rumstemperatur (15 till 25°C) på en torr plats och skyddad från ljus.
ZOVIRAX® Suspension ska förvaras i kontrollerad rumstemperatur (15 till 25°C).
Doseringsformer, sammansättning och förpackning
Suspension: Varje tesked (5 ml) ZOVIRAX® Suspension innehåller 200 mg acyklovir och de icke-medicinska ingredienserna banansmak, cellulosa, glycerin, metylparaben, propylparaben, sorbitol, vanillin och vatten.
Varje ZOVIRAX® 200 tablett innehåller 200 mg acyklovir och de icke-medicinska ingredienserna cellulosa, indigotin, laktos, magnesiumstearat, povidon och natriumstärkelseglykolat.
ZOVIRAX® Suspension finns i flaskor med 125 ml* och 475 ml. Varje tesked (5 ml) benvit suspension med banansmak innehåller 200 mg acyklovir.
*125 ml flaska inte tillgänglig i Kanada
ZOVIRAX® 200 tabletter finns i burkar med 100 tabletter. Varje blå, sköldformad, komprimerad tablett med fasade kanter innehåller 200 mg acyklovir och är märkt med ”ZOVIRAX” på ena sidan och en triangel på den andra sidan.
GlaxoSmithKline Inc., 7333 Mississauga Road, Mississauga, Ontario, L5N 6L4 1-800-387-7374. Reviderad: 10 november 2014
BIEFFEKTER
Översikt över biverkningar
De vanligaste biverkningarna i samband med användning av ZOVIRAX® (acyklovir) är huvudvärk och illamående.
Neurologiska biverkningar har också rapporterats i sällsynta fall. Äldre patienter och patienter med en historia av nedsatt njurfunktion löper ökad risk att utveckla dessa effekter. I de rapporterade fallen var dessa reaktioner i allmänhet reversibla när behandlingen avbröts (se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER , Biverkningar efter marknaden ).
Klinisk prövning Biverkningar av läkemedel
Eftersom kliniska prövningar utförs under mycket specifika förhållanden kanske de biverkningsfrekvenser som observerats i de kliniska prövningarna inte återspeglar de frekvenser som observerats i praktiken och bör inte jämföras med frekvenserna i de kliniska prövningarna av ett annat läkemedel. Information om biverkningar från kliniska prövningar är användbar för att identifiera läkemedelsrelaterade biverkningar och för att uppskatta frekvenser.
Behandling av Herpes Simplex
Korttidsadministrering (5-10 dagar): De vanligaste biverkningarna som rapporterats under kliniska prövningar av behandling av genital herpes med oral ZOVIRAX® hos 298 patienter listas i Tabell 1.
Dämpning av Herpes Simplex
Långtidsadministrering: De vanligaste biverkningarna som rapporterats i en klinisk prövning för att förebygga återfall med kontinuerlig administrering av 400 mg (två 200 mg kapslar) 2 gånger dagligen listas i Tabell 2.
Bevis så långt från kliniska prövningar tyder på att svårighetsgraden och frekvensen av biverkningar sannolikt inte kommer att kräva att behandlingen avbryts.
Bältros
De vanligaste biverkningarna som rapporterats under tre kliniska prövningar av behandling av herpes zoster (bältros) med 800 mg oral ZOVIRAX® 5 gånger dagligen under 7 eller 10 dagar eller placebo listas i Tabell 3.
Vattkoppor
De vanligaste biverkningarna som rapporterats under tre kliniska prövningar av behandling av vattkoppor med oral ZOVIRAX® eller placebo listas i Tabell 4.
Mindre vanliga biverkningar av kliniska prövningar (
Andra biverkningar som rapporterats hos mindre än 1 % av patienterna som fick ZOVIRAX® i någon klinisk prövning inkluderade: buksmärtor, anorexi, förstoppning, yrsel, ödem, trötthet, flatulens, inguinal adenopati, sömnlöshet, bensmärta, medicinsmak, hudutslag, sår hals, krampaktiga handrörelser och urtikaria.
Onormala hematologiska och kliniska kemifynd
Inga kliniskt signifikanta förändringar i laboratorievärden har observerats i kliniska prövningar för behandling av vattkoppor och zoster, och för behandling och suppression av genital herpes med ZOVIRAX®.
Biverkningar efter marknaden
Följande händelser har rapporterats frivilligt efter användning av ZOVIRAX® i klinisk praxis. Dessa händelser har valts för inkludering på grund av antingen deras allvarlighetsgrad, rapporteringsfrekvens, potentiella orsakssamband med ZOVIRAX® eller en kombination av dessa faktorer. Biverkningar efter marknadsintroduktion rapporteras spontant från en population av okänd storlek, varför uppskattningar av frekvensen inte kan göras.
Allmän: Feber, huvudvärk, smärta och perifert ödem.
Nervös: Yrsel, parestesi, agitation, förvirring, tremor, ataxi, dysartri, hallucinationer, psykotiska symtom, kramper, somnolens, encefalopati och koma har rapporterats. Dessa händelser är i allmänhet reversibla och rapporteras vanligtvis hos patienter med nedsatt njurfunktion eller med andra predisponerande faktorer (se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ). Dessa symtom kan vara markanta, särskilt hos äldre vuxna.
Matsmältningskanalen: Diarré, magbesvär och illamående.
Hematogiska och lymfatiska: Anemi, leukopeni, lymfadenopati och trombocytopeni.
Överkänslighet och hud: Alopeci, erythema multiforme, Stevens-Johnsons syndrom, toxisk epidermal nekrolys, utslag inklusive ljuskänslighet, klåda, urtikaria, dyspné, angioödem och anafylaxi.
Lever och gallvägar och bukspottkörtel: Rapporter om reversibel hyperbilirubinemi och förhöjda leverrelaterade enzymer. Hepatit och gulsot.
Muskuloskeletala: Muskelvärk.
Särskilda sinnen: Synavvikelser.
Urogenital: Förhöjt blodkreatinin och blodureakväve (BUN). Akut njursvikt, njursmärta och hematuri har rapporterats. Njursmärta kan vara förknippad med njursvikt (se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ).
LÄKEMEDELSINTERAKTIONER
Läkemedelsinteraktioner
Inga kliniskt signifikanta interaktioner har identifierats.
Acyclovir elimineras huvudsakligen oförändrat i urinen via aktiv renal tubulär sekretion. Alla läkemedel som administreras samtidigt och som konkurrerar med denna mekanism kan öka plasmakoncentrationerna av acyklovir. Probenecid och cimetidin ökar arean under kurvan (AUC) för acyklovir genom denna mekanism, och minskar renal clearance av acyklovir. På liknande sätt har ökningar av plasma-AUC för acyklovir och av den inaktiva metaboliten av mykofenolatmofetil, ett immunsuppressivt medel som används hos transplanterade patienter, visats när läkemedlen ges samtidigt. Ingen dosjustering är dock nödvändig på grund av det breda terapeutiska indexet för acyklovir.
Läkemedel-mat-interaktioner
Det finns ingen känd interaktion med mat (se Handling och klinisk farmakologi , Farmakokinetik ).
Läkemedels-örtinteraktioner
Interaktioner med växtbaserade produkter har inte fastställts.
Interaktioner mellan läkemedel och laboratorietest
Interaktioner med laboratorietester har inte fastställts.
VARNINGAR
ZOVIRAX (acyklovir) kapslar, tabletter och suspension är endast avsedda för oralt intag. Njursvikt, i vissa fall med dödsfall, har observerats vid behandling med acyklovir (se BIVERKNINGAR: Observeras under klinisk praxis och ÖVERDOSERING ). Trombotiskt trombocytopent purpura/hemolytiskt uremiskt syndrom (TTP/HUS), som har resulterat i dödsfall, har förekommit hos immunförsvagade patienter som fått acyklovirbehandling.
FÖRSIKTIGHETSÅTGÄRDER
Dosjustering rekommenderas vid administrering av ZOVIRAX (acyklovir) till patienter med nedsatt njurfunktion (se DOSERING OCH ADMINISTRERING ). Försiktighet bör också iakttas vid administrering av ZOVIRAX (acyklovir) till patienter som får potentiellt nefrotoxiska medel eftersom detta kan öka risken för njurdysfunktion och/eller risken för reversibla symtom i centrala nervsystemet såsom de som har rapporterats hos patienter som behandlats med intravenös acyklovir. . Tillräcklig hydrering bör upprätthållas.
Bältros: Det finns inga data om behandling som påbörjats mer än 72 timmar efter debut av zosterutslag. Patienter bör rådas att påbörja behandling så snart som möjligt efter diagnosen herpes zoster.
Genital herpesinfektion: Patienterna ska informeras om att ZOVIRAX (acyklovir) inte är ett botemedel mot genital herpes. Det finns inga data som utvärderar om ZOVIRAX (acyklovir) kommer att förhindra överföring av infektion till andra. Eftersom genital herpes är en sexuellt överförbar sjukdom, bör patienter undvika kontakt med lesioner eller samlag när lesioner och/eller symtom är närvarande för att undvika att infektera partner. Genital herpes kan också överföras i frånvaro av symtom genom asymtomatisk virusutsöndring. Om medicinsk behandling av ett återfall av genital herpes är indicerad, bör patienterna rådas att påbörja behandlingen vid det första tecknet eller symtomet på en episod.
Vattkoppor: Vattkoppor hos annars friska barn är vanligtvis en självbegränsad sjukdom av mild till måttlig svårighetsgrad. Ungdomar och vuxna tenderar att ha mer allvarlig sjukdom. Behandlingen inleddes inom 24 timmar efter de typiska vattkoppsutslagen i de kontrollerade studierna och det finns ingen information om effekterna av behandling som påbörjats senare i sjukdomsförloppet.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Data som presenteras nedan inkluderar referenser till maximala steady-state plasmakoncentrationer av acyklovir observerade hos människor som behandlats med 800 mg oralt 5 gånger om dagen (dosering lämplig för behandling av herpes zoster) eller 200 mg ges oralt 5 gånger om dagen (dosering lämplig för behandling av genital herpes). Plasmaläkemedelskoncentrationer i djurstudier uttrycks som multiplar av mänsklig exponering för acyklovir vid högre och lägre doseringsscheman (se KLINISK FARMAKOLOGI: Farmakokinetik ).
Acyklovir testades i livstidsbioanalyser på råttor och möss i enstaka dagliga doser på upp till 450 mg/kg administrerat genom sondmatning. Det fanns ingen statistiskt signifikant skillnad i förekomsten av tumörer mellan behandlade djur och kontrolldjur, inte heller förkortade acyklovir tumörernas latens. Maximala plasmakoncentrationer var 3 till 6 gånger humana nivåer i musbioanalysen och 1 till 2 gånger humana nivåer i råttbioanalysen.
Acyclovir testades i 16 in vitro och in vivo genetiska toxicitetsanalyser. Acyclovir var positivt i 5 av analyserna.
Acyklovir försämrade inte fertiliteten eller reproduktionen hos möss (450 mg/kg/dag, po) eller hos råttor (25 mg/kg/dag, sc). I musstudien var plasmanivåerna 9 till 18 gånger mänskliga nivåer, medan de i råttstudien var 8 till 15 gånger mänskliga nivåer. Vid högre doser (50 mg/kg/dag, sc) hos råttor och kaniner (11 till 22 respektive 16 till 31 gånger mänskliga nivåer) minskade implantationseffektiviteten, men inte kullstorleken. I en peri- och postnatal studie på råtta med 50 mg/kg/dag, sc, fanns en statistiskt signifikant minskning av gruppmedelantalet av corpora lutea, totala implantationsställen och levande foster.
Inga testikulära abnormiteter sågs hos hundar som gavs 50 mg/kg/dag, IV under 1 månad (21 till 41 gånger mänskliga nivåer) eller hos hundar som gavs 60 mg/kg/dag oralt under 1 år (6 till 12 gånger humana nivåer). Testikelatrofi och aspermatogenes observerades hos råttor och hundar vid högre dosnivåer.
Graviditet
Teratogena effekter: Graviditetskategori B. Acyc lovir administrerat under organogenes var inte teratogent hos mus (450 mg/kg/dag, po), kanin (50 mg/kg/dag, sc och IV) eller råtta (50 mg/kg/dag, sc). Dessa exponeringar resulterade i plasmanivåer 9 och 18, 16 och 106 respektive 11 och 22 gånger mänskliga nivåer.
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Ett prospektivt epidemiologiskt register över acykloviranvändning under graviditet upprättades 1984 och slutfördes i april 1999. Det följdes 749 graviditeter hos kvinnor som exponerats för systemisk acyklovir under graviditetens första trimester, vilket resulterade i 756 utfall. Förekomsten av fosterskada är ungefär den som finns i den allmänna befolkningen. Den ringa storleken på registret är dock otillräcklig för att utvärdera risken för mindre vanliga defekter eller för att tillåta tillförlitliga eller definitiva slutsatser om säkerheten för acyklovir hos gravida kvinnor och deras foster under utveckling. Acyclovir ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Ammande mödrar
Acyklovirkoncentrationer har dokumenterats i bröstmjölk hos 2 kvinnor efter oral administrering av ZOVIRAX (acyklovir) och varierade från 0,6 till 4,1 gånger motsvarande plasmanivåer. Dessa koncentrationer skulle potentiellt utsätta det ammande barnet för en dos av acyklovir upp till 0,3 mg/kg/dag. ZOVIRAX (acyklovir) ska administreras till en ammande mamma med försiktighet och endast när det är indicerat.
Pediatrisk användning
Säkerhet och effektivitet för orala formuleringar av acyklovir hos pediatriska patienter yngre än 2 år har inte fastställts.
Geriatrisk användning
Av 376 försökspersoner som fick ZOVIRAX (acyklovir) i en klinisk studie av herpes zosterbehandling hos immunkompetenta försökspersoner ¡Ý50 år, var 244 65 år och äldre medan 111 var 75 år och äldre. Inga övergripande skillnader i effektivitet för tid till upphörande av ny lesionsbildning eller tid till läkning rapporterades mellan geriatriska försökspersoner och yngre vuxna försökspersoner. Smärtans varaktighet efter läkning var längre hos patienter 65 år och äldre. Illamående, kräkningar och yrsel rapporterades oftare hos äldre personer. Äldre patienter är mer benägna att ha nedsatt njurfunktion och behöver dosreduktion. Äldre patienter är också mer benägna att få njur- eller CNS-biverkningar. När det gäller CNS-biverkningar som observerats under klinisk praktik, rapporterades somnolens, hallucinationer, förvirring och koma oftare hos äldre patienter (se KLINISK FARMAKOLOGI, BIVERKNINGAR: observerade under klinisk praxis, och DOSERING OCH ADMINISTRERING ).
ÖVERDOS
För hantering av en misstänkt överdos av läkemedel, kontakta ditt regionala giftkontrollcenter.
Aktivt kol kan administreras för att hjälpa till vid avlägsnandet av icke-absorberat läkemedel. Allmänna stödåtgärder rekommenderas.
Acyclovir absorberas endast delvis i mag-tarmkanalen. Patienter har fått i sig upp till 20 g acyklovir vid ett enda tillfälle, utan några oväntade biverkningar. I kliniska studier var den högsta plasmakoncentration som observerades hos en enskild patient vid dessa doser 10,0 μg/ml. Oavsiktliga, upprepade överdoser av oral acyklovir under flera dagar har associerats med gastrointestinala effekter (såsom illamående och kräkningar) och neurologiska effekter (huvudvärk och förvirring).
Intravenösa doser administrerade till människor har varit så höga som 1 200 mg/m² (28 mg/kg) 3 gånger dagligen i upp till 2 veckor. Maximala plasmakoncentrationer har nått 80 μg/ml. Överdosering av intravenöst acyklovir har resulterat i förhöjda serumkreatinin, blodureakväve och efterföljande njursvikt. Neurologiska effekter inklusive förvirring, hallucinationer, agitation, kramper och koma har beskrivits i samband med intravenös överdosering.
Patienter bör observeras noggrant med avseende på tecken på toxicitet. Hemodialys förbättrar avsevärt avlägsnandet av acyklovir från blodet och kan därför betraktas som ett behandlingsalternativ i händelse av symtomatisk överdos. Utfällning av acyklovir i njurtubuli kan inträffa om lösligheten (2,5 mg/ml) i den intratubulära vätskan överskrids. I händelse av njursvikt och anuri kan patienten ha nytta av hemodialys tills njurfunktionen är återställd (se DOSERING OCH ADMINISTRERING ).
KONTRAINDIKATIONER
ZOVIRAX® (acyklovir) är kontraindicerat för patienter som utvecklar överkänslighet eller som är överkänsliga mot acyklovir, valacyklovir eller andra komponenter i formuleringarna av ZOVIRAX®. För en fullständig lista, se Doseringsformer , Sammansättning och förpackning avsnitt av produktmonografin .
KLINISK FARMAKOLOGI
Handling och klinisk farmakologi
Handlingsmekanism
ZOVIRAX® (acyklovir), en syntetisk acyklisk purinnukleosidanalog, är ett substrat med hög grad av specificitet för herpes simplex och varicella-zoster-specificerat tymidinkinas. Acyklovir är ett dåligt substrat för värdcellsspecificerat tymidinkinas. Herpes simplex och varicella-zoster specificerat tymidinkinas omvandlar acyklovir till sitt monofosfat som sedan omvandlas av ett antal cellulära enzymer till acyklovirdifosfat och acyklovirtrifosfat. Acyklovirtrifosfat är både en hämmare av och ett substrat för herpesvirusspecificerat DNA-polymeras. Även om det cellulära a-DNA-polymeraset i infekterade celler också kan hämmas av acyklovirtrifosfat, sker detta endast vid koncentrationer av acyklovirtrifosfat som är högre än de som hämmar det herpesvirusspecificerade DNA-polymeraset. Acyclovir omvandlas selektivt till sin aktiva form i herpesvirusinfekterade celler och tas därför företrädesvis upp av dessa celler. Acyclovir har visat en mycket lägre toxisk potential in vitro för normala oinfekterade celler eftersom: 1) mindre tas upp; 2) mindre omvandlas till den aktiva formen; och 3) cellulärt a-DNA-polymeras har en lägre känslighet för verkan av den aktiva formen av läkemedlet. En kombination av tymidinkinasspecificiteten, hämning av DNA-polymeras och för tidig avslutning av DNA-syntes resulterar i hämning av herpesvirusreplikation. Ingen effekt på latent icke-replikerande virus har visats. Hämning av viruset minskar perioden av virusutsöndring, begränsar graden av spridning och patologinivå och underlättar därigenom läkning. Under suppression finns det inga bevis för att acyklovir förhindrar neural migration av viruset. Det avbryter episoder av återkommande herpes på grund av hämning av viral replikation efter reaktivering.
Farmakokinetik
Farmakokinetiken för acyklovir efter oral administrering har utvärderats i 6 kliniska studier med 110 vuxna patienter.
Absorption
en studie av 35 immunförsvagade patienter med herpes simplex eller varicella-zoster-infektion som gavs ZOVIRAX® Kapslar i doser på 200 till 1 000 mg var 4:e timme, 6 gånger dagligen under 5 dagar, uppskattades biotillgängligheten vara 15 till 20 %. I denna studie nåddes steady-state plasmanivåer den andra dagen av doseringen. Genomsnittliga steady-state topp- och dalkoncentrationer efter den sista 200 mg dosen var 0,49 μg/mL (0,47 till 0,54 μg/mL) och 0,31 μg/mL (0,18 till 0,41 μg/mL), respektive och efter den sista dosen var 800 mg 2,8 μg/mL (2,3 till 3,1 μg/mL) och 1,8 μg/mL (1,3 till 2,5 μg/mL). I en annan studie gav 20 immunkompetenta patienter med återkommande genital herpes simplex-infektioner ZOVIRAX® kapslar i doser på 800 mg var 6:e timme, 4 gånger dagligen under 5 dagar, var medelvärdet för steady-state topp- och dalkoncentrationer 1,4 μg/ml (0,66 till 1,8 μg/mL) och 0,55 μg/mL (0,14 till 1,1 μg/mL).
en crossover-studie med flera doser där 23 frivilliga fick ZOVIRAX® som en 200 mg kapsel, en 400 mg tablett och en 800 mg tablett 6 gånger dagligen, minskade absorptionen med ökande dos och den uppskattade biotillgängligheten av acyklovir var 20, 15 och 10 % , respektive. Minskningen i biotillgänglighet tros vara en funktion av dosen och inte doseringsformen. Det visades att acyklovir inte är dosproportionell över doseringsintervallet 200 till 800 mg. I denna studie var steady-state topp- och dalkoncentrationer av acyklovir 0,83 och 0,46 μg/ml, 1,21 och 0,63 μg/mL och 1,61 och 0,83 μg/ml för regimerna 200, 400 respektive 800 mg.
I en annan studie med 6 frivilliga var inte födans inverkan på absorptionen av acyklovir påtaglig.
En biotillgänglighetsstudie av en oral dos på 23 normala frivilliga visade att ZOVIRAX® Kapslar 200 mg är bioekvivalenta med 200 mg acyklovir i vattenlösning. I en separat studie med 20 frivilliga visades det att ZOVIRAX® Suspension är bioekvivalent med ZOVIRAX® Kapslar. I en annan endosstudie med biotillgänglighet/bioekvivalens på 24 frivilliga, visades en ZOVIRAX® 800 mg tablett vara bioekvivalent med fyra ZOVIRAX® 200 mg kapslar.
Distribution
Plasmaproteinbindningen är relativt låg (9 till 33 %) och läkemedelsinteraktioner som involverar förskjutning av bindningsstället förväntas inte.
Eliminering
Efter oral administrering varierade den genomsnittliga plasmahalveringstiden för acyklovir hos frivilliga och patienter med normal njurfunktion från 2,5 till 3,3 timmar. Den genomsnittliga renala utsöndringen av oförändrat läkemedel står för 14,4 % (8,6 till 19,8 %) av den oralt administrerade dosen. Den enda urinmetaboliten (identifierad genom högpresterande vätskekromatografi) är 9-[(karboximetoxi)metyl]guanin.
Särskilda populationer och förhållanden
Pediatrik
I allmänhet är farmakokinetiken för acyklovir hos barn liknande den hos vuxna. Medelhalveringstiden efter orala doser på 300 och 600 mg/m², hos barn i åldern 7 månader till 7 år, var 2,6 timmar (intervall 1,59 till 3,74 timmar).
Oralt administrerat acyklovir till barn under 2 år har ännu inte studerats fullständigt.
Geriatri
Hos äldre faller det totala kroppsclearancen med stigande ålder, associerat med minskat kreatininclearance, även om det är liten förändring i den terminala plasmahalveringstiden. Dosreduktion kan behövas hos geriatriska patienter med nedsatt njurfunktion (se DOSERING OCH ADMINISTRERING ).
Njurinsufficiens
Halveringstiden och totala kroppsclearance för acyklovir är beroende av njurfunktionen.
En dosjustering rekommenderas för patienter med nedsatt njurfunktion (se DOSERING OCH ADMINISTRERING ).
Kliniska tester
Initial Genital Herpes
Dubbelblinda, placebokontrollerade studier har visat att oralt administrerat ZOVIRAX® signifikant minskade varaktigheten av akut infektion och varaktigheten av lesionsläkning. Varaktigheten av smärta och nybildning av lesioner minskade i vissa patientgrupper.
Återkommande genital herpes
I en studie av patienter som fick ZOVIRAX® 400 mg två gånger dagligen under 3 år förblev 45, 52 och 63 % av patienterna fria från återfall under det första, andra respektive tredje året. Serieanalyser av 3 månaders återfallsfrekvens för patienterna visade att 71 till 87 % var återfallsfria varje kvartal.
Herpes zoster infektioner
I en dubbelblind, placebokontrollerad studie av immunkompetenta patienter med lokaliserad kutan zosterinfektion, förkortade ZOVIRAX® (800 mg 5 gånger dagligen i 10 dagar) tiden till sårskorpor, läkning och fullständigt upphörande av smärta, och minskade varaktigheten av viruset. avfall och varaktigheten av ny lesionsbildning.
en liknande dubbelblind, placebokontrollerad studie förkortade ZOVIRAX® (800 mg 5 gånger dagligen i 7 dagar) tiderna för att slutföra sårskavning, läkning och upphörande av smärta, och minskade varaktigheten av nybildning av lesioner.
Behandlingen påbörjades inom 72 timmar efter att utslagen började och var mest effektiv om den påbörjades inom de första 48 timmarna. Vuxna äldre än 50 år visade större nytta.
Vattkoppor
Tre randomiserade, dubbelblinda, placebokontrollerade studier utfördes på 993 pediatriska patienter i åldern 2 till 18 år med vattkoppor. Alla patienter behandlades inom 24 timmar efter uppkomsten av utslag. I två försök administrerades ZOVIRAX® med 20 mg/kg fyra gånger dagligen (upp till 3 200 mg per dag) i 5 dagar. I den tredje studien administrerades doser på 10, 15 eller 20 mg/kg fyra gånger dagligen under 5 till 7 dagar. Behandling med ZOVIRAX® förkortade tiden till 50 % läkning, minskade det maximala antalet lesioner, minskade medianantalet vesiklar, minskade medianantalet kvarvarande lesioner dag 28 och minskade andelen patienter med feber, anorexi och letargi dag 2. Behandling med ZOVIRAX® påverkade inte varicella zoster-virusspecifika humorala eller cellulära immunsvar 1 månad eller 1 år efter behandling.
Detaljerad farmakologi
Ser Handling och klinisk farmakologi.
Virologi
Det kvantitativa sambandet mellan in vitro-känsligheten hos herpes simplex-virus (HSV) och varicella-zoster-virus (VZV) för acyklovir och det kliniska svaret på terapi har inte fastställts hos människa, och testning av viruskänslighet har inte standardiserats. Känslighetstestresultat, uttryckta som den koncentration av läkemedel som krävs för att hämma tillväxten av virus i cellkultur (ID50) med 50 %, varierar mycket beroende på den speciella analys som används, vilken celltyp som används och laboratoriet som utför testet. ID50 för acyklovir mot HSV-1-isolat kan variera från 0,02 μg/mL (plackreduktion i Vero-celler) till 5,9-13,5 μg/mL (plackreduktion i gröna njurceller [GMK]). ID50 mot HSV-2 varierar från 0,01 till 9,9 μg/mL (plackreduktion i Vero- respektive GMK-celler).
Med hjälp av en färgupptagningsmetod i Vero-celler, som ger ID50-värden cirka 5 till 10 gånger högre än plackreduktionsanalyser, undersöktes 1 417 HSV-isolat (553 HSV-1 och 864 HSV-2) från cirka 500 patienter över en 5- årsperiod. Dessa analyser fann att 90 % av HSV-1-isolaten var känsliga för ≤ 0,9 μg/ml acyklovir och 50 % av alla isolat var känsliga för ≤ 0,2 μg/mL acyklovir. För HSV-2-isolat var 90 % känsliga för ≤ 2,2 μg/ml och 50 % av alla isolat var känsliga för ≤ 0,7 μg/mL acyklovir. Isolat med signifikant minskad känslighet hittades hos 44 patienter. Det måste betonas att varken patienterna eller isolaten valdes ut slumpmässigt och därför inte representerar den allmänna befolkningen. De flesta av de mindre känsliga kliniska HSV-isolaten har varit relativt bristfälliga i det virala tymidinkinaset (TK). Stammar med förändringar i viralt TK eller viralt DNA-polymeras har också rapporterats.
ID50 mot VZV sträcker sig från 0,17-1,53 μg/mL (avkastningsminskning, fibroblaster från mänskliga förhud) till 1,85-3,98 μg/mL (reduktion av foci, fibroblaster från mänskliga embryo [HEF]). Reproduktion av EBV-genom undertrycks med 50 % i superinfekterade Raji-celler eller P3HR-1 lymfoblastoidceller med 1,5 μg/ml acyklovir. Cytomegalovirus (CMV) är relativt resistent mot acyklovir med ID50-värden som sträcker sig från 2,3-17,6 μg/mL (plackreduktion, HEF-celler) till 1,82-56,8 μg/mL (DNA-hybridisering, HEF-celler). Det latenta tillståndet av genomet hos något av de humana herpesvirusen är inte känt för att vara känsligt för acyklovir.
Motstånd
Långvarig exponering av HSV för subinhibitoriska koncentrationer (0,1 μg/ml) av acyklovir i cellkultur har resulterat i uppkomsten av en mängd olika acyklovirresistenta stammar. Uppkomsten av resistenta stammar tros ske genom "selektion" av naturligt förekommande virus med relativt låg känslighet för acyklovir. Sådana stammar har rapporterats i isolat före behandling från flera kliniska studier.
Två resistensmekanismer som involverar viralt tymidinkinas (krävs för aktivering av acyklovir) har beskrivits. Dessa är: (a) selektion av tymidin-kinas-defekta mutanter som inducerar liten eller ingen enzymaktivitet efter infektion, och (b) selektion av mutanter som har ett tymidinkinas med förändrad substratspecificitet som kan fosforylera den naturliga nukleosiden tymidin men inte acyklovir. Majoriteten av mindre känsliga virus som uppstår in vitro är av typen tymidin-kinas-brist som har minskad infektionsförmåga och patogenicitet och mindre sannolikhet att inducera latens hos djur.
En acyklovirresistent HSV-infektion hos en immunsupprimerad benmärgstransplantatmottagare på förlängd acyklovirterapi visade sig dock bero på ett kliniskt isolat som hade ett normalt tymidinkinas men ett förändrat DNA-polymeras. Denna tredje resistensmekanism som involverar DNA-polymeras från herpes simplexvirus beror på valet av mutanter som kodar för ett förändrat enzym, som är resistent mot inaktivering av acyklovirtrifosfat.
VZV verkar manifestera resistens mot acyklovir via mekanismer som liknar de som ses i HSV.
Begränsad klinisk undersökning har dock inte avslöjat några bevis för en signifikant förändring av in vitro-känslighet för VZV med acyklovirterapi, även om resistenta mutanter av detta virus kan isoleras in vitro på ett sätt som är analogt med HSV. Analys av ett litet antal kliniska isolat från patienter som fått oral acyklovir eller placebo för akut herpes zoster tyder på att in vivo uppkomst av resistent VZV kan inträffa sällan. Långvarig acyklovirbehandling av mycket immunförsvagade patienter med förvärvat immunbristsyndrom och svår VZV kan leda till uppkomsten av resistenta virus.
Korsresistens mot andra antivirala medel förekommer in vitro i acyklovirresistenta mutanter. HSV-mutanter som är resistenta mot acyklovir på grund av frånvaro av viralt tymidinkinas är korsresistenta mot andra medel som fosforyleras av herpesvirus tymidinkinas, såsom bromovinyldeoxiuridin, ganciklovir och 2'-fluorpyrimidinnukleosiderna, såsom, 2'-fluoro. -5-jodoarabinosyl-cytosin (FIAC).
Det kliniska svaret på acyklovirbehandling har vanligtvis varit bra för patienter med normal immunitet från vilka HSV med minskad känslighet för acyklovir har återhämtats, antingen före, under eller efter behandlingen. Vissa patientgrupper, såsom gravt immunförsvagade (särskilt benmärgstransplanterade) och de som genomgår kroniska suppressiva regimer har identifierats som oftast associerade med uppkomsten av resistenta herpes simplex-stammar, som kan eller inte kan åtfölja ett dåligt svar. till drogen. Möjligheten av uppkomsten av mindre känsliga virus måste erkännas vid behandling av sådana patienter, och känslighetsövervakning av kliniska isolat från dessa patienter bör uppmuntras.
Sammanfattningsvis har det kvantitativa sambandet mellan in vitro-känsligheten hos HSV och VZV för acyklovir och det kliniska svaret på terapi inte klart fastställts hos människa. Standardiserade metoder för viruskänslighetstestning krävs för att möjliggöra mer exakta korrelationer mellan in vitro-viruskänslighet och kliniskt svar på acyklovirterapi.
Toxikologi
Akut toxicitetsstudier
Vuxna möss och råttor : Den akuta toxiciteten för oral acyklovir bestämdes som visas i tabell 6.
Neonatala, omogna och vuxna råttor
Grupper om 10 han- och 10 honråttor av Charles River CD (Sprague-Dawley) fick stora enstaka doser (5 olika dosnivåer) av en lösning (pH 11,0) av acyklovir genom subkutan injektion när de var 3, 10, 28 och 71 dagar. myndig. De observerades i 14 dagar efter behandling och LD50-värden beräknades med Litchfield och Wilcoxon-metoden (se tabell 7 nedan). Denna studie gjordes för att fastställa om ålder vid exponering påverkar den akuta toxiciteten av acyklovir; det fanns inga bevis för att unga råttor var känsligare än äldre råttor för de akuta toxiska effekterna av acyklovir.
Det fanns inget uppenbart samband mellan överlevnadslängden efter behandling och ålder då behandlingen gavs. Kliniska tecken för råttorna som behandlades vid 3 och 10 dagars ålder inkluderade röda och lila hudblåsor, blå områden, sårskorpor, ärr, nekrotisk och nedsliten hud, öppna sår, kroppsskakningar och alopeci. Nedsatt aktivitet, tårbildning, stängda ögonlock, rödbrunt eller brunt material runt ögon, näsa och mun, ataxi, utmattning, kroppsskakningar, urinfläckar runt buken eller könsorganet, skurna eller nekrotiska områden och alopeci observerades hos råttor som behandlades kl. 28 och 71 dagars ålder.
Subkronisk oral toxicitetsstudie
Möss
Fyra grupper vardera bestående av 28 han- och 28 honmöss av Charles River CD-1 (ICR) doserades oralt genom magsond under 33 dagar med suspensioner av acyklovir. Dagliga dosnivåer var 0, 50, 150 och 450 mg/kg. Hematologiska och kliniska kemimätningar gjordes på ytterligare 8 hanmöss och 8 honmöss per grupp (doserade på samma sätt) efter den första och fjärde veckan av dosering och under den 3:e efterdosveckan.
Plasmaläkemedelskoncentrationer mättes i poolade prover från ytterligare 4 hanmöss och 4 honmöss per grupp på dosdagarna 1, 15 och 30.
Baserat på preliminära experiment med råttor och möss valdes den höga dosen på 450 mg/kg för att producera de högsta plasmanivåerna av läkemedel som kan uppnås, på ett praktiskt sätt, genom oral dosering till en gnagarart. Genomsnittliga plasmakoncentrationer av läkemedel varierade från cirka 3,4 (vid den låga dosen) till 11,0 (vid den höga dosen) μg/ml plasma en timme efter oral dosering.
Inga förändringar i hälsa, tillväxthastighet, hematologi och kliniska kemimätningar inträffade som definitivt kunde tillskrivas dosering med acyklovir. Grov- och histopatologiska undersökningar av 16 hanråttor och 16 honråttor från högdos- och kontrollgrupperna vid slutet av dosperioden visade inget anmärkningsvärt.
Kronisk toxicitetsstudier
Livstidsstudie av oral toxicitet hos råttor som fått acyklovir genom gastrisk intubation
Charles River CD (Sprague-Dawley)-råttor gavs suspensioner av acyklovir genom sondmatning. Det fanns 50 hanråttor och 50 honråttor vid var och en av följande dosnivåer: 0, 50, 150 och 450 mg/kg. Efter 30 och 52 veckors behandling obducerades 10 hanråttor och 10 honråttor från varje grupp. De återstående råttorna doserades varje dag tills den naturliga dödligheten minskade en gruppstorlek till ungefär 20 % av antalet djur av det könet som fanns i testgrupperna när studien startade. Alla återstående råttor dödades och obducerades när gränsen på 20 % nåddes. Detta var under vecka 110 för hanråttorna och vecka 122 för honråttorna. Vävnader från kontrollråttor och de i högdosgruppen utvärderades med ljusmikroskopi. Vävnader från råttor i låg- och medeldosgrupperna med massor, knölar eller ovanliga lesioner undersöktes också med ljusmikroskopi. Fixerade vävnader från råttor som hittades döda under de första 52 veckorna av studien utvärderades också med ljusmikroskopi.
Inga tecken på toxicos observerades. Plasmaprover uppsamlades 1,5 timmar efter dosering på dagarna 7, 90, 209, 369, 771 (endast män) och 852 (endast kvinnor). Genomsnittliga plasmanivåer påträffade hos män med höga doser (450 mg/kg/dag) vid de tidpunkter som anges ovan var följande: 1,54, 1,63, 1,39, 1,60 och 1,70 μg/ml (6,84, 7,26, 6,17, 7,60 och 7 μM). . Motsvarande medelplasmanivåer för högdoshonorna för motsvarande tidsperioder var 1,76, 2,38, 2,12, 1,71 och 1,81 μg/mL (7,82, 10,58, 9,44, 7,62 och 8,03 μM). Plasmanivåer hos både män och kvinnor vid alla dosnivåer efter ett års behandling var i allmänhet jämförbara med plasmanivåer som erhölls vid tidigare provtagningar. Värden för laboratorietester inklusive hematologi, klinisk kemi och oftalmoskopi var alla inom det normala intervallet. Det fanns inga läkemedelsinducerade grova eller mikroskopiska lesioner och det fanns inga bevis för att acyklovir påverkade överlevnaden.
Livstids oral karcinogenicitetsstudie hos råttor
Det fanns inga tecken på toxicos hos Charles River CD (Sprague-Dawley)-råttor (100 råttor/kön/dosgrupp) som fick acyklovir genom oral sondmatning vid 50, 150 och 450 mg/kg i en livslång oral karcinogenicitetsstudie. Genomsnittliga plasmanivåer erhållna hos män med höga doser 1,5 timmar efter dosering vid olika provtagningstider under studien var följande: 1,54, 1,63, 1,39, 1,60 och 1,70 μg/ml (6,84, 7,26, 6,17, 7,56 dagar och .M) 7, 90, 209, 369 respektive 771. Motsvarande medelvärden för honorna med hög dos var 1,76, 2,38, 2,12, 1,71 och 1,81 μg/ml (7,82, 10,58, 9,44, 7,62 och 8,03 μM) vid respektive dag 7, 90, 92, 82, 82, 82, 82, 82, 82, 82, 58, 9,44, 7,62 och 8,03 μM.
Värden för kliniska laboratorietester inklusive hematologi, klinisk kemi, urinanalys, kroppsvikt, matkonsumtion och oftalmoskopi var alla inom normala intervall. Det fanns inga läkemedelsinducerade grova eller mikroskopiska lesioner och det fanns inga bevis för att acyklovir påverkade överlevnad, tidsmönster för tumörincidens eller tumörtal för godartade eller maligna neoplasmer.
De flesta av de relativt få råttor som hittats döda eller döende under de första 52 veckorna av denna studie drabbades av doseringsolyckor, vilket framgår av postmortemfynd av esofagusperforering som orsakade pleurautgjutning, lunginflammation eller mediastinit.
Livstids oral karcinogenicitetsstudie hos möss
Det fanns inga tecken på toxicos hos Charles River CD-1 (ICR) möss (115 möss/kön/dosgrupp) som gavs acyklovir genom oral sondmatning vid 50, 150 och 450 mg/kg/dag i en livslång oral karcinogenicitetsstudie. Genomsnittliga plasmanivåer erhållna hos män med hög dos 1,5 timmar efter dosering vid olika provtagningstider under studien var följande: 2,83, 3,17 och 1,82 μg/ml (12,59, 14,10 och 8,10 μM) vid dag 90, 3165 respektive 5. Motsvarande medelvärden för honorna med hög dos var 9,81, 5,85 och 4,0 μg/ml (43,60, 26,0 och 17,79 μM).
Värden för kliniska laboratorietester inklusive hematologi, kroppsvikt och matkonsumtion var alla inom normala intervall. Det fanns inga läkemedelsinducerade grova eller mikroskopiska lesioner. Honmöss som fick 150 och 450 mg/kg acyklovir överlevde signifikant längre än kontrollmöss av honkön; överlevnaden för behandlade män var jämförbar med överlevnaden för kontrollhanar. Mönster för tumörincidens och tumörtal för benigna eller maligna neoplasmer påverkades inte av behandling med acyklovir.
Kronisk 12-månaders oral toxicitetsstudie på hundar
Renrasiga Beaglehundar gavs 0, 15, 45 eller 150 mg/kg/dag av acyklovir varje dag under de första två veckorna av en ettårig studie. Det fanns 9 hanar och 9 tikar i varje testgrupp. Hundarna fick gelatinkapslar som innehöll lämplig dos. De behandlades tid, varför doserna administrerade vid var och en av tre lika fördelade dosperioder var 0, 5, 15 och 50 mg/kg. Dosnivåerna på 45 och 150 mg/kg inducerade diarré, kräkningar, minskad matkonsumtion och viktminskning hos både han- och honhundar under de första två veckorna av studien. Av denna anledning togs beslutet under den tredje veckan av studien att minska medel- och högdosnivåerna till 30 och 60 mg/kg/dag (10 och 20 mg/kg tid). Den låga dosen på 15 mg/kg/dag (5 mg/kg tid) var oförändrad. Hundar som fick 60 mg/kg/dag kräktes då och då och hade ibland diarré men klarade sig bra under testets varaktighet, och värden för kroppsviktsökning och matkonsumtion var jämförbara med kontrollvärden.
Under den toxicos som inducerades av de större doserna av acyklovir var plasmanivåerna av läkemedlet sannolikt mycket höga (vilket indikeras av initiala medelvärden på 24,0 μg/mL (106,6 μM) för högdos män och 17,4 μg/ml (77,2 μM) för kvinnor med hög dos när det bestäms 1 timme efter den tredje dosen på dag 1 av studien). Vid mätning på dag 15 var plasmanivåerna av acyklovir hos hundar med höga doser (150 mg/kg/dag) fortfarande mycket höga men de minskade senare när doserna minskades. Värden för plasmanivåer efter 12 månaders behandling var i allmänhet jämförbara med värden som registrerades efter 1, 3 och 6 månaders behandling. Det fanns således ingen indikation på ökad metabolism av acyklovir som ett resultat av kronisk behandling.
Under den 13:e veckan hade vissa han- och honhundar vid både medel- och högdosnivåer följande tecken: ömhet i framtassar, erosion av trampdynor och brytning och lossning av naglar. Regenerering av tappade naglar började några veckor senare. Naglar regenererade efter 6 månader (när 3 hanar och 3 honor från varje grupp dödades för ett tillfälligt offer) och vid slutet av studien var av allmänt god kvalitet. Det fanns aldrig några tecken på effekt på tassar eller naglar hos hundar i lågdosgruppen (15 mg/kg/dag).
Det är accepterat att skada på korialepitelet som producerar nagelkeratin kan resultera i stoppad produktion av keratin och produktion av onormalt keratin. Den övergående toxicosen som induceras av de stora doserna (45 och 150 mg/kg/dag) av acyklovir som gavs under de första två veckorna av studien kan ha påverkat korialepitelet. Om det fanns en övergående effekt på korialepitelet (möjligen relaterat till direkta effekter eller sekundärt till läkemedelsinducerad sjukdom under de första två veckorna av studien) kan senare förlust av nageln vara en följd. Inga märkbara effekter på andra keratinproducerande eller keratininnehållande vävnader observerades. Det bör betonas att förändringarna i naglarna verkade vara relaterade till den övergående toxicosen inducerad av dosnivåer på 50 och 150 mg/kg/dag testade under de första två veckorna av studien och inte till 30 och 60 mg/kg /dag dosnivåer testade därefter.
Det fanns inga viktiga läkemedelsinducerade förändringar i värden för biokemiska serumtester, urinanalyser och elektrokardiografiska tester utförda med lämpliga intervall under denna studie. Värden för serumalbumin och totalt protein minskade något hos hundar som behandlades med 30 och 60 mg/kg/dag under 6 och 12 månader. Alla värden för dessa parametrar höll sig dock inom gränser som accepteras som normala.
Med undantag för kvarvarande förändringar i gammalt keratin i klornas spetsar fanns inga tecken på behandlingsrelaterade effekter i någon av de vävnader som undersökts med ljusmikroskopi. Inte heller fanns det meningsfulla förändringar i värden för de organ som vägdes vid obduktion. Således tolererades dosnivåer upp till 60 mg/kg/dag väl under ett år. Dosnivån "ingen doseffekt" av acyklovir var 15 mg/kg/dag (5 mg/kg tid); dock var de enda biverkningarna vid 30 eller 60 mg/kg/dag förändringar i naglar och trampdynor (30 och 60 mg/kg/dag) och milda gastrointestinala symtom (60 mg/kg/dag).
Reproduktionsstudier
Teratologi – Råttor
Acyclovir administrerades till dräktiga ARS Sprague-Dawley honråttor genom subkutan injektion under organogenesperioden (dag 6 till och med dag 15 av dräktigheten) vid dosnivåer på 0,0, 6,0, 12,5 och 25,0 mg/kg kroppsvikt två gånger dagligen.
Kriterier som utvärderades för sammansatt effekt inkluderade moderns kroppsvikter, viktökningar, utseende och beteende, överlevnadsfrekvens, ögonförändringar, graviditetsfrekvens och reproduktionsdata. Avkommans livsduglighet och utveckling utvärderades också.
Utöver ovanstående mätningar avlivades utsedda djur 1 timme efter den första dosen på dag 15 för att samla in prover av moderns blod, fostervatten och foster för mätningar av läkemedelskoncentrationen. Medelvärden från dessa prover listas i tabell 8.
De erhållna värdena för plasma skulle representera cirka 30 % av initiala plasmanivåer bedömt av plasmahalveringstiden hos gnagare.
Inga effekter hänförliga till administrering av acyklovir noterades vid jämförelser av moderns kroppsviktsvärden, utseende och beteende, överlevnadsfrekvens, graviditetsfrekvens eller implantationseffektivitet. Dessutom noterades inga föreningsrelaterade skillnader i utvärderingar av fosterstorlek, kön och utveckling.
Även om incidensen av resorption och fosterlivsduglighet låg inom intervallet för normal variabilitet i alla grupperna, noterades något större incidenser av resorptioner hos djuren med hög dos som avlivats på dagarna 15 och 19 av dräktigheten; dock uppstod inga tydliga dosrelaterade trender.
Därför ansågs acyklovir inte vara teratogent eller embryotoxiskt när det administrerades till råttor i nivåer upp till 50,0 mg/kg kroppsvikt per dag under organogenesen.
Teratologi – kaniner
En teratologisk studie gjordes på vita kaniner från Nya Zeeland med i huvudsak samma experimentella design som hos råtta, förutom att doseringen var från dag 6 till dag 18 av dräktigheten. Även insamling av foster, fostervatten och prover av moderns blod skedde på dag 18 snarare än dag 15.
Inga tecken på maternell toxicitet observerades vid någon dos, men det fanns en statistiskt signifikant (p
Koncentrationer av acyklovir detekterades i plasma- och fostervattenprover, såväl som i homogenat av fostervävnad. Alla prover togs en timme efter den första dosen på dag 18 av graviditeten. Läkemedelskoncentrationerna i fostervatten var väsentligt högre än i plasma (se tabell 9).
Reproduktion – Fertilitet
Acyclovir visade sig inte försämra fertiliteten eller reproduktionen i grupper om 15 hanmöss och 30 honmöss i en tvågenerations fertilitetsstudie. Mössen i denna studie gavs acyklovir genom gastrisk intubation vid dosnivåer på 50, 150 och 450 mg/kg/dag. Hanar doserades i 64 dagar i följd före parning och honor i 21 dagar före parning.
en fertilitetsstudie på råtta där grupper om 20 hanråttor och 20 honråttor gavs 0, 12,5, 25,0 och 50,0 mg/kg/dag genom subkutan injektion, visades aciklovir inte ha någon effekt på parning eller fertilitet. Hanarna doserades i 60 dagar före parning och tills deras parningsschema var avslutat. Honråttor doserades i 14 dagar före parning och fram till dag 7 av dräktigheten. Vid 50 mg/kg/dag sc var det en statistiskt signifikant ökning av post-implantationsförlusten, men ingen samtidig minskning av kullstorleken.
Hos 25 honkaniner som behandlades subkutant med 50 mg/kg/dag acyklovir dag 6 till 18 av dräktigheten fanns en statistiskt signifikant minskning av implantationseffektiviteten men ingen samtidig minskning av kullstorleken. Det fanns också en dosrelaterad ökning av antalet foster med överflödiga revben i alla läkemedelsbehandlade grupper. Denna ökning var inte dosrelaterad när förekomsten av överflödiga revben per kull undersöktes.
Hos 15 honkaniner som behandlades intravenöst med 50 mg/kg/dag acyklovir dag 6 till 18 av dräktigheten fanns ingen effekt på vare sig implantationseffektiviteten eller kullstorleken.
I en peri- och postnatal studie på råtta (20 honråttor per grupp) gavs acyklovir subkutant med 0, 12,5, 25 och 50 mg/kg/dag från 17 dagars dräktighet till 21 dagar efter förlossningen. Vid 50 mg/kg/dag sc var det en statistiskt signifikant minskning av gruppens medelantal av corpora lutea, totala implantationsställen och levande foster i F1-generationen. Även om det inte var statistiskt signifikant, fanns det också en dosrelaterad minskning av gruppmedelantalet levande foster och implantationsställen vid 12,5 mg/kg/dag och 25 mg/kg/dag sc.
en dosstudie med 5 kaniner av honkön orsakade intravenös administrering av acyklovir i en dos på 100 mg/kg/dag från dag 6 till 8 av graviditeten, en dos som är känd för att orsaka obstruktiv nefropati, en signifikant ökning av fosterresorptioner och motsvarande minskning av kullstorleken. Vid en maximalt tolererad intravenös dos på 50 mg/kg/dag hos kaniner fanns inga läkemedelsrelaterade reproduktionseffekter.
I en subkronisk toxicitetsstudie där grupper om 20 hanråttor och 20 honråttor gavs intraperitoneala doser av acyklovir med 0, 20, 80 eller 320 mg/kg/dag under en månad, och följdes under en månad efter dosering, förekom testikel. atrofi. Vissa histologiska bevis på återhämtning av spermieproduktion var uppenbara 30 dagar efter dosering, men detta var otillräcklig tid för att visa full reversibilitet.
Grupper om 25 hanråttor och 25 honråttor administrerades intraperitoneala doser av acyklovir vid 0, 5, 20 eller 80 mg/kg/dag under 6 månader. Tio hanråttor och 10 honråttor i varje grupp fortsatte odoserade under 13 veckor. Testikelatrofi var begränsad till högdosråttor som fick 80 mg/kg/dag under 6 månader. Organviktsdata och ljusmikroskopi definierade full reversibilitet av testikelatrofin vid slutet av återhämtningsperioden efter dosen.
I en 31-dagars hundstudie (16 hanar och 16 honor per grupp) där acyklovir administrerades intravenöst i nivåer av 50, 100 och 200 mg/kg/dag, var testiklarna normala hos hundar vid 50 mg/kg. Doser på 100 eller 200 mg/kg/dag orsakade död hos vissa hundar på grund av cytostatiska effekter (benmärg och gastrointestinala epitel) och aspermiska testiklar eller testiklar med spridda aspermiska tubuli. Det kan inte uteslutas att testikelförändringen kan ha varit primär, men liknande förändringar kan observeras sekundärt till svår stress hos döende hundar.
Utvecklingstoxicitetsstudier
Neonatala råttor - subkronisk studie
Acyclovir löst i 0,4 % steril koksaltlösning gavs genom subkutan injektion till Charles River CD (Sprague-Dawley) neonatala råttor under 19 dagar i följd, med början den 3:e dagen efter förlossningen. De testade dosnivåerna var 0, 5, 20 och 80 mg/kg kroppsvikt. Det fanns 12 kullar (var och en bestående av 5 hanar och 5 nyfödda honor som ammade den naturliga moderdjuret) vid varje dosnivå. Dammarna behandlades inte. Nyfödda togs bort från varje grupp för obduktion och mikroskopisk utvärdering av en mängd olika vävnader, inklusive ögon och flera delar av hjärnan, efter att de hade behandlats i 5, 12 eller 19 dagar och efter en 3-veckors läkemedelsfri period efter dosering ( då de var 45 dagar gamla). Hematologiska (hemoglobin, packad cellvolym, RBC, WBC och differentiella cellantal) och klinisk kemi (BUN) tester gjordes efter 16 dagars behandling och upprepades 18 dagar efter att den sista (19:e) dosen gavs.
Blod samlades in från några nyfödda 30 minuter efter behandling på dag 1, dag 9 och vid slutet av dosperioden för bestämning av koncentrationer av acyklovir i plasma. Den största koncentrationen av acyklovir i plasma var 99,1 μg/ml (440,5 μM) i poolad plasma som samlats in från 6 kvinnliga högdos (80 mg/kg) nyfödda 30 minuter efter att den första dosen gavs. Behandling med acyklovir ökade inte dödligheten under neonatalperioden.
Råttor i lågdosgruppen gick upp lika mycket i kroppsvikt som de respektive kontrollråttorna. Signifikanta (p
Ögonundersökningar och ljusmikroskopi avslöjade inga negativa effekter på ögonutvecklingen. Det bör betonas att det inte fanns några morfologiska eller funktionella bevis för negativa effekter på utvecklande hjärna eller andra delar av det centrala nervsystemet. Sålunda är acyklovir tydligt annorlunda än cytosinarabinosid som rapporterades producera framträdande cerebellär och retinal dysplasi hos neonatala råttor.
Mutagenicitet och andra korttidsstudier
Acyclovir har testats för mutagen potential i ett antal in vitro- och in vivo-system: 10 november 2014 Sida 27 av 38
Mikrobiell
Acyclovir testades med avseende på mutagen aktivitet i Ames Salmonella-plattanalysen; i en preinkubationsmodifiering av Ames-analysen; i Rosenkrantz E. coli polA+/polA-DNA-reparationsanalys; och i eukaryoten S. cerevisiae, D-4. Alla studier utfördes både i närvaro och frånvaro av exogen metabolisk aktivering hos däggdjur. Acyclovir gav inga positiva svar i något av dessa system.
De tidigare Salmonellastudierna utökades till extremt höga koncentrationer för att uppnå toxicitet. Inga positiva effekter observerades vare sig i närvaro eller frånvaro av exogen metabolisk aktivering hos däggdjur, vid koncentrationer av acyklovir upp till 300 mg/platta eller 80 mg/ml.
Däggdjurssystem
Acyclovir testades för mutagen aktivitet i odlade L5178Y-muslymfomceller, heterozygota vid tymidinkinas (TK)-lokus, genom att mäta framåtmutationshastigheten till TK-brist (TK+/- → TK-/-; ytterligare studier utfördes vid HGPRT locus och vid Ouabain-resistensmarkören i dessa samma celler. Alla studier utfördes i närvaro och i frånvaro av exogen metabolisk aktivering av däggdjur. Testföreningen var mutagen på TK-lokuset vid höga koncentrationer (400 -2 400 μg/mL) (Som jämförelse är den övre gränsen för maximala plasmanivåer av acyklovir efter oral dosering av 200 mg q4h 0,9 μg/ml.) Den var negativ vid HGPRT-lokuset och Ouabain-resistensmarkören. Identiska resultat erhölls med och utan metabolisk aktivering.
Osäkra resultat utan uppenbart dosrelaterat svar erhölls när acyklovirs mutagenicitet studerades vid vart och ett av 3 loci (APRT, HGPRT och Ouabain-resistens) i ovarieceller från kinesisk hamster (CHO), både i närvaro och frånvaro av exogen metabol aktivering.
Acyclovir, i en koncentration av 50 μg/ml (222 μM) för en 72-timmars exponering, har visat sig orsaka en statistiskt signifikant ökning av förekomsten av morfologiskt transformerade härdar till följd av behandling av BALB/C-3T3-celler in vitro i frånvaron av exogen metabolisk aktivering. De morfologiskt transformerade härdarna har visats växa som tumörer efter transplantation till immunsupprimerade, syngena, avvandande möss. Tumörvävnader diagnostiserades som antingen odifferentierade sarkom eller lymfosarkom.
Acyclovir, vid koncentrationer mellan 8 och 64 μg/ml under 18 timmars exponering, inducerade inte några morfologiskt transformerade foci bland C3H/10T ½-celler behandlade in vitro i frånvaro av exogen metabolisk aktivering.
Acyclovir, vid koncentrationer på 62,5 och 125 μg/ml för en 48-timmars exponering, inducerade inga kromosomavvikelser i odlade humana lymfocyter i frånvaro av exogen metabolisk aktivering. Vid högre koncentrationer, 250 och 500 μg/ml under 48 timmars exponering, orsakade acyklovir en signifikant ökning av förekomsten av kromosombrott. Det fanns också en signifikant dosrelaterad minskning av mitotiskt index vid exponering för acyklovir.
Acyklovir, vid doser av 25 och 50 mg/kg/dag ip under 5 dagar i följd, gav inte en dominant dödlig effekt hos BKA (CPLP) hanmöss. Vidare fanns det inga bevis för en dominant dödlig effekt på Charles River CD-1 (ICR) han- och honmöss behandlade oralt vid dosnivåer på 50, 150 och 450 mg/kg/dag som sammanfattats för tvågenerationsstudien om reproduktion/fertilitet. .
Acyclovir, vid enstaka intraperitoneala doser på 25, 50 och 100 mg/kg, kunde inte inducera kromosomavvikelser i benmärgsceller hos kinesiska hamstrar när de undersöktes 24 timmar efter dosering. Vid högre nefrotoxiska doser (500 och 1 000 mg/kg) sågs en blastogen effekt. (En intraperitoneal dos på 500 mg/kg ger genomsnittliga maximala plasmanivåer hos kinesiska hamstrar på 611 μg/mL (2,72 mM) vilket är 680 gånger högre än den övre gränsen för humana toppplasmanivåer under oral dosering på 200 mg q4h).
Acyclovir, vid enstaka intravenösa doser på 25, 50 och 100 mg/kg, kunde inte inducera kromosomavvikelser i benmärgsceller hos han- och honråttor när de undersöktes 6, 24 och 48 timmar efter behandling.
Alltså visade alla dessa studier att acyklovir inte orsakar mutationer i singelgen utan kan bryta kromosomer.
Immunotoxikologiska studier
Acyclovir utsattes för ett antal immunologiska tester in vitro och in vivo.
I två in vivo-tester, lymfocytmedierad cytotoxicitet och neutrofil kemotaxi, visade acyklovir inga hämmande effekter vid koncentrationer så höga som 135 μg/ml (600 μM). Föreningen hämmade rosettbildningen med cirka 50 % vid 0,9 μg/ml (4 μM).
fyra in vivo-tester på möss som mätte cellmedierad immunitet (komplementberoende cellulär cytotoxicitet, komplementoberoende cellulär cytotoxicitet, fördröjd överkänslighet och transplantat vs. värdreaktion) visade aciklovir inga hämmande effekter vid engångsdoser upp till 200 mg/kg givet på dag 2 efter antigen stimulering.
Fyra dagliga doser på 100 mg/kg/dag hade ingen signifikant effekt på Jerne hemolysin plack eller cirkulerande antikropp på dag 7 efter antigen stimulering. När Jerne hemolysin plack och antikroppstitrar undersöktes fyra dagar efter antigen utmaning och en dag efter den sista läkemedelsdosen, visade 100 mg/kg endast en lätt undertryckande effekt. Emellertid gav 200 mg/kg en viss viktminskning (-2,2 g), en måttlig minskning av antalet Jerne-hemolysinplack (PFC/mjälte reducerades till 33 % av kontrollen, PFC/107 WBC till 46,5 % av kontrollen). Det var dock endast en liten minskning av den cirkulerande hemagglutinintitern (från 8,3 till 6,5) och den cirkulerande hemolysintitern (från 9,5 till 8,3) vid 200 mg/kg.
experiment på möss utformade för att testa om acyklovir skulle potentiera den immunsuppressiva effekten av azatioprin på antikroppsbildning, fann man att effekterna av de två läkemedlen inte var mer än additiv. Endast 200 mg/kg dosen av acyklovir visade en ökad suppression av antikroppssvar när den gavs i kombination med azatioprin i doser över 25 mg/kg.
Studier utfördes för att utvärdera in vitro inverkan av acyklovir på human lymfocytfunktion. Hämmande effekter på blastogenes sågs endast i analyser som undersökte toppkoncentrationer av potenta mitogener, fytohemagglutinin (PHA) och concanavalin A (Con A), och endast vid koncentrationer av läkemedel över 50 μg/ml (222 μM) och var mycket mindre med monilia och stelkrampstoxoidantigener, där det blastogena svaret är karakteristiskt mindre kraftigt. Det var mycket liten effekt på cytotoxicitet eller LIF-produktion förutom vid koncentrationer på 200 μg/mL (890 μM) där det redan har visats vara en direkt cytotoxisk effekt. Dessa hämmande koncentrationer är långt över förväntade nivåer från doser valda för klinisk tillämpning och över 1 000 gånger högre än den koncentration som krävs för att hämma herpesvirusförökning in vitro.
Effekten av acyklovir på mänskliga celler mättes. En koncentration på 11,2 - 22,5 μg/mL (50-100 μM) hämmar uppdelningen av fibroblaster i varierande utsträckning, beroende på den experimentella designen och sammanflödet av monoskiktet. Omfattningen av denna effekt var mindre än den som orsakades av adenin-arabinosid eller humant leukocytinterferon när dessa tre antivirala medel jämfördes vid kliniskt relevanta koncentrationer. Acyklovir hämmade också tymidininkorporering av mononukleära celler i perifert blod stimulerade av PHA eller tre olika herpesvirusantigener. En linjär dos-responskurva observerades med dessa celler, och deras proliferation hämmades till 50 % av 22,5 μg/ml (100 μM) acyklovir. Hämning utövades på T-cellsproliferation utan uppenbar effekt på frisättningen av lymfokiner eller på monocytfunktionen.
Det bör också nämnas att det inte fanns några bevis för negativa effekter på immunsystemet i de detaljerade subkroniska och kroniska djurtester som behandlats tidigare i denna sammanfattning förutom vid alltför höga doser (50 till 100 mg/kg två gånger dagligen) på hundar med utpräglad lymfoid hypoplasi inträffade.
REFERENSER
1. Balfour HH, Jr., Kelly JM, Suarez CS, Heussner RC, Englund JA, Crane DD et al. Acyklovirbehandling av varicella hos i övrigt friska barn. J Pediatr 1990; 116(4):633-639.
2. Balfour HH, Jr., Rotbart HA, Feldman S, Dunkle LM, Feder HM, Jr., Prober CG et al. Acyklovirbehandling av varicella hos i övrigt friska ungdomar. The Collaborative Acyclovir Varicella Study Group. J Pediatr 1992; 120(4 Pt 1):627-633.
3. Barry DW, Blum MR. Antivirala läkemedel: acyklovir, i de senaste framstegen inom klinisk farmakologi. Turner P, Shand DG (red) Churchill Livingstone, Edinburgh 1983.
4. Barry DW, Nusinoff-Lehrman S. Viral resistens i klinisk praxis: sammanfattning av fem års erfarenhet av acyklovir. Farmakologiska och kliniska tillvägagångssätt för herpesvirus och viruskemoterapi, Aiso, Japan, 10-13 september 1984.
5. Barry DW, Nusinoff-Lehrman S, Ellis MN, Biron KK, Furman PA. Viral resistens, klinisk erfarenhet. Scand J Infect Dis Suppl 1985; 47:155-164.
6. Barry DW, Nusinoff-Lehrman S. Viral resistens i klinisk praxis: sammanfattning av fem års erfarenhet av acyklovir. Proceedings of the International Symposium on Pharmacological and Clinical Approches to Herpes Viruses and Virus Chemotherapy, Elsever, Amsterdam 1985;269-270.
7. Biron KK, Elion GB. Effekt av acyklovir i kombination med andra antiherpetiska medel på varicella zoster-virus in vitro. Am J Med 1982; 73(lA):54-57.
8. Boelaert J, Schurgers M, Daneels R, Van Landuyt HW, Weatherley BC. Farmakokinetik för flera doser av intravenöst acyklovir hos patienter i kontinuerlig ambulatorisk peritonealdialys. J Antimicrob Chemother 1987; 20(1):69-76.
9. Bryson YJ, Dillon M, Lovett M, Acuna G, Taylor S, Cherry JD et al. Behandling av första episoder av genital herpes simplex-virusinfektion med oral acyclovir. En randomiserad dubbelblind kontrollerad studie på normala försökspersoner. N Engl J Med 1983; 308(16):916-921.
10. Burns WH, Saral R, Santos GW, Laskin OL, Lietman PS, McLaren C et al. Isolering och karakterisering av resistent Herpes simplex-virus efter acyklovirbehandling. Lancet 1982; 1(8269):421-423.
11. Christophers J, Sutton RN. Karakterisering av acyklovirresistenta och känsliga kliniska herpes simplex-virusisolat från en immunsupprimerad patient. J Antimicrob Chemother 1987; 20(3):389-398.
12. Cole NL, Balfour HH, Jr. Varicella-Zoster-virus blir inte mer resistent mot acyklovir under behandlingen. J Infect Dis 1986; 153(3):605-608.
13. Collins P, Bauer DJ. Aktiviteten in vitro mot herpesvirus av 9-(2-hydroxietoximetyl)guanin (acykloguanosin), ett nytt antiviralt medel. J Antimicrob Chemother 1979; 5(4):431-436.
14. Collins P, Oliver NM. Känslighetsövervakning av herpes simplex-virusisolat från patienter som får acyklovir. J Antimicrob Chemother 1986; 18 Suppl B:103-112.
15. Collins P. Viral känslighet efter introduktionen av acyklovir. Am J Med 1988; 85(2A):129-134.
16. Collins P, Larder BA, Oliver NM, Kemp S, Smith IW, Darby G. Karakterisering av en DNA-polymerasmutant av herpes simplex-virus från en allvarligt immunförsvagad patient som får acyklovir. J Gen Virol 1989; 70 (Pt 2):375-382.
17. Crumpacker CS, Schnipper LE, Zaia JA, Levin MJ. Tillväxthämning av acykloguanosin av herpesvirus isolerade från mänskliga infektioner. Antimicrob Agents Chemother 1979; 15(5):642-645.
18. Crumpacker CS, Schnipper LE, Marlowe SI, Kowalsky PN, Hershey BJ, Levin MJ. Resistens mot antivirala läkemedel av herpes simplex-virus isolerat från en patient behandlad med acyklovir. N Engl J Med 1982; 306(6):343-346.
19. Darby G, Inglis MM, Larder BA. Mekanismer för resistens mot nukleosidanaloghämmare av herpes simplex-virus. 6th Int Congr Virol 1984;(Abstract #W34-5).
20. De Clercq E, Descamps J, Verhelst G, Walker RT, Jones AS, Torrence PF et al. Jämförande effekt av antiherpesläkemedel mot olika stammar av herpes simplexvirus. J Infect Dis 1980; 141(5):563-574.
21. De Clercq E. Jämförande effekt av antiherpesläkemedel i olika cellinjer. Antimicrob Agents Chemother 1982; 21(4):661-663.
22. Dekker C, Ellis MN, McLaren C, Hunter G, Rogers J, Barry DW. Virusresistens i klinisk praxis. J Antimicrob Chemother 1983; 12 Suppl B:137-152.
23. Douglas JM, Davis LG, Remington ML, Paulsen CA, Perrin EB, Goodman P et al. En dubbelblind, placebokontrollerad studie av effekten av kroniskt administrerad oral acyclovir på spermieproduktion hos män med ofta återkommande genital herpes. J Infect Dis 1988 Mar; 157:588-93.
24. Douglas JM, Critchlow C, Benedetti J, Mertz GJ, Connor JD, Hintz MA et al. En dubbelblind studie av oral acyklovir för undertryckande av återfall av genital herpes simplex-virusinfektion. N Engl J Med 1984; 310(24):1551-1556.
25. Dunkle LM, Arvin AM, Whitley RJ, Rotbart HA, Feder HM, Jr., Feldman S et al. En kontrollerad prövning av acyklovir mot vattkoppor hos normala barn. N Engl J Med 1991; 325(22):1539-1544.
26. Ellis MN, Keller PM, Martin JL, Strauss SE, Nusinoff-Lehrman S etal. Karakterisering av ett HSV-2 kliniskt isolat innehållande en ACV-resistent mutant som producerar ett tymidinkinas med förändrad substratspecificitet. Ninth Int Herpesvirus Workshop, Seattle, Washington, 24-29 augusti 1984.
27. Ellis MN, Keller PM, Fyfe JA, Martin JL, Rooney JF, Straus SE et al. Kliniskt isolat av herpes simplex-virus typ 2 som inducerar ett tymidinkinas med förändrad substratspecificitet. Antimicrob Agents Chemother 1987; 31(7):1117-1125.
28. Englund JA, Zimmerman ME, Swierkosz EM, Goodman JL, Scholl DR, Balfour HH, Jr. Herpes simplex-virus resistent mot acyklovir. En studie på en vårdcentral. Ann Intern Med 1990; 112(6):416-422.
29. Erlich KS, Jacobson MA, Koehler JE, Follansbee SE, Drennan DP, Gooze L et al. Foscarnet-terapi för svåra acyklovirresistenta herpes simplex-virus typ 2-infektioner hos patienter med förvärvat immunbristsyndrom (AIDS). Ett okontrollerat försök. Ann Intern Med 1989; 110(9):710-713.
30. Erlich KS, Mills J, Chatis P, Mertz GJ, Busch DF, Follansbee SE et al. Acyclovir-resistenta herpes simplex-virusinfektioner hos patienter med förvärvat immunbristsyndrom. N Engl J Med 1989; 320(5):293-296.
31. Field HJ, Darby G, Wildy P. Isolering och karakterisering av acyklovirresistenta mutanter av herpes simplex-virus. J Gen Virol 1980; 49(1):115-124.
32. Fält HJ. Problemet med läkemedelsinducerad resistens i virus, i Problem med antiviral terapi. Stuart-Harris CH, Oxford J (Eds) Academic Press, London 1983.
33. Fyfe K. Återkommande mönster av genital herpes efter upphörande av mer än 5 års kronisk acyklovirsuppression. VIII Int Conf AIDS/III Std Wrld Cong 1992;(B240).
34. Huff JC, Bean B, Balfour HH, Jr., Laskin OL, Connor JD, Corey L et al. Terapi av herpes zoster med oral acyclovir. Am J Med 1988; 85(2A):84-89.
35. Jacobson MA, Berger TG, Fikrig S, Becherer P, Moohr JW, Stanat SC et al. Acyclovir-resistent varicella zoster-virusinfektion efter kronisk oral acyclovirbehandling hos patienter med förvärvat immunbristsyndrom (AIDS). Ann Intern Med 1990; 112(3):187-191.
36. Kaplowitz LG, Baker D, Gelb L, Blythe J, Hale R, Frost P et al. Långvarig kontinuerlig acyklovirbehandling av normala vuxna med ofta återkommande genital herpes simplex-virusinfektion. Acyclovir Study Group. JAMA 1991; 265(6):747-751.
37. Krasny HC, Liao SH, de Miranda P, Laskin OL, Whelton A, Lietman PS. Inverkan av hemodialys på acyklovirs farmakokinetik hos patienter med kronisk njursvikt. Am J Med 1982; 73(lA):202-204.
38. Kurtz T. Säkerhet och effekt av långvarig suppressiv cyklovirbehandling av ofta återkommande genital herpes: resultat år 5. 30th Intersci Conf Antimicrob Agents Chemother 1990;270.
39. Laskin OL, Longstreth JA, Whelton A, Krasny HC, Keeney RE, Rocco L et al. Effekt av njursvikt på farmakokinetiken för acyklovir. Am J Med 1982; 73(lA):197-201.
40. Lau RJ, Emery MG, Galinsky RE. Oväntad ackumulering av acyklovir i bröstmjölk med uppskattning av spädbarnsexponering. Obstet Gynecol 1987; 69(3 Pt 2):468-471.
41. Lehrman SN, Douglas JM, Corey L, Barry DW. Återkommande genital herpes och suppressiv oral acyclovirbehandling. Samband mellan kliniskt utfall och in vitro läkemedelskänslighet. Ann Intern Med 1986; 104(6):786-790.
42. Marlowe S, Douglas J, Corey L, Schnipper L, Crumpacker C. Sensitivity of HSV genital isolat after oral acyclovir. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8-10 oktober 1984.
43. Mattison HR, Reichman RC, Benedetti J, Bolgiano D, Davis LG, Bailey-Farchione A et al. Dubbelblind, placebokontrollerad studie som jämför långvarig suppressiv behandling med kortvarig oral acyklovirbehandling för behandling av återkommande genital herpes. Am J Med 1988; 85(2A):20-25.
44. McLaren C, Sibrack CD, Barry DW. Spektrum av känslighet för acyklovir av kliniska isolat av herpes simplexvirus. Am J Med 1982; 73(lA):376-379.
45. McLaren C, Ellis MN, Hunter GA. En kolorimetrisk analys för att mäta känsligheten hos herpes simplex-virus för antivirala medel. Antiviral Res 1983; 3(4):223-234.
46. McLaren C, Corey L, Dekket C, Barry DW. In vitro-känslighet för acyklovir i genital herpes simplex-virus från acyklovirbehandlade patienter. J Infect Dis 1983; 148(5):868-875.
47. Mertz GJ, Critchlow CW, Benedetti J, Reichman RC, Dolin R, Connor J et al. Dubbelblind placebokontrollerad prövning av oral acyklovir vid infektion med genital herpes simplexvirus i första avsnittet. JAMA 1984; 252(9):1147-1151.
48. Mertz GJ, Jones CC, Mills J, Fife KH, Lemon SM, Stapleton JT et al. Långtidsdämpning av acyklovir av ofta återkommande genital herpes simplex-virusinfektion. Ett multicenter dubbelblindprov. JAMA 1988; 260(2):201-206.
49. Mertz GJ, Eron L, Kaufman R, Goldberg L, Raab B, Conant M et al. Långvarig kontinuerlig kontra intermittent oral acyklovirbehandling hos normala vuxna med ofta återkommande genital herpes simplex-virusinfektion. Am J Med 1988; 85(2A):14-19.
50. Meyer LJ, de Miranda P, Sheth N, Spruance S. Acyclovir i human bröstmjölk. Am J Obstet Gynecol 1988; 158(3 Pt 1):586-588.
51. Mindel A, Weller IV, Faherty A, Sutherland S, Hindley D, Fiddian AP et al. Profylaktisk oral acyklovir vid återkommande genital herpes. Lancet 1984; 2(8394):57-59.
52. Morton P, Thomson AN. Oral acyclovir vid behandling av herpes zoster i allmänpraktik. NZ Med J 1989; 102(863):93-95.
53. Naib ZM, Nahmias AJ, Josey WE, Zaki SA. Relation av cytohistopatologi av genital herpesvirusinfektion till cervikal anaplasi. Cancer Res 1973; 33(6):1452-1463.
54. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K et al. Effekten av oral acyklovir vid behandling av initial och återkommande genital herpes. Lancet 1982; 2(8298):571-573.
55. Nusinoff-Lehrman S, Hunter G, Rogers J, Corey L, Davis G. Aciklovirkänsligheten in vitro hos herpesvirus utsöndras av patienter som får suppressiv oral terapi. 24th Interscience Conf Antimicrob Ag Chemother, Washington, DC, 8-10 oktober 1984; (Abstract #1015).
56. O'Brien JJ, Campoli-Richards DM. Acyclovir. En uppdaterad översyn av dess antivirala aktivitet, farmakokinetiska egenskaper och terapeutisk effekt. Drugs 1989; 37(3):233-309.
57. Pahwa S, Biron K, Lim W, Swenson P, Kaplan MH, Sadick N et al. Kontinuerlig varicella-zoster-infektion associerad med acyklovirresistens hos ett barn med AIDS. JAMA 1988; 260(19):2879-2882.
58. Parker AC, Craig JI, Collins P, Oliver N, Smith I. Acyclovir-resistent herpes simplex-virusinfektion på grund av förändrat DNA-polymeras. Lancet 1987; 2(8573):1461.
59. Parris DS, Harrington JE. Herpes simplex-virusvarianter som begränsar höga koncentrationer av acyklovir finns i kliniska isolat. Antimicrob Agents Chemother 1982; 22(1):71-77.
60. Preblud SR, Arbeter AM, Proctor EA, Starr SE, Plotkin SA. Mottaglighet hos vaccinstammar av varicella-zoster-virus för antivirala föreningar. Antimicrob Agents Chemother 1984; 25(4):417-421.
61. Reichman RC, Badger GJ, Mertz GJ, Corey L, Richman DD, Connor JD et al. Behandling av återkommande genital herpes simplex-infektioner med oral acyclovir. En kontrollerad prövning. JAMA 1984; 251(16):2103-2107.
62. Shah GM, Winer RL, Krasny HC. Acyclovirs farmakokinetik hos en patient på kontinuerlig ambulatorisk peritonealdialys. Am J Kidney Dis 1986; 7(6):507-510.
63. Sibrack CD, Gutman LT, Wilfert CM, McLaren C, St Clair MH, Keller PM et al. Patogenicitet av acyklovirresistent herpes simplex-virus typ 1 från ett immunbristbarn. J Infect Dis 1982; 146(5):673-682.
64. Straus SE, Seidlin M, Takiff H, Jacobs D, Bowen D, Smith HA. Oral acyclovir för att undertrycka återkommande herpes simplex-virusinfektioner hos patienter med immunbrist. Ann Intern Med 1984; 100(4):522-524.
65. Straus SE, Takiff HE, Seidlin M, Bachrach S, Lininger L, DiGiovanna JJ et al. Dämpning av ofta återkommande genital herpes. En placebokontrollerad dubbelblind studie av oral acyklovir. N Engl J Med 1984; 310(24):1545-1550.
66. Straus SE, Croen KD, Sawyer MH, Freifeld AG, Felser JM, Dale JK et al. Acyclovir-dämpning av ofta återkommande genital herpes. Effekt och minskat behov under flera år av behandling. JAMA 1988; 260(15):2227-2230.
67. Vinckier F, Boogaerts M, De Clerck D, De Clercq E. Kronisk herpetisk infektion hos en immunsupprimerad patient: rapport om ett fall. J Oral Maxillofac Surg 1987; 45(8):723-728.
68. Wade JC, Newton B, McLaren C, Flournoy N, Keeney RE, Meyers JD. Intravenös acyklovir för att behandla mukokutan herpes simplex-virusinfektion efter märgtransplantation: en dubbelblind studie. Ann Intern Med 1982; 96(3):265-269.
69. Wade JC, McLaren C, Meyers JD. Frekvens och betydelse av acyklovirresistent herpes simplex-virus isolerat från märgtransplanterade patienter som får flera behandlingskurer med acyklovir. J Infect Dis 1983; 148(6):1077-1082.
PATIENTINFORMATION
Patienter uppmanas att rådgöra med sin läkare om de upplever allvarliga eller besvärliga biverkningar, de blir gravida eller tänker bli gravida, de tänker amma medan de tar oralt administrerat ZOVIRAX (acyklovir) eller om de har andra frågor.
Patienter bör rådas att bibehålla adekvat hydrering.
