Copegus 100mg Ribavirin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Copegus 100mg och hur används det?
Copegus 100mg är ett receptbelagt läkemedel som används för att behandla symptomen på kronisk hepatit C. Copegus 100mg kan användas ensamt eller tillsammans med andra läkemedel.
Copegus tillhör en klass av läkemedel som kallas hepatit B/hepatit C-medel; RSV-ombud.
Vilka är de möjliga biverkningarna av Copegus?
Copegus kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- problem med din syn,
- svår smärta i övre delen av magen sprider sig till ryggen,
- illamående,
- kräkningar,
- diarre,
- ny eller förvärrad hosta,
- feber,
- stickande smärta i bröstet,
- väsande andning,
- andnöd,
- allvarlig depression,
- tankar på att skada sig själv eller skada någon annan,
- blek eller gulnad hud,
- mörkfärgad urin,
- förvirring,
- svaghet,
- frossa,
- influensaliknande symtom,
- svullna tandkött,
- munsår,
- hudsår,
- lätt att få blåmärken,
- ovanlig blödning, och
- yrsel
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Copegus inkluderar:
- illamående,
- kräkningar,
- aptitlöshet,
- feber,
- frossa eller skakningar,
- lågt antal blodkroppar,
- anemi,
- svaghet,
- trötthet,
- huvudvärk,
- träningsvärk,
- humörförändringar,
- ångest och
- irritabilitet
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Copegus. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
RISK FÖR ALLVARLIGA STÖDNINGAR OCH RIBAVIRIN-ASSOCIERADE EFFEKTER
COPEGUS (ribavirin) monoterapi är inte effektivt för behandling av kronisk hepatit C-virusinfektion och bör inte användas ensamt för denna indikation.
Den primära kliniska toxiciteten för ribavirin är hemolytisk anemi. Anemin i samband med behandling med ribavirin kan resultera i förvärring av hjärtsjukdom och leda till dödliga och icke-dödliga hjärtinfarkter. Patienter med en historia av signifikant eller instabil hjärtsjukdom bör inte behandlas med COPEGUS [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER, BIVERKNINGAR samt DOSERING OCH ADMINISTRERING].
Signifikanta teratogena och/eller embryocidala effekter har visats hos alla djurarter som exponerats för ribavirin. Dessutom har ribavirin en halveringstid för flera doser på 12 dagar, och det kan kvarstå i icke-plasmakompartment så länge som 6 månader. Därför är ribavirin, inklusive COPEGUS 100 mg, kontraindicerat hos kvinnor som är gravida och hos manliga partners till kvinnor som är gravida. Extrem försiktighet måste iakttas för att undvika graviditet under behandlingen och i 6 månader efter avslutad behandling hos både kvinnliga patienter och hos kvinnliga partner till manliga patienter som tar ribavirinbehandling. Minst två tillförlitliga former av effektiva preventivmedel måste användas under behandlingen och under den 6-månaders uppföljningsperioden efter behandlingen [se KONTRAINDIKATIONER, VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER, samt användning i specifika populationer].
BESKRIVNING
COPEGUS 100mg, ribavirin, är en nukleosidanalog med antiviral aktivitet. Det kemiska namnet på ribavirin är 1-β-Dribofuranosyl-1H-1,2,4-triazol-3-karboxamid och har följande strukturformel:
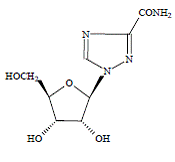
Den empiriska formeln för ribavirin är C8H12N4O5 och molekylvikten är 244,2. Ribavirin är ett vitt till benvitt pulver. Det är fritt lösligt i vatten och lätt lösligt i vattenfri alkohol.
COPEGUS (ribavirin) finns tillgänglig som en ljusrosa till rosa färgad, platt, oval, filmdragerad tablett för oral administrering. Varje tablett innehåller 200 mg ribavirin och följande inaktiva ingredienser: förgelatinerad stärkelse, mikrokristallin cellulosa, natriumstärkelseglykolat, majsstärkelse och magnesiumstearat. Beläggningen på tabletten innehåller Chromatone-P eller Opadry Pink (tillverkad med hydroxipropylmetylcellulosa, talk, titandioxid, syntetisk gul järnoxid och syntetisk röd järnoxid), etylcellulosa (ECD-30) och triacetin.
INDIKATIONER
COPEGUS 100 mg i kombination med PEGASYS (peginterferon alfa-2a) är indicerat för behandling av patienter 5 år och äldre med kronisk hepatit C (CHC)-virusinfektion som har kompenserat leversjukdom och som inte tidigare har behandlats med interferon alfa.
Följande punkter bör beaktas när COPEGUS 100 mg kombinationsbehandling med PEGASYS påbörjas:
- Denna indikation är baserad på kliniska prövningar av kombinationsterapi hos patienter med CHC och kompenserad leversjukdom, av vilka några hade histologiska tecken på cirros (Child-Pugh klass A), och hos vuxna patienter med kliniskt stabil HIV-sjukdom och CD4-tal över 100 celler/mm³.
- Denna indikation är baserad på att uppnå odetekterbart HCV-RNA efter behandling i 24 eller 48 veckor, baserat på HCV-genotyp, och bibehålla ett ihållande virologiskt svar (SVR) 24 veckor efter den sista dosen.
- Säkerhets- och effektdata finns inte tillgängliga för behandling längre än 48 veckor.
- Säkerheten och effekten av COPEGUS 100 mg och PEGASYS-behandling har inte fastställts hos lever- eller andra organtransplanterade patienter, patienter med dekompenserad leversjukdom eller tidigare icke-reagerande på interferonterapi.
- Säkerheten och effekten av COPEGUS-behandling för behandling av adenovirus, RSV, parainfluensa eller influensainfektioner har inte fastställts. COPEGUS ska inte användas för dessa indikationer. Ribavirin för inhalation har en separat bipacksedel, som bör konsulteras om inhalationsbehandling med ribavirin övervägs.
DOSERING OCH ADMINISTRERING
COPEGUS 100mg ska tas med mat. COPEGUS ska ges i kombination med PEGASYS; det är viktigt att notera att COPEGUS 100 mg aldrig ska ges som monoterapi. Ser PEGASYS Bipacksedel för alla instruktioner angående PEGASYS dosering och administrering.
Kronisk hepatit C monoinfektion
Vuxna patienter
Den rekommenderade dosen av COPEGUS 100 mg tabletter anges i Tabell 1. Den rekommenderade behandlingstiden för patienter som tidigare inte behandlats med ribavirin och interferon är 24 till 48 veckor.
Den dagliga dosen av COPEGUS 100 mg är 800 mg till 1200 mg administrerat oralt i två uppdelade doser. Dosen bör anpassas till patienten beroende på sjukdomens utgångspunkt (t.ex. genotyp), respons på behandlingen och tolerabiliteten av regimen (se ).
Pediatriska patienter
PEGASYS administreras som 180 mcg/1,73 m² x BSA en gång i veckan subkutant, till en maximal dos på 180 mcg, och bör ges i kombination med ribavirin. Den rekommenderade behandlingstiden för patienter med genotyp 2 eller 3 är 24 veckor och för andra genotyper är 48 veckor.
COPEGUS ska ges i kombination med PEGASYS. COPEGUS 100mg är endast tillgänglig som en 200 mg tablett och därför bör vårdgivaren avgöra om denna storlek tablett kan sväljas av den pediatriska patienten. De rekommenderade doserna för COPEGUS anges i tabell 2. Patienter som påbörjar behandling före sin 18-årsdag bör bibehålla pediatrisk dosering under behandlingens slut.
Kronisk hepatit C med HIV-saminfektion
Vuxna patienter
Den rekommenderade dosen för behandling av kronisk hepatit C hos patienter som samtidigt är infekterade med HIV är PEGASYS 180 mcg subkutant en gång i veckan och COPEGUS 800 mg genom munnen dagligen under en total varaktighet av 48 veckor, oavsett HCV-genotyp.
Dosändringar
Vuxna och pediatriska patienter
Om allvarliga biverkningar eller laboratorieavvikelser utvecklas under kombinationsbehandling med COPEGUS/PEGASYS, bör dosen ändras eller avbrytas, om så är lämpligt, tills biverkningarna avtar eller minskar i svårighetsgrad. Om intoleransen kvarstår efter dosjustering ska COPEGUS/PEGASYS-behandlingen avbrytas. Tabell 3 ger riktlinjer för dosändringar och utsättning baserat på patientens hemoglobinkoncentration och hjärtstatus.
COPEGUS 100 mg ska administreras med försiktighet till patienter med redan existerande hjärtsjukdom. Patienterna bör utvärderas innan behandlingen påbörjas och bör övervakas på lämpligt sätt under behandlingen. Om det finns någon försämring av kardiovaskulär status ska behandlingen avbrytas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Riktlinjerna för dosändringar av COPEGUS 100 mg som beskrivs i denna tabell gäller även laboratorieavvikelser eller andra biverkningar än minskningar av hemoglobinvärden.
Vuxna patienter
När COPEGUS 100 mg har hållits på grund av antingen en laboratorieavvikelse eller klinisk biverkning, kan ett försök göras att starta om COPEGUS 100 mg med 600 mg dagligen och ytterligare öka dosen till 800 mg dagligen. Det rekommenderas dock inte att COPEGUS ökas till den ursprungliga tilldelade dosen (1000 mg till 1200 mg).
Pediatriska patienter
Efter upplösning av en laboratorieavvikelse eller klinisk biverkning kan en ökning av COPEGUS 100 mg-dosen till den ursprungliga dosen försökas beroende på läkarens bedömning. Om COPEGUS har stoppats på grund av en laboratorieavvikelse eller klinisk biverkning, kan ett försök göras att starta om COPEGUS 100 mg med halva hela dosen.
Nedsatt njurfunktion
Den totala dagliga dosen av COPEGUS bör minskas för patienter med kreatininclearance mindre än eller lika med 50 ml/min; och veckodosen av PEGASYS bör minskas för kreatininclearance mindre än 30 ml/min enligt följande i Tabell 4 [se Användning i specifika populationer , Farmakokinetik , och PEGASYS Bipacksedel ].
Dosen av COPEGUS 100 mg bör inte modifieras ytterligare hos patienter med nedsatt njurfunktion. Om allvarliga biverkningar eller laboratorieavvikelser utvecklas, ska COPEGUS avbrytas, om så är lämpligt, tills biverkningarna avtar eller minskar i svårighetsgrad. Om intoleransen kvarstår efter att COPEGUS 100 mg återupptagits, bör COPEGUS/PEGASYS-behandlingen avbrytas.
Inga data finns tillgängliga för pediatriska patienter med nedsatt njurfunktion.
Avbrytande av dosering
Avbrytande av PEGASYS/COPEGUS 100 mg-behandling bör övervägas om patienten inte har visat en minskning med minst 2 log10 från baslinjen i HCV-RNA med 12 veckors behandling, eller odetekterbara HCV-RNA-nivåer efter 24 veckors behandling.
Behandling med PEGASYS/COPEGUS 100 mg bör avbrytas hos patienter som utvecklar leverdekompensation under behandlingen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
HUR LEVERERAS
Doseringsformer och styrkor
COPEGUS (ribavirin) finns tillgänglig som en ljusrosa till rosa färgad, platt, oval, filmdragerad tablett för oral administrering. Varje tablett innehåller 200 mg ribavirin.
COPEGUS® (ribavirin) finns som tabletter för oral administrering. Varje tablett innehåller 200 mg ribavirin och är ljusrosa till rosa färgad, platt, oval, filmdragerad och graverad med RIB 200 på ena sidan och ROCHE på andra sidan. De är förpackade som flaska med 168 tabletter ( NDC 0004-0086-94).
Förvaring Och Hantering
Förvara flaskan med COPEGUS® tabletter vid 25°C (77°F); utflykter är tillåtna mellan 15°C och 30°C (59°F och 86°F) [se USP-kontrollerad rumstemperatur ]. Förvara flaskan väl tillsluten.
Tillverkad av: Hoffmann-La Roche, Inc. c/o Genentech, Inc. Medlem av Roche Group, 1 DNA Way, South San Francisco, CA 94080-4990. Reviderad: augusti 2015
BIEFFEKTER
PEGASYS i kombination med COPEGUS orsakar ett brett utbud av allvarliga biverkningar [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. De vanligaste allvarliga eller livshotande biverkningarna som induceras eller förvärras av COPEGUS/PEGASYS inkluderar depression, självmord, återfall av drogmissbruk/överdos och bakterieinfektioner som var och en uppträder med en frekvens på mindre än 1 %. Leverdekompensation inträffade hos 2 % (10/574) CHC/HIV-patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Erfarenhet av kliniska studier
Eftersom kliniska prövningar genomförs under mycket varierande förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i de kliniska prövningarna av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i klinisk praxis.
Vuxna patienter
I de pivotala registreringsstudierna NV15801 och NV15942 fick 886 patienter COPEGUS under 48 veckor i doser på 1000/1200 mg baserat på kroppsvikt. I dessa studier inträffade en eller flera allvarliga biverkningar hos 10 % av monoinfekterade patienter med CHC och hos 19 % av patienter med CHC/HIV som fick PEGASYS enbart eller i kombination med COPEGUS. Den vanligaste allvarliga biverkningen (3 % vid CHC och 5 % vid CHC/HIV) var bakteriell infektion (t.ex. sepsis, osteomyelit, endokardit, pyelonefrit, lunginflammation).
Andra allvarliga biverkningar inträffade med en frekvens på mindre än 1 % och inkluderade: självmord, självmordstankar, psykos, aggression, ångest, drogmissbruk och överdosering av droger, angina, leverdysfunktion, fettlever, kolangit, arytmi, diabetes mellitus, autoimmuna fenomen (t.ex. hypertyreos, hypotyreos, sarkoidos, systemisk lupus erythematosus, reumatoid artrit), perifer neuropati, aplastisk anemi, magsår, gastrointestinal blödning, pankreatit, kolit, hornhinnesår, pulmonell emboli, lungemboli, mybolocyt, lungemboli, psykotisk störning och hallucinationer.
Andelen patienter i kliniska prövningar som upplevde en eller flera biverkningar var 98 %. De vanligaste rapporterade biverkningarna var psykiatriska reaktioner, inklusive depression, sömnlöshet, irritabilitet, ångest och influensaliknande symtom som trötthet, feber, myalgi, huvudvärk och stelhet. Andra vanliga reaktioner var anorexi, illamående och kräkningar, diarré, artralgi, reaktioner på injektionsstället, alopeci och klåda.
visar frekvenser av biverkningar som inträffade hos mer än eller lika med 5 % av försökspersonerna som fick kombinationsbehandling med pegylerat interferon och ribavirin i CHC Clinical Trial, NV15801.
Tio procent av monoinfekterade patienter med CHC som fick 48 veckors behandling med PEGASYS i kombination med COPEGUS 100 mg avbröt behandlingen; 16% av CHC/HIV-saminfekterade patienter avbröt behandlingen. De vanligaste orsakerna till att behandlingen avbröts var psykiatriska, influensaliknande syndrom (t.ex. letargi, trötthet, huvudvärk), dermatologiska och gastrointestinala störningar och laboratorieavvikelser (trombocytopeni, neutropeni och anemi).
Totalt behövde 39 % av patienterna med CHC eller CHC/HIV modifiering av PEGASYS- och/eller COPEGUS-behandlingen. Den vanligaste orsaken till dosändring av PEGASYS hos patienter med CHC och CHC/HIV var laboratorieavvikelser; neutropeni (20 % respektive 27 %) och trombocytopeni (4 % respektive 6 %). Den vanligaste orsaken till dosändring av COPEGUS hos patienter med CHC och CHC/HIV var anemi (22 % respektive 16 %).
PEGASYS-dosen reducerades hos 12 % av patienterna som fick 1000 mg till 1200 mg COPEGUS 100 mg under 48 veckor och hos 7 % av patienterna som fick 800 mg COPEGUS under 24 veckor. COPEGUS-dosen reducerades hos 21 % av patienterna som fick 1000 mg till 1200 mg COPEGUS 100 mg under 48 veckor och hos 12 % av patienterna som fick 800 mg COPEGUS 100 mg under 24 veckor.
Monoinfekterade patienter med kronisk hepatit C som behandlats i 24 veckor med PEGASYS och 800 mg COPEGUS 100 mg observerades ha lägre incidens av allvarliga biverkningar (3 % mot 10 %), hemoglobin mindre än 10 g/dL (3 % vs. 15 %) , dosändring av PEGASYS (30 % vs. 36 %) och COPEGUS (19 % vs. 38 %), och avbrytande från behandling (5 % vs. 15 %) jämfört med patienter som behandlats i 48 veckor med PEGASYS och 1000 mg eller 1200 mg COPEGUS. Å andra sidan verkade den totala förekomsten av biverkningar vara likartad i de två behandlingsgrupperna.
Pediatriska patienter
en klinisk prövning med 114 pediatriska försökspersoner (5 till 17 år) behandlade med PEGASYS enbart eller i kombination med COPEGUS 100 mg, krävdes dosjusteringar hos cirka en tredjedel av försökspersonerna, vanligast för neutropeni och anemi. I allmänhet var säkerhetsprofilen som observerades hos pediatriska försökspersoner liknande den som ses hos vuxna. I den pediatriska studien var de vanligaste biverkningarna hos patienter som behandlades med kombinationsbehandling PEGASYS och COPEGUS 100 mg i upp till 48 veckor influensaliknande sjukdom (91 %), övre luftvägsinfektion (60 %), huvudvärk (64 %), gastrointestinala störningar (56 %), hudsjukdomar (47 %) och reaktioner på injektionsstället (45 %). Sju patienter som fick kombinationsbehandling med PEGASYS och COPEGUS under 48 veckor avbröt behandlingen av säkerhetsskäl (depression, onormal psykiatrisk utvärdering, övergående blindhet, näthinneexsudat, hyperglykemi, diabetes mellitus typ 1 och anemi). Allvarliga biverkningar rapporterades hos 2 försökspersoner i gruppen PEGASYS plus COPEGUS 100 mg kombinationsterapi (hyperglykemi och kolecystektomi).
Hos pediatriska försökspersoner som randomiserades till kombinationsbehandling var incidensen av de flesta biverkningar liknande under hela behandlingsperioden (upp till 48 veckor plus 24 veckors uppföljning) jämfört med de första 24 veckorna, och ökade endast något för huvudvärk, gastrointestinala störningar , irritabilitet och utslag. Majoriteten av biverkningarna inträffade under de första 24 veckorna av behandlingen.
Tillväxthämning hos pediatriska försökspersoner
[ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Pediatriska försökspersoner som behandlades med PEGASYS plus ribavirin kombinationsterapi visade en fördröjning i vikt- och längdökningar med upp till 48 veckors behandling jämfört med baslinjen. Både vikt för ålder och längd för ålder z-poäng samt percentilerna för den normativa populationen för försökspersonens vikt och längd minskade under behandlingen. I slutet av 2 års uppföljning efter behandling hade de flesta försökspersoner återgått till normativa procentkurvor för baslinjen för vikt (64:e medelpercentilen vid baslinjen, 60:e medelpercentilen vid 2 år efter behandling) och längd (54:e medelpercentilen vid baslinjen, 56:e medelpercentilen vid baslinjen) medelpercentil 2 år efter behandling). Vid slutet av behandlingen upplevde 43 % (23 av 53) av försökspersonerna en viktpercentilminskning med mer än 15 percentiler och 25 % (13 av 53) upplevde en höjdpercentilminskning med mer än 15 percentiler på de normativa tillväxtkurvorna. 2 år efter behandling var 16 % (6 av 38) av försökspersonerna mer än 15 percentiler under sin baslinjeviktkurva och 11 % (4 av 38) var mer än 15 percentiler under sin baslinjehöjdkurva.
Trettioåtta av de 114 försökspersonerna som ingick i den långsiktiga uppföljningsstudien, som sträcker sig upp till 6 år efter behandling. För de flesta försökspersoner bibehölls återhämtningen i tillväxt efter 2 år efter behandling till 6 år efter behandling.
Vanliga biverkningar vid CHC med HIV-saminfektion (vuxna)
Biverkningsprofilen för samtidigt infekterade patienter behandlade med PEGASYS/COPEGUS i studie NR15961 liknade generellt den som visades för monoinfekterade patienter i studie NV15801 (tabell 5). Händelser som inträffade mer frekvent hos patienter som samtidigt var infekterade var neutropeni (40 %), anemi (14 %), trombocytopeni (8 %), viktminskning (16 %) och humörförändringar (9 %).
Avvikelser i laboratorietest
Vuxna patienter
Anemi på grund av hemolys är den mest signifikanta toxiciteten av ribavirinbehandling. Anemi (hemoglobin mindre än 10 g/dL) observerades hos 13 % av alla COPEGUS- och PEGASYS-kombinationsbehandlade patienter i kliniska prövningar. Den maximala minskningen av hemoglobin inträffade under de första 8 veckorna efter påbörjad behandling med ribavirin [se DOSERING OCH ADMINISTRERING ].
Pediatriska patienter
Minskning av hemoglobin, neutrofiler och trombocyter kan kräva dosreduktion eller permanent avbrytande av behandlingen [se DOSERING OCH ADMINISTRERING ]. De flesta laboratorieavvikelser som noterades under den kliniska prövningen återgick till utgångsnivåerna kort efter avslutad behandling.
Hos patienter randomiserade till kombinationsbehandling ökade förekomsten av abnormiteter under hela behandlingsfasen (upp till 48 veckor plus 24 veckors uppföljning) jämfört med de första 24 veckorna något för neutrofiler mellan 500 och 1 000 celler/mm³ och hemoglobinvärden mellan 8,5 och 10 g/dL. Majoriteten av hematologiska avvikelser inträffade under de första 24 veckorna av behandlingen.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats och rapporterats under användning av PEGASYS/COPEGUS 100 mg kombinationsbehandling efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Blod- och lymfsystemet
Aplasi av ren röda blodkroppar
Öron- och labyrintsjukdomar
Hörselnedsättning, hörselnedsättning
Ögonstörningar
Serös näthinneavlossning
Immunstörningar
Avstötning av lever och njurtransplantat
Metabolism och näringsstörningar
Uttorkning
Hud och subkutan vävnad
Stevens-Johnsons syndrom (SJS)
Toxisk epidermal nekrolys (TEN)
LÄKEMEDELSINTERAKTIONER
Resultat från en farmakokinetisk substudie visade ingen farmakokinetisk interaktion mellan PEGASYS (peginterferon alfa-2a) och ribavirin.
Nukleosid omvänt transkriptashämmare (NRTI)
In vitro-data indikerar att ribavirin minskar fosforyleringen av lamivudin, stavudin och zidovudin. Emellertid observerades ingen farmakokinetisk (t.ex. plasmakoncentrationer eller intracellulära trifosforylerade aktiva metaboliter) eller farmakodynamiska (t.ex. förlust av HIV/HCV virologisk suppression) interaktion när ribavirin och lamivudin (n=18), stavudin (n=10), eller zidovudin (n=6) administrerades samtidigt som en del av en multiläkemedelsbehandling till HCV/HIV-saminfekterade patienter.
I studie NR15961 bland CHC/HIV-saminfekterade cirrospatienter som fick NRTI observerades fall av leverdekompensation (vissa dödlig) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Patienter som får PEGASYS/COPEGUS 100 mg och NRTI bör övervakas noggrant med avseende på behandlingsrelaterade toxiciteter. Läkare bör hänvisa till förskrivningsinformation för respektive NRTI för vägledning angående toxicitetshantering. Dessutom bör dosreduktion eller utsättning av PEGASYS, COPEGUS 100 mg eller båda också övervägas om förvärrade toxiciteter observeras, inklusive leverdekompensation (t.ex. Child-Pugh större än eller lika med 6) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och DOSERING OCH ADMINISTRERING ].
Didanosin
Samtidig administrering av COPEGUS och didanosin är kontraindicerat. Koncentrationerna av didanosin eller dess aktiva metabolit (dideoxiadenosin 5'-trifosfat) ökar när didanosin administreras samtidigt med ribavirin, vilket kan orsaka eller förvärra klinisk toxicitet. Rapporter om fatal leversvikt såväl som perifer neuropati, pankreatit och symtomatisk hyperlaktatemi/laktacidos har rapporterats i kliniska prövningar [se KONTRAINDIKATIONER ].
Zidovudin
studie NR15961 utvecklade patienter som fick zidovudin i kombination med PEGASYS/COPEGUS svår neutropeni (ANC mindre än 500) och svår anemi (hemoglobin mindre än 8 g/dL) oftare än liknande patienter som inte fick zidovudin (neutropeni 15 % vs. 9 %) (anemi 5 % mot 1 %). Utsättning av zidovudin bör anses vara medicinskt lämpligt.
Läkemedel som metaboliseras av Cytokrom P450
In vitro-studier indikerar att ribavirin inte hämmar CYP 2C9, CYP 2C19, CYP 2D6 eller CYP 3A4.
Azatioprin
Användning av ribavirin för att behandla kronisk hepatit C hos patienter som får azatioprin har rapporterats inducera allvarlig pancytopeni och kan öka risken för azatioprinrelaterad myelotoxicitet. Inosinmonofosfatdehydrogenas (IMDH) krävs för en av azatioprins metaboliska vägar. Ribavirin är känt för att hämma IMDH, vilket leder till ackumulering av en azatioprinmetabolit, 6-metyltioinosinmonofosfat (6-MTITP), som är associerad med myelotoxicitet (neutropeni, trombocytopeni och anemi). Patienter som får azatioprin med ribavirin bör ha fullständiga blodvärden, inklusive trombocytantal, övervakas varje vecka under den första månaden, två gånger i månaden under den andra och tredje månaden av behandlingen, sedan en gång i månaden eller oftare om dos- eller annan behandlingsändring är nödvändig [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Signifikanta biverkningar associerade med COPEGUS/PEGASYS kombinationsbehandling inkluderar svår depression och självmordstankar, hemolytisk anemi, undertryckande av benmärgsfunktion, autoimmuna och infektionssjukdomar, oftalmologiska störningar, cerebrovaskulära störningar, lungdysfunktion, kolit, pankreatit och diabetes.
PEGASYS bipacksedeln bör granskas i sin helhet för ytterligare säkerhetsinformation innan kombinationsbehandlingen påbörjas.
Graviditet
COPEGUS 100mg kan orsaka fosterskador och/eller död hos det exponerade fostret. Ribavirin har visat signifikanta teratogena och/eller embryocidala effekter hos alla djurarter där adekvata studier har utförts. Dessa effekter inträffade vid doser så låga som en tjugondel av den rekommenderade humandosen av ribavirin.
COPEGUS-behandling ska inte påbörjas om inte en rapport om ett negativt graviditetstest har erhållits omedelbart före planerad behandlingsstart. Extrem försiktighet måste iakttas för att undvika graviditet hos kvinnliga patienter och hos kvinnliga partner till manliga patienter. Patienter bör instrueras att använda minst två former av effektiva preventivmedel under behandlingen och i 6 månader efter att behandlingen har avbrutits. Graviditetstest bör utföras varje månad under COPEGUS 100 mg-behandling och i 6 månader efter att behandlingen har avslutats [se LÅDA VARNING , KONTRAINDIKATIONER , Användning i specifika populationer , och PATIENTINFORMATION ].
Anemi
Den primära toxiciteten för ribavirin är hemolytisk anemi, som observerades hos cirka 13 % av alla COPEGUS/PEGASYS-behandlade försökspersoner i kliniska prövningar. Anemi associerad med COPEGUS 100 mg inträffar inom 1 till 2 veckor efter påbörjad behandling. Eftersom den initiala minskningen av hemoglobin kan vara signifikant, rekommenderas att hemoglobin eller hematokrit erhålls förbehandling och vid vecka 2 och vecka 4 av behandlingen eller oftare om det är kliniskt indicerat. Patienterna bör sedan följas om det är kliniskt lämpligt. Försiktighet bör iakttas vid inledande av behandling hos alla patienter med baslinjerisk för svår anemi (t.ex. sfärocytos, anamnes på gastrointestinala blödningar) [se DOSERING OCH ADMINISTRERING ].
Fatala och icke-dödliga hjärtinfarkter har rapporterats hos patienter med anemi orsakad av COPEGUS. Patienter bör utvärderas med avseende på underliggande hjärtsjukdom innan behandling med ribavirin påbörjas. Patienter med redan existerande hjärtsjukdom bör få elektrokardiogram administrerat före behandling och bör övervakas på lämpligt sätt under behandlingen. Om det finns någon försämring av kardiovaskulär status ska behandlingen avbrytas eller avbrytas [se DOSERING OCH ADMINISTRERING ]. Eftersom hjärtsjukdom kan förvärras av läkemedelsinducerad anemi, bör patienter med en historia av signifikant eller instabil hjärtsjukdom inte använda COPEGUS [se LÅDA VARNING och DOSERING OCH ADMINISTRERING ].
Leversvikt
Patienter med kronisk hepatit C (CHC) med cirros kan löpa risk för leverdekompensation och död när de behandlas med alfa-interferoner, inklusive PEGASYS. Cirrotiska CHC-patienter samtidigt infekterade med HIV som får högaktiv antiretroviral terapi (HAART) och interferon alfa-2a med eller utan ribavirin verkar ha en ökad risk för utveckling av leverdekompensation jämfört med patienter som inte får HAART. I studie NR15961 [se Kliniska studier ], bland 129 CHC/HIV-cirrospatienter som fick HAART, utvecklade 14 (11 %) av dessa patienter i alla behandlingsgrupper leverdekompensation vilket resulterade i 6 dödsfall. Alla 14 patienterna fick NRTI, inklusive stavudin, didanosin, abakavir, zidovudin och lamivudin. Dessa små antal patienter tillåter inte diskriminering mellan specifika NRTI eller tillhörande risk. Under behandlingen bör patienternas kliniska status och leverfunktion övervakas noggrant med avseende på tecken och symtom på leverdekompensation. Behandling med PEGASYS/COPEGUS 100 mg ska omedelbart avbrytas hos patienter med leverdekompensation [se KONTRAINDIKATIONER ].
Överkänslighet
Allvarliga akuta överkänslighetsreaktioner (t.ex. urtikaria, angioödem, bronkokonstriktion och anafylaxi) har observerats under alfainterferon- och ribavirinbehandling. Om en sådan reaktion inträffar, bör behandlingen med PEGASYS och COPEGUS 100 mg omedelbart avbrytas och lämplig medicinsk behandling inledas. Allvarliga hudreaktioner inklusive vesikulobulösa utslag, reaktioner i spektrumet av Stevens-Johnsons syndrom (erythema multiforme major) med varierande grad av hud- och slemhinneinblandning och exfoliativ dermatit (erytrodermi) har rapporterats hos patienter som fått PEGASYS med och utan ribavirin. Patienter som utvecklar tecken eller symtom på allvarliga hudreaktioner måste avbryta behandlingen [se NEGATIVA REAKTIONER ].
Lungsjukdomar
Dyspné, lunginfiltrat, pneumonit, pulmonell hypertoni och pneumoni har rapporterats under behandling med ribavirin och interferon. Enstaka fall av dödlig lunginflammation har förekommit. Dessutom har sarkoidos eller exacerbation av sarkoidos rapporterats. Om det finns tecken på lunginfiltrat eller lungfunktionsnedsättning ska patienterna övervakas noggrant och, om så är lämpligt, bör kombinationsbehandlingen COPEGUS/PEGASYS avbrytas.
Benmärgsdämpning
Pancytopeni (markerade minskningar av RBC, neutrofiler och trombocyter) och benmärgssuppression har rapporterats i litteraturen inträffa inom 3 till 7 veckor efter samtidig administrering av pegylerat interferon/ribavirin och azatioprin. Hos detta begränsade antal patienter (n=8) var myelotoxiciteten reversibel inom 4 till 6 veckor efter utsättande av både HCV antiviral behandling och samtidig azatioprin och återkom inte vid återinförande av någondera behandlingen ensam. PEGASYS, COPEGUS 100 mg och azatioprin ska avbrytas för pancytopeni, och pegylerat interferon/ribavirin ska inte återinföras med samtidig azatioprin [se LÄKEMEDELSINTERAKTIONER ].
Pankreatit
Behandlingen med COPEGUS och PEGASYS ska avbrytas hos patienter med tecken och symtom på pankreatit och avbrytas hos patienter med bekräftad pankreatit.
Påverkan på tillväxten hos pediatriska patienter
Under kombinationsbehandling i upp till 48 veckor med PEGASYS plus ribavirin observerades tillväxthämning hos pediatriska försökspersoner i åldern 5 till 17 år. Viktminskningar för ålder z-poäng och längd för ålder z-poäng upp till 48 veckors behandling jämfört med baslinjen observerades. 2 år efter behandling var 16 % av de pediatriska försökspersonerna mer än 15 percentiler under sin baslinjeviktkurva och 11 % var mer än 15 percentiler under sin baslinjehöjdkurva.
Tillgängliga långsiktiga data om försökspersoner som följdes upp till 6 år efter behandling är för begränsade för att bestämma risken för minskad vuxenlängd hos vissa patienter [se Erfarenhet av kliniska studier ].
Laboratorietester
Innan PEGASYS/COPEGUS kombinationsbehandling påbörjas rekommenderas standardhematologiska och biokemiska laboratorietester för alla patienter. Graviditetsscreening för kvinnor i fertil ålder måste utföras. Patienter som har redan existerande hjärtavvikelser bör få elektrokardiogram administrerat före behandling med PEGASYS/COPEGUS.
Efter påbörjad behandling bör hematologiska tester utföras efter 2 veckor och 4 veckor och biokemiska tester bör utföras efter 4 veckor. Ytterligare tester bör utföras med jämna mellanrum under behandlingen. I kliniska studier på vuxna mättes CBC (inklusive hemoglobinnivå och antal vita blodkroppar och trombocyter) och kemi (inklusive leverfunktionstester och urinsyra) efter 1, 2, 4, 6 och 8 veckor, och sedan var fjärde till 6 veckor eller oftare om avvikelser upptäcktes. I den pediatriska kliniska prövningen gjordes hematologiska och kemibedömningar vid 1, 3, 5 och 8 veckor, därefter var fjärde vecka. Sköldkörtelstimulerande hormon (TSH) mättes var 12:e vecka. Månatliga graviditetstest ska utföras under kombinationsbehandling och i 6 månader efter avslutad behandling.
Ingångskriterierna som används för de kliniska studierna av COPEGUS 100mg och PEGASYS kan betraktas som en riktlinje för acceptabla baslinjevärden för inledande av behandling:
- Trombocytantal större än eller lika med 90 000 celler/mm³ (så lågt som 75 000 celler/mm³ hos HCV-patienter med cirros eller 70 000 celler/mm³ hos patienter med CHC och HIV)
- Absolut neutrofilantal (ANC) större än eller lika med 1500 celler/mm³
- TSH och T4 inom normala gränser eller adekvat kontrollerad sköldkörtelfunktion
- CD4+-cellantal större än eller lika med 200 celler/mm³ eller CD4+-cellantal större än eller lika med 100 celler/mm³ men mindre än 200 celler/mm³ och HIV-1 RNA mindre än 5 000 kopior/ml hos patienter som samtidigt är infekterade med HIV
- Hemoglobin högre än eller lika med 12 g/dL för kvinnor och större än eller lika med 13 g/dL för män hos monoinfekterade CHC-patienter
- Hemoglobin större än eller lika med 11 g/dL för kvinnor och större än eller lika med 12 g/dL för män hos patienter med CHC och HIV
Information om patientrådgivning
- Ser FDA-godkänd patientmärkning (läkemedelsguide)
Graviditet
Patienterna måste informeras om att ribavirin kan orsaka fosterskador och/eller död hos det exponerade fostret. COPEGUS 100 mg terapi får inte användas av kvinnor som är gravida eller av män vars kvinnliga partner är gravida. Extrem försiktighet måste iakttas för att undvika graviditet hos kvinnliga patienter och hos kvinnliga partner till manliga patienter som tar COPEGUS-behandling och i 6 månader efter behandling. Patienter bör använda två tillförlitliga preventivmetoder under behandling med COPEGUS och i 6 månader efter behandling. Behandling med COPEGUS ska inte påbörjas förrän en rapport om ett negativt graviditetstest har erhållits omedelbart innan behandlingen påbörjas. Patienterna måste utföra ett graviditetstest varje månad under behandlingen och under 6 månader efter behandlingen.
Kvinnliga patienter i fertil ålder och manliga patienter med kvinnliga partners i fertil ålder måste informeras om de teratogena/embryocidala riskerna och måste instrueras att använda effektiv preventivmetod under COPEGUS-behandling och under 6 månader efter behandling. Patienter bör rådas att omedelbart meddela vårdgivaren i händelse av graviditet [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anemi
Den vanligaste biverkningen i samband med ribavirin är anemi, som kan vara allvarlig [se LÅDA VARNING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ]. Patienter bör informeras om att laboratorieutvärderingar krävs innan COPEGUS-behandling påbörjas och med jämna mellanrum därefter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Det rekommenderas att patienterna är väl hydrerade, särskilt under de inledande stadierna av behandlingen.
Patienter som utvecklar yrsel, förvirring, somnolens och trötthet bör varnas för att undvika att köra bil eller använda maskiner.
Patienter bör rådas att ta COPEGUS 100 mg tillsammans med mat.
Patienter bör förhöras om tidigare drogmissbruk innan de påbörjar COPEGUS/PEGASYS, eftersom återfall av drogberoende och läkemedelsöverdoser har rapporterats hos patienter som behandlats med interferoner.
Patienter bör rådas att inte dricka alkohol, eftersom alkohol kan förvärra kronisk hepatit C-infektion.
Patienterna ska informeras om vad de ska göra om de missar en dos av COPEGUS. De missade doserna ska tas så snart som möjligt under samma dag. Patienter ska inte dubbla nästa dos. Patienter bör rådas att ringa sin vårdgivare om de har frågor.
Patienterna bör informeras om att effekten av PEGASYS/COPEGUS-behandling av hepatit C-infektion på överföring inte är känd och att lämpliga försiktighetsåtgärder bör vidtas för att förhindra överföring av hepatit C-virus under behandlingen eller i händelse av behandlingsmisslyckande.
Patienter bör informeras om de potentiella fördelarna och riskerna med användning av COPEGUS. Instruktioner om lämplig användning bör ges, inklusive genomgång av innehållet i det bifogade LÄKEMEDELSGUIDE , vilket inte är ett avslöjande av alla eller möjliga negativa effekter.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
I en karcinogenicitetsstudie på p53 (+/-) mus upp till den maximalt tolererade dosen på 100 mg/kg/dag var ribavirin inte onkogent. Ribavirin var inte heller onkogent i en 2-årig karcinogenicitetsstudie på råtta vid doser upp till den maximalt tolererade dosen på 60 mg/kg/dag. På basis av kroppsytan är dessa doser cirka 0,5 respektive 0,6 gånger den maximala rekommenderade dagliga dosen av ribavirin för människor.
Mutagenes
Ribavirin visade mutagen aktivitet i in vitro muslymfomanalysen. Ingen klastogen aktivitet observerades i en in vivo-musmikronukleusanalys vid doser upp till 2000 mg/kg. Resultat från studier publicerade i litteraturen visar dock klastogen aktivitet i in vivo musmikronkärnanalys vid orala doser upp till 2000 mg/kg. En dominant dödlig analys på råttor var negativ, vilket indikerar att om mutationer inträffade hos råttor så överfördes de inte genom manliga könsceller.
Nedsatt fertilitet
en fertilitetsstudie på råttor visade ribavirin en marginell minskning av antalet spermier vid dosen 100 mg/kg/dag utan effekt på fertiliteten. Vid upphörande av behandlingen inträffade total återhämtning efter 1 spermatogenescykel. Abnormaliteter i spermier observerades i studier på möss utformade för att utvärdera tidsförloppet och reversibiliteten för ribavirin-inducerad testikeldegeneration vid doser på 15 till 150 mg/kg/dag (ungefär 0,1 till 0,8 gånger den maximala rekommenderade dagliga dosen av ribavirin för människor) i 3 till 6 månader. Efter avslutad behandling var i huvudsak total återhämtning från ribavirininducerad testikeltoxicitet uppenbar inom 1 eller 2 spermatogena cykler.
Kvinnliga patienter i fertil ålder och manliga patienter med kvinnliga partner i fertil ålder ska inte få COPEGUS om inte patienten och hans/hennes partner använder effektiv preventivmedel (två tillförlitliga former). Baserat på en halveringstid för flera doser (t½) av ribavirin på 12 dagar, måste effektiv preventivmetod användas under 6 månader efter behandling (dvs. 15 halveringstider för clearance för ribavirin).
Inga reproduktionstoxikologiska studier har utförts med PEGASYS i kombination med COPEGUS. Däremot har peginterferon alfa-2a och ribavirin, när de administreras separat, var och en negativa effekter på reproduktionen. Det bör antas att de effekter som produceras av endera medlen ensamma också skulle orsakas av kombinationen av de två medlen.
Användning i specifika populationer
Graviditet
Kategori X [ser KONTRAINDIKATIONER ]. Ribavirin gav betydande embryocidala och/eller teratogena effekter hos alla djurarter där adekvata studier har utförts. Missbildningar av skalle, gom, öga, käke, lemmar, skelett och mag-tarmkanalen noterades. Incidensen och svårighetsgraden av teratogena effekter ökade med eskalering av läkemedelsdosen. Överlevnaden för foster och avkommor minskade [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
I konventionella embryotoxicitets-/teratogenicitetsstudier på råttor och kaniner var dosnivåerna utan effekt långt under de för föreslagen klinisk användning (0,3 mg/kg/dag för både råtta och kanin; cirka 0,06 gånger den rekommenderade dagliga dosen av ribavirin för människor) . Ingen maternell toxicitet eller effekter på avkomma observerades i en peri/postnatal toxicitetsstudie på råttor som doserades oralt med upp till 1 mg/kg/dag (ungefär 0,01 gånger den maximala rekommenderade dagliga dosen av ribavirin för människor).
Behandling och efterbehandling: Potentiell risk för fostret
Ribavirin är känt för att ackumuleras i intracellulära komponenter varifrån det elimineras mycket långsamt. Det är inte känt om ribavirin finns i spermier och om så är fallet kommer det att utöva en potentiell teratogen effekt vid befruktning av ägget. På grund av de potentiella humana teratogena effekterna av ribavirin bör manliga patienter dock rådas att vidta alla försiktighetsåtgärder för att undvika risken för graviditet för sina kvinnliga partners.
COPEGUS ska inte användas av gravida kvinnor eller av män vars kvinnliga partner är gravida. Kvinnliga patienter i fertil ålder och manliga patienter med kvinnliga partners i fertil ålder bör inte få COPEGUS om inte patienten och hans/hennes partner använder effektiv preventivmedel (två pålitliga former) under behandlingen och under 6 månader efter behandlingen [se KONTRAINDIKATIONER ].
Ribavirin graviditetsregister
Ett ribavirin-graviditetsregister har upprättats för att övervaka mödernet-fosterets graviditeter av kvinnliga patienter och kvinnliga partners till manliga patienter som exponerats för ribavirin under behandlingen och i 6 månader efter avslutad behandling. Vårdgivare och patienter uppmuntras att rapportera sådana fall genom att ringa 1-800-593-2214.
Ammande mödrar
Det är inte känt om ribavirin utsöndras i modersmjölk. Eftersom många läkemedel utsöndras i modersmjölk och för att undvika risken för allvarliga biverkningar hos ammande spädbarn från ribavirin, bör ett beslut fattas antingen om att avbryta amning eller behandling med COPEGUS 100 mg, baserat på behandlingens betydelse för modern.
Pediatrisk användning
Farmakokinetiska utvärderingar hos pediatriska patienter har inte utförts.
Säkerhet och effektivitet för COPEGUS har inte fastställts hos patienter under 5 år.
Geriatrisk användning
Kliniska studier av COPEGUS 100 mg och PEGASYS inkluderade inte tillräckligt många försökspersoner i åldern 65 år eller äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Specifika farmakokinetiska utvärderingar för ribavirin hos äldre har inte utförts. Risken för toxiska reaktioner på detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Dosen av COPEGUS 100 mg bör reduceras hos patienter med kreatininclearance mindre än eller lika med 50 ml/min; och dosen av PEGASYS bör minskas hos patienter med kreatininclearance mindre än 30 ml/min [se DOSERING OCH ADMINISTRERING ; Användning i specifika populationer ].
Lopp
En farmakokinetisk studie på 42 försökspersoner visade att det inte finns någon kliniskt signifikant skillnad i ribavirins farmakokinetik bland svarta (n=14), latinamerikanska (n=13) och kaukasiska (n=15) försökspersoner.
Nedsatt njurfunktion
Njurfunktionen bör utvärderas hos alla patienter innan behandling med COPEGUS påbörjas genom att uppskatta patientens kreatininclearance.
En klinisk prövning utvärderade behandling med COPEGUS och PEGASYS hos 50 patienter med CHC med måttlig (kreatininclearance 30 – 50 ml/min) eller svår (kreatininclearance mindre än 30 ml/min) njurfunktionsnedsättning eller njursjukdom i slutstadiet (ESRD) som kräver kronisk hemodialys (HD). Hos 18 patienter med ESRD som fick kronisk HD, administrerades COPEGUS i en dos på 200 mg dagligen utan någon uppenbar skillnad i biverkningsprofilen jämfört med patienter med normal njurfunktion. Dosminskningar och tillfälliga avbrott av COPEGUS (på grund av COPEGUS-relaterade biverkningar, främst anemi) observerades hos upp till en tredjedel ESRD/HD-patienter under behandlingen; och endast en tredjedel av dessa försökspersoner fick COPEGUS under 48 veckor. Plasmaexponeringen för ribavirin var cirka 20 % lägre hos patienter med ESRD på HD jämfört med patienter med normal njurfunktion som fick standarddosen 1000/1200 mg COPEGUS.
Försökspersoner med måttligt (n=17) eller gravt (n=14) nedsatt njurfunktion tolererade inte 600 mg respektive 400 mg dagliga doser av COPEGUS på grund av COPEGUS-relaterade biverkningar, främst anemi, och uppvisade 20 % till 30 % högre plasmaexponeringar för ribavirin (trots frekventa dosändringar) jämfört med patienter med normal njurfunktion (kreatininclearance större än 80 ml/min) som får standarddosen av COPEGUS. Utsättningsfrekvensen var högre hos patienter med gravt nedsatt njurfunktion jämfört med de som observerades hos patienter med måttligt nedsatt njurfunktion eller normal njurfunktion. Farmakokinetisk modellering och simulering indikerar att en dos på 200 mg dagligen hos patienter med gravt nedsatt njurfunktion och en dos på 200 mg dagligen omväxlande med 400 mg följande dag hos patienter med måttligt nedsatt njurfunktion ger plasmaribavirinexponering liknande patienter med normal njurfunktion. får den godkända behandlingen av COPEGUS. Dessa doser har inte studerats hos patienter [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
Baserat på farmakokinetik och säkerhetsresultat från denna studie bör patienter med kreatininclearance mindre än eller lika med 50 ml/min få en reducerad dos av COPEGUS; och patienter med kreatininclearance mindre än 30 ml/min bör få en reducerad dos av PEGASYS. Det kliniska och hematologiska tillståndet för patienter med kreatininclearance mindre än eller lika med 50 ml/min som får COPEGUS 100 mg bör övervakas noggrant. Patienter med kliniskt signifikanta laboratorieavvikelser eller biverkningar som är ihållande allvarliga eller försämrade bör få behandlingen utsätts [se DOSERING OCH ADMINISTRERING , KLINISK FARMAKOLOGI , och PEGASYS Bipacksedel ].
Nedsatt leverfunktion
Effekten av nedsatt leverfunktion på farmakokinetiken för ribavirin efter administrering av COPEGUS har inte utvärderats. De kliniska prövningarna av COPEGUS 100 mg var begränsade till patienter med Child-Pugh klass A-sjukdom.
Kön
Inga kliniskt signifikanta skillnader i farmakokinetiken för ribavirin observerades mellan manliga och kvinnliga försökspersoner.
Ribavirins farmakokinetik, när den korrigeras för vikt, är likartad hos manliga och kvinnliga patienter.
Organtransplantationsmottagare
Säkerheten och effekten av behandling med PEGASYS och COPEGUS 100 mg har inte fastställts hos patienter med levertransplantationer och andra transplantationer. Som med andra alfa-interferoner har avstötningar av lever och njurtransplantat rapporterats på PEGASYS, enbart eller i kombination med COPEGUS [se NEGATIVA REAKTIONER ].
ÖVERDOS
Inga fall av överdosering med COPEGUS har rapporterats i kliniska prövningar. Hypokalcemi och hypomagnesemi har observerats hos personer som administrerats högre än den rekommenderade dosen av ribavirin. I de flesta av dessa fall administrerades ribavirin intravenöst i doser upp till och i vissa fall över fyra gånger den rekommenderade maximala orala dagliga dosen.
KONTRAINDIKATIONER
COPEGUS (ribavirin) är kontraindicerat vid:
- Kvinnor som är gravida. COPEGUS kan orsaka fosterskador när det ges till en gravid kvinna. COPEGUS är kontraindicerat för kvinnor som är eller kan bli gravida. Om detta läkemedel används under graviditet, eller om patienten blir gravid medan du tar detta läkemedel, ska patienten informeras om den potentiella faran för fostret [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , Användning i specifika populationer , och PATIENTINFORMATION ].
- Män vars kvinnliga partner är gravida.
- Patienter med hemoglobinopatier (t.ex. talassemi major eller sicklecellanemi).
- I kombination med didanosin. Rapporter om fatal leversvikt, såväl som perifer neuropati, pankreatit och symptomatisk hyperlaktatemi/laktacidos har rapporterats i kliniska prövningar [se LÄKEMEDELSINTERAKTIONER ].
COPEGUS och PEGASYS kombinationsbehandling är kontraindicerad hos patienter med:
- Autoimmun hepatit.
- Leverdekompensation (Child-Pugh-poäng högre än 6; klass B och C) hos monoinfekterade patienter med cirrose CHC före behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Leverdekompensation (Child-Pugh-poäng större än eller lika med 6) hos patienter med cirrose CHC som samtidigt infekterats med HIV före behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Ribavirin är ett antiviralt läkemedel [se Mikrobiologi ].
Farmakokinetik
Farmakokinetiska data för multipeldos ribavirin finns tillgängliga för HCV-patienter som fått ribavirin i kombination med peginterferon alfa-2a. Efter administrering av 1200 mg/dag med föda i 12 veckors medel±SD (n=39; kroppsvikt större än 75 kg) var AUC0-12h 25 361±7110 ng·timme/ml och Cmax var 2748±818 ng/ml. Den genomsnittliga tiden för att nå Cmax var 2 timmar. Lägsta plasmakoncentrationer av ribavirin efter 12 veckors dosering med mat var 1662±545 ng/ml hos HCV-infekterade patienter som fick 800 mg/dag (n=89) och 2112±810 ng/ml hos patienter som fick 1200 mg/dag ( n=75; kroppsvikt över 75 kg).
Den terminala halveringstiden för ribavirin efter administrering av en oral engångsdos av COPEGUS är cirka 120 till 170 timmar. Det totala skenbara clearance efter administrering av en oral engångsdos av COPEGUS 100 mg är cirka 26 l/h. Det finns en omfattande ackumulering av ribavirin efter upprepad dosering (två gånger dagligen) så att Cmax vid steady state var fyra gånger högre än för en engångsdos.
Effekt av mat på absorption av ribavirin
Biotillgängligheten av en engångsdos av ribavirin ökade vid samtidig administrering med en måltid med hög fetthalt. Absorptionen bromsades (Tmax fördubblades) och AUC0-192h och Cmax ökade med 42% respektive 66% när COPEGUS togs med en fettrik måltid jämfört med fastande tillstånd [se DOSERING OCH ADMINISTRERING och PATIENTINFORMATION ].
Eliminering och metabolism
Bidraget från njur- och levervägar till eliminering av ribavirin efter administrering av COPEGUS 100 mg är inte känt. In vitro-studier indikerar att ribavirin inte är ett substrat för CYP450-enzymer.
Nedsatt njurfunktion
En klinisk prövning utvärderade 50 patienter med CHC med antingen måttlig (kreatininclearance 30 till 50 ml/min) eller allvarlig (kreatininclearance mindre än 30 ml/min) nedsatt njurfunktion eller slutstadiet av njursjukdom (ESRD) som kräver kronisk hemodialys (HD). Det skenbara clearance av ribavirin reducerades hos försökspersoner med kreatininclearance mindre än eller lika med 50 ml/min, inklusive patienter med ESRD på HD, som uppvisade cirka 30 % av värdet hos patienter med normal njurfunktion. Farmakokinetisk modellering och simulering indikerar att en dos på 200 mg dagligen hos patienter med gravt nedsatt njurfunktion och en dos på 200 mg dagligen omväxlande med 400 mg följande dag hos patienter med måttligt nedsatt njurfunktion ger plasmaribavirinexponeringar liknande den som observerats hos patienter med normal njurfunktion som får standarddosen 1000/1200 mg COPEGUS. Dessa doser har inte studerats på patienter.
Till 18 försökspersoner med ESRD som fick kronisk HD, administrerades COPEGUS i en dos på 200 mg dagligen. Ribavirinplasmaexponeringen hos dessa patienter var cirka 20 % lägre jämfört med patienter med normal njurfunktion som fick standarddosen 1000/1200 mg COPEGUS dagligen [se DOSERING OCH ADMINISTRERING , Användning i specifika populationer ].
Plasmaribavirin avlägsnas genom hemodialys med ett extraktionsförhållande på cirka 50 %; På grund av den stora distributionsvolymen av ribavirin förväntas plasmaexponeringen dock inte förändras med hemodialys.
Mikrobiologi
Handlingsmekanism
Mekanismen genom vilken ribavirin bidrar till dess antivirala effekt på kliniken är inte helt klarlagd. Ribavirin har direkt antiviral aktivitet i vävnadskultur mot många RNA-virus. Ribavirin ökar mutationsfrekvensen i genomen hos flera RNA-virus och ribavirintrifosfat hämmar HCV-polymeras i en biokemisk reaktion.
Antiviral aktivitet i cellkultur
det stabila HCV-cellodlingsmodellsystemet (HCV-replikon) hämmade ribavirin autonom HCV-RNA-replikation med ett 50 % effektiv koncentration (EC50)-värde på 11-21 mcM. I samma modell hämmade PEG-IFN a-2a också HCV RNA-replikation, med ett EC50-värde på 0,1-3 ng/ml. Kombinationen av PEG-IFN α-2a och ribavirin var effektivare för att hämma HCV RNA-replikation än endera medlet ensamt.
Motstånd
Olika HCV-genotyper uppvisar avsevärd klinisk variation i deras svar på PEG-IFN-α och ribavirinterapi. Virala genetiska determinanter associerade med det variabla svaret har inte definitivt identifierats.
Korsmotstånd
Korsresistens mellan IFN α och ribavirin har inte observerats.
Djurtoxikologi
I en studie på råttor drogs slutsatsen att dominant dödlighet inte inducerades av ribavirin vid doser upp till 200 mg/kg under 5 dagar (upp till 1,7 gånger den maximala rekommenderade humana dosen av ribavirin).
Långtidsstudier på mus och råtta (18 till 24 månader; dos 20 till 75 respektive 10 till 40 mg/kg/dag, cirka 0,1 till 0,4 gånger den maximala dagliga humandosen av ribavirin) har visat ett samband mellan kronisk exponering för ribavirin och en ökad förekomst av vaskulära lesioner (mikroskopiska blödningar) hos möss. Hos råttor inträffade retinal degeneration hos kontroller, men incidensen ökade hos ribavirinbehandlade råttor.
Kliniska studier
Patienter med kronisk hepatit C
Vuxna patienter
Säkerheten och effektiviteten av PEGASYS i kombination med COPEGUS för behandling av hepatit C-virusinfektion utvärderades i två randomiserade kontrollerade kliniska prövningar. Alla patienter var vuxna, hade kompenserad leversjukdom, detekterbart hepatit C-virus, leverbiopsidiagnos av kronisk hepatit och var tidigare obehandlade med interferon. Ungefär 20 % av patienterna i båda studierna hade kompenserad cirros (Child-Pugh klass A). Patienter som samtidigt infekterades med HIV exkluderades från dessa studier.
studie NV15801 randomiserades patienterna till att få antingen PEGASYS 180 mcg subkutant en gång i veckan med oral placebo, PEGASYS 180 mcg en gång i veckan med COPEGUS 1000 mg genom munnen (kroppsvikt mindre än 75 kg) eller 1200 mg via munnen (kroppsvikt större än eller lika med 75 kg) eller interferon alfa-2b 3 MIE subkutant tre gånger i veckan plus ribavirin 1000 mg eller 1200 mg genom munnen. Alla patienter fick 48 veckors behandling följt av 24 veckors behandlingsfri uppföljning. COPEGUS- eller placebobehandlingstilldelningen var blind. Ihållande virologiskt svar definierades som odetekterbart (mindre än 50 IE/ml) HCV-RNA på eller efter studievecka 68. PEGASYS i kombination med COPEGUS 100 mg resulterade i en högre SVR jämfört med enbart PEGASYS eller interferon alfa-2b och ribavirin (tabell 9). . I alla behandlingsarmar hade patienter med viral genotyp 1, oavsett virusmängd, en lägre svarsfrekvens på PEGASYS i kombination med COPEGUS 100 mg jämfört med patienter med andra virala genotyper.
Skillnaden i övergripande behandlingssvar (PEGASYS/COPEGUS – Interferon alfa-2b/ribavirin) var 9 % (95 % KI 2,3, 15,3).
I studie NV15942 fick alla patienter PEGASYS 180 mcg subkutant en gång i veckan och randomiserades till behandling i antingen 24 eller 48 veckor och till en COPEGUS-dos på antingen 800 mg eller 1000 mg/1200 mg (för kroppsvikt mindre än 75 kg/mer än eller lika med 75 kg). Tilldelning till de fyra behandlingsarmarna stratifierades efter viral genotyp och baslinje HCV viral titer. Patienter med genotyp 1 och hög viral titer (definierad som mer än 2 x 106 HCV RNA-kopior/ml serum) tilldelades företrädesvis behandling i 48 veckor.
Sustained Virologic Response (SVR) och HCV genotyp
HCV 1 och 4 — Oberoende av virustiter vid baslinje, resulterade behandling i 48 veckor med PEGASYS och 1000 mg eller 1200 mg COPEGUS i högre SVR (definierat som odetekterbart HCV-RNA i slutet av den 24-veckors behandlingsfria uppföljningsperioden) jämfört med kortare behandling (24 veckor) och/eller 800 mg COPEGUS.
HCV 2 och 3 — Oberoende av virustiter vid baslinje, resulterade behandling i 24 veckor med PEGASYS och 800 mg COPEGUS i en liknande SVR jämfört med längre behandling (48 veckor) och/eller 1000 mg eller 1200 mg COPEGUS (se tabell 10).
Antalet patienter med genotyp 5 och 6 var för få för att möjliggöra en meningsfull bedömning.
Pediatriska patienter
Tidigare obehandlade pediatriska försökspersoner i åldern 5 till 17 år (55 % yngre än 12 år) med kronisk hepatit C, kompenserad leversjukdom och detekterbart HCV-RNA behandlades med COPEGUS 100 mg cirka 15 mg/kg/dag plus PEGASYS 180 mcg/1,73 mcg² x kroppsyta en gång i veckan i 48 veckor. Alla försökspersoner följdes under 24 veckor efter behandling. Ihållande virologiskt svar (SVR) definierades som odetekterbart (mindre än 50 IE/ml) HCV-RNA på eller efter studievecka 68. Totalt 114 försökspersoner randomiserades till att få antingen kombinationsbehandling av COPEGUS plus PEGASYS eller PEGASYS monoterapi; försökspersoner som misslyckades med PEGASYS monoterapi vid 24 veckor eller senare kunde få öppen märkning av COPEGUS plus PEGASYS. De initiala randomiserade armarna var balanserade för demografiska faktorer; 55 försökspersoner fick initial kombinationsbehandling av COPEGUS 100 mg plus PEGASYS och 59 fick PEGASYS plus placebo; i den totala intention-to-treat-populationen var 45 % kvinnor, 80 % var kaukasiska och 81 % var infekterade med HCV genotyp 1. SVR-resultaten sammanfattas i tabell 11.
Andra behandlingssvarsprediktorer
Behandlingssvarsfrekvensen är lägre hos patienter med dåliga prognostiska faktorer som får behandling med pegylerat interferon alfa. I studierna NV15801 och NV15942 var behandlingssvarsfrekvensen lägre hos patienter äldre än 40 år (50 % vs. 66 %), hos patienter med cirros (47 % vs. 59 %), hos patienter som vägde över 85 kg (49 % vs. 60 %) och hos patienter med genotyp 1 med hög mot låg virusmängd (43 % mot 56 %). Afroamerikanska patienter hade lägre svarsfrekvens jämfört med kaukasier.
studierna NV15801 och NV15942 var avsaknad av tidigt virologiskt svar efter 12 veckor (definierat som HCV-RNA ej detekterbart eller mer än 2 log10 lägre än baslinjen) skäl för att avbryta behandlingen. Av patienter som saknade ett tidigt viralt svar efter 12 veckor och fullföljde en rekommenderad behandlingskur trots ett protokolldefinierat alternativ att avbryta behandlingen, uppnådde 5/39 (13%) en SVR. Av patienter som saknade ett tidigt viralt svar efter 24 veckor fullföljde 19 en hel behandlingskur och ingen uppnådde en SVR.
Kronisk hepatit C/HIV-saminfekterade patienter
studie NR15961 randomiserades patienter med CHC/HIV till att få antingen PEGASYS 180 mcg subkutant en gång i veckan plus en oral placebo, PEGASYS 180 mcg en gång i veckan plus COPEGUS 800 mg genom munnen dagligen eller interferon alfa-2a, 3 MIE subkutant tre gånger i veckan plus COPEGUS 800 mg per mun dagligen. Alla patienter fick 48 veckors behandling och ihållande virologiskt svar (SVR) bedömdes efter 24 veckors behandlingsfri uppföljning. COPEGUS 100 mg eller placebobehandling var blind i PEGASYS-behandlingsarmarna. Alla patienter var vuxna, hade kompenserad leversjukdom, detekterbart hepatit C-virus, leverbiopsidiagnos av kronisk hepatit C och var tidigare obehandlade med interferon. Patienterna hade också CD4+-cellantal större än eller lika med 200 celler/mm³ eller CD4+-cellantal större än eller lika med 100 celler/mm³ men mindre än 200 celler/mm³ och HIV-1 RNA mindre än 5000 kopior/ml, och stabil status av HIV. Ungefär 15 % av patienterna i studien hade cirros. Resultaten visas i tabell 12.
Behandlingssvarsfrekvensen var lägre hos CHC/HIV-patienter med dåliga prognostiska faktorer (inklusive HCV genotyp 1, HCV RNA större än 800 000 IE/ml och cirros) som fick behandling med pegylerad interferon alfa.
Av patienterna som inte visade vare sig odetekterbart HCV-RNA eller minst en minskning med 2 log10 från baslinjen i HCV-RNA-titer med 12 veckors kombinationsbehandling med PEGASYS och COPEGUS, uppnådde 2 % (2/85) en SVR.
Hos CHC-patienter med HIV-saminfektion som fick 48 veckors PEGASYS enbart eller i kombination med COPEGUS 100 mg-behandling, ökade inte medel- och mediantitrarna för HIV-RNA över baslinjen under behandlingen eller 24 veckor efter behandling.
PATIENTINFORMATION
COPEGUS® (Co-PEG-UHS) (ribavirin) tabletter
Läs denna medicineringsguide noggrant innan du börjar ta COPEGUS 100mg och läs medicinguiden varje gång du får i dig mer COPEGUS. Det kan komma ny information. Denna information ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling.
Läs även medicineringsguiden för PEGASYS (peginterferon alfa-2a).
Vilken är den viktigaste informationen jag borde veta om COPEGUS?
- Kvinnor måste genomgå ett graviditetstest innan de börjar med COPEGUS, varje månad under behandling med COPEGUS 100 mg och varje månad under de 6 månaderna efter behandling med COPEGUS.
- Om du eller din kvinnliga sexpartner blir gravid medan du tar COPEGUS 100 mg eller inom 6 månader efter att du slutat ta COPEGUS, berätta omedelbart för din läkare. Du eller din vårdgivare bör kontakta Ribavirin Pregnancy Registry genom att ringa 1-800-593-2214. Ribavirin Graviditetsregistret samlar in information om vad som händer med mammor och deras barn om mamman tar COPEGUS medan hon är gravid.
Vad är COPEGUS 100mg?
COPEGUS 100mg är ett receptbelagt läkemedel som används tillsammans med ett annat läkemedel som heter PEGASYS (peginterferon alfa-2a) för att behandla kronisk (varar länge) hepatit C-infektion hos personer 5 år och äldre vars lever fortfarande fungerar normalt och som inte har behandlats tidigare med ett läkemedel som kallas interferon alfa. Det är inte känt om COPEGUS är säkert och kommer att fungera på barn under 5 år.
Vem bör inte ta COPEGUS 100mg?
Ser "Vilken är den viktigaste informationen jag borde veta om COPEGUS 100mg?"
Ta inte COPEGUS om du:
- har vissa typer av hepatit orsakas av att ditt immunförsvar angriper din lever (autoimmun hepatit)
- har vissa blodsjukdomar, såsom talassemi major eller sicklecellanemi (hemoglobinopatier)
- ta didanosin (Videx eller Videx EC)
Tala med din vårdgivare innan du påbörjar behandling med COPEGUS 100mg om du har något av dessa medicinska tillstånd.
Vad ska jag berätta för min vårdgivare innan jag tar COPEGUS 100mg?
Innan du tar COPEGUS, berätta för din läkare om du har eller har haft:
- behandling för hepatit C som inte fungerade för dig
- allvarliga allergiska reaktioner mot COPEGUS eller mot något av innehållsämnena i COPEGUS. Se slutet av denna medicinguide för en lista över ingredienser.
- andningsproblem. COPEGUS 100mg kan orsaka eller förvärra dina andningsproblem som du redan har.
- synproblem. COPEGUS kan orsaka ögonproblem eller förvärra ögonproblem som du redan har. Du bör genomgå en synundersökning innan du påbörjar behandling med COPEGUS.
- vissa blodsjukdomar såsom anemi
- högt blodtryck, hjärtproblem eller har haft en hjärtattack. Din vårdgivare bör testa ditt blod och ditt hjärta innan du påbörjar behandlingen med COPEGUS.
- sköldkörtelproblem
- diabetes. COPEGUS 100mg och PEGASYS kombinationsbehandling kan göra din diabetes värre eller svårare att behandla.
- leverproblem annat än infektion med hepatit C-virus
- humant immunbristvirus (HIV) eller andra immunitetsproblem
- psykiska problem, inklusive depression eller självmordstankar
- njurproblem
- en organtransplantation
- drogberoende eller missbruk
- infektion med hepatit B-virus
- något annat medicinskt tillstånd
- ammar. Det är inte känt om COPEGUS 100 mg går över i din bröstmjölk. Du och din vårdgivare bör bestämma om du ska ta COPEGUS eller amma.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Vissa läkemedel kan orsaka allvarliga biverkningar om de tas samtidigt som du också tar COPEGUS. Vissa läkemedel kan påverka hur COPEGUS 100mg fungerar eller COPEGUS 100mg kan påverka hur dina andra läkemedel fungerar.
Berätta särskilt för din vårdgivare om du tar några läkemedel för att behandla HIV, inklusive didanosin (Videx eller Videx EC), eller om du tar azatioprin (Imuran eller Azasan).
Vet vilka mediciner du tar. Håll en lista över dem för att visa din vårdgivare eller apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta COPEGUS 100mg?
- Ta COPEGUS precis som din vårdgivare säger till dig. Din vårdgivare kommer att tala om för dig hur mycket COPEGUS du ska ta och när du ska ta den. För barn från 5 år och äldre kommer din läkare att ordinera dosen COPEGUS 100 mg baserat på vikt.
- Ta COPEGUS med mat.
- Om du missar en dos av COPEGUS 100 mg, ta den missade dosen så snart som möjligt under samma dag. Fördubbla inte nästa dos. Om du har frågor om vad du ska göra, ring din vårdgivare.
- Om du tar för mycket COPEGUS 100 mg, ring din vårdgivare eller lokala Giftinformationscentralen omedelbart, eller åk genast till närmaste akutmottagning.
- Din vårdgivare bör ta blodprov innan du påbörjar behandling med COPEGUS, vid behandlingsveckorna 2 och 4, och sedan vid behov för att se hur väl du tolererar behandlingen och kontrollera biverkningar. Din vårdgivare kan ändra din dos av COPEGUS 100 mg baserat på blodprovsresultat eller biverkningar du kan ha.
- Om du har hjärtproblem bör din vårdgivare kontrollera ditt hjärta genom att göra ett elektrokardiogram innan du påbörjar behandlingen med COPEGUS och vid behov under behandlingen.
Vad ska jag undvika när jag tar COPEGUS?
COPEGUS 100mg kan få dig att känna dig trött, yr eller förvirrad. Du ska inte köra bil eller använda maskiner om du har något av dessa symtom.
Drick inte alkohol, inklusive öl, vin och sprit. Detta kan göra din leversjukdom värre.
Vilka är de möjliga biverkningarna av COPEGUS?
COPEGUS 100mg kan orsaka allvarliga biverkningar inklusive:
Se "Vad är den viktigaste informationen jag borde veta om COPEGUS 100mg?"
- Svullnad och irritation av din bukspottkörtel (pankreatit). Du kan ha ont i magen, illamående, kräkningar eller diarré.
- Allvarliga allergiska reaktioner. Symtomen kan vara nässelfeber, väsande andning, andningssvårigheter, bröstsmärtor, svullnad av mun, tunga eller läppar eller svåra utslag.
- Allvarliga andningsproblem. Andningssvårigheter kan vara ett tecken på en allvarlig lunginfektion (lunginflammation) som kan leda till döden.
- Allvarliga ögonproblem som kan leda till synförlust eller blindhet.
- Leverproblem. Vissa människor kan få försämrad leverfunktion. Berätta omedelbart för din vårdgivare om du har något av dessa symtom: uppblåst mage, förvirring, brun urin och gula ögon.
- Allvarlig depression
- Självmordstankar och självmordsförsök
- Effekt på tillväxt hos barn. Barn kan uppleva en fördröjning i viktökning och höjdökning medan de behandlas med PEGASYS och COPEGUS. Tillväxten kommer ikapp efter att behandlingen avbrutits, men vissa barn kanske inte når den höjd som de förväntades ha före behandlingen. Tala med din vårdgivare om du är orolig över ditt barns tillväxt under behandling med PEGASYS och COPEGUS.
Ring din vårdgivare eller få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan. Dessa kan vara tecken på en allvarlig biverkning av COPEGUS 100 mg behandling.
Vanliga biverkningar av COPEGUS som tas med PEGASYS inkluderar:
- influensaliknande symtom - trötthetskänsla, huvudvärk, skakning tillsammans med hög temperatur (feber) och muskel- eller ledvärk
- humörförändringar, känsla av irritation, ångest och sömnsvårigheter
- aptitlöshet, illamående, kräkningar och diarré
- håravfall
- klåda
Berätta för din vårdgivare om eventuella biverkningar som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av COPEGUS-behandling. För mer information, fråga din vårdgivare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Du kan också rapportera biverkningar till Genentech på 1-888-835-2555.
Hur ska jag förvara COPEGUS 100mg?
- Förvara COPEGUS tabletter mellan 59°F och 86°F (15°C och 30°C).
- Håll flaskan väl stängd.
Förvara COPEGUS 100mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av COPEGUS
Det är inte känt om behandling med COPEGUS 100 mg i kombination med PEGASYS kommer att förhindra en infekterad person från att sprida hepatit C-virus till en annan person under behandling.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte COPEGUS 100 mg för ett tillstånd som det inte har ordinerats för. Ge inte COPEGUS till andra människor, även om de har samma symtom som du har. Det kan skada dem.
Denna medicinguide sammanfattar den viktigaste informationen om COPEGUS. Om du vill ha mer information, prata med din vårdgivare. Du kan be din vårdgivare eller apotekspersonal om information om COPEGUS som är skriven för vårdpersonal.
Vilka är ingredienserna i COPEGUS 100mg?
Aktiv ingrediens: ribavirin
Inaktiva ingredienser: Tablettens kärna innehåller förgelatinerad stärkelse, mikrokristallin cellulosa, natriumstärkelseglykolat, majsstärkelse och magnesiumstearat. Beläggningen på tabletten innehåller Chromatone-P eller Opadry Pink (tillverkad med hydroxipropylmetylcellulosa, talk, titandioxid, syntetisk gul järnoxid och syntetisk röd järnoxid), etylcellulosa (ECD-30) och triacetin.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
