Sustiva 200mg, 600mg Efavirenz Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Sustiva 600mg och hur används det?
Sustiva är ett receptbelagt läkemedel som används för att behandla symptomen på HIV-infektion. Sustiva kan användas ensamt eller tillsammans med andra läkemedel.
Sustiva tillhör en klass av läkemedel som kallas HIV, NNRTI.
Det är inte känt om Sustiva är säkert och effektivt för barn yngre än 3 månader.
Vilka är de möjliga biverkningarna av Sustiva?
Sustiva kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- feber,
- öm hals,
- brännande ögon,
- smärta i huden,
- röda eller lila hudutslag med blåsor och fjällning,
- beslag,
- hallucinationer,
- koncentrationssvårigheter,
- problem med att tala eller röra sig (kan uppstå månader eller år efter att medicinen påbörjats),
- yrsel,
- dåsighet,
- förvirring,
- koncentrationssvårigheter,
- konstiga drömmar,
- sömnlöshet,
- problem med tal,
- svårigheter med din balans eller muskelrörelse,
- ångest,
- paranoia,
- ovanligt beteende,
- känna sig ledsen eller hopplös,
- självmordstankar,
- illamående,
- magont,
- aptitlöshet,
- mörk urin,
- lerfärgad avföring,
- gulfärgning av huden eller ögonen (gulsot),
- nattsvettningar,
- svullna körtlar,
- munsår,
- hosta,
- väsande andning,
- diarre,
- viktminskning,
- svårt att svälja,
- problem med balans eller ögonrörelser,
- svaghet,
- taggig känsla,
- svullnad i nacken eller halsen (förstorad sköldkörtel),
- menstruationsförändringar, och
- impotens
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Sustiva inkluderar:
- illamående,
- kräkningar,
- yrsel,
- dåsighet,
- koncentrationssvårigheter,
- utslag,
- huvudvärk,
- trötthet,
- sömnproblem (sömnlöshet),
- konstiga drömmar, och
- förändringar i form eller placering av kroppsfett (särskilt i dina armar, ben, ansikte, hals, bröst och midja)
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Sustiva. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
SUSTIVA® (efavirenz) är en HIV-1-specifik, icke-nukleosid, omvänt transkriptashämmare (NNRTI). Efavirenz beskrivs kemiskt som (S)-6-klor-4-(cyklopropyletynyl)-1,4-dihydro4-(trifluormetyl)-2H-3,1-bensoxazin-2-on. Dess empiriska formel är C14H9ClF3NO2 och dess strukturformel är:
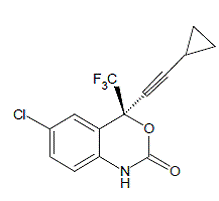
Efavirenz är ett vitt till svagt rosa kristallint pulver med en molekylvikt på 315,68. Det är praktiskt taget olösligt i vatten (
Kapslar
SUSTIVA finns som kapslar för oral administrering innehållande antingen 50 mg eller 200 mg efavirenz och följande inaktiva ingredienser: laktosmonohydrat, magnesiumstearat, natriumlaurylsulfat och natriumstärkelseglykolat. Kapselskalet innehåller följande inaktiva ingredienser och färgämnen: gelatin, natriumlaurylsulfat, titandioxid och/eller gul järnoxid. Kapselskalen kan också innehålla kiseldioxid. Kapslarna är tryckta med bläck som innehåller carmine 40 blue, FD&C Blue No. 2 och titandioxid.
Tabletter
SUSTIVA 600mg finns som filmdragerade tabletter för oral administrering innehållande 600 mg efavirenz och följande inaktiva ingredienser: kroskarmellosnatrium, hydroxipropylcellulosa, laktosmonohydrat, magnesiumstearat, mikrokristallin cellulosa och natriumlaurylsulfat. Filmbeläggningen innehåller Opadry Yellow och Opadry Clear. Tabletterna är polerade med karnaubavax och tryckta med lila bläck, Opacode WB.
INDIKATIONER
SUSTIVA® (efavirenz) i kombination med andra antiretrovirala medel är indicerat för behandling av infektion med humant immunbristvirus typ 1 (HIV-1) hos vuxna och pediatriska patienter som är minst 3 månader gamla och som väger minst 3,5 kg.
DOSERING OCH ADMINISTRERING
Leverfunktion
Övervaka leverfunktionen före och under behandling med SUSTIVA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. SUSTIVA 600mg rekommenderas inte till patienter med måttligt eller gravt nedsatt leverfunktion (Child Pugh B eller C) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Vuxna
Den rekommenderade dosen av SUSTIVA (efavirenz) är 600 mg oralt, en gång dagligen, i kombination med en proteashämmare och/eller nukleosidanalog omvänt transkriptashämmare (NRTI). Det rekommenderas att SUSTIVA tas på fastande mage, helst vid sänggåendet. De ökade efavirenzkoncentrationerna som observerats efter administrering av SUSTIVA 600 mg tillsammans med mat kan leda till en ökning av frekvensen av biverkningar [se KLINISK FARMAKOLOGI ]. Dosering vid sänggåendet kan förbättra tolerabiliteten av symtom i nervsystemet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER , och PATIENTINFORMATION ]. SUSTIVA kapslar eller tabletter ska sväljas intakta med vätska. För patienter som inte kan svälja kapslar eller tabletter rekommenderas administreringsmetoden för kapselströ [se Kapselströ Administreringsmetod ].
Samtidig antiretroviral terapi
SUSTIVA måste ges i kombination med andra antiretrovirala läkemedel [se INDIKATIONER , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER , och KLINISK FARMAKOLOGI ].
Dosjustering
Om SUSTIVA 200 mg administreras samtidigt med voriconazol, bör underhållsdosen för voriconazol ökas till 400 mg var 12:e timme och dosen SUSTIVA 200 mg ska minskas till 300 mg en gång dagligen med kapselformuleringen (en 200 mg och två 50 mg kapslar eller sex 50 mg kapslar mg kapslar). SUSTIVA 600 mg tabletter får inte brytas. [ser LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI .]
Om SUSTIVA administreras samtidigt med rifampin till patienter som väger 50 kg eller mer, rekommenderas en ökning av dosen av SUSTIVA 200 mg till 800 mg en gång dagligen [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Pediatriska patienter
Det rekommenderas att SUSTIVA 600 mg tas på fastande mage, helst vid sänggåendet. Tabell 1 beskriver den rekommenderade dosen av SUSTIVA för pediatriska patienter som är 3 månader eller äldre och som väger mellan 3,5 kg och 40 kg [se KLINISK FARMAKOLOGI ]. Den rekommenderade dosen av SUSTIVA för pediatriska patienter som väger 40 kg eller mer är 600 mg en gång dagligen. För pediatriska patienter som inte kan svälja kapslar kan kapselinnehållet administreras med en liten mängd mat eller modersmjölksersättning med användning av kapselströskning [se Kapselströ Administreringsmetod ].
Kapselströ Administreringsmetod
För pediatriska patienter som är minst 3 månader gamla och som väger minst 3,5 kg och vuxna som inte kan svälja kapslar eller tabletter, kan kapselinnehållet administreras med en liten mängd (1 till 2 teskedar) mat. Användning av modersmjölksersättning för blandning bör endast övervägas för de unga spädbarn som inte på ett tillförlitligt sätt kan konsumera fast föda. Patienter och vårdgivare bör instrueras att öppna kapseln försiktigt för att undvika spill eller spridning av kapselinnehållet i luften. Kapseln ska hållas horisontellt över en liten behållare och försiktigt vridas för att öppnas. För patienter som kan tolerera fast föda, ska hela kapselinnehållet försiktigt blandas med en åldersanpassad mjuk mat, såsom äppelmos, vindruvsgelé eller yoghurt, i den lilla behållaren. För små spädbarn som får blandningen kapselströ-modersmjölksersättning, ska hela kapselinnehållet försiktigt blandas till 2 teskedar rekonstituerad modersmjölksersättning i en liten behållare genom att försiktigt röra om med en liten sked och sedan dra upp blandningen till en 10 st. ml oral doseringsspruta för administrering. Efter administrering av SUSTIVA-maten eller -formelblandningen måste ytterligare en liten mängd (cirka 2 teskedar) mat eller formel tillsättas i den tomma blandningsbehållaren, röras om för att dispergera eventuella kvarvarande SUSTIVA-rester och administreras till patienten. SUSTIVA-mat- eller formelblandningen ska administreras inom 30 minuter efter blandning. Ingen ytterligare mat ska intas under 2 timmar efter administrering av SUSTIVA.
Ytterligare patientinstruktioner om administreringsmetoden för kapselströ finns i den FDA-godkända patientmärkningen (se PATIENTINFORMATION och ANVÄNDNINGSINSTRUKTIONER ).
HUR LEVERERAS
Doseringsformer och styrkor
Kapslar
200 mg kapslar är guldfärgade, omvänd tryckta med ”SUSTIVA” på underdelen och märkta med ”200 mg” på locket.
50 mg kapslar är guldfärgade och vita, tryckta med "SUSTIVA" på det guldfärgade locket och omvänt tryckt "50 mg" på den vita kroppen.
Tabletter
600 mg tabletter är gula, kapselformade, filmdragerade tabletter med ”SUSTIVA” tryckt på båda sidor.
Förvaring Och Hantering
Kapslar
SUSTIVA® (efavirenz) kapslar finns tillgängliga enligt följande:
Kapslar 200 mg är guldfärgade, omvänd tryckta med "SUSTIVA" på kroppen och stämplade "200 mg" på locket.
90 flaskor - NDC 0056-0474-92
Kapslar 50 mg är guldfärgade och vita, tryckta med "SUSTIVA" på det guldfärgade locket och omvänt tryckt "50 mg" på den vita kroppen.
30 flaskor - NDC 0056-0470-30
Tabletter
SUSTIVA® (efavirenz) tabletter finns tillgängliga enligt följande:
Tabletter 600 mg är gula, kapselformade, filmdragerade tabletter, med ”SUSTIVA” tryckt på båda sidor.
30 flaskor - NDC 0056-0510-30
Lagring
SUSTIVA 600mg kapslar och SUSTIVA tabletter ska förvaras vid 25°C (77°F); utflykter tillåtna till 15°C-30°C (59°F-86°F) [se USP-kontrollerad rumstemperatur].
Distribueras av: Bristol-Myers Squibb Company Princeton, NJ 08543 USA. Reviderad: oktober 2020
BIEFFEKTER
De mest signifikanta biverkningarna som observerats hos patienter som behandlats med SUSTIVA är:
- psykiatriska symtom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ],
- nervsystemets symtom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ],
- utslag [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska studier utförs under mycket varierande förhållanden, kan de rapporterade biverkningsfrekvenserna inte direkt jämföras med frekvenserna i andra kliniska studier och återspeglar kanske inte de frekvenser som observerats i klinisk praxis.
Biverkningar hos vuxna
De vanligaste (>5 % i endera efavirenzbehandlingsgruppen) biverkningar av minst måttlig svårighetsgrad bland patienter i studie 006 som behandlades med SUSTIVA 200 mg i kombination med zidovudin/lamivudin eller indinavir var hudutslag, yrsel, illamående, huvudvärk, trötthet, sömnlöshet, och kräkningar.
Utvalda kliniska biverkningar av måttlig eller svår intensitet observerade hos ≥2 % av SUSTIVA-behandlade patienter i två kontrollerade kliniska prövningar presenteras i Tabell 2.
Pankreatit har rapporterats, även om ett orsakssamband med efavirenz inte har fastställts. Asymtomatiska ökningar av serumamylasnivåer observerades hos ett signifikant högre antal patienter som behandlades med efavirenz 600 mg än hos kontrollpatienter (se Laboratorieavvikelser ).
Symtom på nervsystemet
För 1 008 patienter som behandlats med kurer innehållande SUSTIVA och 635 patienter som behandlats med en kontrollregim i kontrollerade prövningar, listar tabell 3 frekvensen av symtom av olika svårighetsgrad och visar avbrottsfrekvensen för ett eller flera av följande nervsystemsymtom: yrsel, sömnlöshet, försämrad koncentration, somnolens, onormalt drömmande, eufori, förvirring, agitation, minnesförlust, hallucinationer, stupor, onormalt tänkande och depersonalisering [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Frekvensen av specifika symtom på centrala och perifera nervsystem anges i tabell 2.
Psykiatriska symtom
Allvarliga psykiatriska biverkningar har rapporterats hos patienter som behandlats med SUSTIVA. I kontrollerade studier var psykiatriska symtom som observerades med en frekvens på mer än 2 % bland patienter som behandlades med SUSTIVA 600 mg respektive kontrollregimer depression (19 %, 16 %), ångest (13 %, 9 %) och nervositet (7 %). , 2%).
Utslag
kontrollerade kliniska prövningar var frekvensen av utslag (alla grader, oavsett orsakssamband) 26 % för 1 008 vuxna behandlade med regimer innehållande SUSTIVA 200 mg och 17 % för 635 vuxna behandlade med en kontrollregim. De flesta rapporter om utslag var milda eller måttliga i svårighetsgrad. Frekvensen av grad 3-utslag var 0,8 % för SUSTIVA-behandlade patienter och 0,3 % för kontrollgrupper, och frekvensen av grad 4-utslag var 0,1 % för SUSTIVA och 0 för kontrollgrupper. Frekvensen av utsättningar som ett resultat av hudutslag var 1,7 % för SUSTIVA-behandlade patienter och 0,3 % för kontrollgrupper [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Erfarenhet av SUSTIVA hos patienter som avbrutit behandling med andra antiretrovirala medel av NNRTI-klassen är begränsad. Nitton patienter som avbröt behandlingen med nevirapin på grund av hudutslag har behandlats med SUSTIVA. Nio av dessa patienter utvecklade lindriga till måttliga utslag när de fick behandling med SUSTIVA, och två av dessa patienter avbröt behandlingen på grund av utslag.
Laboratorieavvikelser
Utvalda laboratorieavvikelser av grad 3-4 rapporterade hos ≥2 % av SUSTIVA-behandlade patienter i två kliniska prövningar presenteras i Tabell 4.
Patienter som samtidigt smittats av hepatit B eller C
Leverfunktionstester bör övervakas hos patienter med hepatit B och/eller C i anamnesen. I långtidsdatauppsättningen från studie 006 behandlades 137 patienter med regimer innehållande SUSTIVA (medianbehandlingslängd, 68 veckor) och 84 behandlades med en kontrollregim (medianvaraktighet, 56 veckor) var seropositiva vid screening för hepatit B (ytantigenpositiv) och/eller C (hepatit C-antikroppspositiv). Bland dessa samtidigt infekterade patienter utvecklades höjningar av ASAT till mer än fem gånger ULN hos 13 % av patienterna i SUSTIVA-armarna och 7 % av dem i kontrollarmen, och höjningar av ALAT till mer än fem gånger ULN hos 20 % av patienterna i SUSTIVA-armarna och 7 % av patienterna i kontrollarmen. Bland saminfekterade patienter avbröt 3 % av de som behandlades med SUSTIVA-innehållande kurer och 2 % i kontrollarmen studien på grund av lever- eller gallvägssjukdomar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Lipider
Ökningar från baslinjen av totalt kolesterol på 10-20 % har observerats hos vissa oinfekterade frivilliga som fått SUSTIVA. Hos patienter som behandlats med SUSTIVA + zidovudin + lamivudin observerades ökningar från baslinjen av totalkolesterol och HDL på cirka 20 % respektive 25 % utan fasta. Hos patienter som behandlats med SUSTIVA + indinavir observerades ökningar från baslinjen av icke-fastande kolesterol och HDL på cirka 40 % respektive 35 %. Icke-fastande totalkolesterolnivåer ≥240 mg/dL och ≥300 mg/dL rapporterades hos 34 % respektive 9 % av patienterna som behandlades med SUSTIVA + zidovudin + lamivudin; 54 % respektive 20 % av patienterna behandlade med SUSTIVA + indinavir; och 28 % respektive 4 % av patienterna som behandlades med indinavir + zidovudin + lamivudin. Effekterna av SUSTIVA 600 mg på triglycerider och LDL i denna studie var inte väl karakteriserade eftersom prover togs från icke-fastande patienter. Den kliniska betydelsen av dessa fynd är okänd [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Biverkningar hos pediatriska patienter
Eftersom kliniska studier utförs under mycket varierande förhållanden, kan de rapporterade biverkningsfrekvenserna inte direkt jämföras med frekvenserna i andra kliniska studier och återspeglar kanske inte de frekvenser som observerats i klinisk praxis.
Bedömningen av biverkningar baseras på tre kliniska prövningar på 182 HIV-1-infekterade pediatriska patienter (3 månader till 21 år) som fick SUSTIVA 200 mg i kombination med andra antiretrovirala medel under en median av 123 veckor. De biverkningar som observerades i de tre prövningarna liknade de som observerades i kliniska prövningar på vuxna, förutom att utslag var vanligare hos pediatriska patienter (32 % för alla grader oavsett orsakssamband) och oftare av högre grad (dvs. svårare). Två (1,1 %) pediatriska patienter fick utslag av grad 3 (sammanflytande utslag med feber, generaliserade utslag) och fyra (2,2 %) pediatriska patienter hade utslag av grad 4 (alla erythema multiforme). Fem pediatriska patienter (2,7%) avbröt studien på grund av hudutslag [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av SUSTIVA efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av okänd storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Kroppen som helhet: allergiska reaktioner, asteni, omfördelning/ansamling av kroppsfett [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Centrala och perifera nervsystemet: onormal koordination, ataxi, encefalopati, cerebellär koordination och balansrubbningar, kramper, hypoestesi, parestesi, neuropati, tremor, yrsel
Endokrin: gynekomasti
Gastrointestinala: förstoppning, malabsorption
Kardiovaskulär: rodnad, hjärtklappning
Lever och gallvägar: ökning av leverenzymer, leversvikt, hepatit.
Metaboliskt och näringsmässigt: hyperkolesterolemi, hypertriglyceridemi
Muskuloskeletala: artralgi, myalgi, myopati
Psykiatrisk: aggressiva reaktioner, agitation, vanföreställningar, emotionell labilitet, mani, neuros, paranoia, psykos, självmord, katatoni
Andningsvägar: dyspné
Hud och bihang: erythema multiforme, fotoallergisk dermatit, Stevens-Johnsons syndrom
Särskilda sinnen: onormal syn, tinnitus
LÄKEMEDELSINTERAKTIONER
Potentiell för SUSTIVA att påverka andra droger
Efavirenz har visats in vivo inducera CYP3A och CYP2B6. Andra föreningar som är substrat för CYP3A eller CYP2B6 kan ha minskade plasmakoncentrationer när de administreras samtidigt med SUSTIVA.
Potentiell för andra droger att påverka SUSTIVA
Läkemedel som inducerar CYP3A-aktivitet (t.ex. fenobarbital, rifampin, rifabutin) skulle förväntas öka clearance av efavirenz vilket resulterar i sänkta plasmakoncentrationer [se DOSERING OCH ADMINISTRERING ].
QT-förlängande läkemedel
Det finns begränsad information tillgänglig om risken för en farmakodynamisk interaktion mellan SUSTIVA 600 mg och läkemedel som förlänger QTc-intervallet. QTc-förlängning har observerats vid användning av efavirenz [se KLINISK FARMAKOLOGI ]. Överväg alternativ till SUSTIVA 600 mg när det administreras samtidigt med ett läkemedel med känd risk för Torsade de Pointes.
Etablerade och andra potentiellt signifikanta läkemedelsinteraktioner
Läkemedelsinteraktioner med SUSTIVA sammanfattas i tabell 5. För farmakokinetiska data, [se KLINISK FARMAKOLOGI ] Tabellerna 7 och 8. Denna tabell inkluderar potentiellt signifikanta interaktioner, men är inte all inclusive.
Läkemedel utan kliniskt signifikanta interaktioner med SUSTIVA
Ingen dosjustering rekommenderas när SUSTIVA 600 mg ges tillsammans med följande: antacida av aluminium/magnesiumhydroxid, azitromycin, cetirizin, famotidin, flukonazol, lorazepam, nelfinavir, nukleosid-omvända transkriptashämmare (abakabine, stavviroxidin, emtricoxivitin, stavivovidin, stavviroxin, ), paroxetin och raltegravir.
Cannabinoid testinteraktion
Efavirenz binder inte till cannabinoidreceptorer. Falskt positiva cannabinoidtestresultat i urin har rapporterats med vissa screeninganalyser hos oinfekterade och HIV-infekterade försökspersoner som fått efavirenz. Bekräftelse av positiva screeningtester för cannabinoider med en mer specifik metod rekommenderas.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Läkemedelsinteraktioner
Efavirenz plasmakoncentrationer kan förändras av substrat, hämmare eller inducerare av CYP3A. På samma sätt kan efavirenz förändra plasmakoncentrationerna av läkemedel som metaboliseras av CYP3A eller CYP2B6. Den mest framträdande effekten av efavirenz vid steady-state är induktion av CYP3A och CYP2B6 [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ].
QTc-förlängning
QTc-förlängning har observerats vid användning av efavirenz [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ]. Överväg alternativ till SUSTIVA 600 mg när det administreras samtidigt med ett läkemedel med känd risk för Torsade de Pointes eller när det administreras till patienter med högre risk för Torsade de Pointes.
Motstånd
SUSTIVA 200 mg får inte användas som ett enda medel för att behandla HIV-1-infektion eller läggas till som ett enda medel till en sviktande behandling. Resistent virus uppstår snabbt när efavirenz administreras som monoterapi. Valet av nya antiretrovirala medel som ska användas i kombination med efavirenz bör ta hänsyn till risken för viral korsresistens.
Samadministration med relaterade produkter
Samtidig administrering av SUSTIVA och ATRIPLA (efavirenz 600 mg/emtricitabin 200 mg/tenofovirdisoproxilfumarat 300 mg) rekommenderas inte om det inte behövs för dosjustering (t.ex. med rifampin), eftersom efavirenz är en av dess aktiva ingredienser.
Psykiatriska symtom
Allvarliga psykiatriska biverkningar har rapporterats hos patienter som behandlats med SUSTIVA. I kontrollerade studier med 1008 patienter behandlade med kurer innehållande SUSTIVA 600 mg i medeltal 2,1 år och 635 patienter behandlade med kontrollkurer i medeltal 1,5 år, frekvensen (oavsett orsakssamband) av specifika allvarliga psykiatriska händelser bland patienter som fick SUSTIVA eller kontrollregimer var respektive svår depression (2,4 %, 0,9 %), självmordstankar (0,7 %, 0,3 %), självmordsförsök utan dödlig utgång (0,5 %, 0), aggressivt beteende (0,4 %, 0,5 %), paranoida reaktioner (0,4 %). %, 0,3 %) och maniska reaktioner (0,2 %, 0,3 %). När psykiatriska symtom liknande de som noterats ovan kombinerades och utvärderades som en grupp i en multifaktoriell analys av data från studie 006, associerades behandling med efavirenz med en ökning av förekomsten av dessa utvalda psykiatriska symtom. Andra faktorer associerade med en ökning av förekomsten av dessa psykiatriska symtom var historia av injektionsdroganvändning, psykiatrisk historia och mottagande av psykiatrisk medicin vid studiestart; liknande samband observerades i både SUSTIVA- och kontrollgruppen. I studie 006 uppträdde nya allvarliga psykiatriska symtom under hela studien för både SUSTIVA-behandlade och kontrollbehandlade patienter. En procent av de SUSTIVA-behandlade patienterna avbröt eller avbröt behandlingen på grund av ett eller flera av dessa utvalda psykiatriska symtom. Det har också förekommit enstaka rapporter efter marknadsföring om dödsfall till följd av självmord, vanföreställningar och psykosliknande beteende även om ett orsakssamband till användningen av SUSTIVA inte kan fastställas utifrån dessa rapporter. Fall av katatoni efter marknadsföring har också rapporterats och kan vara associerade med ökad exponering för efavirenz. Patienter med allvarliga psykiatriska biverkningar bör omedelbart söka medicinsk utvärdering för att bedöma möjligheten att symtomen kan vara relaterade till användningen av SUSTIVA, och i så fall för att avgöra om riskerna med fortsatt behandling uppväger fördelarna. [ser NEGATIVA REAKTIONER .]
Symtom på nervsystemet
Femtiotre procent (531/1008) av patienterna som fick SUSTIVA 600 mg i kontrollerade studier rapporterade symtom på centrala nervsystemet (vilken grad som helst, oavsett orsakssamband) jämfört med 25% (156/635) av patienterna som fick kontrollregimer [se NEGATIVA REAKTIONER ]. Dessa symtom inkluderade, men var inte begränsade till, yrsel (28,1 % av de 1008 patienterna), sömnlöshet (16,3 %), nedsatt koncentrationsförmåga (8,3 %), somnolens (7,0 %), onormala drömmar (6,2 %) och hallucinationer (1,2 %). %). Dessa symtom var allvarliga hos 2,0 % av patienterna; och 2,1 % av patienterna avbröt behandlingen som ett resultat. Dessa symtom börjar vanligtvis under den första eller andra dagen av behandlingen och försvinner vanligtvis efter de första 2-4 veckorna av behandlingen. Efter 4 veckors behandling varierade prevalensen av nervsystemsymtom av minst måttlig svårighetsgrad från 5 % till 9 % hos patienter som behandlades med regimer innehållande SUSTIVA och från 3 % till 5 % hos patienter som behandlades med en kontrollregim. Patienterna bör informeras om att dessa vanliga symtom sannolikt kommer att förbättras med fortsatt behandling och inte förutsäger efterföljande uppkomst av de mindre frekventa psykiatriska symtomen [se Psykiatriska symtom ]. Dosering vid sänggåendet kan förbättra tolerabiliteten av dessa nervsystemsymtom [se DOSERING OCH ADMINISTRERING ].
Analys av långtidsdata från studie 006 (medianuppföljning 180 veckor, 102 veckor och 76 veckor för patienter behandlade med SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir respektive indinavir + zidovudin + lamivudin) visade att, Efter 24 veckors behandling var incidensen av nyuppkomna nervsystemsymtom bland SUSTIVA-behandlade patienter i allmänhet densamma som i den indinavir-innehållande kontrollarmen.
Sen debuterande neurotoxicitet, inklusive ataxi och encefalopati (nedsatt medvetande, förvirring, psykomotorisk nedgång, psykos, delirium), kan inträffa månader till år efter påbörjad efavirenzbehandling. Vissa händelser av sen debuterande neurotoxicitet har inträffat hos patienter med genetiska CYP2B6-polymorfismer som är associerade med ökade efavirenznivåer trots standarddosering av SUSTIVA. Patienter som uppvisar tecken och symtom på allvarliga neurologiska biverkningar bör utvärderas omedelbart för att bedöma möjligheten att dessa händelser kan vara relaterade till användning av efavirenz och om det är motiverat att avbryta behandlingen med SUSTIVA 600 mg.
Patienter som får SUSTIVA 600 mg bör uppmärksammas på risken för additiva effekter på centrala nervsystemet när SUSTIVA 200 mg används samtidigt med alkohol eller psykoaktiva droger.
Patienter som upplever symtom från centrala nervsystemet som yrsel, nedsatt koncentrationsförmåga och/eller dåsighet bör undvika potentiellt farliga uppgifter som att köra bil eller använda maskiner.
Embryo-fetal toxicitet
Efavirenz kan orsaka fosterskador när det administreras under den första trimestern till en gravid kvinna. Informera kvinnor med reproduktionspotential som får SUSTIVA 600 mg för att undvika graviditet. [ser Användning i specifika populationer .]
Utslag
I kontrollerade kliniska prövningar upplevde 26 % (266/1008) av vuxna patienter som behandlades med 600 mg SUSTIVA nyuppkomna hudutslag jämfört med 17 % (111/635) av de som behandlades i kontrollgrupperna [se NEGATIVA REAKTIONER ]. Utslag i samband med blåsor, fuktig avskalning eller sårbildning förekom hos 0,9 % (9/1008) av patienterna som behandlades med SUSTIVA. Incidensen av utslag av grad 4 (t.ex. erythema multiforme, Stevens-Johnsons syndrom) hos vuxna patienter som behandlades med SUSTIVA i alla studier och utökad tillgång var 0,1 %. Utslag är vanligtvis milda till måttliga makulopapulära hudutslag som inträffar inom de första 2 veckorna efter påbörjad behandling med efavirenz (mediantiden tills debut av utslag hos vuxna var 11 dagar) och hos de flesta patienter som fortsätter behandlingen med efavirenz försvinner utslagen inom 1 månad (medianlängd, 16 dagar). Frekvensen av utsättningar för hudutslag i kliniska prövningar för vuxna var 1,7 % (17/1008).
Utslag rapporterades hos 59 av 182 pediatriska patienter (32%) som behandlades med SUSTIVA [se NEGATIVA REAKTIONER ]. Två pediatriska patienter fick utslag av grad 3 (sammanflytande utslag med feber, generaliserade utslag), och fyra patienter hade utslag av grad 4 (erythema multiforme). Mediantiden till debut av hudutslag hos pediatriska patienter var 28 dagar (intervall 3-1642 dagar). Profylax med lämpliga antihistaminer innan behandling med SUSTIVA påbörjas hos pediatriska patienter bör övervägas.
SUSTIVA 600 mg kan i allmänhet återupptas hos patienter som avbryter behandlingen på grund av hudutslag. SUSTIVA 200 mg ska avbrytas hos patienter som utvecklar svåra hudutslag i samband med blåsor, avskalning, slemhinnepåverkan eller feber. Lämpliga antihistaminer och/eller kortikosteroider kan förbättra tolerabiliteten och påskynda upplösningen av utslag. För patienter som har haft en livshotande kutan reaktion (t.ex. Stevens-Johnsons syndrom), bör alternativ behandling övervägas [se KONTRAINDIKATIONER ].
Hepatotoxicitet
Fall av hepatit efter marknadsföring, inklusive fulminant hepatit som utvecklas till leversvikt som kräver transplantation eller leder till dödsfall, har rapporterats hos patienter som behandlats med SUSTIVA. Rapporter har inkluderat patienter med underliggande leversjukdom, inklusive samtidig infektion med hepatit B eller C, och patienter utan redan existerande leversjukdom eller andra identifierbara riskfaktorer.
SUSTIVA 600 mg rekommenderas inte för patienter med måttligt eller gravt nedsatt leverfunktion. Noggrann övervakning rekommenderas för patienter med lätt nedsatt leverfunktion som får SUSTIVA. [ser NEGATIVA REAKTIONER och Användning i specifika populationer ].
Övervakning av leverenzymer före och under behandling rekommenderas för alla patienter [se DOSERING OCH ADMINISTRERING ].
Överväg att avbryta behandlingen med SUSTIVA 600 mg hos patienter med ihållande förhöjningar av serumtransaminaser till mer än fem gånger den övre gränsen för normalintervallet.Avbryt SUSTIVA 200 mg om förhöjda serumtransaminaser åtföljs av kliniska tecken eller symtom på hepatit eller leverdekompensation.
Kramper
Konvulsioner har observerats hos vuxna och pediatriska patienter som får efavirenz, vanligtvis i närvaro av känd medicinsk historia av anfall [se Icke-klinisk toxikologi ]. Försiktighet bör iakttas hos alla patienter med en historia av anfall. Patienter som samtidigt får antikonvulsiva läkemedel som huvudsakligen metaboliseras av levern, såsom fenytoin och fenobarbital, kan behöva periodisk övervakning av plasmanivåer [se LÄKEMEDELSINTERAKTIONER ].
Lipidförhöjningar
Behandling med SUSTIVA har resulterat i ökningar av koncentrationen av totalt kolesterol och triglycerider [se NEGATIVA REAKTIONER ]. Kolesterol- och triglyceridtest bör utföras innan behandling med SUSTIVA 200 mg påbörjas och med periodiska intervall under behandlingen.
Immunrekonstitutionssyndrom
Immunrekonstitutionssyndrom har rapporterats hos patienter som behandlats med antiretroviral kombinationsterapi, inklusive SUSTIVA. Under den inledande fasen av antiretroviral kombinationsbehandling kan patienter vars immunsystem svarar utveckla ett inflammatoriskt svar på indolenta eller kvarvarande opportunistiska infektioner (som Mycobacterium avium-infektion, cytomegalovirus, Pneumocystis jiroveci pneumoni [PCP] eller tuberkulos), vilket kan kräva ytterligare utvärdering och behandling.
Autoimmuna störningar (såsom Graves sjukdom, polymyosit, Guillain-Barrés syndrom och autoimmun hepatit) har också rapporterats förekomma i samband med immunrekonstitution; dock är tiden till debut är mer varierande och kan inträffa många månader efter påbörjad behandling.
Omfördelning av fett
Omfördelning/ackumulering av kroppsfett inklusive central fetma, dorsocervikal fettförstoring (buffalo hump), perifer slöseri, ansiktsförtvining, bröstförstoring och "cushingoid utseende" har observerats hos patienter som får antiretroviral behandling. Mekanismen och de långsiktiga konsekvenserna av dessa händelser är för närvarande okända. Något orsakssamband har inte fastställts.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION och Användningsinstruktioner ).
Läkemedelsinteraktioner
Ett uttalande till patienter och vårdgivare finns på produktens flasketiketter: VARNING: Ta reda på om läkemedel som INTE bör tas med SUSTIVA.
SUSTIVA kan interagera med vissa läkemedel; råd därför patienter att rapportera till sin läkare användning av andra receptbelagda eller receptfria läkemedel.
Allmän information för patienter
Informera patienterna om att SUSTIVA 200 mg inte är ett botemedel mot HIV-1-infektion och att patienter kan fortsätta att uppleva sjukdomar associerade med HIV-1-infektion, inklusive opportunistiska infektioner. Patienter bör förbli under vård av en läkare medan de tar SUSTIVA.
Råda patienter att undvika att göra saker som kan sprida HIV-1-infektion till andra.
- Dela eller återanvänd inte nålar eller annan injektionsutrustning.
- Dela inte personliga föremål som kan ha blod eller kroppsvätskor på sig, som tandborstar och rakblad.
- Ha inte någon form av sex utan skydd. Utöva alltid säkrare sex genom att använda en latex- eller polyuretankondom för att minska risken för sexuell kontakt med sperma, vaginalt sekret eller blod.
- Amma inte. Mödrar med HIV-1 bör inte amma eftersom HIV-1 kan överföras till barnet i bröstmjölk.
Doseringsinstruktioner
Råda patienter att ta SUSTIVA varje dag enligt ordination. Om en patient glömmer att ta SUSTIVA, berätta för patienten att ta den missade dosen omedelbart, om det inte nästan är dags för nästa dos. Rekommendera patienten att inte ta 2 doser på en gång och att ta nästa dos vid den regelbundna schemalagda tiden. Råd patienten att fråga en vårdgivare om han/hon behöver hjälp med att planera de bästa tiderna för att ta sin medicin.
SUSTIVA 200mg ska alltid användas i kombination med andra antiretrovirala läkemedel. Råda patienter att ta SUSTIVA 600 mg på fastande mage, helst vid sänggåendet. Att ta SUSTIVA med mat ökar efavirenzkoncentrationerna och kan öka frekvensen av biverkningar. Dosering vid sänggåendet kan förbättra tolerabiliteten av symtom i nervsystemet [se DOSERING OCH ADMINISTRERING och NEGATIVA REAKTIONER ]. Vårdgivare bör hjälpa föräldrar eller vårdgivare att bestämma det bästa doseringsschemat för SUSTIVA för spädbarn och småbarn.
För vuxna och pediatriska patienter som inte kan svälja kapslar eller tabletter, bör patienter eller deras vårdgivare rådas att läsa och noggrant följa instruktionerna för administrering av kapselinnehållet i en liten mängd mat eller modersmjölksersättning [se DOSERING OCH ADMINISTRERING och FDA-godkänd patientmärkning ( PATIENTINFORMATION och ANVÄNDNINGSINSTRUKTIONER )]. Patienter bör ringa sin vårdgivare eller apotekspersonal om de har några frågor.
Symtom på nervsystemet
Informera patienter om att symtom på centrala nervsystemet (NSS) inklusive yrsel, sömnlöshet, nedsatt koncentrationsförmåga, dåsighet och onormala drömmar vanligtvis rapporteras under de första veckorna av behandlingen med SUSTIVA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Dosering vid sänggåendet kan förbättra tolerabiliteten för dessa symtom, som sannolikt kommer att förbättras med fortsatt behandling. Varna patienterna för risken för additiva effekter när SUSTIVA används samtidigt med alkohol eller psykoaktiva droger. Instruera patienterna att om de upplever NSS bör de undvika potentiellt farliga uppgifter som att köra bil eller använda maskiner.
Informera patienterna om att det finns en risk för att utveckla sent debuterande neurotoxicitet, inklusive ataxi och encefalopati som kan uppstå månader till år efter påbörjad SUSTIVA-behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Psykiatriska symtom
Informera patienter om att allvarliga psykiatriska symtom inklusive svår depression, självmordsförsök, aggressivt beteende, vanföreställningar, paranoia, psykosliknande symtom och katatoni har rapporterats hos patienter som får SUSTIVA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Om de upplever allvarliga psykiatriska biverkningar bör de omedelbart söka medicinsk bedömning. Rekommendera patienter att informera sin läkare om någon historia av psykisk sjukdom eller missbruk.
Utslag
Informera patienterna om att en vanlig biverkning är utslag [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Utslagen försvinner vanligtvis utan någon förändring i behandlingen. Men eftersom utslag kan vara allvarliga, råd patienter att kontakta sin läkare omedelbart om utslag uppstår.
Hepatotoxicitet
Informera patienterna att se efter tidiga varningstecken på leverinflammation eller leversvikt, såsom trötthet, svaghet, aptitlöshet, illamående och kräkningar, samt senare tecken som gulsot, förvirring, buksvullnad och missfärgad avföring, och konsultera deras sjukvårdspersonal utan dröjsmål om sådana symtom uppstår [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Kvinnor Av Reproduktionspotential
Informera kvinnor med reproduktionspotential att använda effektiv preventivmetod samt en barriärmetod under behandling med SUSTIVA 600 mg och i 12 veckor efter avslutad behandling med SUSTIVA. Råda patienter att kontakta sin vårdgivare om de planerar att bli gravida, bli gravida eller om man misstänker graviditet under behandling med SUSTIVA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Registret för graviditetsexponering
Informera patienter om att det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för SUSTIVA under graviditeten [se Användning i specifika populationer ].
Omfördelning av fett
Informera patienter om att omfördelning eller ackumulering av kroppsfett kan förekomma hos patienter som får antiretroviral behandling och att orsaken till och långsiktiga hälsoeffekter av dessa tillstånd inte är kända [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
SUSTIVA är ett registrerat varumärke som tillhör Bristol-Myers Squibb Pharma Company. ATRIPLA är ett varumärke som tillhör Bristol-Myers Squibb & Gilead Sciences, LLC.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Långtidsstudier av karcinogenicitet på möss och råttor utfördes med efavirenz. Möss doserades med 0, 25, 75, 150 eller 300 mg/kg/dag under 2 år. Incidensen av hepatocellulära adenom och karcinom och lungalveolära/bronkiolära adenom ökade över bakgrunden hos kvinnor. Inga ökningar i tumörincidens över bakgrund sågs hos män. Det fanns ingen NOAEL hos kvinnor fastställd för denna studie eftersom tumörfynd inträffade vid alla doser. AUC vid NOAEL (150 mg/kg) hos män var cirka 0,9 gånger högre än hos människor vid den rekommenderade kliniska dosen. I råttstudien observerades ingen ökning av tumörincidensen vid doser upp till 100 mg/kg/dag, för vilka AUC var 0,1 (hanar) eller 0,2 (honor) gånger de hos människor vid den rekommenderade kliniska dosen.
Mutagenes
Efavirenz testades negativt i en rad genotoxicitetsanalyser in vitro och in vivo. Dessa inkluderade bakteriemutationsanalyser i S.typhimurium och E. coli, däggdjursmutationsanalyser i äggstocksceller från kinesisk hamster, analyser av kromosomavvikelser i humana perifera blodlymfocyter eller ovarieceller från kinesisk hamster, och en in vivo-analys av benmärgsmikronkärn hos mus.
Nedsättning av fertilitet
Efavirenz försämrade inte parning eller fertilitet hos han- eller honråttor och påverkade inte spermier från behandlade hanråttor. Reproduktionsförmågan hos avkommor födda av honråttor som fick efavirenz påverkades inte. AUC vid NOAEL-värdena hos hanråttor (200 mg/kg) och honråttor (100 mg/kg) var ungefär ≤0,15 gånger högre än hos människa vid den rekommenderade kliniska dosen.
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsresultat hos kvinnor som exponerats för SUSTIVA 600 mg under graviditeten. Läkare uppmuntras att registrera patienter genom att ringa Antiretroviral Pregnancy Registry på 1-800-258-4263.
Risksammanfattning
Det finns retrospektiva fallrapporter av neuralrörsdefekter hos spädbarn vars mödrar exponerades för behandlingar innehållande efavirenz under graviditetens första trimester. Prospektiva graviditetsdata från Antiretroviral Pregnancy Registry är inte tillräckliga för att bedöma denna risk på ett adekvat sätt. Tillgängliga data från Antiretroviral Pregnancy Registry visar ingen skillnad i risken för övergripande stora fosterskador jämfört med bakgrundsfrekvensen för stora fosterskador på 2,7 % i den amerikanska referenspopulationen i Metropolitan Atlanta Congenital Defects Program (MACDP). Även om ett orsakssamband inte har fastställts mellan exponering för efavirenz under första trimestern och neuralrörsdefekter, har liknande missbildningar observerats i studier utförda på apor vid doser liknande den humana dosen. Dessutom inträffade foster- och embryonala toxiciteter hos råttor, vid en dos som är tio gånger lägre än den mänskliga exponeringen vid rekommenderad klinisk dos. På grund av den potentiella risken för neuralrörsdefekter ska efavirenz inte användas under graviditetens första trimester. Informera gravida kvinnor om den potentiella risken för ett foster.
Data
Mänskliga data
Det finns retrospektiva eftermarknadsföringsrapporter om fynd som överensstämmer med neuralrörsdefekter, inklusive meningomyelocele, alla hos spädbarn till mödrar som exponerats för kurer innehållande efavirenz under den första trimestern.
Baserat på prospektiva rapporter från Antiretroviral Pregnancy Registry (APR) av cirka 1 000 levande födda efter exponering för regimer innehållande efavirenz (inklusive över 800 levande födda exponerade under första trimestern), fanns det ingen skillnad mellan efavirenz och totala fosterskador jämfört med bakgrundsfrekvens av fosterskador på 2,7 % i den amerikanska referenspopulationen i Metropolitan Atlanta Congenital Defects Program. Från och med den interimistiska APR-rapporten från december 2014 var prevalensen av fosterskador efter exponering i första trimestern 2,3 % (95 % KI: 1,4 %-3,6 %). En av dessa prospektivt rapporterade defekter vid exponering under första trimestern var en neuralrörsdefekt. Ett enstaka fall av anoftalmi med exponering för efavirenz under första trimestern har också prospektivt rapporterats. Detta fall omfattade också svåra sneda ansiktssprickor och fostervattenband, som har ett känt samband med anoftalmi.
Djurdata
Effekter av efavirenz på embryo-fosterutveckling har studerats hos tre icke-kliniska arter (cynomolgusapor, råttor och kaniner). Hos apor gavs efavirenz 60 mg/kg/dag till gravida kvinnor under hela graviditeten (dräktighetsdagar 20 till 150). Moderns systemiska läkemedelsexponeringar (AUC) var 1,3 gånger exponeringen hos människor vid den rekommenderade kliniska dosen (600 mg/dag), med fetala navelsträngsvenösa läkemedelskoncentrationer ungefär 0,7 gånger moderns värden. Tre av 20 foster/spädbarn hade en eller flera missbildningar; det fanns inga missbildade foster eller spädbarn från placebobehandlade mödrar. De missbildningar som inträffade hos dessa tre apfoster inkluderade anencefali och unilateral anoftalmi hos ett foster, mikroftalmi hos ett andra och gomspalt i det tredje. Det fanns ingen NOAEL (ingen observerbar biverkningsnivå) fastställd för denna studie eftersom endast en dos utvärderades. Till råttor administrerades efavirenz antingen under organogenesen (dräktighetsdagar 7 till 18) eller från dräktighetsdag 7 till och med laktationsdag 21 med 50, 100 eller 200 mg/kg/dag. Administrering av 200 mg/kg/dag till råttor var associerad med ökad förekomst av tidiga resorptioner; och doser 100 mg/kg/dag och mer var associerade med tidig neonatal mortalitet. AUC vid NOAEL (50 mg/kg/dag) i denna råttstudie var 0,1 gånger högre än hos människor vid den rekommenderade kliniska dosen. Läkemedelskoncentrationerna i mjölken på amningsdag 10 var cirka 8 gånger högre än i moderns plasma. Hos dräktiga kaniner var efavirenz varken embryoletalt eller teratogent när det administrerades i doser på 25, 50 och 75 mg/kg/dag under organogenesperioden (dräktighetsdagar 6 till 18). AUC vid NOAEL (75 mg/kg/dag) hos kaniner var 0,4 gånger högre än hos människa vid den rekommenderade kliniska dosen.
Laktation
Risksammanfattning
Centers for Disease Control and Prevention rekommenderar att HIV-infekterade mödrar inte ammar sina spädbarn för att undvika att riskera postnatal överföring av HIV. På grund av risken för HIV-överföring hos ammade spädbarn, råd kvinnor att inte amma.
Kvinnor Och Hanar Av Reproduktionspotential
På grund av potentiella teratogena effekter bör graviditet undvikas hos kvinnor som får SUSTIVA. [ser Graviditet .]
Graviditetstest
Kvinnor med reproduktionspotential bör genomgå graviditetstest innan behandling med SUSTIVA påbörjas.
Preventivmedel
Kvinnor med reproduktionspotential bör använda effektiva preventivmedel under behandling med SUSTIVA 200 mg och i 12 veckor efter avslutad behandling med SUSTIVA 200 mg på grund av efavirenz långa halveringstid. Barriärpreventivmedel ska alltid användas i kombination med andra preventivmedel. Hormonella metoder som innehåller progesteron kan ha minskad effektivitet [se LÄKEMEDELSINTERAKTIONER ].
Pediatrisk användning
Säkerheten, den farmakokinetiska profilen och det virologiska och immunologiska svaret av SUSTIVA 600 mg utvärderades hos antiretroviralt naiva och - erfarna HIV-1-infekterade pediatriska patienter i åldern 3 månader till 21 år i tre öppna kliniska prövningar [se NEGATIVA REAKTIONER , KLINISK FARMAKOLOGI , och Kliniska studier ]. Typen och frekvensen av biverkningar i dessa studier liknade i allmänhet de hos vuxna patienter med undantag för en högre frekvens av utslag, inklusive en högre frekvens av utslag av grad 3 eller 4, hos pediatriska patienter jämfört med vuxna [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
Användning av SUSTIVA till patienter yngre än 3 månader gamla ELLER mindre än 3,5 kg kroppsvikt rekommenderas inte eftersom säkerheten, farmakokinetiken och den antivirala aktiviteten för SUSTIVA 600 mg inte har utvärderats i denna åldersgrupp och det finns en risk för att utveckla HIV-resistens om SUSTIVA är underdoserad. ser DOSERING OCH ADMINISTRERING för doseringsrekommendationer för pediatriska patienter.
Geriatrisk användning
Kliniska studier av SUSTIVA 200 mg inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. I allmänhet bör dosval för en äldre patient vara försiktigt, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion och av samtidig sjukdom eller annan behandling.
Nedsatt leverfunktion
SUSTIVA rekommenderas inte för patienter med måttligt eller gravt nedsatt leverfunktion eftersom det inte finns tillräckliga data för att avgöra om dosjustering är nödvändig. Patienter med lätt nedsatt leverfunktion kan behandlas med efavirenz utan någon dosjustering. På grund av den omfattande cytokrom P450-medierade metabolismen av efavirenz och begränsad klinisk erfarenhet av patienter med nedsatt leverfunktion, bör försiktighet iakttas vid administrering av SUSTIVA till dessa patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
ÖVERDOS
Vissa patienter som av misstag tar 600 mg två gånger dagligen har rapporterat ökade symtom i nervsystemet. En patient upplevde ofrivilliga muskelsammandragningar.
Behandling av överdosering med SUSTIVA 200 mg bör bestå av allmänna stödåtgärder, inklusive övervakning av vitala tecken och observation av patientens kliniska status. Administrering av aktivt kol kan användas för att hjälpa till att avlägsna oabsorberat läkemedel. Det finns ingen specifik motgift mot överdosering med SUSTIVA. Eftersom efavirenz är starkt proteinbundet, är det osannolikt att dialys avsevärt tar bort läkemedlet från blodet.
KONTRAINDIKATIONER
- SUSTIVA är kontraindicerat hos patienter med tidigare påvisad kliniskt signifikant överkänslighet (t.ex. Stevens-Johnsons syndrom, erythema multiforme eller toxiska hudutslag) mot någon av komponenterna i denna produkt.
- Samtidig administrering av efavirenz med elbasvir och grazoprevir är kontraindicerat [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Efavirenz är ett antiviralt läkemedel [se Mikrobiologi ].
Farmakodynamik
Hjärtets elektrofysiologi
Effekten av SUSTIVA 600 mg på QTc-intervallet utvärderades i en öppen, positiv och placebokontrollerad, fixerad enkelsekvens 3-periods, 3-behandlings crossover QT-studie på 58 friska försökspersoner berikade för CYP2B6-polymorfismer. Genomsnittlig Cmax för efavirenz hos försökspersoner med genotyp CYP2B6 *6/*6 efter administrering av 600 mg daglig dos under 14 dagar var 2,25 gånger det genomsnittliga Cmax som observerats hos försökspersoner med genotyp CYP2B6 *1/*1. Ett positivt samband mellan efavirenzkoncentration och QTc-förlängning observerades. Baserat på förhållandet mellan koncentration och QTc är den genomsnittliga QTc-förlängningen och dess övre gräns 90 % konfidensintervall 8,7 ms och 11,3 ms hos patienter med genotyp CYP2B6*6/*6 efter administrering av 600 mg daglig dos under 14 dagar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Farmakokinetik
Absorption
Maximala plasmakoncentrationer av efavirenz på 1,6-9,1 μM uppnåddes 5 timmar efter orala engångsdoser på 100 mg till 1600 mg administrerade till oinfekterade frivilliga. Dosrelaterade ökningar av Cmax och AUC sågs för doser upp till 1600 mg; ökningarna var mindre än proportionella vilket tyder på minskad absorption vid högre doser.
Hos HIV-1-infekterade patienter vid steady state var medel-Cmax, medel-Cmin och medel-AUC dosproportionella efter 200 mg, 400 mg och 600 mg dagliga doser. Tid till toppplasmakoncentrationer var cirka 3-5 timmar och steady-state plasmakoncentrationer nåddes inom 6-10 dagar. Hos 35 patienter som fick SUSTIVA 600 mg en gång dagligen var steady-state Cmax 12,9 ± 3,7 μM (medelvärde ± SD), steadystate Cmin var 5,6 ± 3,2 μM och AUC var 184 ± 73 μM•h.
Effekt av mat på oral absorption:
Kapslar
Administrering av en engångsdos på 600 mg efavirenzkapslar tillsammans med en måltid med hög fetthalt/hög kalori (894 kcal, 54 g fett, 54 % kalorier från fett) eller en måltid med låg fetthalt/normalkalori (440 kcal, 2 g) fett, 4 % kalorier från fett) associerades med en genomsnittlig ökning på 22 % och 17 % i efavirenz AUC∞ och en genomsnittlig ökning av efavirenz Cmax på 39 % respektive 51 %, i förhållande till de exponeringar som uppnåddes vid fasta. . [ser DOSERING OCH ADMINISTRERING och PATIENTINFORMATION .]
Tabletter
Administrering av en enstaka 600 mg efavirenztablett tillsammans med en måltid med hög fetthalt/hög kaloriinnehåll (cirka 1000 kcal, 500-600 kcal från fett) associerades med en 28% ökning av medel-AUC∞ för efavirenz och en 79% ökning av medelvärdet. Cmax för efavirenz i förhållande till de exponeringar som uppnåtts under fasta. [ser DOSERING OCH ADMINISTRERING och PATIENTINFORMATION .]
Biotillgänglighet av kapselinnehåll blandat med livsmedelsbärare
Hos friska vuxna försökspersoner uppfyllde efavirenz AUC när det administrerades som innehållet i tre 200 mg kapslar blandade med 2 teskedar av vissa livsmedelsbärare (äppelmos, druvgelé eller yoghurt eller modersmjölksersättning) bioekvivalenskriterierna för AUC för den intakta kapselformuleringen som administrerades under fasta förhållanden.
Distribution
Efavirenz är starkt bundet (ungefär 99,5-99,75%) till humana plasmaproteiner, främst albumin. Hos HIV-1-infekterade patienter (n=9) som fick SUSTIVA 200 till 600 mg en gång dagligen under minst en månad, varierade koncentrationerna av cerebrospinalvätska från 0,26 till 1,19 % (medelvärde 0,69 %) av motsvarande plasmakoncentration. Denna andel är ungefär 3 gånger högre än den icke-proteinbundna (fria) fraktionen av efavirenz i plasma.
Ämnesomsättning
Studier på människor och in vitro-studier med humana levermikrosomer har visat att efavirenz huvudsakligen metaboliseras av cytokrom P450-systemet till hydroxylerade metaboliter med efterföljande glukuronidering av dessa hydroxylerade metaboliter. Dessa metaboliter är väsentligen inaktiva mot HIV-1. In vitro-studierna tyder på att CYP3A och CYP2B6 är de huvudsakliga isozymerna som är ansvariga för metabolismen av efavirenz.
Efavirenz har visat sig inducera CYP-enzymer, vilket resulterar i induktion av sin egen metabolism. Flera doser på 200-400 mg per dag i 10 dagar resulterade i en lägre än förutspått omfattning av ackumulering (22-42 % lägre) och en kortare terminal halveringstid på 40-55 timmar (halveringstid för engångsdos 52-76 timmar) ).
Eliminering
Efavirenz har en terminal halveringstid på 52-76 timmar efter engångsdoser och 40-55 timmar efter flera doser. En en månad lång massbalans-/utsöndringsstudie genomfördes med 400 mg per dag med en C-märkt dos administrerad på dag 8. Cirka 14-34 % av radiomärkningen återfanns i urinen och 16-61 % återfanns i avföringen. . Nästan all urinutsöndring av det radiomärkta läkemedlet var i form av metaboliter. Efavirenz stod för majoriteten av den totala radioaktiviteten mätt i avföring.
Särskilda populationer
Pediatrisk
De farmakokinetiska parametrarna för efavirenz vid steady state hos pediatriska patienter förutspåddes av en populationsfarmakokinetisk modell och är sammanfattade i tabell 6 efter viktintervall som motsvarar de rekommenderade doserna.
Kön och ras
Farmakokinetiken för efavirenz hos patienter verkar vara likartad mellan män och kvinnor och bland de rasgrupper som studerats.
Nedsatt njurfunktion
Farmakokinetiken för efavirenz har inte studerats hos patienter med njurinsufficiens; dock utsöndras mindre än 1 % av efavirenz oförändrat i urinen, så effekten av nedsatt njurfunktion på efavirenz-elimineringen bör vara minimal.
Nedsatt leverfunktion
En studie med flera doser visade ingen signifikant effekt på efavirenz farmakokinetik hos patienter med lätt nedsatt leverfunktion (Child-Pugh klass A) jämfört med kontroller. Det fanns otillräckliga data för att avgöra om måttligt eller gravt nedsatt leverfunktion (Child-Pugh klass B eller C) påverkar efavirenz farmakokinetik.
Läkemedelsinteraktionsstudier
Efavirenz har visats in vivo orsaka leverenzyminduktion, vilket ökar biotransformationen av vissa läkemedel som metaboliseras av CYP3A och CYP2B6. In vitro-studier har visat att efavirenz hämmade CYP-isozymen 2C9 och 2C19 med Ki-värden (8,5-17 μM) inom området för observerade plasmakoncentrationer av efavirenz. I in vitro-studier hämmade inte efavirenz CYP2E1 och hämmade CYP2D6 och CYP1A2 (Ki-värden 82-160 μM) endast vid koncentrationer långt över de kliniskt uppnådda. Samtidig administrering av efavirenz med läkemedel som primärt metaboliseras av CYP2C9, CYP2C19, CYP3A eller CYP2B6 isozymer kan resultera i förändrade plasmakoncentrationer av det samtidigt administrerade läkemedlet. Läkemedel som inducerar CYP3A- och CYP2B6-aktivitet förväntas öka clearance av efavirenz vilket resulterar i sänkta plasmakoncentrationer.
Läkemedelsinteraktionsstudier utfördes med efavirenz och andra läkemedel som sannolikt kommer att administreras samtidigt eller läkemedel som vanligtvis används som sonder för farmakokinetisk interaktion. Effekterna av samtidig administrering av efavirenz på Cmax, AUC och Cmin sammanfattas i Tabell 7 (effekt av efavirenz på andra läkemedel) och Tabell 8 (effekt av andra läkemedel på efavirenz). För information om kliniska rekommendationer se LÄKEMEDELSINTERAKTIONER .
Mikrobiologi
Handlingsmekanism
Efavirenz är en NNRTI av HIV-1. Efavirenz-aktivitet medieras huvudsakligen av icke-kompetitiv hämning av HIV-1 omvänt transkriptas. HIV-2 omvänt transkriptas och humana cellulära DNA-polymeraser α, β, γ och δ hämmas inte av efavirenz.
Antiviral aktivitet i cellkultur
Koncentrationen av efavirenz som hämmade replikationen av vildtyps-laboratorieanpassade stammar och kliniska isolat i cellkultur med 90-95 % (EC90-95) varierade från 1,7 till 25 nM i lymfoblastoidcellinjer, perifera mononukleära blodceller (PBMC) och makrofager /monocytkulturer. Efavirenz visade antiviral aktivitet mot clade B och de flesta icke-clade B isolat (subtyper A, AE, AG, C, D, F, G, J, N), men hade minskad antiviral aktivitet mot grupp O-virus. Efavirenz uppvisade additiv antiviral aktivitet utan cytotoxicitet mot HIV-1 i cellodling i kombination med NNRTI:erna delavirdin och nevirapin, NRTIs (abakavir, didanosin, emtricitabin, lamivudin, stavudin, tenofovir, zalcitabin, zidovudin, PIs, invirampudin, PIs, vira nelfinavir, ritonavir, saquinavir) och fusionshämmaren enfuvirtid. Efavirenz visade additiv till antagonistisk antiviral aktivitet i cellkultur med atazanavir. Efavirenz var inte antagonistiskt med adefovir, som används för behandling av hepatit B-virusinfektion, eller ribavirin, som används i kombination med interferon för behandling av hepatit C-virusinfektion.
Motstånd
cellkultur
I cellodling uppstod snabbt HIV-1-isolat med minskad känslighet för efavirenz (>380-faldig ökning av EC90-värde) i närvaro av läkemedel. Genotypisk karakterisering av dessa virus identifierade enkla aminosyrasubstitutioner L100I eller V179D, dubbla substitutioner L100I/V108I och trippelsubstitutioner L100I/V179D/Y181C i omvänt transkriptas.
Kliniska studier
Kliniska isolat med minskad känslighet i cellkultur för efavirenz har erhållits. En eller flera substitutioner vid aminosyrapositionerna 98, 100, 101, 103, 106, 108, 188, 190, 225 och 227 i omvänt transkriptas observerades hos patienter som misslyckades med behandling med efavirenz i kombination med indinavir eller med zidovudin plus lamivudin. K103N-substitutionen var den vanligast observerade. Långtidsövervakning av resistens (i genomsnitt 52 veckor, intervall 4-106 veckor) analyserade 28 matchande isolat från baslinje och virologiskt misslyckande. Sextioen procent (17/28) av dessa misslyckade isolat hade minskad efavirenzkänslighet i cellkultur med en median 88-faldig förändring i efavirenzkänslighet (EC50-värde) från referensen. Den vanligaste NNRTI-substitutionen som utvecklades hos dessa patientisolat var K103N (54%). Andra NNRTI-substitutioner som utvecklades var L100I (7%), K101E/Q/R (14%), V108I (11%), G190S/T/A (7%), P225H (18%) och M230I/L (11%) %).
Korsmotstånd
Korsresistens bland NNRTIs har observerats. Kliniska isolat som tidigare karakteriserats som efavirenzresistenta var också fenotypiskt resistenta i cellkulturer mot delavirdin och nevirapin jämfört med baseline. Delavirdin- och/eller nevirapinresistenta kliniska virala isolat med NNRTI-resistensassocierade substitutioner (A98G, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, L100I, K101E/P, K103N/S, V106A, Y181X, Y188X, G190X, P225H, F227a susceptibility) i cellkultur. Mer än 90 % av NRTI-resistenta kliniska isolat som testades i cellkultur behöll känsligheten för efavirenz.
Djurtoxikologi
Icke-hållna kramper observerades hos 6 av 20 apor som fick efavirenz i doser som gav plasma-AUC-värden 4-13 gånger högre än hos människor som fick den rekommenderade dosen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kliniska studier
Vuxna
Studie 006 en randomiserad, öppen studie, jämförde SUSTIVA (600 mg en gång dagligen) + zidovudin (ZDV, 300 mg var 12h) + lamivudin (LAM, 150 mg var 12h) eller SUSTIVA (600 mg en gång dagligen) + indinavir (IDV, 1000 mg q8h) med indinavir (800 mg q8h) + zidovudin (300 mg q12h) + lamivudin (150 mg q12h). Tolvhundrasextiosex patienter (medelålder 36,5 år [intervall 18-81], 60 % kaukasiska, 83 % män) inkluderades. Alla patienter var efavirenz-, lamivudin-, NNRTI- och PI-naiva vid studiestart. Medianvärdet för CD4+-cellantalet vid baslinjen var 320 celler/mm3 och medianvärdet för HIV-1 RNA-nivån vid baslinjen var 4,8 log kopior/ml. Behandlingsresultat med standardanalys (analysgräns 400 kopior/ml) till och med 48 och 168 veckor visas i tabell 9. Plasma HIV RNA-nivåer kvantifierades med standard (analysgräns 400 kopior/ml) och ultrakänslig (analysgräns 50 kopior/ml) versioner av AMPLICOR HIV-1 MONITOR-analysen. Under studien introducerades version 1.5 av analysen i Europa för att förbättra upptäckten av icke-klade B-virus.
För patienter som behandlats med SUSTIVA + zidovudin + lamivudin, SUSTIVA + indinavir eller indinavir + zidovudin + lamivudin var andelen svarande med HIV-1 RNA
ACTG 364 är en randomiserad, dubbelblind, placebokontrollerad, 48-veckors studie på NRTI-erfarna patienter som hade genomfört två tidigare ACTG-studier. Etthundra nittiosex patienter (medelålder 41 år [intervall 18-76], 74 % kaukasiska, 88 % män) fick NRTI i kombination med SUSTIVA (600 mg en gång dagligen) eller nelfinavir (NFV, 750 mg tre gånger dagligen) ), eller SUSTIVA (600 mg en gång dagligen) + nelfinavir på ett randomiserat, dubbelblindat sätt. Det genomsnittliga antalet CD4+-celler vid baslinjen var 389 celler/mm3 och medelvärdet för HIV-1 RNA-nivån vid baslinjen var 8130 kopior/ml. Vid inträdet i studien tilldelades alla patienter en ny öppen NRTI-regim, som var beroende av deras tidigare NRTI-behandlingserfarenhet. Det fanns ingen signifikant skillnad i det genomsnittliga antalet CD4+-celler bland behandlingsgrupperna; den totala genomsnittliga ökningen var cirka 100 celler vid 48 veckor bland patienter som fortsatte med studieregimer. Behandlingsresultat visas i Tabell 10. Plasma-HIV-RNA-nivåer kvantifierades med AMPLICOR HIV-1 MONITOR-analysen med användning av en nedre kvantifieringsgräns på 500 kopior/ml.
En Kaplan-Meier-analys av tiden till behandlingssvikt genom 72 veckor visar en längre varaktighet av virologisk suppression (HIV RNA
Pediatriska patienter
Studie AI266922 är en öppen studie för att utvärdera farmakokinetiken, säkerheten, tolerabiliteten och den antivirala aktiviteten av SUSTIVA 200 mg i kombination med didanosin och emtricitabin hos antiretroviralt naiva och erfarna pediatriska patienter. Trettiosju patienter i åldern 3 månader till 6 år (median 0,7 år) behandlades med SUSTIVA. Vid baslinjen var median plasma HIV-1 RNA 5,88 log kopior/ml, median CD4+ cellantal var 1144 celler/mm3 och median CD4+ procentandel var 25%. Mediantiden för studieterapi var 60 veckor; 27 % av patienterna avbröt behandlingen före vecka 48. Med en ITT-analys var den totala andelen patienter med HIV RNA
Studie PACTG 1021 var en öppen studie för att utvärdera farmakokinetiken, säkerheten, tolerabiliteten och den antivirala aktiviteten av SUSTIVA 200 mg i kombination med didanosin och emtricitabin hos pediatriska patienter som var naiva med antiretroviral terapi. Fyrtiotre patienter i åldern 3 månader till 21 år (median 9,6 år) doserades med SUSTIVA. Vid baslinjen var median plasma HIV-1 RNA 4,8 log kopior/ml, median CD4+ cellantal var 367 celler/mm3 och median CD4+ procentandel var 18%. Mediantiden för studieterapi var 181 veckor; 16 % av patienterna avbröt behandlingen före vecka 48. Med en ITT-analys var den totala andelen patienter med HIV RNA
Studie PACTG 382 var en öppen studie för att utvärdera farmakokinetiken, säkerheten, tolerabiliteten och den antivirala aktiviteten av SUSTIVA i kombination med nelfinavir och en NRTI hos antiretroviralt naiva och NRTI-erfarna pediatriska patienter. Hundra två patienter i åldern 3 månader till 16 år (median 5,7 år) behandlades med SUSTIVA. 87 procent av patienterna hade tidigare fått antiretroviral behandling. Vid baslinjen var median plasma HIV-1 RNA 4,57 log kopior/ml, median CD4+ cellantal var 755 celler/mm3 och median CD4+ procentandel var 30 %. Mediantiden för studieterapi var 118 veckor; 25 % av patienterna avbröt behandlingen före vecka 48. Med en ITT-analys var den totala andelen patienter med HIV RNA
PATIENTINFORMATION
SUSTIVA® (sus-TEE-vah) (efavirenz) kapslar
SUSTIVA® (sus-TEE-vah) (efavirenz) tabletter
Viktigt: Fråga din läkare eller apotekspersonal om läkemedel som inte ska tas med SUSTIVA. För mer information, se avsnittet "Vad ska jag berätta för min läkare innan jag tar SUSTIVA?"
Läs denna patientinformation innan du börjar ta SUSTIVA och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling.
Vad är SUSTIVA?
SUSTIVA 600mg är ett receptbelagt läkemedel mot HIV-1 (humant immunbristvirus typ 1) som används tillsammans med andra antiretrovirala läkemedel för att behandla HIV-1-infektion hos vuxna och barn som är minst 3 månader gamla och som väger minst 7 pund 12 ounces (3,5 ounces). kg). HIV är viruset som orsakar AIDS (Acquired Immune Deficiency Syndrome).
Det är inte känt om SUSTIVA är säkert och effektivt för barn yngre än 3 månaders ålder eller som väger mindre än 7 pund 12 ounce (3,5 kg).
När det används tillsammans med andra antiretrovirala läkemedel för att behandla HIV-1-infektion kan SUSTIVA 600 mg hjälpa:
- minska mängden HIV-1 i ditt blod. Detta kallas viral load.
- öka antalet CD4+ (T)-celler i ditt blod som hjälper till att bekämpa andra infektioner.
Att minska mängden HIV-1 och öka antalet CD4+ (T)-celler i ditt blod kan bidra till att förbättra ditt immunförsvar. Detta kan minska risken att dö eller få infektioner som kan inträffa när ditt immunförsvar är svagt (opportunistiska infektioner).
SUSTIVA 600mg botar inte HIV-1-infektion eller AIDS. Du bör fortsätta att ta HIV-1-läkemedel för att kontrollera HIV-1-infektion och minska HIV-relaterade sjukdomar.
Undvik att göra saker som kan sprida HIV-1-infektion till andra:
- Dela eller återanvänd inte nålar eller annan injektionsutrustning.
- Dela inte personliga föremål som kan ha blod eller kroppsvätskor på sig, som tandborstar och rakblad.
- Ha inte någon form av sex utan skydd. Utöva alltid säkrare sex genom att använda en latex- eller polyuretankondom för att minska risken för sexuell kontakt med kroppsvätskor som sperma, vaginalt sekret eller blod.
Fråga din läkare om du har några frågor om hur du kan förhindra att hiv överförs till andra människor.
Vem bör inte ta SUSTIVA 600mg?
Ta inte SUSTIVA om du är allergisk mot efavirenz eller något av innehållsämnena i SUSTIVA. Se slutet av denna bipacksedel för en komplett lista över ingredienser i SUSTIVA.
Ta inte SUSTIVA om du för närvarande tar elbasvir och grazoprevir (ZEPATIER®).
Vad ska jag berätta för min läkare innan jag tar SUSTIVA 200mg?
Innan du tar SUSTIVA, tala om för din läkare om du har några medicinska tillstånd och i synnerhet om du:
- har en hjärtsjukdom
- någonsin haft psykiska problem
- någonsin har använt gatudroger eller stora mängder alkohol
- har leverproblem, inklusive hepatit B- eller C-virusinfektion
- har en historia av anfall
- är gravid eller planerar att bli gravid. SUSTIVA 600mg kan skada ditt ofödda barn. Om du kan bli gravid bör din läkare göra ett graviditetstest innan du börjar med SUSTIVA. Du ska inte bli gravid medan du tar SUSTIVA och under 12 veckor efter avslutad behandling med SUSTIVA. Kvinnor som kan bli gravida ska använda två effektiva preventivmedel under behandlingen och i 12 veckor efter avslutad behandling med SUSTIVA. En barriärform av preventivmedel bör alltid användas tillsammans med en annan typ av preventivmedel.
- Barriärformer av preventivmedel kan inkludera latex- eller polyuretankondom, preventivsvamp, diafragma med spermiedödande medel och cervikal mössa.
- Hormonella former av preventivmedel, såsom p-piller, injektioner, vaginalringar eller implantat kanske inte fungerar under behandling med SUSTIVA.
- Tala med din läkare om former av preventivmedel som kan användas under behandling med SUSTIVA.
- Graviditetsregistret. Det finns ett graviditetsregister för kvinnor som tar antiretrovirala läkemedel under graviditeten. Syftet med detta register är att samla in information om hälsan hos dig och ditt barn. Prata med din läkare om hur du kan ta del av detta register.
- Amma inte om du tar SUSTIVA.
- Du bör inte amma om du har HIV på grund av risken att överföra HIV till ditt barn.
Berätta för din läkare och apotekspersonal om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
SUSTIVA 600mg kan påverka hur andra läkemedel fungerar, och andra läkemedel kan påverka hur SUSTIVA 600mg fungerar, och kan orsaka allvarliga biverkningar. Om du tar vissa läkemedel tillsammans med SUSTIVA kan mängden SUSTIVA 600 mg i kroppen vara för låg och det kanske inte fungerar för att hjälpa till att kontrollera din hiv-infektion. Hiv-viruset i din kropp kan bli resistent mot SUSTIVA eller andra hiv-läkemedel som liknar det.
Du ska inte ta SUSTIVA 600 mg om du tar ATRIPLA (efavirenz, emtricitabin, tenofovirdisoproxilfumarat) om inte din läkare säger åt dig att göra det.
Berätta för din läkare och apotekspersonal om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Vissa läkemedel interagerar med SUSTIVA.
Håll en lista över dina mediciner för att visa din läkare och apotekspersonal.
- Du kan fråga din läkare eller apotekspersonal om en lista över läkemedel som interagerar med SUSTIVA.
- Börja inte ta ett nytt läkemedel utan att berätta för din läkare. Din läkare kan tala om för dig om det är säkert att ta SUSTIVA tillsammans med andra läkemedel.
Hur ska jag ta SUSTIVA?
- Ta SUSTIVA 600 mg precis som din läkare säger åt dig.
- Ändra inte din dos eller sluta ta SUSTIVA om inte din läkare säger åt dig att göra det.
- Håll dig under vård av din läkare under behandling med SUSTIVA.
- SUSTIVA måste användas tillsammans med andra antiretrovirala läkemedel.
- Ta SUSTIVA 1 gång varje dag.
- SUSTIVA kommer som tabletter eller kapslar.
- SUSTIVA tabletter får inte brytas.
- Svälj SUSTIVA tabletter eller kapslar hela med vätska.
Hur och när du ska ta SUSTIVA.
- Du ska ta SUSTIVA 600 mg på fastande mage vid sänggåendet. Att ta SUSTIVA 200 mg tillsammans med mat ökar mängden läkemedel i kroppen. Vissa biverkningar kan störa dig mindre om du tar SUSTIVA 600 mg på fastande mage och vid sänggåendet.
- Ditt barns läkare kommer att ordinera rätt dos av SUSTIVA 200 mg baserat på ditt barns vikt.
- Om du har svårt att svälja tabletter eller kapslar, tala om för din läkare. Din läkare kan rekommendera att du öppnar SUSTIVA-kapseln och blandar innehållet med mat eller modersmjölksersättning. Se den detaljerade "Användningsinstruktioner" i slutet av denna patientinformation för att lära dig det rätta sättet att ta SUSTIVA 600mg med kapselströsmetoden.
- Vuxna och barn som tar SUSTIVA 600 mg med kapselströsmetoden ska inte äta på 2 timmar efter att ha tagit en dos av SUSTIVA.
- Spädbarn ska inte ges modersmjölksersättning under 2 timmar efter att ha tagit en dos av SUSTIVA med kapselströskelmetoden.
- Missa inte en dos av SUSTIVA. Om du glömmer att ta SUSTIVA, ta den missade dosen omedelbart, om det inte nästan är dags för din nästa dos. Ta inte 2 doser på en gång. Ta bara din nästa dos vid din regelbundna tidpunkt. Om du behöver hjälp med att planera de bästa tiderna för att ta din medicin, fråga din läkare eller apotekspersonal.
- Om du tar för mycket SUSTIVA, ring din läkare eller gå till närmaste akutmottagning direkt.
- När din SUSTIVA 600mg-förråd börjar ta slut, få mer från din läkare eller apotek. Det är viktigt att inte få slut på SUSTIVA. Mängden hiv-1 i ditt blod kan öka om läkemedlet stoppas ens en kort tid. Viruset kan bli resistent mot SUSTIVA 600 mg och svårare att behandla.
Vilka är de möjliga biverkningarna av SUSTIVA?
SUSTIVA 600mg kan orsaka allvarliga biverkningar, inklusive:
Om du har yrsel, koncentrationssvårigheter eller dåsighet, kör inte bil, använd inte maskiner eller gör något som kräver att du är uppmärksam.
Vissa nervsystemsymtom (t.ex. förvirring, långsamma tankar och fysiska rörelser, och vanföreställningar [falska övertygelser] eller hallucinationer [att se eller höra saker som andra inte ser eller hör]) kan uppstå månader till år efter påbörjad behandling med SUSTIVA 600 mg. Kontakta omedelbart din vårdgivare om något av dessa symtom uppstår.
Tala genast om för din läkare om du får något av följande symtom:
- Allvarliga psykiska problem kan hända hos personer som tar SUSTIVA. Tala genast om för din läkare om du har något av följande symtom:
- känna dig ledsen eller hopplös lita inte på andra människor
- känna sig orolig eller rastlös höra eller se saker som inte är verkliga
- har tankar på att skada dig själv (självmord) eller har försökt skada dig själv eller andra
- inte kan röra sig eller tala normalt
- inte kan se skillnaden mellan vad som är sant eller verkligt och vad som är falskt eller overkligt
- Symtom på nervsystemet är vanliga hos personer som tar SUSTIVA 200 mg och kan vara allvarliga. Dessa symtom börjar vanligtvis under den första eller andra dagen av behandlingen med SUSTIVA 200 mg och försvinner vanligtvis efter 2 till 4 veckors behandling. Vissa symtom kan uppstå månader till år efter påbörjad SUSTIVA-behandling. Dessa symtom kan bli värre om du dricker alkohol, tar medicin mot psykiska problem eller använder vissa gatudroger under behandling med SUSTIVA. Symtom kan inkludera:
- yrsel
- koncentrationssvårigheter
- sömnproblem
- dåsighet
- ovanliga drömmar
- bristande koordination eller svårigheter med balansen
- Hudutslag är vanligt med SUSTIVA 600mg men kan ibland vara allvarligt. Hudutslag försvinner vanligtvis utan någon förändring i behandlingen. Om du får utslag med något av följande symtom, berätta omedelbart för din läkare:
- hudutslag, med eller utan klåda
- peeling hud
- feber
- munsår
- svullnad i ansiktet
- röda eller inflammerade ögon, som "rosa öga" (konjunktivit)
- blåsor eller hudskador
- Leverproblem, inklusive leversvikt och död kan hända hos personer som tar SUSTIVA. Leverproblem kan inträffa hos personer utan tidigare leverproblem. Din läkare kommer att ta blodprover för att kontrollera din lever innan du börjar med SUSTIVA 200 mg och under behandlingen.
- din hud eller den vita delen av dina ögon blir gul (gulsot)
- du känner inte för att äta mat på flera dagar eller längre
- din urin blir mörk
- du får ont i magen (illamående)
- dina tarmrörelser (avföring) blir ljusa i färgen
- du har smärta i nedre delen av magen (buken).
- Anfall kan hända hos personer som tar SUSTIVA. Anfall är mer benägna att inträffa om du har haft anfall tidigare. Tala om för din läkare om du har haft ett anfall eller om du tar ett läkemedel för att förhindra anfall.
- Förändringar i ditt immunförsvar (immunrekonstitutionssyndrom) kan hända när du börjar ta HIV-1-läkemedel. Ditt immunförsvar kan bli starkare och börja bekämpa infektioner som har varit gömda i din kropp under lång tid. Tala om för din läkare om du börjar få nya symtom efter att du har börjat med ditt HIV-1-läkemedel.
- Förändringar i kroppsfett kan hända hos personer som tar hiv-1-medicin. Dessa förändringar kan inkludera ökad mängd fett i övre delen av ryggen och nacken ("buffelpuckel"), bröstet och runt huvuddelen av din kropp (bålen). Förlust av fett från ben, armar och ansikte kan också inträffa. Orsaken och de långsiktiga hälsoeffekterna av dessa tillstånd är inte kända.
De vanligaste biverkningarna av SUSTIVA 600mg inkluderar:
- utslag
- onormala drömmar
- yrsel
- trötthet
- illamående
- sömnproblem
- huvudvärk
- kräkningar
- koncentrationssvårigheter
Vissa patienter som tar SUSTIVA har upplevt ökade nivåer av lipider (kolesterol och triglycerider) i blodet. Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av SUSTIVA. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara SUSTIVA?
- Förvara SUSTIVA kapslar och tabletter i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
Förvara SUSTIVA och alla läkemedel utom räckhåll för barn.
Allmän information om SUSTIVA
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte SUSTIVA 600mg för ett tillstånd som det inte ordinerats för. Ge inte SUSTIVA 600 mg till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Om du vill ha mer information, prata med din läkare. Du kan fråga din apotekspersonal eller läkare om information om SUSTIVA som är skriven för vårdpersonal. För mer information, gå till www.sustiva.com eller ring 1-800-321-1335.
Vilka är ingredienserna i SUSTIVA?
Aktiv beståndsdel: efavirenz
Inaktiva Ingredienser:
SUSTIVA 600mg kapslar: laktosmonohydrat, magnesiumstearat, natriumlaurylsulfat och natriumstärkelseglykolat. Kapselskalet innehåller gelatin, natriumlaurylsulfat, titandioxid och/eller gul järnoxid. Kapselskalet kan också innehålla kiseldioxid. Kapslarna är tryckta med bläck som innehåller carmine 40 blue, FD&C Blue No. 2 och titandioxid.
SUSTIVA tabletter: kroskarmellosnatrium, hydroxipropylcellulosa, laktosmonohydrat, magnesiumstearat, mikrokristallin cellulosa och natriumlaurylsulfat. Tablettfilmöverdraget innehåller Opadry Yellow och Opadry Clear. Tabletterna är polerade med karnaubavax och tryckta med lila bläck, Opacode WB.
Denna patientinformation har godkänts av US Food and Drug Administration.
Användningsinstruktioner
SUSTIVA® (sus-TEE-vah) (efavirenz) kapslar
Förberedelse av en dos av SUSTIVA 600 mg med kapselströskelmetoden
Läs denna bruksanvisning innan du förbereder din första dos av SUSTIVA blandat med mat eller modersmjölksersättning med kapselströskelmetoden, varje gång du får påfyllning och efter behov. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling. Fråga din läkare eller apotekspersonal om du har några frågor om hur du ska blanda eller ge en dos av SUSTIVA 200 mg med kapselströskelmetoden.
Viktig information:
- För mer information om SUSTIVA 600 mg kapslar, se patientinformationsbroschyren.
- Kapselströsmetoden för att blanda innehållet i SUSTIVA kapslar med mjuk mat eller modersmjölksersättning kan användas för vuxna eller barn som inte kan svälja kapslar eller tabletter.
- Du ska ta SUSTIVA 600 mg på fastande mage vid sänggåendet.
- Du ska inte äta på 2 timmar efter att du tagit SUSTIVA blandat med mat.
- Spädbarn som är gamla nog att svälja mat ska ges SUSTIVA med kapselströskelmetoden blandad med mat istället för med modersmjölksersättning.
- Prata med din läkare för att hjälpa dig att bestämma det bästa schemat för att ge ditt barn SUSTIVA blandat med modersmjölksersättning med hjälp av kapselströskelmetoden.
Förbereda en dos av SUSTIVA 600 mg blandad med mat med kapselströsmetoden.
Innan du förbereder en dos av SUSTIVA 200 mg blandat med mat med kapselströsmetoden, samla in följande förråd:
- pappershandukar
- tesked för att mäta
- liten sked för omrörning och matning
- små ren behållare (som en små kopp eller skål)
- mjuk mat som äppelmos, druvgelé eller yoghurt
Steg 1. Välj en ren, plan arbetsyta. Lägg en ren pappershandduk på arbetsytan. Lägg sedan de andra tillbehören på pappershandduken.
Steg 2. Tvätta och torka händerna väl.
Steg 3. Placera 1 till 2 teskedar mjuk mat som äppelmos, druvgelé eller yoghurt i den lilla behållaren (se Bild A ). Färgen och tjockleken på maten kan ändras när den blandas med läkemedlet.
Bild A
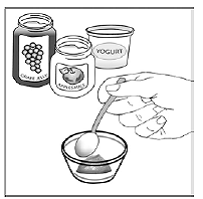
Steg 4. Det finns 2 delar av SUSTIVA 200 mg kapseln. Titta på SUSTIVA-kapseln för att se vilken del av kapseln som överlappar den andra delen (se Bild B ).
Bild B
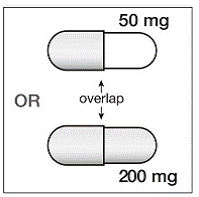
Steg 5. Håll SUSTIVA-kapseln i sidled (horisontellt) direkt över behållaren med mat. Håll varje ände av SUSTIVA-kapseln mellan tummarna och pekfingrarna (se Bild C ).
Bild C
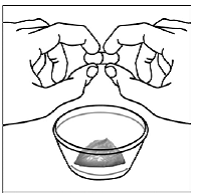
Steg 6. Använd tummen och pekfingret för att nypa nära änden av den överlappande delen av SUSTIVA 600 mg kapseln (se Bild D ).
Bild D
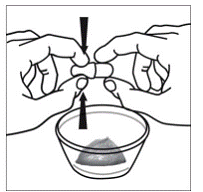
Vrid sedan försiktigt båda ändarna av SUSTIVA 600 mg kapseln i motsatta riktningar för att öppna den (se Bild E ). Var noga med att inte spilla kapselinnehållet eller sprida det i luften.
Bild E

Steg 7. Strö innehållet i SUSTIVA-kapseln på maten (se Bild F ).
- Kontrollera kapselskalen för att se till att de är tomma.
- Släng de tomma kapselskalen.
Bild F

Om den totala ordinerade dosen är mer än 1 kapsel, följ steg 4 till 7 för varje kapsel. Lägg inte till mer mat.
Steg 8 till 11 bör slutföras inom 30 minuter att blanda läkemedlet (se Bild G ).
Bild G

Steg 8. Använd den lilla skeden för att försiktigt blanda kapselinnehållet och maten (se Bild H ). Strössel kommer inte att lösas upp. Blandningen kommer att se grynig ut men bör inte vara klumpig.
Bild H
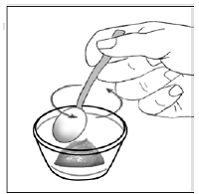
Steg 9. Använd den lilla skeden för att ge eller ta blandningen av mat och kapselinnehåll. Se till att all blandning sväljs.
Steg 10. Tillsätt cirka 2 teskedar mer av maten i den tomma behållaren och rör försiktigt med den lilla skeden för att blanda med eventuellt kapselinnehåll som fortfarande finns i behållaren.
Steg 11. Använd den lilla skeden för att ge eller ta blandningen av mat och kapselinnehåll. Se till att all blandning sväljs.
Steg 12. Tvätta behållaren och skedar. Släng pappershandduken och rengör arbetsytan. Tvätta händerna.
Förbereda en dos av SUSTIVA 600mg blandat med modersmjölksersättning med användning av kapselströskelmetoden
För att säkerställa att ditt barn får i sig all medicin, ge inte SUSTIVA kapselinnehållet till ditt barn i en flaska.
Innan du förbereder en dos av SUSTIVA blandat med modersmjölksersättning med kapselströskelmetoden, samla in följande förråd:
- pappershandukar
- tesked för omrörning och mätning
- små ren behållare (som en små kopp eller skål) (se Figur I ).
- 10 mL oral doseringsspruta (fråga din apotekspersonal om detta) (se Figur I ).
- modersmjölksersättning i rumstemperatur.
Figur I
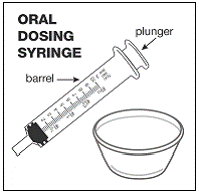
Steg 1. Förbered modersmjölksersättningen enligt anvisningarna på modersmjölksersättningsförpackningen. Du kommer att använda cirka 1 uns av formeln för att ge medicinen. Eventuell återstående formel bör inte ges till barnet under 2 timmar.
Steg 2. Välj en ren, plan arbetsyta. Lägg en ren pappershandduk på arbetsytan. Placera de tillbehör du behöver på pappershandduken.
Steg 3. Tvätta och torka händerna väl.
Steg 4. Häll 2 teskedar rumstempererad modersmjölksersättning i behållaren (se Bild J ).
Bild J
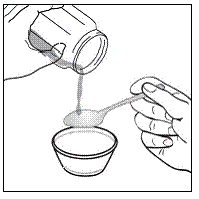
Steg 5. Det finns 2 delar av SUSTIVA kapseln. Titta på SUSTIVA-kapseln för att se vilken del av kapseln som överlappar den andra delen (se Bild K ).
Bild K
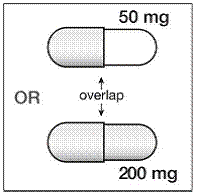
Steg 6. Håll SUSTIVA-kapseln i sidled (horisontellt) direkt över behållaren med modersmjölksersättningen. Håll vardera änden av SUSTIVA 600 mg kapseln mellan tummarna och pekfingrarna (se Bild L ).
Bild L
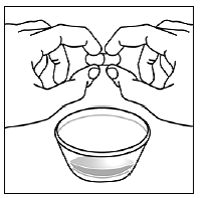
Steg 7. Använd tummen och pekfingret för att nypa nära änden av den överlappande delen av SUSTIVA-kapseln (se Bild M ).
Bild M
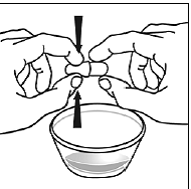
Vrid sedan försiktigt båda ändarna av SUSTIVA-kapseln i motsatta riktningar för att öppna den (se Bild N ). Var noga med att inte spilla kapselinnehållet eller sprida det i luften.
Bild N
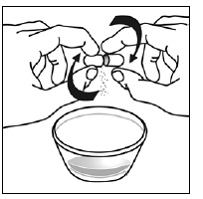
Steg 8. Strö innehållet i SUSTIVA 600 mg kapseln på modersmjölksersättningen (se Bild O ).
- Kontrollera kapselskalen för att se till att de är tomma.
- Släng de tomma kapselskalen.
Bild O
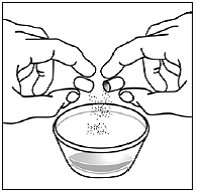
Om den totala ordinerade dosen är mer än 1 kapsel, följ steg 5 till 8 för varje kapsel. Tillsätt inte mer modersmjölksersättning.
Steg 9 till 12 bör slutföras inom 30 minuter att blanda läkemedlet (se Bild P ).
Bild P

Steg 9. Håll behållaren med en hand. Med din andra hand, använd teskeden för att försiktigt blanda kapselinnehållet och modersmjölksersättningen (se Bild Q ). Strössel kommer inte att lösas upp. Blandningen kommer att se grynig ut men bör inte vara klumpig.
Bild Q
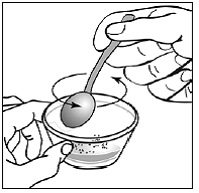
Steg 10. För att dra upp all blandning i den orala doseringssprutan:
Bild R
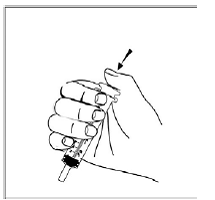
Bild S
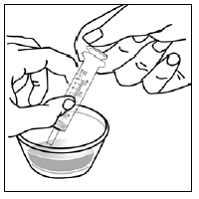
Bild T
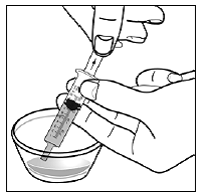
- Kontrollera att kolven är helt intryckt i sprutans cylinder (se Bild R ).
- Placera spetsen på sprutan i blandningen i behållaren (se Bild S ).
- Dra långsamt tillbaka kolven och dra upp all blandning (se Bild T ).
Steg 11. Placera spetsen på sprutan i ditt barns mun längs den inre kinden (se Bild U ). Tryck långsamt på kolven för att ge ditt barn hela blandningen.
Bild U
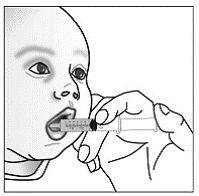
Steg 12. För att säkerställa att all medicin ges till ditt barn:
- Upprepa steg 4 ovan.
- Rör om med en tesked.
- Upprepa sedan Steg 10 och 11 ovan (ser Bild V ).
Bild V
Steg 13. Ta bort kolven från den orala doseringssprutan. Tvätta behållaren, teskeden och orala doseringssprutan. Låt kolven och sprutcylindern torka innan du sätter ihop dem igen.
Steg 14. Släng pappershandduken och rengör arbetsytan. Tvätta händerna.
Hur ska jag förvara SUSTIVA 600mg kapslar?
- Förvara SUSTIVA kapslar i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
Förvara SUSTIVA 600 mg kapslar och alla läkemedel utom räckhåll för barn.
Denna bruksanvisning har godkänts av US Food and Drug Administration.
