Famvir 250mg, 500mg Famciclovir Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Famvir och hur används det?
Famvir är ett receptbelagt läkemedel som används för att behandla symptomen på akut herpes zoster (bältros), Herpes Labiallis och Genital Herpes. Famvir 250 mg kan användas ensamt eller tillsammans med andra läkemedel.
Famvir 250mg tillhör en klass av läkemedel som kallas antivirala medel, andra.
Det är inte känt om Famvir är säkert och effektivt för barn yngre än 18 år.
Vilka är de möjliga biverkningarna av Famvir 250mg?
Famvir 250mg kan orsaka allvarliga biverkningar inklusive:
- förvirring,
- lite eller ingen urinering,
- svullnad i dina fötter eller vrister,
- trötthet och
- andnöd
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Famvir 500mg inkluderar:
- huvudvärk och
- illamående
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Famvir. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
Den aktiva ingrediensen i FAMVIR 500 mg tabletter är famciklovir, en oralt administrerad prodrug av det antivirala medlet penciklovir. Kemiskt är famciklovir känt som 2-[2-(2-amino-9H-purin-9-yl)etyl]-1,3-propandioldiacetat. Dess molekylformel är C14H19N5O4; dess molekylvikt är 321,3. Det är ett syntetiskt acykliskt guaninderivat och har följande struktur
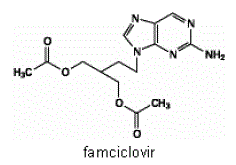
Famciklovir är ett vitt till ljusgult fast ämne. Det är fritt lösligt i aceton och metanol, och svårlösligt i etanol och isopropanol. Vid 25°C är famciklovir fritt lösligt (>25 % w/v) i vatten initialt, men fälls snabbt ut som det svårlösliga (2 %-3 % w/v) monohydratet. Famciklovir är inte hygroskopiskt under 85 % relativ luftfuktighet. Fördelningskoefficienter är: oktanol/vatten (pH 4,8) P=1,09 och oktanol/fosfatbuffert (pH 7,4) P=2,08.
FAMVIR 250 mg tabletter innehåller 125 mg, 250 mg eller 500 mg famciklovir, tillsammans med följande inaktiva ingredienser: hydroxipropylcellulosa, hydroxipropylmetylcellulosa, laktos, magnesiumstearat, polyetylenglykoler, natriumstärkelseglykolat och titandioxid.
INDIKATIONER
Immunokompetenta vuxna patienter
Herpes Labialis (munsår)
FAMVIR är indicerat för behandling av återkommande herpes labialis.
Genital herpes
Återkommande avsnitt:
FAMVIR är indicerat för behandling av återkommande episoder av genital herpes. Effekten av FAMVIR när den påbörjas mer än 6 timmar efter debut av symtom eller lesioner har inte fastställts.
Undertryckande terapi:
FAMVIR 250 mg är indicerat för kronisk suppressiv behandling av återkommande episoder av genital herpes. Effekten och säkerheten för FAMVIR för hämning av återkommande genital herpes efter 1 år har inte fastställts.
Herpes zoster (bältros)
FAMVIR 500mg är indicerat för behandling av herpes zoster. Effekten av FAMVIR när den påbörjas mer än 72 timmar efter att utslagen har börjat har inte fastställts.
HIV-infekterade vuxna patienter
Återkommande orolabial eller genital herpes
FAMVIR är indicerat för behandling av återkommande episoder av orolabial eller genital herpes hos HIV-infekterade vuxna. Effekten av FAMVIR när den påbörjas mer än 48 timmar efter debut av symtom eller lesioner har inte fastställts.
Användningsbegränsning
Effekten och säkerheten för FAMVIR har inte fastställts för:
- Patienter
- Patienter med första episoden av genital herpes
- Patienter med oftalmisk zoster
- Immunförsvagade patienter förutom för behandling av återkommande orolabial eller genital herpes hos HIV-infekterade patienter
- Svarta och afroamerikanska patienter med återkommande genital herpes
DOSERING OCH ADMINISTRERING
FAMVIR 500 mg kan tas med eller utan mat.
Doseringsrekommendation hos immunkompetenta vuxna patienter
Herpes Labialis (munsår)
Den rekommenderade dosen av FAMVIR 500 mg för behandling av återkommande herpes labialis är 1500 mg som engångsdos. Behandlingen bör inledas vid det första tecknet eller symtomet på herpes labialis (t.ex. stickningar, klåda, sveda, smärta eller lesion).
Genital herpes
Återkommande avsnitt
Den rekommenderade dosen av FAMVIR för behandling av återkommande episoder av genital herpes är 1000 mg två gånger dagligen under 1 dag. Behandlingen bör inledas vid det första tecknet eller symtomet på en återkommande episod (t.ex. stickningar, klåda, sveda, smärta eller lesion).
Undertryckande terapi
Den rekommenderade dosen av FAMVIR 500 mg för kronisk suppressiv behandling av återkommande episoder av genital herpes är 250 mg två gånger dagligen.
Herpes zoster (bältros)
Den rekommenderade dosen av FAMVIR 250 mg för behandling av herpes zoster är 500 mg var 8:e timme i 7 dagar. Behandling bör påbörjas så snart herpes zoster diagnostiserats.
Doseringsrekommendation hos HIV-infekterade vuxna patienter
Återkommande orolabial eller genital herpes
Den rekommenderade dosen av FAMVIR för behandling av återkommande orolabial eller genital herpes hos HIV-infekterade patienter är 500 mg två gånger dagligen i 7 dagar. Behandlingen bör inledas vid det första tecknet eller symtomet på en återkommande episod (t.ex. stickningar, klåda, sveda, smärta eller lesion).
Doseringsrekommendation hos patienter med nedsatt njurfunktion
Dosrekommendationer för vuxna patienter med nedsatt njurfunktion finns i Tabell 1 [se Användning i specifika populationer , KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
FAMVIR tabletter finns i tre styrkor:
- 125 mg: Vita, runda filmbelagda, bikonvexa, fasade kanter, präglade med "FAMVIR" på ena sidan och "125" på den andra sidan
- 250 mg: Vita, runda filmbelagda, bikonvexa, fasade kanter, präglade med "FAMVIR" på ena sidan och "250" på den andra sidan
- 500 mg: Vit, oval filmbelagd, bikonvex, präglad med "FAMVIR" på ena sidan och "500" på den andra sidan
Förvaring Och Hantering
FAMVIR tabletter levereras som filmdragerade tabletter enligt följande: 125 mg i flaskor om 30; 250 mg i flaskor om 30; 500 mg i flaskor om 30 och enenhetsförpackningar om 50 (endast avsedda för institutionell användning).
- FAMVIR 125 mg tablett: Vit, rund filmdragerad, bikonvexa, fasade kanter, präglad med ”FAMVIR” på ena sidan och ”125” på den andra. 125 mg 30-tal NDC 0078-0366-15
- FAMVIR 250 mg tablett : Vita, runda filmbelagda, bikonvexa, fasade kanter, präglade med "FAMVIR" på ena sidan och "250" på den andra. 250 mg 30-tal NDC 0078-0367-15
- FAMVIR 500 mg tablett : Vit, oval filmbelagd, bikonvex, präglad med "FAMVIR" på ena sidan och "500" på den andra. 500 mg 30-tal NDC 0078-0368-15 500 mg SUP 50-tal NDC 0078-0368-64
Förvara vid 25°C (77°F); utflykter tillåtna till 15-30°C (59-86°F) [se USP-kontrollerad rumstemperatur].
Distribueras av: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Reviderad: sep 2016
BIEFFEKTER
Akut njursvikt diskuteras mer i detalj i andra avsnitt av etiketten [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
De vanligaste biverkningarna som rapporterats vid minst 1 indikation av >10 % av vuxna patienter som behandlats med FAMVIR 250 mg är huvudvärk och illamående.
Erfarenhet av kliniska prövningar hos vuxna patienter
Eftersom kliniska prövningar utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i praktiken.
Immunokompetenta patienter
Säkerheten för FAMVIR 250 mg har utvärderats i aktiva och placebokontrollerade kliniska studier med 816 FAMVIR-behandlade patienter med herpes zoster (FAMVIR, 250 mg tre gånger dagligen till 750 mg tre gånger dagligen); 163 FAMVIR-behandlade patienter med återkommande genital herpes (FAMVIR, 1000 mg två gånger dagligen); 1 197 patienter med återkommande genital herpes behandlade med FAMVIR 250 mg som suppressiv terapi (125 mg en gång dagligen till 250 mg tre gånger dagligen), varav 570 patienter fick FAMVIR (öppen märkt och/eller dubbelblind) i minst 10 månader; och 447 FAMVIR-behandlade patienter med herpes labialis (FAMVIR 500 mg, 1500 mg en gång dagligen eller 750 mg två gånger dagligen). Tabell 2 listar utvalda biverkningar.
Tabell 3 listar utvalda laboratorieavvikelser i genital herpesundertryckande försök.
HIV-infekterade patienter
Hos HIV-infekterade patienter var de vanligast rapporterade biverkningarna för FAMVIR (500 mg två gånger dagligen; n=150) respektive acyklovir (400 mg, 5 gånger/dag; n=143) huvudvärk (17 % vs. 15 % ), illamående (11 % vs. 13 %), diarré (7 % vs. 11 %), kräkningar (5 % vs. 4 %), trötthet (4 % vs. 2 %) och buksmärtor (3 % vs. 6 %).
Erfarenhet efter marknadsföring
De biverkningar som anges nedan har rapporterats under användning av FAMVIR efter godkännande. Eftersom dessa händelser rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering:
Störningar i blodet och lymfsystemet : Trombocytopeni
Lever och gallvägar : Onormala leverfunktionstester, kolestatisk gulsot
Immunsystemets störningar : Anafylaktisk chock, anafylaktisk reaktion
Störningar i nervsystemet : Yrsel, somnolens, kramper
Psykiatriska störningar Förvirring (inklusive delirium, desorientering och förvirringstillstånd som förekommer främst hos äldre), hallucinationer
Hud och subkutan vävnad : Urticaria, erythema multiforme, Stevens-Johnsons syndrom, toxisk epidermal nekrolys, angioödem (t.ex. ansikte, ögonlock, periorbitalt och svalgödem), överkänslighetsvaskulit
Hjärtsjukdomar : Hjärtklappning
LÄKEMEDELSINTERAKTIONER
Potential för FAMVIR 250mg att påverka andra droger
Farmakokinetiken vid steady-state för digoxin förändrades inte vid samtidig administrering av flera doser av famciklovir (500 mg tre gånger dagligen). Ingen kliniskt signifikant effekt på farmakokinetiken för zidovudin, dess metabolit zidovudinglukuronid eller emtricitabin observerades efter en oral engångsdos på 500 mg famciklovir administrerat samtidigt med zidovudin eller emtricitabin.
En in vitro-studie med humana levermikrosomer tyder på att famciklovir inte är en hämmare av CYP3A4-enzymer.
Potentiell för andra läkemedel att påverka penciklovir
Inga kliniskt signifikanta förändringar i penciklovirs farmakokinetik observerades efter administrering av engångsdos av 500 mg famciklovir efter förbehandling med flera doser av allopurinol, cimetidin, teofyllin, zidovudin, prometazin, när det gavs kort efter en antacida (magnesium och aluminiumhydroxid), emtricitabin. Ingen kliniskt signifikant effekt på penciklovirs farmakokinetik observerades efter administrering av flera doser (tre gånger dagligen) av famciklovir (500 mg) med flera doser av digoxin.
Samtidig användning med probenecid eller andra läkemedel som signifikant elimineras av aktiv renal tubulär sekretion kan resultera i ökade plasmakoncentrationer av penciklovir.
Omvandlingen av 6-deoxipenciklovir till penciklovir katalyseras av aldehydoxidas. Interaktioner med andra läkemedel som metaboliseras av detta enzym och/eller hämmar detta enzym kan potentiellt inträffa. Kliniska interaktionsstudier av famciklovir med cimetidin och prometazin, in vitro-hämmare av aldehydoxidas, visade inga relevanta effekter på bildningen av penciklovir. Raloxifen, en potent aldehydoxidashämmare in vitro, kan minska bildningen av penciklovir. En klinisk läkemedelsinteraktionsstudie för att fastställa storleken på interaktionen mellan penciklovir och raloxifen har dock inte utförts.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Akut njursvikt
Fall av akut njursvikt har rapporterats hos patienter med underliggande njursjukdom som har fått olämpligt höga doser av FAMVIR för sin njurfunktionsnivå. Dosreduktion rekommenderas vid administrering av FAMVIR till patienter med nedsatt njurfunktion [se DOSERING OCH ADMINISTRERING , Användning i specifika populationer ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen (patientinformation).
Det finns inga bevis för att FAMVIR kommer att påverka en patients förmåga att köra bil eller att använda maskiner. Patienter som upplever yrsel, somnolens, förvirring eller andra störningar i centrala nervsystemet när de tar FAMVIR 500 mg bör dock avstå från att köra bil eller använda maskiner.
Eftersom FAMVIR innehåller laktos (FAMVIR 125 mg, 250 mg och 500 mg tabletter innehåller laktos 26,9 mg, 53,7 mg respektive 107,4 mg), bör patienter med sällsynta ärftliga problem med galaktosintolerans, en allvarlig laktasbrist-malabsorption vara galaktisk eller glukos rekommenderas att diskutera med sin vårdgivare innan du tar FAMVIR.
Herpes Labialis (munsår)
Patienter bör rådas att påbörja behandling vid de tidigaste tecknen eller symtomen på ett återkommande munsår (t.ex. stickningar, klåda, sveda, smärta eller lesion). Patienter bör instrueras om att behandling av munsår inte bör överstiga 1 dos. Patienterna bör informeras om att FAMVIR inte är ett botemedel mot munsår.
Genital herpes
Patienterna bör informeras om att FAMVIR inte är ett botemedel mot genital herpes. Det finns inga data som utvärderar om FAMVIR kommer att förhindra överföring av infektion till andra. Eftersom genital herpes är en sexuellt överförbar sjukdom, bör patienter undvika kontakt med lesioner eller samlag när lesioner och/eller symtom är närvarande för att undvika att infektera partner. Genital herpes överförs ofta i frånvaro av symtom genom asymtomatisk virusutsöndring. Därför bör patienter rådas att använda säkrare sexmetoder.
Om episodisk behandling för återkommande genital herpes är indicerad, bör patienterna rådas att påbörja behandlingen vid det första tecknet eller symtomet på en episod.
Det finns inga data om säkerhet eller effektivitet av kronisk suppressiv behandling som varar längre än 1 år.
Herpes zoster (bältros)
Det finns inga data om behandling som påbörjats mer än 72 timmar efter debut av zosterutslag. Patienter bör rådas att påbörja behandling så snart som möjligt efter diagnosen herpes zoster.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Tvååriga karcinogenicitetsstudier i kosten med famciklovir utfördes på råttor och möss. En ökning av incidensen av bröstadenokarcinom (en vanlig tumör hos djur av denna stam) sågs hos honråttor som fick den höga dosen på 600 mg/kg/dag (1,1 till 4,5 gånger den mänskliga systemiska exponeringen vid den rekommenderade totala dagliga orala dosen varierar mellan 500 mg och 2000 mg, baserat på arean under plasmakoncentrationskurvans jämförelser [24 timmars AUC] för penciklovir). Ingen ökning av tumörincidensen har rapporterats hos hanråttor som behandlats med doser upp till 240 mg/kg/dag (0,7 till 2,7 gånger den mänskliga AUC), eller hos möss av hankön och honor vid doser upp till 600 mg/kg/dag (0,3 till 1,2x den mänskliga AUC).
Mutagenes
Famciklovir och penciklovir (den aktiva metaboliten av famciklovir) testades med avseende på genotoxisk potential i en rad in vitro- och in vivo-analyser. Famciklovir och penciklovir var negativa i in vitro-tester för genmutationer i bakterier (S. typhimurium och E. coli) och oplanerad DNA-syntes i HeLa 83-celler från däggdjur (vid doser upp till 10 000 respektive 5 000 mcg/platta). Famciklovir var också negativt i L5178Y muslymfomanalysen (5000 mcg/ml), in vivo musmikronukleustestet (4800 mg/kg) och råttdominant dödlig studie (5000 mg/kg). Famciklovir inducerade ökningar av polyploidi i humana lymfocyter in vitro i frånvaro av kromosomskada (1200 mcg/ml). Penciklovir var positivt i L5178Y-muslymfomanalysen för genmutation/kromosomavvikelser, med och utan metabolisk aktivering (1000 mcg/ml). I humana lymfocyter orsakade penciklovir kromosomavvikelser i frånvaro av metabolisk aktivering (250 mcg/ml). Penciklovir orsakade en ökad förekomst av mikrokärnor i benmärg hos mus in vivo när det administrerades intravenöst i doser som var mycket giftiga för benmärgen (500 mg/kg), men inte vid oral administrering.
Nedsättning av fertilitet
Testikeltoxicitet observerades hos råttor, möss och hundar efter upprepad administrering av famciklovir eller penciklovir. Testikelförändringar inkluderade atrofi av seminiferösa tubuli, minskning av antalet spermier och/eller ökad förekomst av spermier med onormal morfologi eller minskad motilitet. Graden av toxicitet för manlig reproduktion var relaterad till dos och exponeringslängd. Hos hanråttor observerades minskad fertilitet efter 10 veckors dosering med 500 mg/kg/dag (1,4 till 5,7 gånger human AUC). Den icke observerbara effektnivån för sperma- och testikeltoxicitet hos råttor efter kronisk administrering (26 veckor) var 50 mg/kg/dag (0,15 till 0,6 gånger den humana systemiska exponeringen baserat på AUC-jämförelser). Testikeltoxicitet observerades efter kronisk administrering till möss (104 veckor) och hundar (26 veckor) vid doser på 600 mg/kg/dag (0,3 till 1,2 gånger den mänskliga AUC) och 150 mg/kg/dag (1,3 till 5,1 gånger den human AUC), respektive.
Famciklovir hade ingen effekt på den allmänna reproduktionsförmågan eller fertiliteten hos honråttor vid doser upp till 1000 mg/kg/dag (2,7 till 10,8 gånger den mänskliga AUC).
Två placebokontrollerade studier på totalt 130 i övrigt friska män med normal spermieprofil under en 8-veckors baslinjeperiod och återkommande genital herpes som fick oral FAMVIR (250 mg två gånger dagligen) (n=66) eller placebo (n=64) behandling under 18 veckor visade inga tecken på signifikanta effekter på spermieantal, motilitet eller morfologi under behandling eller under en 8-veckors uppföljning.
Användning i specifika populationer
Graviditet
Graviditetskategori B
Efter oral administrering omvandlas famciklovir (prodrug) till penciklovir (aktivt läkemedel). Det finns inga adekvata och välkontrollerade studier av användning av famciklovir eller penciklovir hos gravida kvinnor. Inga negativa effekter på embryofetal utveckling observerades i reproduktionsstudier på djur med famciklovir och penciklovir vid doser högre än den maximala rekommenderade humana dosen (MRHD) och human exponering. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör famciklovir endast användas under graviditet vid behov.
reproduktionsstudier på djur fick gravida råttor och kaniner oral famciklovir i doser (upp till 1000 mg/kg/dag) som gav 2,7 till 10,8 gånger (råttor) och 1,4 till 5,4 gånger (kaniner) den humana systemiska exponeringen baserat på AUC. Inga negativa effekter observerades på embryo-fosterutveckling. I andra studier fick gravida råttor och kaniner intravenöst famciklovir i doser (360 mg/kg/dag) 1,5 till 6 gånger (råttor) och (120 mg/kg/dag) 1,1 till 4,5 gånger (kaniner) eller penciklovir i doser (80) mg/kg/dag) 0,3 till 1,3 gånger (råttor) och (60 mg/kg/dag) 0,5 till 2,1 gånger (kaniner) MRHD baserat på jämförelser av kroppsyta. Inga negativa effekter observerades på embryo-fosterutveckling.
Rapportering av graviditetsexponering
För att övervaka mödernet-fosterutfallet hos gravida kvinnor som exponerats för FAMVIR 500mg, upprätthåller Novartis Pharmaceuticals Corporation ett FAMVIR-graviditetsrapporteringssystem. Läkare uppmuntras att rapportera sina patienter genom att ringa 1-888-NOW-NOVA (669-6682).
Ammande mödrar
Det är inte känt om famciklovir (prodrug) eller penciklovir (aktivt läkemedel) utsöndras i modersmjölk. Efter oral administrering av famciklovir till digivande råttor utsöndrades penciklovir i bröstmjölk i högre koncentrationer än i plasma. Det finns inga data om säkerheten för FAMVIR 250 mg hos spädbarn. FAMVIR 500 mg ska inte användas till ammande mödrar om inte de potentiella fördelarna anses uppväga de potentiella riskerna med behandling.
Pediatrisk användning
Effekten av FAMVIR 250 mg har inte fastställts hos pediatriska patienter. Den farmakokinetiska profilen och säkerheten för famciklovir (experimentella granuler blandade med OraSweet® eller tabletter) studerades i 3 öppna studier.
Studie 1 var en endos farmakokinetisk och säkerhetsstudie på spädbarn 1 månad till
Studie 2 var en öppen farmakokinetisk säkerhetsstudie för engångsdoser av famciklovir experimentella granulat blandat med OraSweet hos barn 1 till
Totalt 100 patienter inkluderades i säkerhetsdelen av flera doser av studien; 47 försökspersoner med aktiv eller latent HSV-infektion och 53 försökspersoner med vattkoppor. Patienter med aktiv eller latent HSV-infektion fick famciklovir två gånger om dagen i 7 dagar. Den dagliga dosen av famciklovir varierade från 150 mg till 500 mg två gånger dagligen beroende på patientens kroppsvikt. Patienter med vattkoppor fick famciklovir tre gånger dagligen i 7 dagar. Den dagliga dosen av famciklovir varierade från 150 mg till 500 mg tre gånger dagligen beroende på patientens kroppsvikt. De kliniska biverkningarna och laboratorietestavvikelser som observerades i denna studie liknade de som setts hos vuxna. Tillgängliga data är otillräckliga för att stödja användningen av famciklovir för behandling av barn 1 till
Vattkoppor
Effekten av famciklovir för behandling av vattkoppor har inte fastställts hos vare sig pediatriska eller vuxna patienter. Famciclovir är godkänt för behandling av herpes zoster hos vuxna patienter. Det skulle dock inte vara lämpligt att extrapolera effektdata från vuxna med herpes zoster till barn med vattkoppor. Även om vattkoppor och herpes zoster orsakas av samma virus, är sjukdomarna olika.
Genital herpes
Klinisk information om genital herpes hos barn är begränsad. Effektdata från vuxna kan därför inte extrapoleras till denna population. Vidare har famciklovir inte studerats hos barn 1 till
Herpes Labialis
Det finns inga farmakokinetiska och säkerhetsdata hos barn 1 till
Studie 3 var en öppen enarmad studie för att utvärdera farmakokinetiken, säkerheten och antiviral aktivitet av en engångsdos på 1500 mg (tre 500 mg tabletter) av famciklovir hos barn 12 till
en fas 3-studie på vuxna där patienter fick en engångsdos på 1500 mg famciklovir eller placebo, var mediantiden till läkning bland patienter med icke-aborterade lesioner 4,4 dagar i famciklovir 1500 mg enkeldosgruppen och 6,2 dagar i placebogruppen. Observera att i vuxenstudien initierades behandling av patienter inom 1 timme efter symtomdebut [se Kliniska studier ]. Baserat på effektresultaten i studie 3, rekommenderas inte famciklovir till barn 12 till
Geriatrisk användning
Av 816 patienter med herpes zoster i kliniska studier som behandlades med FAMVIR var 248 (30,4%) ≥65 år och 103 (13%) var ≥75 år. Inga övergripande skillnader observerades i incidens eller typer av biverkningar mellan yngre och äldre patienter. Av 610 patienter med återkommande herpes simplex (typ 1 eller typ 2) i kliniska studier som behandlades med FAMVIR 500 mg, var 26 (4,3 %) >65 år och 7 (1,1 %) var >75 år gamla. Kliniska studier av FAMVIR 500 mg på patienter med återkommande genital herpes inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda jämfört med yngre försökspersoner.
Ingen dosjustering av famciklovir baserat på ålder rekommenderas om inte njurfunktionen är nedsatt [se DOSERING OCH ADMINISTRERING , KLINISK FARMAKOLOGI ]. I allmänhet bör lämplig försiktighet iakttas vid administrering och övervakning av FAMVIR 250 mg till äldre patienter, vilket återspeglar den högre frekvensen av nedsatt njurfunktion och samtidig användning av andra läkemedel.
Patienter med nedsatt njurfunktion
Synbar plasmaclearance, renal clearance och plasma-elimineringshastighetskonstanten för penciklovir minskade linjärt med minskad njurfunktion. Efter administrering av en oral engångsdos på 500 mg famciklovir (n=27) till friska frivilliga och till frivilliga med olika grader av nedsatt njurfunktion (CLCR varierade från 6,4 till 138,8 ml/min), erhölls följande resultat (tabell 4):
I en flerdosstudie av famciklovir utförd på försökspersoner med olika grader av nedsatt njurfunktion (n=18), var farmakokinetiken för penciklovir jämförbar med den efter engångsdoser.
En dosjustering rekommenderas för patienter med nedsatt njurfunktion [se DOSERING OCH ADMINISTRERING ].
Patienter med nedsatt leverfunktion
Lätt eller måttligt nedsatt leverfunktion (kronisk hepatit [n=6], kroniskt etanolmissbruk [n=8] eller primär biliär cirros [n=1]) hade ingen effekt på graden av tillgänglighet (AUC) av penciklovir efter en engångsdos 500 mg famciklovir. Det var dock en minskning med 44 % av penciklovirs genomsnittliga maximala plasmakoncentration (Cmax) och tiden till maximal plasmakoncentration (tmax) ökade med 0,75 timmar hos patienter med nedsatt leverfunktion jämfört med normala frivilliga. Ingen dosjustering rekommenderas för patienter med lätt eller måttligt nedsatt leverfunktion. Farmakokinetiken för penciklovir har inte utvärderats hos patienter med gravt nedsatt leverfunktion. Omvandlingen av famciklovir till den aktiva metaboliten penciklovir kan försämras hos dessa patienter, vilket resulterar i lägre plasmakoncentrationer av penciklovir och därmed möjligen en minskning av effekten av famciklovir [se KLINISK FARMAKOLOGI ].
Svarta och afroamerikanska patienter
en randomiserad, dubbelblind, placebokontrollerad studie utförd på 304 immunkompetenta svarta och afroamerikanska vuxna med återkommande genital herpes fanns det ingen skillnad i mediantid till läkning mellan patienter som fick FAMVIR eller placebo. Generellt sett liknade biverkningsprofilen den som observerats i andra FAMVIR kliniska prövningar för vuxna patienter [se NEGATIVA REAKTIONER ]. Relevansen av dessa studieresultat för andra indikationer hos svarta och afroamerikanska patienter är okänd [se Kliniska studier ].
ÖVERDOS
Lämplig symtomatisk och stödjande behandling bör ges. Penciklovir avlägsnas genom hemodialys.
KONTRAINDIKATIONER
FAMVIR 250mg är kontraindicerat hos patienter med känd överkänslighet mot produkten, dess komponenter eller Denavir® (penciklovirkräm).
KLINISK FARMAKOLOGI
Handlingsmekanism
Famciklovir är en oralt administrerad prodrug av det antivirala medlet penciklovir [se Mikrobiologi ].
Farmakokinetik
Famciklovir är diacetyl-6-deoxianalogen till den aktiva antivirala föreningen penciklovir. Efter oral administrering genomgår famciklovir snabb och omfattande metabolism till penciklovir och lite eller inget famciklovir detekteras i plasma eller urin. Penciklovir elimineras huvudsakligen oförändrat via njurarna. Därför behöver dosen av FAMVIR 500 mg justeras hos patienter med olika grader av nedsatt njurfunktion [se DOSERING OCH ADMINISTRERING ].
Farmakokinetik hos vuxna
Absorption och biotillgänglighet:
Den absoluta biotillgängligheten för penciklovir är 77 ± 8 %, bestämt efter administrering av en oral dos på 500 mg famciklovir och en intravenös dos på 400 mg penciklovir till 12 friska manliga försökspersoner.
Penciklovirkoncentrationerna ökade i proportion till dosen över ett dosintervall av famciklovir på 125 mg till 1000 mg administrerat som engångsdos. Tabell 5 visar de genomsnittliga farmakokinetiska parametrarna för penciklovir efter engångsadministrering av FAMVIR till friska manliga frivilliga.
Efter oral enkeldosadministrering av 500 mg famciklovir till 7 patienter med herpes zoster var AUC (medelvärde ± SD), Cmax och tmax 12,1±1,7 mcg tim/ml, 4,0±0,7 mcg/ml och 0,7±0,2 timmar , respektive. AUC för penciklovir var cirka 35 % högre hos patienter med herpes zoster jämfört med friska frivilliga. En del av denna skillnad kan bero på skillnader i njurfunktion mellan de två grupperna.
Det finns ingen ackumulering av penciklovir efter administrering av 500 mg famciklovir tre gånger dagligen i 7 dagar.
Penciklovir Cmax minskade med cirka 50 % och tmax fördröjdes med 1,5 timmar när en kapselformulering av famciklovir administrerades tillsammans med mat (näringsinnehållet var cirka 910 kcal och 26 % fett). Det fanns ingen effekt på graden av tillgänglighet (AUC) av penciklovir. Det fanns en 18 % minskning av Cmax och en fördröjning av tmax på cirka 1 timme när famciklovir gavs 2 timmar efter en måltid jämfört med administrering 2 timmar före måltid. Eftersom det inte fanns någon effekt på omfattningen av systemisk tillgänglighet av penciklovir, kan FAMVIR 250 mg tas utan hänsyn till måltider.
Distribution:
Distributionsvolymen (Vdβ) var 1,08±0,17 l/kg hos 12 friska manliga försökspersoner efter en intravenös engångsdos av penciklovir på 400 mg administrerat som en 1-timmes intravenös infusion. Penciklovir är
Ämnesomsättning:
Efter oral administrering deacetyleras famciklovir och oxideras till penciklovir. Metaboliter som är inaktiva inkluderar 6-deoxipenciklovir, monoacetylerad penciklovir och 6-deoximonoacetylerad penciklovir (5 %, LÄKEMEDELSINTERAKTIONER ].
Eliminering:
Cirka 94 % av den administrerade radioaktiviteten återfanns i urinen under 24 timmar (83 % av dosen utsöndrades under de första 6 timmarna) efter administrering av 5 mg/kg radiomärkt penciklovir som en 1-timmes infusion till 3 friska manliga frivilliga. Penciklovir stod för 91 % av radioaktiviteten som utsöndrades i urinen.
Efter oral administrering av en engångsdos på 500 mg radiomärkt famciklovir till 3 friska frivilliga män, återfanns 73 % och 27 % av den administrerade radioaktiviteten i urin respektive feces under 72 timmar. Penciklovir stod för 82 % och 6-deoxipenciklovir stod för 7 % av radioaktiviteten som utsöndrades i urinen. Ungefär 60 % av den administrerade radiomärkta dosen samlades i urin under de första 6 timmarna.
Efter intravenös administrering av penciklovir till 48 friska frivilliga män var medelvärdet ± SD totalt plasmaclearance av penciklovir 36,6±6,3 l/timme (0,48±0,09 l/timme/kg). Penciklovir renalt clearance stod för 74,5±8,8 % av totalt plasmaclearance.
Renalt clearance av penciklovir efter oral administrering av en engångsdos på 500 mg famciklovir till 109 friska frivilliga män var 27,7±7,6 l/timme. Aktiv tubulär sekretion bidrar till renal eliminering av penciklovir.
Halveringstiden för plasmaeliminering av penciklovir var 2,0±0,3 timmar efter intravenös administrering av penciklovir till 48 friska frivilliga män och 2,3±0,4 timmar efter oral administrering av 500 mg famciklovir till 124 friska frivilliga män. Halveringstiden hos 17 patienter med herpes zoster var 2,8±1,0 timmar och 2,7±1,0 timmar efter enstaka respektive upprepade doser.
Särskilda populationer
Geriatriska patienter
Baserat på jämförelse av korsstudier var penciklovir AUC 40 % högre och penciklovir renalt clearance var 22 % lägre hos äldre försökspersoner (n=18, ålder 65-79 år) jämfört med yngre försökspersoner. En del av denna skillnad kan bero på skillnader i njurfunktion mellan de två grupperna. Ingen dosjustering av famciklovir baserat på ålder rekommenderas om inte njurfunktionen är nedsatt [se DOSERING OCH ADMINISTRERING , Användning i specifika populationer ]
Patienter med nedsatt njurfunktion
Hos försökspersoner med olika grader av nedsatt njurfunktion minskade skenbart plasmaclearance, renalt clearance och plasmaelimineringshastighetskonstanten för penciklovir linjärt med minskad njurfunktion, efter både engångsdosering och upprepad dosering [se Användning i specifika populationer ]. En dosjustering rekommenderas för patienter med nedsatt njurfunktion [se DOSERING OCH ADMINISTRERING ].
Patienter med nedsatt leverfunktion
Lätt eller måttligt nedsatt leverfunktion hade ingen effekt på graden av tillgänglighet (AUC) av penciklovir [se Användning i specifika populationer ]. Ingen dosjustering rekommenderas för patienter med lätt eller måttligt nedsatt leverfunktion. Effekten av gravt nedsatt leverfunktion på farmakokinetiken för penciklovir har inte utvärderats.
HIV-infekterade patienter
Efter oral administrering av en engångsdos på 500 mg famciklovir till HIV-positiva patienter var de farmakokinetiska parametrarna för penciklovir jämförbara med de som observerades hos friska försökspersoner.
Kön
Farmakokinetiken för penciklovir utvärderades hos 18 friska män och 18 friska kvinnliga frivilliga efter oral engångsdos av 500 mg famciklovir. AUC för penciklovir var 9,3±1,9 mcg tim/ml och 11,1±2,1 mcg tim/mL hos män respektive kvinnor. Penciklovirs njurclearance var 28,5±8,9 l/timme respektive 21,8±4,3 l/timme. Dessa skillnader tillskrevs skillnader i njurfunktion mellan de två grupperna. Ingen dosjustering av famciklovir baserat på kön rekommenderas.
Lopp
En retrospektiv utvärdering utfördes för att jämföra de farmakokinetiska parametrarna som erhållits hos svarta och kaukasiska försökspersoner efter engångs- och upprepad administrering en gång dagligen, två gånger dagligen eller tre gånger dagligen av famciklovir 500 mg. Data från en studie på friska frivilliga (engångsdos), en studie på försökspersoner med olika grader av nedsatt njurfunktion (enkeldos och upprepad dos) och en studie på försökspersoner med nedsatt leverfunktion (enkeldos) indikerade inga signifikanta skillnader i farmakokinetiken för penciklovir mellan svarta och kaukasiska försökspersoner.
Mikrobiologi
Handlingsmekanism
Famciklovir är en prodrug av penciklovir, som har visat hämmande aktivitet mot herpes simplex-virus typ 1 (HSV-1) och 2 (HSV-2) och varicella zoster-virus (VZV). I celler infekterade med HSV-1, HSV-2 eller VZV, fosforylerar det virala tymidinkinaset penciklovir till en monofosfatform som i sin tur omvandlas av cellulära kinaser till den aktiva formen penciklovirtrifosfat. Biokemiska studier visar att penciklovirtrifosfat hämmar HSV-2 DNA-polymeras konkurrerande med deoxyguanosintrifosfat. Följaktligen inhiberas herpesvirus-DNA-syntes och därför replikation selektivt. Penciklovirtrifosfat har en intracellulär halveringstid på 10 timmar i HSV-1-, 20 timmar i HSV-2 och 7 timmar i VZV-infekterade celler odlade i kultur. Den kliniska betydelsen av den intracellulära halveringstiden är dock okänd.
Antiviral aktivitet
cellodlingsstudier är penciklovir hämmande mot följande herpesvirus: HSV-1, HSV-2 och VZV. Den antivirala aktiviteten av penciklovir mot vildtypsstammar odlade på humana förhudsfibroblaster bedömdes med en plackreduktionsanalys och färgning med kristallviolett 3 dagar efter infektion för HSV och 10 dagar efter infektion för VZV. Medianvärdet för EC50 för penciklovir mot laboratorie- och kliniska isolat av HSV-1, HSV-2 och VZV var 2 μM (intervall 1,2 till 2,4 μM, n=7), 2,6 μM (intervall 1,6 till 11 μM, n=6) , respektive 34 μM (intervall 6,7 till 71 μM, n=6).
Motstånd
Penciklovir-resistenta mutanter av HSV och VZV kan vara resultatet av mutationer i generna för viralt tymidinkinas (TK) och DNA-polymeras. Mutationer i den virala TK-genen kan leda till fullständig förlust av TK-aktivitet (TK-negativ), minskade nivåer av TK-aktivitet (partiell TK) eller förändring av förmågan hos viral TK att fosforylera läkemedlet utan motsvarande förlust av förmågan att fosforylera tymidin (TK förändrad). Medianvärdet för EC50 som observerades i en plackreduktionsanalys med penciklovirresistent HSV-1, HSV-2 och VZV var 69 μM (intervall 14 till 115 μM, n=6), 46 μM (intervall 4 till >395 μM, n= 9), respektive 92 μM (intervall 51 till 148 μM, n=4). Möjligheten av viral resistens mot penciklovir bör övervägas hos patienter som inte svarar eller upplever återkommande virusutsöndring under behandlingen.
Korsmotstånd
Korsresistens har observerats bland HSV DNA-polymerashämmare. De vanligast förekommande acyklovirresistenta mutanterna som är TK-negativa är också resistenta mot penciklovir.
Kliniska studier
Herpes Labialis (munsår)
En randomiserad, dubbelblind, placebokontrollerad studie genomfördes på 701 immunkompetenta vuxna med återkommande herpes labialis. Patienter påbörjade självbehandling inom 1 timme efter första början av tecken eller symtom på en återkommande episod av herpes labialis med FAMVIR 1500 mg som engångsdos (n=227), FAMVIR 750 mg två gånger dagligen (n=220) eller placebo (n= 254) för 1 dag. Mediantiden till läkning bland patienter med icke-avbrutna lesioner (utöver papelstadiet) var 4,4 dagar i FAMVIR 1500 mg endosgruppen (n=152) jämfört med 6,2 dagar i placebogruppen (n=168) . Medianskillnaden i tid till läkning mellan placebo- och FAMVIR 1500 mg-behandlade grupperna var 1,3 dagar (95 % KI: 0,6–2,0). Inga skillnader i andel patienter med aborterade lesioner (som inte fortskrider efter papulstadiet) observerades mellan patienter som fick FAMVIR 250 mg eller placebo: 33 % för FAMVIR 1 500 mg engångsdos och 34 % för placebo. Mediantiden till förlust av smärta och ömhet var 1,7 dagar hos FAMVIR 1500 mg enkeldosbehandlade patienter jämfört med 2,9 dagar hos placebobehandlade patienter.
Genital herpes
Återkommande avsnitt
En randomiserad, dubbelblind, placebokontrollerad studie genomfördes på 329 immunkompetenta vuxna med återkommande genital herpes. Patienter påbörjade självbehandling inom 6 timmar efter det första tecknet eller symtomet på en återkommande genital herpesepisod med antingen FAMVIR 1000 mg två gånger dagligen (n=163) eller placebo (n=166) under 1 dag. Mediantiden till läkning bland patienter med icke-avbrutna lesioner (utöver papulstadiet) var 4,3 dagar hos FAMVIR-behandlade patienter (n=125) jämfört med 6,1 dagar hos placebobehandlade patienter (n=145). Medianskillnaden i tid till läkning mellan placebo- och FAMVIR-behandlade grupperna var 1,2 dagar (95 % KI: 0,5 till 2,0). Tjugotre procent av FAMVIR-behandlade patienter hade aborterade lesioner (ingen lesionsutveckling utöver erytem) jämfört med 13 % hos placebobehandlade patienter. Mediantiden till förlust av alla symtom (t.ex. stickningar, klåda, sveda, smärta eller ömhet) var 3,3 dagar hos FAMVIR-behandlade patienter jämfört med 5,4 dagar hos placebobehandlade patienter.
En randomiserad (2:1), dubbelblind, placebokontrollerad studie genomfördes på 304 immunkompetenta svarta och afroamerikanska vuxna med återkommande genital herpes. Patienter påbörjade självbehandling inom 6 timmar efter det första tecknet eller symtomet på en återkommande genital herpesepisod med antingen FAMVIR 1000 mg två gånger dagligen (n=206) eller placebo (n=98) under 1 dag. Mediantiden till läkning bland patienter med icke-aborterade lesioner var 5,4 dagar hos FAMVIR-behandlade patienter (n=152) jämfört med 4,8 dagar hos placebobehandlade patienter (n=78). Medianskillnaden i tid till läkning mellan placebo- och FAMVIR-behandlade grupper var -0,26 dagar (95 % KI: -0,98 till 0,40).
Undertryckande terapi
Två randomiserade, dubbelblinda, placebokontrollerade, 12-månadersstudier genomfördes på 934 immunkompetenta vuxna med en historia av 6 eller fler återkommande episoder av genital herpes per år. Jämförelser inkluderade FAMVIR 125 mg tre gånger dagligen, 250 mg två gånger dagligen, 250 mg tre gånger dagligen och placebo. Efter 12 månader fick 60 % till 65 % av patienterna fortfarande FAMVIR och 25 % fick placebobehandling. Återfallsfrekvensen efter 6 och 12 månader hos patienter som behandlats med dosen 250 mg två gånger dagligen visas i Tabell 6.
FAMVIR-behandlade patienter hade ungefär 1/5 av mediantalet återfall jämfört med placebobehandlade patienter. Högre doser av FAMVIR 250 mg var inte associerade med ökad effekt.
Återkommande orolabial eller genital herpes hos HIV-infekterade patienter
En randomiserad, dubbelblind studie jämförde famciklovir 500 mg två gånger dagligen i 7 dagar (n=150) med oral acyklovir 400 mg 5 gånger dagligen i 7 dagar (n=143) hos HIV-infekterade patienter med återkommande orolabial eller genital herpes som behandlades inom 48 timmar efter att lesionen debuterade. Cirka 40% av patienterna hade ett CD4+-antal under 200 celler/mm3, 54% av patienterna hade anogenitala lesioner och 35% hade orolabiala lesioner. Behandling med Famciklovir var jämförbar med oral acyklovir när det gäller att minska nybildning av lesioner och i tid till fullständig läkning.
Herpes zoster (bältros)
Två randomiserade, dubbelblinda studier, en placebokontrollerad och en aktivkontrollerad, genomfördes på 964 immunkompetenta vuxna med okomplicerad herpes zoster. Behandlingen initierades inom 72 timmar efter första lesionens uppkomst och fortsatte i 7 dagar.
den placebokontrollerade studien behandlades 419 patienter med antingen FAMVIR 500 mg tre gånger dagligen (n=138), FAMVIR 750 mg tre gånger dagligen (n=135) eller placebo (n=146). Mediantiden till full skorpbildning var 5 dagar bland FAMVIR 500 mg-behandlade patienter jämfört med 7 dagar hos placebobehandlade patienter. Tiderna till full skorpbildning, förlust av vesikler, förlust av sår och förlust av skorpa var kortare för FAMVIR 500 mg-behandlade patienter än för placebobehandlade patienter i den totala studiepopulationen. Effekterna av FAMVIR 500 mg var större när behandlingen inleddes inom 48 timmar efter att utslagen började; det var också mer djupgående hos patienter 50 år eller äldre. Bland de 65,2 % av patienterna med minst 1 positiv virusodling hade FAMVIR-behandlade patienter en kortare medianduration av virusutsöndring än placebobehandlade patienter (1 dag respektive 2 dagar).
Det fanns inga övergripande skillnader i varaktigheten av smärta före utslagsläkning mellan FAMVIR- och placebobehandlade grupper. Dessutom var det ingen skillnad i förekomst av smärta efter utslagsläkning (postherpetisk neuralgi) mellan behandlingsgrupperna. Hos de 186 patienter (44,4 % av den totala studiepopulationen) som utvecklade postherpetisk neuralgi, var mediandurationen för postherpetisk neuralgi kortare hos patienter som behandlades med FAMVIR 500 mg än hos de som behandlades med placebo (63 dagar respektive 119 dagar). Ingen ytterligare effekt visades med högre dos av FAMVIR.
I den aktivt kontrollerade studien behandlades 545 patienter med 1 av 3 doser av FAMVIR tre gånger dagligen eller med acyklovir 800 mg fem gånger dagligen. Tiderna till fullständig lesionsskorpa och tiderna till förlust av akut smärta var jämförbara för alla grupper och det fanns inga statistiskt signifikanta skillnader i tiden till förlust av postherpetisk neuralgi mellan FAMVIR- och acyklovirbehandlade grupper.
PATIENTINFORMATION
FAMVIR® (Fam'-veer) (famciclovir) Tabletter
Läs denna patientinformation innan du börjar ta FAMVIR och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling.
Vad är FAMVIR?
Famvir är ett receptbelagt antiviralt läkemedel som används för att:
- behandla utbrott av munsår (feberblåsor) hos friska vuxna
- behandla utbrott av genital herpes hos friska vuxna
- minska antalet utbrott av genital herpes hos friska vuxna
- behandla utbrott av herpes simplex-lesioner i eller runt munnen, könsorganen och analområdet hos personer som är infekterade med HIV
- behandla bältros (herpes zoster) hos vuxna med normalt immunförsvar
Det är inte känt om FAMVIR 500mg är säkert och effektivt för barn yngre än 18 år.
FAMVIR 250mg är inte ett botemedel mot herpes. Det är inte känt om FAMVIR kan stoppa spridningen av herpes till andra. Om du är sexuellt aktiv kan du överföra herpes till din partner även om du tar FAMVIR. Herpes kan överföras även om du inte har aktiva symtom. Du bör fortsätta att utöva säkrare sex för att minska risken att sprida genital herpes till andra. Ha inte sexuell kontakt med din partner under ett utbrott av genital herpes eller om du har några symtom på genital herpes. Använd en kondom gjord av latex eller polyuretan när du har en sexuell kontakt. Fråga din vårdgivare om mer information om säkrare sexpraxis.
Vem bör inte ta FAMVIR?
Ta inte FAMVIR 250mg om du är allergisk mot något av dess ingredienser eller mot Denavir® (penciklovirkräm). Se slutet av denna patientinformationsbroschyr för en komplett lista över ingredienser i FAMVIR.
Vad ska jag berätta för min vårdgivare innan jag tar FAMVIR 500mg?
Innan du börjar ta FAMVIR 500 mg, berätta för din läkare om du:
- har njur- eller leverproblem
- har ett sällsynt genetiskt problem med galaktosintolerans, en allvarlig laktasbrist eller du inte absorberar glukos-galaktos (malabsorption)
- är gravid eller planerar att bli gravid. Det är inte känt om FAMVIR 250mg kommer att skada ditt ofödda barn
- Rapportering av graviditetsexponering: Novartis Pharmaceuticals Corporation samlar in graviditetsrapporter som rapporteras på frivillig basis. Vid graviditet, prata med din vårdgivare om att anmäla din graviditet
- ammar eller planerar att amma
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. Berätta särskilt för din vårdgivare om du tar:
- andra läkemedel och produkter du använder för att behandla herpesutbrott
- probenecid (Probalan)
Vet vilka mediciner du tar. Håll en lista över dem med dig för att visa för din vårdgivare och apotekspersonal varje gång du får ett nytt läkemedel.
Hur ska jag ta FAMVIR?
- Ta FAMVIR precis som ordinerats
- Din vårdgivare kommer att tala om för dig hur många FAMVIR du ska ta och när du ska ta dem. Din dos av FAMVIR 250 mg och hur ofta du tar den kan variera beroende på ditt tillstånd
- FAMVIR kan tas med eller utan mat
- Det är viktigt för dig att avsluta all medicin som ordinerats, även om du börjar må bättre
- Dina symtom kan fortsätta även efter att du avslutat hela din FAMVIR. Detta betyder inte att du behöver mer medicin, eftersom du redan har avslutat en hel kur med FAMVIR 500 mg och det kommer att fortsätta att verka i din kropp. Prata med din vårdgivare om du har några frågor om ditt tillstånd och din behandling
Vilka är de möjliga biverkningarna av FAMVIR 250mg?
De vanligaste biverkningarna av FAMVIR 500mg inkluderar:
- huvudvärk
- illamående
Prata med din vårdgivare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av FAMVIR. Fråga din vårdgivare eller apotekspersonal för mer information.
Ring din vårdgivare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA1088.
Hur ska jag förvara FAMVIR 500mg?
- Förvara FAMVIR i rumstemperatur mellan 59°F och 86°F (15°C till 30°C).
Förvara FAMVIR och alla läkemedel utom räckhåll för barn.
Allmän information om FAMVIR
Läkemedel skrivs ibland ut för andra ändamål än de som anges i patientinformationsbroschyrerna. Använd inte FAMVIR för ett tillstånd som det inte har ordinerats för. Ge inte FAMVIR 500 mg till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna broschyr sammanfattar den viktigaste informationen om FAMVIR. Om du vill ha mer information, prata med din vårdgivare. Din vårdgivare eller apotekspersonal kan ge dig information om FAMVIR 500mg som är skriven för vårdpersonal. För mer information, gå till www.FAMVIR.com eller ring 1-888-669-6682.
Vilka är ingredienserna i FAMVIR?
Aktiv beståndsdel: famciklovir
Inaktiva Ingredienser: hydroxipropylcellulosa, hydroxipropylmetylcellulosa, laktos, magnesiumstearat, polyetylenglykoler, natriumstärkelseglykolat och titandioxid
