Uniphyl 400mg Theophylline Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Uniphyl 400mg och hur används det?
Uniphyl är ett receptbelagt läkemedel som används för att behandla symtom på astma, bronkit, emfysem och andra andningsproblem (akut bronkospasm). Uniphyl 400mg kan användas ensamt eller tillsammans med andra läkemedel.
Uniphyl tillhör en klass av läkemedel som kallas xantinderivat; Fosfodiesterasenzymhämmare, icke-selektiva.
Det är inte känt om Uniphyl 400mg är säkert och effektivt för barn yngre än 1 ½ månads ålder.
Vilka är de möjliga biverkningarna av Uniphyl?
Uniphyl kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- allvarliga eller pågående kräkningar,
- pågående huvudvärk,
- sömnproblem,
- snabba hjärtslag,
- beslag,
- feber,
- kramper i benen,
- förstoppning,
- oregelbundna hjärtslag,
- fladdrande i ditt bröst,
- ökad törst eller urinering,
- domningar eller stickningar,
- muskelsvaghet,
- slapp känsla,
- ökad törst,
- ökad urinering,
- muntorrhet och
- fruktig andedräkt lukt
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Uniphyl inkluderar:
- illamående,
- kräkningar,
- diarre,
- huvudvärk,
- sömnproblem (sömnlöshet),
- skakningar,
- svettas,
- rastlöshet och
- irritabilitet
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Uniphyl. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
Uniphyl (teofyllin vattenfri tablett) ® (teofyllin, vattenfri) Tabletter i ett system med kontrollerad frisättning tillåter ett 24-timmars doseringsintervall för lämpliga patienter.
Teofyllin klassificeras strukturellt som en metylxantin. Det förekommer som ett vitt, luktfritt, kristallint pulver med en bitter smak.
Vattenfri teofyllin har det kemiska namnet 1H-Purine-2,6-dion, 3,7-dihydro-1,3-dimethyl-, och representeras av följande strukturformel:
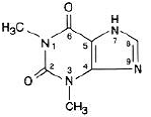
Molekylformeln för vattenfri teofyllin är C7H8N4O2 med en molekylvikt på 180,17.
Varje tablett med kontrollerad frisättning för oral administrering innehåller 400 eller 600 mg vattenfritt teofyllin.
Inaktiva ingredienser: cetostearylalkohol, hydroxietylcellulosa, magnesiumstearat, povidon och talk.
INDIKATIONER
Teofyllin är indicerat för behandling av symtom och reversibel luftflödesobstruktion i samband med kronisk astma och andra kroniska lungsjukdomar, t.ex. emfysem och kronisk bronkit.
DOSERING OCH ADMINISTRERING
Uniphyl (teofyllin vattenfri tablett) ® 400 eller 600 mg tabletter kan tas en gång om dagen på morgonen eller kvällen. Det rekommenderas att Uniphyl (vattenfri teofyllintablett) tas i samband med måltid. Patienter bör informeras om att om de väljer att ta Uniphyl (vattenfri teofyllintablett) med mat bör den tas konsekvent med mat och om de tar den i fastande tillstånd bör den rutinmässigt tas fastande. Det är viktigt att produkten när den doseras doseras konsekvent med eller utan mat.
Uniphyl (vattenfri teofyllin tablett) ® Tabletter får inte tuggas eller krossas eftersom det kan leda till en snabb frisättning av teofyllin med risk för toxicitet. Den skårade tabletten kan delas. I sällsynta fall kan patienter som får Uniphyl (vattenfri teofyllintablett) 400 eller 600 mg tabletter passera en intakt matristablett i avföringen eller via kolostomi. Dessa matristabletter innehåller vanligtvis lite eller inget kvarvarande teofyllin.
Stabiliserade patienter, 12 år eller äldre, som tar en teofyllinprodukt med omedelbar frisättning eller kontrollerad frisättning kan övergå till administrering en gång dagligen av 400 mg eller 600 mg Uniphyl (vattenfri teofyllintablett) tabletter på en mg-för- mg-basis.
Det måste inses att topp- och dalnivåerna av teofyllin i serum som produceras vid dosering en gång dagligen kan variera från de som producerats av den tidigare produkten och/eller kuren.
allmänna överväganden
Den högsta serumkoncentrationen av teofyllin vid steady-state är en funktion av dosen, doseringsintervallet och graden av absorption och clearance av teofyllin hos den enskilda patienten. På grund av markanta individuella skillnader i hastigheten för teofyllinclearance, varierar den dos som krävs för att uppnå en maximal serum-teofyllinkoncentration i intervallet 10-20 mcg/ml fyrfaldigt bland annars liknande patienter i frånvaro av faktorer som är kända för att förändra teofyllinclearance (t.ex. 400-1600 mg/dag hos vuxna Dosen av teofyllin måste individualiseras på basis av mätningar av maximal serumkoncentration av teofyllin för att uppnå en dos som ger maximal potentiell nytta med minimal risk för biverkningar.
Övergående koffeinliknande biverkningar och för höga serumkoncentrationer i långsamma metaboliserare kan undvikas hos de flesta patienter genom att börja med en tillräckligt låg dos och långsamt öka dosen, om det bedöms vara kliniskt indicerat, i små steg (Se ). Dosökningar bör endast göras om den tidigare dosen tolereras väl och med minst 3 dagars intervall för att tillåta serumteofyllinkoncentrationerna att nå det nya steady-state. Dosjustering bör vägledas av mätning av serumkoncentrationen av teofyllin (se FÖRSIKTIGHETSÅTGÄRDER , Laboratorietester och DOSERING OCH ADMINISTRERING ). Sjukvårdsgivare bör instruera patienter och vårdgivare att avbryta all dosering som orsakar biverkningar, att hålla inne medicineringen tills dessa symtom är borta och att sedan återuppta behandlingen med en lägre, tidigare tolererad dos (se VARNINGAR ).
Om patientens symtom är väl kontrollerade finns det inga uppenbara biverkningar och inga ingripande faktorer som kan ändra doseringskraven (se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER ), bör serumkoncentrationer av teofyllin övervakas med 6 månaders intervall för snabbt växande barn och med årliga intervall för alla andra. Hos akut sjuka patienter bör serumkoncentrationen av teofyllin övervakas med täta intervall, t.ex. var 24:e timme.
Teofyllin fördelar sig dåligt i kroppsfettet, därför bör mg/kg dos beräknas på basis av ideal kroppsvikt.
Tabell V innehåller titreringsschema för teofyllin som rekommenderas för patienter i olika åldersgrupper och kliniska omständigheter.
Tabell VI innehåller rekommendationer för dosjustering av teofyllin baserat på serumkoncentrationer av teofyllin. Tillämpningen av dessa allmänna doseringsrekommendationer på individuella patienter måste ta hänsyn till varje patients unika kliniska egenskaper. Generellt sett bör dessa rekommendationer fungera som den övre gränsen för dosjusteringar för att minska risken för potentiellt allvarliga biverkningar associerade med oväntade stora ökningar av serumkoncentrationen av teofyllin.
B. Patienter med riskfaktorer för nedsatt clearance, äldre (> 60 år) och de hos vilka det inte är möjligt att övervaka serumteofyllinkoncentrationer:
Hos barn 12-15 år bör teofyllindosen inte överstiga 16 mg/kg/dag upp till maximalt 400 mg/dag i närvaro av riskfaktorer för minskat teofyllinclearance (se VARNINGAR ) eller om det inte är möjligt att övervaka serumkoncentrationer av teofyllin.
Hos ungdomar ≥ 16 år och vuxna, inklusive äldre, bör teofyllindosen inte överstiga 400 mg/dag i närvaro av riskfaktorer för minskat teofyllinclearance (se VARNINGAR ) eller om det inte är möjligt att övervaka serumkoncentrationer av teofyllin.
*Patienter med snabbare metabolism som kliniskt identifierats av högre dosbehov än genomsnittet, bör få en mindre dos oftare (var 12:e timme) för att förhindra genombrottssymtom till följd av låga dalkoncentrationer före nästa dos.
TABELL VI. Dosjustering styrd av serumkoncentrationen av teofyllin.
HUR LEVERERAS
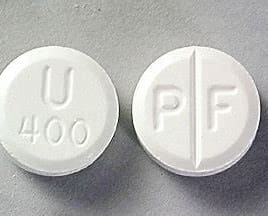
Uniphyl® (teofyllin, vattenfri) tabletter med kontrollerad frisättning 400 mg levereras i vita, ogenomskinliga barnsäkra flaskor av plast innehållande 100 tabletter ( NDC 67781-251-01) eller 500 tabletter ( NDC 67781-251-05). Varje rund, vit 400 mg tablett bär symbolen PF på den skårade sidan och U400 på den andra sidan.
Uniphyl® (teofyllin, vattenfri) tabletter med kontrollerad frisättning 600 mg levereras i vita, ogenomskinliga barnsäkra flaskor av plast innehållande 100 tabletter ( NDC 67781-252-01). Varje rektangulär, konkav, vit 600 mg tablett bär symbolen PF på den skårade sidan och U 600 på den andra sidan.
Förvara vid 25°C (77°F); utflykter tillåtna mellan 15°-30°C (59°-86°F).
Dispensera i en tät, ljusbeständig behållare.
Purdue Pharmaceutical Products LP, Dist. av: Purdue Pharmaceutical Products LP, Stamford, CT 06901-3431. 17 mars 2004.
BIEFFEKTER
Biverkningar associerade med teofyllin är i allmänhet milda när maximala serumkoncentrationer av teofyllin är ÖVERDOSERING ). De övergående koffeinliknande biverkningarna inträffar hos cirka 50 % av patienterna när teofyllinbehandling initieras med doser högre än rekommenderade initialdoser (t.ex. > 300 mg/dag hos vuxna och > 12 mg/kg/dag hos barn över > 1 års ålder ). Under inledningen av teofyllinbehandling kan koffeinliknande biverkningar övergående förändra patientens beteende, särskilt hos barn i skolåldern, men detta svar kvarstår sällan. Initiering av teofyllinbehandling med en låg dos med efterföljande långsam titrering till en förutbestämd åldersrelaterad maximal dos kommer signifikant att minska frekvensen av dessa övergående biverkningar (se DOSERING OCH ADMINISTRERING ). Hos en liten andel av patienterna (
Andra biverkningar som har rapporterats vid serumkoncentrationer av teofyllin
TABELL IV. Manifestationer av teofyllintoxicitet. *
LÄKEMEDELSINTERAKTIONER
Teofyllin interagerar med en mängd olika läkemedel. Interaktionen kan vara farmakodynamisk, dvs förändringar i det terapeutiska svaret på teofyllin eller annat läkemedel eller förekomst av biverkningar utan förändring i serumkoncentrationen av teofyllin. Mer frekvent är dock interaktionen farmakokinetisk, dvs. hastigheten för teofyllinclearance förändras av ett annat läkemedel vilket resulterar i ökade eller minskade serumkoncentrationer av teofyllin. Teofyllin förändrar endast sällan farmakokinetiken för andra läkemedel. Läkemedlen som anges i tabell II har potential att producera kliniskt signifikanta farmakodynamiska eller farmakokinetiska interaktioner med teofyllin. Informationen i "Effekt"-kolumnen i Tabell II förutsätter att det interagerande läkemedlet läggs till en teofyllinbehandling vid steadystate. Om teofyllin initieras hos en patient som redan tar ett läkemedel som hämmar teofyllinclearance (t.ex. cimetidin, erytromycin), kommer den dos av teofyllin som krävs för att uppnå en terapeutisk serumteofyllinkoncentration att vara mindre. Omvänt, om teofyllin initieras hos en patient som redan tar ett läkemedel som ökar teofyllinclearance (t.ex. rifampin), kommer den dos av teofyllin som krävs för att uppnå en terapeutisk serumteofyllinkoncentration att vara större. Utsättning av ett samtidigt läkemedel som ökar teofyllinclearance kommer att resultera i ackumulering av teofyllin till potentiellt toxiska nivåer, om inte teofyllindosen reduceras på lämpligt sätt. Utsättning av ett samtidigt läkemedel som hämmar clearance av teofyllin kommer att resultera i minskade serumkoncentrationer av teofyllin, såvida inte teofyllindosen höjs på lämpligt sätt. Läkemedlen som anges i tabell III har antingen dokumenterats att de inte interagerar med teofyllin eller ger ingen kliniskt signifikant interaktion (dvs
Listan över läkemedel i tabellerna II och III är aktuella den 9 februari 1995. Nya interaktioner rapporteras kontinuerligt för teofyllin, speciellt med nya kemiska enheter. Vårdpersonalen ska inte anta att ett läkemedel inte interagerar med teofyllin om det inte finns med i tabell II. Innan ett nytt tillgängligt läkemedel tillsätts till en patient som får teofyllin, bör bipacksedeln för det nya läkemedlet och/eller den medicinska litteraturen konsulteras för att fastställa om en interaktion mellan det nya läkemedlet och teofyllin har rapporterats.
TABELL II. Kliniskt signifikanta läkemedelsinteraktioner med teofyllin.*
TABELL III. Läkemedel som har dokumenterats inte interagera med teofyllin eller läkemedel som inte ger någon kliniskt signifikant interaktion med teofyllin. *
Läkemedel-mat-interaktioner
Biotillgängligheten av Uniphyl® tabletter (teofyllin, vattenfri) har studerats vid samtidig administrering av mat. I tre enkeldosstudier jämfördes försökspersoner som fick Uniphyl (vattenfri teofyllintablett) 400 mg eller 600 mg tabletter med en standardiserad måltid med hög fetthalt med fastande tillstånd. Under utfodrade förhållanden ökade den maximala plasmakoncentrationen och biotillgängligheten; dock var en hastig ökning av absorptionshastigheten och omfattningen av absorption inte uppenbar (se Farmakokinetik, Absorption ). Den ökade toppen och omfattningen av absorption under utfodrade förhållanden tyder på att doseringen helst bör administreras konsekvent antingen med eller utan mat.
Effekten av andra läkemedel på teofyllinserumkoncentrationsmätningar
De flesta serumteofyllinanalyser i klinisk användning är immunanalyser som är specifika för teofyllin. Andra xantiner som koffein, dypfyllin och pentoxifyllin detekteras inte av dessa analyser. Vissa läkemedel (t.ex. cefazolin, cefalotin) kan dock störa vissa HPLC-tekniker. Koffein- och xantinmetaboliter hos nyfödda eller patienter med nedsatt njurfunktion kan göra att avläsningen från vissa torrreagensmetoder är högre än den faktiska serumteofyllinkoncentrationen.
VARNINGAR
Samtidig sjukdom
Teofyllin bör användas med extrem försiktighet hos patienter med följande kliniska tillstånd på grund av den ökade risken för förvärring av det samtidiga tillståndet:
Aktivt magsår Krampanfall Hjärtarytmier (inte inklusive bradyarytmier)
Tillstånd som minskar clearance av teofyllin
Det finns flera lätt identifierbara orsaker till minskad teofyllinclearance. Om den totala dagliga dosen inte reduceras på lämpligt sätt i närvaro av dessa riskfaktorer, kan allvarlig och potentiellt dödlig teofyllintoxicitet uppstå. Noggrant övervägande måste tas till fördelarna och riskerna med användning av teofyllin och behovet av mer intensiv övervakning av serumkoncentrationer av teofyllin hos patienter med följande riskfaktorer:
Ålder
Nyfödda (avgångna och för tidigt födda) Barn 60 år)
Samtidiga sjukdomar
Akut lungödem Kongestiv hjärtsvikt Cor-pulmonale Feber; ≥ 102° i 24 timmar eller mer; eller lägre temperaturhöjningar under längre perioder Hypotyreos Leversjukdom; cirros, akut hepatit Nedsatt njurfunktion hos spädbarn
Upphörande av rökning
Läkemedelsinteraktioner
Lägga till ett läkemedel som hämmar teofyllinmetabolismen (t.ex. cimetidin, erytromycin, takrin) eller stoppa ett samtidigt administrerat läkemedel som förbättrar teofyllinmetabolismen (t.ex. karbamazepin, rifampin). (Ser FÖRSIKTIGHETSÅTGÄRDER: INTERAKTIONER , ).
När tecken eller symtom på teofyllintoxicitet är närvarande
Närhelst en patient som får teofyllin utvecklar illamående eller kräkningar, särskilt upprepade kräkningar, eller andra tecken eller symtom som överensstämmer med teofyllintoxicitet (även om annan orsak kan misstänkas), bör ytterligare doser av teofyllin avbrytas och en serumkoncentration av teofyllin mätas omedelbart. Patienterna ska instrueras att inte fortsätta med någon dos som orsakar biverkningar och att hålla inne efterföljande doser tills symtomen har försvunnit, då sjukvårdspersonalen kan instruera patienten att återuppta läkemedlet med en lägre dos (se DOSERING OCH ADMINISTRERING , Doseringsriktlinjer, tabell VI ).
Dosering ökar
Ökning av dosen av teofyllin bör inte göras som svar på en akut förvärring av symtom på kronisk lungsjukdom eftersom teofyllin ger liten extra fördel för inhalerade beta2-selektiva agonister och systemiskt administrerade kortikosteroider i denna omständighet och ökar risken för biverkningar. En maximal steady-state serumkoncentration av teofyllin bör mätas innan dosen ökas som svar på ihållande kroniska symtom för att fastställa om en dosökning är säker. Innan man ökar teofyllindosen på basis av en låg serumkoncentration bör vårdpersonalen överväga om blodprovet togs vid en lämplig tidpunkt i förhållande till dosen och om patienten har följt den föreskrivna regimen (se FÖRSIKTIGHETSÅTGÄRDER , Laboratorietester ).
Eftersom hastigheten för teofyllinclearance kan vara dosberoende (dvs. steady-state serumkoncentrationer kan öka oproportionerligt med dosökningen), bör en dosökning baserad på en subterapeutisk serumkoncentrationsmätning vara konservativ. I allmänhet kommer en begränsning av dosökningar till cirka 25 % av den tidigare totala dagliga dosen att minska risken för oavsiktlig överdriven ökning av serumkoncentrationen av teofyllin (se DOSERING OCH ADMINISTRERING , ).
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Noggrant övervägande av de olika interagerande läkemedlen och fysiologiska tillstånd som kan förändra teofyllinclearance och kräver dosjustering bör ske innan teofyllinbehandlingen påbörjas, före ökningar av teofyllindosen och under uppföljning (se VARNINGAR ). Den dos av teofyllin som väljs för att påbörja behandlingen bör vara låg och, om den tolereras, ökas långsamt under en period på en vecka eller längre med den slutliga dosen styrd av övervakning av serumkoncentrationer av teofyllin och patientens kliniska svar (se DOSERING OCH ADMINISTRERING , ).
Övervakning av serumteofyllinkoncentrationer
Mätningar av teofyllinkoncentrationen i serum är lätt tillgängliga och bör användas för att avgöra om dosen är lämplig. Specifikt bör teofyllinkoncentrationen i serum mätas enligt följande:
För att vägleda en dosökning bör blodprovet tas vid tidpunkten för den förväntade maximala serumteofyllinkoncentrationen; 12 timmar efter en kvällsdos eller 9 timmar efter en morgondos vid steady-state. För de flesta patienter kommer steady-state att uppnås efter 3 dagars dosering när inga doser har missats, inga extra doser har lagts till och ingen av doserna har tagits med olika intervall. En dalkoncentration (dvs. vid slutet av doseringsintervallet) ger ingen ytterligare användbar information och kan leda till en olämplig dosökning eftersom den maximala serumkoncentrationen av teofyllin kan vara två eller flera gånger högre än dalkoncentrationen med en formulering med omedelbar frisättning . Om serumprovet tas mer än 12 timmar efter kvällsdosen, eller mer än 9 timmar efter en morgondos, måste resultaten tolkas med försiktighet eftersom koncentrationen kanske inte reflekterar toppkoncentrationen. Däremot, när tecken eller symtom på teofyllintoxicitet förekommer, bör ett serumprov tas så snart som möjligt, analyseras omedelbart och resultatet rapporteras till vårdpersonal utan dröjsmål. Hos patienter hos vilka man misstänker minskad serumproteinbindning (t.ex. skrumplever, kvinnor under graviditetens tredje trimester), bör koncentrationen av obundet teofyllin mätas och dosen justeras för att uppnå en obunden koncentration på 6-12 mcg/ml. Salivkoncentrationer av teofyllin kan inte användas på ett tillförlitligt sätt för att justera doseringen utan speciella tekniker.
Effekter på laboratorietester
Som ett resultat av dess farmakologiska effekter ökar teofyllin i serumkoncentrationer inom intervallet 10-20 mcg/ml måttligt plasmaglukos (från ett medelvärde av 88 mg% till 98 mg%), urinsyra (från ett medelvärde av 4 mg/dL) till 6 mg/dL), fria fettsyror (från ett medelvärde av 451 μEq/L till 800 μEq/L, totalt kolesterol (från ett medelvärde av 140 vs 160 mg/dL), HDL (från ett medelvärde av 36 till 50 mg /dL), HDL/LDL-förhållande (från ett medelvärde av 0,5 till 0,7) och utsöndring av fritt kortisol i urin (från ett medelvärde av 44 till 63 mcg/24 h). Teofyllin vid serumkoncentrationer inom intervallet 10-20 mcg/ml kan också tillfälligt minska serumkoncentrationerna av trijodtyronin (144 före, 131 efter en vecka och 142 ng/dL efter 4 veckor med teofyllin) Den kliniska betydelsen av dessa förändringar bör vägas mot den potentiella terapeutiska nyttan av teofyllin hos enskilda patienter.
Karcinogenes, mutagenes och försämring av fertilitet
Långtidsstudier av karcinogenicitet har utförts på möss (orala doser 30-150 mg/kg) och råttor (orala doser 5-75 mg/kg). Resultat väntar.
Teofyllin har studerats i Ames salmonella, in vivo och in vitro cytogenetik, mikronukleus och kinesisk hamster ovarie testsystem och har inte visats vara genotoxiskt.
en 14 veckors kontinuerlig avelsstudie försämrade teofyllin, administrerat till par av B6C3F1-möss i orala doser på 120, 270 och 500 mg/kg (ungefär 1,0-3,0 gånger den mänskliga dosen på mg/m²-basis), fertiliteten, vilket framgår av minskningar i antalet levande ungar per kull, minskningar i medelantalet kullar per fertilt par och ökningar i dräktighetsperioden vid den höga dosen samt minskningar av andelen ungar födda levande vid medel- och högdosen. I 13 veckors toxicitetsstudier administrerades teofyllin till F344-råttor och B6C3F1-möss i orala doser på 40-300 mg/kg (ungefär 2,0 gånger den mänskliga dosen på mg/m²-basis). Vid den höga dosen observerades systemisk toxicitet hos båda arterna inklusive minskning av testikelvikten.
Graviditet
Teratogena effekter: Kategori C
I studier där gravida möss, råttor och kaniner doserades under organogenesperioden gav teofyllin teratogena effekter.
studier med möss gav en intraperitoneal engångsdos på och över 100 mg/kg (ungefär lika med den maximala rekommenderade orala dosen för vuxna på mg/m²-basis) under organogenesen gomspalt och digitala abnormiteter. Mikromeli, mikrognati, klumpfot, subkutant hematom, öppna ögonlock och embryodödlighet observerades vid doser som är cirka 2 gånger den maximala rekommenderade orala dosen för vuxna på mg/m²-basis.
en studie med råttor doserade från befruktning till organogenes gav en oral dos på 150 mg/kg/dag (ungefär 2 gånger den maximala rekommenderade orala dosen för vuxna på mg/m²-basis) digitala abnormiteter. Embryoletalitet observerades med en subkutan dos på 200 mg/kg/dag (ungefär 4 gånger den maximala rekommenderade orala dosen för vuxna på mg/m²-basis). I en studie där dräktiga kaniner doserades under hela organogenesen, en intravenös dos på 60 mg/kg/dag (ungefär 2 gånger den maximala rekommenderade orala dosen för vuxna på en mg/m²-basis), som orsakade en dovs död och klinisk tecken hos andra, producerade gomspalt och var embryodödlig. Doser på och över 15 mg/kg/dag (mindre än den maximala rekommenderade orala dosen för vuxna på mg/m²-basis) ökade förekomsten av skelettvariationer.
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Teofyllin ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Ammande mödrar
Teofyllin utsöndras i bröstmjölk och kan orsaka irritabilitet eller andra tecken på mild toxicitet hos ammande spädbarn. Koncentrationen av teofyllin i bröstmjölk är ungefär likvärdig med moderns serumkoncentration. Ett spädbarn som får i sig en liter bröstmjölk som innehåller 10-20 mcg/ml teofyllin per dag kommer sannolikt att få 10-20 mg teofyllin per dag. Allvarliga biverkningar hos spädbarnet är osannolika om inte mamman har toxiska teofyllinkoncentrationer i serum.
Pediatrisk användning
Teofyllin är säkert och effektivt för de godkända indikationerna hos pediatriska patienter. Underhållsdosen av teofyllin måste väljas med försiktighet hos pediatriska patienter eftersom graden av teofyllinclearance är mycket varierande över det pediatriska åldersintervallet (se KLINISK FARMAKOLOGI , , VARNINGAR , och DOSERING OCH ADMINISTRERING , ).
Geriatrisk användning
Äldre patienter löper en signifikant större risk att uppleva allvarlig toxicitet från teofyllin än yngre patienter på grund av farmakokinetiska och farmakodynamiska förändringar i samband med åldrande. Clearance av teofyllin minskar med i genomsnitt 30 % hos friska äldre vuxna (> 60 år) jämfört med friska unga vuxna. Teofyllinclearance kan reduceras ytterligare av samtidiga sjukdomar som är vanliga hos äldre, vilket ytterligare försämrar clearance av detta läkemedel och har potential att öka serumnivåerna och potentiell toxicitet. Dessa tillstånd inkluderar nedsatt njurfunktion, kronisk obstruktiv lungsjukdom, kongestiv hjärtsvikt, leversjukdom och en ökad prevalens av användning av vissa mediciner (se FÖRSIKTIGHETSÅTGÄRDER : LÄKEMEDELSINTERAKTIONER ) med potential för farmakokinetisk och farmakodynamisk interaktion. Proteinbindningen kan minska hos äldre vilket resulterar i en ökad andel av den totala serumkoncentrationen av teofyllin i den farmakologiskt aktiva obundna formen. Äldre patienter verkar också vara mer känsliga för de toxiska effekterna av teofyllin efter kronisk överdosering än yngre patienter. Noggrann uppmärksamhet på dosminskning och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos äldre patienter (se FÖRSIKTIGHETSÅTGÄRDER , Övervakning av serumteofyllinkoncentrationer , och DOSERING OCH ADMINISTRERING ).
Den maximala dagliga dosen av teofyllin hos patienter äldre än 60 år bör vanligtvis inte överstiga 400 mg/dag såvida inte patienten fortsätter att vara symtomatisk och den maximala steady-state serumkoncentrationen av teofyllin är DOSERING OCH ADMINISTRERING ). Teofyllindoser större än 400 mg/dag bör förskrivas med försiktighet till äldre patienter.
ÖVERDOS
Allmän
Kroniciteten och mönstret för överdosering av teofyllin påverkar signifikant kliniska manifestationer av toxicitet, hantering och resultat. Det finns två vanliga former: (1) akut överdos, dvs. intag av en enda stor överdos (> 10 mg/kg), som inträffar i samband med ett självmordsförsök eller enstaka medicineringsfel, och (2) kronisk överdosering, dvs intag av upprepade doser som är överdrivna för patientens hastighet av teofyllinclearance. De vanligaste orsakerna till kronisk överdosering av teofyllin inkluderar patientens eller vårdgivarens fel i doseringen, sjukvårdspersonal förskrivning av en för hög dos eller en normal dos i närvaro av faktorer som är kända för att minska graden av teofyllinclearance, och ökning av dosen som svar på en exacerbation. symtom utan att först mäta serumkoncentrationen av teofyllin för att avgöra om en dosökning är säker.
Allvarlig toxicitet från överdosering av teofyllin är en relativt sällsynt händelse. I en hälsovårdsorganisation var frekvensen av sjukhusinläggningar för kronisk överdosering av teofyllin cirka 1 per 1000 personår exponering. I en annan studie, bland 6000 blodprover som tagits för mätning av serumkoncentrationen av teofyllin, av någon anledning, från patienter som behandlats på en akutmottagning, var 7 % i intervallet 20-30 mcg/ml och 3 % var > 30 mcg/ml. Ungefär två tredjedelar av patienterna med serumteofyllinkoncentrationer i intervallet 20-30 mcg/ml hade en eller flera manifestationer av toxicitet medan > 90 % av patienterna med serumteofyllinkoncentrationer > 30 mcg/ml var kliniskt berusade. På liknande sätt, i andra rapporter, ses allvarlig toxicitet från teofyllin huvudsakligen vid serumkoncentrationer > 30 mcg/ml.
Flera studier har beskrivit de kliniska manifestationerna av överdosering av teofyllin och försökt fastställa de faktorer som förutsäger livshotande toxicitet. I allmänhet är patienter som upplever en akut överdos mindre benägna att uppleva anfall än patienter som har upplevt en kronisk överdosering, såvida inte den maximala serumkoncentrationen av teofyllin är > 100 mcg/ml. Efter en kronisk överdosering kan generaliserade anfall, livshotande hjärtarytmier och död inträffa vid serumkoncentrationer av teofyllin > 30 mcg/ml. Allvarligheten av toxiciteten efter kronisk överdosering är starkare korrelerad med patientens ålder än den maximala serumteofyllinkoncentrationen; patienter > 60 år löper störst risk för allvarlig toxicitet och dödlighet efter en kronisk överdosering. Redan existerande eller samtidig sjukdom kan också signifikant öka känsligheten hos en patient för en viss toxisk manifestation, t.ex. har patienter med neurologiska störningar en ökad risk för anfall och patienter med hjärtsjukdom har en ökad risk för hjärtarytmier för en given serumteofyllinkoncentration jämfört med till patienter utan den underliggande sjukdomen.
Frekvensen av olika rapporterade manifestationer av överdosering av teofyllin enligt överdoseringssättet anges i tabell IV. Andra manifestationer av teofyllintoxicitet inkluderar ökningar av serumkalcium, kreatinkinas, myoglobin och leukocytantal, minskningar av serumfosfat och magnesium, akut hjärtinfarkt och urinretention hos män med obstruktiv uropati. Kramper associerade med serumteofyllinkoncentrationer > 30 mcg/ml är ofta resistenta mot antikonvulsiv behandling och kan resultera i irreversibel hjärnskada om de inte kontrolleras snabbt. Död till följd av teofyllintoxicitet är oftast sekundärt till hjärtstillestånd och/eller hypoxisk encefalopati efter långvariga generaliserade anfall eller svårlösta hjärtarytmier som orsakar hemodynamisk kompromiss.
Överdoshantering
Allmänna rekommendationer för patienter med symtom på överdosering av teofyllin eller serumkoncentrationer av teofyllin > 30 mcg/ml (Obs: Serumkoncentrationerna av teofyllin kan fortsätta att öka efter att patienten har presenterats för medicinsk vård.)
Samtidigt som behandlingen påbörjas, kontakta ett regionalt giftcenter för att få uppdaterad information och råd om hur du individualiserar de rekommendationer som följer.
Instituera stödjande vård, inklusive etablering av intravenös åtkomst, underhåll av luftvägarna och elektrokardiografisk övervakning.
Behandling av anfall
På grund av den höga sjukligheten och dödligheten i samband med teofyllininducerade anfall bör behandlingen vara snabb och aggressiv. Antikonvulsiv behandling bör inledas med ett intravenöst bensodiazepin, t.ex. diazepam, i steg om 0,1-0,2 mg/kg var 1-3:e minut tills anfallen upphör. Upprepade anfall bör behandlas med en laddningsdos av fenobarbital (20 mg/kg infunderat under 30-60 minuter). Fallrapporter om överdosering av teofyllin hos människor och djurstudier tyder på att fenytoin är ineffektivt för att avsluta teofyllininducerade anfall. Doserna av bensodiazepiner och fenobarbital som krävs för att avsluta teofyllin-inducerade anfall är nära de doser som kan orsaka allvarlig andningsdepression eller andningsstopp; vårdpersonalen bör därför vara beredd att tillhandahålla assisterad ventilation. Äldre patienter och patienter med KOL kan vara mer mottagliga för de andningsdepressiva effekterna av antikonvulsiva medel. Barbituratinducerad koma eller administrering av allmän anestesi kan krävas för att avsluta upprepade anfall eller status epilepticus. Generell anestesi ska användas med försiktighet hos patienter med överdosering av teofyllin eftersom fluorerade flyktiga anestetika kan göra myokardiet sensibiliserat för endogena katekolaminer som frisätts av teofyllin. Enfluran verkar mindre sannolikt vara associerat med denna effekt än halotan och kan därför vara säkrare. Enbart neuromuskulära blockerande medel ska inte användas för att avsluta anfall eftersom de tar bort de muskuloskeletala manifestationerna utan att avsluta anfallsaktiviteten i hjärnan.
Förutse behovet av antikonvulsiva medel
Hos patienter med teofyllinöverdos som löper hög risk för teofyllininducerade anfall, t.ex. patienter med akuta överdoser och serumteofyllinkoncentrationer > 100 mcg/ml eller kronisk överdosering hos patienter > 60 år med serumteofyllinkoncentrationer > 30 mcg/mL , bör behovet av antikonvulsiv terapi förutses. Ett bensodiazepin som diazepam ska dras upp i en spruta och förvaras vid patientens säng och medicinsk personal som är kvalificerad att behandla anfall ska vara omedelbart tillgänglig. Hos utvalda patienter med hög risk för teofyllininducerade anfall bör administrering av profylaktisk antikonvulsiv behandling övervägas. Situationer där profylaktisk antikonvulsiv behandling bör övervägas hos högriskpatienter inkluderar förväntade förseningar i införandet av metoder för extrakorporealt avlägsnande av teofyllin (t.ex. överföring av en högriskpatient från en vårdinrättning till en annan för extrakorporealt avlägsnande) och kliniska omständigheter som avsevärt stör ansträngningarna för att förbättra clearance av teofyllin (t.ex. en nyfödd där dialys kanske inte är tekniskt möjlig eller en patient med kräkningar som inte svarar på antiemetika som inte kan tolerera flera doser oralt aktivt kol). I djurstudier har profylaktisk administrering av fenobarbital, men inte fenytoin, visat sig fördröja uppkomsten av teofyllin-inducerade generaliserade anfall och öka den dos av teofyllin som krävs för att inducera anfall (dvs. ökar markant LD50). Även om det inte finns några kontrollerade studier på människor, kan en laddningsdos av intravenös fenobarbital (20 mg/kg infunderad under 60 minuter) fördröja eller förhindra livshotande anfall hos högriskpatienter samtidigt som ansträngningarna att förbättra clearance av teofyllin fortsätter. Fenobarbital kan orsaka andningsdepression, särskilt hos äldre patienter och patienter med KOL.
Behandling av hjärtarytmier
Sinustakykardi och enkla ventrikulära förtida slag är inte förebud om livshotande arytmier, de kräver ingen behandling i frånvaro av hemodynamiska kompromisser, och de försvinner med sjunkande teofyllinkoncentrationer i serum. Andra arytmier, särskilt de som är förknippade med hemodynamisk kompromiss, bör behandlas med antiarytmisk behandling som är lämplig för typen av arytmi.
Gastrointestinal dekontaminering
Oralt aktivt kol (0,5 g/kg upp till 20 g och upprepa minst en gång 1-2 timmar efter den första dosen) är extremt effektivt för att blockera absorptionen av teofyllin i mag-tarmkanalen, även när det administreras flera timmar efter intag. Om patienten kräks ska kolet administreras genom en nasogastrisk sond eller efter administrering av ett antiemetikum. Fetiazin-antiemetika som proklorperazin eller perfenazin bör undvikas eftersom de kan sänka kramptröskeln och ofta orsaka dystoniska reaktioner. En enkel dos sorbitol kan användas för att främja avföring för att underlätta avlägsnande av teofyllin bundet till kol från mag-tarmkanalen. Sorbitol bör dock doseras med försiktighet eftersom det är ett kraftfullt renande medel som kan orsaka allvarliga vätske- och elektrolytavvikelser, särskilt efter flera doser. Kommersiellt tillgängliga fasta kombinationer av flytande kol och sorbitol bör undvikas hos små barn och efter den första dosen hos ungdomar och vuxna eftersom de inte tillåter individualisering av kol och sorbitoldosering. Ipecac sirap bör undvikas i överdoser av teofyllin. Även om ipecac inducerar kräkning, minskar det inte absorptionen av teofyllin om det inte administreras inom 5 minuter efter intag och är även då mindre effektivt än oralt aktivt kol. Dessutom kan ipecac-inducerad kräkning kvarstå i flera timmar efter en engångsdos och avsevärt minska retentionen och effektiviteten av oralt aktivt kol.
Serum Theophy linne
Koncentrationsövervakning Serumkoncentrationen av teofyllin bör mätas omedelbart efter presentation, 2-4 timmar senare, och sedan med tillräckliga intervall, t.ex. var fjärde timme, för att vägleda behandlingsbeslut och för att bedöma behandlingens effektivitet. Koncentrationerna av teofyllin i serum kan fortsätta att öka efter att patienten har lämnats in för medicinsk vård som ett resultat av fortsatt absorption av teofyllin från mag-tarmkanalen. Seriell övervakning av serumkoncentrationer av teofyllin i serum bör fortsätta tills det är klart att koncentrationen inte längre stiger och har återgått till icke-toxiska nivåer.
Allmän övervakning
Procedurer Elektrokardiografisk övervakning bör initieras vid presentation och fortsätta tills serumteofyllinnivån har återgått till en icke-toxisk nivå. Serumelektrolyter och glukos bör mätas vid uppvisande och med lämpliga intervall som anges av kliniska omständigheter. Vätske- och elektrolytavvikelser bör korrigeras omedelbart. Övervakning och behandling bör fortsätta tills serumkoncentrationen sjunker under 20 mcg/ml.
Förbättra clearance av teofyllin
Flerdos peroralt aktivt kol (t.ex. 0,5 mg/kg upp till 20 g, varannan timme) ökar clearance av teofyllin minst två gånger genom adsorption av teofyllin som utsöndras i gastrointestinala vätskor. Träkol måste hållas kvar i, och passera genom, mag-tarmkanalen för att vara effektiv; kräkning bör därför kontrolleras genom administrering av lämpliga antiemetika. Alternativt kan kolet administreras kontinuerligt genom en nasogastrisk sond i samband med lämpliga antiemetika. En enstaka dos sorbitol kan administreras med det aktiverade kolet för att främja avföring för att underlätta eliminering av det adsorberade teofyllinet från mag-tarmkanalen. Sorbitol ensamt förbättrar inte clearance av teofyllin och bör doseras med försiktighet för att förhindra överdriven avföring som kan resultera i allvarliga vätske- och elektrolytobalanser. Kommersiellt tillgängliga fasta kombinationer av flytande kol och sorbitol bör undvikas hos små barn och efter den första dosen hos ungdomar och vuxna eftersom de inte tillåter individualisering av kol och sorbitoldosering. Hos patienter med svårbehandlade kräkningar bör extrakorporeala metoder för borttagning av teofyllin sättas in (se ÖVERDOSERING , Extrakorporealt avlägsnande ).
Specifika rekommendationer
Akut överdosering
Kronisk överdosering
Extrakorporealt avlägsnande
Att öka graden av teofyllinclearance med extrakorporeala metoder kan snabbt minska serumkoncentrationerna, men riskerna med proceduren måste vägas mot den potentiella nyttan. Träkolshemoperfusion är den mest effektiva metoden för extrakorporealt avlägsnande, vilket ökar teofyllinclearance upp till sex gånger, men allvarliga komplikationer, inklusive hypotoni, hypokalcemi, konsumtion av blodplättar och blödningsdiateser kan förekomma. Hemodialys är ungefär lika effektivt som flerdos oralt aktivt kol och har en lägre risk för allvarliga komplikationer än kolhemoperfusion. Hemodialys bör övervägas som ett alternativ när kolhemoperfusion inte är möjlig och oralt kol med flera doser är ineffektivt på grund av svårbehandlad emes. Koncentrationer av teofyllin i serum kan återhämta sig med 5-10 mcg/ml efter avbrytande av kolhemoperfusion eller hemodialys på grund av omfördelning av teofyllin från vävnadsavdelningen. Peritonealdialys är ineffektivt för avlägsnande av teofyllin; utbytestransfusioner hos nyfödda har varit minimalt effektiva.
KONTRAINDIKATIONER
Uniphyl (teofyllin vattenfri tablett) ® är kontraindicerat för patienter med en historia av överkänslighet mot teofyllin eller andra komponenter i produkten.
KLINISK FARMAKOLOGI
Handlingsmekanism
Teofyllin har två distinkta effekter i luftvägarna hos patienter med reversibel obstruktion; glatt muskelavslappning (dvs luftrörsvidgning) och undertryckande av luftvägarnas svar på stimuli (dvs icke-bronkdilaterande profylaktiska effekter). Även om verkningsmekanismerna för teofyllin inte är kända med säkerhet, tyder studier på djur att bronkodilatation medieras av hämning av två isozymer av fosfodiesteras (PDE III och, i mindre utsträckning, PDE IV) medan icke-bronkdilaterande profylaktiska effekter troligen är medierad genom en eller flera olika molekylära mekanismer, som inte involverar hämning av PDE III eller antagonism av adenosinreceptorer. Vissa av de negativa effekterna associerade med teofyllin verkar förmedlas av hämning av PDE III (t.ex. hypotoni, takykardi, huvudvärk och kräkningar) och adenosinreceptorantagonism (t.ex. förändringar i cerebralt blodflöde).
Teofyllin ökar sammandragningskraften av diafragmamusklerna. Denna verkan verkar bero på ökat kalciumupptag genom en adenosinmedierad kanal.
Serum koncentration-effekt relation
Bronkodilation sker över serumteofyllinkoncentrationsintervallet 5-20 mcg/ml. Kliniskt viktig förbättring av symtomkontroll har i de flesta studier visat sig kräva maximala serumkoncentrationer av teofyllin > 10 mcg/ml, men patienter med mild sjukdom kan ha nytta av lägre koncentrationer. Vid serumkoncentrationer av teofyllin > 20 mcg/ml ökar både frekvensen och svårighetsgraden av biverkningarna. I allmänhet kommer att bibehålla maximala serumkoncentrationer av teofyllin mellan 10 och 15 mcg/ml uppnå de flesta av läkemedlets potentiella terapeutiska fördelar samtidigt som risken för allvarliga biverkningar minimeras.
Farmakokinetik
Översikt
Teofyllin absorberas snabbt och fullständigt efter oral administrering i lösning eller fast oral dosform med omedelbar frisättning. Teofyllin genomgår inte någon märkbar pre-systemisk eliminering, distribueras fritt till fettfria vävnader och metaboliseras i stor utsträckning i levern.
Farmakokinetiken för teofyllin varierar kraftigt bland liknande patienter och kan inte förutsägas utifrån ålder, kön, kroppsvikt eller andra demografiska egenskaper. Dessutom kan vissa samtidiga sjukdomar och förändringar i normal fysiologi (se tabell I) och samtidig administrering av andra läkemedel (se tabell II) signifikant förändra de farmakokinetiska egenskaperna hos teofyllin. Variabilitet inom ämnesomsättningen har också rapporterats i vissa studier, särskilt hos akut sjuka patienter. Det rekommenderas därför att serumkoncentrationer av teofyllin mäts ofta hos akut sjuka patienter (t.ex. med 24-timmarsintervall) och regelbundet hos patienter som får långtidsbehandling, t.ex. med 6-12 månaders intervall. Mer frekventa mätningar bör göras i närvaro av tillstånd som signifikant kan förändra teofyllinclearance (se FÖRSIKTIGHETSÅTGÄRDER, Laboratorietester ).
TABELL I. Genomsnitt och intervall för total kroppsclearance och halveringstid för teofyllin relaterat till ålder och förändrade fysiologiska tillstånd.
Notera: Utöver de faktorer som anges ovan, ökas teofyllinclearance och halveringstiden minskas av dieter med låg kolhydrat/hög proteinhalt, parenteral näring och daglig konsumtion av kolstekt nötkött. En kost med hög kolhydrat/lågt protein kan minska clearance och förlänga halveringstiden för teofyllin.
Absorption
Uniphyl (teofyllin vattenfri tablett) ® administrerad i utfodrat tillstånd absorberas fullständigt efter oral administrering.
en endos övergångsstudie administrerades två 400 mg Uniphyl (teofyllin vattenfri tablett) tabletter till 19 normala frivilliga på morgonen eller kvällen omedelbart efter samma standardiserade måltid (769 kalorier bestående av 97 gram kolhydrater, 33 gram protein och 27 gram fett). Det fanns inga bevis för dosdumpning och det fanns inte heller några signifikanta skillnader i farmakokinetiska parametrar hänförliga till tidpunkten för läkemedelsadministrering. På morgonarmen var de farmakokinetiska parametrarna AUC = 241,9 ± 83,0 mcg tim/ml, Cmax = 9,3 ± 2,0 mcg/ml, Tmax = 12,8 ± 4,2 timmar. På kvällsarmen var de farmakokinetiska parametrarna AUC = 219,7 ± 83,0 mcg tim/ml, Cmax = 9,2 ± 2,0 mcg/ml, Tmax = 12,5 ± 4,2 timmar.
En studie där Uniphyl (vattenfri teofyllintablett) 400 mg tabletter administrerades till 17 utfodrade vuxna astmatiker gav liknande kurvor för teofyllinnivå-tid vid administrering på morgonen eller kvällen. Serumnivåerna var generellt högre under kvällsregimen men det fanns inga statistiskt signifikanta skillnader mellan de två regimerna.
En singeldosstudie på 15 frivilliga frivilliga män med normala fastande vars teofyllin inneboende medelhalveringstid för eliminering verifierades av en flytande teofyllinprodukt till 6,9 ± 2,5 (SD) timmar, administrerades två eller tre 400 mg Uniphyl (teofyllin vattenfri tablett) ® tabletter . Den relativa biotillgängligheten av Uniphyl (vattenfri teofyllintablett) givet i fastande tillstånd jämfört med en produkt med omedelbar frisättning var 59 %. Toppnivåer av teofyllin i serum inträffade efter 6,9 ± 5,2 (SD) timmar, med en normaliserad (till 800 mg) toppnivå på 6,2 ± 2,1 (SD). Den skenbara halveringstiden för 400 mg Uniphyl (teofyllin-vattenfri tablett)-tabletter var 17,2 ± 5,8 (SD) timmar.
Steady-state farmakokinetik fastställdes i en studie på 12 fastande patienter med kronisk reversibel obstruktiv lungsjukdom. Alla doserades med två 400 mg Uniphyl (vattenfri teofyllintabletter) som gavs en gång dagligen på morgonen och en referensprodukt med kontrollerad frisättning två gånger dagligen administrerad som två 200 mg tabletter med 12 timmars mellanrum. De farmakokinetiska parametrarna som erhölls för Uniphyl (vattenfri teofyllintabletter) som gavs i doser på 800 mg en gång dagligen på morgonen var praktiskt taget identiska med motsvarande parametrar för referensläkemedlet när de gavs som 400 mg två gånger dagligen. I synnerhet AUC-, Cmax- och Cmin-värdena som erhölls i denna studie var följande:
Enkeldosstudier där försökspersoner fastade i tolv (12) timmar före och ytterligare fyra (4) timmar efter dosering, visade minskad biotillgänglighet jämfört med dosering med mat. En enkeldosstudie på 20 normala frivilliga doserade med två (2) 400 mg tabletter på morgonen, jämförde dosering under dessa fastaförhållanden med dosering omedelbart före en standardiserad frukost (769 kalorier, bestående av 97 gram kolhydrater, 33 gram protein och 27 gram fett). Under utfodrade förhållanden var de farmakokinetiska parametrarna: AUC = 231,7 ± 92,4 mcg tim/ml, Cmax = 8,4 ± 2,6 mcg/ml, Tmax = 17,3 ± 6,7 timmar. Under fastande förhållanden var dessa parametrar AUC = 141,2 ± 6,53 mcg tim/ml, Cmax = 5,5 ± 1,5 mcg/ml, Tmax = 6,5 ± 2,1 timmar.
En annan endosstudie på 21 normala frivilliga män, doserade på kvällen, jämförde fasta med en standardiserad högkalorimåltid med hög fetthalt (870-1 020 kalorier, bestående av 33 gram protein, 55-75 gram fett, 58 gram kolhydrater). I den fastande armen fick försökspersonerna en Uniphyl (vattenfri teofyllintablett) ® 400 mg tablett kl. 20.00 efter en åtta timmars fasta följt av ytterligare fyra timmars fasta. I den utfodrade armen doserades försökspersonerna igen med en 400 mg Uniphyl (teofyllin-vattenfri tablett) tablett, men kl. 20.00 omedelbart efter den standardiserade måltiden med hög fetthalt som citeras ovan. De farmakokinetiska parametrarna (normaliserade till 800 mg) som gavs var AUC = 221,8 ± 40,9 mcg tim/ml, Cmax = 10,9 ± 1,7 mcg/ml, Tmax = 11,8 ± 2,2 timmar. I den fastande armen var de farmakokinetiska parametrarna (normaliserade till 800 mg) AUC = 146,4 ± 40,9 mcg tim/ml, Cmax = 6,7 ± 1,7 mcg/ml, Tmax = 7,3 ± 2,2 timmar.
Således leder administrering av engångsdoser av Uniphyl (teofyllinvattenfri tablett) till friska normala frivilliga under långvarig fasta (minst 10 timmars fasta över natten före dosering följt av ytterligare fyra (4) timmars fasta efter dosering) i minskad biotillgänglighet. Det var dock inget fel i detta tillförselsystem som ledde till en plötslig och oväntad frisättning av en stor mängd teofyllin med Uniphyl (vattenfri teofyllin tablett) även när de administreras tillsammans med en måltid med hög fetthalt och hög kalori.
Liknande studier utfördes med 600 mg Uniphyl (vattenfri teofyllintablett). En enkeldosstudie på 24 försökspersoner med en etablerad teofyllinclearance på ≤ 4 l/timme, jämförde den farmakokinetiska utvärderingen av en 600 mg Uniphyl (teofyllin vattenfri tablett) och en och en halv 400 mg Uniphyl (teofyllin vattenfri tablett) tabletter under utfodring (med en vanlig diet med hög fetthalt) och fasta. Resultaten av denna 4-vägs randomiserade crossover-studie visar bioekvivalensen för 400 mg och 600 mg Uniphyl (teofyllin vattenfri tablett) tabletter. Under utfodrade förhållanden var de farmakokinetiska resultaten för en och en halv 400 mg tabletter AUC = 214,64 ± 55,88 mcg tim/ml, Cmax = 10,58 ± 2,21 mcg/ml och Tmax = 9,00 ± 2,64 timmar, och mg under 60 timmar. var AUC = 207,85 ± 48,9 mcg h/ml, Cmax = 10,39 ± 1,91 mcg/ml och Tmax = 9,58 ± 1,86 timmar. Under fasta var de farmakokinetiska resultaten för en och en halv 400 mg tabletter AUC = 191,85 ± 51,1 mcg tim/ml, Cmax = 7,37 ± 1,83 mcg/ml och Tmax = 8,08 ± 4,39 timmar; och för 600 mg tabletten var AUC = 199,39 ± 70,27 mcg tim/ml, Cmax = 7,66 ± 2,09 mcg/ml och Tmax = 9,67 ± 4,89 timmar.
denna studie var den genomsnittliga kvoten mellan mat och fasta för en och en halv 400 mg tablett och 600 mg tablett cirka 112 % respektive 104 %.
I en annan studie undersöktes biotillgängligheten för 600 mg Uniphyl (vattenfri teofyllin tablett) med administrering morgon och kväll. Denna endos, crossover-studie på 22 friska män utfördes under utfodrade (standard diet med hög fetthalt). Resultaten visade ingen kliniskt signifikant skillnad i biotillgängligheten för 600 mg Uniphyl (vattenfri teofyllin tablett) administrerad på morgonen eller på kvällen. Resultaten var: AUC = 233,6 ± 45,1 mcg tim/ml, Cmax = 10,6 ± 1,3 mcg/ml och Tmax = 12,5 ± 3,2 timmar med morgondosering; AUC = 209,8 ± 46,2 mcg tim/ml, Cmax = 9,7 ± 1,4 mcg/ml och Tmax = 13,7 ± 3,3 timmar med kvällsdosering. Förhållandet PM/AM var 89,3 %.
Absorptionsegenskaperna hos Uniphyl®-tabletter (teofyllin, vattenfri) har studerats omfattande. En steady-state crossover biotillgänglighetsstudie på 22 normala män jämförde två Uniphyl (teofyllin vattenfri tablett) 400 mg tabletter administrerade 24h kl 8 omedelbart efter frukost med en referens teofyllinprodukt med kontrollerad frisättning administrerad två gånger dagligen till utfodrade försökspersoner kl 8 omedelbart efter frukost och 20.00 direkt efter middagen (769 kalorier, bestående av 97 gram kolhydrater, 33 gram protein och 27 gram fett).
De farmakokinetiska parametrarna för Uniphyl (teofyllin vattenfri tablett) 400 mg tabletter under dessa steady-state-förhållanden var AUC = 203,3 ± 87,1 mcg tim/ml, Cmax = 12,1 ± 3,8 mcg/ml, Cmin = 4,80 ± 3,6 Tmax, ± 3,6 Tmax. timmar. För referensprodukten två gånger dagligen var de farmakokinetiska parametrarna AUC = 219,2 ± 88,4 mcg tim/ml, Cmax = 11,0 ± 4,1 mcg/mL, Cmin = 7,28 ± 3,5, Tmax = 6,9 ± 3,4 timmar. Den genomsnittliga procentuella fluktuationen [(Cmax-Cmin/Cmin)x100] = 169 % för kuren en gång dagligen och 51 % för referensprodukten två gånger dagligen.
Biotillgängligheten för 600 mg Uniphyl (vattenfri teofyllintablett) utvärderades ytterligare i en flerdosstudie i steady-state på 26 friska män som jämförde 600 mg tabletten med en och en halv 400 mg Uniphyl (teofyllin vattenfri tablett) tabletter. Alla försökspersoner hade tidigare etablerat teofyllinclearance på ≤ 4 l/timme och doserades en gång dagligen under 6 dagar under matningsförhållanden. Resultaten visade ingen kliniskt signifikant skillnad mellan regimerna med 600 mg och en och en halv 400 mg Uniphyl (teofyllin vattenfri tablett). Steady-state resultat var:
Biotillgänglighetskvoten för 600/400 mg tabletterna var 98,8 %. Under alla studieförhållanden är 600 mg tabletten bioekvivalent med en och en halv 400 mg tablett.
Studier visar att så länge som försökspersonerna antingen matades konsekvent eller konsekvent fastade, finns det liknande biotillgänglighet vid administrering en gång dagligen av Uniphyl (vattenfri teofyllin tablett) oavsett om de doseras på morgonen eller på kvällen.
Distribution
När teofyllin väl kommer in i den systemiska cirkulationen är cirka 40 % bundet till plasmaprotein, främst albumin. Obundet teofyllin distribueras i kroppsvattnet, men distribueras dåligt till kroppsfettet. Den skenbara distributionsvolymen för teofyllin är cirka 0,45 l/kg (intervall 0,3-0,7 l/kg) baserat på ideal kroppsvikt. Teofyllin passerar fritt över moderkakan, in i bröstmjölk och in i cerebrospinalvätskan (CSF). Salivteofyllinkoncentrationer ungefärliga obundna serumkoncentrationer, men är inte tillförlitliga för rutinmässig eller terapeutisk övervakning om inte speciella tekniker används. En ökning av distributionsvolymen av teofyllin, främst på grund av minskad plasmaproteinbindning, inträffar hos prematura nyfödda, patienter med levercirros, okorrigerad acidemi, äldre och hos kvinnor under graviditetens tredje trimester. I sådana fall kan patienten visa tecken på toxicitet vid totala (bundet+obundet) serumkoncentrationer av teofyllin inom det terapeutiska området (10-20 mcg/ml) på grund av förhöjda koncentrationer av det farmakologiskt aktiva obundna läkemedlet. På liknande sätt kan en patient med minskad teofyllinbindning ha en subterapeutisk total läkemedelskoncentration medan den farmakologiskt aktiva obundna koncentrationen ligger inom det terapeutiska området. Om endast total serumkoncentration av teofyllin mäts kan detta leda till en onödig och potentiellt farlig dosökning. Hos patienter med minskad proteinbindning ger mätning av obundet teofyllinkoncentration i serum ett mer tillförlitligt sätt för dosjustering än mätning av total serumteofyllinkoncentration. Generellt bör koncentrationer av obundet teofyllin hållas inom intervallet 6-12 mcg/ml.
Ämnesomsättning
Efter oral dosering genomgår inte teofyllin någon mätbar first-pass-eliminering. Hos vuxna och barn över ett års ålder metaboliseras cirka 90 % av dosen i levern. Biotransformation sker genom demetylering till 1-metylxantin och 3-metylxantin och hydroxylering till 1,3-dimetylurinsyra. 1-metylxantin hydroxyleras ytterligare, med xantinoxidas, till 1-metylurinsyra. Cirka 6 % av en teofyllindos är N-metylerad till koffein. Teofyllin-demetylering till 3-metylxantin katalyseras av cytokrom P-450 1A2, medan cytokromerna P-450 2E1 och P-450 3A3 katalyserar hydroxyleringen till 1,3-dimetylurinsyra. Demetylering till 1-metylxantin verkar katalyseras antingen av cytokrom P-450 1A2 eller ett närbesläktat cytokrom. Hos nyfödda är N-demetyleringsvägen frånvarande medan funktionen hos hydroxyleringsvägen är markant bristfällig. Aktiviteten hos dessa vägar ökar långsamt till maximala nivåer vid ett års ålder.
Koffein och 3-metylxantin är de enda teofyllinmetaboliterna med farmakologisk aktivitet. 3-metylxantin har ungefär en tiondel av teofyllins farmakologiska aktivitet och serumkoncentrationerna hos vuxna med normal njurfunktion är
Både N-demetylerings- och hydroxyleringsvägarna för biotransformation av teofyllin är kapacitetsbegränsade. På grund av den stora variabiliteten mellan individer av teofyllinmetabolismens hastighet, kan icke-linjär eliminering börja hos vissa patienter vid serumteofyllinkoncentrationer DOSERING OCH ADMINISTRERING, Tabell VI ). Noggrann förutsägelse av dosberoende av teofyllinmetabolismen hos patienter a priori är inte möjlig, men patienter med mycket höga initiala clearancehastigheter (dvs låga steady-state serumteofyllinkoncentrationer vid doser över genomsnittet) har störst sannolikhet att uppleva stora förändringar i serum teofyllinkoncentration som svar på dosförändringar.
Exkretion
Hos nyfödda utsöndras cirka 50 % av teofyllindosen oförändrad i urinen. Efter de tre första levnadsmånaderna utsöndras cirka 10 % av teofyllindosen oförändrad i urinen. Resten utsöndras i urinen huvudsakligen som 1,3-dimetylurinsyra (35-40%), 1-metylurinsyra (20-25%) och 3-metylxantin (15-20%). Eftersom lite teofyllin utsöndras oförändrat i urinen och eftersom aktiva metaboliter av teofyllin (dvs. koffein, 3-metylxantin) inte ackumuleras till kliniskt signifikanta nivåer även vid njursjukdom i slutstadiet, behövs ingen dosjustering för njurinsufficiens. hos vuxna och barn > 3 månaders ålder. Däremot kräver den stora andelen av teofyllindosen som utsöndras i urinen som oförändrat teofyllin och koffein hos nyfödda noggrann dosreduktion och frekvent övervakning av serumkoncentrationer av teofyllin hos nyfödda med nedsatt njurfunktion (se VARNINGAR ).
Serumkoncentrationer vid Steady-State
Efter flera doser av teofyllin uppnås steady-state inom 30-65 timmar (i genomsnitt 40 timmar) hos vuxna. Vid steady-state, på en doseringsregim med 24 timmars intervall, är den förväntade genomsnittliga dalkoncentrationen cirka 50 % av den genomsnittliga maximala koncentrationen, med antagande av en genomsnittlig halveringstid för teofyllin på 8 timmar. Skillnaden mellan topp- och dalkoncentrationer är större hos patienter med snabbare teofyllinclearance. Hos dessa patienter kan administrering av Uniphyl (vattenfri teofyllin tablett) ® behövas oftare (var 12:e timme).
Speciella populationer (se tabell I för medelvärden för clearance och halveringstid)
Geriatrisk
Clearance av teofyllin minskar med i genomsnitt 30 % hos friska äldre vuxna (> 60 år) jämfört med friska unga vuxna. Noggrann uppmärksamhet på dosminskning och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos äldre patienter (se VARNINGAR ).
Pediatrik
Clearance av teofyllin är mycket lågt hos nyfödda (se VARNINGAR ). Teofyllinclearance når maximala värden vid ett års ålder, förblir relativt konstant till cirka 9 års ålder och minskar sedan långsamt med cirka 50 % till vuxenvärden vid cirka 16 års ålder. Renal utsöndring av oförändrat teofyllin hos nyfödda uppgår till cirka 50 % av dos, jämfört med cirka 10 % hos barn äldre än tre månader och hos vuxna. Noggrann uppmärksamhet vid val av dos och övervakning av serumkoncentrationer av teofyllin krävs hos pediatriska patienter (se VARNINGAR och DOSERING OCH ADMINISTRERING ).
Kön
Könsskillnader i teofyllinclearance är relativt små och sannolikt inte av klinisk betydelse. Signifikant minskning av teofyllinclearance har dock rapporterats hos kvinnor på den 20:e dagen av menstruationscykeln och under graviditetens tredje trimester.
Lopp
Farmakokinetiska skillnader i teofyllinclearance på grund av ras har inte studerats.
Njurinsufficiens
Endast en liten del, t.ex. cirka 10 %, av den administrerade teofyllindosen utsöndras oförändrad i urinen hos barn äldre än tre månader och vuxna. Eftersom lite teofyllin utsöndras oförändrat i urinen och eftersom aktiva metaboliter av teofyllin (dvs. koffein, 3-metylxantin) inte ackumuleras till kliniskt signifikanta nivåer även vid njursjukdom i slutstadiet, behövs ingen dosjustering för njurinsufficiens hos vuxna och barn > 3 månader gamla. Däremot utsöndras cirka 50 % av den administrerade teofyllindosen oförändrad i urinen hos nyfödda. Noggrann uppmärksamhet på dosreduktion och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos nyfödda med nedsatt njurfunktion (se VARNINGAR ).
Leverinsufficiens
Teofyllinclearance minskar med 50 % eller mer hos patienter med leverinsufficiens (t.ex. cirros, akut hepatit, kolestas). Noggrann uppmärksamhet på dosminskning och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos patienter med nedsatt leverfunktion (se VARNINGAR ).
Kongestiv hjärtsvikt (CHF)
Teofyllinclearance minskar med 50 % eller mer hos patienter med CHF. Graden av minskning av teofyllinclearance hos patienter med CHF verkar vara direkt korrelerad till svårighetsgraden av hjärtsjukdomen. Eftersom teofyllinclearance är oberoende av leverns blodflöde verkar minskningen i clearance bero på nedsatt hepatocytfunktion snarare än minskad perfusion. Noggrann uppmärksamhet på dosreduktion och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos patienter med CHF (se VARNINGAR ).
Rökare
Tobaks- och marijuanarökning verkar öka clearance av teofyllin genom induktion av metabola vägar. Teofyllinclearance har visats öka med cirka 50 % hos unga vuxna tobaksrökare och med cirka 80 % hos äldre tobaksrökare jämfört med icke-rökare. Passiv rökexponering har också visat sig öka teofyllinclearancen med upp till 50 %. Avhållsamhet från tobaksrökning under en vecka ger en minskning av teofyllinclearance med cirka 40 %. Noggrann uppmärksamhet på dosreduktion och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos patienter som slutar röka (se VARNINGAR ). Användning av nikotingummi har inte visat sig ha någon effekt på clearance av teofyllin.
Feber
Feber, oavsett dess bakomliggande orsak, kan minska clearance av teofyllin. Feberns storlek och varaktighet verkar vara direkt korrelerad till graden av minskning av teofyllinclearance. Exakta data saknas, men en temperatur på 39°C (102°F) under minst 24 timmar krävs troligen för att producera en kliniskt signifikant ökning av serumteofyllinkoncentrationerna. Barn med snabb teofyllinclearance (dvs de som behöver en dos som är väsentligt högre än genomsnittet [t.ex. > 22 mg/kg/dag] för att uppnå en terapeutisk toppkoncentration av teofyllin i serum när de är afebrila) kan löpa större risk för toxiska effekter effekter från minskat clearance under ihållande feber. Noggrann uppmärksamhet på dosreduktion och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos patienter med ihållande feber (se VARNINGAR ).
Diverse
Andra faktorer associerade med minskat teofyllinclearance inkluderar graviditetens tredje trimester, sepsis med multipel organsvikt och hypotyreos. Noggrann uppmärksamhet på dosreduktion och frekvent övervakning av serumkoncentrationer av teofyllin krävs hos patienter med något av dessa tillstånd (se VARNINGAR ). Andra faktorer associerade med ökad teofyllinclearance inkluderar hypertyreos och cystisk fibros.
Kliniska studier
Hos patienter med kronisk astma, inklusive patienter med svår astma som kräver inhalerade kortikosteroider eller orala kortikosteroider varannan dag, har många kliniska studier visat att teofyllin minskar frekvensen och svårighetsgraden av symtom, inklusive nattliga exacerbationer, och minskar "efter behov" användningen av inhalerad beta-2-agonister. Teofyllin har också visat sig minska behovet av korta kurer med daglig oral prednison för att lindra exacerbationer av luftvägsobstruktion som inte svarar på luftrörsvidgare hos astmatiker.
Hos patienter med kronisk obstruktiv lungsjukdom (KOL) har kliniska studier visat att teofyllin minskar dyspné, luftinfällning, andningsarbetet och förbättrar kontraktiliteten hos diafragmamusklerna med liten eller ingen förbättring av lungfunktionsmätningarna.
PATIENTINFORMATION
Patienten (eller föräldern/vårdgivaren) ska instrueras att söka läkare närhelst illamående, kräkningar, ihållande huvudvärk, sömnlöshet eller snabba hjärtslag uppstår under behandling med teofyllin, även om annan orsak misstänks. Patienten bör instrueras att kontakta sin vårdpersonal om de utvecklar en ny sjukdom, särskilt om de åtföljs av en ihållande feber, om de upplever förvärring av en kronisk sjukdom, om de börjar eller slutar röka cigaretter eller marijuana, eller om en annan vårdpersonal tillägger ett nytt läkemedel eller avbryter ett tidigare ordinerat läkemedel. Patienterna bör informeras om att teofyllin interagerar med en mängd olika läkemedel (se tabell II). Kosttillskottet johannesört (Hypericum perforatum) ska inte tas samtidigt med teofyllin, eftersom det kan leda till minskade teofyllinnivåer. Om patienter redan tar johannesört och teofyllin tillsammans, bör de rådfråga sin läkare innan de slutar ta johannesört, eftersom deras teofyllinkoncentrationer kan stiga när detta görs, vilket resulterar i toxicitet. Patienter bör instrueras att informera all vårdpersonal som är involverad i deras vård att de tar teofyllin, särskilt när ett läkemedel läggs till eller tas bort från behandlingen. Patienter bör instrueras att inte ändra dosen, tidpunkten för dosen eller administreringsfrekvensen utan att först rådfråga sin läkare. Om en dos glöms bort ska patienten instrueras att ta nästa dos vid den vanligtvis schemalagda tiden och att inte försöka kompensera för den missade dosen.
Uniphyl (teofyllin vattenfri tablett) ® tabletter kan tas en gång om dagen på morgonen eller kvällen. Det rekommenderas att Uniphyl (vattenfri teofyllintablett) tas i samband med måltid. Patienter bör informeras om att om de väljer att ta Uniphyl (vattenfri teofyllintablett) med mat bör den tas konsekvent med mat och om de tar den i fastande tillstånd bör den rutinmässigt tas fastande. Det är viktigt att produkten när den doseras doseras konsekvent med eller utan mat.
Uniphyl (vattenfri teofyllintablett) Tabletter får inte tuggas eller krossas eftersom det kan leda till en snabb frisättning av teofyllin med risk för toxicitet. Den skårade tabletten kan delas. Patienter som får Uniphyl (vattenfri teofyllintablett) tabletter kan passera en intakt matristablett i avföringen eller via kolostomi. Dessa matristabletter innehåller vanligtvis lite eller inget kvarvarande teofyllin.
