Proair Inhaler 100mcg Salbutamol Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är ProAir och hur används det?
ProAir är ett receptbelagt läkemedel som används för att behandla symtom på akut, svår eller ansträngningsutlöst astma (bronkospasm). ProAir kan användas ensamt eller tillsammans med andra läkemedel.
ProAir tillhör en klass av läkemedel som kallas PAH, PDE-5-hämmare, fosfodiesteras-5-enzymhämmare.
Det är inte känt om ProAir är säkert och effektivt för barn yngre än 4 år.
Vilka är de möjliga biverkningarna av ProAir?
ProAir kan orsaka allvarliga biverkningar inklusive:
- väsande andning,
- kvävning,
- andra andningsproblem,
- bröstsmärta,
- snabb puls,
- bultande hjärtslag eller fladdrande i bröstet,
- svår huvudvärk,
- dunkar i nacken eller öronen,
- smärta eller sveda när du kissar,
- ökad törst,
- ökad urinering,
- torr mun,
- fruktig andedräkt lukt,
- kramper i benen,
- förstoppning,
- oregelbundna hjärtslag,
- ökad törst eller urinering,
- domningar eller stickningar, och
- muskelsvaghet eller slapp känsla
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av ProAir inkluderar:
- bröstsmärta,
- snabba eller bultande hjärtslag,
- yrsel,
- känner sig skakig eller nervös,
- huvudvärk,
- ryggont,
- kroppssmärtor,
- orolig mage,
- öm hals,
- sinus smärta, och
- rinnande eller täppt näsa
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av ProAir. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
Den aktiva ingrediensen i ProAir HFA (albuterolsulfat) Inhalationsaerosol är albuterolsulfat, ett racemiskt salt av albuterol. Albuterolsulfat har det kemiska namnet α -[(tert-butylamino) methyl]-4-hydroxi-m-xylen-α,α'-diol sulfate (2:1) (salt), och har följande kemiska struktur:
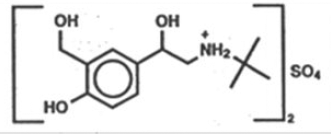
Molekylvikten för albuterolsulfat är 576,7 och den empiriska formeln är (C13H21NO3)2 •H2SO4. Albuterolsulfat är ett vitt till benvitt kristallint pulver. Det är lösligt i vatten och något lösligt i etanol. Albuterolsulfat är det officiella generiska namnet i USA, och salbutamolsulfat är det av Världshälsoorganisationens rekommenderade generiska namnet. ProAir HFA Inhalation Aerosol är en trycksatt aerosolenhet med uppmätt dos med dosräknare. ProAir HFA är endast för oral inhalation. Den innehåller en mikrokristallin suspension av albuterolsulfat i drivmedlet HFA-134a (1, 1, 1, 2-tetrafluoretan) och etanol.
Prime inhalatorn innan den används för första gången och i fall där inhalatorn inte har använts på mer än 2 veckor genom att släppa tre sprayer i luften, bort från ansiktet. Efter priming levererar varje aktivering 108 mcg albuterolsulfat från manöverorganets munstycke (motsvarande 90 mcg albuterolbas). Varje kapsel ger 200 manöver (inhalationer).
Denna produkt innehåller inte klorfluorkolväten (CFC) som drivmedel.
INDIKATIONER
Bronkospasm
PROAIR HFA Inhalationsaerosol är indicerat för behandling eller förebyggande av bronkospasm hos patienter 4 år och äldre med reversibel obstruktiv luftvägssjukdom.
Träningsutlöst bronkospasm
PROAIR HFA inhalationsaerosol är indicerat för att förebygga ansträngningsutlöst bronkospasm hos patienter 4 år och äldre.
DOSERING OCH ADMINISTRERING
Bronkospasm
För behandling av akuta episoder av bronkospasm eller förebyggande av symtom associerade med bronkospasm, är den vanliga dosen för vuxna och barn 4 år och äldre två inhalationer som upprepas var 4:e till 6:e timme. Frekventare administrering eller ett större antal inhalationer rekommenderas inte. Hos vissa patienter kan en inhalation var 4:e timme vara tillräckligt.
Träningsutlöst bronkospasm
Den vanliga dosen för vuxna och barn 4 år eller äldre är två inhalationer 15 till 30 minuter före träning.
Administrationsinformation
Administrera PROAIR HFA endast genom oral inandning. Skaka ordentligt före varje spray. För att upprätthålla korrekt användning av denna produkt och för att förhindra ansamling av medicin och blockering är det viktigt att följa rengöringsanvisningarna noggrant.
Grundning
Prime inhalatorn innan den används för första gången och i fall där inhalatorn inte har använts på mer än 2 veckor genom att släppa tre sprayer i luften, bort från ansiktet.
Rengöring
Som med alla HFA-innehållande albuterol-inhalatorer är det viktigt att rengöra plastmunstycket regelbundet för att upprätthålla korrekt användning av denna produkt och för att förhindra att mediciner bildas och blockeras. Inhalatorn kan sluta leverera medicin om plastmanöverdonets munstycke inte rengörs och torkas ordentligt. Rengöring: Tvätta plastmunstycket med varmt rinnande vatten i 30 sekunder, skaka av överflödigt vatten och lufttorka noggrant minst en gång i veckan. Om patienten har mer än en PROAIR HFA-inhalator ska patienten tvätta var och en separat för att förhindra att fel behållare sätts fast på fel plastmanöverdon. På så sätt kan patienten vara säker på att alltid veta det korrekta antalet återstående doser. Fäst aldrig en behållare med medicin från någon annan inhalator till PROAIR HFA-ställdonet och anslut aldrig PROAIR HFA-behållaren till ett ställdon från någon annan inhalator. Om munstycket blir blockerat kommer blockeringen att avlägsnas genom att tvätta munstycket. Om det är nödvändigt att använda inhalatorn innan den är helt torr, skaka av överflödigt vatten, byt ut behållaren, spraya två gånger i luften bort från ansiktet och ta den föreskrivna dosen. Efter sådan användning ska munstycket tvättas om och tillåtas lufttorka ordentligt. [ser FDA-godkänd patientmärkning ].
Dosräknare
PROAIR HFA har en dosräknare ansluten till ställdonet. När patienten tar emot inhalatorn kommer en svart prick att dyka upp i visningsfönstret tills den har förbehandlats 3 gånger, då kommer siffran 200 att visas. Dosräknaren kommer att räkna ner varje gång en spray släpps. När dosräknaren når 20 kommer färgen på siffrorna att ändras till röd för att påminna patienten om att kontakta sin farmaceut för påfyllning av medicin eller konsultera sin läkare för att få en receptpåfyllning.
När dosräknaren når 0 ändras bakgrunden till fast röd. PROAIR HFA-inhalator ska kasseras när dosräknaren visar 0 eller efter utgångsdatumet på produkten, beroende på vilket som inträffar först.
HUR LEVERERAS
Doseringsformer och styrkor
PROAIR HFA är en inhalationsaerosol. PROAIR HFA levereras som en trycksatt aluminiumbehållare på 8,5 g/200 manöverdon med ett rött ställdon av plast med dosräknare och vit dammlock vardera i lådor om en. Varje aktivering levererar 120 mcg albuterolsulfat från kanisterventilen och 108 mcg albuterolsulfat från manöverorganets munstycke (motsvarande 90 mcg albuterolbas).
Förvaring & Hantering
PROAIR HFA (albuterolsulfat) Inandning Aerosol levereras som en trycksatt aluminiumkapsel med ett rött plastmanöverdon med dosräknare och vitt dammlock vardera i lådor om en. Varje behållare innehåller 8,5 g av formuleringen och ger 200 manövreringar ( NDC 59310-579-22). Varje aktivering levererar 120 mcg albuterolsulfat från kanisterventilen och 108 mcg albuterolsulfat från manöverorganets munstycke (motsvarande 90 mcg albuterolbas).
SKAKA VÄL INNAN ANVÄNDNING. Förvara mellan 15° och 25°C (59° och 77°F). Innehåll under press. Får inte punktera eller bränna. Skydda mot minusgrader och långvarig exponering för direkt solljus. Exponering för temperaturer över 120°F kan orsaka sprickbildning. För bästa resultat bör behållaren vara i rumstemperatur före användning. Undvik att spraya i ögonen. Förvara utom räckhåll för barn.
Ser FDA-godkänd patientmärkning för grundnings- och rengöringsinstruktioner.
Det röda ställdonet som medföljer PROAIR HFA inhalationsaerosol ska inte användas med behållaren från några andra inhalationsaerosolprodukter. PROAIR HFA inhalationsaerosolbehållare ska inte användas med ställdonet från andra inhalationsaerosolprodukter.
PROAIR HFA-inhalatorn har en dosräknare ansluten till ställdonet. Patienter ska aldrig försöka ändra siffrorna för dosräknaren eller manipulera stiftmekanismen inuti ställdonet. Kassera PROAIR HFA-inhalatorn när räknaren visar 0 eller efter utgångsdatumet på produkten, beroende på vilket som inträffar först. Den märkta mängden medicin i varje aktivering kan inte garanteras efter att räknaren visar 0, även om behållaren inte är helt tom och kommer att fortsätta att fungera. Doppa aldrig ned behållaren i vatten för att avgöra hur full behållaren är ("flyttest").
PROAIR HFA Inandning Aerosol innehåller inte klorfluorkolväten (CFC) som drivmedel.
Mktd av: Teva Respiratory, LLC, Frazer, PA 19355. Tillverkad av: IVAX Pharmaceuticals Ireland Waterford, Irland. Reviderad: februari 2019
BIEFFEKTER
Användning av PROAIR HFA kan vara förknippad med följande:
- Paradoxal bronkospasm [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kardiovaskulära effekter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Omedelbara överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hypokalemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Totalt 1090 försökspersoner behandlades med PROAIR HFA inhalationsaerosol, eller med samma formulering av albuterol som i PROAIR HFA inhalationsaerosol, under det världsomspännande kliniska utvecklingsprogrammet.
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Vuxna och ungdomar 12 år och äldre
Biverkningsinformationen som presenteras i tabellen nedan om PROAIR HFA inhalationsaerosol härrör från en 6-veckors blindad studie som jämförde PROAIR HFA inhalationsaerosol (180 mcg fyra gånger dagligen) med en dubbelblind matchad placebo HFA-inhalationsaerosol och en utvärderingsblindad marknadsförd aktiv komparator HFA-134a albuterolinhalator hos 172 astmatiska patienter i åldern 12 till 76 år. Tabellen listar förekomsten av alla biverkningar (oavsett om det anses av utredarens läkemedelsrelaterade eller orelaterade till läkemedlet) från denna studie som inträffade med en frekvens av 3 % eller mer i PROAIR HFA-inhalationsaerosolbehandlingsgruppen och mer frekvent i PROAIR HFA Inhalation Aerosolbehandlingsgruppen än i den matchade placebogruppen. Sammantaget var incidensen och arten av de biverkningar som rapporterats för PROAIR HFA inhalationsaerosol och den marknadsförda aktiva komparatorn HFA-134a albuterolinhalatorn jämförbara.
Incidens av negativa upplevelser (% av patienterna) i en sexveckors klinisk prövning*
Biverkningar som rapporterades av mindre än 3 % av patienterna som fick PROAIR HFA inhalationsaerosol men av en större andel PROAIR HFA inhalationsaerosolpatienter än de matchade placebopatienterna, som har potential att vara relaterade till PROAIR HFA inhalationsaerosol, inkluderade bröstsmärtor, infektion, diarré, glossit, oavsiktlig skada (nervsystemet), ångest, dyspné, öronsjukdom, öronvärk och urinvägsinfektion.
I studier med små kumulativa doser var tremor, nervositet och huvudvärk de vanligast förekommande biverkningarna.
Pediatriska patienter i åldern 4 till 11 år
Biverkningar som rapporterades i en 3-veckors pediatrisk klinisk prövning som jämförde samma formulering av albuterol som i PROAIR HFA inhalationsaerosol (180 mikrogram albuterol fyra gånger dagligen) med en matchande placebo-HFA-inhalationsaerosol inträffade vid en låg incidensfrekvens (högst 2 % i den aktiva behandlingsgruppen) och liknade de som setts i studier för vuxna och ungdomar.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av PROAIR HFA efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering. Rapporter har inkluderat sällsynta fall av förvärrad bronkospasm, bristande effekt, astmaexacerbation (rapporterad dödlig i ett fall), muskelkramper och olika orofaryngeala biverkningar såsom halsirritation, förändrad smak, glossit, tungsår och munkavle.
Följande biverkningar har observerats vid användning av inhalerat albuterol efter godkännande: urtikaria, angioödem, hudutslag, bronkospasm, heshet, orofaryngealt ödem och arytmier (inklusive förmaksflimmer, supraventrikulär takykardi, extrasystoler). Dessutom kan albuterol, liksom andra sympatomimetiska medel, orsaka biverkningar såsom: angina, högt blodtryck eller hypotoni, hjärtklappning, stimulering av centrala nervsystemet, sömnlöshet, huvudvärk, nervositet, tremor, muskelkramper, uttorkning eller irritation av orofarynx, hypokalemi, hyperglykemi och metabolisk acidos.
LÄKEMEDELSINTERAKTIONER
Andra kortverkande sympatomimetiska bronkodilatatorer i aerosol bör inte användas samtidigt med PROAIR HFA inhalationsaerosol. Om ytterligare adrenerga läkemedel ska administreras på något sätt, bör de användas med försiktighet för att undvika skadliga kardiovaskulära effekter.
Betablockerare
Beta-adrenerga receptorblockerare blockerar inte bara den pulmonella effekten av beta-agonister, såsom PROAIR HFA inhalationsaerosol, utan kan ge allvarliga bronkospasmer hos astmatiska patienter. Patienter med astma ska därför normalt inte behandlas med betablockerare. Under vissa omständigheter, t.ex. som profylax efter hjärtinfarkt, kanske det inte finns några acceptabla alternativ till användning av beta-adrenerga blockerande medel hos patienter med astma. I denna inställning, överväg kardioselektiva betablockerare, även om de bör administreras med försiktighet.
Diuretika
EKG-förändringar och/eller hypokalemi som kan bli resultatet av administrering av icke-kaliumsparande diuretika (såsom loop- eller tiaziddiuretika) kan förvärras akut av beta-agonister, särskilt när den rekommenderade dosen av beta-agonisten överskrids. Även om den kliniska betydelsen av dessa effekter inte är känd, rekommenderas försiktighet vid samtidig administrering av beta-agonister och icke-kaliumsparande diuretika. Överväg att övervaka kaliumnivåerna.
Digoxin
Genomsnittliga minskningar på 16 % och 22 % i serumdigoxinnivåer påvisades efter engångsdos intravenös respektive oral administrering av albuterol till normala frivilliga som hade fått digoxin i 10 dagar. Den kliniska betydelsen av dessa fynd för patienter med obstruktiv luftvägssjukdom som får albuterol och digoxin på kronisk basis är oklar. Icke desto mindre skulle det vara klokt att noggrant utvärdera digoxinnivåerna i serum hos patienter som för närvarande får digoxin och PROAIR HFA inhalationsaerosol.
Monoaminoxidashämmare eller tricykliska antidepressiva medel
PROAIR HFA Inhalation Aerosol ska administreras med yttersta försiktighet till patienter som behandlas med monoaminoxidashämmare eller tricykliska antidepressiva medel, eller inom 2 veckor efter utsättning av sådana medel, eftersom effekten av albuterol på det kardiovaskulära systemet kan förstärkas. Överväg alternativ behandling hos patienter som tar MAO-hämmare eller tricykliska antidepressiva medel.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Paradoxal bronkospasm
PROAIR HFA Inandning Aerosol kan producera paradoxal bronkospasm som kan vara livshotande. Om paradoxal bronkospasm uppstår ska PROAIR HFA inhalationsaerosol avbrytas omedelbart och alternativ behandling sättas in. Det bör erkännas att paradoxal bronkospasm, när den förknippas med inhalerade formuleringar, ofta inträffar vid den första användningen av en ny kapsel.
Försämring av astma
Astma kan försämras akut under en period av timmar eller kroniskt under flera dagar eller längre. Om patienten behöver fler doser av PROAIR HFA inhalationsaerosol än vanligt, kan detta vara en markör för destabilisering av astma och kräver en omvärdering av patienten och behandlingsregimen, med särskild hänsyn till det eventuella behovet av antiinflammatorisk behandling, t.ex. kortikosteroider.
Användning av antiinflammatoriska medel
Enbart användning av beta-adrenerga agonistiska bronkodilatorer kanske inte är tillräcklig för att kontrollera astma hos många patienter. Tidiga överväganden bör övervägas att lägga till antiinflammatoriska medel, t.ex. kortikosteroider, till den terapeutiska regimen.
Kardiovaskulära effekter
PROAIR HFA Inhalation Aerosol, liksom andra beta-adrenerga agonister, kan ge kliniskt signifikanta kardiovaskulära effekter hos vissa patienter mätt som pulsfrekvens, blodtryck och/eller symtom. Även om sådana effekter är ovanliga efter administrering av PROAIR HFA inhalationsaerosol i rekommenderade doser, kan läkemedlet behöva avbrytas om de inträffar. Dessutom har beta-agonister rapporterats ge EKG-förändringar, såsom tillplattad T-våg, förlängning av QTc-intervallet och ST-segmentdepression. Den kliniska betydelsen av dessa fynd är okänd. Därför bör PROAIR HFA inhalationsaerosol, liksom alla sympatomimetiska aminer, användas med försiktighet hos patienter med kardiovaskulära störningar, särskilt kranskärlssvikt, hjärtarytmier och hypertoni.
Överskrid inte rekommenderad dos
Dödsfall har rapporterats i samband med överdriven användning av inhalerade sympatomimetika hos patienter med astma. Den exakta dödsorsaken är okänd, men hjärtstopp efter en oväntad utveckling av en allvarlig akut astmatisk kris och efterföljande hypoxi misstänks.
Omedelbara överkänslighetsreaktioner
Omedelbara överkänslighetsreaktioner kan uppstå efter administrering av albuterolsulfat, vilket har visat sig i sällsynta fall av urtikaria, angioödem, hudutslag, bronkospasm, anafylaxi och orofaryngealt ödem. Risken för överkänslighet måste beaktas i den kliniska utvärderingen av patienter som upplever omedelbara överkänslighetsreaktioner när de får PROAIR HFA inhalationsaerosol.
Samexisterande förhållanden
PROAIR HFA Inhalationsaerosol, liksom alla sympatomimetiska aminer, bör användas med försiktighet hos patienter med kardiovaskulära störningar, särskilt kranskärlssvikt, hjärtarytmier och hypertoni; hos patienter med konvulsiva störningar, hypertyreos eller diabetes mellitus; och hos patienter som är ovanligt känsliga för sympatomimetiska aminer. Kliniskt signifikanta förändringar i systoliskt och diastoliskt blodtryck har setts hos enskilda patienter och kan förväntas inträffa hos vissa patienter efter användning av någon beta-adrenerg bronkodilator. Stora doser av intravenös albuterol har rapporterats förvärra redan existerande diabetes mellitus och ketoacidos.
Hypokalemi
Som med andra beta-agonister kan PROAIR HFA inhalationsaerosol orsaka signifikant hypokalemi hos vissa patienter, möjligen genom intracellulär shunting, vilket har potential att ge negativa kardiovaskulära effekter. Minskningen är vanligtvis övergående och kräver inte tillskott.
Information om patientrådgivning
Ser FDA-godkänd patientmärkning
Patienterna bör ges följande information:
Användningsfrekvens
Verkan av PROAIR HFA inhalationsaerosol bör pågå i 4 till 6 timmar. Använd inte PROAIR HFA inhalationsaerosol oftare än vad som rekommenderas. Instruera patienterna att inte öka dosen eller frekvensen av doser av PROAIR HFA inhalationsaerosol utan att rådfråga läkare. Om patienter upptäcker att behandling med PROAIR HFA inhalationsaerosol blir mindre effektiv för symtomlindring, symtomen blir värre och/eller de behöver använda produkten oftare än vanligt, bör de omedelbart uppsöka läkare.
Grundning och rengöring
Grundning
Priming är väsentlig för att säkerställa lämplig albuterolhalt i varje aktivering. Instruera patienterna att förbereda inhalatorn innan den används för första gången och i fall där inhalatorn inte har använts på mer än 2 veckor genom att släppa tre sprayer i luften, bort från ansiktet.
Rengöring
För att säkerställa korrekt dosering och förhindra blockering av ställdonets öppning, instruera patienterna att tvätta det röda ställdonets munstycke av plast och torka noggrant minst en gång i veckan. Instruera patienterna att om de har mer än en PROAIR HFA-inhalator ska de tvätta var och en vid olika tidpunkter för att förhindra att fel behållare fästs på fel plastmanöverdon. På så sätt kan de vara säkra på att de alltid kommer att veta det korrekta antalet återstående doser. Patienter ska instrueras att aldrig fästa en medicinbehållare från någon annan inhalator till PROAIR HFA-manöverdonet och aldrig fästa PROAIR HFA-behållaren på ett manöverdon från någon annan inhalator. Patienter bör inte ta bort behållaren från ställdonet förutom under rengöring eftersom återmontering kan släppa ut en dos i luften och dosräknaren kommer att räkna ner varje gång en spray släpps. Detaljerade rengöringsinstruktioner finns i den illustrerade informationen till patientbroschyren.
Dosräknare
Patienterna ska informeras om att PROAIR HFA har en dosräknare kopplad till ställdonet. När patienten tar emot inhalatorn kommer en svart prick att dyka upp i visningsfönstret tills den har förbehandlats 3 gånger, då kommer siffran 200 att visas. Dosräknaren kommer att räkna ner varje gång en spray släpps. Dosräknarfönstret visar antalet sprayer som finns kvar i inhalatorn i enheter om två (t.ex. 200, 198, 196, etc). När räkneverket visar 20 kommer färgen på siffrorna att ändras till rött för att påminna patienten om att kontakta sin farmaceut för påfyllning av medicin eller konsultera sin läkare för att få påfyllning av recept. När dosräknaren når 0 ändras bakgrunden till fast röd. Patienter ska informeras om att kassera PROAIR HFA-inhalatorn när dosräknaren visar 0 eller efter utgångsdatumet på produkten, beroende på vilket som inträffar först.
Paradoxal bronkospasm
Informera patienterna om att PROAIR HFA inhalationsaerosol kan ge paradoxal bronkospasm. Instruera patienterna att avbryta behandlingen med PROAIR HFA inhalationsaerosol om paradoxal bronkospasm uppstår.
Samtidig droganvändning
Medan patienter tar PROAIR HFA inhalationsaerosol ska andra inhalationsläkemedel och astmamediciner endast tas enligt läkares anvisningar.
Vanliga biverkningar
Vanliga biverkningar av behandling med inhalerat albuterol inkluderar hjärtklappning, bröstsmärtor, snabb hjärtfrekvens, tremor eller nervositet.
Graviditet
Patienter som är gravida eller ammar bör kontakta sin läkare om användningen av PROAIR HFA inhalationsaerosol.
Det finns ett graviditetsexponeringsregister som övervakar graviditetsutfall hos kvinnor som exponerats för astmamediciner under graviditeten [se Användning i specifika populationer ].
Allmän information om användning
Effektiv och säker användning av PROAIR HFA inhalationsaerosol inkluderar en förståelse för hur den ska administreras.
Skaka ordentligt före varje spray.
Använd endast PROAIR HFA inhalationsaerosol med ställdonet som medföljer produkten. Kassera PROAIR HFA-inhalatorn när dosräknaren visar 0 eller efter utgångsdatumet på produkten, beroende på vilket som inträffar först. Doppa aldrig ned behållaren i vatten för att avgöra hur full behållaren är ("flyttest").
Generellt sett liknar tekniken för administrering av PROAIR HFA inhalationsaerosol till barn den för vuxna. Barn ska använda PROAIR HFA inhalationsaerosol under vuxens övervakning, enligt instruktioner från patientens läkare.
FDA-godkänd patientmärkning
Se avrivning illustrerad Information till patienten folder.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
en 2-årig studie på Sprague-Dawley-råttor orsakade albuterolsulfat en dosrelaterad ökning av incidensen av benigna leiomyom i mesovarium vid och över dietdoser på 2 mg/kg (ungefär 15 gånger och 6 gånger den maximala rekommenderade människan daglig inhalationsdos (MRHDID) för vuxna respektive barn, på en mg/m²-basis). I en annan studie blockerades denna effekt av samtidig administrering av propranolol, en icke-selektiv beta-adrenerg antagonist. I en 18-månaders studie på CD-1 möss visade albuterolsulfat inga tecken på tumörframkallande egenskaper vid dietdoser på upp till 500 mg/kg (ungefär 1 900 gånger respektive 740 gånger MRHDID för vuxna och barn, på en mg/m²) grund). I en 22-månaders studie på gyllene hamstrar visade albuterolsulfat inga tecken på tumörframkallande egenskaper vid kostdoser på upp till 50 mg/kg (ungefär 250 gånger respektive 100 gånger MRHDID för vuxna och barn, på mg/m²-basis) .
Albuterolsulfat var inte mutagent i Ames-testet eller ett mutationstest i jäst. Albuterolsulfat var inte klastogent i en human perifer lymfocytanalys eller i en AH1-stam mikronukleusanalys.
Reproduktionsstudier på råttor visade inga tecken på nedsatt fertilitet vid orala doser upp till 50 mg/kg (ungefär 380 gånger MRHDID för vuxna på mg/m²-basis).
Användning i specifika populationer
Graviditet
Registret för graviditetsexponering
Det finns ett graviditetsexponeringsregister som övervakar graviditetsutfall hos kvinnor som exponerats för astmamediciner under graviditeten. För mer information, kontakta Mothers To Baby Pregnancy Studies utförda av Organisation of Teratology Information Specialists på 1-877-311-8972 eller besök http://mothertobaby.org/pregnancystudies/.
Risksammanfattning
Det finns inga randomiserade kliniska studier av användning av albuterol under graviditet. Tillgängliga data från publicerade epidemiologiska studier och fallrapporter efter marknadsföring av graviditetsresultat efter inhalerad albuterolanvändning visar inte konsekvent en risk för allvarliga fosterskador eller missfall. Det finns kliniska överväganden med användning av albuterol hos gravida kvinnor [se Kliniska överväganden ]. I reproduktionsstudier på djur, när albuterolsulfat administrerades subkutant till gravida möss, fanns det tecken på gomspalt vid mindre än och upp till 9 gånger den maximala rekommenderade humana dagliga inhalationsdosen (MRHDID) [se Data ].
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den eller de indikerade populationerna är okänd. I den allmänna befolkningen i USA är den uppskattade risken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 till 4 % respektive 15 till 20 %.
Kliniska överväganden
Sjukdomsrelaterad risk för mödrar och/eller embryon/foster
Hos kvinnor med dåligt eller måttligt kontrollerad astma finns en ökad risk för havandeskapsförgiftning hos modern och prematuritet, låg födelsevikt och liten för graviditetsåldern hos den nyfödda. Gravida kvinnor bör övervakas noggrant och medicineringen justeras vid behov för att bibehålla optimal kontroll.
Arbetskraft eller leverans
På grund av risken för beta-agonistinterferens med uterus kontraktilitet, bör användning av PROAIR HFA inhalationsaerosol för lindring av bronkospasm under förlossningen begränsas till de patienter hos vilka fördelarna klart överväger risken. PROAIR HFA Inhalationsaerosol har inte godkänts för hantering av för tidigt förlossningsarbete. Allvarliga biverkningar, inklusive lungödem, har rapporterats under eller efter behandling av för tidig förlossning med beta2-agonister, inklusive albuterol.
Data
Djurdata
en reproduktionsstudie på mus gav subkutant administrerat albuterolsulfat bildning av gomspalt hos 5 av 111 (4,5 %) foster vid en exponering för nio tiondelar av MRHDID för vuxna (på en mg/m²-basis vid en moderns dos på 0,25 mg/kg ) och hos 10 av 108 (9,3 %) foster vid ungefär 9 gånger MRHDID (på en mg/m²-basis vid en moderns dos på 2,5 mg/kg). Liknande effekter observerades inte vid ungefär en elfte av MRHDID för vuxna (på en mg/m² basis vid en modern dos på 0,025 mg/kg). Gomspalt förekom också hos 22 av 72 (30,5 %) foster från honor som behandlats subkutant med isoproterenol (positiv kontroll).
I en reproduktionsstudie på kanin inducerade oralt administrerat albuterolsulfat kranioschisis hos 7 av 19 foster (37 %) vid cirka 750 gånger MRHDID (på en mg/m² basis vid en moderns dos på 50 mg/kg).
en reproduktionsstudie på råttor gav en albuterolsulfat/HFA-134a-formulering administrerad genom inhalation inga teratogena effekter vid exponeringar ungefär 80 gånger MRHDID (på mg/m² basis vid en modern dos på 10,5 mg/kg).
En studie där gravida råttor doserades med radiomärkt albuterolsulfat visade att läkemedelsrelaterat material överförs från moderns cirkulation till fostret.
Laktation
Risksammanfattning
Det finns inga tillgängliga data om förekomsten av albuterol i bröstmjölk, effekterna på det ammade barnet eller effekterna på mjölkproduktionen. Plasmanivåerna av albuterol efter inhalerade terapeutiska doser är dock låga hos människor, och om det finns i bröstmjölk har albuterol en låg oral biotillgänglighet [se KLINISK FARMAKOLOGI ].
Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av albuterol och eventuella negativa effekter på det ammade barnet från albuterol eller från det underliggande moderns tillståndet.
Pediatrisk användning
Säkerheten och effektiviteten av PROAIR HFA inhalationsaerosol för behandling eller förebyggande av bronkospasm hos barn 12 år och äldre med reversibel obstruktiv luftvägssjukdom baseras på en 6-veckors klinisk prövning med 116 patienter 12 år och äldre med astma. doser på 180 mcg fyra gånger dagligen med placebo, och en endosövergångsstudie som jämförde doser på 90, 180 och 270 mcg med placebo hos 58 patienter [se Kliniska studier ]. Säkerheten och effektiviteten av PROAIR HFA inhalationsaerosol för behandling av ansträngningsutlöst bronkospasm hos barn 12 år och äldre är baserad på en endosövergångsstudie på 24 vuxna och ungdomar med ansträngningsutlöst bronkospasm som jämför doser på 180 mikrogram med placebo [ser Kliniska studier ].
Säkerheten för PROAIR HFA inhalationsaerosol hos barn 4 till 11 år är baserad på en 3-veckors klinisk prövning på 50 patienter 4 till 11 år med astma med samma formulering av albuterol som i PROAIR HFA inhalationsaerosol som jämför doser av 180 mcg fyra gånger dagligen med placebo. Effektiviteten av PROAIR HFA inhalationsaerosol hos barn 4 till 11 år är extrapolerad från kliniska prövningar på patienter 12 år och äldre med astma och ansträngningsutlöst bronkospasm, baserat på data från en endosstudie som jämför den bronkodilatoriska effekten av PROAIR HFA 90 mcg och 180 mcg med placebo hos 55 patienter med astma och en 3-veckors klinisk prövning med samma formulering av albuterol som i PROAIR HFA inhalationsaerosol hos 95 astmatiska barn 4 till 11 år, jämfört med en dos på 180 mcg albuterol fyra gånger dagligen med placebo [se Kliniska studier ].
Säkerheten och effektiviteten av PROAIR HFA inhalationsaerosol hos pediatriska patienter under 4 år har inte fastställts.
Geriatrisk användning
Kliniska studier av PROAIR HFA inhalationsaerosol inkluderade inte tillräckligt många patienter i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre patienter. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Alla beta2-adrenerga agonister, inklusive albuterol, är kända för att väsentligen utsöndras via njurarna, och risken för toxiska reaktioner kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen.
ÖVERDOS
De förväntade symtomen vid överdosering är de med överdriven betaadrenerg stimulering och/eller förekomst eller överdrift av något av symtomen listade under BIVERKNINGAR, t.ex. kramper, angina, högt blodtryck eller hypotoni, takykardi med hastigheter upp till 200 slag per minut, arytmier, nervositet , huvudvärk, tremor, muntorrhet, hjärtklappning, illamående, yrsel, trötthet, sjukdomskänsla och sömnlöshet.
Hypokalemi kan också förekomma. Som med alla sympatomimetiska läkemedel kan hjärtstillestånd och till och med dödsfall vara förknippat med missbruk av PROAIR HFA inhalationsaerosol.
Behandlingen består av utsättande av PROAIR HFA inhalationsaerosol tillsammans med lämplig symtomatisk behandling. En klok användning av en kardioselektiv beta-receptorblockerare kan övervägas, med tanke på att sådan medicinering kan ge bronkospasm. Det finns inte tillräckligt med bevis för att avgöra om dialys är fördelaktigt för överdosering av PROAIR HFA inhalationsaerosol.
Den orala dödliga dosen av albuterolsulfat hos möss är högre än 2 000 mg/kg (cirka 6 800 gånger den maximala rekommenderade dagliga inhalationsdosen för vuxna på en mg/m²-basis och cirka 3 200 gånger den maximala rekommenderade dagliga inhalationsdosen för barn på en mg /m² basis). Hos mogna råttor är den subkutana medianletala dosen av albuterolsulfat cirka 450 mg/kg (ungefär 3 000 gånger den maximala rekommenderade dagliga inhalationsdosen för vuxna på mg/m²-basis och cirka 1 400 gånger den maximala rekommenderade dagliga inhalationsdosen för barn på en mg/m²). Hos unga råttor är den subkutana medianletala dosen cirka 2 000 mg/kg (cirka 14 000 gånger den maximala rekommenderade dagliga inhalationsdosen för vuxna på en mg/m²-basis och cirka 6 400 gånger den maximala rekommenderade dagliga inhalationsdosen för barn på en mg/m² grund). Den dödliga mediandosen för inhalation har inte fastställts hos djur.
KONTRAINDIKATIONER
PROAIR HFA inhalationsaerosol är kontraindicerat hos patienter med en historia av överkänslighet mot albuterol och andra PROAIR HFA inhalationsaerosolkomponenter. Sällsynta fall av överkänslighetsreaktioner, inklusive urtikaria, angioödem och hudutslag har rapporterats efter användning av albuterolsulfat [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Albuterolsulfat är en beta 2-adrenerg agonist. De farmakologiska effekterna av albuterolsulfat kan tillskrivas aktivering av beta 2-adrenerga receptorer på glatt muskulatur i luftvägarna. Aktivering av beta2-adrenerga receptorer leder till aktivering av adenylcyklas och till en ökning av den intracellulära koncentrationen av cykliskt-3', 5'-adenosinmonofosfat (cykliskt AMP). Denna ökning av cykliskt AMP är associerad med aktiveringen av proteinkinas A, som i sin tur hämmar fosforyleringen av myosin och sänker intracellulära joniska kalciumkoncentrationer, vilket resulterar i muskelavslappning. Albuterol slappnar av den glatta muskulaturen i alla luftvägar, från luftstrupen till de terminala bronkiolerna. Albuterol fungerar som en funktionell antagonist för att slappna av i luftvägarna oavsett vilken spasmogen som är inblandad och skyddar på så sätt mot alla bronkokonstriktorproblem. Ökade koncentrationer av cykliskt AMP är också associerade med hämning av frisättning av mediatorer från mastceller i luftvägarna. Även om det är känt att beta2adrenerga receptorer är de dominerande receptorerna på bronkial glatt muskulatur, indikerar data att det finns betareceptorer i det mänskliga hjärtat, varav 10% till 50% är hjärt-beta2-adrenerga receptorer. Den exakta funktionen av dessa receptorer har inte fastställts [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Albuterol har i de flesta kontrollerade kliniska prövningar visat sig ha mer effekt på luftvägarna, i form av bronkial glattmuskelavslappning, än isoproterenol vid jämförbara doser samtidigt som det ger färre kardiovaskulära effekter. Men inhalerad albuterol, liksom andra beta-adrenerga agonistläkemedel, kan ge en signifikant kardiovaskulär effekt hos vissa patienter, mätt med pulsfrekvens, blodtryck, symtom och/eller elektrokardiografiska förändringar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Farmakokinetik
De systemiska nivåerna av albuterol är låga efter inandning av rekommenderade doser. I en crossover-studie utförd på friska manliga och kvinnliga frivilliga, gav höga kumulativa doser av PROAIR HFA inhalationsaerosol (1 080 mcg albuterolbas administrerad under en timme) genomsnittliga maximala plasmakoncentrationer (Cmax) och systemisk exponering (AUCinf) på cirka 4 100 pg/ ml respektive 28 426 pg/ml*timme jämfört med cirka 3 900 pg/mL respektive 28 395 pg/ml*timme efter samma dos av en aktiv HFA-134a albuterolinhalatorjämförare. Den terminala plasmahalveringstiden för albuterol levererad av PROAIR HFA inhalationsaerosol var cirka 6 timmar. Jämförelse av de farmakokinetiska parametrarna visade inga skillnader mellan produkterna.
Den farmakokinetiska profilen för PROAIR HFA inhalationsaerosol utvärderades i en tvåvägs cross-over studie på 11 friska pediatriska frivilliga, 4 till 11 år gamla. En enkeldosadministrering av PROAIR HFA inhalationsaerosol (180 mcg albuterolbas) gav ett minsta kvadratmedelvärde (SE) Cmax och AUC0-∞ på 1 100 (1,18) pg/mL respektive 5 120 (1,15) pg/mL*timme. Den minsta kvadratiska medelvärdet (SE) terminala plasmahalveringstiden för albuterol levererat av PROAIR HFA inhalationsaerosol var 166 (7,8) minuter.
Metabolism och eliminering
Information tillgänglig i den publicerade litteraturen tyder på att det primära enzymet som ansvarar för metabolismen av albuterol hos människor är SULTIA3 (sulfotransferas). När racemisk albuterol administrerades antingen intravenöst eller via inhalation efter oral koladministrering, fanns det en 3- till 4-faldig skillnad i området under koncentration-tidskurvorna mellan (R)- och (S)albuterol-enantiomererna, med (S) )-albuterolkoncentrationerna är konsekvent högre. Men utan kolförbehandling, efter antingen oral eller inhalationsadministrering, var skillnaderna 8- till 24-faldiga, vilket tyder på att (R)-albuterol företrädesvis metaboliseras i mag-tarmkanalen, förmodligen av SULTIA3.
Den primära elimineringsvägen för albuterol är genom renal utsöndring (80 % till 100 %) av antingen modersubstansen eller den primära metaboliten. Mindre än 20% av läkemedlet detekteras i avföringen. Efter intravenös administrering av racemisk albuterol utsöndrades mellan 25 % och 46 % av (R)-albuterolfraktionen av dosen som oförändrad (R)-albuterol i urinen.
Geriatrisk, pediatrisk, lever/njurfunktionsnedsättning
Inga farmakokinetiska studier för PROAIR HFA inhalationsaerosol har utförts på nyfödda eller äldre försökspersoner.
Effekten av nedsatt leverfunktion på farmakokinetiken för PROAIR HFA inhalationsaerosol har inte utvärderats.
Effekten av nedsatt njurfunktion på farmakokinetiken för albuterol utvärderades hos 5 försökspersoner med kreatininclearance på 7 till 53 ml/min, och resultaten jämfördes med de från friska frivilliga. Njursjukdom hade ingen effekt på halveringstiden, men det var en 67% minskning av albuterolclearance. Försiktighet bör iakttas vid administrering av höga doser av PROAIR HFA inhalationsaerosol till patienter med nedsatt njurfunktion [se Användning i specifika populationer ].
Djurtoxikologi och/eller farmakologi
Preklinisk
Intravenösa studier på råttor med albuterolsulfat har visat att albuterol passerar blod-hjärnbarriären och når hjärnkoncentrationer som uppgår till cirka 5 % av plasmakoncentrationerna. I strukturer utanför blod-hjärnbarriären (pineal och hypofys) visade sig albuterolkoncentrationerna vara 100 gånger högre än i hela hjärnan.
Studier på laboratoriedjur (minigrisar, gnagare och hundar) har visat förekomsten av hjärtarytmier och plötslig död (med histologiska tecken på myokardnekros) när β-agonister och metylxantiner administrerades samtidigt. Den kliniska betydelsen av dessa fynd är okänd.
Drivmedlet HFA-134a saknar farmakologisk aktivitet förutom vid mycket höga doser hos djur (380-1300 gånger den maximala mänskliga exponeringen baserat på jämförelser av AUC-värden), vilket främst ger ataxi, skakningar, dyspné eller salivutsöndring. Dessa liknar effekter som produceras av de strukturellt besläktade klorfluorkolvätena (CFC), som har använts flitigt i inhalatorer med uppmätta doser.
Hos djur och människor visade sig drivmedlet HFA-134a snabbt absorberas och snabbt elimineras, med en eliminationshalveringstid på 3-27 minuter hos djur och 5-7 minuter hos människor. Tiden till maximal plasmakoncentration (Tmax) och genomsnittlig uppehållstid är båda extremt korta vilket leder till ett övergående utseende av HFA-134a i blodet utan tecken på ackumulering.
Kliniska studier
Bronkospasm associerad med astma
Vuxna och ungdomar 12 år och äldre
I en 6-veckors, randomiserad, dubbelblind, placebokontrollerad studie jämfördes PROAIR HFA inhalationsaerosol (58 patienter) med en matchad placebo HFA inhalationsaerosol (58 patienter) hos astmatiska patienter 12 till 76 år i en dos av 180 mcg albuterol fyra gånger dagligen. En utvärderingsblind marknadsförd aktiv komparator HFA-134a albuterolinhalatorarm (56 patienter) inkluderades.
Seriella FEV1-mätningar, som visas nedan som procentuell förändring från testdagens baslinje vid dag 1 och dag 43, visade att två inhalationer av PROAIR HFA inhalationsaerosol gav en signifikant större förbättring av FEV1 jämfört med förbehandlingsvärdet än den matchade placebo, samt en jämförbar bronkdilaterande effekt med den marknadsförda aktiva komparatorn HFA-134a albuterolinhalator.
FEV1 som genomsnittlig procentuell förändring från testdagens fördos i en 6-veckors klinisk prövning Dag 1
PATIENTINFORMATION
PROAIR® HFA (pro' ar) (albuterolsulfat) Inandning Aerosol
Läs denna patientinformation innan du börjar använda PROAIR HFA och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling.
Vad är PROAIR HFA?
PROAIR HFA är ett receptbelagt läkemedel som används av personer 4 år och äldre för att:
- behandla eller förebygga bronkospasm hos personer som har reversibel obstruktiv luftvägssjukdom
- förhindra träningsinducerad bronkospasm
Det är inte känt om PROAIR HFA är säkert och effektivt hos barn under 4 år.
Vem ska inte använda PROAIR HFA?
Använd inte PROAIR HFA om du är allergisk mot albuterolsulfat eller någon av ingredienserna i PROAIR HFA. Se slutet av denna bipacksedel för en komplett lista över ingredienser i PROAIR HFA.
Vad ska jag berätta för min läkare innan jag använder PROAIR HFA?
Innan du använder PROAIR HFA, tala om för din läkare om du:
- har hjärtproblem
- har högt blodtryck (hypertoni)
- har kramper (kramper)
- har problem med sköldkörteln
- har diabetes
- har låga kaliumnivåer i ditt blod
- är gravid eller planerar att bli gravid. Det är inte känt om PROAIR HFA kommer att skada ditt ofödda barn. Tala med din läkare om du är gravid eller planerar att bli gravid.
- ammar eller planerar att amma. Det är inte känt om PROAIR HFA går över i din bröstmjölk. Tala med din läkare om det bästa sättet att mata ditt barn om du använder PROAIR HFA.
Berätta för din läkare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
PROAIR HFA och andra läkemedel kan påverka varandra och orsaka biverkningar. PROAIR HFA kan påverka hur andra läkemedel fungerar och andra läkemedel kan påverka hur PROAIR HFA fungerar.
Tala särskilt om för din läkare om du tar:
- andra inhalationsläkemedel eller astmamediciner
- betablockerare
- diuretika
- digoxin
- monoaminoxidashämmare
- tricykliska antidepressiva medel
Fråga din läkare eller apotekspersonal om en lista över dessa läkemedel om du är osäker.
Vet vilka mediciner du tar. Håll en lista över dem för att visa din läkare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag använda PROAIR HFA?
- För detaljerade instruktioner, se "Användningsinstruktioner" i slutet av denna patientinformation.
- Använd PROAIR HFA exakt som din läkare säger åt dig att använda det.
- Om ditt barn behöver använda PROAIR HFA, övervaka ditt barn noga för att se till att ditt barn använder inhalatorn på rätt sätt. Din läkare kommer att visa dig hur ditt barn ska använda PROAIR HFA.
- Varje dos av PROAIR HFA bör vara i upp till 4 timmar till 6 timmar.
- Låt bli öka din dos eller ta extra doser PROAIR HFA utan att först prata med din läkare.
- Få medicinsk hjälp direkt om PROAIR HFA inte längre hjälper dina symtom.
- Få medicinsk hjälp omedelbart om dina symtom blir värre eller om du behöver använda din inhalator oftare.
- Medan du använder PROAIR HFA, använd inte andra inhalerade räddningsmediciner och astmaläkemedel om inte din läkare säger åt dig att göra det.
- Ring din läkare om dina astmasymtom som väsande andning och andningssvårigheter blir värre under några timmar eller dagar. Din läkare kan behöva ge dig ett annat läkemedel (till exempel kortikosteroider) för att behandla dina symtom.
Vilka är de möjliga biverkningarna av PROAIR HFA?
PROAIR HFA kan orsaka allvarliga biverkningar, inklusive:
- förvärrade andningsbesvär, hosta och väsande andning (paradoxal bronkospasm). Om detta händer sluta använda PROAIR HFA och ring din läkare eller få akut hjälp omedelbart. Paradoxal bronkospasm är mer sannolikt att inträffa vid din första användning av en ny medicinbehållare.
- hjärtproblem inklusive snabbare puls och högre blodtryck
- möjlig död hos personer med astma som använder för mycket PROAIR HFA
- allergiska reaktioner. Ring din läkare omedelbart om du har följande symtom på en allergisk reaktion:
- kliande hud
- svullnad under huden eller i halsen
- utslag
- förvärrade andningsbesvär
- låga kaliumnivåer i ditt blod
- försämring av andra medicinska problem hos personer som också använder PROAIR HFA, inklusive blodsockerhöjningar
De vanligaste biverkningarna av PROAIR HFA inkluderar:
- ditt hjärta känns som om det bultar eller bultar (hjärtklappning)
- bröstsmärta
- snabb puls
- skakighet
- nervositet
- huvudvärk
- yrsel
- öm hals
- rinnande näsa
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av PROAIR HFA. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara PROAIR HFA?
- Förvara PROAIR HFA i rumstemperatur mellan 59°F och 77°F (15°C och 25°C).
- Undvik exponering för extrem värme och kyla.
- Skaka PROAIR HFA-behållaren väl före användning.
- Låt bli punktera PROAIR HFA-kapseln.
- Låt bli förvara PROAIR HFA-behållaren nära värme eller låga. Temperaturer över 120°F kan få kapseln att spricka.
- Låt bli kasta PROAIR HFA-behållaren i en eld eller en förbränningsugn.
- Undvik att spraya PROAIR HFA i dina ögon.
Förvara PROAIR HFA och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av PROAIR HFA
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte PROAIR HFA för ett tillstånd som det inte har ordinerats för. Ge inte PROAIR HFA till andra personer, även om de har samma symtom som du. Det kan skada dem.
Denna patientinformation sammanfattar den viktigaste informationen om PROAIR HFA. Om du vill ha mer information, prata med din läkare. Du kan fråga din apotekspersonal eller läkare om information om PROAIR HFA som är skriven för vårdpersonal.
För mer information, gå till www.ProAirHFA.com eller ring 1-888-482-9522.
Vilka är ingredienserna i PROAIR HFA?
Aktiv ingrediens: albuterolsulfat
Inaktiva ingredienser: drivmedel HFA-134a och etanol.
Användningsinstruktioner
PROAIR® HFA (pro' ar) (albuterolsulfat) Inandning Aerosol
Läs denna bruksanvisning innan du börjar använda PROAIR HFA och varje gång du får påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling.
Delarna av din PROAIR HFA-inhalator:
Det finns två huvuddelar av din PROAIR HFA-inhalator, inklusive en:
- rött plastmanöverdon som sprejar medicinen från kapseln. Se bild A.
- skyddande dammlock som täcker ställdonets munstycke. Se bild A.
Det finns också en metallbehållare som rymmer medicinen. Se bild A.
Det finns också en dosräknare fäst på baksidan av ställdonet med ett visningsfönster som visar hur många sprayer av medicin du har kvar. Se bild B.
Du kommer att se en svart prick i visningsfönstret på ställdonet tills enheten har förbehandlats 3 gånger. Se figur B och "Förbereda din PROAIR HFA-enhet" nedan.
Figur A och Figur B 
- Låt bli använd PROAIR HFA-ställdonet med en kanister med medicin från vilken annan inhalator som helst.
- Låt bli använd en PROAIR HFA-behållare med ett manöverdon från någon annan inhalator, inklusive en annan PROAIR HFA-inhalator.
Förbereda din PROAIR HFA-enhet:
Din PROAIR-enhet måste förberedas innan du använder den för första gången eller om din enhet inte har använts mer än 14 dagar i rad. Låt bli förbered din PROAIR HFA-enhet varje dag.
- Ta ut din PROAIR HFA-enhet ur förpackningen.
- Ta bort det skyddande dammskyddet från munstycket.
- Skaka inhalatorn väl och spraya den i luften bort från ansiktet. Se bild C.
Bild C 
- Skaka och spraya inhalatorn så här 2 gånger till för att klara den. Dosräknaren på ställdonet bör visa siffran 200 efter att du förbereder ställdonet för första gången. Se bild D.
Bild D 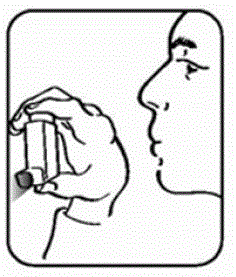
Varje gång du använder din PROAIR HFA-enhet:
- Se till att behållaren sitter stadigt i plastmanöverdonet.
- Titta in i munstycket för att säkerställa att det inte finns några främmande föremål där, särskilt om locket inte har använts för att täcka munstycket.
Läs av dosräknaren på ditt PROAIR HFA-ställdon
- Dosräknaren kommer att räkna ner varje gång en spray släpps. Dosräknarens fönster visar antalet sprayer kvar i din inhalator i enheter om 2 sprayer. Till exempel finns det 190 sprayer kvar om pilen är precis mitt emot siffran 190, eller 189 sprayer kvar om pilen pekar mellan 190 och 188. Se figur D.
- När dosräknaren når 0 fortsätter den att visa 0 och du bör byta ut din PROAIR HFA-enhet.
- Dosräknaren kan inte återställas och är permanent ansluten till ställdonet. Ändra aldrig siffrorna för dosräknaren eller rör vid stiftet inuti ställdonet.
- Låt bli ta bort behållaren från plastmanöverdonet förutom under rengöring. Återanslutning av behållaren till ställdonet kan av misstag släppa ut en dos PROAIR HFA i luften. Dosräknaren kommer att räkna ner varje gång en spray släpps.
Använda din PROAIR HFA-enhet:
Steg 1. Skaka inhalatorn väl före varje sprayning. Ta av locket från ställdonets munstycke.
Steg 2. Håll inhalatorn med munstycket nedåt. Se bild E.
Bild E 
Steg 3. Andas ut genom munnen och tryck så mycket luft från dina lungor som du kan. Sätt munstycket i munnen och stäng läpparna runt det. Se bild F.
Steg 4. Tryck ned toppen av behållaren hela vägen medan du andas in djupt och långsamt genom munnen. Se bild F.
Bild F 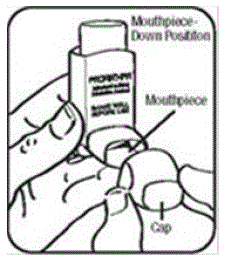
Steg 5. Direkt efter att sprayen kommer ut, ta bort fingret från behållaren. När du har andats in hela vägen, ta ut inhalatorn ur munnen och stäng munnen.
Steg 6. Håll andan så länge du kan, upp till 10 sekunder, andas sedan normalt.
Om din läkare har sagt att du ska använda fler sprayer, vänta 1 minut och skaka inhalatorn igen. Upprepa steg 2 till steg 6.
Steg 7. Sätt tillbaka locket på munstycket varje gång du använder inhalatorn. Se till att locket snäpper fast ordentligt.
Rengöra din PROAIR HFA-enhet:
Det är mycket viktigt att hålla plastmanöverdonet rent så att medicinen inte ansamlas och blockerar sprayen. Se figur G och figur H.
Figur G och Figur H 
- Försök inte att rengöra metallbehållaren eller låt den bli blöt. Inhalatorn kan sluta spraya om den inte rengörs på rätt sätt.
- Om du har mer än 1 PROAIR HFA-inhalator, tvätta varje enhet vid olika tidpunkter för att förhindra att fel behållare sätts ihop med fel plastmanöverdon. På så sätt kan du vara säker på att du alltid vet det korrekta antalet återstående doser av PROAIR HFA.
- Tvätta ställdonet minst 1 gång i veckan enligt följande:
- Ta ut behållaren ur ställdonet och ta av locket från munstycket.
- Håll ställdonet under kranen och kör varmt vatten genom den i cirka 30 sekunder. Se figur I.
Figur I 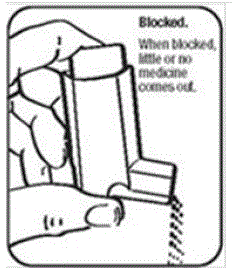
- Vänd ställdonet upp och ner och kör varmt vatten genom munstycket i cirka 30 sekunder. Se bild J.
Bild J 
- Skaka av så mycket vatten som möjligt från ställdonet. Titta in i munstycket för att försäkra dig om att all medicinansamling har sköljts bort helt. Om det finns någon ansamling, upprepa tvättråden.
- Låt ställdonet lufttorka helt, till exempel över natten. Se bild K.
Bild K 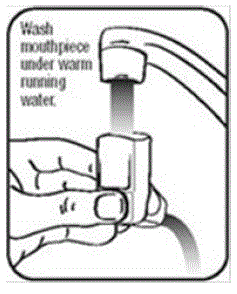
- När ställdonet är torrt, sätt behållaren i ställdonet och se till att den sitter stadigt. Skaka inhalatorn väl och spraya den två gånger i luften bort från ansiktet. Sätt tillbaka locket på munstycket.
Om du behöver använda din inhalator innan ställdonet är helt torrt:
- Skaka så mycket vatten från ställdonet som möjligt.
- Sätt behållaren i ställdonet och se till att den sitter stadigt.
- Skaka inhalatorn väl och spraya den två gånger i luften bort från ansiktet.
- Ta din PROAIR HFA-dos enligt ordination.
- Följ rengöringsinstruktionerna ovan.
Byta ut din PROAIR HFA-enhet
- När dosräknaren på ställdonet säger siffran 20, färgen på siffrorna ändras till röd. De röda siffrorna är för att påminna dig om att fylla på ditt recept eller be din läkare om ett annat recept för PROAIR HFA. När dosräknaren når 0 ändras bakgrundsfärgen till fast röd.
- Kasta PROAIR HFA-inhalatorn så snart dosräknaren säger 0 eller efter utgångsdatumet på PROAIR HFA-förpackningen, beroende på vilket som inträffar först. Du bör inte fortsätta använda inhalatorn efter 200 sprayningar även om behållaren kanske inte är helt tom. Du kan inte vara säker på att du kommer att få någon medicin efter att ha använt 200 sprayer.
- Använd inte inhalatorn efter utgångsdatumet på PROAIR HFA-förpackningen.
Denna patientinformation och bruksanvisning har godkänts av US Food and Drug Administration.
