Pulmicort 100mcg, 200mcg Budesonide Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Pulmicort 100mcg Turbuhaler och hur används det?
Pulmicort 100mcg Turbuhaler är ett receptbelagt läkemedel som används för att behandla symtom på astma. Pulmicort 100mcg Turbuhaler kan användas ensamt eller tillsammans med andra läkemedel.
Pulmicort Turbuhaler tillhör en klass av läkemedel som kallas kortikosteroider, inhalatorer.
Det är inte känt om Pulmicort Turbuhaler är säkert och effektivt för barn yngre än 1 år.
Vilka är de möjliga biverkningarna av Pulmicort 200mcg Turbuhaler?
Pulmicort 100mcg Turbuhaler kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- ovanlig trötthet,
- synproblem,
- lätta blåmärken eller blödningar,
- svullet ansikte,
- ovanlig hårväxt,
- humörförändringar,
- depression,
- humörsvängningar,
- agitation,
- muskelsvaghet eller smärta,
- tunn hud,
- långsam sårläkning, och
- ökad törst eller urinering
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Pulmicort 100mcg Turbuhaler inkluderar:
- torr, irriterad eller ont i halsen,
- heshet,
- röstförändringar,
- dålig smak i munnen,
- rinnande eller täppt näsa, och
- näsblod
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Pulmicort Turbuhaler. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Endast för oral inandning.
BESKRIVNING
Budesonid, den aktiva komponenten i PULMICORT TURBUHALER (budesonid) 200 mcg, är en kortikosteroid kemiskt betecknad som (RS)-11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion cyklisk 16,17 acetal med butyraldehyd. Budesonid tillhandahålls som en blandning av två epimerer (22R och 22S). Den empiriska formeln för budesonid är C25H34O6 och dess molekylvikt är 430,5. Dess strukturformel är:
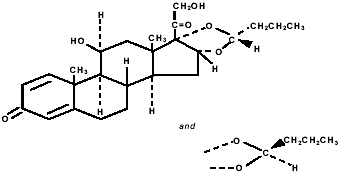
Budesonid är ett vitt till benvitt, smaklöst, luktfritt pulver som är praktiskt taget olösligt i vatten och i heptan, svårlösligt i etanol och fritt lösligt i kloroform. Dess fördelningskoefficient mellan oktanol och vatten vid pH 7,4 är 1,6 x 103.
PULMICORT 100mcg TURBUHALER (budesonid) är en inhalationsdriven flerdosinhalator för torrt pulver som endast innehåller mikroniserad budesonid. Varje aktivering av PULMICORT 100 mcg TURBUHALER ger 200 mcg budesonid per uppmätt dos, vilket ger cirka 160 mcg budesonid från munstycket (baserat på in vitro-testning vid 60 l/min i 2 sekunder).
In vitro-tester har visat att doseringen av PULMICORT 100 mcg TURBUHALER (budesonid) är väsentligt beroende av luftflödet genom enheten. Patientfaktorer som inspiratoriska flödeshastigheter kommer också att påverka dosen som levereras till lungorna hos patienter som faktiskt används (se Patientens bruksanvisning ). Hos vuxna patienter med astma (medelvärde FEV1 2,9 L [0,8 - 5,1 L]) var genomsnittligt maximalt inspiratoriskt flöde (PIF) genom PULMICORT TURBUHALER (budesonid) 78 (40-111) L/min. Liknande resultat (medelvärde PIF 82 [43-125] L/min) erhölls hos astmatiska barn (6 till 15 år, medel FEV1 2,1 L [0,9 - 5,4 L]). Patienter bör noggrant instrueras om användningen av denna läkemedelsprodukt för att säkerställa optimal dosleverans.
INDIKATIONER
PULMICORT TURBUHALER (budesonid) är indicerat för underhållsbehandling av astma som profylaktisk terapi hos vuxna och pediatriska patienter som är sex år eller äldre. Det är också indicerat för patienter som behöver oral kortikosteroidbehandling för astma. Många av dessa patienter kan med tiden minska eller eliminera sitt behov av orala kortikosteroider.
PULMICORT 100mcg TURBUHALER (budesonid) är INTE indicerat för lindring av akut bronkospasm.
DOSERING OCH ADMINISTRERING
PULMICORT 200 mcg TURBUHALER (budesonid) ska administreras oralt inhalerat till astmatiska patienter 6 år och äldre. Enskilda patienter kommer att uppleva en varierande debut och grad av symtomlindring. Generellt sett har PULMICORT TURBUHALER (budesonid) en relativt snabb insättande effekt för en inhalerad kortikosteroid. Förbättring av astmakontrollen efter inhalerad administrering av PULMICORT 200 mcg TURBUHALER (budesonid) kan inträffa inom 24 timmar efter påbörjad behandling, även om maximal nytta kanske inte uppnås efter 1 till 2 veckor eller längre. Säkerheten och effekten av PULMICORT TURBUHALER (budesonid) vid administrering i överskridande av rekommenderade doser har inte fastställts.
Den rekommenderade startdosen och den högsta rekommenderade dosen av PULMICORT TURBUHALER (budesonid), baserat på tidigare astmabehandling, listas i följande tabell.
*Hos patienter med mild till måttlig astma som är välkontrollerade på inhalerade kortikosteroider, kan dosering med PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg eller 400 mcg en gång dagligen övervägas. PULMICORT 200mcg TURBUHALER (budesonid) kan administreras en gång dagligen antingen på morgonen eller på kvällen.
Om behandlingen en gång dagligen med PULMICORT 200mcg TURBUHALER (budesonid) inte ger adekvat kontroll av astmasymtom, bör den totala dagliga dosen ökas och/eller administreras som en uppdelad dos.
Patienter som hålls på kroniska orala kortikosteroider
Inledningsvis ska PULMICORT TURBUHALER (budesonid) användas samtidigt med patientens vanliga underhållsdos av systemisk kortikosteroid. Efter cirka en vecka påbörjas gradvis utsättning av den systemiska kortikosteroiden genom att minska den dagliga eller alternativa dagliga dosen. Nästa minskning görs efter ett intervall på en eller två veckor, beroende på patientens svar. Generellt bör dessa minskningar inte överstiga 2,5 mg prednison eller motsvarande. En långsam uttagshastighet rekommenderas starkt. Under minskning av orala kortikosteroider bör patienterna noggrant övervakas med avseende på astmainstabilitet, inklusive objektiva mätningar av luftvägsfunktion, och för binjurebarksvikt (se VARNINGAR ). Under abstinens kan vissa patienter uppleva symtom på systemisk kortikosteroidabstinens, t.ex. led- och/eller muskelsmärta, trötthet och depression, trots underhåll eller till och med förbättring av lungfunktionen. Sådana patienter bör uppmuntras att fortsätta med PULMICORT TURBUHALER (budesonid) men bör övervakas för objektiva tecken på binjurebarksvikt. Om tecken på binjurebarksvikt uppträder, bör de systemiska kortikosteroiddoserna tillfälligt ökas och därefter bör utsättningen fortsätta långsammare. Under perioder av stress eller en svår astmaanfall kan transferpatienter behöva kompletterande behandling med systemiska kortikosteroider.
NOTERA: Hos alla patienter är det önskvärt att titrera till lägsta effektiva dos när astmastabilitet har uppnåtts.
Användarinstruktioner
Illustrerad patientanvisning för användning medföljer varje förpackning med PULMICORT 200mcg TURBUHALER (budesonid).
Patienterna ska instrueras att förbereda PULMICORT TURBUHALER (budesonid) före den första användningen och instrueras att andas in djupt och kraftfullt varje gång enheten används. Sköljning av munnen efter inandning rekommenderas också.
HUR LEVERERAS
PULMICORT TURBUHALER (budesonid) består av ett antal sammansatta plastdetaljer, där huvuddelarna är doseringsmekanismen, förvaringsenheten för läkemedelssubstans och munstycket. Inhalatorn skyddas av ett vitt yttre rörformigt lock som skruvas på inhalatorn. Inhalatorns kropp är vit och det vridbara greppet är brunt. Följande formulering är tryckt på greppet med upphöjda bokstäver, "Pulmicort™ 200 mcg". TURBUHALER-inhalatorn kan inte fyllas på och ska kasseras när den är tom.
PULMICORT TURBUHALER (budesonid) finns som 200 mcg/dos, 200 doser (NDC 0186-0915-42) och har en målfylld vikt på 104 mg.
När det finns 20 doser kvar i PULMICORT 200mcg TURBUHALER (budesonid) visas en röd markering i indikatorfönstret. Om enheten används bortom den punkt där det röda märket visas längst ner i fönstret, kan det hända att den korrekta mängden medicin inte erhålls. Enheten ska kasseras.
Förvara med locket åtdraget på en torr plats vid kontrollerad rumstemperatur 20-25°C (68-77°F) [se USP]. Förvaras oåtkomligt för barn.
Alla varumärken tillhör AstraZeneca-företagsgruppen. ©AstraZeneca 2001, 2006. Tillverkad för: AstraZeneca LP, Wilmington, DE 19850 Av: AstraZeneca AB, Södertälje, Sverige 33020-00. Rev. 10/06. FDA Rev. datum: 2007-08-20
BIEFFEKTER
Följande biverkningar rapporterades hos patienter som behandlats med PULMICORT 100 mikrogram TURBUHALER (budesonid).
Incidensen av vanliga biverkningar baseras på dubbelblinda, placebokontrollerade kliniska prövningar i USA där 1116 vuxna och pediatriska patienter i åldern 6-70 år (472 kvinnor och 644 män) behandlades med PULMICORT TURBUHALER (budesonid) (200 till 800). mcg två gånger dagligen i 12 till 20 veckor) eller placebo.
Följande tabell visar förekomsten av biverkningar hos patienter som tidigare fått bronkodilatorer och/eller inhalerade kortikosteroider i kontrollerade kliniska prövningar i USA. Denna population inkluderade 232 manliga och 62 kvinnliga pediatriska patienter (ålder 6 till 17 år) och 332 manliga och 331 kvinnliga vuxna patienter (ålder 18 år och äldre).
Biverkningar med ≥ 3 % incidens rapporterade av patienter på PULMICORT 100 mcg TURBUHALER (budesonid)
Tabellen ovan inkluderar alla händelser (oavsett om de betraktas som läkemedelsrelaterade eller icke-läkemedelsrelaterade av utredarna) som inträffade med en frekvens av ≥3 % i någon PULMICORT TURBUHALER-grupp (budesonid) och var vanligare än i placebogruppen. Vid övervägande av dessa data bör den ökade genomsnittliga exponeringstiden för patienter med PULMICORT 200 mcg TURBUHALER (budesonid) beaktas.
Följande andra biverkningar inträffade i dessa kliniska prövningar med PULMICORT 100 mcg TURBUHALER (budesonid) med en incidens på 1 till 3 % och var vanligare med PULMICORT 200 mcg TURBUHALER (budesonid) än med placebo.
Kroppen som helhet: nacksmärta
Kardiovaskulär: synkope
Matsmältningskanalen: buksmärtor, muntorrhet, kräkningar
Metaboliskt och näringsmässigt: viktökning
Muskuloskeletala: fraktur, myalgi
Nervös: hypertoni, migrän
Trombocyter, blödningar och koagulering: ekkymos
Psykiatrisk: sömnlöshet
Motståndsmekanismer: infektion
Särskilda sinnen: smakperversion
en 20-veckors studie på vuxna astmatiker som tidigare behövde orala kortikosteroider jämfördes effekterna av PULMICORT TURBUHALER (budesonid) 400 mcg två gånger dagligen (N=53) och 800 mcg två gånger dagligen (N=53) med placebo (N=53) ) om frekvensen av rapporterade biverkningar. Biverkningar, oavsett om de anses läkemedelsrelaterade eller icke-läkemedelsrelaterade av utredarna, rapporterade hos fler än fem patienter i gruppen PULMICORT 200mcg TURBUHALER (budesonid) och som inträffade oftare med PULMICORT TURBUHALER (budesonid) än placebo visas nedan ( % PULMICORT TURBUHALER (budesonid) och % placebo). Vid övervägande av dessa data bör den ökade genomsnittliga exponeringstiden för patienter med PULMICORT 200 mcg TURBUHALER (budesonid) (78 dagar för PULMICORT TURBUHALER (budesonid) jämfört med 41 dagar för placebo) beaktas.
Patienter som får PULMICORT TURBUHALER (budesonid) en gång dagligen
Biverkningsprofilen för administrering en gång dagligen av PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg och 400 mcg, och placebo, utvärderades hos 309 vuxna astmatiska patienter i en 18-veckors studie. Studiepopulationen inkluderade både patienter som tidigare behandlats med inhalerade kortikosteroider och patienter som inte tidigare fått kortikosteroidbehandling. Det fanns ingen kliniskt relevant skillnad i mönstret av biverkningar efter administrering en gång dagligen av PULMICORT 200 mikrogram TURBUHALER (budesonid) jämfört med dosering två gånger dagligen.
Pediatriska studier: en 12-veckors placebokontrollerad studie på 404 pediatriska patienter i åldern 6 till 18 år som tidigare fått inhalerade kortikosteroider, var frekvensen av biverkningar för varje ålderskategori (6 till 12 år, 13 till 18 år) jämförbar för PULMICORT TURBUHALER (budesonid) (vid 100, 200 och 400 mikrogram två gånger dagligen) och placebo. Det fanns inga kliniskt relevanta skillnader i mönstret eller svårighetsgraden av biverkningar hos barn jämfört med de som rapporterats hos vuxna.
Rapporter om biverkningar från andra källor: Sällsynta biverkningar som rapporterats i den publicerade litteraturen eller från världsomspännande marknadsföringserfarenhet med någon formulering av inhalerad budesonid inkluderar: omedelbara och fördröjda överkänslighetsreaktioner inklusive hudutslag, kontaktdermatit, urtikaria, angioödem och bronkospasm; symtom på hypokorticism och hyperkorticism; glaukom, grå starr; psykiatriska symtom inklusive depression, aggressiva reaktioner, irritabilitet, ångest och psykos.
LÄKEMEDELSINTERAKTIONER
kliniska studier har samtidig administrering av budesonid och andra läkemedel som vanligtvis används vid behandling av astma inte resulterat i en ökad frekvens av biverkningar. Den huvudsakliga metabolismen av budesonid, såväl som andra kortikosteroider, är via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Efter oral administrering av ketokonazol, en potent hämmare av CYP3A4, ökade den genomsnittliga plasmakoncentrationen av oralt administrerad budesonid. Samtidig administrering av andra kända hämmare av CYP3A4 (t.ex. itrakonazol, klaritromycin, erytromycin, etc.) kan hämma metabolismen av och öka den systemiska exponeringen för budesonid. Försiktighet bör iakttas när budesonid ges samtidigt med långtidsverkande ketokonazol och andra kända CYP3A4-hämmare.
VARNINGAR
Särskild omsorg behövs för patienter som övergår från systemiskt aktiva kortikosteroider till PULMICORT 200mcg TURBUHALER (budesonid) eftersom dödsfall på grund av binjurebarksvikt har inträffat hos astmatiska patienter under och efter övergång från systemiska kortikosteroider till mindre systemiskt tillgängliga inhalerade kortikosteroider. Efter utsättning från systemiska kortikosteroider krävs ett antal månader för återhämtning av hypotalamus-hypofys-binjurefunktionen (HPA).
Patienter som tidigare har hållits på 20 mg eller mer per dag av prednison (eller motsvarande) kan vara mest mottagliga, särskilt när deras systemiska kortikosteroider nästan helt har tagits ut. Under denna period av HPA-dämpning kan patienter uppvisa tecken och symtom på binjurebarksvikt när de utsätts för trauma, kirurgi eller infektion (särskilt gastroenterit) eller andra tillstånd associerade med allvarlig elektrolytförlust. Även om PULMICORT TURBUHALER (budesonid) kan ge kontroll över astmasymtom under dessa episoder, tillför den i rekommenderade doser mindre än normala fysiologiska mängder av glukokortikoid systemiskt och ger INTE den mineralokortikoidaktivitet som är nödvändig för att klara av dessa nödsituationer.
Under perioder av stress eller ett allvarligt astmaanfall, bör patienter som har avbrutits från systemiska kortikosteroider instrueras att omedelbart återuppta orala kortikosteroider (i stora doser) och att kontakta sin läkare för vidare instruktioner. Dessa patienter bör också instrueras att bära ett medicinskt ID-kort som visar att de kan behöva kompletterande systemiska kortikosteroider under perioder av stress eller en svår astmaanfall.
Patienter som behöver orala kortikosteroider bör långsamt avvänjas från systemisk kortikosteroidanvändning efter övergång till PULMICORT 100mcg TURBUHALER (budesonid). Lungfunktion (FEV1 eller AM PEF), användning av beta-agonister och astmasymtom bör övervakas noggrant under utsättande av orala kortikosteroider. Förutom att övervaka astma-tecken och symtom, bör patienter observeras för tecken och symtom på binjurebarksvikt såsom trötthet, trötthet, svaghet, illamående och kräkningar och hypotoni.
Övergång av patienter från systemisk kortikosteroidbehandling till PULMICORT 200mcg TURBUHALER (budesonid) kan avslöja allergiska tillstånd som tidigare undertryckts av systemisk kortikosteroidbehandling, t.ex. rinit, konjunktivit, artrit, eosinofila tillstånd och eksem (se DOSERING OCH ADMINISTRERING ).
Patienter som tar läkemedel som dämpar immunförsvaret är mer mottagliga för infektion än friska individer. Vattkoppor och mässling, till exempel, kan ha ett allvarligare eller till och med dödligt förlopp hos känsliga barn eller vuxna på immunsuppressiva doser av kortikosteroider. Hos pediatriska eller vuxna patienter som inte har haft dessa sjukdomar bör särskild försiktighet iakttas för att undvika exponering. Hur dosen, vägen och varaktigheten av administrering av kortikosteroider påverkar risken för att utveckla en spridd infektion är inte känt. Bidraget från den underliggande sjukdomen och/eller tidigare kortikosteroidbehandling till risken är inte heller känt. Vid exponering kan behandling med varicella zoster immunglobulin (VZIG) eller poolat intravenöst immunglobulin (IVIG), beroende på vad som är lämpligt, vara indicerat. Vid exponering för mässling kan profylax med poolat intramuskulärt immunglobulin (IG) vara indicerat. (Se respektive bipacksedel för fullständig VZIG- och IG-förskrivningsinformation.) Om vattkoppor utvecklas kan behandling med antivirala medel övervägas.
PULMICORT 200mcg TURBUHALER (budesonid) är inte ett luftrörsvidgande medel och är inte indicerat för snabb lindring av bronkospasm eller andra akuta episoder av astma.
Som med andra inhalerade astmamediciner kan bronkospasm, med en omedelbar ökning av väsande andning, uppstå efter dosering. Om bronkospasm uppstår efter dosering med PULMICORT TURBUHALER (budesonid), ska den behandlas omedelbart med en snabbverkande inhalerad luftrörsvidgare. Behandling med PULMICORT TURBUHALER (budesonid) ska avbrytas och alternativ behandling inledas.
Patienter ska instrueras att kontakta sin läkare omedelbart när astmaepisoder som inte svarar på deras vanliga doser av luftrörsvidgande medel inträffar under behandling med PULMICORT TURBUHALER (budesonid). Under sådana episoder kan patienter behöva behandling med orala kortikosteroider.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Under abstinens från orala kortikosteroider kan vissa patienter uppleva symtom på systemiskt aktivt kortikosteroidabstinens, t.ex. led- och/eller muskelsmärta, trötthet och depression, trots underhåll eller till och med förbättring av andningsfunktionen (se DOSERING OCH ADMINISTRERING ).
Hos lyhörda patienter kan PULMICORT TURBUHALER (budesonid) tillåta kontroll av astmasymtom med mindre undertryckande av HPA-axelns funktion än terapeutiskt ekvivalenta orala doser av prednison. Eftersom budesonid absorberas i cirkulationen och kan vara systemiskt aktivt, kan de gynnsamma effekterna av PULMICORT 100mcg TURBUHALER (budesonid) för att minimera HPA-dysfunktion förväntas endast när rekommenderade doser inte överskrids och enskilda patienter titreras till lägsta effektiva dos. Eftersom individuell känslighet för effekter på kortisolproduktion existerar, bör läkare beakta denna information när de förskriver PULMICORT 100mcg TURBUHALER (budesonid).
På grund av möjligheten till systemisk absorption av inhalerade kortikosteroider, bör patienter som behandlas med PULMICORT 200 mcg TURBUHALER (budesonid) observeras noggrant för tecken på systemiska kortikosteroideffekter. Särskild försiktighet bör iakttas vid observation av patienter postoperativt eller under perioder av stress för tecken på otillräckligt binjuresvar.
Det är möjligt att systemiska kortikosteroideffekter såsom hyperkorticism, minskad benmineraldensitet och binjuresuppression kan uppträda hos ett litet antal patienter, särskilt vid högre doser. Om sådana förändringar inträffar bör PULMICORT 100 mcg TURBUHALER (budesonid) minskas långsamt, i enlighet med accepterade procedurer för hantering av astmasymtom och för nedtrappning av systemiska steroider.
Oralt inhalerade kortikosteroider, inklusive budesonid, kan orsaka en minskning av tillväxthastigheten när de administreras till pediatriska patienter. En minskning av tillväxthastigheten kan uppstå som ett resultat av otillräcklig kontroll av astma eller användning av kortikosteroider för behandling. De potentiella effekterna av förlängd behandling på tillväxthastigheten bör vägas mot de kliniska fördelarna som erhålls och riskerna förknippade med alternativa terapier. För att minimera de systemiska effekterna av orala inhalerade kortikosteroider, inklusive PULMICORT 200mcg TURBUHALER (budesonid), bör varje patient titreras till sin lägsta effektiva dos (se FÖRSIKTIGHETSÅTGÄRDER, Pediatrisk användning ).
Även om patienter i kliniska prövningar har fått PULMICORT TURBUHALER (budesonid) kontinuerligt under perioder på 1 till 2 år, är de långsiktiga lokala och systemiska effekterna av PULMICORT 200 mcg TURBUHALER (budesonid) på människor inte helt kända. I synnerhet är effekterna av kronisk användning av PULMICORT TURBUHALER (budesonid) på utvecklings- eller immunologiska processer i mun, svalg, luftstrupe och lunga okända.
I kliniska prövningar med PULMICORT TURBUHALER (budesonid) förekom lokaliserade infektioner med Candida albicans i munnen och svalget hos vissa patienter. Dessa infektioner kan kräva behandling med lämplig antimykotikabehandling och/eller avbrytande av behandlingen med PULMICORT TURBUHALER (budesonid).
Inhalerade kortikosteroider bör användas med försiktighet, om överhuvudtaget, till patienter med aktiv eller vilande tuberkulosinfektion i luftvägarna, obehandlade systemiska svamp-, bakterie-, virus- eller parasitinfektioner eller okulär herpes simplex.
Sällsynta fall av glaukom, ökat intraokulärt tryck och grå starr har rapporterats efter inhalerad administrering av kortikosteroider.
Information till patienter
Patienter som behandlas med PULMICORT TURBUHALER (budesonid) bör få följande information och instruktioner. Denna information är avsedd att hjälpa patienten med en säker och effektiv användning av läkemedlet. Det är inte ett avslöjande av alla möjliga negativa eller avsedda effekter. För korrekt användning av PULMICORT 200mcg TURBUHALER (budesonid) och för att uppnå maximal förbättring, bör patienten läsa och följa den medföljande Patientens instruktioner för använd försiktigt.
- Patienter bör använda PULMICORT 200 mcg TURBUHALER (budesonid) med regelbundna intervall enligt anvisningarna eftersom dess effektivitet beror på regelbunden användning. Patienten ska inte ändra den föreskrivna dosen såvida inte läkaren har rekommenderat det.
- Patienter bör informeras om att PULMICORT 100 mcg TURBUHALER (budesonid) inte är ett luftrörsvidgande medel och inte är avsett att behandla akuta eller livshotande astmaepisoder.
- Patienter bör informeras om att effektiviteten av PULMICORT 100mcg TURBUHALER (budesonid) beror på korrekt användning av enheten och inhalationsadministrerande teknik:
- 1. PULMICORT TURBUHALER (budesonid) måste vara i upprätt läge (munstycket på toppen) under laddning för att ge rätt dos.
- 2. PULMICORT 100mcg TURBUHALER (budesonid) måste förberedas när enheten används för första gången. För att förbereda enheten måste den hållas i upprätt läge och det bruna greppet vrids helt åt höger och sedan helt åt vänster tills det klickar. Upprepa.
- 3. För att ladda den första dosen måste greppet vridas helt åt höger och helt åt vänster tills det klickar.
- 4. Efter den första dosen är det inte nödvändigt att förbereda enheten. Den måste dock laddas i upprätt läge omedelbart före användning enligt beskrivningen ovan.
- 5. Patienter bör rådas att inte skaka inhalatorn.
- Patienterna ska placera munstycket mellan läpparna och andas in kraftfullt och djupt. Pulvret levereras sedan till lungorna.
- Patienter ska inte andas ut genom PULMICORT TURBUHALER (budesonid).
- På grund av den lilla volymen pulver kanske patienten inte smakar eller känner närvaron av någon medicin som kommer in i lungorna när han andas in från TURBUHALER-inhalatorn. Denna brist på känsel tyder inte på att patienten inte får nytta av PULMICORT TURBUHALER (budesonid).
- Patienter bör informeras om att sköljning av munnen med vatten utan att svälja efter varje dosering kan minska risken för utveckling av oral candidiasis.
- Patienterna bör instrueras att de kommer att få en ny PULMICORT TURBUHALER (budesonid) enhet varje gång de fyller på sitt recept. Patienter bör rådas att kassera hela enheten efter att det angivna antalet inhalationer har använts. När det finns 20 doser kvar i PULMICORT TURBUHALER (budesonid) visas en röd markering i indikatorfönstret.
- PULMICORT TURBUHALER (budesonid) ska inte användas med en distans.
- Munstycket ska inte bitas eller tuggas.
- Locket bör sättas tillbaka säkert efter varje öppning.
- Patienter ska hålla PULMICORT TURBUHALER (budesonid) ren och torr hela tiden.
- Patienter bör informeras om att förbättring av astmakontrollen efter inhalation av PULMICORT TURBUHALER (budesonid) kan inträffa inom 24 timmar efter påbörjad behandling, även om maximal nytta kanske inte uppnås efter 1 till 2 veckor eller längre. Om symtomen inte förbättras inom den tidsramen, eller om tillståndet förvärras, bör patienten instrueras att inte öka dosen, utan att kontakta läkare.
- Patienter vars systemiska kortikosteroider har reducerats eller tagits ut ska instrueras att bära ett varningskort som anger att de kan behöva kompletterande systemiska kortikosteroider under perioder av stress eller en astmaanfall som inte svarar på luftrörsvidgare.
- Patienter bör rådas att inte avbryta användningen av PULMICORT TURBUHALER (budesonid) abrupt.
- Patienter bör varnas för att undvika exponering för vattkoppor eller mässling och om de utsätts, att rådfråga sin läkare utan dröjsmål.
- Långvarig användning av inhalerade kortikosteroider, inklusive budesonid, kan öka risken för vissa ögonproblem (grå starr eller glaukom). Regelbundna ögonundersökningar bör övervägas.
- Kvinnor som överväger att använda PULMICORT TURBUHALER (budesonid) bör rådgöra med sin läkare om de är gravida eller planerar att bli gravida, eller om de ammar ett barn.
- Patienter som överväger att använda PULMICORT TURBUHALER (budesonid) bör rådfråga sin läkare om de är allergiska mot budesonid eller någon annan oralt inhalerad kortikosteroid.
- Patienter bör informera sin läkare om andra mediciner de tar eftersom PULMICORT 100mcg TURBUHALER (budesonid) kanske inte är lämpligt under vissa omständigheter och läkaren kanske vill använda ett annat läkemedel.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Långtidsstudier utfördes på råttor och möss med oral administrering för att utvärdera den karcinogena potentialen hos budesonid.
en 104-veckors oral studie på Sprague-Dawley-råttor observerades en statistiskt signifikant ökning av incidensen av gliom hos hanråttor som fick en oral dos på 50 mikrogram/kg/dag (mindre än den maximala rekommenderade dagliga inhalationsdosen hos vuxna och barn på en mcg/m2-basis). Ingen tumörframkallande effekt sågs hos han- och honråttor vid respektive orala doser upp till 25 och 50 mikrogram/kg (mindre än den maximala rekommenderade dagliga inhalationsdosen till vuxna och barn på en mikrogram/m2-basis). I ytterligare två tvååriga studier på Fischer- och Sprague-Dawley-hanråttor orsakade budesonid inga gliom vid en oral dos på 50 mcg/kg (mindre än den maximala rekommenderade dagliga inhalationsdosen för vuxna och barn på en mcg/m2-basis). Hos Sprague-Dawley-hanråttor orsakade dock budesonid en statistiskt signifikant ökning av förekomsten av levercellstumörer vid en oral dos på 50 mcg/kg (mindre än den maximala rekommenderade dagliga inhalationsdosen för vuxna och barn på en mcg/m2-basis ). De samtidiga referenskortikosteroiderna (prednison och triamcinolonacetonid) i dessa två studier visade liknande fynd.
Det fanns inga tecken på en karcinogen effekt när budesonid administrerades oralt i 91 veckor till möss i doser upp till 200 mikrogram/kg/dag (mindre än den maximala rekommenderade dagliga inhalationsdosen till vuxna och barn på en mikrogram/m2 basis).
Budesonid var inte mutagent eller klastogent i sex olika testsystem: Ames Salmonella/mikrosomplattest, mus-mikronkärntest, muslymfomtest, kromosomavvikelsetest i humana lymfocyter, könsbundet recessivt dödligt test i Drosophila melanogaster och DNA-reparationsanalys hos råtta hepatocytodling.
Hos råttor hade budesonid ingen effekt på fertiliteten vid subkutana doser upp till 80 mcg/kg (mindre än den maximala rekommenderade dagliga inhalationsdosen för människor på en mcg/m2-basis).
Vid 20 mikrogram/kg/dag (mindre än den maximala rekommenderade dagliga inhalationsdosen för människor på en mikrogram/m2-basis) observerades minskningar i moderns kroppsviktsökning, prenatal livsduglighet och livsduglighet hos ungar vid födseln och under amning. Inga sådana effekter noterades vid 5 mcg/kg (mindre än den maximala rekommenderade humana dagliga inhalationsdosen hos vuxna på mcg/m2-basis).
Graviditet: teratogena effekter
Graviditet Kategori B: Som med andra glukokortikoider, gav budesonid fosterförlust, minskad valpvikt och skelettavvikelser vid subkutana doser på 25 mcg/kg/dag hos kaniner (mindre än den maximala rekommenderade dagliga inhalationsdosen för människor på en mcg/m2-basis) och 500 mcg/kg/dag hos råttor (ungefär 3 gånger den maximala rekommenderade dagliga inhalationsdosen för människor på en mcg/m2-basis).
Inga teratogena eller embryocidala effekter observerades hos råttor när budesonid administrerades genom inhalation i doser upp till 250 mcg/kg/dag (motsvarande den maximala rekommenderade dagliga inhalationsdosen för människor på en mcg/m2-basis).
Erfarenhet av orala kortikosteroider sedan de introducerades i farmakologiska i motsats till fysiologiska doser tyder på att gnagare är mer benägna att få teratogena effekter från kortikosteroider än människor.
Studier av gravida kvinnor har dock inte visat att PULMICORT TURBUHALER (budesonid) ökar risken för abnormiteter vid administrering under graviditet. Resultaten från en stor populationsbaserad prospektiv kohort epidemiologisk studie som granskar data från tre svenska register som täcker cirka 99 % av graviditeterna från 1995-1997 (dvs. Svenska Medicinska födelseregistret; Register över medfödda missbildningar; Barnkardiologiska registret) indikerar ingen ökad risk för medfödda missbildningar från användning av inhalerad budesonid under tidig graviditet. Medfödda missbildningar studerades hos 2 014 spädbarn födda av mödrar som rapporterade användning av inhalerad budesonid mot astma i början av graviditeten (vanligtvis 10-12 veckor efter den sista menstruationen), den period då de flesta större organmissbildningar inträffar. Frekvensen av registrerade medfödda missbildningar var liknande jämfört med den allmänna populationsfrekvensen (3,8 % respektive 3,5 %). Dessutom, efter exponering för inhalerad budesonid, var antalet spädbarn födda med orofaciala klyftor liknande det förväntade antalet i normalpopulationen (4 barn respektive 3,3).
Samma data användes i en andra studie som gav det totala antalet till 2 534 spädbarn vars mödrar exponerades för inhalerad budesonid. I denna studie skilde sig inte frekvensen av medfödda missbildningar bland spädbarn vars mödrar exponerades för inhalerad budesonid under tidig graviditet från frekvensen för alla nyfödda barn under samma period (3,6 %).
Trots djurfynden verkar det som om risken för fosterskador är liten om läkemedlet används under graviditeten. Ändå, eftersom studier på människor inte kan utesluta risken för skada, bör PULMICORT TURBUHALER (budesonid) endast användas under graviditet om det verkligen behövs.

Icke-ratogena effekter
Hypoadrenalism kan förekomma hos spädbarn födda av mödrar som får kortikosteroider under graviditeten. Sådana spädbarn bör observeras noggrant.
Ammande mödrar
Kortikosteroider utsöndras i bröstmjölk. På grund av risken för biverkningar hos ammande spädbarn från vilken kortikosteroid som helst, bör ett beslut fattas om att avbryta amningen eller avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern. Faktiska data för budesonid saknas.
Pediatrisk användning
Säkerhet och effektivitet för PULMICORT 100 mcg TURBUHALER (budesonid) hos pediatriska patienter under 6 år har inte fastställts.
Hos pediatriska astmapatienter var frekvensen av biverkningar som observerades med PULMICORT 100 mcg TURBUHALER (budesonid) liknande mellan 6- till 12-årsgruppen (N=172) jämfört med 13- till 17-årsgruppen (N=124) .
Kontrollerade kliniska studier har visat att oralt inhalerade kortikosteroider kan orsaka en minskning av tillväxthastigheten hos pediatriska patienter. Denna effekt har observerats i avsaknad av laboratoriebevis för undertryckning av hypotalamus-hypofys-binjureaxeln (HPA), vilket tyder på att tillväxthastigheten är en känsligare indikator på systemisk kortikosteroidexponering hos pediatriska patienter än några vanliga tester av HPA-axelns funktion. De långsiktiga effekterna av denna minskning av tillväxthastigheten i samband med oralt inhalerade kortikosteroider inklusive effekten på den slutliga vuxenlängden är okända. Potentialen för tillväxt efter avslutad behandling med orala inhalerade kortikosteroider har inte studerats tillräckligt.
en studie av astmatiska barn 5-12 år hade de som behandlades med PULMICORT 200 mcg TURBUHALER (budesonid) 200 mcg två gånger dagligen (n=311) en minskning av tillväxten med 1,1 centimeter jämfört med de som fick placebo (n=418) kl. slutet av ett år; skillnaden mellan dessa två behandlingsgrupper ökade inte ytterligare under tre års ytterligare behandling. Vid slutet av fyra år hade barn som behandlats med PULMICORT TURBUHALER (budesonid) och barn som behandlats med placebo liknande tillväxthastigheter. Slutsatserna från denna studie kan förvirras av den ojämlika användningen av kortikosteroider i behandlingsgrupperna och inkluderandet av data från patienter som uppnår puberteten under studiens gång.
Tillväxten hos pediatriska patienter som får orala inhalerade kortikosteroider, inklusive PULMICORT TURBUHALER (budesonid), bör övervakas rutinmässigt (t.ex. via stadiometri). De potentiella tillväxteffekterna av förlängd behandling bör vägas mot kliniska fördelar och riskerna och fördelarna med alternativa behandlingar. För att minimera de systemiska effekterna av inhalerade kortikosteroider, inklusive PULMICORT 100 mcg TURBUHALER (budesonid), bör varje patient titreras till sin lägsta effektiva dos.
Geriatrisk användning
Hundra patienter 65 år eller äldre inkluderades i USA och icke-amerikanska kontrollerade kliniska prövningar av PULMICORT 100 mikrogram TURBUHALER (budesonid). Det fanns inga skillnader i läkemedlets säkerhet och effekt jämfört med de som ses hos yngre patienter.
allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
ÖVERDOS
Risken för akuta toxiska effekter efter överdosering av PULMICORT 100 mcg TURBUHALER (budesonid) är låg. Om det används i för höga doser under längre perioder kan systemiska kortikosteroideffekter som hyperkorticism uppträda (se FÖRSIKTIGHETSÅTGÄRDER ). PULMICORT TURBUHALER vid två gånger den högsta rekommenderade dosen (3200 mikrogram dagligen) administrerad under 6 veckor orsakade en signifikant minskning (27%) av plasmakortisolsvaret på en 6-timmars infusion av ACTH jämfört med placebo (+1%). Motsvarande effekt av 10 mg prednison dagligen var en 35 % minskning av plasmakortisolsvaret på ACTH.
Den minimala inhalationsdödliga dosen hos möss var 100 mg/kg (ungefär 320 gånger den maximala rekommenderade dagliga inhalationsdosen för vuxna och cirka 380 gånger den maximala rekommenderade dagliga inhalationsdosen för barn på en mcg/m2-basis). Det förekom inga dödsfall efter administrering av en inhalationsdos på 68 mg/kg till råttor (cirka 430 gånger den maximala rekommenderade dagliga inhalationsdosen hos vuxna och ungefär 510 gånger den maximala rekommenderade dagliga inhalationsdosen till barn på en mcg/m2-basis). Den minsta orala dödliga dosen var 200 mg/kg hos möss (ungefär 630 gånger den maximala rekommenderade dagliga inhalationsdosen för vuxna och cirka 750 gånger den maximala rekommenderade dagliga inhalationsdosen hos barn på en mikrogram/m2-basis) och mindre än 100 mg/kg hos råttor (cirka 630 gånger den maximala rekommenderade dagliga inhalationsdosen för vuxna och cirka 750 gånger den maximala rekommenderade dagliga inhalationsdosen för barn baserat på en mcg/m2-basis).
Erfarenheter efter marknadsföring visade att patienter som upplever akut överdos av inhalerad budesonid vanligtvis förblev asymtomatiska. Användning av för höga doser (upp till 6400 mikrogram dagligen) under långa perioder visade systemiska kortikosteroideffekter såsom hyperkorticism.
KONTRAINDIKATIONER
PULMICORT TURBUHALER (budesonid) är kontraindicerat vid primär behandling av status asthmaticus eller andra akuta episoder av astma där intensiva åtgärder krävs.
Överkänslighet mot budesonid kontraindicerar användningen av PULMICORT TURBUHALER (budesonid).
KLINISK FARMAKOLOGI
Handlingsmekanism
Budesonid är en antiinflammatorisk kortikosteroid som uppvisar potent glukokortikoidaktivitet och svag mineralokortikoidaktivitet. I standard in vitro- och djurmodeller har budesonid ungefär 200 gånger högre affinitet för glukokortikoidreceptorn och en 1000 gånger högre topikal antiinflammatorisk potens än kortisol (råttkrotonolja öronödemanalys). Som ett mått på systemisk aktivitet är budesonid 40 gånger mer potent än kortisol när det administreras subkutant och 25 gånger mer potent när det administreras oralt i råtttymusinvolutionsanalysen.
Aktiviteten hos PULMICORT 100mcg TURBUHALER beror på moderläkemedlet budesonid. I glukokortikoidreceptoraffinitetsstudier var 22R-formen två gånger så aktiv som 22S-epimeren. In vitro-studier visade att de två formerna av budesonid inte omvandlas till varandra.
Den exakta mekanismen för kortikosteroidverkan på inflammation vid astma är inte känd. Inflammation är en viktig komponent i patogenesen av astma. Kortikosteroider har visat sig ha ett brett spektrum av hämmande aktiviteter mot flera celltyper (t.ex. mastceller, eosinofiler, neutrofiler, makrofager och lymfocyter) och mediatorer (t.ex. histamin, eikosanoider, leukotriener och cytokiner) involverade i allergiska och icke -allergiskt förmedlad inflammation. Dessa antiinflammatoriska effekter av kortikosteroider kan bidra till deras effektivitet vid astma.
Studier på astmatiska patienter har visat ett gynnsamt förhållande mellan topikal antiinflammatorisk aktivitet och systemiska kortikosteroideffekter över ett brett spektrum av doser från PULMICORT 200mcg TURBUHALER (budesonid). Detta förklaras av en kombination av en relativt hög lokal antiinflammatorisk effekt, omfattande första pass-levernedbrytning av oralt absorberat läkemedel (85-95%) och den låga styrkan hos bildade metaboliter (se nedan).
Farmakokinetik
Absorption:
Efter oral administrering av budesonid uppnåddes maximal plasmakoncentration inom cirka 1 till 2 timmar och den absoluta systemiska tillgängligheten var 6-13%. Däremot absorberas det mesta av budesonid som levereras till lungorna systemiskt. Hos friska försökspersoner avsattes 34 % av den uppmätta dosen i lungorna (bedömt med plasmakoncentrationsmetoden) med en absolut systemisk tillgänglighet på 39 % av den uppmätta dosen. Farmakokinetiken för budesonid skiljer sig inte signifikant hos friska frivilliga och astmatiska patienter. Maximala plasmakoncentrationer av budesonid inträffade inom 30 minuter efter inhalation från PULMICORT 200 mcg TURBUHALER.Hos astmatiska patienter visade budesonid en linjär ökning av AUC och Cmax med ökande dos efter både engångsdos och upprepad dosering från PULMICORT 200 mikrogram TURBUHALER (budesonid).
Distribution:
Distributionsvolymen för budesonid var cirka 3 L/kg. Det var 85-90 % bundet till plasmaproteiner. Proteinbindningen var konstant över koncentrationsintervallet (1-100 nmol/L) som uppnåddes med och översteg rekommenderade doser av PULMICORT TURBUHALER. Budesonid visade liten eller ingen bindning till kortikosteroidbindande globulin. Budesonid kom snabbt i jämvikt med röda blodkroppar på ett koncentrationsoberoende sätt med ett blod/plasmaförhållande på cirka 0,8.Ämnesomsättning:
In vitro-studier med humana leverhomogenat har visat att budesonid metaboliseras snabbt och omfattande. Två huvudmetaboliter bildade via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4) katalyserad biotransformation har isolerats och identifierats som 16α-hydroxiprednisolon och 6β-hydroxibudesonid. Kortikosteroidaktiviteten för var och en av dessa två metaboliter är mindre än 1 % av moderföreningens. Inga kvalitativa skillnader mellan in vitro och in vivo metaboliska mönster har upptäckts. Försumbar metabolisk inaktivering observerades i humana lung- och serumberedningar.Utsöndring/eliminering:
22R-formen av budesonid eliminerades företrädesvis av levern med systemisk clearance på 1,4 l/min mot 1,0 l/min för 22S-formen. Den terminala halveringstiden, 2 till 3 timmar, var densamma för båda epimererna och var oberoende av dos. Budesonid utsöndrades i urin och avföring i form av metaboliter. Ungefär 60 % av en intravenöst radiomärkt dos återfanns i urinen. Ingen oförändrad budesonid upptäcktes i urinen.Särskilda populationer:
Inga farmakokinetiska skillnader har identifierats på grund av ras, kön eller hög ålder.Pediatrisk:
Efter intravenös dosering till pediatriska patienter i åldern 10-14 år var plasmahalveringstiden kortare än hos vuxna (1,5 timmar mot 2,0 timmar hos vuxna). I samma population efter inhalation av budesonid via en trycksatt dosinhalator var den absoluta systemiska tillgängligheten liknande den hos vuxna.Leverinsufficiens:
Nedsatt leverfunktion kan påverka elimineringen av kortikosteroider. Budesonids farmakokinetik påverkades av nedsatt leverfunktion, vilket framgår av en fördubblad systemisk tillgänglighet efter oralt intag. Den intravenösa farmakokinetiken för budesonid var dock likartad hos cirrospatienter och hos friska försökspersoner.Läkemedelsinteraktioner:
Ketokonazol, en potent hämmare av cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4), det huvudsakliga metaboliska enzymet för kortikosteroider, ökade plasmanivåerna av oralt intaget budesonid. Vid rekommenderade doser hade cimetidin en liten men kliniskt obetydlig effekt på farmakokinetiken för oral budesonid.Farmakodynamik
För att bekräfta att systemisk absorption inte är en signifikant faktor i den kliniska effekten av inhalerad budesonid, utfördes en klinisk studie på patienter med astma som jämförde 400 mikrogram budesonid administrerat via en inhalator med uppmätta doser under tryck med en tubdistans med 1400 mikrogram oral budesonid och placebo. Studien visade effekten av inhalerad budesonid men inte oralt intagen budesonid trots jämförbara systemiska nivåer. Sålunda förklaras den terapeutiska effekten av konventionella doser av oralt inhalerad budesonid till stor del av dess direkta verkan på luftvägarna.
Generellt sett har PULMICORT TURBUHALER (budesonid) en relativt snabb insättande effekt för en inhalerad kortikosteroid. Förbättring av astmakontrollen efter inhalation av PULMICORT TURBUHALER (budesonid) kan inträffa inom 24 timmar efter påbörjad behandling även om maximal nytta kanske inte uppnås förrän efter 1 till 2 veckor eller längre.
PULMICORT TURBUHALER (budesonid) har visat sig minska luftvägsreaktiviteten i olika utmaningsmodeller, inklusive histamin, metakolin, natriummetabisulfit och adenosinmonofosfat hos patienter med hyperreaktiva luftvägar. Den kliniska relevansen av dessa modeller är inte säker.
Förbehandling med PULMICORT 200 mcg TURBUHALER (budesonid) 1600 mcg dagligen (800 mcg två gånger dagligen) i 2 veckor minskade den akuta (tidigfasreaktionen) och fördröjda (sen-fasreaktionen) minskningen av FEV1 efter inhalerad allergenutmaning.
Effekterna av PULMICORT 200mcg TURBUHALER (budesonid) på hypotalamus-hypofys-binjureaxeln (HPA) studerades hos 905 vuxna och 404 pediatriska patienter med astma. För de flesta patienter förblev förmågan att öka kortisolproduktionen som svar på stress, bedömd med cosyntropin (ACTH)-stimuleringstest, intakt med PULMICORT TURBUHALER (budesonid)-behandling vid rekommenderade doser. För vuxna patienter som behandlats med 100, 200, 400 eller 800 mcg två gånger dagligen under 12 veckor hade 4 %, 2 %, 6 % respektive 13 % ett onormalt stimulerat kortisolsvar (toppkortisol
Administrering av budesonid via PULMICORT 200 mcg TURBUHALER (budesonid) i doser upp till 800 mcg/dag (genomsnittlig daglig dos 445 mcg/dag) eller via en trycksatt inhalator med uppmätta doser i doser upp till 1200 mcg/dag (genomsnittlig daglig dos 620 mcg/dag) /dag) till 216 pediatriska patienter (ålder 3 till 11 år) under 2 till 6 år hade ingen signifikant effekt på staturell tillväxt jämfört med icke-kortikosteroidbehandling hos 62 matchade kontrollpatienter. Den långsiktiga effekten av PULMICORT TURBUHALER (budesonid) på tillväxten är dock inte helt känd.
Kliniska spår
Den terapeutiska effekten av PULMICORT 100mcg TURBUHALER (budesonid) har utvärderats i kontrollerade kliniska prövningar med fler än 1300 patienter (6 år och äldre) med astma av varierande sjukdomslängd (20 år) och svårighetsgrad.
Dubbelblinda, parallella, placebokontrollerade kliniska prövningar av 12 veckors varaktighet och längre har visat att jämfört med placebo, PULMICORT TURBUHALER (budesonid) signifikant förbättrade lungfunktionen (mätt med PEF och FEV1), signifikant minskade morgon- och kvällssymtom på astma , och minskade signifikant behovet av inhalerad β2-agonist vid behov vid doser på 400 mcg till 1600 mcg per dag (200 mcg till 800 mcg två gånger dagligen) hos vuxna och 400 mcg till 800 mcg per dag (200 mcg till 400 mcg två gånger dagligen) hos pediatriska patienter 6 år och äldre.
Förbättrad lungfunktion (morgon PEF) observerades inom 24 timmar efter påbörjad behandling hos både vuxna och pediatriska patienter 6 år och äldre, även om maximal nytta inte uppnåddes förrän 1 till 2 veckor, eller längre, efter påbörjad behandling. Förbättrad lungfunktion bibehölls under de 12 veckorna av den dubbelblinda delen av försöken.
Patienter som inte får kortikosteroidterapi
en 12-veckors klinisk prövning med 273 patienter med mild till måttlig astma (medelvärde FEV1 2,27 L) som inte var välkontrollerade av enbart bronkodilatorer, utvärderades PULMICORT 200 mcg TURBUHALER (budesonid) i doser på 200 mcg två gånger dagligen och 400 mcg två gånger dagligen dagligen kontra placebo. FEV1-resultaten från denna studie visas i figuren nedan. Lungfunktionen förbättrades signifikant på båda doserna av PULMICORT 100 mcg TURBUHALER (budesonid) jämfört med placebo.
En 12-veckors prövning på patienter som inte behandlades med kortikosteroidbehandling innan studiestart
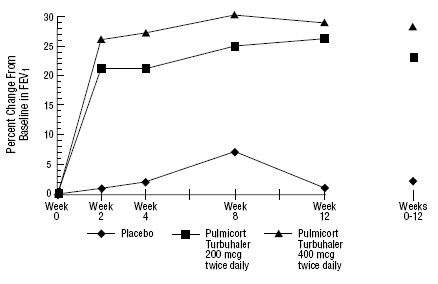
I en 12-månaders kontrollerad studie med 75 patienter som inte tidigare fått kortikosteroider, resulterade PULMICORT TURBUHALER (budesonid) vid 200 mikrogram två gånger dagligen i förbättrad lungfunktion (mätt med PEF) och minskad bronkial hyperreaktivitet jämfört med placebo.
Patienter som tidigare hållits på inhalerade kortikosteroider
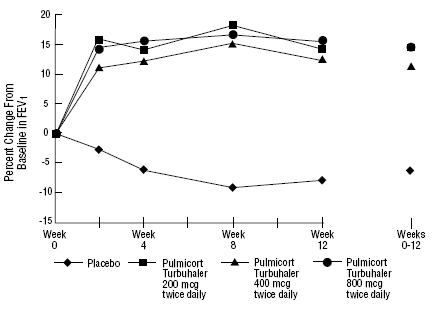
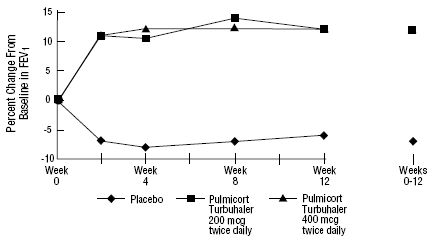
Säkerheten och effekten av PULMICORT 200 mcg TURBUHALER (budesonid) utvärderades även hos vuxna och pediatriska patienter (åldern 6 till 18 år) som tidigare hållits på inhalerade kortikosteroider (vuxna: N=473, genomsnittlig baslinje FEV1 2,04 L, utgångsdoser 12-metasondipropionatason av bediklorat. -1008 mcg/dag; pediatrik: N=404, genomsnittlig baslinje FEV1 2,09 L, baslinjedoser av beklometasondipropionat 126-672 mcg/dag eller triamcinolonacetonid 300-1800 mcg/dag). FEV1-resultaten från dessa två försök, båda 12 veckor långa, presenteras i följande figurer. Lungfunktionen förbättrades signifikant med alla doser av PULMICORT TURBUHALER (budesonid) jämfört med placebo i båda studierna.
Vuxna patienter som tidigare hållits på inhalerade kortikosteroider
Pediatriska patienter i åldern 6 till 18 år som tidigare hållits på inhalerade kortikosteroider
Patienter som får PULMICORT TURBUHALER (budesonid) en gång dagligen
Effekten och säkerheten av administrering en gång dagligen av PULMICORT 100 mcg TURBUHALER (budesonid) 200 mcg och 400 mcg och placebo utvärderades också hos 309 vuxna astmatiska patienter (medelvärde FEV1 2,7 l) i en 18-veckors studie. Jämfört med placebo visade patienter som fick Pulmicort 200 eller 400 mikrogram en gång dagligen signifikant bättre astmastabilitet, bedömd med PEF och FEV1 under en initial 6-veckors behandlingsperiod, som bibehölls med en daglig dos på 200 mikrogram under de efterföljande 12 veckorna. Även om studiepopulationen inkluderade både patienter som tidigare behandlats med inhalerade kortikosteroider, såväl som patienter som inte tidigare fått kortikosteroidbehandling, visade resultaten att dosering en gång dagligen var mest tydligt effektiv för de patienter som tidigare hållits på orala inhalerade kortikosteroider (se DOSERING OCH ADMINISTRERING ).
Patienter som tidigare hållits på orala kortikosteroider
en klinisk prövning med 159 patienter med svår astma som behövde kronisk peroral prednisonbehandling (genomsnittlig baslinjedos av prednison 19,3 mg/dag) jämfördes PULMICORT TURBUHALER (budesonid) i doser på 400 mikrogram två gånger dagligen och 800 mikrogram två gånger dagligen med placebo under en 20-veckor. period. Cirka två tredjedelar (68 % på 400 mcg två gånger dagligen och 64 % på 800 mcg två gånger dagligen) av PULMICORT TURBUHALER (budesonid)-behandlade patienter kunde uppnå varaktigt (minst 2 veckor) oralt kortikosteroidavbrott (jämfört med 8 % av placebobehandlade patienter) och förbättrad astmakontroll. Den genomsnittliga orala kortikosteroiddosen reducerades med 83 % på 400 mikrogram två gånger dagligen och 79 % på 800 mikrogram två gånger dagligen för PULMICORT TURBUHALER (budesonid)-behandlade patienter jämfört med 27 % för placebo. Dessutom förblev 58 av 64 patienter (91%) som helt eliminerade orala kortikosteroider under den dubbelblinda fasen av studien utan orala kortikosteroider i ytterligare 12 månader medan de fick PULMICORT 200 mikrogram TURBUHALER (budesonid).
PATIENTINFORMATION
Patientens bruksanvisning
Läs denna bipacksedel noggrant innan du börjar ta din medicin. Den ger en sammanfattning av information om ditt läkemedel. Att följa dessa instruktioner hjälper till att säkerställa att du andas in medicinen korrekt.
FÖR YTTERLIGARE INFORMATION FRÅGA DIN LÄKARE ELLER Apoteker.
VAD DU BÖR VETA OM PULMICORT TURBUHALER (budesonid)
Din läkare har ordinerat PULMICORT TURBUHALER 200 mcg. Den innehåller ett läkemedel som heter budesonid, som är en syntetisk kortikosteroid. Kortikosteroider är naturliga ämnen som finns i kroppen som hjälper till att bekämpa inflammation. De används för att behandla astma eftersom de minskar svullnad och irritation i väggarna i de små luftpassagerna i lungorna och underlättar andningsproblem. Vid inandning regelbundet hjälper kortikosteroider också till att förhindra astmaanfall.
PULMICORT TURBUHALER (budesonid) behandlar inflammationen – den "tysta delen" av astma som du inte kan höra, se eller känna. När inflammation lämnas obehandlad kan dina astmasymtom och attacker öka. PULMICORT 200mcg TURBUHALER (budesonid) verkar för att förebygga och minska dina astmasymtom och attacker.
VIKTIGA PUNKTER ATT KOMMA IHÅG OM PULMICORT TURBUHALER (budesonid)
SE till att detta läkemedel är lämpligt för dig (se "INNAN DU ANVÄNDER DIN PULMICORT TURBUHALER (budesonid)").
Det är viktigt att du andas in varje dos enligt din läkares anvisningar.
Använd din Turbuhaler enligt din läkares anvisningar. SLUTA INTE BEHANDLING ELLER MINSKA DIN DOS EVEN OM DU MÅR BÄTTRE, såvida inte din läkare säger att du ska göra det.
LÅT BLI andas in fler doser eller använd din Turbuhaler oftare än vad din läkare har ordinerat.
Denna medicin är INTE avsedd att ge snabb lindring av dina andningssvårigheter under ett astmaanfall. Det måste tas med jämna mellanrum enligt din läkares rekommendationer, och inte som en nödåtgärd.
Din läkare kan ordinera ytterligare mediciner (som luftrörsvidgare) för akut lindring
Om du också använder ett annat läkemedel genom inhalation, bör du rådfråga din läkare för instruktioner om när du ska använda det i samband med användning av din PULMICORT 100mcg TURBUHALER (budesonid).
INNAN DU ANVÄNDER DIN PULMICORT TURBUHALER (budesonid)
BERÄTTA FÖR DIN LÄKARE INNAN DU BÖRJAR TA DETTA LÄKEMEDEL OM DU:
- är gravid (eller planerar att bli gravid),
- ammar ett barn,
- är allergisk mot budesonid eller någon annan oralt inhalerad kortikosteroid,
- har några infektioner,
- har eller haft tuberkulos,
- har osteoporos,
- har nyligen varit runt någon med vattkoppor eller mässling,
- planerar att opereras,
- har tagit ett oralt kortikosteroidläkemedel som prednison. Du kan behöva följa specifika instruktioner för att undvika hälsorisker förknippade med att sluta använda dessa typer av läkemedel.
Under vissa omständigheter kanske detta läkemedel inte är lämpligt och din läkare kan vilja ordinera ett annat läkemedel. Se till att din läkare vet vilka andra läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, samt eventuella vitaminer eller kost- och örttillskott.
VILKA ÄR DE MÖJLIGA BIVERKNINGARNA AV PULMICORT TURBUHALER (budesonid)?
Som med alla inhalerade kortikosteroider bör du vara medveten om följande biverkningar:
- Ökad väsande andning direkt efter att ha tagit PULMICORT 100mcg TURBUHALER (budesonid). Ha alltid ett kortverkande luftrörsvidgande läkemedel med dig för att behandla plötslig väsande andning. Kortverkande luftrörsvidgande läkemedel hjälper till att slappna av musklerna runt luftvägarna i lungorna. Väsande andning uppstår när musklerna runt luftvägarna stramar. Detta gör det svårt att andas. I svåra fall kan väsande andning stoppa din andning och orsaka dödsfall om den inte behandlas omedelbart.
- Immunsystemets effekter och en högre risk för infektioner.
- Ögonproblem inklusive glaukom och grå starr. Ögonundersökningar bör övervägas när du använder PULMICORT TURBUHALER (budesonid).
- Ett barns tillväxt bör kontrolleras regelbundet när du tar PULMICOR TURBUHALER på grund av risken för långsam tillväxt.
Baserat på kliniska prövningar är de vanligaste biverkningarna som rapporterats av patienter som använder PULMICORT 100mcg TURBUHALER (budesonid):
- luftvägsinfektion
- huvudvärk
- influensasymptom
- öm hals
- bihåleinflammation
Dessa är inte alla möjliga biverkningar av PULMICORT TURBUHALER (budesonid). För mer information, fråga din läkare, sjukvårdspersonal eller apotekspersonal.
ANVÄNDA DIN PULMICORT TURBUHALER (budesonid)
- Följ instruktionerna som visas i avsnittet "HUR DU ANVÄNDER DIN PULMICORT 200mcg TURBUHALER". Om du har några problem, tala om för din läkare eller apotekspersonal.
- Det är viktigt att du andas in varje dos enligt anvisningar från din läkare. Apotekets etikett talar vanligtvis om vilken dos du ska ta och hur ofta. Om det inte gör det, eller om du är osäker, fråga din läkare eller apotekspersonal.
DOSERING
- Använd enligt anvisningar från din läkare.
- Det är VÄLDIGT VIKTIGT att du följer din läkares instruktioner om hur många inhalationer du ska ta och hur ofta du ska använda din PULMICORT TURBUHALER (budesonid).
- LÅT BLI andas in fler doser eller använd din PULMICORT TURBUHALER (budesonid) oftare än din läkare rekommenderar.
- Det kan ta 1 till 2 veckor eller längre innan du känner maximal förbättring, så DET ÄR MYCKET VIKTIGT ATT DU ANVÄNDER PULMICORT 100mcg TURBUHALER (budesonid) REGELBUNDET. SLUTA INTE BEHANDLING ELLER MINSKA DIN DOS EVEN OM DU MÅR BÄTTRE, såvida inte din läkare säger att du ska göra det.
- Om du missar en dos, ta bara din regelbundna schemalagda nästa dos när det är dags. DUBBEL INTE dosen.
HUR DU ANVÄNDER DIN PULMICORT TURBUHALER (budesonid)
Läs hela instruktionerna noggrant och använd endast enligt anvisningarna.
PRIMNINGSINSTRUKTIONER:
Innan du använder en ny PULMICORT 200mcg TURBUHALER (budesonid) för första gången bör du förbereda den. För att göra detta, vrid locket och lyft av. Håll PULMICORT TURBUHALER (budesonid) upprätt (med munstycket uppåt), vrid sedan det bruna greppet helt åt höger och tillbaka till vänster igen. Upprepa. Nu är du redo att ta din första dos (se instruktionerna för "TA EN DOS"). Du behöver inte grunda den någon annan gång efter detta, även om du lägger den åt sidan under en längre tid.
ATT TA EN DOS:
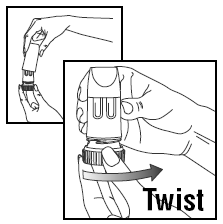
LADDA EN DOS
- Vrid locket och lyft av.
- För att ge rätt dos, PULMICORT TURBUHALER (budesonid) måste hållas i upprätt läge (munstycket upp) närhelst en dos läkemedel laddas.
- Vrid det bruna greppet helt åt höger så långt det går. Vrid tillbaka den helt åt vänster igen.
- Du kommer att höra ett klick.
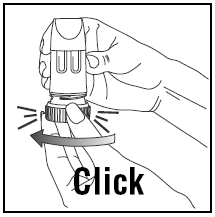
INANDNING AV DOSEN
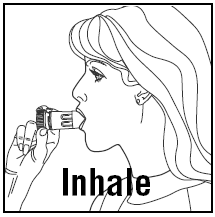
- När du andas in måste PULMICORT 200mcg TURBUHALER (budesonid) hållas i upprätt (munstycket uppåt) eller horisontellt läge.
- Vänd bort huvudet från inhalatorn och andas ut. Skaka inte inhalatorn efter att ha laddat den.
- Placera munstycket mellan dina läppar och andas in djupt och kraftfullt. Du kanske inte smakar eller känner av medicinen.
- Tugga eller bit inte på munstycket.
- Ta ut inhalatorn ur munnen och andas ut. Blås eller andas inte in i munstycket.
- Om mer än en dos krävs, upprepa bara stegen ovan.
- När du är klar, sätt tillbaka locket på inhalatorn och vrid igen. Skölj munnen med vatten. Svälj inte.
- Håll din PULMICORT TURBUHALER (budesonid) ren och torr hela tiden.
- Använd inte PULMICORT TURBUHALER (budesonid) om den har skadats eller om munstycket har lossnat.
FÖRVARING AV DIN PULMICORT TURBUHALER (budesonid)
- Efter varje användning, sätt tillbaka det vita locket och vrid det ordentligt på plats.
- Förvara PULMICORT TURBUHALER (budesonid) på en torr plats vid kontrollerad rumstemperatur, 68-77°F (20-25°C).
- Förvara din PULMICORT TURBUHALER (budesonid) på ett säkert ställe utanför räckvidd för små barn.
- LÅT BLI använd efter det datum som visas på kroppen av din Turbuhaler.
HUR MAN VET NÄR DIN PULMICORT TURBUHALER (budesonid) ÄR TOM
Etiketten på kartongen eller locket talar om hur många doser det finns i din PULMICORT TURBUHALER. Din PULMICORT TURBUHALER (budesonid) har ett bekvämt dosindikatorfönster precis under munstycket.
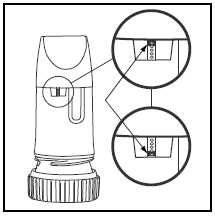
- När en röd markering visas överst i fönstret finns det 20 doser medicin kvar. Nu är det dags att skaffa din nästa PULMICORT 100mcg TURBUHALER (budesonid).
- När det röda märket når botten av fönstret ska din inhalator kasseras eftersom den kanske inte längre ger rätt mängd läkemedel. (Du kan fortfarande höra ett ljud om du skakar det – det här ljudet är inte läkemedlet. Detta ljud produceras av torkmedlet inuti Turbuhalern.)
- Kom ihåg att du får en ny inhalator varje gång du fyller på ditt recept.
- Doppa den inte i vatten för att se om den är tom. Kontrollera helt enkelt ditt dosindikatorfönster.
YTTERLIGARE INFORMATION OM PULMICORT TURBUHALER (budesonid)
- PULMICORT 200mcg TURBUHALER (budesonid) levererar din medicin som ett mycket fint pulver. På grund av detta kanske du inte smak, lukt eller känsla någon medicin som kommer in i lungorna när du andas in från PULMICORT TURBUHALER (budesonid) Detta betyder inte att du inte får din medicin.
- PULMICORT 100mcg TURBUHALER (budesonid) ska inte användas med en distans.
- PULMICORT 100mcg TURBUHALER innehåller endast budesonid och innehåller inga inaktiva ingredienser.
- PULMICORT TURBUHALER (budesonid) är speciellt utformad för att leverera endast en dos åt gången, oavsett hur ofta du klickar på det bruna greppet. Om du av misstag blåser in i din inhalator efter att ha laddat en dos, följ bara instruktionerna för att ladda en ny dos.
Denna bipacksedel innehåller inte fullständig information om ditt läkemedel. Om du har några frågor, eller är osäker på något, bör du fråga din läkare eller apotekspersonal.
Du kanske vill läsa denna broschyr igen. Vänligen KASTA INTE DET förrän du har avslutat din medicin.
KOM IHÅG: Detta läkemedel har ordinerats åt dig av din läkare. Ge INTE detta läkemedel till någon annan.
ANVÄND DENNA PRODUKT ENLIGT ANVISNINGAR, OM INTE DIN LÄKARE har fått instruktioner om att göra något annat.
Om du har ytterligare frågor om användningen av PULMICORT 100mcg TURBUHALER (budesonid), ring: 1-800-236-9933.
