Spiriva 9mcg Tiotropium Bromide Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Spiriva 9mcg HandiHaler och hur används det?
Spiriva HandiHaler (tiotropiumbromid) Inhalationspulver är ett antikolinergt läkemedel som används för att förhindra bronkospasm (förträngning av luftvägarna i lungorna) hos personer med bronkit, emfysem eller KOL (kronisk obstruktiv lungsjukdom).
Vilka är biverkningarna av Spiriva 9mcg HandiHaler?
Vanliga biverkningar av Spiriva 9mcg HandiHaler inkluderar:
- torr mun,
- förstoppning,
- orolig mage,
- kräkningar,
- förkylningssymtom (täppt näsa, nysningar, ont i halsen),
- näsblod, eller
- träningsvärk.
Tala om för din läkare om du har några allvarliga biverkningar av Spiriva 9mcg HandiHaler inklusive:
- svår eller smärtsam urinering, eller
- snabba hjärtslag.
BESKRIVNING
SPIRIVA 9mcg HANDIHALER består av SPIRIVA-kapslar och en HANDIHALER-enhet. Varje ljusgrön, hård gelatin SPIRIVA 9 mcg kapsel innehåller ett torrt pulver bestående av 18 mcg tiotropium (motsvarande 22,5 mcg tiotropiumbromidmonohydrat) blandat med laktosmonohydrat (som kan innehålla mjölkproteiner).
Innehållet i SPIRIVA-kapslarna är endast avsett för oral inhalation och är endast avsett för administrering med HANDIHALER-enheten.
Den aktiva beståndsdelen i SPIRIVA HANDIHALER är tiotropium. Läkemedlets substans, tiotropiumbromidmonohydrat, är ett antikolinergikum med specificitet för muskarina receptorer. Det beskrivs kemiskt som (1α, 2β, 4β, 5α, 7β)-7-[(Hydroxidi-2-tienylacetyl)oxi]-9,9-dimetyl-3-oxa-9-azoniatricyklo[3.3.1.02,4] nonanbromidmonohydrat. Det är en syntetisk, icke-kiral, kvartär ammoniumförening. Tiotropiumbromid är ett vitt eller gulvitt pulver. Det är svårlösligt i vatten och lösligt i metanol.
Strukturformeln är:
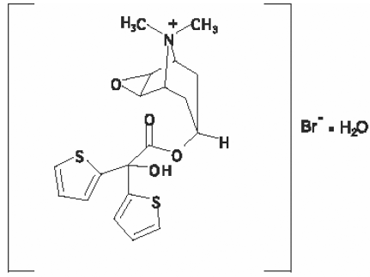
Tiotropiumbromid (monohydrat) har en molekylvikt på 490,4 och en molekylformel av C19H22NO4S2Br • H2O.
HANDIHALER-anordningen är en inhalationsanordning som används för att inhalera det torra pulvret som finns i SPIRIVA 9mcg-kapseln. Det torra pulvret levereras från HANDIHALER-enheten med flödeshastigheter så låga som 20 l/min. Under standardiserad in vitro-testning levererar HANDIHALER-enheten i medeltal 10,4 mcg tiotropium när den testas med en flödeshastighet på 39 l/min under 3,1 sekunder (2 L totalt). I en studie av 26 vuxna patienter med KOL och allvarligt nedsatt lungfunktion [medelvärde FEV1 1,02 L (intervall 0,45 till 2,24 L); 37,6 % av förutspått (intervall 16 % till 65 %)], mediantoppinandningsflödet (PIF) genom HANDIHALER-anordningen var 30,0 L/min (intervall 20,4 till 45,6 L/min). Mängden läkemedel som levereras till lungorna kommer att variera beroende på patientfaktorer som inspiratoriskt flöde och maximalt inspiratoriskt flöde genom HANDIHALER-enheten, vilket kan variera från patient till patient och kan variera med exponeringstiden för SPIRIVA 9 mcg-kapseln utanför blistern. packa.
INDIKATIONER
SPIRIVA HANDIHALER (tiotropiumbromid inhalationspulver) är indicerat för långsiktig underhållsbehandling en gång dagligen av bronkospasm i samband med kronisk obstruktiv lungsjukdom (KOL), inklusive kronisk bronkit och emfysem. SPIRIVA 9mcg HANDIHALER är indicerat för att minska exacerbationer hos KOL-patienter.
DOSERING OCH ADMINISTRERING
Endast för oral inandning. Svälj inte SPIRIVA 9 mcg kapslar, eftersom den avsedda effekten på lungorna inte kommer att uppnås. Innehållet i SPIRIVA-kapslarna ska endast användas med HANDIHALER-enheten [ser ÖVERDOS ].
Den rekommenderade dosen av SPIRIVA HANDIHALER är två inhalationer av pulverinnehållet i en SPIRIVA-kapsel, en gång dagligen, med HANDIHALER-anordningen [se PATIENTINFORMATION ]. Ta inte mer än en dos på 24 timmar.
För administrering av SPIRIVA HANDIHALER placeras en SPIRIVA 9 mcg kapsel i HANDIHALER-enhetens mittkammare. SPIRIVA 9mcg-kapseln genomborras genom att trycka och släppa den gröna håltagningsknappen på sidan av HANDIHALER-enheten. Tiotropiumformuleringen dispergeras i luftströmmen när patienten andas in genom munstycket [se PATIENTINFORMATION ].
Ingen dosjustering krävs för geriatriska, nedsatt lever- eller njurfunktion. Patienter med måttligt till gravt nedsatt njurfunktion som får SPIRIVA 9 mcg HANDIHALER bör dock övervakas noggrant med avseende på antikolinerga effekter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , Användning i specifika populationer , och KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
Inandningspulver
SPIRIVA 9mcg HANDIHALER består av SPIRIVA-kapslar innehållande tiotropiumpulver för oral inhalation och en HANDIHALER-enhet. SPIRIVA 9 mcg kapslar innehåller 18 mcg tiotropium i en ljusgrön, hård gelatinkapsel med TI 01 tryckt på ena sidan och Boehringer Ingelheims företagslogotyp på andra sidan. HANDIHALER-enheten är endast avsedd för användning med SPIRIVA-kapslarna.
Förvaring Och Hantering
SPIRIVA HANDIHALER består av SPIRIVA 9mcg kapslar och HANDIHALER-enheten. SPIRIVA 9 mcg kapslar innehåller 18 mcg tiotropium och är ljusgröna, med Boehringer Ingelheims företagslogotyp på SPIRIVA kapselkapseln och TI 01 på SPIRIVA kapselkroppen, eller vice versa.
HANDIHALER-enheten är grå med en grön piercingknapp. Den är präglad med SPIRIVA HANDIHALER (tiotropiumbromid inhalationspulver), Boehringer Ingelheims företagslogotyp. Den är också stämplad för att indikera att SPIRIVA-kapslar inte ska förvaras i HANDIHALER-enheten och att HANDIHALER-enheten endast ska användas med SPIRIVA 9 mcg-kapslar.
SPIRIVA 9 mcg kapslar är förpackade i ett blisterkort av aluminium/aluminium och sammanfogade längs en perforerad linje. SPIRIVA 9mcg kapslar ska alltid förvaras i blisterförpackningen och endast tas ut omedelbart före användning. Läkemedlet ska användas omedelbart efter att förpackningen över en individuell SPIRIVA-kapsel har öppnats.
Följande paket är tillgängliga:
- kartong innehållande 5 SPIRIVA 9 mcg kapslar (1 enhetsdos blisterkort) och 1 HANDIHALER inhalationsanordning ( NDC 0597-0075-75) (institutionellt paket)
- kartong innehållande 30 SPIRIVA 9 mcg kapslar (3 enhetsdosblisterkort) och 1 HANDIHALER inhalationsanordning ( NDC 0597-0075-41)
- kartong innehållande 90 SPIRIVA-kapslar (9 enhetsdosblisterkort) och 1 HANDIHALER-inhalationsanordning ( NDC 0597-0075-47)
Förvara utom räckhåll för barn. Få inte pulver i ögonen.
Lagring
Förvara vid 25°C (77°F); utflykter tillåtna till 15° till 30°C (59° till 86°F) [se USP kontrollerad rumstemperatur].
SPIRIVA-kapslarna ska inte utsättas för extrem temperatur eller fukt. Förvara inte SPIRIVA 9 mcg kapslar i HANDIHALER-enheten.
Distribueras av: Boehringer Ingelheim Pharmaceuticals, Inc. Ridgefield, CT 06877 USA. Reviderad: februari 2018
BIEFFEKTER
Följande biverkningar beskrivs eller beskrivs mer i detalj i andra avsnitt:
- Omedelbara överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Paradoxal bronkospasm [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Försämring av trångvinkelglaukom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Försämring av urinretention [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan förekomsten av biverkningar som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvensen i de kliniska prövningarna av ett annat läkemedel och återspeglar kanske inte de förekomster som observerats i praktiken.
6-månaders till 1-års prov
Data som beskrivs nedan återspeglar exponering för SPIRIVA 9mcg HANDIHALER hos 2663 patienter. SPIRIVA 9mcg HANDIHALER studerades i två 1-åriga placebokontrollerade prövningar, två 1-åriga aktivkontrollerade prövningar och två 6-månaders placebokontrollerade prövningar på patienter med KOL. I dessa studier behandlades 1308 patienter med SPIRIVA HANDIHALER i den rekommenderade dosen på 18 mikrogram en gång dagligen. Befolkningen hade en ålder som sträckte sig från 39 till 87 år med 65 % till 85 % män, 95 % kaukasiska och hade KOL med en genomsnittlig pre-bronkdilaterande forcerad expiratorisk volym på en sekund (FEV1) procent förutspådd på 39 % till 43 %. Patienter med trångvinkelglaukom eller symtomatisk prostatahypertrofi eller obstruktion av blåsutloppet exkluderades från dessa studier. En ytterligare 6-månaders studie utförd i en Veteran's Affairs-miljö ingår inte i denna säkerhetsdatabas eftersom endast allvarliga biverkningar samlades in.
Den vanligaste rapporterade biverkningen var muntorrhet. Muntorrhet var vanligtvis mild och försvann ofta under fortsatt behandling. Andra reaktioner som rapporterats hos enskilda patienter och som överensstämmer med möjliga antikolinerga effekter inkluderar förstoppning, takykardi, dimsyn, glaukom (nyuppstått eller förvärrad), dysuri och urinretention.
Fyra multicenter, 1-åriga, placebokontrollerade och aktivkontrollerade studier utvärderade SPIRIVA HANDIHALER hos patienter med KOL. Tabell 1 visar alla biverkningar som inträffade med en frekvens på ≥3 % i SPIRIVA 9 mcg HANDIHALER-gruppen i de 1-åriga placebokontrollerade studierna där frekvensen i SPIRIVA HANDIHALER-gruppen översteg placebo med ≥1 %. Frekvensen av motsvarande reaktioner i de ipratropiumkontrollerade studierna ingår för jämförelse.
Artrit, hosta och influensaliknande symtom förekom i en frekvens av ≥3 % i SPIRIVA 9 mcg HANDIHALER-behandlingsgruppen, men var
Andra reaktioner som inträffade i SPIRIVA HANDIHALER-gruppen med en frekvens på 1 % till 3 % i de placebokontrollerade studierna där frekvensen översteg den i placebogruppen inkluderar:
Kroppen som helhet: allergisk reaktion, smärta i benen;
Centrala och perifera nervsystemet: dysfoni, parestesi;
Gastrointestinala störningar: gastrointestinala störningar som inte anges på annat sätt (NOS), gastroesofageal reflux, stomatit (inklusive ulcerös stomatit);
Metaboliska och näringsmässiga störningar: hyperkolesterolemi, hyperglykemi;
Muskuloskeletala systemet: skelettsmärta;
Hjärthändelser: angina pectoris (inklusive förvärrad angina pectoris);
Psykiatrisk sjukdom: depression; Infektioner: herpes zoster;
Störning i andningsorganen (övre): laryngit;
Synstörning: grå starr.
Bland de biverkningar som observerats i de kliniska prövningarna med en incidens på
de 1-åriga försöken ökade förekomsten av muntorrhet, förstoppning och urinvägsinfektion med åldern [se Användning i specifika populationer ].
Två multicenter, 6-månaders, kontrollerade studier utvärderade SPIRIVA 9 mcg HANDIHALER hos patienter med KOL. Biverkningarna och incidensen liknade de som sågs i de 1-åriga kontrollerade studierna.
4-årig provperiod
Data som beskrivs nedan återspeglar exponering för SPIRIVA 9mcg HANDIHALER hos 5992 KOL-patienter i en 4-årig placebokontrollerad studie. I denna studie behandlades 2986 patienter med SPIRIVA 9 mcg HANDIHALER i den rekommenderade dosen på 18 mcg en gång om dagen. Befolkningen hade ett åldersintervall från 40 till 88 år, var 75% män, 90% kaukasiska och hade KOL med en genomsnittlig pre-bronkdilaterande FEV1 procent förutspådd på 40%. Patienter med trångvinkelglaukom eller symtomatisk prostatahypertrofi eller obstruktion av blåsutloppet exkluderades från dessa studier. När biverkningarna analyserades med en frekvens på ≥3 % i SPIRIVA 9mcg HANDIHALER-gruppen där frekvensen i SPIRIVA 9mcg HANDIHALER-gruppen översteg placebo med ≥1 %, inkluderade biverkningar (SPIRIVA 9mcg HANDIHALER, placebo): 12,5 %pharyngitis , 10,8 %), bihåleinflammation (6,5 %, 5,3 %), huvudvärk (5,7 %, 4,5 %), förstoppning (5,1 %, 3,7 %), muntorrhet (5,1 %, 2,7 %), depression (4,4 %, 3,3 %) , sömnlöshet (4,4 %, 3,0 %) och artralgi (4,2 %, 3,1 %).
Ytterligare biverkningar
Andra biverkningar som inte tidigare listats och som rapporterades oftare hos KOL-patienter som behandlades med SPIRIVA 9mcg HANDIHALER än placebo inkluderar: uttorkning, hudsår, stomatit, gingivit, orofaryngeal candidiasis, torr hud, hudinfektion och ledsvullnad.
Erfarenhet efter marknadsföring
Biverkningar har identifierats under världsomspännande användning av SPIRIVA HANDIHALER efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering. Dessa biverkningar är: irritation på appliceringsstället (glossit, munsår och svalgsmärta), yrsel, dysfagi, heshet, intestinal obstruktion inklusive paralytisk ileus, ökat intraokulärt tryck, oral candidiasis, hjärtklappning, klåda, takykardi, halsirritation och svalg.
LÄKEMEDELSINTERAKTIONER
Sympatomimetika, Metylxantiner, Steroider
SPIRIVA 9mcg HANDIHALER har använts samtidigt med kortverkande och långverkande sympatomimetiska (beta-agonister) bronkodilatorer, metylxantiner och orala och inhalerade steroider utan ökning av biverkningar.
Antikolinergika
Det finns potential för en additiv interaktion med samtidigt använda antikolinerga läkemedel. Undvik därför samtidig administrering av SPIRIVA 9mcg HANDIHALER med andra antikolinerga läkemedel eftersom detta kan leda till en ökning av antikolinerga biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Ej för akut användning
SPIRIVA 9mcg HANDIHALER är avsedd som en underhållsbehandling en gång dagligen för KOL och ska inte användas för lindring av akuta symtom, dvs som räddningsterapi för behandling av akuta episoder av bronkospasm.
Omedelbara överkänslighetsreaktioner
Omedelbara överkänslighetsreaktioner, inklusive urtikaria, angioödem (inklusive svullnad av läppar, tunga eller svalg), utslag, bronkospasm, anafylaxi eller klåda, kan uppstå efter administrering av SPIRIVA 9 mcg HANDIHALER. Om en sådan reaktion inträffar ska behandlingen med SPIRIVA 9mcg HANDIHALER avbrytas omedelbart och alternativa behandlingar bör övervägas. Med tanke på strukturformeln som liknar atropin och tiotropium, bör patienter med en historia av överkänslighetsreaktioner mot atropin eller dess derivat övervakas noggrant för liknande överkänslighetsreaktioner som SPIRIVA HANDIHALER. Dessutom bör SPIRIVA HANDIHALER användas med försiktighet till patienter med allvarlig överkänslighet mot mjölkproteiner.
Paradoxal bronkospasm
Inhalationsläkemedel, inklusive SPIRIVA HANDIHALER, kan orsaka paradoxal bronkospasm. Om detta inträffar ska det behandlas omedelbart med en inhalerad kortverkande beta2-agonist såsom albuterol. Behandling med SPIRIVA HANDIHALER bör avbrytas och andra behandlingar övervägas.
Försämring av smalvinkelglaukom
SPIRIVA 9mcg HANDIHALER ska användas med försiktighet hos patienter med trångvinkelglaukom. Förskrivare och patienter bör vara uppmärksamma på tecken och symtom på akut trångvinkelglaukom (t.ex. ögonsmärta eller obehag, dimsyn, synglorier eller färgade bilder i samband med röda ögon från konjunktival congestion och hornhinneödem). Instruera patienterna att omedelbart konsultera en läkare om något av dessa tecken eller symtom skulle utvecklas.
Försämring av urinretention
SPIRIVA HANDIHALER ska användas med försiktighet hos patienter med urinretention. Förskrivare och patienter bör vara uppmärksamma på tecken och symtom på urinretention (t.ex. svårigheter att kasta urin, smärtsam urinering), särskilt hos patienter med prostatahyperplasi eller blåshalsobstruktion. Instruera patienterna att omedelbart konsultera en läkare om något av dessa tecken eller symtom skulle utvecklas.
Nedsatt njurfunktion
Som ett övervägande renalt utsöndrat läkemedel bör patienter med måttligt till gravt nedsatt njurfunktion (kreatininclearance KLINISK FARMAKOLOGI ].
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION och bruksanvisning ).
Ej för akut användning
Informera patienterna om att SPIRIVA HANDIHALER är en luftrörsvidgare för underhåll en gång dagligen och inte bör användas för omedelbar lindring av andningsproblem (dvs. som ett räddningsmedicin).
Omedelbara överkänslighetsreaktioner
Informera patienter om att anafylaxi, angioödem (inklusive svullnad av läppar, tunga eller svalg), urtikaria, utslag, bronkospasm eller klåda kan uppstå efter administrering av SPIRIVA 9 mcg HANDIHALER. Rekommendera patienten att omedelbart avbryta behandlingen och konsultera en läkare om något av dessa tecken eller symtom uppstår.
Paradoxal bronkospasm
Informera patienterna om att SPIRIVA HANDIHALER kan ge paradoxal bronkospasm. Informera patienterna om att om paradoxal bronkospasm uppstår, bör patienterna avbryta behandlingen med SPIRIVA HANDIHALER.
Försämring av smalvinkelglaukom
Instruera patienterna att vara uppmärksamma på tecken och symtom på trångvinkelglaukom (t.ex. ögonsmärta eller obehag, dimsyn, synglorier eller färgbilder i samband med röda ögon från konjunktival congestion och hornhinneödem). Instruera patienterna att omedelbart konsultera en läkare om något av dessa tecken och symtom skulle utvecklas.
Informera patienterna om att försiktighet måste iakttas så att pulvret inte kommer in i ögonen eftersom det kan orsaka dimsyn och pupillvidgning.
Eftersom yrsel och dimsyn kan uppstå vid användning av SPIRIVA HANDIHALER, varna patienter för att delta i aktiviteter som att köra fordon eller använda apparater eller maskiner.
Försämring av urinretention
Instruera patienterna att vara uppmärksamma på tecken och symtom på urinretention (t.ex. svårigheter att kissa, smärtsam urinering). Instruera patienterna att omedelbart konsultera en läkare om något av dessa tecken eller symtom skulle utvecklas.
Instruktioner för administrering av SPIRIVA HANDIHALER
Instruera patienter om hur de korrekt administrerar SPIRIVA 9mcg kapslar med hjälp av HANDIHALER-enheten [se PATIENTINFORMATION ]. Instruera patienterna att SPIRIVA 9 mcg kapslar endast ska administreras via HANDIHALER-enheten och HANDIHALER-enheten inte ska användas för administrering av andra läkemedel. Påminn patienterna om att innehållet i SPIRIVA 9mcg kapslar endast är för oral inhalation och inte får sväljas.
Instruera patienterna att alltid förvara SPIRIVA 9 mcg kapslar i förseglade blister och att ta bort endast en SPIRIVA kapsel omedelbart före användning, annars kan dess effektivitet minska. Instruera patienterna att kassera oanvända ytterligare SPIRIVA-kapslar som exponeras för luft (dvs. inte avsedda för omedelbar användning).
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Inga tecken på tumörframkallande egenskaper observerades i en 104-veckors inhalationsstudie på råttor vid tiotropiumdoser upp till 59 mikrogram/kg/dag, i en 83-veckors inhalationsstudie på honmöss vid doser upp till 145 mikrogram/kg/dag, och i en 101-veckors inhalationsstudie på hanmöss i doser upp till 2 mikrogram/kg/dag. Dessa doser motsvarar cirka 30, 40 respektive 0,5 gånger den rekommenderade dagliga inhalationsdosen för människor (MRHDID) på mcg/m2-basis.
Tiotropiumbromid visade inga tecken på mutagenicitet eller klastogenicitet i följande analyser: bakteriegenmutationsanalysen, V79 kinesisk hamstercellmutagenesanalysen, kromosomavvikelseanalyserna i humana lymfocyter in vitro och mus-mikronkärnbildning in vivo, och den oplanerade DNA-syntesen primära råtthepatocyter in vitro-analys.
Hos råttor noterades minskningar av antalet corpora lutea och andelen implantat vid inhalationsdoser av tiotropium på 78 mcg/kg/dag eller mer (ungefär 40 gånger MRHDID på en mcg/m2-basis). Inga sådana effekter observerades vid 9 mcg/kg/dag (ungefär 5 gånger MRHDID på mcg/m2-basis). Fertilitetsindexet påverkades dock inte vid inhalationsdoser upp till 1689 mcg/kg/dag (ungefär 910 gånger MRHDID på en mcg/m2-basis).
Användning i specifika populationer
Graviditet
Risksammanfattning
De begränsade humandata med användning av SPIRIVA 9mcg HANDIHALER under graviditet är otillräckliga för att informera om en läkemedelsrelaterad risk för negativa graviditetsrelaterade utfall. Baserat på reproduktionsstudier på djur observerades inga strukturella abnormiteter när tiotropium administrerades genom inhalation till dräktiga råttor och kaniner under organogenesperioden vid doser 790 respektive 8 gånger den maximala rekommenderade humana dagliga inhalationsdosen (MRHDID). Ökad förlust efter implantation observerades hos råttor och kaniner som administrerades tiotropium vid maternalt toxiska doser 430 gånger respektive 40 gånger MRHDID [se Data ].
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Data
Djurdata
2 separata embryo-fosterutvecklingsstudier fick gravida råttor och kaniner tiotropium under organogenesperioden i doser upp till cirka 790 respektive 8 gånger MRHDID (på en mcg/m2-basis vid inhalationsdoser på 1471 och 7 mcg/kg /dag hos råttor respektive kaniner). Inga tecken på strukturella abnormiteter observerades hos råttor eller kaniner. Hos råttor orsakade dock tiotropium fosterresorption, kullförlust, minskningar av antalet levande ungar vid födseln och medelvikten av valparna, och en fördröjning av ungas könsmognad vid tiotropiumdoser på cirka 40 gånger MRHDID (på en mcg/m2) vid en modern inhalationsdos på 78 mikrogram/kg/dag). Hos kaniner orsakade tiotropium en ökning av postimplantationsförlusten vid en tiotropiumdos på cirka 430 gånger MRHDID (på en mcg/m2-basis vid en moderns inhalationsdos på 400 mcg/kg/dag). Sådana effekter observerades inte vid cirka 5 respektive 95 gånger MRHDID (på en mcg/m2-basis vid inhalationsdoser på 9 och 88 mcg/kg/dag hos råttor respektive kaniner).
Laktation
Risksammanfattning
Det finns inga data om förekomsten av tiotropium i bröstmjölk, effekterna på det ammade barnet eller effekterna på mjölkproduktionen. Tiotropium finns i mjölk från digivande råttor; Men på grund av artspecifika skillnader i amningsfysiologi är den kliniska relevansen av dessa data inte klarlagd [se Data ]. Utvecklings- och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av SPIRIVA 9mcg HANDIHALER och eventuella negativa effekter på det ammade barnet från SPIRIVA HANDIHALER eller från det underliggande moderns tillståndet.
Data
Fördelningen av tiotropiumbromid i mjölk undersöktes efter en enda intravenös administrering av 10 mg/kg till digivande råttor. Tiotropium och/eller dess metaboliter finns i mjölken hos digivande råttor i koncentrationer över dem i plasma.
Pediatrisk användning
SPIRIVA HANDIHALER är inte indicerat för användning till barn. Säkerheten och effekten av SPIRIVA 9mcg HANDIHALER hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Baserat på tillgängliga data är ingen justering av SPIRIVA HANDIHALER-dosen berättigad till geriatriska patienter [se KLINISK FARMAKOLOGI ].
Av det totala antalet patienter som fick SPIRIVA 9 mcg HANDIHALER i de 1-åriga kliniska prövningarna var 426
Nedsatt njurfunktion
Patienter med måttligt till gravt nedsatt njurfunktion (kreatininclearance DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , och KLINISK FARMAKOLOGI ].
Nedsatt leverfunktion
Effekterna av nedsatt leverfunktion på farmakokinetiken för tiotropium har inte studerats.
ÖVERDOS
Höga doser av tiotropium kan leda till antikolinerga tecken och symtom. Det fanns dock inga systemiska antikolinerga biverkningar efter en enstaka inhalerad dos på upp till 282 mikrogram tiotropium hos 6 friska frivilliga. I en studie av 12 friska frivilliga sågs bilateral konjunktivit och muntorrhet efter upprepad inhalation en gång dagligen av 141 mikrogram tiotropium.
Behandling av överdosering består av utsättande av SPIRIVA HANDIHALER tillsammans med insättande av lämplig symtomatisk och/eller stödjande behandling.
Oavsiktligt förtäring
Akut förgiftning genom oavsiktligt oralt intag av SPIRIVA-kapslar är osannolikt eftersom det inte absorberas väl systemiskt.
Ett fall av överdosering har rapporterats efter marknadsföring. En kvinnlig patient rapporterades ha inhalerat 30 kapslar under en period på 2,5 dagar och utvecklat förändrad mental status, skakningar, buksmärtor och svår förstoppning. Patienten lades in på sjukhus, SPIRIVA HANDIHALER avbröts och förstoppningen behandlades med lavemang. Patienten återhämtade sig och skrevs ut samma dag.
KONTRAINDIKATIONER
SPIRIVA 9mcg HANDIHALER är kontraindicerat hos patienter med överkänslighet mot tiotropium, ipratropium eller någon av komponenterna i denna produkt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. I kliniska prövningar och erfarenhet efter marknadsföring av SPIRIVA 9mcg HANDIHALER har omedelbara överkänslighetsreaktioner, inklusive angioödem (inklusive svullnad av läppar, tunga eller svalg), klåda eller utslag rapporterats [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Tiotropium är ett långtidsverkande, antimuskarint medel, som ofta kallas antikolinergt. Den har liknande affinitet till undertyperna av muskarina receptorer, M1 till M5. I luftvägarna uppvisar det farmakologiska effekter genom hämning av M3-receptorer vid den glatta muskulaturen, vilket leder till bronkodilation. Den kompetitiva och reversibla karaktären av antagonism visades med humana och animaliska receptorer och isolerade organpreparat. I prekliniska in vitro- såväl som in vivo-studier var förebyggandet av metakolininducerade bronkokonstriktionseffekter dosberoende och varade längre än 24 timmar. Bronkodilationen efter inhalation av tiotropium är huvudsakligen en platsspecifik effekt.
Farmakodynamik
Hjärtets elektrofysiologi
en multicenter, randomiserad, dubbelblind studie med tiotropium torrt pulver för inhalation som inkluderade 198 patienter med KOL, var antalet försökspersoner med förändringar från baslinjekorrigerat QT-intervall på 30 till 60 msek högre i SPIRIVA 9 mcg HANDIHALER-gruppen jämfört med med placebo. Denna skillnad var uppenbar med både Bazett (QTcB) [20 (20 %) patienter vs. 12 (12 %) patienter] och Fredericia (QTcF) [16 (16 %) patienter vs. 1 (1 %) patient] korrigeringar av QT för hjärtfrekvens. Inga patienter i någon av grupperna hade varken QTcB eller QTcF på >500 msek. Andra kliniska studier med SPIRIVA HANDIHALER upptäckte ingen effekt av läkemedlet på QTc-intervall.
Effekten av tiotropium torrt pulver för inhalation på QT-intervallet utvärderades också i en randomiserad, placebo- och positivt kontrollerad crossover-studie på 53 friska frivilliga. Försökspersonerna fick tiotropium torrt pulver för inhalation 18 mcg, 54 mcg (3 gånger den rekommenderade dosen) eller placebo i 12 dagar. EKG-bedömningar utfördes vid baslinjen och under hela doseringsintervallet efter den första och sista dosen av studiemedicin. I förhållande till placebo var den maximala genomsnittliga förändringen från baslinjen i studiespecifikt QTc-intervall 3,2 msek och 0,8 msek för tiotropium torrt pulver för inhalation 18 mcg respektive 54 mcg. Ingen försöksperson visade en ny start av QTc >500 ms eller QTc-förändringar från baslinjen på ≥60 ms.
Farmakokinetik
Tiotropium administreras genom inandning av torrt pulver. Vissa av de farmakokinetiska data som beskrivs nedan erhölls med högre doser än vad som rekommenderas för terapi. En dedikerad farmakokinetisk studie på patienter med KOL som utvärderade tiotropium en gång dagligen från RESPIMAT-inhalatorn (5 mikrogram) och som inhalationspulver (18 mikrogram) från HANDIHALER-enheten resulterade i en liknande systemisk exponering mellan de två produkterna.
Absorption
Efter inandning av torrt pulver av unga friska frivilliga, tyder den absoluta biotillgängligheten på 19,5 % på att fraktionen som når lungan är mycket biotillgänglig. Orala lösningar av tiotropium har en absolut biotillgänglighet på 2-3 %. Mat förväntas inte påverka absorptionen av tiotropium. Maximala plasmakoncentrationer av tiotropium observerades 7 minuter efter inhalation.
Distribution
Tiotropium är till 72 % bundet till plasmaprotein och hade en distributionsvolym på 32 l/kg efter intravenös administrering till unga friska frivilliga. Lokala koncentrationer i lungan är inte kända, men administreringssättet tyder på väsentligt högre koncentrationer i lungan. Studier på råttor har visat att tiotropium inte lätt penetrerar blod-hjärnbarriären.
Eliminering
Den terminala halveringstiden för tiotropium hos KOL-patienter efter inhalation en gång dagligen av 5 mikrogram tiotropium var cirka 25 timmar. Totalt clearance var 880 ml/min efter intravenös administrering hos unga friska frivilliga. Efter kronisk inandning av torrt pulver en gång dagligen av KOL-patienter nåddes farmakokinetisk steady state dag 7 utan ackumulering därefter.
Ämnesomsättning
Omfattningen av ämnesomsättningen är liten. Detta framgår av en urinutsöndring av 74 % av oförändrad substans efter en intravenös dos till unga friska frivilliga. Tiotropium, en ester, spjälkas icke-enzymatiskt till alkoholen N-metylskopin och ditienylglykolsyra, varav ingen binder till muskarina receptorer.
In vitro-experiment med humana levermikrosomer och humana hepatocyter tyder på att en del av den administrerade dosen (74 % av en intravenös dos utsöndras oförändrad i urinen, vilket lämnar 25 % för metabolism) metaboliseras av cytokrom P450-beroende oxidation och efterföljande glutationkonjugering till en mängd olika fas II-metaboliter. Denna enzymatiska väg kan hämmas av CYP450 2D6- och 3A4-hämmare, såsom kinidin, ketokonazol och gestoden. Således är CYP450 2D6 och 3A4 involverade i den metaboliska vägen som är ansvarig för elimineringen av en liten del av den administrerade dosen. In vitro-studier med humana levermikrosomer visade att tiotropium i supraterapeutiska koncentrationer inte hämmade CYP450 1A1, 1A2, 2B6, 2C9, 2C19, 2D6, 2E1 eller 3A4.
Exkretion
Intravenöst administrerad tiotropiumbromid utsöndras huvudsakligen oförändrad i urinen (74%). Efter inandning av torrt pulver till KOL-patienter vid steady state var urinutsöndringen 7 % (1,3 mikrogram) av den oförändrade dosen under 24 timmar. Njurclearancen av tiotropium överstiger kreatininclearancen, vilket tyder på utsöndring i urinen.
Specifika populationer
Geriatriska patienter
Som förväntat för alla läkemedel som huvudsakligen utsöndras genom njurarna, var högre ålder associerad med en minskning av renal clearance av tiotropium (365 ml/min hos KOL-patienter
Nedsatt njurfunktion
Efter 4 veckors SPIRIVA 9mcg HANDIHALER eller SPIRIVA 9mcg RESPIMAT en gång dagligen till patienter med KOL, resulterade mild njurfunktionsnedsättning (kreatininclearance 60-
Nedsatt leverfunktion
Effekterna av nedsatt leverfunktion på farmakokinetiken för tiotropium har inte studerats.
Läkemedelsinteraktioner
En interaktionsstudie med tiotropium (14,4 mikrogram intravenös infusion under 15 minuter) och cimetidin 400 mg tre gånger dagligen eller ranitidin 300 mg en gång dagligen genomfördes. Samtidig administrering av cimetidin och tiotropium resulterade i en 20 % ökning av AUC0-4h, en 28 % minskning av renal clearance av tiotropium och ingen signifikant förändring av Cmax och mängd som utsöndras i urinen under 96 timmar. Samtidig administrering av tiotropium och ranitidin påverkade inte farmakokinetiken för tiotropium.
Vanliga samtidiga läkemedel (långverkande beta2-adrenerga agonister (LABA), inhalerade kortikosteroider (ICS)) som används av patienter med KOL visade sig inte förändra exponeringen för tiotropium.
Kliniska studier
SPIRIVA 9mcg HANDIHALER (tiotropiumbromid inhalationspulver) kliniska utvecklingsprogrammet bestod av sex fas 3-studier på 2663 patienter med KOL (1308 som fick SPIRIVA 9mcg HANDIHALER): två 1-åriga, placebokontrollerade studier, två 6-månaders, placebokontrollerade studier studier och två 1-åriga, ipratropiumkontrollerade studier. Dessa studier inkluderade patienter som hade en klinisk diagnos av KOL, var 40 år eller äldre, hade en historia av rökning i mer än 10 pack-år, hade en forcerad utandningsvolym på en sekund (FEV1) mindre än eller lika med 60 % eller 65 % av förutsagt, och ett förhållande mellan FEV1/FVC som är mindre än eller lika med 0,7.
I dessa studier gav SPIRIVA HANDIHALER, administrerat en gång dagligen på morgonen, förbättring av lungfunktionen (FEV1), med maximal effekt inom 3 timmar efter den första dosen.
Två ytterligare studier utvärderade exacerbationer: en 6-månaders, randomiserad, dubbelblind, placebokontrollerad, multicenter klinisk prövning av 1829 KOL-patienter i en US Veterans Affairs-miljö och en 4-årig, randomiserad, dubbelblind, placebokontrollerad, multicenter, klinisk prövning av 5992 KOL-patienter. Långtidseffekter på lungfunktion och andra resultat utvärderades också i den 4-åriga multicenterstudien.
6-månaders till 1-års effekter på lungfunktionen
de 1-åriga placebokontrollerade studierna var den genomsnittliga förbättringen av FEV1 efter 30 minuter 0,13 liter (13 %) med en maximal förbättring på 0,24 liter (24 %) jämfört med baslinjen efter den första dosen (dag 1). Ytterligare förbättringar av FEV1 och forcerad vitalkapacitet (FVC) observerades med farmakodynamisk steady state nådd dag 8 med behandling en gång dagligen. Den genomsnittliga maximala förbättringen av FEV1, i förhållande till baslinjen, var 0,28 till 0,31 liter (28 % till 31 %), efter 1 vecka (dag 8) av behandling en gång dagligen. Förbättring av lungfunktionen bibehölls i 24 timmar efter en engångsdos och bibehölls konsekvent under den 1-åriga behandlingsperioden utan tecken på tolerans.
de två 6-månaders placebokontrollerade studierna utfördes seriella spirometriska utvärderingar under dagtid i försök A (12 timmar) och begränsade till 3 timmar i försök B. De seriella FEV1-värdena över 12 timmar (försök A) visas i Figur 1. Dessa försök stöder ytterligare förbättringen av lungfunktionen (FEV1) med SPIRIVA 9mcg HANDIHALER, som kvarstod under den spirometriska observationsperioden. Effektiviteten bibehölls i 24 timmar efter administrering under den 6 månader långa behandlingsperioden.
Figur 1: Genomsnittlig FEV1 över tid (före och efter administrering av studieläkemedlet) på dag 1 och 169 för försök A (en sex månader lång placebokontrollerad studie)* 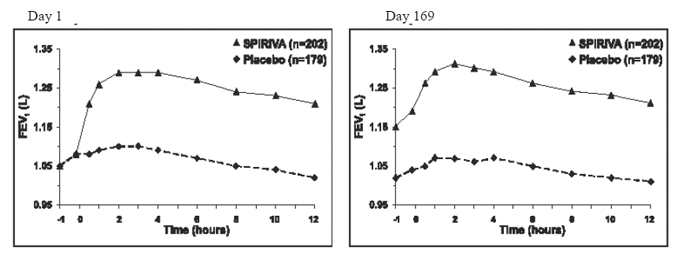
*Medel justerat för centrum, behandling och baslinjeeffekt. På dag 169 slutförde totalt 183 och 149 patienter i SPIRIVA HANDIHALER- respektive placebogruppen studien. Data för de återstående patienterna imputerades med hjälp av den senaste observationen eller den minst gynnsamma observationen som överfördes.
Resultaten från var och en av de 1-åriga ipratropiumkontrollerade studierna liknade resultaten från de 1-åriga placebokontrollerade studierna. Resultaten av en av dessa försök visas i figur 2.
Figur 2: Genomsnittlig FEV1 över tid (0 till 6 timmar efter dosering) på dag 1 respektive 92 för en av de två Ipratropium-kontrollerade studierna* 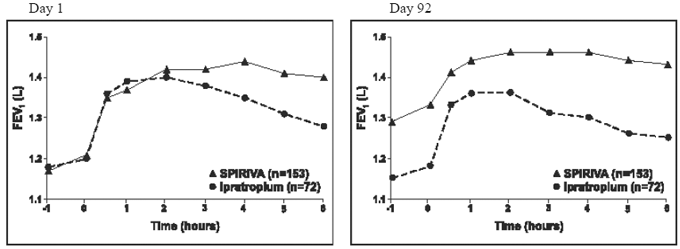
*Medel justerat för centrum, behandling och baslinjeeffekt. På dag 92 (primärt effektmått) slutfördes totalt 151 och 69 patienter i SPIRIVA HANDIHALER- respektive ipratropium-gruppen genom 3 månaders observation. Data för de återstående patienterna imputerades med hjälp av den senaste observationen eller den minst gynnsamma observationen som överfördes.
En randomiserad, placebokontrollerad klinisk studie på 105 patienter med KOL visade att bronkdilatation bibehölls under hela 24-timmarsdoseringsintervallet jämfört med placebo, oavsett om SPIRIVA 9 mcg HANDIHALER administrerades på morgonen eller på kvällen.
Under varje vecka av den 1-åriga behandlingsperioden i de två placebokontrollerade studierna hade patienter som tog SPIRIVA 9 mcg HANDIHALER ett minskat behov av användning av räddningskortverkande beta2-agonister. En minskning av användningen av räddningskortverkande beta2-agonister, jämfört med placebo, visades i en av de två 6-månadersstudierna.
4-års effekter på lungfunktionen
En 4-årig, randomiserad, dubbelblind, placebokontrollerad, multicenter klinisk studie som involverade 5992 KOL-patienter genomfördes för att utvärdera de långsiktiga effekterna av SPIRIVA HANDIHALER på sjukdomsprogression (takt av nedgång i FEV1). Patienterna fick använda alla andningsmediciner (inklusive kortverkande och långverkande beta-agonister, inhalerade och systemiska steroider och teofylliner) förutom inhalerade antikolinergika. Patienterna var 40 till 88 år gamla, 75 % män och 90 % kaukasiska med diagnosen KOL och en genomsnittlig pre-bronkdilaterande FEV1 på 39 % förutspått (intervall = 9 % till 76 %) vid studiestart. Det fanns ingen skillnad mellan grupperna i någon av de co-primära effektmåtten, årlig nedgångstakt i FEV1 före och efter luftrörsvidgande behandling, vilket visas av liknande lutningar av FEV1-nedgången över tiden (Figur 3).
SPIRIVA HANDIHALER bibehöll förbättringar i dal (före dos) FEV1 (justerat medelvärde över tiden: 87 till 103 ml) under studiens fyra år (Figur 3).
Figur 3: Lägsta (före dos) FEV1-medelvärden vid varje tidpunkt 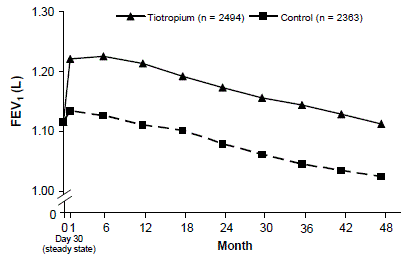
Upprepad mätning ANOVA användes för att uppskatta medelvärden. Medelvärden är justerade för baslinjemätningar. Baslinje dal FEV1 (observerat medelvärde) = 1,12. Patienter med ≥3 acceptabla lungfunktionstester efter dag 30 och icke-saknat baslinjevärde inkluderades i analysen.
Exacerbationer
Effekten av SPIRIVA 9mcg HANDIHALER på KOL-exacerbationer utvärderades i två kliniska prövningar: en 4-årig klinisk prövning som beskrivs ovan och en 6-månaders klinisk prövning av 1829 KOL-patienter i Veterans Affairs-miljö. I 6-månadersstudien definierades KOL-exacerbationer som ett komplex av andningssymtom (ökning eller nystart) av mer än ett av följande: hosta, sputum, väsande andning, dyspné eller tryck över bröstet med en varaktighet på minst 3 dagar som kräver behandling med antibiotika, systemiska steroider eller sjukhusvistelse. Befolkningen hade en ålder som sträckte sig från 40 till 90 år med 99 % män, 91 % kaukasiska och hade KOL med en genomsnittlig prebronkodilator FEV1 procent förutspådd på 36 % (intervall = 8 % till 93 %). Patienterna fick använda andningsmediciner (inklusive kortverkande och långverkande beta-agonister, inhalerade och systemiska steroider och teofylliner) andra än inhalerade antikolinergika. I 6-månadersstudien var de co-primära effektmåtten andelen patienter med KOL-exacerbation och andelen patienter med sjukhusinläggning på grund av KOL-exacerbation. SPIRIVA 9mcg HANDIHALER minskade signifikant andelen KOL-patienter som upplevde exacerbationer jämfört med placebo (27,9% respektive 32,3%; Odds Ratio (OR) (tiotropium/placebo) = 0,81; 95% CI = 0,606, 7,093; p = 0,903; ). Andelen patienter med sjukhusvistelse på grund av KOL-exacerbationer hos patienter som använde SPIRIVA 9 mcg HANDIHALER jämfört med placebo var 7,0 % respektive 9,5 %; ELLER = 0,72; 95% Cl = 0,51, 1,01; p = 0,056.
Exacerbationer utvärderades som ett sekundärt resultat i den 4-åriga multicenterstudien. I denna studie definierades KOL-exacerbationer som en ökning eller ny debut av mer än ett av följande andningssymtom (hosta, sputum, sputumpurulens, väsande andning, dyspné) med en varaktighet på tre eller fler dagar som kräver behandling med antibiotika och/eller systemiska (orala, intramuskulära eller intravenösa) steroider. SPIRIVA HANDIHALER minskade signifikant risken för en exacerbation med 14 % (Hazard Ratio (HR) = 0,86; 95 % CI = 0,81, 0,91; p
Dödlighet av alla orsaker
den 4-åriga placebokontrollerade lungfunktionsstudien som beskrivs ovan utvärderades dödlighet av alla orsaker jämfört med placebo. Det fanns inga signifikanta skillnader i dödlighetsfrekvens av alla orsaker mellan SPIRIVA 9mcg HANDIHALER och placebo.
Dödligheten av alla orsaker för SPIRIVA HANDIHALER jämfördes också med tiotropiuminhalationsspray 5 mcg (SPIRIVA RESPIMAT 5 mcg) i en ytterligare långtidsrandomiserad, dubbelblind, dubbeldummy aktiv kontrollerad studie med en observationsperiod på upp till 3 år. Dödligheten av alla orsaker var likartad mellan SPIRIVA 9mcg HANDIHALER och SPIRIVA RESPIMAT.
PATIENTINFORMATION
SPIRIVA 9mcgR® (speh REE vah) HANDIHALER® (tiotropiumbromid) Inhalationspulver, för oral inhalation
Svälj INTE SPIRIVA kapslar.
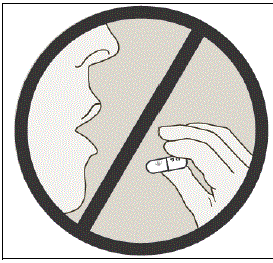
Viktig information: Svälj inte SPIRIVA kapslar. SPIRIVA 9mcg kapslar ska endast användas med HANDIHALER-enheten och inhaleras genom munnen (oral inhalation).
Läs informationen som följer med din SPIRIVA HANDIHALER innan du börjar använda den och varje gång du fyller på ditt recept. Det kan komma ny information. Denna bipacksedel ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling.
Vad är SPIRIVA HANDIHALER?
- SPIRIVA HANDIHALER är ett receptbelagt läkemedel som används varje dag (ett underhållsläkemedel) för att kontrollera symtom på kronisk obstruktiv lungsjukdom (KOL), inklusive kronisk bronkit och emfysem.
- SPIRIVA HANDIHALER hjälper till att få dina lungor att fungera bättre i 24 timmar. SPIRIVA 9mcg HANDIHALER slappnar av dina luftvägar och hjälper till att hålla dem öppna. Du kan börja känna att det är lättare att andas den första dagen, men det kan ta längre tid för dig att känna den fulla effekten av läkemedlet. SPIRIVA HANDIHALER fungerar bäst och kan hjälpa till att göra det lättare att andas när du använder den varje dag.
- SPIRIVA 9mcg HANDIHALER minskar sannolikheten för uppblossningar och försämring av KOL-symtom (KOL-exacerbationer). En KOL-exacerbation definieras som en ökning eller nystart av mer än ett KOL-symtom såsom hosta, slem, andnöd och väsande andning som kräver medicin utöver din räddningsmedicin.
SPIRIVA 9mcg HANDIHALER är inte ett räddningsläkemedel och ska inte användas för att behandla plötsliga andningsproblem. Din läkare kan ge dig andra läkemedel för plötsliga andningsproblem.
Det är inte känt om SPIRIVA 9mcg HANDIHALER är säkert och effektivt för barn.
Vem bör inte ta SPIRIVA 9mcg HANDIHALER?
Använd inte SPIRIVA 9mcg HANDIHALER om du:
- är allergisk mot tiotropium, ipratropium (Atrovent®) eller något av innehållsämnena i SPIRIVA 9mcg HANDIHALER. Se slutet av denna bipacksedel för en komplett lista över ingredienser i SPIRIVA 9mcg HANDIHALER.
Symtom på en allvarlig allergisk reaktion mot SPIRIVA 9mcg HANDIHALER kan inkludera:
- upphöjda röda fläckar på huden (nässelutslag)
- klåda
- utslag
- svullnad av ansikte, läppar, tunga och svalg som kan orsaka svårigheter att andas eller svälja
Om du har dessa symtom på en allergisk reaktion, sluta ta SPIRIVA HANDIHALER och ring din läkare omedelbart eller gå till närmaste akutmottagning.
Vad ska jag berätta för min läkare innan jag använder SPIRIVA HANDIHALER?
Innan du tar SPIRIVA HANDIHALER, berätta för din läkare om alla dina medicinska tillstånd, inklusive om du:
- har njurproblem.
- har glaukom. SPIRIVA HANDIHALER kan förvärra din glaukom.
- har en förstorad prostata, problem med urinering eller en blockering i urinblåsan. SPIRIVA 9mcg HANDIHALER kan förvärra dessa problem.
- är gravid eller planerar att bli gravid. Det är inte känt om SPIRIVA HANDIHALER kan skada ditt ofödda barn.
- ammar eller planerar att amma. Det är inte känt om SPIRIVA HANDIHALER går över i bröstmjölk. Du och din läkare kommer att avgöra om SPIRIVA 9mcg HANDIHALER är rätt för dig när du ammar.
- har en allvarlig allergi mot mjölkproteiner. Fråga din läkare om du är osäker.
Berätta för din läkare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel och ögondroppar, vitaminer och växtbaserade kosttillskott. Vissa av dina andra läkemedel eller kosttillskott kan påverka hur SPIRIVA HANDIHALER fungerar. SPIRIVA 9mcg HANDIHALER är ett antikolinergiskt läkemedel. Du bör inte ta andra antikolinerga läkemedel medan du använder SPIRIVA 9 mcg HANDIHALER, inklusive ipratropium. Fråga din läkare eller apotekspersonal om du är osäker på om något av dina läkemedel är ett antikolinergika.
Vet vilka mediciner du tar. Ha en lista över dina läkemedel med dig för att visa din läkare och apotekspersonal när du får ett nytt läkemedel.
Hur ska jag ta SPIRIVA 9mcg HANDIHALER?
- Använd SPIRIVA 9mcg HANDIHALER exakt enligt anvisningarna. Använd SPIRIVA HANDIHALER en gång varje dag.
- Läs "Bruksanvisning" i slutet av denna bipacksedel innan du använder SPIRIVA HANDIHALER. Tala med din läkare om du inte förstår instruktionerna.
- Svälj inte SPIRIVA 9mcg kapslar.
- Använd endast SPIRIVA 9mcg kapslar med HANDIHALER-enheten.
- Använd inte HANDIHALER-enheten för att ta något annat läkemedel.
- SPIRIVA 9mcg HANDIHALER kommer som ett pulver i en SPIRIVA 9mcg kapsel som passar till HANDIHALER-enheten. Varje SPIRIVA-kapsel, som endast innehåller en liten mängd SPIRIVA-pulver, är en hel dos läkemedel.
- Separera en blister från blisterkortet. Ta sedan ut en av SPIRIVA 9 mcg kapslarna ur blisterförpackningen precis innan du använder den.
- Efter att kapseln har genomborrats, ta en hel dos av SPIRIVA HANDIHALER genom att andas in pulvret genom munnen två gånger med hjälp av HANDIHALER-anordningen (ta 2 inhalationer från en SPIRIVA-kapsel). Se den "Användningsinstruktioner" slutet av denna bipacksedel.
- Kasta alla SPIRIVA-kapslar som inte används direkt efter att de tagits ut ur blisterförpackningen. Lämna inte SPIRIVA-kapslarna öppna för luft; de kanske inte fungerar lika bra.
- Om du missar en dos, ta den så snart du kommer ihåg det. Använd inte SPIRIVA HANDIHALER mer än en gång var 24:e timme. ? Om du använder mer än din ordinerade dos av SPIRIVA HANDIHALER, kontakta din läkare eller en giftcentral.
Vad ska jag undvika när jag använder SPIRIVA 9mcg HANDIHALER?
- Låt inte pulvret från SPIRIVA-kapseln komma in i dina ögon. Din syn kan bli suddig och pupillen i ögat kan bli större (vidgas). Om detta händer, ring din läkare.
- SPIRIVA 9mcg HANDIHALER kan orsaka yrsel och dimsyn. Om du upplever dessa symtom bör du vara försiktig när du deltar i aktiviteter som att köra bil eller använda apparater eller andra maskiner.
Vilka är de möjliga biverkningarna av SPIRIVA HANDIHALER?
SPIRIVA 9mcg HANDIHALER kan orsaka allvarliga biverkningar, inklusive: Allergisk reaktion. Symtom kan inkludera:
- upphöjda röda fläckar på huden (nässelutslag)
- klåda
- utslag
- svullnad av läppar, tunga eller svalg som kan orsaka svårigheter att andas eller svälja
Om du har dessa symtom på en allergisk reaktion, sluta ta SPIRIVA HANDIHALER och ring din läkare omedelbart eller gå till närmaste akutmottagning.
- Plötslig förträngning och blockering av luftvägarna in i lungorna (bronkospasm) . Din andning blir plötsligt värre.
Om du har dessa symtom på bronkospasm, sluta ta SPIRIVA 9mcg HANDIHALER och ring din läkare omedelbart eller gå till närmaste akutmottagning.
- Nytt eller försämrat ökat tryck i ögonen (akut trångvinkelglaukom). Symtom på akut trångvinkelglaukom kan inkludera:
- ögonsmärta
- suddig syn
- se glorier (visuella glorier) eller färgade bilder tillsammans med röda ögon
Att endast använda ögondroppar för att behandla dessa symtom kanske inte fungerar. Om du har dessa symtom, sluta ta SPIRIVA HANDIHALER och kontakta din läkare omedelbart.
- Ny eller försämrad urinretention. Symtom på blockering i urinblåsan och/eller förstorad prostata kan inkludera: svårigheter att kissa, smärtsam urinering.
Om du har dessa symtom på urinretention, sluta ta SPIRIVA HANDIHALER och kontakta din läkare omedelbart.
Andra biverkningar med SPIRIVA 9mcg HANDIHALER inkluderar:
- övre luftvägsinfektion
- torr mun
- bihåleinflammation
- öm hals
- ospecifik bröstsmärta
- urinvägsinfektion
- dålig matsmältning
- rinnande näsa
- förstoppning
- ökad hjärtrytm
- suddig syn
Dessa är inte alla möjliga biverkningar med SPIRIVA HANDIHALER. Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur förvarar jag SPIRIVA HANDIHALER?
- Förvara inte SPIRIVA-kapslar i HANDIHALER-enheten.
- Förvara SPIRIVA kapslar i den förseglade blisterförpackningen vid rumstemperatur 68°F till 77°F (20°C till 25°C).
- Håll SPIRIVA kapslar borta från värme och kyla (får inte frysas).
- Förvara SPIRIVA 9mcg kapslar på en torr plats. Släng alla oanvända SPIRIVA 9 mcg kapslar som har varit öppna för luft.
Fråga din läkare eller apotekspersonal om du har några frågor om förvaring av dina SPIRIVA 9 mcg kapslar.
Förvara SPIRIVA HANDIHALER, SPIRIVA 9 mcg kapslar och alla läkemedel utom räckhåll för barn.
Allmän information om SPIRIVA HANDIHALER
Läkemedel skrivs ibland ut för andra ändamål än de som anges i patientinformationsbroschyrerna. Använd inte SPIRIVA 9mcg HANDIHALER för ett ändamål som det inte har ordinerats för. Ge inte SPIRIVA HANDIHALER till andra personer även om de har samma symtom som du. Det kan skada dem.
För mer information om SPIRIVA HANDIHALER, tala med din läkare. Du kan fråga din läkare eller apotekspersonal om information om SPIRIVA 9mcg HANDIHALER som är skriven för vårdpersonal.
För mer information om SPIRIVA 9mcg HANDIHALER, gå till www.SPIRIVA.com, eller skanna koden nedan, eller ring Boehringer Ingelheim Pharmaceuticals, Inc. på 1-800-542-6257 eller (TTY) 1-800-459-9906.
Vilka är ingredienserna i SPIRIVA 9mcg HANDIHALER?
Aktiv beståndsdel: tiotropium
Inaktiv ingrediens: laktosmonohydrat
Vad är KOL (kronisk obstruktiv lungsjukdom)?
KOL är en allvarlig lungsjukdom som inkluderar kronisk bronkit, emfysem eller båda. De flesta KOL orsakas av rökning. När du har KOL blir dina luftvägar trånga. Så luften rör sig ut ur dina lungor långsammare. Detta gör det svårt att andas.
Denna patientinformation har godkänts av US Food and Drug Administration.
ANVÄNDNINGSINSTRUKTIONERSPIRIVA® (speh REE vah) HANDIHALER® (tiotropiumbromid) inhalationspulver, för oral inhalation
Svälj inte SPIRIVA kapslar.
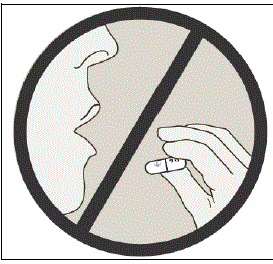
Viktig information om hur du använder din SPIRIVA HANDIHALER
- Svälj inte SPIRIVA 9mcg kapslar.
- SPIRIVA-kapslar ska endast användas med HANDIHALER-enheten och inhaleras genom munnen (oral inandning).
- Använd inte din HANDIHALER-enhet för att ta något annat läkemedel.
Läs först patientinformationen, läs sedan dessa bruksanvisningar innan du börjar använda SPIRIVA HANDIHALER och varje gång du fyller på ditt recept. Det kan komma ny information.
Att bli bekant med din HANDIHALER-enhet och SPIRIVA-kapslar:
Din SPIRIVA HANDIHALER levereras med SPIRIVA 9mcg kapslar i blisterförpackning och en HANDIHALER-enhet. Använd den nya HANDIHALER-enheten som medföljer din medicin.
Delarna av din HANDIHALER-enhet inkluderar:
(Se bild A)
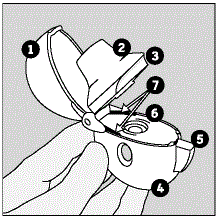
Bild A
Varje SPIRIVA 9 mcg kapsel är förpackad i en blister. (Se bild B)
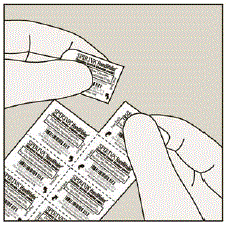
Bild B
- Varje SPIRIVA kapsel innehåller endast en liten mängd pulver. (Se figur C) Detta är 1 hel dos.
- Öppna inte SPIRIVA 9mcg kapseln eller så kanske det inte fungerar.

Bild C
Att ta din fulla dagliga dos av medicin kräver fyra huvudsteg.
Steg 1. Öppna din HANDIHALER-enhet:
När du har tagit bort din HANDIHALER-enhet från påsen:
- Öppna dammlocket (locket) genom att trycka på den gröna håltagningsknappen. (Se bild D)
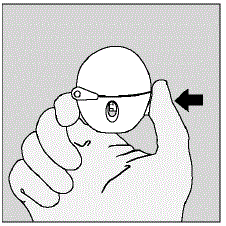
Bild D
- Dra dammlocket (locket) uppåt bort från basen för att exponera munstycket. (Se bild E)
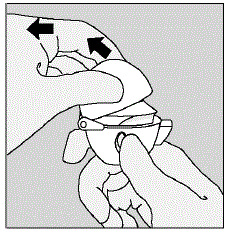
Bild E
- Öppna munstycket genom att dra munstyckets kant uppåt och bort från basen så att mittkammaren syns. (Se bild F)

Bild F
Steg 2. Sätt i SPIRIVA 9mcg-kapseln i din HANDIHALER-enhet:
Varje dag, separera endast 1 av blåsorna från blisterkortet genom att riva längs den perforerade linjen. (Se bild G)
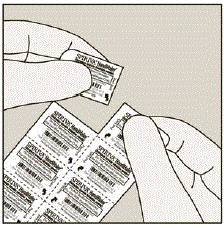
Bild G
Ta bort SPIRIVA-kapseln från blisterförpackningen:
- Låt bli skär av folien eller använd vassa instrument för att ta ut SPIRIVA-kapseln från blistern.
- Böj 1 av blisterhörnen med en pil och separera aluminiumfolielagren.
- Dra av den tryckta folien tills du ser hela SPIRIVA-kapseln. (Se bild H)
- Om du har öppnat mer än 1 blisterförpackning i luften ska den extra SPIRIVA 9 mcg kapseln inte användas och ska kastas.
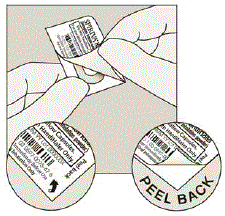
Bild H
Placera SPIRIVA 9mcg-kapseln i mittkammaren på din HANDIHALER-enhet. (Se bild I)
Figur I
Stäng munstycket ordentligt mot den grå basen tills du hör ett klick. Låt dammlocket (locket) vara öppet. (Se bild J)
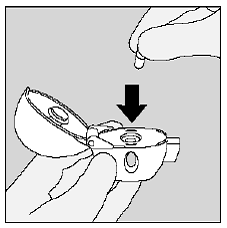
Bild J
Steg 3. Piercing av SPIRIVA 9 mcg kapsel:
- Håll din HANDIHALER-enhet med munstycket uppåt. (Se bild K)
- Tryck på den gröna håltagningsknappen en gång tills den är platt (spolad) mot basen och släpp sedan. Så här gör du hål i SPIRIVA-kapseln så att du får din medicin när du andas in.
- Låt bli tryck på den gröna knappen mer än en gång.
- Låt bli skaka din HANDIHALER-enhet.
- Piercingen av SPIRIVA 9mcg kapseln kan ge små gelatinbitar. Vissa av dessa små bitar kan passera genom skärmen på din HANDIHALER-enhet in i din mun eller hals när du andas in din medicin. Det här är normalt. De små gelatinbitarna ska inte skada dig.
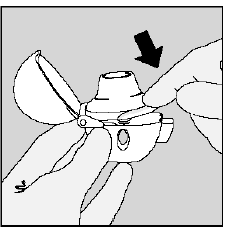
Bild K
Steg 4. Ta din fulla dagliga dos (2 inhalationer från samma SPIRIVA 9 mcg kapsel):
Andas ut helt på ett andetag, tömma lungorna på all luft. (Se bild L)
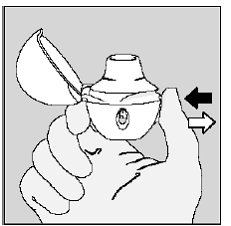
Bild L
Viktigt: Gör inte det andas in i din HANDIHALER-enhet.
Med ditt nästa andetag, ta din medicin:
- Håll huvudet i upprätt position medan du tittar rakt fram. (Se bild M)
- Lyft din HANDIHALER-enhet till munnen i horisontellt läge. Låt bli blockera luftintagsventilerna.
- Stäng läpparna tätt runt munstycket.
- Andas in djupt tills lungorna är fulla. Du borde hör eller känna SPIRIVA-kapseln vibrera (skallra). (Se bild M)
- Håll andan i några sekunder och ta samtidigt din HANDIHALER ur munnen.
- Andas normalt igen.
Bild M
Skallran talar om för dig att du andades in korrekt. Om du inte hör eller känner ett skallra, se avsnittet "Om du inte hör eller känner hur SPIRIVA-kapseln skramlar när du andas in din medicin."
Bild N
För att få din fulla dagliga dos måste du återigen andas ut helt (se figur N) och för en andra gång andas in (se figur O) från samma SPIRIVA-kapsel.
Viktigt: Gör inte det tryck på den gröna piercingknappen igen.
Bild O
Kom ihåg: För att få hela din medicindos varje dag måste du andas in 2 gånger från samma SPIRIVA 9 mcg kapsel. Se till att du andas ut helt varje gång innan du andas in från din HANDIHALER-enhet.
Sköta och förvara din SPIRIVA HANDIHALER:
Bild P
- Efter att ha tagit din dagliga dos, öppna munstycket och tippa ut den använda SPIRIVA 9 mcg kapseln i din papperskorg utan att röra den.
- Ta bort eventuella SPIRIVA 9mcg kapselbitar eller SPIRIVA 9mcg pulver genom att vända din HANDIHALER-enhet upp och ner och försiktigt men bestämt knacka på den. (Se figur P) Stäng sedan munstycket och dammskyddet för förvaring.
- Låt bli förvara din HANDIHALER-enhet och SPIRIVA 9mcg-kapslar (blister) på en fuktig och fuktig plats. Förvara alltid SPIRIVA kapslar i förseglade blister.
Om du inte hör eller känner att SPIRIVA 9 mcg kapseln skramlar när du andas in din medicin:
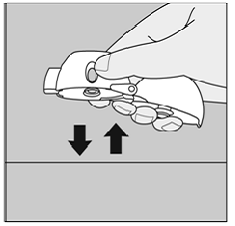
Bild Q
Låt bli tryck på den gröna piercingknappen igen.
Håll din HANDIHALER-enhet med munstycket uppåt och slå försiktigt din HANDIHALER-enhet mot ett bord. (Se bild Q)
Kontrollera att munstycket är helt stängt. Andas ut helt innan du andas in djupt igen med munstycket i munnen. (Se bild O)
Om du fortfarande inte hör eller känner hur SPIRIVA-kapseln skramlar efter att du upprepat stegen ovan:
- Släng SPIRIVA-kapseln.
- Öppna basen genom att lyfta den gröna håltagningsknappen och kontrollera mittkammaren för delar av SPIRIVA 9mcg-kapseln. SPIRIVA 9mcg kapselbitar i mittkammaren kan göra att en SPIRIVA 9mcg kapsel inte skramlar.
- Vänd din HANDIHALER-enhet upp och ner och tryck försiktigt men bestämt för att ta bort SPIRIVA-kapselbitarna. Ring din läkare för instruktioner.
Rengöring av din HANDIHALER-enhet:
Rengör din HANDIHALER-enhet vid behov. (Se bild R)
- Det tar 24 timmar att lufttorka din HANDIHALER-enhet efter att du har rengjort den.
- Låt bli använd rengöringsmedel eller rengöringsmedel.
- Låt bli placera din HANDIHALER-enhet i diskmaskinen för rengöring.
Rengöringssteg:
- Öppna dammlocket och munstycket.
- Öppna basen genom att lyfta på den gröna piercingknappen.
- Titta i mittkammaren efter SPIRIVA 9 mcg kapselbitar eller pulveruppbyggnad. Om den syns, tryck ut.
- Skölj din HANDIHALER-enhet med varmt vatten, tryck på den gröna piercingknappen några gånger så att mittkammaren och piercingnålen är under det rinnande vattnet. Kontrollera att eventuell pulveruppbyggnad eller SPIRIVA-kapselbitar är borttagna.
- Torka din HANDIHALER-enhet väl genom att hälla ut överflödigt vatten på en pappershandduk. Lufttorka efteråt, lämna dammskyddet, munstycket och basen öppna genom att sprida ut det helt så att det torkar helt.
- Låt bli använd en hårtork för att torka din HANDIHALER-enhet.
- Låt bli använd din HANDIHALER-enhet när den är våt. Om det behövs kan du rengöra utsidan av munstycket med en ren fuktig trasa.
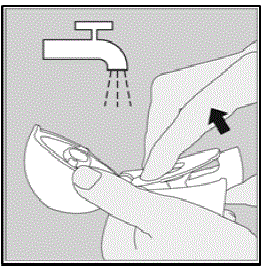
Bild R
Användbara tips för att säkerställa att du tar din fulla dagliga dos av SPIRIVA 9mcg HANDIHALER:
- Tryck den gröna piercingknappen En gång; Andas in 2 gånger; Andas ut helt före var och en av de 2 inhalationerna.
- Använd alltid den nya HANDIHALER-enheten som medföljer din medicin.
- Håll din HANDIHALER-enhet med munstycket uppåt när du trycker på den gröna piercingsknappen.
- Tryck på den gröna piercingsknappen en gång för att genomborra SPIRIVA-kapseln.
- Andas inte ut i din HANDIHALER-enhet.
- Håll din HANDIHALER-enhet i horisontellt läge och håll huvudet upprätt, titta rakt fram, när du andas in.
- Kontrollera mittkammaren på din HANDIHALER-enhet för SPIRIVA 9 mcg kapselbitar eller pulveruppbyggnad. Om bitar eller pulver ses, knacka ut före användning.
- Rengör din HANDIHALER efter behov och torka ordentligt.
För mer information, fråga din läkare eller apotekspersonal, eller gå till www.spiriva.com, eller skanna koden nedan, eller ring 1-800-542-6257 eller (TTY) 1-800-459-9906.
Denna bruksanvisning har godkänts av US Food and Drug Administration.
