Symbicort 160/4.5mcg Budesonide Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Symbicort 4,5 mcg och hur används det?
Symbicort 4,5 mcg är ett receptbelagt läkemedel som används för att behandla symtom på astma och kronisk obstruktiv lungsjukdom. Symbicort kan användas ensamt eller tillsammans med andra läkemedel.
Symbicort tillhör en klass av läkemedel som kallas Respiratory Inhalant Combos.
Det är inte känt om Symbicort 4,5 mcg är säkert och effektivt för barn yngre än 6 år.
Vilka är de möjliga biverkningarna av Symbicort 4,5 mcg?
Symbicort kan orsaka allvarliga biverkningar inklusive:
- förvärrade andningsproblem,
- sår eller vita fläckar i munnen eller halsen,
- smärta vid sväljning,
- skakningar,
- nervositet,
- bröstsmärta,
- snabba eller bultande hjärtslag,
- hosta med slem,
- känner andfåddhet,
- väsande andning,
- kvävning,
- andra andningsproblem,
- suddig syn,
- tunnelseende,
- ögonsmärta eller rodnad,
- ser glorier runt ljus,
- feber,
- frossa,
- kroppssmärtor,
- ovanlig trötthet,
- ökad törst,
- ökad urinering,
- torr mun,
- fruktig andedräkt lukt,
- kramper i benen,
- förstoppning,
- oregelbundna hjärtslag,
- fladdrande i ditt bröst,
- domningar eller stickningar,
- muskelsvaghet,
- slapp känsla,
- trötthet,
- svaghet,
- yrsel,
- illamående, och
- kräkningar
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Symbicort inkluderar:
- halssmärta eller irritation,
- vita fläckar i munnen eller halsen,
- obehag i magen,
- kräkningar,
- ryggont,
- huvudvärk,
- influensasymptom och
- förkylningssymtom (täppt eller rinnande näsa, nysningar, sinussmärta eller halsont)
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Symbicort. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
SYMBICORT 80/4.5 och SYMBICORT 160/4.5 innehåller vardera mikroniserat budesonid och mikroniserat formoterolfumaratdihydrat endast för oral inhalation.
Varje SYMBICORT 80/4.5- och SYMBICORT 160/4.5-behållare är formulerad som en hydrofluoralkan (HFA 227; 1,1,1,2,3,3,3-heptafluorpropan)-driven trycksatt dosinhalator innehållande antingen 60 eller 120 aktiveringar [se Doseringsformer och styrkor och HUR LEVERERAS / Förvaring Och Hantering ]. Efter priming mäter varje aktivering antingen 91/5,1 mcg eller 181/5,1 mcg från ventilen och levererar antingen 80/4,5 mcg eller 160/4,5 mcg (budesonidmikroniserat/formoterolfumaratdihydratmikroniserat) från ställdonet. Den faktiska mängden läkemedel som levereras till lungan kan bero på patientfaktorer, såsom koordinationen mellan aktivering av anordningen och inandning genom tillförselsystemet. SYMBICORT 160mg innehåller även povidon K25 USP som suspenderingsmedel och polyetylenglykol 1000 NF som smörjmedel.
SYMBICORT 160mg ska grundas innan användning för första gången genom att släppa två testsprayer i luften bort från ansiktet, skaka ordentligt i 5 sekunder före varje spray. I fall där inhalatorn inte har använts på mer än 7 dagar eller när den har tappats, förbered inhalatorn igen genom att skaka ordentligt i 5 sekunder före varje spray och släppa ut två testsprayer i luften bort från ansiktet.
En aktiv komponent i SYMBICORT 4,5 mcg är budesonid, en kortikosteroid kemiskt betecknad som (RS)11β, 16α, 17,21-Tetrahydroxypregna-1,4-dien-3,20-dion cyklisk 16,17-acetal med butyraldehyd. Budesonid tillhandahålls som en blandning av två epimerer (22R och 22S). Den empiriska formeln för budesonid är C25H34O6 och dess molekylvikt är 430,5. Dess strukturformel är:
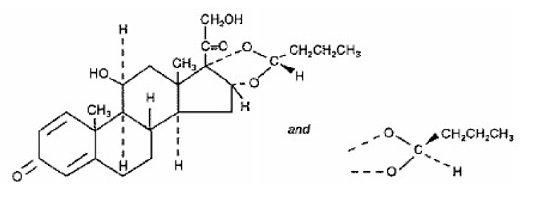
Budesonid är ett vitt till benvitt, smaklöst, luktfritt pulver som är praktiskt taget olösligt i vatten och i heptan, svårlösligt i etanol och fritt lösligt i kloroform. Dess fördelningskoefficient mellan oktanol och vatten vid pH 7,4 är 1,6 x 103.
Den andra aktiva komponenten i SYMBICORT 160mg är formoterolfumaratdihydrat, en selektiv beta2-agonist kemiskt betecknad som (R*,R*)-(±)-N-[2-hydroxi-5-[1-hydroxi-2-[[ 2-(4-metoxifenyl)-1 metyletyl]amino]etyl]fenyl]formamid, (E)-2-butendioat(2:1), dihydrat. Den empiriska formeln för formoterol är C42H56N4O14 och dess molekylvikt är 840,9. Dess strukturformel är:
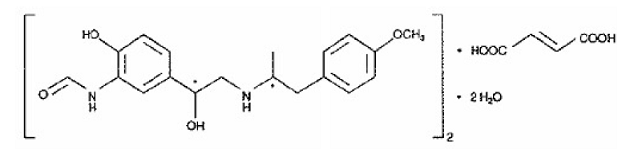
Formoterolfumaratdihydrat är ett pulver som är lätt lösligt i vatten. Dess oktanol-vattenfördelningskoefficient vid pH 7,4 är 2,6. pKa för formoterolfumaratdihydrat vid 25°C är 7,9 för fenolgruppen och 9,2 för aminogruppen.
INDIKATIONER
Behandling av astma
SYMBICORT 4,5 mcg är indicerat för behandling av astma hos patienter 6 år och äldre.
SYMBICORT ska användas för patienter som inte är tillräckligt kontrollerade på ett långtidsläkemedel för astmakontroll såsom en inhalerad kortikosteroid (ICS) eller vars sjukdom motiverar behandling med både en inhalerad kortikosteroid och långverkande beta2-adrenerg agonist (LABA).
Viktiga användningsbegränsningar
- SYMBICORT är INTE indicerat för lindring av akut bronkospasm.
Underhållsbehandling av kronisk obstruktiv lungsjukdom
SYMBICORT 160/4.5 är indicerat för underhållsbehandling av luftflödeshinder hos patienter med kronisk obstruktiv lungsjukdom (KOL) inklusive kronisk bronkit och/eller emfysem. SYMBICORT 160/4.5 är också indicerat för att minska exacerbationer av KOL. SYMBICORT 160/4.5 är den enda styrkan som anges för behandling av KOL.
Viktiga användningsbegränsningar
- SYMBICORT 4,5 mcg är INTE indicerat för lindring av akut bronkospasm.
DOSERING OCH ADMINISTRERING
Administrationsinformation
SYMBICORT 160 mg ska administreras som 2 inhalationer två gånger dagligen (morgon och kväll, med cirka 12 timmars mellanrum), varje dag endast genom oral inhalation. Efter inandning ska patienten skölja munnen med vatten utan att svälja.
Prime SYMBICORT 4,5mcg före användning för första gången genom att släppa två testsprayer i luften bort från ansiktet, skaka ordentligt i 5 sekunder före varje spray. I fall där inhalatorn inte har använts på mer än 7 dagar eller när den har tappats, förbered inhalatorn igen genom att skaka ordentligt före varje spray och släppa ut två testsprayer i luften bort från ansiktet.
Frekventare administrering eller ett högre antal inhalationer (mer än 2 inhalationer två gånger dagligen) av den föreskrivna styrkan av SYMBICORT rekommenderas inte eftersom vissa patienter är mer benägna att uppleva biverkningar med högre doser av formoterol. Patienter som använder SYMBICORT ska inte använda ytterligare LABA av någon anledning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Astma
Om astmasymtom uppstår under tiden mellan doserna ska en inhalerad, kortverkande beta2-agonist tas för omedelbar lindring.
Vuxna och ungdomar 12 år och äldre
För patienter 12 år och äldre är dosen 2 inhalationer av SYMBICORT 80/4,5 eller SYMBICORT 160/4,5 två gånger dagligen.
De rekommenderade startdoserna för SYMBICORT för patienter 12 år och äldre baseras på patienters svårighetsgrad av astma eller nivå av kontroll av astmasymtom och risk för exacerbationer med aktuella inhalerade kortikosteroider.
Den maximala rekommenderade dosen för vuxna och ungdomar 12 år och äldre är SYMBICORT 160/4,5, två inhalationer två gånger dagligen.
Förbättring av astmakontrollen efter inhalerad administrering av SYMBICORT kan inträffa inom 15 minuter efter påbörjad behandling, även om maximal nytta kanske inte uppnås förrän 2 veckor eller längre efter påbörjad behandling. Individuella patienter kommer att uppleva en varierande tid till debut och grad av symtomlindring.
För patienter som inte svarar adekvat på startdosen efter 1-2 veckors behandling med SYMBICORT 80/4.5, kan ersättning med SYMBICORT 160/4.5 ge ytterligare astmakontroll.
Om en tidigare effektiv dosregim av SYMBICORT 4,5 mcg inte ger adekvat kontroll av astma, bör den terapeutiska regimen omvärderas och ytterligare terapeutiska alternativ, (t.ex. ersätta den lägre styrkan av SYMBICORT 4,5 mcg med den högre styrkan, lägga till ytterligare inhalation kortikosteroider eller initiering av orala kortikosteroider) bör övervägas.
Pediatriska patienter i åldern 6 till mindre än 12 år
För patienter 6 till under 12 år är dosen 2 inhalationer av SYMBICORT 80/4,5 två gånger dagligen.
Kronisk obstruktiv lungsjukdom
För patienter med KOL är den rekommenderade dosen SYMBICORT 160/4,5, två inhalationer två gånger dagligen.
Om andnöd uppstår under tiden mellan doserna ska en inhalerad, kortverkande beta2-agonist tas för omedelbar lindring.
HUR LEVERERAS
Doseringsformer och styrkor
SYMBICORT finns som en inhalator för uppmätta doser innehållande en kombination av budesonid (80 eller 160 mikrogram) och formoterol (4,5 mikrogram) som inhalationsaerosol i följande två styrkor: 80/4,5 och 160/4,5. Varje doseringsstyrka innehåller 60 eller 120 aktivering per/kanister. Varje styrka av SYMBICORT 160mg levereras med ett rött plastmanöverdon med ett grått dammskydd.
Förvaring Och Hantering
SYMBICORT finns i två styrkor och levereras i följande förpackningsstorlekar:
Doseringsformer och styrkor
Varje styrka levereras som en trycksatt aluminiumkapsel med en bifogad räkneanordning, en röd plastmanöverkropp med ett vitt munstycke och påsatt grå dammlock. Varje 120 inhalationsbehållare har en nettofyllnadsvikt på 10,2 gram och varje 60 inhalationsbehållare har en nettofyllnadsvikt på 6,9 gram (SYMBICORT 80/4,5) eller 6 gram (SYMBICORT 160/4,5). Varje burk är förpackad i en foliepåse med torkmedelspåse och placeras i en kartong. Varje kartong innehåller en behållare och en patientinformationsbroschyr.
SYMBICORT 4,5 mcg-behållaren ska endast användas med SYMBICORT 4,5 mcg-ställdonet, och SYMBICORT-ställdonet ska inte användas med någon annan inhalationsläkemedelsprodukt.
Den korrekta mängden medicin i varje inhalation kan inte säkerställas efter att det märkta antalet inhalationer från kapseln har använts, även om inhalatorn kanske inte känns helt tom och kan fortsätta att fungera. Inhalatorn ska kasseras när det märkta antalet inhalationer har använts eller inom 3 månader efter att ha tagits ut ur foliepåsen. Doppa aldrig ned behållaren i vatten för att bestämma mängden kvar i behållaren ("flyttest").
Förvara vid kontrollerad rumstemperatur 20°C till 25°C (68°F till 77°F) [se USP]. Förvara inhalatorn med munstycket nedåt.
För bästa resultat bör behållaren vara i rumstemperatur före användning. Skaka väl i 5 sekunder före användning.
Förvaras oåtkomligt för barn. Undvik att spraya i ögonen.
INNEHÅLL UNDER TRYCK.
Får inte punktera eller bränna. Förvara inte nära värme eller öppen låga. Exponering för temperaturer över 120°F kan orsaka sprickbildning. Kasta aldrig behållare i eld eller förbränningsugn.
Tillverkad för: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850 av: AstraZeneca Dunkerque Production, Dunkerque, Frankrike. Reviderad: Dec 2017
BIEFFEKTER
Användning av LABA kan resultera i följande:
- Allvarliga astmarelaterade händelser – sjukhusinläggningar, intubationer, dödsfall [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Kardiovaskulära och centrala nervsystemets effekter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Systemisk och inhalerad kortikosteroidanvändning kan resultera i följande:
- Candida albicans infektion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Lunginflammation eller nedre luftvägsinfektioner hos patienter med KOL [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Immunsuppression [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hyperkorticism och adrenal suppression [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Tillväxteffekter hos pediatriska patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Glaukom och grå starr [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Erfarenhet av kliniska prövningar vid astma
Vuxna och ungdomar 12 år och äldre
De övergripande säkerhetsdata för vuxna och ungdomar är baserade på 10 aktiva och placebokontrollerade kliniska studier där 3393 patienter i åldrarna 12 år och äldre (2052 kvinnor och 1341 män) med astma av varierande svårighetsgrad behandlades med SYMBICORT 80/4,5 eller 160 /4,5 tagit 2 inhalationer en eller två gånger dagligen i 12 till 52 veckor. I dessa studier hade patienterna på SYMBICORT en medelålder på 38 år och var övervägande kaukasiska (82%).
Incidensen av vanliga biverkningar i tabell 2 nedan baseras på sammanslagna data från tre 12-veckors dubbelblinda, placebokontrollerade kliniska studier där 401 vuxna och ungdomar (148 män och 253 kvinnor) i åldern 12 år och äldre var behandlas med 2 inhalationer av SYMBICORT 80/4.5 eller SYMBICORT 160/4.5 två gånger dagligen. SYMBICORT-gruppen bestod mestadels av kaukasiska (84 %) patienter med en medelålder på 38 år, och en genomsnittlig procent förutspådde FEV1 vid baslinjen på 76 och 68 för behandlingsgrupperna 80/4,5 mcg respektive 160/4,5 mcg. Kontrollarmar för jämförelse inkluderade 2 inhalationer av budesonid HFA inhalator med uppmätta doser (MDI) 80 eller 160 mcg, formoterol torrpulverinhalator (DPI) 4,5 mcg, eller placebo (MDI och DPI) två gånger dagligen. Tabell 2 inkluderar alla biverkningar som inträffade med en incidens på >3 % i någon SYMBICORT-grupp och vanligare än i placebogruppen med dosering två gånger dagligen. Vid övervägande av dessa data bör den ökade genomsnittliga varaktigheten av patientexponeringen för SYMBICORT-patienter beaktas, eftersom incidensen inte justeras för en obalans i behandlingslängden.
Långtidssäkerhet - Kliniska prövningar av astma hos patienter 12 år och äldre
Långtidsstudier av säkerhet på ungdomar och vuxna patienter från 12 år och äldre, behandlade i upp till 1 år med doser upp till 1280/36 mikrogram/dag (640/18 mikrogram två gånger dagligen), visade varken kliniskt viktiga förändringar i incidensen inte heller nya typer av biverkningar som dyker upp efter längre behandlingsperioder. På liknande sätt observerades inga signifikanta eller oväntade mönster av abnormiteter under upp till 1 år i säkerhetsåtgärder inklusive kemi, hematologi, EKG, Holter-monitor och HPA-axelbedömningar.
Pediatriska patienter 6 till yngre än 12 år
Säkerhetsdata för pediatriska patienter i åldern 6 till mindre än 12 år är baserade på 1 studie med 12 veckors behandlingslängd. Patienter (79 kvinnor och 105 män) som fick inhalerad kortikosteroid vid start av studien randomiserades till SYMBICORT 80/4,5 (n=92) eller budesonid pMDI 80 mcg (n=92), 2 inhalationer två gånger dagligen. Den övergripande säkerhetsprofilen för dessa patienter liknade den som observerats hos patienter 12 år och äldre som fick SYMBICORT 80/4,5 två gånger dagligen i studier av liknande design. Vanliga biverkningar som inträffade hos patienter som behandlades med SYMBICORT 80/4,5 med en frekvens av ≥3 % och oftare än patienter som endast behandlades med budesonid pMDI 80 mcg inkluderade övre luftvägsinfektion, faryngit, huvudvärk och rinit.
Kliniska prövningar Erfarenhet av kronisk obstruktiv lungsjukdom
Säkerhetsdata som beskrivs nedan återspeglar exponering för SYMBICORT 160/4,5 hos 1783 patienter. SYMBICORT 160/4,5 studerades i två placebokontrollerade lungfunktionsstudier (6 och 12 månader) och två aktivt kontrollerade exacerbationsstudier (6 och 12 månader) på patienter med KOL.
Incidensen av vanliga biverkningar i tabell 3 nedan baseras på sammanslagna data från två dubbelblinda, placebokontrollerade lungfunktionsstudier (6 och 12 månader långa) där 771 vuxna KOL-patienter (496 män och 275 kvinnor) 40 år och äldre behandlades med SYMBICORT 160/4.5, två inhalationer två gånger dagligen. Av dessa patienter behandlades 651 i 6 månader och 366 behandlades i 12 månader. SYMBICORT-gruppen bestod av mestadels kaukasiska (93 %) patienter med en medelålder på 63 år och en genomsnittlig procent förutspådde FEV1 vid baslinjen på 33 %. Kontrollarmarna för jämförelse inkluderade 2 inhalationer av budesonid HFA (MDI) 160 mcg, formoterol (DPI) 4,5 mcg eller placebo (MDI och DPI) två gånger dagligen. Tabell 3 inkluderar alla biverkningar som inträffade med en incidens på ≥3 % i SYMBICORT-gruppen och vanligare än i placebogruppen. Vid övervägande av dessa data bör den ökade genomsnittliga varaktigheten av patientexponeringen för SYMBICORT 4,5 mikrogram beaktas, eftersom incidensen inte justeras för en obalans i behandlingslängden.
Andra lunginfektioner än lunginflammation (främst bronkit) förekom hos en större andel av patienterna som behandlades med SYMBICORT 160/4,5 jämfört med placebo (7,9 % respektive 5,1 %). Det observerades inga kliniskt viktiga eller oväntade mönster av abnormiteter under upp till 1 år i kemi, hematologi, EKG, EKG (Holter)-övervakning, HPA-axeln, bentäthet och oftalmologiska bedömningar.
Säkerhetsfynden från de två dubbelblinda, aktivt kontrollerade exacerbationsstudierna (6 och 12 månader långa) där 1012 vuxna KOL-patienter (616 män och 396 kvinnor) 40 år och äldre behandlades med SYMBICORT 160/4,5, två inhalationer två gånger dagligen överensstämde med lungfunktionsstudierna.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av SYMBICORT efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering. Vissa av dessa biverkningar kan också ha observerats i kliniska studier med SYMBICORT.
Hjärtsjukdomar: angina pectoris, takykardi, förmaks- och ventrikulära takyarytmier, förmaksflimmer, extrasystoler, hjärtklappning
Endokrina störningar: hyperkorticism, tillväxthastighetsminskning hos pediatriska patienter
Ögonbesvär: grå starr, glaukom, ökat intraokulärt tryck
Gastrointestinala störningar: orofaryngeal candidiasis, illamående
Immunsystemets störningar: omedelbara och fördröjda överkänslighetsreaktioner, såsom anafylaktisk reaktion, angioödem, bronkospasm, urtikaria, exantem, dermatit, klåda
Metabola och näringsstörningar: hyperglykemi, hypokalemi
Muskuloskeletala, bindvävs- och skelettsjukdomar: muskelkramp
Störningar i nervsystemet: tremor, yrsel
Psykiatriska störningar: beteendestörningar, sömnstörningar, nervositet, agitation, depression, rastlöshet
Andningsvägar, bröstkorg och mediastinum: dysfoni, hosta, irritation i halsen
Hud och subkutan vävnad: blåmärken på huden
Vaskulära störningar: hypotoni, högt blodtryck
LÄKEMEDELSINTERAKTIONER
I kliniska studier har samtidig administrering av SYMBICORT och andra läkemedel, såsom kortverkande beta2agonister, intranasala kortikosteroider och antihistaminer/avsvällande medel inte resulterat i en ökad frekvens av biverkningar. Inga formella läkemedelsinteraktionsstudier har utförts med SYMBICORT.
Hämmare av Cytokrom P4503A4
Den huvudsakliga metabolismen av kortikosteroider, inklusive budesonid, en komponent i SYMBICORT, är via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4). Efter oral administrering av ketokonazol, en stark hämmare av CYP3A4, ökade den genomsnittliga plasmakoncentrationen av oralt administrerad budesonid. Samtidig administrering av CYP3A4 kan hämma metabolismen av och öka den systemiska exponeringen för budesonid. Försiktighet bör iakttas när man överväger samtidig administrering av SYMBICORT 4,5 mcg med långtidsverkande ketokonazol och andra kända starka CYP3A4-hämmare (t.ex. ritonavir, atazanavir, klaritromycin, indinavir, itrakonazol, nefazodon, nelfinavir, saquinavir) [teli VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Monoaminoxidashämmare och tricykliska antidepressiva medel
SYMBICORT bör administreras med försiktighet till patienter som behandlas med monoaminoxidashämmare eller tricykliska antidepressiva medel, eller inom 2 veckor efter utsättning av sådana medel, eftersom effekten av formoterol, en komponent i SYMBICORT 160 mg, på kärlsystemet kan förstärkas av dessa medel. . I kliniska prövningar med SYMBICORT fick ett begränsat antal KOL- och astmapatienter tricykliska antidepressiva läkemedel, och därför kan inga kliniskt betydelsefulla slutsatser om biverkningar dras.
Beta-adrenerga receptorblockerande medel
Betablockerare (inklusive ögondroppar) kan inte bara blockera den pulmonella effekten av beta-agonister, såsom formoterol, en komponent i SYMBICORT, utan kan ge allvarlig bronkospasm hos patienter med astma. Patienter med astma ska därför normalt inte behandlas med betablockerare. Under vissa omständigheter kan det dock inte finnas några acceptabla alternativ till användning av beta-adrenerga blockerande medel hos patienter med astma. I denna miljö kan kardioselektiva betablockerare övervägas, även om de bör administreras med försiktighet.
Diuretika
De EKG-förändringar och/eller hypokalemi som kan bli resultatet av administrering av icke-kaliumsparande diuretika (såsom loop- eller tiaziddiuretika) kan förvärras akut av beta-agonister, särskilt när den rekommenderade dosen av beta-agonisten överskrids. Även om den kliniska betydelsen av dessa effekter inte är känd, rekommenderas försiktighet vid samtidig administrering av SYMBICORT och icke-kaliumsparande diuretika.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Allvarliga astmarelaterade händelser – sjukhusvistelser, intubationer och dödsfall
Användning av LABA som monoterapi (utan ICS) för astma är associerad med en ökad risk för astma-relaterad död [se Salmeterol Multicenter Asthma Research Trial (SMART)]. Tillgängliga data från kontrollerade kliniska prövningar tyder också på att användning av LABA som monoterapi ökar risken för astma-relaterad sjukhusvistelse hos barn och ungdomar. Dessa fynd anses vara en klasseffekt av LABA. När LABA används i kombination med fasta doser med ICS visar data från stora kliniska prövningar inte en signifikant ökning av risken för allvarliga astmarelaterade händelser (sjukhusinläggningar, intubationer, dödsfall) jämfört med enbart ICS (se Allvarliga astmarelaterade händelser) med ICS/LABA).
Allvarliga astmarelaterade händelser med ICS/LABA
Fyra stora, 26 veckor långa, randomiserade, blinda, aktivt kontrollerade kliniska säkerhetsprövningar genomfördes för att utvärdera risken för allvarliga astmarelaterade händelser när LABA användes i kombination med fast dos med ICS jämfört med enbart ICS hos patienter med astma. Tre studier inkluderade vuxna och ungdomar i åldern ≥12 år: en studie jämförde budesonid/formoterol (SYMBICORT) med budesonid [se Kliniska studier ]; ett försök jämförde flutikasonpropionat/salmeterol inhalationspulver med flutikasonpropionat inhalationspulver; och en studie jämförde mometasonfuroat/formoterol med mometasonfuroat. Den fjärde studien omfattade pediatriska patienter i åldern 4 till 11 år och jämförde flutikasonpropionat/salmeterol inhalationspulver med flutikasonpropionat inhalationspulver. Det primära säkerhetsmåttet för alla fyra studierna var allvarliga astmarelaterade händelser (sjukhusinläggningar, intubationer och dödsfall). En blindad bedömningskommitté fastställde om händelserna var astmarelaterade.
De tre prövningarna för vuxna och ungdomar var utformade för att utesluta en riskmarginal på 2,0, och den pediatriska prövningen utformades för att utesluta en risk på 2,7. Varje enskild studie uppfyllde sitt fördefinierade mål och visade att ICS/LABA inte var underlägsen i förhållande till enbart ICS. En metaanalys av de tre studierna för vuxna och ungdomar visade inte en signifikant ökning av risken för en allvarlig astma-relaterad händelse med ICS/LABA fast doskombination jämfört med enbart ICS (tabell 1). Dessa studier var inte utformade för att utesluta all risk för allvarliga astmarelaterade händelser med ICS/LABA jämfört med ICS.
Den pediatriska säkerhetsprövningen inkluderade 6208 pediatriska patienter i åldern 4 till 11 år som fick ICS/LABA (flutikasonpropionat/salmeterol inhalationspulver) eller ICS (flutikasonpropionat inhalationspulver). I denna studie upplevde 27/3107 (0,9%) patienter randomiserade till ICS/LABA och 21/3101 (0,7%) patienter randomiserade till ICS en allvarlig astma-relaterad händelse. Det förekom inga astmarelaterade dödsfall eller intubationer. ICS/LABA visade inte en signifikant ökad risk för en allvarlig astma-relaterad händelse jämfört med ICS baserat på den förspecificerade riskmarginalen (2,7), med en uppskattad riskkvot av tid till första händelse på 1,29 (95 % KI: 0,73) 2,27).
Salmeterol Multicenter Astma Research Trial (SMART)
En 28-veckors, placebokontrollerad amerikansk studie som jämförde säkerheten för salmeterol med placebo, var och en tillagd till vanlig astmabehandling, visade en ökning av astmarelaterade dödsfall hos patienter som fick salmeterol (13/13 176 hos patienter behandlade med salmeterol vs. 3 /13 179 hos patienter behandlade med placebo; relativ risk: 4,37 [95 % KI 1,25, 15,34]). Användning av bakgrunds-ICS krävdes inte i SMART. Den ökade risken för astma-relaterad död anses vara en klasseffekt av LABA monoterapi.
Formoterol monoterapi studier
Kliniska studier med formoterol som monoterapi antydde en högre incidens av allvarlig astmaexacerbation hos patienter som fick formoterol än hos dem som fick placebo. Storleken på dessa studier var inte tillräckliga för att exakt kvantifiera skillnaden i allvarliga astmaexacerbationer mellan behandlingsgrupperna.
Försämring av sjukdom och akuta episoder
SYMBICORT 4,5 mcg ska inte initieras hos patienter under snabbt försämrade eller potentiellt livshotande episoder av astma eller KOL. SYMBICORT har inte studerats på patienter med akut försämrad astma eller KOL. Initieringen av SYMBICORT 4,5mcg i denna inställning är inte lämplig.
Ökad användning av inhalerade, kortverkande beta2-agonister är en markör för försämrad astma. I denna situation kräver patienten omedelbar omvärdering med omvärdering av behandlingsregimen, med särskild hänsyn till det eventuella behovet av att ersätta den nuvarande styrkan av SYMBICORT med en högre styrka, lägga till ytterligare inhalerad kortikosteroid eller initiera systemiska kortikosteroider. Patienter ska inte använda mer än 2 inhalationer två gånger dagligen (morgon och kväll) av SYMBICORT.
SYMBICORT 160mg ska inte användas för att lindra akuta symtom, dvs som räddningsterapi för behandling av akuta episoder av bronkospasm. En inhalerad, kortverkande beta2-agonist, inte SYMBICORT, ska användas för att lindra akuta symtom som andnöd.
När behandling med SYMBICORT 4,5 mcg påbörjas, bör patienter som har tagit orala eller inhalerade, kortverkande beta2-agonister regelbundet (t.ex. 4 gånger om dagen) instrueras att avbryta den regelbundna användningen av dessa läkemedel.
Överdriven användning av SYMBICORT 4,5 mcg och användning med andra långverkande beta2-agonister
Som med andra inhalationsläkemedel som innehåller beta2-adrenerga medel, ska SYMBICORT 4,5 mcg inte användas oftare än vad som rekommenderas, i högre doser än vad som rekommenderas, eller tillsammans med andra läkemedel som innehåller LABA, eftersom en överdos kan leda till. Kliniskt signifikanta kardiovaskulära effekter och dödsfall har rapporterats i samband med överdriven användning av inhalerade sympatomimetika. Patienter som använder SYMBICORT ska inte använda ytterligare LABA (t.ex. salmeterol, formoterolfumarat, arformoteroltartrat) av någon anledning, inklusive förebyggande av ansträngningsutlöst bronkospasm (EIB) eller behandling av astma eller KOL.
Lokala effekter
kliniska studier har utvecklingen av lokaliserade infektioner i mun och svalg med Candida albicans inträffat hos patienter som behandlats med SYMBICORT. När en sådan infektion utvecklas bör den behandlas med lämplig lokal eller systemisk (dvs oral antimykotika) behandling medan behandlingen med SYMBICORT 160 mg fortsätter, men ibland kan behandlingen med SYMBICORT 4,5 mcg behöva avbrytas. Rekommendera patienten att skölja munnen med vatten utan att svälja efter inandning för att minska risken för orofaryngeal candidiasis.
Lunginflammation och andra nedre luftvägsinfektioner
Läkare bör förbli vaksamma på eventuell utveckling av lunginflammation hos patienter med KOL, eftersom de kliniska dragen av lunginflammation och exacerbationer ofta överlappar varandra. Nedre luftvägsinfektioner, inklusive lunginflammation, har rapporterats efter inhalerad administrering av kortikosteroider.
en 6-månaders lungfunktionsstudie av 1704 patienter med KOL, fanns en högre incidens av andra lunginfektioner än lunginflammation (t.ex. bronkit, virusinfektioner i de nedre luftvägarna, etc.) hos patienter som fick SYMBICORT 160/4,5 (7,6 %) än hos dem som fick SYMBICORT 80/4,5 (3,2 %), formoterol 4,5 mikrogram (4,6 %) eller placebo (3,3 %). Lunginflammation förekom inte med högre incidens i SYMBICORT 160/4,5-gruppen (1,1 %) jämfört med placebo (1,3 %). I en 12-månaders lungfunktionsstudie av 1964 patienter med KOL fanns det också en högre incidens av andra lunginfektioner än lunginflammation hos patienter som fick SYMBICORT 160/4,5 (8,1 %) än hos de som fick SYMBICORT 80/4,5 (6,9 %). formoterol 4,5 mcg (7,1 %) eller placebo (6,2 %). I likhet med 6-månadersstudien förekom inte lunginflammation med högre incidens i SYMBICORT 160/4,5-gruppen (4,0 %) jämfört med placebo (5,0 %).
Immunsuppression
Patienter som tar läkemedel som dämpar immunförsvaret är mer mottagliga för infektion än friska individer. Vattkoppor och mässling, till exempel, kan ha ett allvarligare eller till och med dödligt förlopp hos känsliga barn eller vuxna som använder kortikosteroider. Hos sådana barn eller vuxna som inte har haft dessa sjukdomar eller blivit ordentligt immuniserade bör särskild försiktighet iakttas för att undvika exponering. Hur dosen, vägen och varaktigheten av administrering av kortikosteroider påverkar risken för att utveckla en spridd infektion är inte känt. Bidraget från den underliggande sjukdomen och/eller tidigare kortikosteroidbehandling till risken är inte heller känt. Vid exponering kan behandling med varicella zoster immunglobulin (VZIG) eller poolat intravenöst immunglobulin (IVIG), beroende på vad som är lämpligt, vara indicerat. Vid exponering för mässling kan profylax med poolat intramuskulärt immunglobulin (IG) vara indicerat (se respektive bipacksedel för fullständig VZIG- och IG-förskrivningsinformation). Om vattkoppor utvecklas kan behandling med antivirala medel övervägas. Immunresponsen mot varicellavaccin utvärderades hos pediatriska patienter med astma i åldrarna 12 månader till 8 år med budesonid-inhalationssuspension.
En öppen, icke-randomiserad klinisk studie undersökte immunsvaret mot varicellavaccin hos 243 astmapatienter i åldern 12 månader till 8 år som behandlades med budesonid-inhalationssuspension 0,25 mg till 1 mg dagligen (n=151) eller icke-kortikosteroid astmaterapi (n) =92) (dvs beta2-agonister, leukotrienreceptorantagonister, kromoner). Andelen patienter som utvecklade en seroprotektiv antikroppstiter på >5,0 (gpELISA-värde) som svar på vaccinationen var liknande hos patienter som behandlats med budesonid-inhalationssuspension (85 %), jämfört med patienter som behandlats med icke-kortikosteroid astmabehandling (90 %). Ingen patient som behandlats med budesonid-inhalationssuspension utvecklade vattkoppor som ett resultat av vaccination.
Inhalerade kortikosteroider bör användas med försiktighet, om överhuvudtaget, till patienter med aktiva eller vilande tuberkulosinfektioner i luftvägarna; obehandlade systemiska svamp-, bakterie-, virus- eller parasitinfektioner; eller okulär herpes simplex.
Överföring av patienter från systemisk kortikosteroidterapi
Särskild omsorg behövs för patienter som har övergått från systemiskt aktiva kortikosteroider till inhalerade kortikosteroider eftersom dödsfall på grund av binjurebarksvikt har inträffat hos patienter med astma under och efter övergång från systemiska kortikosteroider till mindre systemiskt tillgängliga inhalerade kortikosteroider. Efter utsättning från systemiska kortikosteroider krävs ett antal månader för återhämtning av hypotalamus-hypofys-binjurefunktionen (HPA).
Patienter som tidigare har hållits på 20 mg eller mer per dag av prednison (eller motsvarande) kan vara mest mottagliga, särskilt när deras systemiska kortikosteroider nästan helt har tagits ut. Under denna period av HPA-dämpning kan patienter uppvisa tecken och symtom på binjurebarksvikt när de utsätts för trauma, kirurgi eller infektion (särskilt gastroenterit) eller andra tillstånd associerade med allvarlig elektrolytförlust. Även om SYMBICORT kan ge kontroll över astmasymtom under dessa episoder, tillför det i rekommenderade doser mindre än normala fysiologiska mängder av glukokortikoid systemiskt och ger INTE den mineralokortikoidaktivitet som är nödvändig för att hantera dessa nödsituationer.
Under perioder av stress, ett allvarligt astmaanfall eller en allvarlig KOL-exacerbation, bör patienter som har tagit slut från systemiska kortikosteroider instrueras att omedelbart återuppta orala kortikosteroider (i stora doser) och att kontakta sin läkare för vidare instruktioner. Dessa patienter bör också instrueras att bära ett varningskort som indikerar att de kan behöva kompletterande systemiska kortikosteroider under perioder av stress, ett allvarligt astmaanfall eller en allvarlig KOL-exacerbation.
Patienter som behöver orala kortikosteroider bör långsamt avvänjas från systemisk kortikosteroidanvändning efter övergång till SYMBICORT. Prednisonreduktion kan uppnås genom att minska den dagliga prednisondosen med 2,5 mg på veckobasis under behandling med SYMBICORT. Lungfunktion (genomsnittlig forcerad utandningsvolym på 1 sekund [FEV1] eller toppexspirationsflöde på morgonen [PEF]), användning av beta-agonist och astma- eller KOL-symtom bör övervakas noggrant under utsättande av orala kortikosteroider. Dessutom bör patienter observeras för tecken och symtom på binjurebarksvikt, såsom trötthet, trötthet, svaghet, illamående och kräkningar samt hypotoni.
Övergång av patienter från systemisk kortikosteroidbehandling till inhalerade kortikosteroider eller SYMBICORT kan avslöja tillstånd som tidigare undertryckts av den systemiska kortikosteroidterapin (t.ex. rinit, konjunktivit, eksem, artrit, eosinofila tillstånd). Vissa patienter kan uppleva symtom på systemiskt aktiva kortikosteroidabstinenser (t.ex. led- och/eller muskelsmärta, trötthet, depression) trots underhåll eller till och med förbättring av andningsfunktionen.
Hyperkorticism och binjuresuppression
Budesonid, en komponent i SYMBICORT, hjälper ofta till att kontrollera astma- och KOL-symtom med mindre hämmande av HPA-funktionen än terapeutiskt ekvivalenta orala doser av prednison. Eftersom budesonid absorberas i cirkulationen och kan vara systemiskt aktivt vid högre doser, kan de fördelaktiga effekterna av SYMBICORT för att minimera HPA-dysfunktion förväntas endast när rekommenderade doser inte överskrids och enskilda patienter titreras till lägsta effektiva dos.
På grund av möjligheten till systemisk absorption av inhalerade kortikosteroider, bör patienter som behandlas med SYMBICORT 160 mg observeras noggrant för tecken på systemiska kortikosteroideffekter. Särskild försiktighet bör iakttas vid observation av patienter postoperativt eller under perioder av stress för tecken på otillräckligt binjuresvar.
Det är möjligt att systemiska kortikosteroideffekter såsom hyperkorticism och binjurebarksuppression (inklusive binjurekris) kan uppträda hos ett litet antal patienter, särskilt när budesonid administreras i högre än rekommenderade doser under längre tidsperioder. Om sådana effekter uppstår ska dosen av SYMBICORT minskas långsamt, i enlighet med accepterade förfaranden för att minska systemiska kortikosteroider och för hantering av astmasymtom.
Läkemedelsinteraktioner med starka Cytokrom P450 3A4-hämmare
Försiktighet bör iakttas när man överväger samtidig administrering av SYMBICORT 4,5 mcg med ketokonazol och andra kända starka CYP3A4-hämmare (t.ex. ritonavir, atazanavir, klaritromycin, indinavir, itrakonazol, nefazodon, nelfinavir, sakinavireffekt relaterad till ökad exponering för telitromycin i systemet) till budesonid kan förekomma [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
Paradoxal bronkospasm och övre luftvägssymtom
Som med andra inhalationsläkemedel kan SYMBICORT 160mg ge paradoxal bronkospasm, som kan vara livshotande. Om paradoxal bronkospasm uppstår efter dosering med SYMBICORT 160 mg, ska den behandlas omedelbart med en inhalerad, kortverkande luftrörsvidgare, SYMBICORT ska avbrytas omedelbart och alternativ behandling bör sättas in.
Omedelbara överkänslighetsreaktioner
Omedelbara överkänslighetsreaktioner kan uppstå efter administrering av SYMBICORT 160 mg, vilket påvisats genom fall av urtikaria, angioödem, hudutslag och bronkospasm.
Kardiovaskulära och centrala nervsystemets effekter
Överdriven beta-adrenerg stimulering har associerats med kramper, angina, hypertoni eller hypotoni, takykardi med hastigheter upp till 200 slag/min, arytmier, nervositet, huvudvärk, tremor, hjärtklappning, illamående, yrsel, trötthet, sjukdomskänsla och sömnlöshet [se ÖVERDOSERING ]. Därför bör SYMBICORT 160mg, liksom alla produkter som innehåller sympatomimetiska aminer, användas med försiktighet hos patienter med kardiovaskulära störningar, särskilt kranskärlssvikt, hjärtarytmier och hypertoni.
Formoterol, en komponent i SYMBICORT, kan ge en kliniskt signifikant kardiovaskulär effekt hos vissa patienter mätt som puls, blodtryck och/eller symtom. Även om sådana effekter är ovanliga efter administrering av formoterol i rekommenderade doser, kan läkemedlet behöva avbrytas om de inträffar. Dessutom har beta-agonister rapporterats ge EKG-förändringar, såsom tillplattad T-våg, förlängning av QTc-intervallet och ST-segmentdepression. Den kliniska betydelsen av dessa fynd är okänd. Dödsfall har rapporterats i samband med överdriven användning av inhalerade sympatomimetika.
Minskning av benmineraldensitet
Minskning av bentäthet (BMD) har observerats vid långvarig administrering av produkter som innehåller inhalerade kortikosteroider. Den kliniska betydelsen av små förändringar i BMD med avseende på långsiktiga konsekvenser som fraktur är okänd. Patienter med stora riskfaktorer för minskat benmineralinnehåll, såsom långvarig immobilisering, familjehistoria av osteoporos, postmenopausal status, tobaksanvändning, hög ålder, dålig kost eller kronisk användning av läkemedel som kan minska benmassan (t.ex. antikonvulsiva medel, orala kortikosteroider ) bör övervakas och behandlas med etablerade vårdstandarder. Eftersom patienter med KOL ofta har flera riskfaktorer för minskad BMD, rekommenderas bedömning av BMD innan SYMBICORT 160 mg påbörjas och periodvis därefter. Om betydande minskningar av BMD ses och SYMBICORT fortfarande anses vara medicinskt viktigt för den patientens KOL-behandling, bör användning av läkemedel för att behandla eller förebygga osteoporos starkt övervägas.
Effekter av behandling med SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoterol 4,5 mikrogram eller placebo på BMD utvärderades i en undergrupp av 326 patienter (kvinnor och män i åldern 41 till 88 år) med KOL i 12-månaders lungfunktion studie. BMD-utvärderingar av höft- och ländryggsregionerna utfördes vid baslinjen och 52 veckor med användning av dubbelenergiröntgenabsorptiometri (DEXA) skanningar. Medelförändringar i BMD från baslinjen till slutet av behandlingen var små (medelförändringar varierade från -0,01 -0,01 g/cm²). ANCOVA-resultat för total ryggrad och total höft-BMD baserad på tidpunkten för slutet av behandlingen visade att alla geometriska LS-medelkvoter för de parvisa behandlingsgruppens jämförelser var nära 1, vilket indikerar att totalt BMD för totala höft- och totala ryggradsregionerna för de 12 -månader var stabila under hela behandlingsperioden.
Effekt På Tillväxt
Oralt inhalerade kortikosteroider kan orsaka en minskning av tillväxthastigheten när de administreras till pediatriska patienter. Övervaka tillväxten hos pediatriska patienter som får SYMBICORT rutinmässigt (t.ex. via stadiometri). För att minimera de systemiska effekterna av orala inhalerade kortikosteroider, inklusive SYMBICORT, titrera varje patients dos till den lägsta dos som effektivt kontrollerar hans/hennes symtom [se DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
Glaukom och grå starr
Glaukom, ökat intraokulärt tryck och grå starr har rapporterats hos patienter med astma och KOL efter långvarig administrering av inhalerade kortikosteroider, inklusive budesonid, en komponent i SYMBICORT. Därför är noggrann övervakning berättigad hos patienter med en förändring i synen eller med anamnes på ökat intraokulärt tryck, glaukom och/eller grå starr.
Effekter av behandling med SYMBICORT 160/4,5, SYMBICORT 80/4,5, formoterol 4,5 mikrogram eller placebo på utveckling av grå starr eller glaukom utvärderades hos en undergrupp av 461 patienter med KOL i den 12-månaders lungfunktionsstudien. Oftalmiska undersökningar utfördes vid baslinjen, 24 veckor och 52 veckor. Det fanns 26 försökspersoner (6%) med en ökning av den bakre subkapsulära poängen från baslinjen till maximalt värde (>0,7) under den randomiserade behandlingsperioden. Förändringar i posterior subkapsulära poäng på >0,7 från baslinje till behandlingsmaximum inträffade hos 11 patienter (9,0 %) i SYMBICORT 160/4,5-gruppen, 4 patienter (3,8 %) i SYMBICORT 80/4,5-gruppen, 5 patienter (4,2 %) i formoterolgruppen och 6 patienter (5,2%) i placebogruppen.
Eosinofila tillstånd och Churg-Strauss syndrom
sällsynta fall kan patienter på inhalerade kortikosteroider uppvisa systemiska eosinofila tillstånd. Vissa av dessa patienter har kliniska drag av vaskulit som överensstämmer med Churg-Strauss syndrom, ett tillstånd som ofta behandlas med systemisk kortikosteroidbehandling. Dessa händelser har vanligtvis, men inte alltid, associerats med minskning och/eller utsättning av oral kortikosteroidbehandling efter introduktion av inhalerade kortikosteroider. Läkare bör vara uppmärksamma på eosinofili, vaskulitutslag, förvärrade lungsymtom, hjärtkomplikationer och/eller neuropati hos sina patienter. Ett orsakssamband mellan budesonid och dessa underliggande tillstånd har inte fastställts.
Samexisterande förhållanden
SYMBICORT 4,5 mcg, liksom alla läkemedel som innehåller sympatomimetiska aminer, bör användas med försiktighet till patienter med krampsjukdomar eller tyreotoxikos och till de som är ovanligt känsliga för sympatomimetiska aminer. Doser av den besläktade beta2-adrenoceptoragonisten albuterol, när de administreras intravenöst, har rapporterats förvärra redan existerande diabetes mellitus och ketoacidos.
Hypokalemi och hyperglykemi
Beta-adrenerga agonister kan ge signifikant hypokalemi hos vissa patienter, möjligen genom intracellulär shunting, vilket har potential att ge negativa kardiovaskulära effekter [se KLINISK FARMAKOLOGI ]. Minskningen av serumkalium är vanligtvis övergående och kräver inte tillskott. Kliniskt signifikanta förändringar i blodsocker och/eller serumkalium sågs sällan under kliniska studier med SYMBICORT i rekommenderade doser.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION och bruksanvisning ).
Allvarliga astmarelaterade händelser
Informera patienter med astma att LABA när det används ensamt ökar risken för astma-relaterad sjukhusvistelse eller astma-relaterad död. Tillgängliga data visar att när ICS och LABA används tillsammans, såsom med SYMBICORT, finns det ingen signifikant ökning av risken för dessa händelser.
Inte för akuta symtom
Informera patienterna om att SYMBICORT 160mg inte är avsett att lindra akuta symtom på astma eller KOL och att extra doser inte ska användas för detta ändamål. Rekommendera patienter att behandla akuta symtom med en inhalerad, kortverkande beta2-agonist såsom albuterol. Ge patienterna sådan medicin och instruera patienten i hur den ska användas.
Instruera patienterna att omedelbart söka läkarvård om de upplever något av följande:
- Minskad effektivitet av inhalerade, kortverkande beta2-agonister
- Behov av fler inhalationer än vanligt av inhalerade, kortverkande beta2-agonister
- Betydande minskning av lungfunktionen enligt läkarens beskrivning
Berätta för patienterna att de inte ska avbryta behandlingen med SYMBICORT utan vägledning från läkare/leverantör eftersom symtomen kan återkomma efter utsättning.
Använd inte ytterligare långverkande beta2-agonister
Instruera patienterna att inte använda annan LABA för astma och KOL.
Lokala effekter
Informera patienterna om att lokaliserade infektioner med Candida albicans förekom i munnen och svalget hos vissa patienter. Om orofaryngeal candidiasis utvecklas, bör den behandlas med lämplig lokal eller systemisk (dvs oral) svampdödande behandling samtidigt som behandlingen med SYMBICORT 4,5 mikrogram fortsätter, men ibland kan behandlingen med SYMBICORT behöva avbrytas tillfälligt under noggrann medicinsk övervakning. Att skölja munnen med vatten utan att svälja efter inandning rekommenderas för att minska risken för trast.
Lunginflammation
Patienter med KOL har en högre risk för lunginflammation; instruera dem att kontakta sin vårdgivare om de utvecklar symtom på lunginflammation.
Immunsuppression
Varna patienter som är på immunsuppressiva doser av kortikosteroider för att undvika exponering för vattkoppor eller mässling och, om de exponeras, att konsultera sin läkare utan dröjsmål. Informera patienter om potentiell försämring av befintlig tuberkulos, svamp-, bakterie-, virus- eller parasitinfektioner eller okulär herpes simplex.
Hyperkorticism och binjuresuppression
Informera patienter om att SYMBICORT kan orsaka systemiska kortikosteroideffekter av hyperkorticism och binjuresuppression. Informera dessutom patienterna om att dödsfall på grund av binjurebarksvikt har inträffat under och efter övergång från systemiska kortikosteroider. Patienter bör långsamt minska från systemiska kortikosteroider om de går över till SYMBICORT.
Minskning av benmineraldensitet
Informera patienter som löper en ökad risk för minskad BMD att användning av kortikosteroider kan utgöra en ytterligare risk.
Minskad tillväxthastighet
Informera patienter om att orala inhalerade kortikosteroider, en komponent i SYMBICORT, kan orsaka en minskning av tillväxthastigheten när de administreras till pediatriska patienter. Läkare bör noggrant följa tillväxten hos barn och ungdomar som tar kortikosteroider oavsett väg.
Okulära effekter
Långvarig användning av inhalerade kortikosteroider kan öka risken för vissa ögonproblem (grå starr eller glaukom); överväga regelbundna ögonundersökningar.
Risker förknippade med beta-agonistterapi
Informera patienter om biverkningar associerade med beta2agonister, såsom hjärtklappning, bröstsmärtor, snabb hjärtfrekvens, tremor eller nervositet.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Budesonid
Långtidsstudier utfördes på råttor och möss med oral administrering för att utvärdera den karcinogena potentialen hos budesonid.
en 2-årig studie på Sprague-Dawley-råttor orsakade budesonid en statistiskt signifikant ökning av incidensen av gliom hos hanråttor vid en oral dos på 50 mcg/kg (ungefär motsvarande MRHDID hos vuxna och barn på en mcg/m² grund). Ingen tumörframkallande effekt sågs hos han- och honråttor vid respektive orala doser upp till 25 och 50 mikrogram/kg (ungefär ekvivalent med MRHDID hos vuxna och barn på en mikrogram/m²-basis). I ytterligare två 2-åriga studier på Fischer- och Sprague-Dawley-hanråttor orsakade budesonid inga gliom vid en oral dos på 50 mcg/kg (ungefär motsvarande MRHDID hos vuxna och barn på en mcg/m²-basis). Hos Sprague-Dawley-hanråttor orsakade dock budesonid en statistiskt signifikant ökning av förekomsten av hepatocellulära tumörer vid en oral dos på 50 mcg/kg (ungefär ekvivalent med MRHDID hos vuxna och barn på en mcg/m²-basis). De samtidiga referenskortikosteroiderna (prednisolon och triamcinolonacetonid) i dessa två studier visade liknande fynd.
en 91-veckors studie på möss orsakade budesonid ingen behandlingsrelaterad karcinogenicitet vid orala doser upp till 200 mcg/kg (ungefär 2 gånger MRHDID hos vuxna och barn på en mcg/m² basis).
Budesonid var inte mutagent eller klastogent i sex olika testsystem: Ames Salmonella/mikrosomplattest, mus-mikronkärntest, muslymfomtest, kromosomavvikelsetest i humana lymfocyter, könsbundet recessivt dödligt test i Drosophila melanogaster och DNA-reparationsanalys hos råtta hepatocytodling.
Fertilitet och reproduktionsförmåga påverkades inte hos råttor vid subkutana doser upp till 80 mcg/kg (ungefär lika med MRHDID på en mcg/m²-basis). Det orsakade dock en minskning av prenatal livsduglighet och livsduglighet hos ungarna vid födseln och under laktationen, tillsammans med en minskning av moderns kroppsviktsökning, vid subkutana doser på 20 mcg/kg och högre (mindre än MRHDID på en mcg/m²-basis ). Inga sådana effekter noterades vid 5 mcg/kg (mindre än MRHDID på en mcg/m²-basis).
Formoterol
Långtidsstudier utfördes på möss som använde oral administrering och på råttor som använde inhalationsadministrering för att utvärdera den karcinogena potentialen hos formoterolfumarat.
I en 24-månaders karcinogenicitetsstudie på CD-1-möss orsakade formoterol vid orala doser på 100 mcg/kg och högre (ungefär 30 och 15 gånger MRHDID hos vuxna respektive barn, på en mcg/m²-basis) en dos- relaterad ökning av incidensen av uterina leiomyom.
I en 24-månaders karcinogenicitetsstudie på Sprague-Dawley-råttor observerades en ökad incidens av mesovarian leiomyom och uterin leiomyosarkom vid inhalerad dos på 130 mcg/kg (ungefär 70 och 35 gånger MRHDID hos vuxna och barn, resp. mcg/m²). Inga tumörer sågs vid 22 mcg/kg (ungefär 12 och 6 gånger MRHDID hos vuxna respektive barn, på en mcg/m² basis).
Andra beta-agonistläkemedel har på liknande sätt visat ökningar av leiomyom i könsorganen hos kvinnliga gnagare. Relevansen av dessa fynd för mänsklig användning är okänd.
Formoterol var inte mutagent eller klastogent i Ames Salmonella/mikrosomplatttest, muslymfomtest, kromosomavvikelsetest i humana lymfocyter och mikrokärntest på råtta.
En minskning av fertilitet och/eller reproduktionsförmåga identifierades hos hanråttor som behandlats med formoterol vid en oral dos på 15 000 mcg/kg (ungefär 2200 gånger MRHDID på AUC-basis). Ingen sådan effekt sågs vid 3000 mcg/kg (ungefär 1600 gånger MRHDID på en mcg/m²-basis). I en separat studie med råttor av hankön behandlade med en oral dos på 15 000 mcg/kg (ungefär 8000 gånger MRHDID på en mcg/m²-basis), upptäcktes testikelröratrofi och spermatiskt skräp i testiklarna och oligospermi i epididymiderna. Ingen effekt på fertiliteten upptäcktes hos honråttor vid doser upp till 15 000 mikrogram/kg (ungefär 1100 gånger MRHDID på AUC-basis).
Användning i specifika populationer
Graviditet
Risksammanfattning
Det finns inga adekvata och välkontrollerade studier av SYMBICORT 160 mg eller en av dess individuella komponenter, formoterolfumarat, på gravida kvinnor; studier finns dock tillgängliga för den andra komponenten budesonid. I reproduktionsstudier på djur var SYMBICORT 4,5 mcg, administrerat via inhalationsvägen, teratogen, embryocidal och reducerad fostervikt hos råttor vid mindre än den maximala rekommenderade humana dagliga inhalationsdosen (MRHDID) på en mcg/m² basis. Enbart budesonid, administrerat subkutant, var teratogent, embryocidal och reducerade fostervikten hos råttor och kaniner vid mindre än MRHDID, men dessa effekter sågs inte hos råttor som fick inhalerade doser upp till 4 gånger MRHDID. Studier av gravida kvinnor har inte visat att inhalerad budesonid ensamt ökar risken för abnormiteter vid administrering under graviditet. Erfarenhet av orala kortikosteroider tyder på att gnagare är mer benägna att få teratogena effekter av kortikosteroidexponering än människor. Enbart formoterolfumarat, administrerat oralt, var teratogent hos råttor och kaniner vid 1600 respektive 65 000 gånger MRHDID. Formoterolfumarat var också embryodödande, ökade förlusten av ungar vid födseln och under laktation, och minskade valpvikten hos råttor vid 110 gånger MRHDID. Dessa biverkningar inträffade i allmänhet vid stora multiplar av MRHDID när formoterolfumarat administrerades oralt för att uppnå hög systemisk exponering. Inga teratogena, embryocidala eller utvecklingseffekter sågs hos råttor som fick inhalationsdoser upp till 375 gånger MRHDID.
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall hos de indikerade populationerna är okänd. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Kliniska överväganden
Sjukdomsrelaterad risk för mödrar och/eller embryo/foster
Hos kvinnor med dåligt eller måttligt kontrollerad astma finns en ökad risk för flera perinatala biverkningar såsom havandeskapsförgiftning hos modern och prematuritet, låg födelsevikt och liten för graviditetsåldern hos den nyfödda. Gravida kvinnor med astma bör övervakas noggrant och medicineringen justeras vid behov för att bibehålla optimal astmakontroll.
Arbetskraft eller leverans
Det finns inga välkontrollerade studier på människa som har undersökt effekterna av SYMBICORT 4,5 mcg under förlossning och förlossning. På grund av risken för beta-agonistinterferens med uterus kontraktilitet, bör användning av SYMBICORT 4,5 mcg under förlossningen begränsas till de patienter hos vilka fördelarna klart överväger risken.
Data
Mänskliga data
Studier av gravida kvinnor har inte visat att inhalerad budesonid ökar risken för abnormiteter vid administrering under graviditet. Resultaten från en stor populationsbaserad prospektiv kohort epidemiologisk studie som granskar data från tre svenska register som täcker cirka 99 % av graviditeterna från 1995-1997 (dvs. Svenska Medicinska födelseregistret; Register över medfödda missbildningar; Barnkardiologiska registret) indikerar ingen ökad risk för medfödda missbildningar från användning av inhalerad budesonid under tidig graviditet. Medfödda missbildningar studerades 2014 hos spädbarn födda av mödrar som rapporterade användningen av inhalerad budesonid för astma under tidig graviditet (vanligtvis 10-12 veckor efter den sista menstruationen), den period då de flesta större organmissbildningar inträffar. Frekvensen av registrerade medfödda missbildningar var liknande jämfört med den allmänna populationsfrekvensen (3,8 % respektive 3,5 %). Dessutom, efter exponering för inhalerad budesonid, var antalet spädbarn födda med orofaciala klyftor liknande det förväntade antalet i normalpopulationen (4 barn respektive 3,3).
Samma data användes i en andra studie som gav det totala antalet till 2534 spädbarn vars mödrar exponerades för inhalerad budesonid. I denna studie skilde sig inte frekvensen av medfödda missbildningar bland spädbarn vars mödrar exponerades för inhalerad budesonid under tidig graviditet från frekvensen för alla nyfödda barn under samma period (3,6 %).
Djurdata
SYMBICORT
I en embryo-fosterutvecklingsstudie på dräktiga råttor som doserats under organogenesperioden från dräktighetsdagarna 6-16, producerade SYMBICORT 160 mg navelbråck hos foster vid doser lägre än MRHDID (på en mcg/m² basis vid moderns inhalerade doser på 12/ 0,66 mcg/kg/dag och mer). Fostervikten reducerades med cirka 5 respektive 3 gånger MRHDID (på AUC-basis vid en modern inhalerad dos på 80/4,4 mcg/kg (budesonid/formoterol)). Inga teratogena eller embryocidala effekter upptäcktes vid doser lägre än MRHDID (på en mcg/m² basis vid en modern inhalerad dos på 2,5/0,14 mcg/kg/dag).
Budesonid
en fertilitets- och reproduktionsstudie doserades hanråttor subkutant i 9 veckor och honor i 2 veckor före parning och under hela parningsperioden. Honor doserades fram till avvänjning av sina avkommor. Budesonid orsakade en minskning av prenatal livsduglighet och livsduglighet hos ungarna vid födseln och under laktationen, tillsammans med en minskning av moderns kroppsviktsökning, vid doser lägre än MRHDID (på en mcg/m² basis vid moderns subkutana doser på 20 mcg/ kg/dag och uppåt). Inga sådana effekter noterades vid en lägre dos än MRHDID (på en mcg/m²-basis vid en subkutan dos av modern på 5 mcg/kg/dag).
en embryo-fosterutvecklingsstudie på dräktiga kaniner doserade under organogenesperioden från dräktighetsdagarna 6-18 gav budesonid fosterförlust, minskad fostervikt och skelettavvikelser vid doser lägre än MRHDID (på en mcg/m²-basis vid en modern subkutan dos på 25 mcg/kg/dag). I en embryo-fosterutvecklingsstudie på dräktiga råttor som doserats under organogenesperioden från dräktighetsdagarna 6-15, gav budesonid liknande negativa fostereffekter vid doser ungefär 8 gånger MRHDID (på en mcg/m²-basis vid en subkutan dos av modern på 500 mcg/kg/dag). I en annan embryo-fosterutvecklingsstudie på gravida råttor sågs inga teratogena eller embryocidala effekter vid doser upp till 4 gånger MRHDID (på en mcg/m² basis vid moderns inhalationsdoser upp till 250 mcg/kg/dag).
en peri- och postnatal utvecklingsstudie, där råttor doserade från dräktighetsdag 15 till postpartum dag 21, hade budesonid inga effekter på förlossningen, men hade en effekt på tillväxt och utveckling av avkomma. Avkommans överlevnad minskade och överlevande avkommor hade minskat medelkroppsvikten vid födseln och under amning vid doser lägre än MRHDID och högre (på en mcg/m² basis vid moderns subkutana doser på 20 mcg/kg/dag och högre). Dessa fynd inträffade i närvaro av maternell toxicitet.
Formoterol
en fertilitets- och reproduktionsstudie doserades hanråttor oralt i 9 veckor och honor i 2 veckor före parning och under hela parningsperioden. Honor doserades antingen fram till dräktighetsdag 19 eller fram till avvänjning av sina avkommor. Hanar doserades upp till 25 veckor. Navelbråck observerades hos råttfoster vid orala doser 1600 gånger och högre än MRHDID (på en mcg/m² basis vid moderns orala doser på 3000 mcg/kg/dag och högre). Brachygnati observerades hos råttfoster vid en dos på 8 000 gånger MRHDID (på en mcg/m²-basis vid en oral dos för modern på 15 000 mcg/kg/dag). Graviditeten förlängdes med en dos på 8000 gånger MRHDID (på en mcg/m²-basis vid en modern oral dos på 15 000 mcg/kg/dag). Foster- och valpdöd inträffade vid doser ungefär 1600 gånger MRHDID och högre (på en mcg/m²-basis vid orala doser på 3000 mcg/kg/dag och högre) under dräktigheten.
en embryo-fosterutvecklingsstudie på dräktiga råttor doserade under organogenesperioden från dräktighetsdagarna 6-15, sågs inga teratogena, embryocidala eller utvecklingseffekter vid doser upp till 375 gånger MRHDID (på en mcg/m²-basis med modern inandning doser upp till 690 mcg/kg/dag).
I en embryo-fosterutvecklingsstudie på dräktiga kaniner doserade under organogenesperioden från dräktighetsdagarna 6-18, observerades subkapsulära cystor på levern hos fostren vid en dos 65 000 gånger MRHDID (på en mcg/m²-basis med en maternell oral dos på 60 000 mcg/kg/dag). Inga teratogena effekter observerades vid doser upp till 3 800 gånger MRHDID (på en mcg/m² basis vid orala doser för modern upp till 3 500 mcg/kg/dag).
en pre- och postnatal utvecklingsstudie fick gravida honråttor formoterol i orala doser på 0, 210, 840 och 3400 mcg/kg/dag från dräktighetsdag 6 till och med laktationsperioden. Valpens överlevnad minskade från födseln till postpartum dag 26 vid doser 110 gånger MRHDID och högre (på en mcg/m²-basis vid moderns orala doser på 210 mcg/kg/dag och högre), även om det inte fanns några tecken på dosrespons relation. Det fanns inga behandlingsrelaterade effekter på den fysiska, funktionella och beteendemässiga utvecklingen hos råttungar.
Laktation
Risksammanfattning
Det finns inga tillgängliga data om effekterna av SYMBICORT 4,5 mcg, budesonid eller formoterolfumarat på det ammade barnet eller på mjölkproduktionen. Budesonid, liksom andra inhalerade kortikosteroider, finns i bröstmjölk [se Data ]. Det finns inga tillgängliga data om förekomsten av formoterolfumarat i modersmjölk. Formoterolfumarat finns i råttmjölk [se Data ]. Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av SYMBICORT 4,5 mikrogram och eventuella negativa effekter på det ammade barnet från SYMBICORT 160 mg eller från det underliggande moderns tillståndet.
Data
Humandata med budesonid tillfört via torrpulverinhalator indikerar att den totala dagliga orala dosen av budesonid som är tillgänglig i bröstmjölk till spädbarnet är cirka 0,3 % till 1 % av dosen som inhaleras av modern [se KLINISK FARMAKOLOGI ]. För SYMBICORT 4,5 mikrogram förväntas den tillgängliga dosen av budesonid för spädbarnet i bröstmjölk, i procent av moderns dos, vara liknande.
I fertilitets- och reproduktionsstudien på råttor mättes plasmanivåer av formoterol i ungar på postnatal dag 15 [se Användning i specifika populationer ]. Det uppskattades att den maximala plasmakoncentrationen som ungarna fick från moderdjuret, vid den högsta dosen på 15 mg/kg, efter amning var 4,4 % (0,24 nmol/L för en kull mot 5,5 nmol/L för modern) .
Pediatrisk användning
Säkerhet och effektivitet av SYMBICORT hos astmapatienter 12 år och äldre har fastställts i studier upp till 12 månader. I de två 12 veckor långa, dubbelblinda, placebokontrollerade amerikanska pivotala studierna behandlades 25 patienter i åldern 12 till 17 år med SYMBICORT två gånger dagligen [se Kliniska studier ]. Effektresultaten i denna åldersgrupp liknade de som observerats hos patienter 18 år och äldre. Det fanns inga uppenbara skillnader i typen eller frekvensen av biverkningar som rapporterats i denna åldersgrupp jämfört med patienter 18 år och äldre.
Säkerheten och effektiviteten av SYMBICORT 80/4.5 hos astmapatienter 6 till yngre än 12 år har fastställts i studier av upp till 12 veckors varaktighet [se Kliniska studier ]. Säkerhetsprofilen hos dessa patienter överensstämde med den som observerades hos patienter 12 år och äldre som också fick SYMBICORT [se NEGATIVA REAKTIONER ].
Säkerheten och effektiviteten av SYMBICORT 160 mg hos astmapatienter yngre än 6 år har inte fastställts.
Kontrollerade kliniska studier har visat att oralt inhalerade kortikosteroider inklusive budesonid, en komponent i SYMBICORT, kan orsaka en minskning av tillväxthastigheten hos pediatriska patienter. Denna effekt har observerats i avsaknad av laboratoriebevis för HPA-axelsuppression, vilket tyder på att tillväxthastigheten är en känsligare indikator på systemisk kortikosteroidexponering hos pediatriska patienter än några vanliga tester av HPA-axelns funktion. Den långsiktiga effekten av denna minskning av tillväxthastigheten associerad med oralt inhalerade kortikosteroider, inklusive effekten på den slutliga längden är okänd. Potentialen för tillväxt efter avslutad behandling med oralt inhalerade kortikosteroider har inte studerats tillräckligt.
en studie av astmatiska barn i åldern 5 till 12 år hade de som behandlades med budesonid DPI 200 mcg två gånger dagligen (n=311) en minskning av tillväxten med 1,1 centimeter jämfört med de som fick placebo (n=418) i slutet av ett år ; skillnaden mellan dessa två behandlingsgrupper ökade inte ytterligare under tre års ytterligare behandling. Vid slutet av fyra år hade barn som behandlats med budesonid DPI och barn som behandlats med placebo liknande tillväxthastigheter. Slutsatserna från denna studie kan förvirras av den ojämlika användningen av kortikosteroider i behandlingsgrupperna och inkluderandet av data från patienter som uppnår puberteten under studiens gång.
Tillväxten hos pediatriska patienter som får oralt inhalerade kortikosteroider, inklusive SYMBICORT, bör övervakas. Om ett barn eller en ungdom som använder någon kortikosteroid verkar ha tillväxthämning, bör möjligheten att han/hon är särskilt känslig för denna effekt övervägas. De potentiella tillväxteffekterna av förlängd behandling bör vägas mot de kliniska fördelarna som erhålls. För att minimera de systemiska effekterna av orala inhalerade kortikosteroider, inklusive SYMBICORT, bör varje patient titreras till den lägsta styrkan som effektivt kontrollerar hans/hennes astma [se DOSERING OCH ADMINISTRERING ].
Geriatrisk användning
Av det totala antalet astmapatienter som behandlades med SYMBICORT 160 mg två gånger dagligen i två 12-veckorsstudier och en 26-veckors studie efter marknadsföring var 791 65 år eller äldre, varav 141 var 75 år eller äldre.
KOL-studierna på 6 till 12 månader var 810 patienter som behandlades med SYMBICORT 160/4.5, två inhalationer två gånger dagligen 65 år och äldre och av dessa var 177 patienter 75 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa patienter och yngre patienter, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter.
Liksom med andra produkter som innehåller beta2-agonister, bör särskild försiktighet iakttas vid användning av SYMBICORT till geriatriska patienter som har samtidig hjärt-kärlsjukdom som kan påverkas negativt av beta2-agonister.
Baserat på tillgängliga data för SYMBICORT eller dess aktiva komponenter är ingen justering av dosen av SYMBICORT 4,5 mikrogram till geriatriska patienter motiverad.
Nedsatt leverfunktion
Formella farmakokinetiska studier med SYMBICORT har inte utförts på patienter med nedsatt leverfunktion. Men eftersom både budesonid och formoterolfumarat huvudsakligen elimineras genom levermetabolism, kan försämrad leverfunktion leda till ackumulering av budesonid och formoterolfumarat i plasma. Därför bör patienter med leversjukdom övervakas noggrant.
Nedsatt njurfunktion
Formella farmakokinetiska studier med SYMBICORT har inte utförts på patienter med nedsatt njurfunktion.
ÖVERDOS
SYMBICORT
SYMBICORT innehåller både budesonid och formoterol; därför gäller riskerna förknippade med överdosering av de enskilda komponenterna som beskrivs nedan för SYMBICORT. I farmakokinetiska studier administrerades engångsdoser på 960/54 mikrogram (12 aktivering av SYMBICORT 80/4,5) och 1280/36 mikrogram (8 aktivering av 160/4,5), till patienter med KOL. Totalt 1920/54 mikrogram (12 aktiveringar av SYMBICORT 160/4,5) administrerades som engångsdos till både friska försökspersoner och patienter med astma. I en långsiktig aktiv-kontrollerad säkerhetsstudie på ungdomar och vuxna astmapatienter 12 år och äldre, administrerades SYMBICORT 160/4,5 i upp till 12 månader i doser upp till två gånger den högsta rekommenderade dagliga dosen. Det observerades inga kliniskt signifikanta biverkningar i någon av dessa studier.
Budesonid
Risken för akuta toxiska effekter efter överdosering av budesonid är låg. Om det används i för höga doser under längre perioder kan systemiska kortikosteroideffekter såsom hyperkorticism uppträda [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Budesonid vid fem gånger den högsta rekommenderade dosen (3200 mcg dagligen) administrerad till människor under 6 veckor orsakade en signifikant minskning (27 %) av plasmakortisolsvaret på en 6-timmars infusion av ACTH jämfört med placebo (+1 %). Motsvarande effekt av 10 mg prednison dagligen var en 35 % minskning av plasmakortisolsvaret på ACTH.
Formoterol
En överdos av formoterol skulle sannolikt leda till en överdrift av effekter som är typiska för beta2agonister: kramper, angina, högt blodtryck, hypotoni, takykardi, förmaks- och ventrikulära takyarytmier, nervositet, huvudvärk, tremor, hjärtklappning, muskelkramper, illamående, yrsel, yrsel. , metabolisk acidos, hyperglykemi, hypokalemi. Som med alla sympatomimetiska läkemedel kan hjärtstillestånd och till och med dödsfall vara förknippat med missbruk av formoterol. Inga kliniskt signifikanta biverkningar sågs när formoterol gavs till vuxna patienter med akut bronkokonstriktion i en dos på 90 mikrogram/dag under 3 timmar eller till stabila astmatiker 3 gånger om dagen med en total dos på 54 mikrogram/dag under 3 dagar.
Behandling av överdosering av formoterol består av utsättande av läkemedlet tillsammans med insättande av lämplig symtomatisk och/eller stödjande behandling. En klok användning av en kardioselektiv beta-receptorblockerare kan övervägas, med tanke på att sådan medicinering kan ge bronkospasm. Det finns inte tillräckligt med bevis för att avgöra om dialys är fördelaktigt för överdosering av formoterol. Hjärtövervakning rekommenderas vid överdosering.
KONTRAINDIKATIONER
Användningen av SYMBICORT är kontraindicerad under följande tillstånd:
- Primärbehandling av status asthmaticus eller andra akuta episoder av astma eller KOL där intensiva åtgärder krävs.
- Överkänslighet mot något av innehållsämnena i SYMBICORT.
KLINISK FARMAKOLOGI
Handlingsmekanism
SYMBICORT
SYMBICORT innehåller både budesonid och formoterol; därför gäller de verkningsmekanismer som beskrivs nedan för de enskilda komponenterna för SYMBICORT. Dessa läkemedel representerar två klasser av läkemedel (en syntetisk kortikosteroid och en långverkande selektiv beta2-adrenoceptoragonist) som har olika effekter på kliniska, fysiologiska och inflammatoriska index för KOL och astma.
Budesonid
Budesonid är en antiinflammatorisk kortikosteroid som uppvisar potent glukokortikoidaktivitet och svag mineralokortikoidaktivitet. I standardmodeller för in vitro och djur, har budesonid ungefär 200 gånger högre affinitet för glukokortikoidreceptorn och en 1000 gånger högre topisk antiinflammatorisk potens än kortisol (råttkrotonolja öronödemanalys). Som ett mått på systemisk aktivitet är budesonid 40 gånger mer potent än kortisol när det administreras subkutant och 25 gånger mer potent när det administreras oralt i råtttymusinvolutionsanalysen.
glukokortikoidreceptoraffinitetsstudier var 22R-formen av budesonid två gånger så aktiv som 22S-epimeren. In vitro-studier visade att de två formerna av budesonid inte omvandlas till varandra.
Inflammation är en viktig komponent i patogenesen av KOL och astma. Kortikosteroider har ett brett utbud av hämmande aktiviteter mot flera celltyper (t.ex. mastceller, eosinofiler, neutrofiler, makrofager och lymfocyter) och mediatorer (t.ex. histamin, eikosanoider, leukotriener och cytokiner) involverade i allergiska och icke-allergiska medierade inflammation. Dessa antiinflammatoriska effekter av kortikosteroider kan bidra till deras effektivitet vid KOL och astma.
Studier på astmatiska patienter har visat ett gynnsamt förhållande mellan topikal antiinflammatorisk aktivitet och systemiska kortikosteroideffekter över ett brett utbud av doser av budesonid. Detta förklaras av en kombination av en relativt hög lokal antiinflammatorisk effekt, omfattande första pass-levernedbrytning av oralt absorberat läkemedel (85%-95%) och den låga styrkan hos bildade metaboliter.
Formoterol
Formoterolfumarat är en långverkande selektiv beta2-adrenerg agonist (beta2-agonist) med en snabbt insättande effekt. Inhalerat formoterolfumarat verkar lokalt i lungan som en bronkodilator. In vitro-studier har visat att formoterol har mer än 200 gånger högre agonistaktivitet vid beta2-receptorer än vid beta1-receptorer. Bindningsselektiviteten in vitro till beta2-över beta1-adrenoceptorer är högre för formoterol än för albuterol (5 gånger), medan salmeterol har en högre (3 gånger) beta2-selektivitetskvot än formoterol.
Även om beta2-receptorer är de dominerande adrenerga receptorerna i bronkial glatt muskulatur och beta1-receptorer är de dominerande receptorerna i hjärtat, finns det också beta2-receptorer i det mänskliga hjärtat som utgör 10 % till 50 % av de totala beta-adrenerga receptorerna. Den exakta funktionen av dessa receptorer har inte fastställts, men de ger upphov till möjligheten att även mycket selektiva beta2-agonister kan ha hjärteffekter.
De farmakologiska effekterna av beta2-adrenoceptoragonistläkemedel, inklusive formoterol, är åtminstone delvis hänförliga till stimulering av intracellulärt adenylcyklas, enzymet som katalyserar omvandlingen av adenosintrifosfat (ATP) till cykliskt-3', 5'-adenosinmonofosfat ( cyklisk AMP). Ökade cykliska AMP-nivåer orsakar avslappning av bronkial glatt muskulatur och hämning av frisättning av mediatorer av omedelbar överkänslighet från celler, särskilt från mastceller.
In vitro-tester visar att formoterol är en hämmare av frisättningen av mastcellsmediatorer, såsom histamin och leukotriener, från den mänskliga lungan. Formoterol hämmar även histamininducerad plasmaalbuminextravasation hos sövda marsvin och hämmar allergeninducerat eosinofilinflöde hos hundar med hyperrespons i luftvägarna. Relevansen av dessa in vitro- och djurfynd för människor är okänd.
Farmakodynamik
Astma
Kardiovaskulära effekter
en endosövergångsstudie med 201 patienter med ihållande astma jämfördes endosbehandlingar på 4,5, 9 och 18 mikrogram formoterol i kombination med 320 mikrogram budesonid tillfört via SYMBICORT med enbart budesonid 320 mikrogram. Dosordnad förbättring av FEV1 visades jämfört med budesonid. EKG och blodprover för glukos och kalium erhölls efter dosering. För SYMBICORT 4,5 mcg observerades små genomsnittliga ökningar av serumglukos och minskningar av serumkalium (+0,44 mmol/L respektive -0,18 mmol/L vid högsta dosen) med ökande doser av formoterol, jämfört med budesonid. I EKG gav SYMBICORT små dosrelaterade medelökningar i hjärtfrekvens (cirka 3 slag/min vid högsta dosen) och QTc-intervall (3-6 msek) jämfört med enbart budesonid. Ingen försöksperson hade ett QT- eller QTc-värde ≥500 msek.
USA utvärderade fem 12-veckors, aktiva och placebokontrollerade studier och en 6-månaders aktivt kontrollerad studie 2976 patienter i åldern 6 år och äldre med astma. Systemiska farmakodynamiska effekter av formoterol (hjärta/pulsfrekvens, blodtryck, QTc-intervall, kalium och glukos) var liknande hos patienter som behandlades med SYMBICORT, jämfört med patienter som behandlades med formoterol torrt inhalationspulver 4,5 mikrogram, 2 inhalationer två gånger dagligen. Ingen patient hade ett QT- eller QTc-värde ≥500 msek under behandlingen.
I tre placebokontrollerade studier på ungdomar och vuxna med astma, 12 år och äldre, hade totalt 1232 patienter (553 patienter i SYMBICORT 160 mg-gruppen) utvärderbar kontinuerlig 24-timmars elektrokardiografisk övervakning. Totalt sett fanns det inga viktiga skillnader i förekomsten av ventrikulär eller supraventrikulär ektopi och inga tecken på ökad risk för kliniskt signifikant dysrytmi i SYMBICORT 160 mg-gruppen jämfört med placebo.
HPA-axeleffekter
Totalt sett observerades inga kliniskt viktiga effekter på HPA-axeln, mätt med 24-timmars kortisol i urinen, för SYMBICORT-behandlade vuxna eller ungdomar vid doser upp till 640/18 mikrogram/dag jämfört med budesonid.
Kronisk obstruktiv lungsjukdom
Kardiovaskulära effekter
I två KOL-lungfunktionsstudier, 6 månader och 12 månader långa inklusive 3668 KOL-patienter, sågs inga kliniskt viktiga skillnader i pulsfrekvens, blodtryck, kalium och glukos mellan SYMBICORT, de individuella komponenterna i SYMBICORT 160 mg och placebo [se Kliniska studier ].
EKG som registrerats vid flera klinikbesök på behandling i båda studierna visade inga kliniskt viktiga skillnader för hjärtfrekvens, PR-intervall, QRS-längd, hjärtfrekvens, tecken på hjärtischemi eller arytmier mellan SYMBICORT 160/4.5 monoprodukterna och placebo, alla administrerade som 2 inhalationer två gånger dagligen. Baserat på EKG upplevde 6 patienter behandlade med SYMBICORT 160/4.5, 6 patienter behandlade med formoterol 4,5 mikrogram och 6 patienter i placebogruppen förmaksflimmer eller fladder som inte fanns vid baslinjen. Det fanns inga fall av icke-uthållig ventrikulär takykardi i grupperna SYMBICORT 160/4,5, formoterol 4,5 mikrogram eller placebo.
den 12-månadersstudien hade 520 patienter utvärderbar kontinuerlig 24-timmars EKG (Holter)-övervakning före den första dosen och efter cirka 1 och 4 månader under behandling. Inga kliniskt viktiga skillnader i ventrikulära eller supraventrikulära arytmier, ventrikulära eller supraventrikulära ektopiska slag eller hjärtfrekvens observerades bland grupperna som behandlades med SYMBICORT 160/4.5, formoterol eller placebo som tagits som 2 inhalationer två gånger dagligen. Baserat på EKG-övervakning (Holter) upplevde en patient på SYMBICORT 160/4,5, inga patienter på formoterol 4,5 mikrogram och tre patienter i placebogruppen förmaksflimmer eller fladder som inte fanns vid baslinjen.
HPA-axeleffekter
24 timmars urinkortisolmätningar samlades in i en poolad undergrupp (n=616) av patienter från två KOL-lungfunktionsstudier. Data indikerade cirka 30 % lägre genomsnittliga 24-timmarsvärden för fritt kortisol från urin efter kronisk administrering (> 6 månader) av SYMBICORT jämfört med placebo. SYMBICORT 4,5 mcg verkade uppvisa jämförbar kortisolsuppression med budesonid 160 mcg ensamt eller samtidigt administrering av budesonid 160 mcg och formoterol 4,5 mcg. För patienter som behandlats med SYMBICORT 160 mg eller placebo i upp till 12 månader var andelen patienter som skiftade från normalt till lågt för denna åtgärd generellt sett jämförbar.
Andra Budesonide-produkter
För att bekräfta att systemisk absorption inte är en signifikant faktor i den kliniska effekten av inhalerad budesonid, utfördes en klinisk studie på patienter med astma som jämförde 400 mikrogram budesonid administrerat via en trycksatt dosinhalator med en rördistans med 1400 mikrogram oral budesonid och placebo . Studien visade effekten av inhalerad budesonid men inte oralt intagen budesonid, trots jämförbara systemiska nivåer. Sålunda förklaras den terapeutiska effekten av konventionella doser av oralt inhalerad budesonid till stor del av dess direkta verkan på luftvägarna.
Inhalerad budesonid har visat sig minska luftvägsreaktiviteten till olika utmaningsmodeller, inklusive histamin, metakolin, natriummetabisulfit och adenosinmonofosfat hos patienter med hyperreaktiva luftvägar. Den kliniska relevansen av dessa modeller är inte säker.
Förbehandling med inhalerad budesonid, 1600 mcg dagligen (800 mcg två gånger dagligen) under 2 veckor minskade den akuta (tidigfasreaktionen) och fördröjda (sen-fasreaktionen) minskningen av FEV1 efter inhalerad allergenutmaning.
De systemiska effekterna av inhalerade kortikosteroider är relaterade till den systemiska exponeringen för sådana läkemedel. Farmakokinetiska studier har visat att hos både vuxna och barn med astma är den systemiska exponeringen för budesonid lägre med SYMBICORT 160 mg jämfört med inhalerad budesonid administrerad i samma tillförda dos via en torrpulverinhalator [se KLINISK FARMAKOLOGI ]. Därför skulle de systemiska effekterna (HPA-axeln och tillväxt) av budesonid som levereras från SYMBICORT förväntas inte vara större än vad som rapporteras för inhalerad budesonid när det administreras i jämförbara doser via torrpulverinhalatorn [se Användning i specifika populationer ].
HPA-axeleffekter
Effekterna av inhalerad budesonid administrerad via en torrpulverinhalator på HPA-axeln studerades hos 905 vuxna och 404 pediatriska patienter med astma. För de flesta patienter förblev förmågan att öka kortisolproduktionen som svar på stress, bedömd med cosyntropin (ACTH) stimuleringstest, intakt med budesonidbehandling vid rekommenderade doser. För vuxna patienter som behandlats med 100, 200, 400 eller 800 mcg två gånger dagligen under 12 veckor hade 4 %, 2 %, 6 % respektive 13 % ett onormalt stimulerat kortisolsvar (toppkortisol
Andra formoterolprodukter
Medan den farmakodynamiska effekten sker via stimulering av beta-adrenerga receptorer, leder överdriven aktivering av dessa receptorer vanligen till skelettmuskeltremor och kramper, sömnlöshet, takykardi, minskningar av plasmakalium och ökningar av plasmaglukos. Inhalerad formoterol kan, liksom andra beta2-adrenerga agonistläkemedel, ge dosrelaterade kardiovaskulära effekter och effekter på blodsocker och/eller serumkalium [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. För SYMBICORT 160 mg beskrivs dessa effekter i avsnittet Klinisk farmakologi, farmakodynamik, SYMBICORT (12.2).
Användning av LABA-läkemedel kan resultera i tolerans mot bronkoskyddande och bronkdilaterande effekter.
Rebound bronkial hyperresponsivitet efter upphörande av kronisk långverkande beta-agonistbehandling har inte observerats.
Farmakokinetik
SYMBICORT
Absorption
Budesonid
Friska ämnen
Oralt inhalerad budesonid absorberas snabbt i lungorna och maximal koncentration uppnås vanligtvis inom 20 minuter. Efter oral administrering av budesonid uppnåddes maximal plasmakoncentration inom cirka 1 till 2 timmar och den absoluta systemiska tillgängligheten var 6%-13% på grund av omfattande första passage-metabolism. Däremot absorberades det mesta av budesoniden som levererades till lungorna systemiskt. Hos friska försökspersoner deponerades 34 % av den uppmätta dosen i lungan (bedömd med plasmakoncentrationsmetoden och med en budesonid-innehållande torrpulverinhalator) med en absolut systemisk tillgänglighet på 39 % av den uppmätta dosen.
Efter administrering av SYMBICORT 160/4.5, två eller fyra inhalationer två gånger dagligen i 5 dagar hos friska försökspersoner, ökade plasmakoncentrationen av budesonid i allmänhet i proportion till dosen. Ackumuleringsindex för gruppen som fick 2 inhalationer två gånger dagligen var 1,32 för budesonid.
Astmapatienter
en endosstudie gavs högre än rekommenderade doser av SYMBICORT (12 inhalationer av SYMBICORT 160/4,5) till patienter med måttlig astma. Maximal plasmakoncentration av budesonid på 4,5 nmol/L inträffade 20 minuter efter dosering. Denna studie visade att den totala systemiska exponeringen för budesonid från SYMBICORT 4,5 mcg var cirka 30 % lägre än från inhalerad budesonid via en torrpulverinhalator (DPI) vid samma tillförda dos. Efter administrering av SYMBICORT var halveringstiden för budesonidkomponenten 4,7 timmar.
en upprepad dosstudie gavs den högsta rekommenderade dosen av SYMBICORT (160/4,5, två inhalationer två gånger dagligen) till patienter med måttlig astma och friska försökspersoner under 1 vecka. Maximal plasmakoncentration av budesonid på 1,2 nmol/L inträffade efter 21 minuter hos astmapatienter. Den maximala plasmakoncentrationen av budesonid var 27 % lägre hos astmapatienter jämfört med hos friska försökspersoner. Den totala systemiska exponeringen av budesonid var dock jämförbar med den hos astmapatienter.
Maximala steady-state plasmakoncentrationer av budesonid administrerat av DPI hos vuxna med astma var i genomsnitt 0,6 och 1,6 nmol/L vid doser på 180 mcg respektive 360 mcg två gånger dagligen. Hos astmatiska patienter visade budesonid en linjär ökning av AUC och Cmax med ökande dos efter både engångsdosering och upprepad dosering av inhalerad budesonid.
KOL-patienter
en enkeldosstudie administrerades 12 inhalationer av SYMBICORT 80/4,5 (total dos 960/54 mikrogram) till patienter med KOL. Den genomsnittliga maximala plasmakoncentrationen för budesonid på 3,3 nmol/L inträffade 30 minuter efter dosering. Systemisk exponering för budesonid var jämförbar mellan SYMBICORT pMDI och samtidig administrering av budesonid via en dosinhalator och formoterol via en torrpulverinhalator (budesonid 960 mcg och formoterol 54 mcg). I samma studie fick en öppen grupp av patienter med måttlig astma också samma högre dos av SYMBICORT. För budesonid uppvisade KOL-patienter 12 % högre AUC och 10 % lägre Cmax jämfört med astmapatienter.
den 6-månaders pivotala kliniska lungfunktionsstudien erhölls farmakokinetiska data vid steady-state för budesonid i en undergrupp av KOL-patienter med behandlingsarmar av SYMBICORT 4,5 mcg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5 mg, budesonid 160 mcg, budeson 160 mcg och formoterol 4,5 mcg ges tillsammans, alla administrerade som 2 inhalationer två gånger dagligen. Systemisk exponering för budesonid (AUC och Cmax) ökade proportionellt med doser från 80 mcg till 160 mcg och var generellt likartad mellan de 3 behandlingsgrupperna som fick samma dos budesonid (SYMBICORT 4,5 mcg pMDI 160/4,5, budesonid 160 mcg och 16 mcg budesonid formoterol 4,5 mcg administrerat tillsammans).
Formoterol
Inhalerad formoterol absorberas snabbt; maximala plasmakoncentrationer uppnås vanligtvis vid den första plasmaprovtagningstiden, inom 5-10 minuter efter dosering. Som med många läkemedel för oral inhalation är det troligt att majoriteten av den inhalerade formoterolen som levereras sväljs och absorberas sedan från mag-tarmkanalen.
Friska ämnen
Efter administrering av SYMBICORT (160/4,5, två eller fyra inhalationer två gånger dagligen) i 5 dagar till friska försökspersoner ökade plasmakoncentrationen av formoterol i allmänhet i proportion till dosen. Ackumuleringsindex för gruppen som fick 2 inhalationer två gånger dagligen var 1,77 för formoterol.
Astmapatienter
I en endosstudie gavs högre än rekommenderade doser av SYMBICORT (12 inhalationer av SYMBICORT 160/4,5) till patienter med måttlig astma. Maximal plasmakoncentration för formoterol på 136 pmol inträffade 10 minuter efter dosering. Ungefär 8 % av den tillförda dosen av formoterol återfanns i urinen som oförändrat läkemedel.
en upprepad dosstudie gavs den högsta rekommenderade dosen av SYMBICORT (160/4,5, två inhalationer två gånger dagligen) till patienter med måttlig astma och friska försökspersoner under 1 vecka. Maximal plasmakoncentration av formoterol på 28 pmol/L inträffade efter 10 minuter hos astmapatienter. Den maximala plasmakoncentrationen av formoterol var cirka 42 % lägre hos astmapatienter jämfört med den hos friska försökspersoner. Den totala systemiska exponeringen av formoterol var dock jämförbar med den hos astmapatienter.
KOL-patienter
Efter administrering av engångsdos av 12 inhalationer av SYMBICORT 80/4.5 uppnåddes snabbt en genomsnittlig maximal plasmakoncentration av formoterol på 167 pmol/L 15 minuter efter dosering. Formoterolexponeringen var något större (~16-18 %) från SYMBICORT 160 mg pMDI jämfört med samtidig administrering av budesonid via en inhalator med uppmätta doser och formoterol via en torrpulverinhalator (total dos av budesonid 960 mcg och formoterol 54 mcg). I samma studie fick en öppen grupp av patienter med måttlig astma samma dos av SYMBICORT. KOL-patienter uppvisade 12-15 % högre AUC och Cmax för formoterol jämfört med astmapatienter.
den 6-månaders pivotala kliniska lungfunktionsstudien erhölls farmakokinetiska data vid steady-state för formoterol i en undergrupp av KOL-patienter med behandlingsgrupper av SYMBICORT 160 mg pMDI 160/4,5, SYMBICORT 160 mg pMDI 80/4,5, för. mcg och formoterol 4,5 mcg ges tillsammans, alla administrerade som 2 inhalationer två gånger dagligen. Den systemiska exponeringen av formoterol, som framgår av AUC, var cirka 30 % och 16 % högre från SYMBICORT pMDI jämfört med enbart formoterol behandlingsarm och samtidig administrering av enskilda komponenter av budesonid respektive formoterol behandlingsarm.
Distribution
Budesonid
Distributionsvolymen för budesonid var cirka 3 L/kg. Det var 85 %-90 % bundet till plasmaproteiner. Proteinbindningen var konstant över koncentrationsintervallet (1-100 nmol/L) som uppnåddes med och översteg rekommenderade inhalerade doser. Budesonid visade liten eller ingen bindning till kortikosteroidbindande globulin. Budesonid kom snabbt i jämvikt med röda blodkroppar på ett koncentrationsoberoende sätt med ett blodplasmaförhållande på cirka 0,8.
Formoterol
Över koncentrationsintervallet 10-500 nmol/L var plasmaproteinbindningen för RR- och SS-enantiomererna av formoterol 46 % respektive 58 %. Koncentrationerna av formoterol som användes för att bedöma plasmaproteinbindningen var högre än de som uppnåddes i plasma efter inhalation av en engångsdos på 54 mikrogram.
Ämnesomsättning
Budesonid
In vitro-studier med humana leverhomogenat har visat att budesonid metaboliserades snabbt och omfattande. Två huvudmetaboliter bildade via cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4) katalyserad biotransformation har isolerats och identifierats som 16α-hydroxiprednisolon och 6ß-hydroxibudesonid. Kortikosteroidaktiviteten för var och en av dessa två metaboliter var mindre än 1 % av modersubstansens. Inga kvalitativa skillnader mellan in vitro och in vivo metaboliska mönster upptäcktes. Försumbar metabolisk inaktivering observerades i humana lung- och serumberedningar.
Formoterol
Den primära metabolismen av formoterol sker genom direkt glukuronidering och genom O-demetylering följt av konjugering till inaktiva metaboliter. Sekundära metaboliska vägar inkluderar deformylering och sulfatkonjugering. CYP2D6 och CYP2C har identifierats som primärt ansvariga för Odemetylering.
Eliminering
Budesonid
Budesonid utsöndrades i urin och avföring i form av metaboliter. Ungefär 60 % av en intravenöst radiomärkt dos återfanns i urinen.
Ingen oförändrad budesonid upptäcktes i urinen. 22R-formen av budesonid eliminerades företrädesvis av levern med systemisk clearance på 1,4 l/min mot 1,0 l/min för 22S-formen. Den terminala halveringstiden, 2 till 3 timmar, var densamma för båda epimererna och var oberoende av dos.
Formoterol
Utsöndringen av formoterol studerades hos fyra friska försökspersoner efter samtidig administrering av radiomärkt formoterol oralt och intravenöst. I den studien utsöndrades 62 % av det radiomärkta formoterolet i urinen medan 24 % eliminerades i avföringen.
Särskilda populationer
Geriatrisk
Farmakokinetiken för SYMBICORT 4,5 mcg hos geriatriska patienter har inte studerats specifikt.
Pediatrisk
Plasmakoncentrationer av budesonid mättes efter administrering av fyra inhalationer av SYMBICORT 160/4,5 i en endosstudie på pediatriska patienter med astma, 6 till yngre än 12 år. Toppkoncentrationer av budesonid på 1,4 nmol/L inträffade 20 minuter efter dosering. Denna studie visade också att den totala systemiska exponeringen för budesonid från SYMBICORT 4,5 mcg var cirka 30 % lägre än från inhalerad budesonid via en torrpulverinhalator som också utvärderades vid samma tillförda dos. Den dosnormaliserade Cmax och AUC0-inf för budesonid efter engångsinhalation hos barn 6 till under 12 år var numeriskt lägre än vad som observerats hos vuxna.
Efter 2 inhalationer av SYMBICORT 160/4,5 behandling två gånger dagligen var formoterol Cmax och AUC0-6 vid steady state hos barn 6 till under 12 år jämförbara med det som observerats hos vuxna.
Kön/ras
Specifika studier för att undersöka effekterna av kön och ras på farmakokinetiken för SYMBICORT har inte utförts. Populations-PK-analys av SYMBICORT 4,5 mcg-data indikerar att kön inte påverkar farmakokinetiken för budesonid och formoterol. Inga slutsatser kan dras om effekten av ras på grund av det låga antalet icke-kaukasier som utvärderats för PK.
Ammande mödrar
Fördelningen av budesonid vid inhalation från en torrpulverinhalator i doser på 200 eller 400 mikrogram två gånger dagligen under minst 3 månader studerades hos åtta ammande kvinnor med astma från 1 till 6 månader efter förlossningen. Systemisk exponering för budesonid hos dessa kvinnor verkar vara jämförbar med den hos icke-ammande kvinnor med astma från andra studier. Bröstmjölk erhållen under åtta timmar efter dosering avslöjade att den maximala koncentrationen av budesonid för de totala dagliga doserna på 400 och 800 mikrogram var 0,39 respektive 0,78 nmol/L och inträffade inom 45 minuter efter dosering. Den uppskattade orala dagliga dosen budesonid från bröstmjölk till spädbarnet är cirka 0,007 och 0,014 mikrogram/kg/dag för de två dosregimer som används i denna studie, vilket motsvarar cirka 0,3 % till 1 % av dosen som inhaleras av modern. Budesonidnivåer i plasmaprover från fem spädbarn cirka 90 minuter efter amning (och cirka 140 minuter efter läkemedelsadministrering till mamman) var under kvantifierbara nivåer ( Användning i specifika populationer ].
Njur- eller leverinsufficiens
Det finns inga data om den specifika användningen av SYMBICORT hos patienter med nedsatt lever- eller njurfunktion. Nedsatt leverfunktion kan påverka elimineringen av kortikosteroider. Budesonids farmakokinetik påverkades av nedsatt leverfunktion, vilket framgår av en fördubblad systemisk tillgänglighet efter oralt intag. Den intravenösa farmakokinetiken för budesonid var dock likartad hos cirrotiska patienter och hos friska försökspersoner. Specifika data för formoterol är inte tillgängliga, men eftersom formoterol primärt elimineras via levermetabolism kan en ökad exponering förväntas hos patienter med gravt nedsatt leverfunktion.
Läkemedelsinteraktioner
En endosöverkorsningsstudie genomfördes för att jämföra farmakokinetiken för åtta inhalationer av följande: budesonid, formoterol och budesonid plus formoterol administrerade samtidigt. Resultaten av studien visade att det inte fanns några bevis för en farmakokinetisk interaktion mellan de två komponenterna i SYMBICORT.
Hämmare av cytokrom P450 enzymer
Ketokonazol
Ketokonazol, en stark hämmare av cytokrom P450 (CYP) isoenzym 3A4 (CYP3A4), det huvudsakliga metaboliska enzymet för kortikosteroider, ökade plasmanivåerna av oralt intaget budesonid.
Cimetidin
Vid rekommenderade doser hade cimetidin, en ospecifik hämmare av CYP-enzymer, en liten men kliniskt obetydlig effekt på farmakokinetiken för oral budesonid.
Specifika läkemedelsinteraktionsstudier med formoterol har inte utförts.
Djurtoxikologi och/eller farmakologi
Preklinisk
Studier på laboratoriedjur (minigrisar, gnagare och hundar) har visat förekomsten av hjärtarytmier och plötslig död (med histologiska tecken på myokardnekros) när beta-agonister och metylxantiner administreras samtidigt. Den kliniska betydelsen av dessa fynd är okänd.
Kliniska studier
Astma
Patienter med astma 12 år och äldre
två kliniska studier som jämförde SYMBICORT 4,5 mikrogram med de individuella komponenterna, var förbättringar av de flesta effektmåtten större med SYMBICORT än med användning av antingen budesonid eller enbart formoterol. Dessutom visade en klinisk studie liknande resultat mellan SYMBICORT och samtidig användning av budesonid och formoterol i motsvarande doser från separata inhalatorer.
Säkerheten och effekten av SYMBICORT 160 mg visades i två randomiserade, dubbelblinda, placebokontrollerade kliniska studier i USA med 1076 patienter från 12 år och äldre. Fasta SYMBICORT-doser på 160/9 mcg och 320/9 mcg två gånger dagligen (varje dos administrerad som 2 inhalationer av styrkorna 80/4,5 respektive 160/4,5 mcg) jämfördes med monokomponenterna (budesonid och formoterol) och placebototo. ge information om lämplig dosering för att täcka olika svårighetsgrad av astma.
Studie 1: Klinisk studie med SYMBICORT 160/4.5
Denna 12-veckorsstudie utvärderade 596 patienter 12 år och äldre genom att jämföra SYMBICORT 160/4,5, den fria kombinationen av budesonid 160 mcg plus formoterol 4,5 mcg i separata inhalatorer, budesonid 160 mcg, formoterol 4,5 mcg och placebo; var och en administrerad som 2 inhalationer två gånger dagligen. Studien inkluderade en 2-veckors inkörningsperiod med budesonid 80 mcg, 2 inhalationer två gånger dagligen. De flesta patienter hade måttlig till svår astma och använde måttliga till höga doser av inhalerade kortikosteroider innan studiestarten. Randomisering stratifierades av tidigare inhalerad kortikosteroidbehandling (71,6 % på måttlig och 28,4 % på högdos inhalerad kortikosteroid). Den genomsnittliga procentandelen förutspådde FEV1 vid baslinjen var 68,1 % och var likartad mellan behandlingsgrupperna. De co-primära effektslutpunkterna var 12-timmars i genomsnitt FEV1 efter dos vid vecka 2, och medelvärdet av FEV1 före dos under studiens gång. Studien krävde också att patienter som uppfyllde ett fördefinierat kriterium för astmaförvärring dras tillbaka. De fördefinierade kriterierna för försämring av astma var en kliniskt viktig minskning av FEV1 eller PEF, ökad användning av räddningsalbuterol, uppvaknande nattetid på grund av astma, akut intervention eller sjukhusvistelse på grund av astma, eller krav på astmamedicin som inte tillåts enligt protokollet. För kriteriet nattuppvaknande på grund av astma tilläts patienter att stanna kvar i studien efter utredarens gottfinnande om inget av de andra astmaförvärrande kriterierna uppfylldes. Andelen patienter som drar tillbaka på grund av eller uppfyller fördefinierade kriterier för förvärrad astma visas i tabell 4.
Genomsnittlig procentuell förändring från baslinjen i FEV1 mätt omedelbart före dosering (fördos) under 12 veckor visas i figur 1. Eftersom denna studie använde fördefinierade utsättningskriterier för förvärrad astma, vilket orsakade en differentiell utsättningsfrekvens i behandlingsgrupperna, pre- dos FEV1-resultat vid det senaste tillgängliga studiebesöket (slut på behandlingen, EOT) tillhandahålls också. Patienter som fick SYMBICORT 160/4,5 hade signifikant större genomsnittliga förbättringar från baslinjen i FEV1 före dos vid slutet av behandlingen (0,19 l, 9,4 %), jämfört med budesonid 160 mcg (0,10 l, 4,9 %), formoterol 4,5 mcg (-0,12 %). L, -4,8%) och placebo (-0,17 L, -6,9%).
Figur 1: Genomsnittlig procentuell förändring från baslinjen i FEV1 före dos under 12 veckor (studie 1)
PATIENTINFORMATION
SYMBICORT (SIM-bi-kort) (budesonid 80 mcg och formoterolfumaratdihydrat 4,5 mcg) Inandningsaerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg och formoterolfumaratdihydrat 4,5 mcg) Inandningsaerosol
Vad är SYMBICORT?
SYMBICORT kombinerar ett inhalerat kortikosteroidläkemedel (ICS), budesonid och en långverkande beta2-adrenerg agonist (LABA), formoterol.
- Inhalerade kortikosteroider hjälper till att minska inflammation i lungorna. Inflammation i lungorna kan leda till andningsproblem.
- LABA-läkemedel används till personer med kronisk obstruktiv lungsjukdom (KOL) och astma. LABA-läkemedel hjälper musklerna runt luftvägarna i dina lungor att hålla sig avslappnade för att förhindra symtom som väsande andning, hosta, tryck över bröstet och andnöd. Dessa symtom kan uppstå när musklerna runt luftvägarna stramar. Detta gör det svårt att andas. I svåra fall kan väsande andning stoppa din andning och kan leda till döden om den inte behandlas omedelbart.
SYMBICORT 4,5 mcg används inte för att lindra plötsliga andningsproblem och kommer inte att ersätta en räddningsinhalator. SYMBICORT används för astma och KOL enligt följande:
- Astma: SYMBICORT används för att kontrollera symtom på astma och förebygga symtom som väsande andning hos vuxna och barn från 6 år och äldre. SYMBICORT 4,5 mcg innehåller formoterol. LABA-läkemedel som formoterol när de används ensamma ökar risken för dödsfall och sjukhusinläggningar av astmaproblem. SYMBICORT innehåller en ICS och en LABA. När en ICS och LABA används tillsammans finns det ingen signifikant ökad risk vid sjukhusinläggningar och dödsfall i astmaproblem. SYMBICORT 160mg är inte för vuxna och barn med astma som är välkontrollerade med ett astmakontrollerande läkemedel, såsom en låg till medelhög dos av en ICS. SYMBICORT 160mg är för vuxna och barn med astma som behöver både ett ICS- och LABA-läkemedel. Det är inte känt om SYMBICORT är säkert och effektivt för barn under 6 år med astma.
- KOL: KOL är en långvarig (kronisk) lungsjukdom som inkluderar kronisk bronkit, emfysem eller båda. SYMBICORT 160/4,5 mcg används under lång tid, som 2 inhalationer 2 gånger varje dag, för att förbättra symtomen på KOL för bättre andning och för att minska antalet uppblossningar (förvärringen av dina KOL-symtom under flera dagar).
Använd inte SYMBICORT:
- för att behandla plötsliga svåra symtom på astma eller KOL.
- om du är allergisk mot något av innehållsämnena i SYMBICORT. Se slutet av denna bipacksedel för en lista över ingredienser i SYMBICORT.
Innan du använder SYMBICORT, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har hjärtproblem.
- har högt blodtryck.
- har anfall.
- har problem med sköldkörteln.
- har diabetes.
- har leverproblem.
- har osteoporos.
- har problem med immunförsvaret.
- har ögonproblem som ökat tryck i ögat, glaukom eller grå starr.
- är allergiska mot något läkemedel.
- har någon typ av virus-, bakterie-, svamp- eller parasitinfektion.
- utsätts för vattkoppor eller mässling.
- är gravid eller planerar att bli gravid. Det är inte känt om SYMBICORT 4,5 mcg kan skada ditt ofödda barn.
- ammar. Budesonid, en av de aktiva ingredienserna i SYMBICORT, går över i bröstmjölk. Du och din vårdgivare bör bestämma om du ska ta SYMBICORT 160mg medan du ammar.
Berätta för din vårdgivare om alla läkemedel du tar inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. SYMBICORT och vissa andra läkemedel kan interagera med varandra. Detta kan orsaka allvarliga biverkningar. Berätta särskilt för din vårdgivare om du tar antimykotika eller anti-HIV-läkemedel.
Känn till alla mediciner du tar. Håll en lista och visa den för din vårdgivare och apotekspersonal varje gång du får ett nytt läkemedel.
Hur ska jag använda SYMBICORT?
Se steg-för-steg-instruktionerna för användning av SYMBICORT i slutet av denna patientinformation. Använd inte SYMBICORT 4,5 mcg om inte din vårdgivare har lärt dig och du förstår allt. Fråga din vårdgivare eller apotekspersonal om du har några frågor.
- Använd SYMBICORT exakt enligt anvisningarna. Använd inte SYMBICORT 160mg oftare än föreskrivet. SYMBICORT finns i 2 styrkor. Din vårdgivare har ordinerat den styrka som är bäst för dig. Observera skillnaderna mellan SYMBICORT och dina andra inhalationsläkemedel, inklusive skillnaderna i ordinerad användning och fysiskt utseende.
- Barn ska använda SYMBICORT med hjälp av en vuxen, enligt instruktioner från barnets vårdgivare.
- SYMBICORT 160mg ska tas varje dag som 2 bloss på morgonen och 2 bloss på kvällen med cirka 12 timmars mellanrum.
- Om du missar en dos av SYMBICORT 160 mg ska du ta din nästa dos vid samma tidpunkt som du brukar.
- Skölj munnen med vatten och spotta ut vattnet efter varje dos (2 bloss) av SYMBICORT. Svälj inte vattnet. Detta kommer att bidra till att minska risken för att få en svampinfektion (trast) i mun och svalg.
- Om du tar för mycket SYMBICORT, ring din vårdgivare eller gå till närmaste akutmottagning omedelbart om du har några ovanliga symtom, såsom förvärrad andnöd, bröstsmärtor, ökad hjärtfrekvens eller skakighet.
- Spraya inte SYMBICORT 4,5mcg i dina ögon. Om du av misstag får SYMBICORT 160mg i ögonen, skölj ögonen med vatten och om rodnad eller irritation kvarstår, kontakta din läkare.
- Ändra eller sluta inte med några läkemedel som används för att kontrollera eller behandla dina andningsproblem. Din vårdgivare kommer att ändra dina mediciner vid behov.
- Medan du använder SYMBICORT 2 gånger varje dag, använd inte andra läkemedel som innehåller en LABA av någon anledning. Fråga din vårdgivare eller apotekspersonal om något av dina andra läkemedel är LABA-läkemedel.
- SYMBICORT 4,5 mcg lindrar inte plötsliga symtom. Ha alltid en räddningsinhalator med dig för att behandla plötsliga symtom. Om du inte har en räddningsinhalator, ring din vårdgivare för att få en ordinerad åt dig.
- Ring din vårdgivare eller få medicinsk vård omedelbart om:
- dina andningsproblem förvärras med SYMBICORT.
- du behöver använda din räddningsinhalator oftare än vanligt.
- din räddningsinhalator fungerar inte lika bra för dig när det gäller att lindra symtomen.
- dina toppflödesmätares resultat minskar. Din vårdgivare kommer att berätta vilka siffror som är rätt för dig.
- dina symtom förbättras inte efter att ha använt SYMBICORT 160mg regelbundet i 1 vecka.
Vilka är de möjliga biverkningarna av SYMBICORT?
SYMBICORT 4,5 mcg kan orsaka allvarliga biverkningar, inklusive:
- Att använda för mycket av ett LABA-läkemedel kan orsaka:
- bröstsmärta
- ökat blodtryck
- snabba och oregelbundna hjärtslag
- huvudvärk
- darrning
- nervositet
- Svampinfektion i munnen eller svalget (trast). Skölj munnen med vatten utan att svälja efter att du har använt SYMBICORT 4,5 mcg för att minska risken att få trast.
- Lunginflammation och andra nedre luftvägsinfektioner. Personer med KOL har större chans att få lunginflammation och andra lunginfektioner. Inhalerade kortikosteroider kan öka risken för att få lunginflammation. Ring din vårdgivare om du märker något av dessa symtom:
- ökad slemproduktion (sputum).
- förändring i slemfärg
- feber
- frossa
- ökad hosta
- ökade andningsproblem
- Immunsystemets effekter och en högre risk för infektioner. Berätta för din vårdgivare om eventuella tecken på infektion som:
- feber
- smärta
- kroppssmärtor
- frossa
- känner mig trött
- illamående
- kräkningar
- Adrenal insufficiens. Binjureinsufficiens är ett tillstånd där binjurarna inte producerar tillräckligt med steroidhormoner. Detta kan hända när du slutar ta orala kortikosteroidläkemedel och börjar med inhalerad kortikosteroidmedicin.
- Ökad väsande andning direkt efter att ha tagit SYMBICORT. Ha alltid en räddningsinhalator med dig för att behandla plötslig väsande andning.
- Allvarliga allergiska reaktioner inklusive utslag, nässelfeber, svullnad av ansikte, mun och tunga och andningsproblem. Ring din vårdgivare eller få akut sjukvård om du får några symtom på en allvarlig allergisk reaktion.
- Lägre benmineraltäthet. Detta kan hända hos personer som har en stor chans för låg bentäthet (benskörhet). Din vårdgivare bör kontrollera dig för detta under behandling med SYMBICORT.
- Långsam tillväxt hos barn. Ett barns tillväxt bör kontrolleras regelbundet när du använder SYMBICORT.
- Ögonproblem inklusive glaukom och grå starr. Du bör göra regelbundna ögonundersökningar när du använder SYMBICORT.
- Svullnad av dina blodkärl. Detta kan hända hos personer med astma. Berätta genast för din vårdgivare om du har:
- en känsla av nålar eller
- influensaliknande symtom domningar i armar eller ben
- smärta och svullnad i bihålorna
- utslag
- Minskad kaliumnivåer i blodet (hypokalemi).
- Ökade blodsockernivåer (hyperglykemi).
De vanligaste biverkningarna av SYMBICORT inkluderar:
Personer med astma:
- irritation i halsen
- huvudvärk
- övre luftvägsinfektion
- halsont
- inflammation i slemhinnor i bihålorna
- influensa (bihåleinflammation)
- nästäppa
- ryggont
- kräkningar
- magbesvär
- trast i mun och svalg. Skölj munnen med vatten utan att svälja efter användning för att förhindra trast
Personer med KOL:
- irritation i halsen.
- trast i mun och svalg. Skölj munnen med vatten utan att svälja efter användning för att förhindra trast.
- infektion och inflammation i luftrörens slemhinnor (bronkit).
- inflammation i slemhinnor i bihålorna (bihåleinflammation).
- övre luftvägsinfektion.
Berätta för din vårdgivare om eventuella biverkningar som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av SYMBICORT.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Du kan också rapportera biverkningar till AstraZeneca på 1-800-236-9933.
Hur ska jag förvara SYMBICORT?
- Förvara SYMBICORT i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
- Förvara SYMBICORT med munstycket nedåt.
- Innehållet i din SYMBICORT-behållare är under tryck. Punktera eller kasta inte behållaren i en eld eller förbränningsugn. Använd eller förvara den inte nära värme eller öppen låga. Förvaring över 120°F kan göra att behållaren spricker.
- Kasta SYMBICORT 160mg när räknaren når noll (“0”) eller 3 månader efter att du tagit SYMBICORT ur foliepåsen, beroende på vad som kommer först.
- Förvara SYMBICORT 4,5 mcg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av SYMBICORT.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte SYMBICORT 4,5 mcg för ett tillstånd som det inte ordinerats för. Ge inte SYMBICORT till andra personer, även om de har samma symtom som du. Det kan skada dem.
Du kan fråga din vårdgivare eller apotekspersonal om information om SYMBICORT 4,5mcg som är skriven för vårdpersonal.
Vilka är ingredienserna i SYMBICORT 4,5mcg?
Aktiva ingredienser: mikroniserad budesonid och mikroniserad formoterolfumaratdihydrat
Inaktiva ingredienser: hydrofluoralkan (HFA 227), povidon K25 USP och polyetylenglykol 1000 NF
Användningsinstruktioner
SYMBICORT (SIM-bi-kort)(budesonid 80 mcg och formoterolfumaratdihydrat 4,5 mcg) Inandningsaerosol
SYMBICORT (SIM-bi-kort) (budesonid 160 mcg och formoterolfumaratdihydrat 4,5 mcg) Inandningsaerosol
Figur 1  Upprätt position
Upprätt position
Hur man använder SYMBICORT
Följ instruktionerna nedan för att använda SYMBICORT. Du kommer att andas in (andas in) läkemedlet. Om du har några frågor, fråga din läkare eller apotekspersonal.
Förbereda din SYMBICORT-inhalator för användning
figur 2 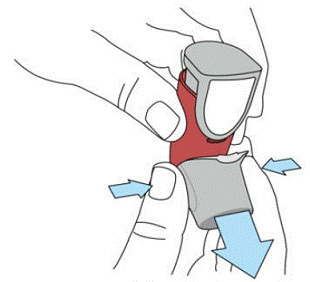
5. Förbered din SYMBICORT-inhalator
Innan du använder SYMBICORT för första gången måste du förbereda den. För att förbereda SYMBICORT 160mg, håll den i upprätt läge. Se figur 1. Skaka SYMBICORT 4,5 mcg inhalatorn väl i 5 sekunder. Håll din SYMBICORT 160mg inhalator vänd bort från dig och tryck ned ordentligt och helt på toppen av disken på SYMBICORT 160mg inhalatorn för att frigöra en testspray. Skaka den sedan igen i 5 sekunder och släpp en andra testspray. Din SYMBICORT 160mg inhalator är nu förberedd och klar för användning. Efter att du har förberett SYMBICORT-inhalatorn för första gången kommer räknaren att visa antingen 120 eller 60, beroende på vilken storlek du fick.
Om du inte använder din SYMBICORT-inhalator på mer än 7 dagar eller om du tappar den, måste du förbereda igen.
Sätt att hålla SYMBICORT 160mg inhalatorn för användning
Figur 3 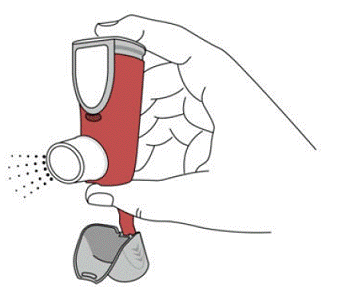
ELLER
Figur 4 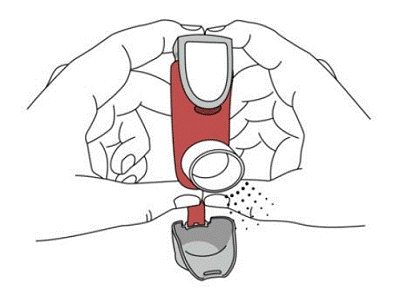
Använda din SYMBICORT-inhalator
6. Skaka din SYMBICORT 160mg inhalator väl i 5 sekunder. Ta bort munstyckets skydd. Kontrollera munstycket för främmande föremål.
7. Andas ut helt (andas ut). Håll SYMBICORT-inhalatorn upp till munnen. Placera det vita munstycket helt i munnen och stäng läpparna runt det. Se till att SYMBICORT 4,5 mcg-inhalatorn står upprätt och att öppningen på munstycket pekar mot baksidan av halsen (se figur 5).
Bild 5 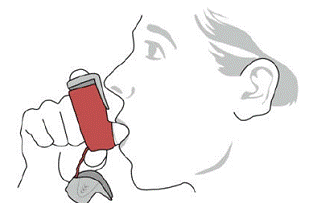
8. Andas in (andas in) djupt och långsamt genom munnen. Tryck ned ordentligt och helt på toppen av disken på SYMBICORT-inhalatorn för att frigöra läkemedlet (se figur 3 och 4).
9. Fortsätt att andas in (andas in) och håll andan i cirka 10 sekunder, eller så länge det är bekvämt. Innan du andas ut (andas ut), släpp fingret från toppen av disken. Håll SYMBICORT-inhalatorn upprätt och ta bort den ur munnen.
10. Skaka SYMBICORT-inhalatorn igen i 5 sekunder och upprepa steg 7 till 9.
Efter att du har använt din SYMBICORT-inhalator
11. Efter användning, stäng munstycket genom att trycka tills det klickar på plats.
12. När du har tagit SYMBICORT (2 bloss), skölj munnen med vatten. Spotta ut vattnet. Svälj den inte.
Läser räknaren
- Pilen på räkneverket på toppen av SYMBICORT-inhalatorn pekar på antalet inhalationer (bloss) som finns kvar i din inhalator.
DISKEN 
- Räknaren kommer att räknas ner varje gång du släpper en bloss med medicin (antingen när du förbereder din SYMBICORT-inhalator eller när du tar medicinen).
- När pilen på disken närmar sig 20, kommer du att märka början av ett gult område som låter dig veta att det är dags att ringa din vårdgivare för påfyllning.
DISKEN 
- Det är viktigt att du uppmärksammar antalet inhalationer (bloss) som finns kvar i din SYMBICORT 160mg-inhalator genom att läsa räkneverket. Kasta SYMBICORT när räknaren visar noll (“0”) eller 3 månader efter att du tagit ut din SYMBICORT 160 mg inhalator ur foliepåsen, beroende på vad som inträffar först. Din SYMBICORT-inhalator kanske inte känns tom och den kan fortsätta att fungera, men du kommer inte att få rätt mängd medicin om du fortsätter att använda den. Använd en ny SYMBICORT-inhalator och följ instruktionerna för priming (se instruktion 5 ovan).
Hur du rengör din SYMBICORT-inhalator
Rengör det vita munstycket på din SYMBICORT 4,5 mcg inhalator var 7:e dag. För att rengöra munstycket:
- Ta bort det grå munstyckets lock
- Torka av insidan och utsidan av den vita munstyckets öppning med en ren, torr trasa
- Sätt tillbaka munstyckets lock
- Lägg inte SYMBICORT-inhalatorn i vatten
- Försök inte att ta isär din SYMBICORT inhalator
Denna patientinformation och bruksanvisning har godkänts av US Food and Drug Administration.
