Behandlingar vid psykiska sjukdomar: Strattera 10mg, 18mg, 25mg, 40mg Atomoxetine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Strattera 40mg och hur används det?
Strattera är ett receptbelagt läkemedel som används för att behandla symtom på uppmärksamhetsbrist/hyperaktivitetsstörning (ADHD). Strattera 18mg kan användas ensamt eller tillsammans med andra läkemedel.
Strattera 10mg är en selektiv noradrenalinåterupptagshämmare.
Det är inte känt om Strattera är säkert och effektivt för barn yngre än 2 år.
Vilka är de möjliga biverkningarna av Strattera?
Strattera 25mg kan orsaka allvarliga biverkningar inklusive:
- bröstsmärta,
- problem att andas,
- yrsel,
- hallucinationer,
- nya beteendeproblem,
- aggression,
- fientlighet,
- paranoia,
- magont,
- klåda,
- influensaliknande symtom,
- mörk urin,
- gulsot (gulning av hud eller ögon),
- smärtsam eller svår urinering, och
- erektion som är smärtsam eller varar längre än 4 timmar
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Strattera 40mg inkluderar:
- illamående,
- kräkningar,
- orolig mage,
- förstoppning,
- torr mun,
- aptitlöshet,
- humörförändringar,
- känner mig trött,
- yrsel,
- urineringsproblem, och
- impotens, problem med erektion,
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Strattera. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
SJÄLVMIDSDAG HOS BARN OCH UNGDOMAR
STRATTERA (atomoxetin) ökade risken för självmordstankar i korttidsstudier på barn eller ungdomar med Attention Deficit/Hyperactivity Disorder (ADHD). Alla som överväger att använda STRATTERA 18 mg till ett barn eller en ungdom måste balansera denna risk med det kliniska behovet. Samsjukligheter som uppstår med ADHD kan vara associerade med en ökad risk för självmordstankar och/eller självmordsbeteende. Patienter som påbörjas med behandling bör övervakas noga med avseende på suicidalitet (suicidalt tänkande och beteende), klinisk försämring eller ovanliga beteendeförändringar. Familjer och vårdgivare bör informeras om behovet av noggrann observation och kommunikation med förskrivaren. STRATTERA 10mg är godkänt för ADHD hos pediatriska och vuxna patienter. STRATTERA 40mg är inte godkänt för egentlig depression. Sammanslagna analyser av korttidsstudier (6 till 18 veckor) placebokontrollerade studier av STRATTERA 10 mg på barn och ungdomar (totalt 12 studier som involverade över 2200 patienter, inklusive 11 studier med ADHD och 1 studie med enures) har visat en större risk av självmordstankar tidigt under behandlingen hos dem som fick STRATTERA jämfört med placebo. Den genomsnittliga risken för självmordstankar hos patienter som fick STRATTERA 25 mg var 0,4 % (5/1357 patienter), jämfört med ingen hos placebobehandlade patienter (851 patienter). Inga självmord inträffade i dessa försök [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
BESKRIVNING
STRATTERA® (atomoxetin) är en selektiv noradrenalinåterupptagshämmare. Atomoxetin-HCl är R(-)-isomeren, bestämd genom röntgendiffraktion. Den kemiska beteckningen är (-)-N-Metyl-3-fenyl-3-(o-tolyloxi)-propylaminhydroklorid. Molekylformeln är C17H21NO•HCl, vilket motsvarar en molekylvikt på 291,82. Den kemiska strukturen är:
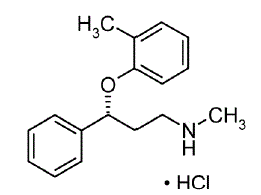
Atomoxetine HCl är ett vitt till praktiskt taget vitt fast ämne, som har en löslighet på 27,8 mg/ml i vatten.
STRATTERA kapslar är endast avsedda för oral administrering.
Varje kapsel innehåller atomoxetin HCl motsvarande 10, 18, 25, 40, 60, 80 eller 100 mg atomoxetin. Kapslarna innehåller även förgelatinerad stärkelse och dimetikon. Kapselskalen innehåller gelatin, natriumlaurylsulfat och andra inaktiva ingredienser. Kapselskalen innehåller också ett eller flera av följande:
FD&C Blue No. 2, syntetisk gul järnoxid, titandioxid, röd järnoxid. Kapslarna är präglade med ätbart svart bläck.
INDIKATIONER
Attention-Deficit/Hyperactivity Disorder (ADHD)
STRATTERA 25 mg är indicerat för behandling av Attention-Deficit/Hyperactivity Disorder (ADHD).
Effekten av STRATTERA kapslar har fastställts i sju kliniska prövningar på öppenvårdspatienter med ADHD: fyra 6 till 9-veckors prövningar på pediatriska patienter (åldrar 6 till 18), två 10-veckors prövningar på vuxna och en underhållsprövning i pediatrik (6 år). till 15) [se Kliniska studier ].
Diagnostiska överväganden
En diagnos av ADHD (DSM-IV) innebär närvaron av hyperaktiva-impulsiva eller ouppmärksamma symtom som orsakar funktionsnedsättning och som var närvarande före 7 års ålder. Symtomen måste vara ihållande, måste vara allvarligare än vad som vanligtvis observeras hos individer på en jämförbar utvecklingsnivå, måste orsaka kliniskt signifikant funktionsnedsättning, t.ex. i social, akademisk eller yrkesmässig funktion, och måste vara närvarande i två eller flera miljöer, t.ex. skolan (eller jobbet) och hemma. Symtomen får inte bättre förklaras av en annan psykisk störning.
Den specifika etiologin för ADHD är okänd och det finns inget enda diagnostiskt test. Adekvat diagnos kräver användning av inte bara medicinska utan också särskilda psykologiska, pedagogiska och sociala resurser. Inlärning kan eller kanske inte försämras. Diagnosen måste baseras på en fullständig historia och utvärdering av patienten och inte enbart på närvaron av det erforderliga antalet DSM-IV-egenskaper.
För den ouppmärksamma typen måste minst 6 av följande symtom ha hållit i sig i minst 6 månader: bristande uppmärksamhet på detaljer/vårdslösa misstag, bristande ihållande uppmärksamhet, dålig lyssnare, underlåtenhet att följa uppgifterna, dålig organisation, undviker uppgifter kräver ihållande mental ansträngning, förlorar saker, lätt distraherad, glömsk. För den hyperaktiva-impulsiva typen måste minst 6 av följande symtom ha pågått i minst 6 månader: ryckande/snurrande, lämnar sätet, olämplig löpning/klättring, svårigheter med tysta aktiviteter, "på språng", överdrivet prat, vapningar svarar, kan inte vänta tur, påträngande. För en kombinerad typdiagnos måste både ouppmärksamma och hyperaktiv-impulsiva kriterier uppfyllas.
Behov av omfattande behandlingsprogram
STRATTERA 18mg är indicerat som en integrerad del av ett totalt behandlingsprogram för ADHD som kan innefatta andra åtgärder (psykologiska, pedagogiska, sociala) för patienter med detta syndrom. Läkemedelsbehandling kanske inte är indicerad för alla patienter med detta syndrom. Läkemedelsbehandling är inte avsedd att användas hos patienten som uppvisar symtom som är sekundära till miljöfaktorer och/eller andra primära psykiatriska störningar, inklusive psykos. Lämplig utbildningsplacering är avgörande för barn och ungdomar med denna diagnos och psykosocial intervention är ofta till hjälp. När enbart avhjälpande åtgärder är otillräckliga kommer beslutet att förskriva läkemedelsbehandling bero på läkarens bedömning av kroniska och svårighetsgraden av patientens symtom.
DOSERING OCH ADMINISTRERING
Akut behandling
Dosering av barn och ungdomar upp till 70 kg kroppsvikt
STRATTERA 40 mg bör inledas med en total daglig dos på cirka 0,5 mg/kg och ökas efter minst 3 dagar till en målinställd total daglig dos på cirka 1,2 mg/kg administrerad antingen som en engångsdos på morgonen eller som jämnt fördelat. doser på morgonen och sen eftermiddag/tidig kväll. Ingen ytterligare fördel har visats för doser högre än 1,2 mg/kg/dag [se Kliniska studier ].
Den totala dagliga dosen för barn och ungdomar bör inte överstiga 1,4 mg/kg eller 100 mg, beroende på vilket som är lägre.
Dosering av barn och ungdomar över 70 kg kroppsvikt och vuxna
STRATTERA 18 mg bör inledas med en total daglig dos på 40 mg och ökas efter minst 3 dagar till en målinställd total daglig dos på cirka 80 mg administrerad antingen som en engångsdos på morgonen eller som jämnt fördelade doser på morgonen och sen eftermiddag/tidig kväll. Efter ytterligare 2 till 4 veckor kan dosen ökas till maximalt 100 mg hos patienter som inte har uppnått ett optimalt svar. Det finns inga data som stöder ökad effektivitet vid högre doser [se Kliniska studier ].
Den maximala rekommenderade totala dagliga dosen för barn och ungdomar över 70 kg och vuxna är 100 mg.
Underhåll/Utvidgad behandling
Det är allmänt överens om att farmakologisk behandling av ADHD kan behövas under längre perioder. Fördelen med att bibehålla pediatriska patienter (6-15 år) med ADHD på STRATTERA 18 mg efter att ha uppnått ett svar i ett dosintervall på 1,2 till 1,8 mg/kg/dag visades i en kontrollerad studie. Patienter som tilldelats STRATTERA i underhållsfasen fortsatte i allmänhet med samma dos som användes för att uppnå ett svar i den öppna fasen. Den läkare som väljer att använda STRATTERA under längre perioder bör med jämna mellanrum omvärdera läkemedlets långsiktiga användbarhet för den enskilda patienten [se Kliniska studier ].
Allmän doseringsinformation
STRATTERA kan tas med eller utan mat.
STRATTERA 40 mg kan avbrytas utan att avsmalnande.
STRATTERA kapslar är inte avsedda att öppnas, de ska tas hela [se PATIENTINFORMATION ].
Säkerheten för engångsdoser över 120 mg och totala dagliga doser över 150 mg har inte utvärderats systematiskt.
Dosering i specifika populationer
Dosjustering för patienter med nedsatt leverfunktion
För de ADHD-patienter som har leverinsufficiens (HI) rekommenderas dosjustering enligt följande: För patienter med måttlig HI (Child-Pugh klass B) bör initial- och måldoserna reduceras till 50 % av den normala dosen (för patienter utan HEJ). För patienter med svår HI (Child-Pugh klass C), bör initialdos och måldos reduceras till 25 % av det normala [se Användning i specifika populationer ].
Dosjustering för användning med en stark CYP2D6-hämmare eller hos patienter som är kända för att vara CYP2D6 PM
Hos barn och ungdomar upp till 70 kg kroppsvikt som administreras starka CYP2D6-hämmare, t.ex. paroxetin, fluoxetin och kinidin, eller hos patienter som är kända för att vara CYP2D6 PMs, bör STRATTERA inledas med 0,5 mg/kg/dag och endast ökas till den vanliga måldosen på 1,2 mg/kg/dag om symtomen inte förbättras efter 4 veckor och den initiala dosen tolereras väl.
Hos barn och ungdomar över 70 kg kroppsvikt och vuxna som administrerats starka CYP2D6-hämmare, t.ex. paroxetin, fluoxetin och kinidin, bör STRATTERA initieras med 40 mg/dag och endast ökas till den vanliga måldosen på 80 mg/dag om symtomen uteblir. förbättras efter 4 veckor och den initiala dosen tolereras väl.
HUR LEVERERAS
Doseringsformer och styrkor
Varje kapsel innehåller atomoxetin HCl motsvarande 10 mg (Opaque White, Opaque White), 18 mg (Guld, Opaque White), 25 mg (Opaque Blue, Opaque White), 40 mg (Opaque Blue, Opaque Blue), 60 mg (Opaque Blue). Blå, guld), 80 mg (ogenomskinlig brun, ogenomskinlig vit) eller 100 mg (ogenomskinlig brun, ogenomskinlig brun) atomoxetin.
Förvaring Och Hantering
Förvara vid 25°C (77°F); utflykter tillåtna till 15° till 30°C (59° till 86°F) [se USP kontrollerad rumstemperatur].
Marknadsförs av: Lilly USA, LLC Indianapolis, IN 46285, USA. Reviderad: maj 2017.
BIEFFEKTER
Erfarenhet av kliniska prövningar
STRATTERA 10 mg administrerades till 5382 barn eller ungdomar med ADHD och 1007 vuxna med ADHD i kliniska studier. Under de kliniska prövningarna med ADHD behandlades 1625 barn och ungdomar under längre tid än 1 år och 2529 barn och ungdomar behandlades i över 6 månader.
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Kliniska prövningar för barn och ungdomar
Orsaker till att behandlingen avbryts på grund av biverkningar i kliniska prövningar för barn och ungdomar
akuta placebokontrollerade studier för barn och ungdomar avbröt 3,0 % (48/1613) av atomoxetin-patienterna och 1,4% (13/945) placebopatienterna på grund av biverkningar. För alla studier, (inklusive öppna och långtidsstudier), avbröt 6,3 % av patienterna med omfattande metaboliserare (EM) och 11,2 % av patienterna med låg metaboliserad (PM) på grund av en biverkning. Bland STRATTERA-behandlade patienter, irritabilitet (0,3 %, N=5); somnolens (0,3%, N=5); aggression (0,2%, N=4); illamående (0,2%, N=4); kräkningar (0,2%, N=4); buksmärta (0,2%, N=4); förstoppning (0,1%, N=2); trötthet (0,1%, N=2); onormal känsla (0,1%, N=2); och huvudvärk (0,1 %, N=2) var orsakerna till att behandlingen avbröts som rapporterades av mer än 1 patient.
Anfall
STRATTERA har inte utvärderats systematiskt hos pediatriska patienter med krampanfall eftersom dessa patienter exkluderades från kliniska studier under produktens premarket-testning. I det kliniska utvecklingsprogrammet rapporterades anfall hos 0,2 % (12/5073) av barn vars medelålder var 10 år (intervall 6 till 16 år). I dessa kliniska prövningar var anfallsrisken bland dåliga metaboliserare 0,3% (1/293) jämfört med 0,2% (11/4741) för omfattande metaboliserare.
Vanligt observerade biverkningar i akuta barn och ungdomar, placebokontrollerade försök
Vanligt observerade biverkningar förknippade med användning av STRATTERA (incidens av 2 % eller mer) och som inte observerats vid en likvärdig incidens bland placebobehandlade patienter (STRATTERA 40 mg incidens högre än placebo) listas i tabell 2. Resultaten var liknande i BID och QD-försöket förutom som visas i Tabell 3, som visar både BID- och QD-resultat för utvalda biverkningar baserat på statistiskt signifikanta Breslow-Day-tester. De vanligaste observerade biverkningarna hos patienter som behandlades med STRATTERA (incidens på 5 % eller mer och minst dubbelt så stor incidens hos placebopatienter, för antingen två gånger dagligen eller en gång dagligen) var: illamående, kräkningar, trötthet, minskad aptit, buksmärtor och somnolens (se tabellerna 2 och 3).
Ytterligare data från kliniska prövningar med ADHD (kontrollerade och okontrollerade) har visat att cirka 5 till 10 % av pediatriska patienter upplevde potentiellt kliniskt viktiga förändringar i hjärtfrekvens (≥20 slag per min) eller blodtryck (≥15 till 20 mm Hg) [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Följande biverkningar inträffade hos minst 2 % av barn och ungdomar med CYP2D6 PM och var statistiskt signifikant vanligare hos PM-patienter jämfört med CYP2D6 EM-patienter: sömnlöshet (11 % av PM, 6 % av EM); vikt minskade (7 % av PM, 4 % av EM); förstoppning (7 % av PM, 4 % av EM); depression1 (7 % av PM, 4 % av EM); tremor (5 % av PM, 1 % av EM); excoriation (4 % av PM, 2 % av EM); medel sömnlöshet (3 % av PM, 1 % av EM); konjunktivit (3 % av PM, 1 % av EM); synkope (3 % av PM, 1 % av EM); uppvaknande tidigt på morgonen (2 % av PM, 1 % av EM); mydriasis (2 % av PM, 1 % av EM); sedering (4 % av PM, 2 % av EM).
1Depression inkluderar följande termer: depression, rejäl depression, depressiva symtom, nedstämdhet, dysfori.
Kliniska prövningar för vuxna
Orsaker till att behandlingen avbryts på grund av biverkningar i akuta placebokontrollerade prövningar för vuxna
de akuta placebokontrollerade studierna för vuxna avbröt 11,3% (61/541) atomoxetin-personer och 3,0% (12/405) placebo-personer på grund av biverkningar. Bland STRATTERA-behandlade patienter, sömnlöshet (0,9 %, N=5); illamående (0,9%, N=5); bröstsmärta (0,6%, N=3); trötthet (0,6%, N=3); ångest (0,4%, N=2); erektil dysfunktion (0,4%, N=2); humörsvängningar (0,4%, N=2); nervositet (0,4%, N=2); hjärtklappning (0,4%, N=2); och urinretention (0,4 %, N=2) var orsakerna till att behandlingen avbröts som rapporterades av mer än 1 patient.
Anfall
STRATTERA har inte utvärderats systematiskt hos vuxna patienter med krampanfall eftersom dessa patienter exkluderades från kliniska studier under produktens premarket-testning. I det kliniska utvecklingsprogrammet rapporterades anfall hos 0,1 % (1/748) av vuxna patienter. I dessa kliniska prövningar rapporterade inga dåliga metaboliserare (0/43) anfall jämfört med 0,1 % (1/705) för omfattande metaboliserare.
Vanligt observerade biverkningar i akuta placebokontrollerade vuxna försök
Vanligt observerade biverkningar förknippade med användning av STRATTERA (incidens av 2 % eller mer) och som inte observerats vid en likvärdig incidens bland placebobehandlade patienter (STRATTERA 25 mg incidens högre än placebo) listas i Tabell 4. De vanligaste observerade biverkningarna Hos patienter som behandlades med STRATTERA (incidens av 5 % eller mer och minst dubbelt så stor incidens hos placebopatienter) var: förstoppning, muntorrhet, illamående, minskad aptit, yrsel, erektil dysfunktion och urintvång (se tabell 4). Ytterligare data från kliniska prövningar med ADHD (kontrollerade och okontrollerade) har visat att cirka 5 till 10 % av vuxna patienter upplevde potentiellt kliniskt viktiga förändringar i hjärtfrekvens (≥20 slag per min) eller blodtryck (≥15 till 20 mm Hg) [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Följande biverkningar inträffade hos minst 2 % av vuxna CYP2D6-patienter med låg metaboliserare (PM) och var statistiskt signifikant vanligare hos PM-patienter jämfört med CYP2D6-patienter med extensiv metaboliserare (EM): suddig syn (4 % av PM, 1 % av EM). ); muntorrhet (35 % av PM, 17 % av EM); förstoppning (11 % av PM, 7 % av EM); orolig känsla (5 % av PM, 2 % av EM); minskad aptit (23 % av PM, 15 % av EM); tremor (5 % av PM, 1 % av EM); sömnlöshet (19 % av PM, 11 % av EM); sömnstörningar (7 % av PM, 3 % av EM); medel sömnlöshet (5 % av PM, 3 % av EM); terminal sömnlöshet (3 % av PM, 1 % av EM); urinretention (6 % av PM, 1 % av EM); erektil dysfunktion (21 % av PM, 9 % av EM); ejakulationsstörning (6 % av PM, 2 % av EM); hyperhidros (15 % av PM, 7 % av EM); perifer kyla (3 % av PM, 1 % av EM).
Manlig och kvinnlig sexuell dysfunktion
Atomoxetin verkar försämra den sexuella funktionen hos vissa patienter. Förändringar i sexuell lust, sexuell prestation och sexuell tillfredsställelse är inte väl utvärderade i de flesta kliniska prövningar eftersom de behöver särskild uppmärksamhet och eftersom patienter och läkare kan vara ovilliga att diskutera dem. Följaktligen kommer uppskattningar av förekomsten av ogynnsam sexuell upplevelse och prestanda som nämns i produktmärkningen sannolikt att underskatta den faktiska förekomsten. Tabell 4 ovan visar förekomsten av sexuella biverkningar som rapporterats av minst 2 % av vuxna patienter som tar STRATTERA i placebokontrollerade studier.
Det finns inga adekvata och välkontrollerade studier som undersöker sexuell dysfunktion med STRATTERA 40 mg behandling. Även om det är svårt att veta den exakta risken för sexuell dysfunktion i samband med användning av STRATTERA 40 mg, bör läkare rutinmässigt fråga om sådana möjliga biverkningar.
Spontana rapporter efter marknadsföring
Följande biverkningar har identifierats efter användning av STRATTERA efter godkännande. Om inget annat anges har dessa biverkningar inträffat hos vuxna och barn och ungdomar. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Kardiovaskulära systemet - QT-förlängning, synkope.
Perifera vaskulära effekter - Raynauds fenomen.
Allmänna symtom och tillstånd vid administreringsstället - Letargi.
Muskuloskeletala systemet - Rabdomyolys.
Störningar i nervsystemet - Hypoestesi; parestesi hos barn och ungdomar; sensoriska störningar; tics.
Psykiatriska störningar - Depression och nedstämdhet; ångest, förändringar i libido.
Anfall Kramper har rapporterats under perioden efter marknadsföringen. Anfallsfallen efter marknadsföring inkluderar patienter med redan existerande anfallsstörningar och de med identifierade riskfaktorer för anfall, såväl som patienter med varken en historia av eller identifierade riskfaktorer för anfall. Det exakta sambandet mellan STRATTERA 40mg och anfall är svårt att utvärdera på grund av osäkerhet om bakgrundsrisken för anfall hos ADHD-patienter.
Hud och subkutan vävnad - Alopeci, hyperhidros.
Urogenitala systemet - Manlig bäckensmärta; urintveksamhet hos barn och ungdomar; urinretention hos barn och ungdomar.
LÄKEMEDELSINTERAKTIONER
Monoaminoxidashämmare
Med andra läkemedel som påverkar hjärnans monoaminkoncentrationer har det rapporterats om allvarliga, ibland dödliga reaktioner (inklusive hypertermi, stelhet, myoklonus, autonom instabilitet med möjliga snabba fluktuationer av vitala tecken och mentala statusförändringar som inkluderar extrem agitation som utvecklas till delirium och koma. ) när det tas i kombination med en MAO-hämmare. Vissa fall presenterades med egenskaper som liknar malignt neuroleptikasyndrom. Sådana reaktioner kan uppstå när dessa läkemedel ges samtidigt eller i omedelbar närhet [se KONTRAINDIKATIONER ].
Effekt av CYP2D6-hämmare på Atomoxetin
Hos extensiva metaboliserare (EMs) ökar hämmare av CYP2D6 (t.ex. paroxetin, fluoxetin och kinidin) atomoxetin steady-state plasmakoncentrationer till exponeringar liknande de som observerats hos låga metaboliserare (PM). Hos EM-individer som behandlats med paroxetin eller fluoxetin är AUC för atomoxetin cirka 6 till 8 gånger och Css, max är cirka 3 till 4 gånger högre än atomoxetin enbart.
In vitro-studier tyder på att samtidig administrering av cytokrom P450-hämmare till PM inte kommer att öka plasmakoncentrationerna av atomoxetin.
Antihypertensiva läkemedel och tryckmedel
På grund av möjliga effekter på blodtrycket ska STRATTERA användas med försiktighet tillsammans med blodtryckssänkande läkemedel och pressormedel (t.ex. dopamin, dobutamin) eller andra läkemedel som ökar blodtrycket.
Albuterol
STRATTERA ska administreras med försiktighet till patienter som behandlas med systemiskt administrerat (oralt eller intravenöst) albuterol (eller andra beta2-agonister) eftersom effekten av albuterol på det kardiovaskulära systemet kan förstärkas vilket resulterar i ökad hjärtfrekvens och blodtryck. Albuterol (600 mcg iv under 2 timmar) inducerade ökningar av hjärtfrekvens och blodtryck. Dessa effekter förstärktes av atomoxetin (60 mg två gånger dagligen i 5 dagar) och var mest markant efter den initiala samtidiga administreringen av albuterol och atomoxetin. Dessa effekter på hjärtfrekvens och blodtryck sågs dock inte i en annan studie efter samtidig administrering med inhalerad dos av albuterol (200-800 mikrogram) och atomoxetin (80 mg dagligen i 5 dagar) hos 21 friska asiatiska försökspersoner som exkluderades för dåliga patienter. metaboliserarens status.
Effekt av Atomoxetine på P450-enzymer
Atomoxetin orsakade inte kliniskt viktig hämning eller induktion av cytokrom P450-enzymer, inklusive CYP1A2, CYP3A, CYP2D6 och CYP2C9.
CYP3A-substrat (t.ex. Midazolam)
Samtidig administrering av STRATTERA (60 mg två gånger dagligen i 12 dagar) med midazolam, en modellförening för CYP3A4-metaboliserade läkemedel (engångsdos på 5 mg), resulterade i 15 % ökning av AUC för midazolam. Ingen dosjustering rekommenderas för läkemedel som metaboliseras av CYP3A.
CYP2D6-substrat (t.ex. desipramin)
Samtidig administrering av STRATTERA (40 eller 60 mg två gånger dagligen i 13 dagar) med desipramin, en modellförening för CYP2D6-metaboliserade läkemedel (enkeldos på 50 mg), förändrade inte farmakokinetiken för desipramin. Ingen dosjustering rekommenderas för läkemedel som metaboliseras av CYP2D6.
Alkohol
Konsumtion av etanol med STRATTERA 18 mg förändrade inte berusningseffekterna av etanol.
Metylfenidat
Samtidig administrering av metylfenidat och STRATTERA 18 mg ökade inte kardiovaskulära effekter utöver de som sågs med enbart metylfenidat.
Läkemedel starkt bundna till plasmaprotein
In vitro läkemedelsförskjutningsstudier utfördes med atomoxetin och andra högbundna läkemedel i terapeutiska koncentrationer. Atomoxetin påverkade inte bindningen av warfarin, acetylsalicylsyra, fenytoin eller diazepam till humant albumin. På liknande sätt påverkade dessa föreningar inte bindningen av atomoxetin till humant albumin.
Läkemedel som påverkar magens pH
Läkemedel som höjer magsäckens pH (magnesiumhydroxid/aluminiumhydroxid, omeprazol) hade ingen effekt på STRATTERA biotillgänglighet.
Narkotikamissbruk och beroende
Kontrollerad substans
STRATTERA är inte en kontrollerad substans.
Missbruk
I en randomiserad, dubbelblind, placebokontrollerad, missbrukspotentialstudie på vuxna som jämförde effekterna av STRATTERA och placebo, associerades STRATTERA inte med ett svarsmönster som antydde stimulerande eller euforiserande egenskaper.
Beroende
Data från kliniska studier på över 2 000 barn, ungdomar och vuxna med ADHD och över 1 200 vuxna med depression visade endast enstaka incidenter av drogavledning eller olämplig självadministration i samband med STRATTERA. Det fanns inga tecken på symtomåterhämtning eller biverkningar som tydde på ett läkemedelsavbrott eller abstinenssyndrom.
Djurupplevelse
Läkemedelsdiskrimineringsstudier på råttor och apor visade inkonsekvent stimulansgeneralisering mellan atomoxetin och kokain.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Självmordstankar
STRATTERA ökade risken för självmordstankar i korttidsstudier på barn och ungdomar med Attention-Deficit/Hyperactivity Disorder (ADHD). Sammanslagna analyser av kortvariga (6 till 18 veckor) placebokontrollerade studier av STRATTERA på barn och ungdomar har visat en större risk för självmordstankar tidigt under behandlingen hos dem som får STRATTERA. Det gjordes totalt 12 studier (11 vid ADHD och 1 vid enures) som involverade över 2200 patienter (inklusive 1357 patienter som fick STRATTERA och 851 som fick placebo). Den genomsnittliga risken för självmordstankar hos patienter som fick STRATTERA var 0,4 % (5/1357 patienter), jämfört med ingen hos placebobehandlade patienter. Det gjordes 1 självmordsförsök bland dessa cirka 2200 patienter, som inträffade hos en patient som behandlades med STRATTERA. Inga självmord inträffade i dessa försök. Alla reaktioner inträffade hos barn 12 år eller yngre. Alla reaktioner inträffade under den första behandlingsmånaden. Det är okänt om risken för självmordstankar hos pediatriska patienter sträcker sig till långvarig användning. En liknande analys hos vuxna patienter som behandlats med STRATTERA för antingen ADHD eller egentlig depression (MDD) visade inte någon ökad risk för självmordstankar eller självmordsbeteende i samband med användning av STRATTERA.
Alla pediatriska patienter som behandlas med STRATTERA bör övervakas på lämpligt sätt och observeras noggrant med avseende på klinisk försämring, suicidalitet och ovanliga beteendeförändringar, särskilt under de första månaderna av en läkemedelsbehandlingskur, eller vid tidpunkter med dosförändringar, antingen ökningar eller minskningar .
Följande symtom har rapporterats med STRATTERA: ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani och mani. Även om ett orsakssamband mellan uppkomsten av sådana symtom och uppkomsten av självmordsimpulser inte har fastställts, finns det en oro för att sådana symtom kan representera föregångare till framväxande suicidalitet. Patienter som behandlas med STRATTERA 40 mg bör därför observeras med avseende på uppkomsten av sådana symtom.
Man bör överväga att ändra den terapeutiska regimen, inklusive eventuellt avbrytande av medicineringen, hos patienter som upplever framväxande suiciditet eller symtom som kan vara prekursorer till framväxande suicidalitet, särskilt om dessa symtom är allvarliga eller plötsligt inträdande, eller inte var en del av patientens symtom.
Familjer och vårdgivare till pediatriska patienter som behandlas med STRATTERA 10 mg bör uppmärksammas på behovet av att övervaka patienter med avseende på uppkomsten av agitation, irritabilitet, ovanliga beteendeförändringar och de andra symtomen som beskrivs ovan, såväl som uppkomsten av suicidalitet, och rapportera sådana symtom omedelbart till vårdgivare. Sådan övervakning bör innefatta daglig observation av familjer och vårdgivare.
Allvarlig leverskada
Rapporter efter marknadsföring tyder på att STRATTERA kan orsaka allvarlig leverskada. Även om inga tecken på leverskada upptäcktes i kliniska prövningar med cirka 6 000 patienter, har det förekommit sällsynta fall av kliniskt signifikant leverskada som ansågs sannolikt eller möjligen relaterade till användning av STRATTERA 40 mg efter marknadsföring. Sällsynta fall av leversvikt har också rapporterats, inklusive ett fall som resulterade i en levertransplantation. På grund av trolig underrapportering är det omöjligt att ge en exakt uppskattning av den verkliga förekomsten av dessa reaktioner. Rapporterade fall av leverskada inträffade inom 120 dagar efter påbörjad behandling med atomoxetin i de flesta fall och vissa patienter uppvisade markant förhöjda leverenzymer [>20 X övre normalgränsen (ULN)] och gulsot med signifikant förhöjda bilirubinnivåer (>2) X ULN), följt av återhämtning vid utsättande av atomoxetin. Hos en patient återkom leverskada, som manifesterades av förhöjda leverenzymer upp till 40 X ULN och gulsot med bilirubin upp till 12 X ULN, vid återinsättning och följdes av återhämtning vid utsättning av läkemedel, vilket gav bevis för att STRATTERA sannolikt orsakade leverskadan. Sådana reaktioner kan uppstå flera månader efter att behandlingen påbörjats, men laboratorieavvikelser kan fortsätta att förvärras i flera veckor efter att läkemedlet har stoppats. Den ovan beskrivna patienten återhämtade sig från sin leverskada och behövde ingen levertransplantation.
STRATTERA ska avbrytas hos patienter med gulsot eller laboratoriebevis på leverskada och ska inte återupptas. Laboratorietester för att fastställa leverenzymnivåer bör göras vid det första symtomet eller tecknet på leverdysfunktion (t.ex. klåda, mörk urin, gulsot, ömhet i den övre högra kvadranten eller oförklarliga "influensaliknande" symtom) [se Laboratorietester , PATIENTINFORMATION ].
Allvarliga kardiovaskulära händelser
Plötslig död och redan existerande strukturella hjärtavvikelser eller andra allvarliga hjärtproblem
Barn och ungdomar
Plötslig död har rapporterats i samband med atomoxetinbehandling i vanliga doser hos barn och ungdomar med strukturella hjärtavvikelser eller andra allvarliga hjärtproblem. Även om vissa allvarliga hjärtproblem ensamma medför en ökad risk för plötslig död, bör atomoxetin i allmänhet inte användas till barn eller ungdomar med kända allvarliga strukturella hjärtavvikelser, kardiomyopati, allvarliga hjärtrytmavvikelser eller andra allvarliga hjärtproblem som kan göra dem mer sårbara. till de noradrenerga effekterna av atomoxetin.
Vuxna
Plötsliga dödsfall, stroke och hjärtinfarkt har rapporterats hos vuxna som tar atomoxetin i vanliga doser för ADHD. Även om atomoxetins roll i dessa vuxna fall också är okänd, har vuxna en större sannolikhet än barn att ha allvarliga strukturella hjärtavvikelser, kardiomyopati, allvarliga hjärtrytmavvikelser, kranskärlssjukdom eller andra allvarliga hjärtproblem. Man bör överväga att inte behandla vuxna med kliniskt signifikanta hjärtavvikelser.
Bedömning av kardiovaskulär status hos patienter som behandlas med Atomoxetin
Barn, ungdomar eller vuxna som övervägs för behandling med atomoxetin bör ha en noggrann historia (inklusive bedömning av familjehistoria av plötslig död eller ventrikulär arytmi) och fysisk undersökning för att bedöma förekomsten av hjärtsjukdom, och bör få ytterligare hjärtsjukdom. utvärdering om fynd tyder på sådan sjukdom (t.ex. elektrokardiogram och ekokardiogram). Patienter som utvecklar symtom som ansträngande bröstsmärtor, oförklarlig synkope eller andra symtom som tyder på hjärtsjukdom under atomoxetinbehandling bör genomgå en omedelbar hjärtutvärdering.
Effekter På Blodtryck Och Puls
STRATTERA ska användas med försiktighet till patienter vars underliggande medicinska tillstånd kan förvärras av förhöjt blodtryck eller hjärtfrekvens, såsom vissa patienter med hypertoni, takykardi eller kardiovaskulär eller cerebrovaskulär sjukdom. Det ska inte användas till patienter med allvarliga hjärt- eller kärlsjukdomar vars tillstånd förväntas försämras om de upplever kliniskt viktiga ökningar av blodtryck eller hjärtfrekvens [se KONTRAINDIKATIONER ]. Puls och blodtryck bör mätas vid baslinjen, efter dosökningar av STRATTERA, och regelbundet under behandlingen för att upptäcka möjliga kliniskt viktiga ökningar.
Följande tabell ger korttidsdata från placebokontrollerade kliniska prövningar för andelen patienter som har en ökning av: diastoliskt blodtryck ≥15 mm Hg; systoliskt blodtryck ≥20 mm Hg; hjärtfrekvens högre än eller lika med 20 slag per minut, i både den pediatriska och den vuxna populationen (se tabell 1).
placebokontrollerade registreringsstudier som involverade pediatriska patienter identifierades takykardi som en biverkning för 0,3 % (5/1597) av dessa STRATTERA 10 mg patienter jämfört med 0 % (0/934) av placebopatienterna. Den genomsnittliga hjärtfrekvensökningen hos patienter med omfattande metaboliserare (EM) var 5,0 slag/minut och hos patienter med låg metaboliserare (PM) 9,4 slag/minut.
I kliniska prövningar för vuxna där EM/PM-status var tillgänglig var den genomsnittliga hjärtfrekvensökningen hos PM-patienter signifikant högre än hos EM-patienter (11 slag/minut mot 7,5 slag/minut). Hjärtfrekvenseffekterna kan vara kliniskt viktiga hos vissa PM-patienter.
I placebokontrollerade registreringsstudier som involverade vuxna patienter identifierades takykardi som en biverkning för 1,5 % (8/540) av patienterna med STRATTERA 25 mg jämfört med 0,5 % (2/402) av placebopatienterna.
kliniska prövningar för vuxna där EM/PM-status var tillgänglig, var den genomsnittliga förändringen från baslinjen i diastoliskt blodtryck hos PM-patienter högre än hos EM-patienter (4,21 mot 2,13 mm Hg) liksom medelförändringen från baslinjen i systoliskt blodtryck (PM) : 2,75 mot EM: 2,40 mm Hg). Blodtryckseffekterna kan vara kliniskt viktiga hos vissa PM-patienter.
Ortostatisk hypotoni och synkope har rapporterats hos patienter som tar STRATTERA. I registreringsstudier för barn och ungdomar upplevde 0,2 % (12/5596) av STRATTERA-behandlade patienter ortostatisk hypotoni och 0,8 % (46/5596) upplevde synkope. I korttidsregistreringsstudier för barn och ungdomar upplevde 1,8 % (6/340) av STRATTERA-behandlade patienter ortostatisk hypotoni jämfört med 0,5 % (1/207) av placebobehandlade patienter. Synkope rapporterades inte under korttidsstudier med placebokontrollerade ADHD-registreringsstudier för barn och ungdomar. STRATTERA 10 mg ska användas med försiktighet vid alla tillstånd som kan predisponera patienter för hypotoni eller tillstånd associerade med plötsliga hjärtfrekvens- eller blodtrycksförändringar.
Uppkomsten av nya psykotiska eller maniska symtom
Behandlingsuppkomna psykotiska eller maniska symtom, t.ex. hallucinationer, vanföreställningar eller mani hos barn och ungdomar utan tidigare psykotisk sjukdom eller mani kan orsakas av atomoxetin i vanliga doser. Om sådana symtom uppträder bör man överväga en möjlig orsaksroll för atomoxetin och att avbryta behandlingen bör övervägas. I en poolad analys av flera korttidsstudier, placebokontrollerade studier uppträdde sådana symtom hos cirka 0,2 % (4 patienter med reaktioner av 1939 exponerade för atomoxetin under flera veckor i vanliga doser) av atomoxetinbehandlade patienter jämfört med 0 av 0 av 1939 1056 placebobehandlade patienter.
Screening av patienter för bipolär sjukdom
allmänhet bör särskild försiktighet iakttas vid behandling av ADHD hos patienter med komorbid bipolär sjukdom på grund av oro för möjlig induktion av en blandad/manisk episod hos patienter med risk för bipolär sjukdom. Huruvida något av de ovan beskrivna symptomen representerar en sådan omvandling är okänt. Innan behandling med STRATTERA 40 mg påbörjas bör dock patienter med komorbida depressiva symtom screenas adekvat för att fastställa om de löper risk för bipolär sjukdom; sådan screening bör inkludera en detaljerad psykiatrisk historia, inklusive en familjehistoria av självmord, bipolär sjukdom och depression.
Aggressivt beteende eller fientlighet
Patienter som börjar behandling för ADHD bör övervakas med avseende på utseende eller försämring av aggressivt beteende eller fientlighet. Aggressivt beteende eller fientlighet observeras ofta hos barn och ungdomar med ADHD. I pediatriska korttidskontrollerade kliniska prövningar rapporterade 21/1308 (1,6 %) av atomoxetinpatienterna mot 9/806 (1,1 %) av placebobehandlade patienter spontant behandlingsuppkomna fientlighetsrelaterade biverkningar (total riskkvot på 1,33 [95 %). CI 0,67-2,64 – inte statistiskt signifikant]). I placebokontrollerade kliniska prövningar för vuxna rapporterade 6/1697 (0,35 %) av atomoxetinpatienterna mot 4/1 560 (0,26 %) av placebobehandlade patienter spontant behandlingsuppkomna fientlighetsrelaterade biverkningar (total riskkvot på 1,38 [95 % KI) 0,39-4,88 – inte statistiskt signifikant]). Även om detta inte är avgörande bevis för att STRATTERA 10 mg orsakar aggressivt beteende eller fientlighet, observerades dessa beteenden oftare i kliniska prövningar bland barn, ungdomar och vuxna behandlade med STRATTERA jämfört med placebo.
Allergiska händelser
Även om det är ovanligt, har allergiska reaktioner, inklusive anafylaktiska reaktioner, angioneurotiskt ödem, urtikaria och hudutslag, rapporterats hos patienter som tar STRATTERA.
Effekter på urinutflöde från urinblåsan
I ADHD-kontrollerade studier för vuxna ökade frekvensen av urinretention (1,7 %, 9/540) och urintveksamhet (5,6 %, 30/540) bland atomoxetinpatienter jämfört med placebopatienter (0 %, 0/402 ; 0,5 %, 2/402, respektive). Två vuxna patienter med atomoxetin och inga placebopatienter avbröt behandlingen från kontrollerade kliniska prövningar på grund av urinretention. Ett klagomål av urinretention eller urintveksamhet bör anses vara potentiellt relaterat till atomoxetin.
Priapism
Sällsynta fall av priapism efter marknadsföring, definierat som smärtsam och icke smärtsam peniserektion som varar mer än 4 timmar, har rapporterats för pediatriska och vuxna patienter som behandlats med STRATTERA. Erektionerna försvann i fall där uppföljningsinformation fanns tillgänglig, vissa efter utsättning av STRATTERA. Omgående läkarvård krävs vid misstänkt priapism.
Effekter På Tillväxt
Data om de långsiktiga effekterna av STRATTERA 25 mg på tillväxten kommer från öppna studier, och vikt- och längdförändringar jämförs med normativa populationsdata. I allmänhet ligger vikt- och längdökningen hos pediatriska patienter som behandlats med STRATTERA efter vad som förutspåtts av normativa populationsdata för ungefär de första 9-12 månaderna av behandlingen. Därefter går viktökningen tillbaka och efter cirka 3 års behandling har patienter som behandlats med STRATTERA gått upp 17,9 kg i genomsnitt, 0,5 kg mer än vad som förutspåtts av deras baslinjedata. Efter cirka 12 månader stabiliseras höjdökningen och efter 3 år har patienter som behandlats med STRATTERA 40 mg ökat i genomsnitt 19,4 cm, 0,4 cm mindre än vad som förutspåtts av deras baslinjedata (se figur 1 nedan).
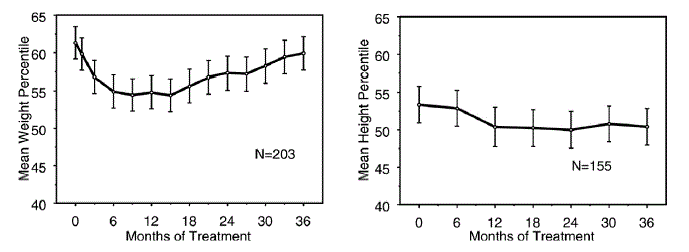
Figur 1: Medelvikt och längdpercentiler över tid för patienter med tre års behandling med STRATTERA 40 mg
Detta tillväxtmönster var i allmänhet likartat oavsett pubertetsstatus vid tidpunkten för behandlingsstart. Patienter som var pre-pubertala i början av behandlingen (flickor ≤8 år, pojkar ≤9 år) gick upp i genomsnitt 2,1 kg och 1,2 cm mindre än förutspått efter tre år. Patienter som var pubertet (flickor >8 till ≤13 år gamla, pojkar >9 till ≤14 år) eller sen pubertet (flickor >13 år gamla, pojkar >14 år) hade genomsnittliga vikt- och längdökningar som var nära eller överträffade de förutspådda efter tre års behandling.
Tillväxten följde ett liknande mönster hos både omfattande och dåliga metaboliserare (EM, PM). PM som behandlats i minst två år ökade i genomsnitt 2,4 kg och 1,1 cm mindre än förutspått, medan EM gick upp i genomsnitt 0,2 kg och 0,4 cm mindre än förutspått.
korttidskontrollerade studier (upp till 9 veckor) gick STRATTERA-behandlade patienter ner i genomsnitt 0,4 kg och gick upp i genomsnitt 0,9 cm, jämfört med en ökning på 1,5 kg och 1,1 cm hos de placebobehandlade patienterna. I en kontrollerad studie med fast dos förlorade 1,3 %, 7,1 %, 19,3 % och 29,1 % av patienterna minst 3,5 % av sin kroppsvikt i dosgrupperna med placebo, 0,5, 1,2 och 1,8 mg/kg/dag.
Tillväxten bör övervakas under behandling med STRATTERA.
Laboratorietester
Rutinmässiga laboratorietester krävs inte.
CYP2D6 Metabolism
Dåliga metaboliserare (PM) av CYP2D6 har en 10 gånger högre AUC och en 5 gånger högre toppkoncentration till en given dos av STRATTERA 25 mg jämfört med extensiva metaboliserare (EMs). Ungefär 7% av en kaukasisk befolkning är PM. Laboratorietester finns tillgängliga för att identifiera CYP2D6 PM. Blodnivåerna i PM liknar de som uppnås genom att ta starka hämmare av CYP2D6. De högre blodnivåerna i PM leder till en högre frekvens av vissa biverkningar av STRATTERA [se NEGATIVA REAKTIONER ].
Samtidig användning av potenta CYP2D6-hämmare eller användning hos patienter som är kända för att vara CYP2D6 PMs
Atomoxetin metaboliseras primärt via CYP2D6-vägen till 4-hydroxiatomoxetin. Dosjustering av STRATTERA kan vara nödvändig när det administreras samtidigt med potenta CYP2D6-hämmare (t.ex. paroxetin, fluoxetin och kinidin) eller när det administreras till CYP2D6 PM. [Ser DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ].
Information om patientrådgivning
Se FDA-godkänd PATIENTINFORMATION .
Allmän information
Läkare bör instruera sina patienter att läsa läkemedelsguiden innan behandlingen med STRATTERA påbörjas och att läsa om den varje gång receptet förnyas.
Förskrivare eller annan hälso- och sjukvårdspersonal bör informera patienter, deras familjer och deras vårdgivare om fördelarna och riskerna förknippade med behandling med STRATTERA och bör ge dem råd om lämplig användning. Förskrivaren eller sjukvårdspersonalen bör instruera patienter, deras familjer och deras vårdgivare att läsa medicinguiden och bör hjälpa dem att förstå innehållet. Patienterna ska ges möjlighet att diskutera innehållet i Läkemedelsguiden och få svar på eventuella frågor de kan ha.
Patienter bör informeras om följande problem och uppmanas att varna sin förskrivare om dessa inträffar när de tar STRATTERA.
Självmordsrisk
Patienter, deras familjer och deras vårdgivare bör uppmuntras att vara uppmärksamma på uppkomsten av ångest, agitation, panikattacker, sömnlöshet, irritabilitet, fientlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastlöshet), hypomani, mani, andra ovanliga beteendeförändringar , depression och självmordstankar, särskilt tidigt under behandlingen med STRATTERA och när dosen justeras. Familjer och vårdgivare till patienter bör rådas att observera uppkomsten av sådana symtom på en daglig basis, eftersom förändringar kan vara plötsliga. Sådana symtom bör rapporteras till patientens förskrivare eller hälso- och sjukvårdspersonal, särskilt om de är allvarliga, plötsliga debuterande eller inte var en del av patientens uppvisande symtom. Symtom som dessa kan vara förknippade med en ökad risk för suicidtänkande och självmordsbeteende och tyder på behov av mycket noggrann övervakning och eventuellt förändringar i medicineringen.
Allvarlig leverskada
Patienter som påbörjar STRATTERA bör varnas för att allvarlig leverskada kan utvecklas. Patienter bör instrueras att kontakta sin läkare omedelbart om de utvecklar klåda, mörk urin, gulsot, ömhet i den övre högra kvadranten eller oförklarliga "influensaliknande" symtom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Aggression eller fientlighet
Patienter bör instrueras att ringa sin läkare så snart som möjligt om de märker en ökning av aggression eller fientlighet.
Priapism
Sällsynta fall av priapism efter marknadsföring, definierat som smärtsam och icke smärtsam peniserektion som varar mer än 4 timmar, har rapporterats för pediatriska och vuxna patienter som behandlats med STRATTERA. Föräldrar eller vårdnadshavare till pediatriska patienter som tar STRATTERA 25 mg och vuxna patienter som tar STRATTERA bör instrueras om att priapism kräver omedelbar läkarvård.
Ögonirriterande
STRATTERA är ögonirriterande. STRATTERA kapslar är inte avsedda att öppnas. Om kapselinnehållet kommer i kontakt med ögat ska det drabbade ögat omedelbart spolas med vatten och medicinsk rådgivning inhämtas. Händer och eventuellt förorenade ytor bör tvättas så snart som möjligt.
Läkemedel-läkemedelsinteraktion
Patienter bör instrueras att konsultera en läkare om de tar eller planerar att ta några receptbelagda eller receptfria läkemedel, kosttillskott eller naturläkemedel.
Graviditet
Patienter ska instrueras att konsultera en läkare om de ammar, är gravida eller funderar på att bli gravida medan de tar STRATTERA.
Mat
Patienter kan ta STRATTERA 25 mg med eller utan mat.
Missad dos
Om patienter missar en dos ska de instrueras att ta den så snart som möjligt, men de ska inte ta mer än den ordinerade totala dagliga mängden STRATTERA under någon 24-timmarsperiod.
Interferens med psykomotorisk prestanda
Patienter bör instrueras att vara försiktiga när de kör bil eller använder farliga maskiner tills de är rimligt säkra på att deras prestanda inte påverkas av atomoxetin.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Atomoxetin HCl var inte cancerframkallande hos råttor och möss när det gavs i kosten i 2 år vid tidsvägda medeldoser upp till 47 respektive 458 mg/kg/dag. Den högsta dosen som används till råttor är cirka 8 och 5 gånger den maximala humandosen till barn respektive vuxna, på mg/m2-basis. Plasmanivåer (AUC) av atomoxetin vid denna dos hos råttor uppskattas vara 1,8 gånger (omfattande metaboliserare) eller 0,2 gånger (dåliga metaboliserare) de hos människor som får den maximala humana dosen. Den högsta dosen som används till möss är cirka 39 och 26 gånger den maximala humandosen till barn respektive vuxna, på mg/m2-basis.
Mutagenes
Atomoxetin HCl var negativ i en rad genotoxicitetsstudier som inkluderade en omvänd punktmutationsanalys (Ames-test), en in vitro-analys av muslymfom, ett kromosomavvikelsetest i äggstocksceller från kinesisk hamster, ett oplanerat DNA-syntestest i råtthepatocyter och en in vivo mikrokärntest på möss. Det fanns dock en liten ökning av andelen kinesiska hamsteräggstocksceller med diplokromosomer, vilket tyder på endoduplicering (numerisk aberration).
Metaboliten N-desmetylatomoxetin HCl var negativ i Ames-testet, muslymfomanalysen och oplanerat DNA-syntestest.
Nedsättning av fertilitet
Atomoxetin HCl försämrade inte fertiliteten hos råttor när det gavs i kosten i doser på upp till 57 mg/kg/dag, vilket är cirka 6 gånger den maximala humana dosen på mg/m2-basis.
Användning i specifika populationer
Graviditet
Graviditetskategori C
Dräktiga kaniner behandlades med upp till 100 mg/kg/dag atomoxetin genom sondmatning under hela organogenesperioden. Vid denna dos observerades i 1 av 3 studier en minskning av antalet levande foster och en ökning av tidiga resorptioner. Små ökningar av förekomsten av atypiskt ursprung i halspulsådern och frånvarande artär subklavia observerades. Dessa fynd observerades vid doser som orsakade lätt maternell toxicitet. Ingen effektdos för dessa fynd var 30 mg/kg/dag. Dosen på 100 mg/kg är cirka 23 gånger den maximala dosen för människor på mg/m2-basis; Plasmanivåer (AUC) av atomoxetin vid denna dos hos kaniner uppskattas vara 3,3 gånger (omfattande metaboliserare) eller 0,4 gånger (dåliga metaboliserare) de hos människor som får den maximala humana dosen.
Råttor behandlades med upp till cirka 50 mg/kg/dag av atomoxetin (ungefär 6 gånger den maximala humana dosen på mg/m2-basis) i kosten från 2 veckor (honor) eller 10 veckor (hanar) före parning genom perioder av organogenes och laktation. I 1 av 2 studier observerades minskningar i valpvikt och valpöverlevnad. Den minskade valpöverlevnaden sågs också vid 25 mg/kg (men inte vid 13 mg/kg). I en studie där råttor behandlades med atomoxetin i kosten från 2 veckor (honor) eller 10 veckor (hanar) före parning under hela organogenesperioden, en minskning av fostrets vikt (endast honor) och en ökning av incidensen av ofullständig förbening av kotbågen hos foster observerades vid 40 mg/kg/dag (ungefär 5 gånger den maximala humana dosen på mg/m2-basis) men inte vid 20 mg/kg/dag.
Inga negativa fostereffekter sågs när dräktiga råttor behandlades med upp till 150 mg/kg/dag (ungefär 17 gånger den maximala humana dosen på mg/m2-basis) genom sondmatning under hela organogenesperioden. Inga adekvata och välkontrollerade studier har utförts på gravida kvinnor. STRATTERA 18mg ska inte användas under graviditet såvida inte den potentiella nyttan motiverar den potentiella risken för fostret.
Arbete och leverans
Förlossningen hos råttor påverkades inte av atomoxetin. Effekten av STRATTERA på förlossning och förlossning hos människor är okänd.
Ammande mödrar
Atomoxetin och/eller dess metaboliter utsöndrades i mjölken hos råttor. Det är inte känt om atomoxetin utsöndras i modersmjölk. Försiktighet bör iakttas om STRATTERA ges till en ammande kvinna.
Pediatrisk användning
Alla som överväger att använda STRATTERA hos ett barn eller en ungdom måste balansera de potentiella riskerna med det kliniska behovet [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Farmakokinetiken för atomoxetin hos barn och ungdomar liknar den hos vuxna. Säkerheten, effekten och farmakokinetiken för STRATTERA hos pediatriska patienter yngre än 6 år har inte utvärderats.
En studie genomfördes på unga råttor för att utvärdera effekterna av atomoxetin på tillväxt och neurobeteende och sexuell utveckling. Råttor behandlades med 1, 10 eller 50 mg/kg/dag (ungefär 0,2, 2 respektive 8 gånger den maximala humana dosen på mg/m2-basis) av atomoxetin som gavs genom sondmatning från den tidiga postnatala perioden (dag). 10 år) genom vuxen ålder. Små fördröjningar i början av vaginal öppenhet (alla doser) och preputial separation (10 och 50 mg/kg), lätt minskning av bitestikelvikt och spermieantal (10 och 50 mg/kg) och en lätt minskning av corpora lutea (50 mg) /kg) sågs, men det fanns inga effekter på fertilitet eller reproduktionsförmåga. En liten fördröjning i början av incisiveruption sågs vid 50 mg/kg. En lätt ökning av motorisk aktivitet sågs på dag 15 (män vid 10 och 50 mg/kg och kvinnor vid 50 mg/kg) och på dag 30 (kvinnor vid 50 mg/kg) men inte på dag 60 i åldern. Det fanns inga effekter på inlärnings- och minnestester. Betydelsen av dessa fynd för människor är okänd.
Geriatrisk användning
Säkerheten, effekten och farmakokinetiken för STRATTERA 10 mg hos geriatriska patienter har inte utvärderats.
Leverinsufficiens
Atomoxetinexponeringen (AUC) är ökad jämfört med normala försökspersoner hos EM-patienter med måttlig (Child-Pugh Klass B) (2-faldig ökning) och svår (Child-Pugh Class C) (4-faldig ökning) leverinsufficiens. Dosjustering rekommenderas för patienter med måttlig eller svår leverinsufficiens [se DOSERING OCH ADMINISTRERING ].
Njurinsufficiens
EM-personer med njursjukdom i slutstadiet hade högre systemisk exponering för atomoxetin än friska försökspersoner (ca 65 % ökning), men det fanns ingen skillnad när exponeringen korrigerades för mg/kg dos. STRATTERA 25 mg kan därför administreras till ADHD-patienter med njursjukdom i slutstadiet eller mindre grad av njurinsufficiens med normal dosering.
Kön
Kön påverkade inte dispositionen av atomoxetin.
Etniskt ursprung
Etniskt ursprung påverkade inte dispositionen av atomoxetin (förutom att PM är vanligare hos kaukasier).
Patienter med samtidig sjukdom
Tics hos patienter med ADHD och komorbid Tourettes sjukdom
Atomoxetin administrerat i ett flexibelt dosintervall på 0,5 till 1,5 mg/kg/dag (medeldos på 1,3 mg/kg/dag) och placebo jämfördes i 148 randomiserade pediatriska (ålder 717 år) patienter med en DSM-IV-diagnos ADHD och komorbid tic-störning i en 18 veckor lång, dubbelblind, placebokontrollerad studie där majoriteten (80 %) deltog i denna studie med Tourettes sjukdom (Tourettes sjukdom: 116 försökspersoner; kronisk motorisk tic-störning: 29 försökspersoner). En non-inferiority-analys visade att STRATTERA 10 mg inte förvärrade tics hos dessa patienter, vilket bestämts av Yale Global Tic Severity Scale Total Score (YGTSS). Av 148 patienter som gick in i den akuta behandlingsfasen avbröt 103 (69,6 %) patienter studien. Den primära orsaken till att behandlingen avbröts i både behandlingsgruppen atomoxetin (38 av 76 patienter, 50,0 %) och placebo (45 av 72 patienter, 62,5 %) identifierades som bristande effekt med de flesta av patienterna som avbröts vid vecka 12. Detta var första besök där patienter med CGI-S≥4 också kunde uppfylla kriterierna för "klinisk icke-svarare" (CGI-S förblev detsamma eller ökade från studiens baslinje) och vara berättigade att gå in i en öppen förlängningsstudie med atomoxetin. Det har förekommit rapporter om tics efter marknadsföring [se NEGATIVA REAKTIONER ].
Ångest hos patienter med ADHD och komorbida ångestsyndrom
I två dubbelblinda, placebokontrollerade studier efter marknadsföring har det visats att behandling av patienter med ADHD och komorbida ångeststörningar med STRATTERA 10 mg inte förvärrar deras ångest.
I en 12-veckors dubbelblind, placebokontrollerad studie fick 176 patienter, i åldern 8-17 år, som uppfyllde DSM-IV-kriterierna för ADHD och minst en av ångeststörningarna separationsångest, generaliserat ångestsyndrom eller social fobi. randomiserat. Efter en 2-veckors dubbelblind placebo-introduktion, initierades STRATTERA 25 mg med 0,8 mg/kg/dag med ökning till en måldos på 1,2 mg/kg/dag (mediandos 1,30 mg/kg/dag +/- 0,29 mg/kg/dag). STRATTERA förvärrade inte ångest hos dessa patienter, vilket bestämts av Pediatric Anxiety Rating Scale (PARS). Av de 158 patienter som slutförde den dubbelblinda placebo-introduktionen, avbröt 26 (16 %) patienter studien.
en separat 16-veckors, dubbelblind, placebokontrollerad studie randomiserades 442 patienter i åldrarna 18-65, som uppfyllde DSM-IV-kriterierna för adhd och social ångest för vuxna (23 % av dem hade generaliserat ångestsyndrom). Efter en 2-veckors dubbelblind placebo-introduktion inleddes STRATTERA 10 mg med 40 mg/dag till en maximal dos på 100 mg/dag (genomsnittlig daglig dos 83 mg/dag +/- 19,5 mg/dag). STRATTERA 18 mg förvärrade inte ångest hos dessa patienter enligt Liebowitz Social Anxiety Scale (LSAS). Av de 413 patienter som slutförde den dubbelblinda placebo-introduktionen, avbröt 149 (36,1 %) patienter studien. Det har förekommit rapporter om ångest efter marknadsföring [se NEGATIVA REAKTIONER ] .
ÖVERDOS
Mänsklig erfarenhet
Det finns begränsad erfarenhet från kliniska prövningar med överdosering av STRATTERA. Under eftermarknadsföring har det rapporterats dödsfall som involverat en blandad överdos av STRATTERA 10 mg och minst ett annat läkemedel. Det har inte rapporterats om dödsfall med överdosering av enbart STRATTERA, inklusive avsiktliga överdoser i mängder upp till 1400 mg. I vissa fall av överdosering med STRATTERA har anfall rapporterats. De vanligast rapporterade symtomen som åtföljde akuta och kroniska överdoser av STRATTERA var gastrointestinala symtom, somnolens, yrsel, tremor och onormalt beteende. Hyperaktivitet och agitation har också rapporterats. Tecken och symtom som överensstämmer med mild till måttlig aktivering av det sympatiska nervsystemet (t.ex. takykardi, förhöjt blodtryck, mydriasis, muntorrhet) har också observerats. De flesta händelserna var milda till måttliga. Mindre vanligt har det förekommit rapporter om QT-förlängning och mentala förändringar, inklusive desorientering och hallucinationer [se KLINISK FARMAKOLOGI ].
Hantering av överdosering
Rådgör med ett certifierat giftkontrollcenter för uppdaterad vägledning och råd. Eftersom atomoxetin är mycket proteinbundet är det inte troligt att dialys är användbart vid behandling av överdosering.
KONTRAINDIKATIONER
Överkänslighet
STRATTERA är kontraindicerat till patienter som är kända för att vara överkänsliga mot atomoxetin eller andra beståndsdelar i produkten [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Monoaminoxidashämmare (MAO-hämmare)
STRATTERA ska inte tas tillsammans med en MAO-hämmare eller inom 2 veckor efter avslutad behandling med en MAO-hämmare. Behandling med en MAO-hämmare ska inte påbörjas inom 2 veckor efter avslutad behandling med STRATTERA. Med andra läkemedel som påverkar hjärnans monoaminkoncentrationer har det rapporterats om allvarliga, ibland dödliga reaktioner (inklusive hypertermi, stelhet, myoklonus, autonom instabilitet med möjliga snabba fluktuationer av vitala tecken och mentala statusförändringar som inkluderar extrem agitation som utvecklas till delirium och koma) när det tas i kombination med en MAO-hämmare. Vissa fall presenterades med egenskaper som liknar malignt neuroleptikasyndrom. Sådana reaktioner kan uppstå när dessa läkemedel ges samtidigt eller i omedelbar närhet [se LÄKEMEDELSINTERAKTIONER ].
Trångvinkelglaukom
I kliniska prövningar var användning av STRATTERA associerad med en ökad risk för mydriasis och därför rekommenderas användningen inte till patienter med trångvinkelglaukom.
Feokromocytom
Allvarliga reaktioner, inklusive förhöjt blodtryck och takyarytmi, har rapporterats hos patienter med feokromocytom eller en historia av feokromocytom som fått STRATTERA. Därför ska STRATTERA 18 mg inte tas av patienter med feokromocytom eller tidigare feokromocytom.
Allvarliga hjärt-kärlsjukdomar
STRATTERA 40 mg ska inte användas till patienter med allvarliga hjärt- eller kärlsjukdomar vars tillstånd förväntas försämras om de upplever förhöjningar av blodtrycket eller hjärtfrekvensen som kan vara kliniskt viktiga (till exempel 15 till 20 mm Hg i blodtrycket eller 20 slag per minut i puls). [Ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Den exakta mekanismen genom vilken atomoxetin producerar sina terapeutiska effekter vid Attention-Deficit/Hyperactivity Disorder (ADHD) är okänd, men tros vara relaterad till selektiv hämning av den presynaptiska noradrenalintransportören, vilket bestämts i ex vivo-studier för upptag och neurotransmittorutarmning. .
Farmakodynamik
En exponerings-responsanalys omfattande doser av atomoxetin (0,5, 1,2 eller 1,8 mg/kg/dag) eller placebo visade att atomoxetinexponering korrelerar med effekt mätt med Attention-Deficit/Hyperactivity Disorder Rating Scale-IV-Prent Version: Utredare administrerad och gjorde mål. Förhållandet mellan exponering och effekt liknade det som observerades mellan dos och effekt med medianexponeringar vid de två högsta doserna, vilket resulterade i nästan maximala förändringar från baslinjen [se Kliniska studier ].
Hjärtets elektrofysiologi
Effekten av STRATTERA på QTc-förlängning utvärderades i en randomiserad, dubbelblind, positiv (moxifloxacin 400 mg) och placebokontrollerad, överkorsningsstudie på friska manliga CYP2D6-metaboliserare. Totalt 120 friska försökspersoner fick STRATTERA (20 mg och 60 mg) två gånger dagligen under 7 dagar. Inga stora förändringar i QTc-intervall (dvs. ökningar >60 ms från baslinjen, absolut QTc >480 ms) observerades i studien. Små förändringar i QTc-intervall kan dock inte uteslutas från den aktuella studien, eftersom studien inte kunde visa analyskänslighet. Det var en lätt ökning av QTc-intervallet med ökad atomoxetinkoncentration.
Farmakokinetik
Atomoxetin absorberas väl efter oral administrering och påverkas minimalt av mat. Det elimineras primärt genom oxidativ metabolism genom den enzymatiska vägen cytokrom P450 2D6 (CYP2D6) och efterföljande glukuronidering. Atomoxetin har en halveringstid på cirka 5 timmar. En bråkdel av befolkningen (cirka 7 % av kaukasierna och 2 % av afroamerikanerna) är dåliga metaboliserare (PM) av CYP2D6-metaboliserade läkemedel. Dessa individer har minskad aktivitet på denna väg, vilket resulterar i 10 gånger högre AUC, 5 gånger högre maximala plasmakoncentrationer och långsammare eliminering (plasmahalveringstid på cirka 24 timmar) av atomoxetin jämfört med personer med normal aktivitet [extensiva metaboliserare (EMs) )]. Läkemedel som hämmar CYP2D6, såsom fluoxetin, paroxetin och kinidin, orsakar liknande ökningar i exponeringen.
Farmakokinetiken för atomoxetin har utvärderats hos mer än 400 barn och ungdomar i utvalda kliniska prövningar, främst med hjälp av populationsfarmakokinetiska studier. Individuella farmakokinetiska data för engångsdos och steady-state erhölls även hos barn, ungdomar och vuxna. När doserna normaliserades till mg/kg, observerades liknande halveringstid, Cmax och AUC-värden hos barn, ungdomar och vuxna. Clearance och distributionsvolym efter justering för kroppsvikt var också likartade.
Absorption och distribution
Atomoxetin absorberas snabbt efter oral administrering, med en absolut biotillgänglighet på cirka 63 % vid EM och 94 % vid PM. Maximala plasmakoncentrationer (Cmax) uppnås cirka 1 till 2 timmar efter dosering.
STRATTERA 18 mg kan administreras med eller utan mat. Administrering av STRATTERA tillsammans med en standardmåltid med hög fetthalt till vuxna påverkade inte graden av oral absorption av atomoxetin (AUC), men minskade absorptionshastigheten, vilket resulterade i en 37 % lägre Cmax och fördröjde Tmax med 3 timmar. I kliniska prövningar med barn och ungdomar resulterade administrering av STRATTERA med mat i en 9% lägre Cmax.
Distributionsvolymen vid steady-state efter intravenös administrering är 0,85 l/kg, vilket indikerar att atomoxetin huvudsakligen distribueras i hela kroppsvattnet. Distributionsvolymen är liknande över patientens viktintervall efter normalisering för kroppsvikt.
Vid terapeutiska koncentrationer är 98 % av atomoxetin i plasma bundet till protein, främst albumin.
Metabolism och eliminering
Atomoxetin metaboliseras huvudsakligen via den enzymatiska vägen CYP2D6. Personer med minskad aktivitet i denna väg (PM) har högre plasmakoncentrationer av atomoxetin jämfört med personer med normal aktivitet (EM). För PM är AUC för atomoxetin cirka 10 gånger och Css, max är cirka 5 gånger högre än EM. Laboratorietester finns tillgängliga för att identifiera CYP2D6 PM. Samtidig administrering av STRATTERA med potenta hämmare av CYP2D6, såsom fluoxetin, paroxetin eller kinidin, resulterar i en avsevärd ökning av plasmaexponeringen för atomoxetin, och dosjustering kan vara nödvändig [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Atomoxetin hämmade eller inducerade inte CYP2D6-vägen.
Den huvudsakliga oxidativa metaboliten som bildas, oavsett CYP2D6-status, är 4-hydroxiatomoxetin, som är glukuroniderat. 4-Hydroxyatomoxetin är ekvipotent med atomoxetin som en hämmare av noradrenalintransportören men cirkulerar i plasma vid mycket lägre koncentrationer (1 % av atomoxetinkoncentrationen i EM och 0,1 % av atomoxetinkoncentrationen i PM). 4-Hydroxyatomoxetin bildas främst av CYP2D6, men i PM bildas 4-hydroxyatomoxetin i långsammare takt av flera andra cytokrom P450-enzymer. N-desmetylatomoxetin bildas av CYP2C19 och andra cytokrom P450-enzymer, men har väsentligt mindre farmakologisk aktivitet jämfört med atomoxetin och cirkulerar i plasma vid lägre koncentrationer (5 % av atomoxetinkoncentrationen i EM och 45 % av atomoxetinkoncentrationen i PM).
Genomsnittlig skenbar plasmaclearance av atomoxetin efter oral administrering hos vuxna EM är 0,35 l/timme/kg och den genomsnittliga halveringstiden är 5,2 timmar. Efter oral administrering av atomoxetin till PM är den genomsnittliga skenbara plasmaclearancen 0,03 l/timme/kg och den genomsnittliga halveringstiden är 21,6 timmar. För PM är AUC för atomoxetin cirka 10 gånger och Css, max är cirka 5 gånger högre än EM. Elimineringshalveringstiden för 4-hydroxiatomoxetin liknar den för N-desmetylatomoxetin (6 till 8 timmar) hos patienter med EM, medan halveringstiden för N-desmetylatomoxetin är mycket längre hos patienter med PM (34 till 40 timmar).
Atomoxetin utsöndras primärt som 4-hydroxiatomoxetin-O-glukuronid, främst i urinen (mer än 80 % av dosen) och i mindre utsträckning i avföringen (mindre än 17 % av dosen). Endast en liten del av dosen STRATTERA 40 mg utsöndras som oförändrat atomoxetin (mindre än 3 % av dosen), vilket tyder på omfattande biotransformation.
[Ser Användning i specifika populationer ].
Kliniska studier
ADHD-studier hos barn och ungdomar
Akuta studier
Effektiviteten av STRATTERA 40 mg vid behandling av ADHD fastställdes i 4 randomiserade, dubbelblinda, placebokontrollerade studier på pediatriska patienter (6 till 18 år). Ungefär en tredjedel av patienterna uppfyllde DSM-IV-kriterierna för ouppmärksam subtyp och två tredjedelar uppfyllde kriterierna för både ouppmärksamma och hyperaktiva/impulsiva subtyper.
Tecken och symtom på ADHD utvärderades genom en jämförelse av genomsnittlig förändring från baslinje till effektmått för STRATTERA- och placebobehandlade patienter med hjälp av en avsiktsanalys av det primära resultatmåttet, utredaren administrerade och bedömde ADHD Rating Scale-IV- Totalpoäng för överordnad version (ADHDRS) inklusive hyperaktiva/impulsiva och ouppmärksamma subskalor. Varje post på ADHDRS mappar direkt till ett symptomkriterium för ADHD i DSM-IV.
studie 1, en 8-veckors randomiserad, dubbelblind, placebokontrollerad, dos-respons, akut behandlingsstudie av barn och ungdomar i åldern 8 till 18 (N=297), fick patienterna antingen en fast dos av STRATTERA (0,5, 1,2 eller 1,8 mg/kg/dag) eller placebo. STRATTERA 10 mg administrerades som en uppdelad dos tidigt på morgonen och sen eftermiddag/tidig kväll. Vid de 2 högre doserna var förbättringar av ADHD-symtom statistiskt signifikant överlägsna hos STRATTERA-behandlade patienter jämfört med placebobehandlade patienter, mätt på ADHDRS-skalan. Dosen på 1,8 mg/kg/dag STRATTERA 25 mg gav ingen ytterligare fördel jämfört med den som observerades med dosen 1,2 mg/kg/dag. STRATTERA-dosen på 0,5 mg/kg/dag var inte överlägsen placebo.
studie 2, en 6-veckors randomiserad, dubbelblind, placebokontrollerad, akut behandlingsstudie av barn och ungdomar i åldern 6 till 16 (N=171), fick patienterna antingen STRATTERA 40 mg eller placebo. STRATTERA administrerades som en engångsdos tidigt på morgonen och titrerades på viktjusterad basis i enlighet med kliniskt svar, upp till en maximal dos på 1,5 mg/kg/dag. Den genomsnittliga slutdosen av STRATTERA 10 mg var cirka 1,3 mg/kg/dag. ADHD-symtom var statistiskt signifikant förbättrade på STRATTERA jämfört med placebo, mätt på ADHDRS-skalan. Denna studie visar att STRATTERA är effektivt när det administreras en gång dagligen på morgonen.
2 identiska, 9-veckors, akuta, randomiserade, dubbelblinda, placebokontrollerade studier av barn i åldern 7 till 13 (Studie 3, N=147; Studie 4, N=144), jämfördes STRATTERA 40 mg och metylfenidat med placebo . STRATTERA 18 mg administrerades som en uppdelad dos tidigt på morgonen och sen eftermiddag (efter skolan) och titrerades på viktjusterad basis i enlighet med kliniskt svar. Den maximala rekommenderade dosen av STRATTERA var 2,0 mg/kg/dag. Den genomsnittliga slutdosen av STRATTERA 18 mg för båda studierna var cirka 1,6 mg/kg/dag. I båda studierna förbättrades ADHD-symtomen statistiskt signifikant mer på STRATTERA 10 mg än på placebo, mätt på ADHDRS-skalan.
Undersökning av populationsundergrupper baserade på kön och ålder (
Underhållsstudie
Effektiviteten av STRATTERA 18 mg vid underhållsbehandling av ADHD fastställdes i en öppenvårdsstudie på barn och ungdomar (6-15 år). Patienter som uppfyllde DSM-IV-kriterierna för ADHD och som visade kontinuerligt svar i cirka 4 veckor under en första 10 veckors öppen behandlingsfas med STRATTERA (1,2 till 1,8 mg/kg/dag) randomiserades till att fortsätta med sin nuvarande dos av STRATTERA (N =292) eller till placebo (N=124) under dubbelblind behandling för observation av återfall. Respons under den öppna fasen definierades som CGI-ADHD-S-poäng ≤2 och en minskning med minst 25 % från baslinjen i ADHDRS-IV-Parent:Inv totalpoäng. Patienter som tilldelades STRATTERA och visade kontinuerligt svar under cirka 8 månader under den första dubbelblinda behandlingsfasen randomiserades återigen till att fortsätta med sin nuvarande dos av STRATTERA (N=81) eller till placebo (N=82) under dubbelblinda behandling. behandling för observation av återfall. Återfall under den dubbelblinda fasen definierades som en ökning av CGI-ADHD-S-poängen med minst 2 från slutet av den öppna fasen och ADHDRS-IV-Parent:Inv-totalpoängen återgår till ≥90 % av studiestartpoängen för 2 på varandra följande besök. I båda de dubbelblinda faserna upplevde patienter som fick fortsatt behandling med STRATTERA signifikant längre tid för återfall än de som fick placebo.
ADHD-studier hos vuxna
Effektiviteten av STRATTERA vid behandling av ADHD fastställdes i 2 randomiserade, dubbelblinda, placebokontrollerade kliniska studier av vuxna patienter, 18 år och äldre, som uppfyllde DSM-IV-kriterierna för ADHD.
Tecken och symtom på ADHD utvärderades med den utredare administrerade Conners Adult ADHD Rating Scale Screening Version (CAARS), en skala med 30 punkter. Det primära effektivitetsmåttet var totalt ADHD-symtompoäng på 18 punkter (summan av underskalorna för ouppmärksam och hyperaktivitet/impulsivitet från CAARS) utvärderad genom en jämförelse av genomsnittlig förändring från baslinje till effektmått med hjälp av en avsikt-att-behandla-analys.
2 identiska, 10 veckor långa, randomiserade, dubbelblinda, placebokontrollerade akuta behandlingsstudier (Studie 5, N=280; Studie 6, N=256) fick patienterna antingen STRATTERA 25 mg eller placebo. STRATTERA administrerades som en uppdelad dos tidigt på morgonen och sen eftermiddag/tidig kväll och titrerades enligt kliniskt svar inom intervallet 60 till 120 mg/dag. Den genomsnittliga slutdosen av STRATTERA 40 mg för båda studierna var cirka 95 mg/dag. I båda studierna förbättrades ADHD-symtomen statistiskt signifikant på STRATTERA, mätt på ADHD-symtompoängen från CAARS-skalan.
Undersökning av populationsundergrupper baserade på kön och ålder (
PATIENTINFORMATION
STRATTERA® (Stra-TAIR-a) (atomoxetin) Kapslar
Läs medicinguiden som medföljer STRATTERA® innan du eller ditt barn börjar ta den och varje gång du får påfyllning. Det kan komma ny information. Denna medicineringsguide ersätter inte att prata med din läkare om din behandling eller ditt barns behandling med STRATTERA.
Vilken är den viktigaste informationen jag borde veta om STRATTERA 18mg?
Följande har rapporterats vid användning av STRATTERA:
Barn och tonåringar tänker ibland på självmord, och många rapporterar att de försöker ta livet av sig. Resultat från STRATTERA kliniska studier med över 2200 barn eller tonåringar med ADHD-patienter tyder på att vissa barn och tonåringar kan ha en högre chans att få självmordstankar eller självmordstankar. Även om inga självmord inträffade i dessa studier, utvecklade 4 av 1000 patienter självmordstankar. Berätta för ditt barn eller tonårings läkare om ditt barn eller tonåring (eller det finns en familjehistoria av):
- har bipolär sjukdom (manodepressiv sjukdom)
- hade självmordstankar eller självmordshandlingar innan du började med STRATTERA
Risken för självmordstankar och handlingar kan vara högre:
- tidigt under behandlingen med STRATTERA 10 mg
- under dosjusteringar
Förhindra självmordstankar och självmordshandlingar hos ditt barn eller tonåring genom att:
- uppmärksamma ditt barns eller tonårings humör, beteenden, tankar och känslor under behandlingen med STRATTERA 25 mg
- hålla alla uppföljningsbesök hos ditt barns eller tonårings läkare enligt schemat
Se upp för följande tecken hos ditt barn eller tonåring under behandlingen med STRATTERA 25 mg:
- ångest
- agitation
- panikattacker
- sömnproblem
- irritabilitet
- fientlighet
- aggressivitet
- impulsivitet
- rastlöshet
- mani
- depression
- självmordstankar
Ring din barns eller tonårings läkare omedelbart om de har något av ovanstående tecken, särskilt om de är nya, plötsliga eller allvarliga. Ditt barn eller tonåring kan behöva övervakas noga för självmordstankar och -handlingar eller behöver en förändring i medicin.
STRATTERA kan orsaka leverskada hos vissa patienter. Ring din läkare omedelbart om du eller ditt barn har följande tecken på leverproblem:
- klåda
- höger övre magsmärta
- mörk urin
- gul hud eller ögon
- oförklarliga influensaliknande symtom
- plötslig död hos patienter som har hjärtproblem eller hjärtfel
- stroke och hjärtinfarkt hos vuxna
- ökat blodtryck och hjärtfrekvens
Tala om för din läkare om du eller ditt barn har några hjärtproblem, hjärtfel, högt blodtryck eller en familjehistoria av dessa problem. Din läkare bör kontrollera dig eller ditt barn noggrant med avseende på hjärtproblem innan du börjar med STRATTERA.
Din läkare bör kontrollera ditt blodtryck eller ditt barns blodtryck och hjärtfrekvens regelbundet under behandling med STRATTERA.
Ring din läkare omedelbart om du eller ditt barn har några tecken på hjärtproblem som bröstsmärtor, andnöd eller svimning när du tar STRATTERA.
- nya psykotiska symtom (som att höra röster, tro på saker som inte är sant, vara misstänksam) eller nya maniska symtom
Ring ditt barns eller tonårings läkare omedelbart om eventuella nya psykiska symtom eftersom justering eller avbrytande av behandlingen med STRATTERA 40 mg kan behöva övervägas.
Vad är STRATTERA 18mg?
STRATTERA är ett selektivt noradrenalinåterupptagshämmande läkemedel. Det används för behandling av uppmärksamhetsbrist och hyperaktivitetsstörning (ADHD). STRATTERA kan hjälpa till att öka uppmärksamheten och minska impulsivitet och hyperaktivitet hos patienter med ADHD.
STRATTERA 10 mg ska användas som en del av ett totalt behandlingsprogram för ADHD som kan innefatta rådgivning eller andra terapier.
STRATTERA har inte studerats på barn yngre än 6 år.
Vem ska inte ta STRATTERA?
STRATTERA ska inte tas om du eller ditt barn:
- tar eller har tagit under de senaste 14 dagarna ett läkemedel mot depression som kallas monoaminoxidashämmare eller MAO-hämmare. Några namn på MAO-hämmare är Nardil® (fenelzinsulfat), Parnate® (tranylcyprominsulfat) och Emsam® (selegilin transdermalt system).
- har ett ögonproblem som kallas trångvinkelglaukom
- är allergiska mot något i STRATTERA. Se slutet av denna medicinguide för en komplett lista över ingredienser.
- har eller har haft en sällsynt tumör som kallas feokromocytom.
STRATTERA kanske inte är rätt för dig eller ditt barn. Innan du börjar med STRATTERA berätta för din läkare eller ditt barns läkare om alla hälsotillstånd (eller en familjehistoria av) inklusive:
- har eller haft självmordstankar eller -handlingar
- hjärtproblem, hjärtfel, oregelbunden hjärtrytm, högt blodtryck eller lågt blodtryck
- psykiska problem, psykos, mani, bipolär sjukdom eller depression
- leverproblem Tala om för din läkare om du eller ditt barn är gravid, planerar att bli gravid eller ammar.
Kan STRATTERA tas tillsammans med andra läkemedel?
Berätta för din läkare om alla läkemedel som du eller ditt barn tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. STRATTERA och vissa läkemedel kan interagera med varandra och orsaka allvarliga biverkningar. Din läkare kommer att avgöra om STRATTERA kan tas tillsammans med andra läkemedel.
Tala särskilt om för din läkare om du eller ditt barn tar:
- astmamediciner
- läkemedel mot depression inklusive MAO-hämmare
- blodtrycksmediciner
- förkylnings- eller allergiläkemedel som innehåller avsvällande medel
Vet vilka mediciner du eller ditt barn tar. Ha en lista över dina mediciner med dig för att visa din läkare och apotekspersonal.
Börja inte med något nytt läkemedel medan du tar STRATTERA utan att först tala med din läkare.
Hur ska STRATTERA tas?
- Ta STRATTERA 40mg precis som ordinerats. STRATTERA 18mg finns i kapslar med olika dosstyrkor. Din läkare kan justera dosen tills den är rätt för dig eller ditt barn.
- Tugga, krossa eller öppna inte kapslarna. Svälj STRATTERA kapslar hela med vatten eller andra vätskor. Tala om för din läkare om du eller ditt barn inte kan svälja STRATTERA 10 mg hel. Ett annat läkemedel kan behöva förskrivas.
- Undvik att röra en trasig STRATTERA 18 mg kapsel. Tvätta händer och ytor som berörde en öppen STRATTERA 10 mg kapsel. Om något av pulvret kommer i dina ögon eller ditt barns ögon, skölj genast med vatten och kontakta din läkare.
- STRATTERA kan tas med eller utan mat.
- STRATTERA 10 mg tas vanligtvis en eller två gånger om dagen. Ta STRATTERA 25 mg vid samma tidpunkt varje dag för att hjälpa dig komma ihåg. Om du missar en dos STRATTERA, ta den så snart du kommer ihåg den dagen. Om du missar en dag med STRATTERA 10 mg, dubbla inte din dos nästa dag. Hoppa bara över dagen du missade.
- Då och då kan din läkare avbryta behandlingen med STRATTERA 25 mg ett tag för att kontrollera ADHD-symtom.
- Din läkare kan göra regelbundna kontroller av blod, hjärta och blodtryck medan du tar STRATTERA. Barn bör ofta kontrollera sin längd och vikt när de tar STRATTERA. Behandlingen med STRATTERA kan avbrytas om ett problem upptäcks under dessa kontroller.
- Om du eller ditt barn tar för mycket STRATTERA eller överdoser, ring din läkare eller giftkontrollcentral omedelbart eller få akut behandling.
Vilka är möjliga biverkningar av STRATTERA?
Ser "Vilken är den viktigaste informationen jag borde veta om STRATTERA 10mg?" för information om rapporterade självmordstankar och -handlingar, andra psykiska problem, allvarliga leverskador och hjärtproblem.
Andra allvarliga biverkningar inkluderar:
- allvarliga allergiska reaktioner (ringa din läkare om du har svårt att andas, ser svullnad eller nässelfeber eller upplever andra allergiska reaktioner)
- bromsning av tillväxten (längd och vikt) hos barn
- problem med urinering inklusive
- problem med att starta eller hålla en urinström
- kan inte tömma blåsan helt
Vanliga biverkningar hos barn och tonåringar inkluderar:
- orolig mage
- minskad aptit
- illamående eller kräkningar
- yrsel
- trötthet
- humörsvängningar
Vanliga biverkningar hos vuxna inkluderar:
- förstoppning
- torr mun
- illamående
- minskad aptit
- yrsel
- sexuella biverkningar
- problem med att kissa
Annan information för barn, tonåringar och vuxna:
- Erektioner som inte försvinner (priapism) har förekommit sällan under behandling med STRATTERA. Om du har en erektion som varar mer än 4 timmar, sök medicinsk hjälp omedelbart. På grund av risken för bestående skada, inklusive den potentiella oförmågan att få erektion, bör priapism omedelbart utvärderas av en läkare.
- STRATTERA 10 mg kan påverka din förmåga eller ditt barns förmåga att köra bil eller använda tunga maskiner. Var försiktig tills du vet hur STRATTERA 25 mg påverkar dig eller ditt barn.
- Tala med din läkare om du eller ditt barn har biverkningar som är besvärande eller inte försvinner.
Detta är inte en komplett lista över möjliga biverkningar. Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara STRATTERA?
- Förvara STRATTERA på en säker plats i rumstemperatur, 59 till 86°F (15 till 30°C).
- Förvara STRATTERA 40 mg och alla läkemedel utom räckhåll för barn.
Allmän information om STRATTERA
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte STRATTERA 25 mg för ett tillstånd som det inte ordinerats för. Ge inte STRATTERA andra personer, även om de har samma tillstånd. Det kan skada dem.
Den här medicineringsguiden sammanfattar den viktigaste informationen om STRATTERA. Om du vill ha mer information, prata med din läkare. Du kan fråga din läkare eller apotekspersonal om information om STRATTERA som är skriven för sjukvårdspersonal. För mer information om STRATTERA ring 1-800-Lilly-Rx (1-800-545-5979) eller besök www.strattera.com.
Vilka är ingredienserna i STRATTERA 40mg?
Aktiv beståndsdel: atomoxetinhydroklorid.
Inaktiva Ingredienser: förgelatinerad stärkelse, dimetikon, gelatin, natriumlaurylsulfat, FD&CBlue No. 2, syntetisk gul järnoxid, titandioxid, röd järnoxid och ätbart svart bläck.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
