Prandin 0.5mg, 1mg, 2mg Repaglinide Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Prandin 2mg och hur används det?
Prandin 1mg är ett receptbelagt läkemedel som används för att behandla symtom på typ 2-diabetes mellitus. Prandin kan användas ensamt eller tillsammans med andra läkemedel.
Prandin tillhör en klass av läkemedel som kallas antidiabetika, Maglitinides Derivates.
Det är inte känt om Prandin 1mg är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Prandin?
Prandin kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- svår smärta i övre delen av magen sprider sig till ryggen,
- illamående,
- kräkningar,
- snabb puls,
- blek eller gulnad hud,
- mörkfärgad urin,
- feber,
- förvirring,
- svaghet,
- öm hals,
- brännande i dina ögon,
- hudsmärta och
- följt av ett rött eller lila hudutslag som sprider sig (särskilt i ansiktet eller överkroppen) och orsakar blåsor och fjällning
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Prandin inkluderar:
- lågt blodsocker,
- illamående,
- diarre,
- huvudvärk,
- ryggont,
- ledvärk och
- förkylningssymtom (täppt näsa, nysningar, ont i halsen)
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Prandin. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
PRANDIN (repaglinid) är ett oralt blodsockersänkande läkemedel av glinidklassen. Repaglinid, S(+)2-etoxi-4(2((3-metyl-1-(2-(1piperidinyl)fenyl)-butyl)amino)-2-oxoetyl)bensoesyra, är kemiskt obesläktad med oralt sulfonylurea-insulin sekretagoger.
Strukturformel för repaglinid
Repaglinid är ett vitt till benvitt pulver med molekylformel C27H36N2O4 och en molekylvikt på 452,6. PRANDIN tabletter innehåller 0,5 mg, 1 mg eller 2 mg repaglinid. Dessutom innehåller varje tablett följande inaktiva ingredienser: kalciumvätefosfat (vattenfritt), mikrokristallin cellulosa, majsstärkelse, polakrilinkalium, povidon, glycerol (85%), magnesiumstearat, meglumin och poloxamer. 1 mg och 2 mg tabletterna innehåller järnoxider (gula respektive röda) som färgämnen.
INDIKATIONER
PRANDIN är indicerat som ett komplement till kost och träning för att förbättra glykemisk kontroll hos vuxna med typ 2-diabetes mellitus.
Användningsbegränsning
PRANDIN ska inte användas till patienter med typ 1-diabetes mellitus eller för behandling av diabetisk ketoacidos.
DOSERING OCH ADMINISTRERING
Rekommenderad dosering och administrering
Den rekommenderade startdosen för patienter vars HbA1c är mindre än 8 % är 0,5 mg oralt före varje måltid. För patienter vars HbA1c är 8 % eller högre är startdosen 1 eller 2 mg oralt före varje måltid.
Det rekommenderade dosintervallet är 0,5 mg till 4 mg före måltid, med en maximal daglig dos på 16 mg. Patientens dos ska fördubblas upp till 4 mg med varje måltid tills tillfredsställande glykemisk kontroll uppnås. Minst en vecka bör dröja för att bedöma svaret efter varje dosjustering.
Instruera patienterna att ta PRANDIN inom 30 minuter före måltid. PRANDIN 2mg kan doseras 2, 3 eller 4 gånger om dagen som svar på förändringar i patientens måltidsmönster.
Hos patienter som hoppar över måltider, instruera patienterna att hoppa över den schemalagda dosen PRANDIN 1 mg för att minska risken för hypoglykemi. Hos patienter som upplever hypoglykemi bör dosen PRANDIN 1 mg minskas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Patienter med gravt nedsatt njurfunktion
Hos patienter med gravt nedsatt njurfunktion (CrCl = 20 till 40 ml/min) initieras PRANDIN 0,5 mg oralt före varje måltid. Titrera gradvis dosen, om det behövs för att uppnå glykemisk kontroll.
Dosändringar för läkemedelsinteraktioner
Dosjusteringar rekommenderas för patienter som samtidigt tar starka CYP3A4- eller CYP2C8-hämmare eller starka CYP3A4- eller CYP2C8-inducerare [se LÄKEMEDELSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Samtidig användning med gemfibrozil är kontraindicerad [se KONTRAINDIKATIONER ].
Undvik samtidig användning av PRANDIN 2mg och klopidogrel. Om samtidig användning inte kan undvikas, påbörja PRANDIN med 0,5 mg före varje måltid och överskrid inte en total daglig dos på 4 mg [se LÄKEMEDELSINTERAKTIONER , KLINISK FARMAKOLOGI ].
Överskrid inte en total daglig dos på 6 mg PRANDIN 2 mg hos patienter som får ciklosporin [se LÄKEMEDELSINTERAKTIONER , KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
- mg tabletter (gula, runda, bikonvexa tabletter, präglade med "745" på ena sidan och "C" på den andra sidan)
- 2 mg tabletter (rosa, runda, bikonvexa tabletter, präglade med "747" på ena sidan och "C" på den andra sidan)
PRANDIN (repaglinid) tabletter, 1 mg , levereras som gula, runda, bikonvexa tabletter, präglade med ”745” på ena sidan och ”C” på den andra sidan. De finns tillgängliga enligt följande:
100 flaskor NDC 60846-882-01
PRANDIN (repaglinid) tabletter, 2 mg , levereras som rosa, runda, bikonvexa tabletter, präglade med "747" på ena sidan och "C" på den andra sidan. De finns tillgängliga enligt följande:
100 flaskor NDC 60846-884-01
Förvara vid 20° till 25°C (68° till 77°F) [se USP kontrollerad rumstemperatur]. Skydda mot fukt. Förvara flaskorna väl tillslutna.
Dispensera i täta behållare med säkerhetsförslutningar.
Distribuerat av: Amneal Specialty, en division av Amneal Pharmaceuticals LLC Bridgewater, NJ 08807. Reviderad: Mar 2019
BIEFFEKTER
Följande allvarliga biverkningar beskrivs också på andra ställen i märkningen:
Hypoglykemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar utförs under vitt skilda utformningar, kan det hända att de biverkningsfrekvenser som rapporterats i en klinisk prövning inte är lätta att jämföra med de frekvenser som rapporterats i en annan klinisk prövning, och kanske inte återspeglar de frekvenser som faktiskt observerats i klinisk praxis.
PRANDIN 1mg har administrerats till 2931 individer under kliniska prövningar. Ungefär 1500 av dessa individer med typ 2-diabetes har behandlats i minst 3 månader, 1000 i minst 6 månader och 800 i minst 1 år. Majoriteten av dessa individer (1228) fick PRANDIN i en av fem 1-åriga, aktivt kontrollerade studier. Under ett år avbröts 13 % av PRANDIN 1 mg patienter på grund av biverkningar. De vanligaste biverkningarna som ledde till abstinens var hyperglykemi, hypoglykemi och relaterade symtom.
Tabell 1 listar de vanligaste biverkningarna för PRANDIN-patienter jämfört med placebo i prövningar på 12 till 24 veckor.
Hypoglykemi
I kliniska prövningar med PRANDIN 1 mg är hypoglykemi den vanligast observerade biverkningen. Mild eller måttlig hypoglykemi inträffade hos 31 % av PRANDIN 1 mg-behandlade patienter och 7 % av placebobehandlade patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hypoglykemi rapporterades hos 16 % av 1228 PRANDIN-patienter, 20 % av 417 glyburidpatienter och 19 % av 81 glipizidpatienter i 1-åriga kontrollerade studier. Av PRANDIN-behandlade patienter med symtomatisk hypoglykemi utvecklade ingen koma eller krävde sjukhusvistelse.
I en 24-veckors placebokontrollerad studie hade patienter som var naiva till oral behandling med hypoglykemiska medel och patienter med ett HbA1c under 8 % vid baslinjen en högre frekvens av hypoglykemi.
Viktökning
Det fanns ingen genomsnittlig ökning i kroppsvikt när patienter som tidigare behandlats med orala hypoglykemiska medel byttes till PRANDIN. Den genomsnittliga viktökningen hos patienter som behandlats med PRANDIN 0,5 mg och som inte tidigare behandlats med sulfonylureapreparat var 3,3 %.
Kardiovaskulära händelser
Incidensen av totala allvarliga kardiovaskulära biverkningar, inklusive ischemi, var högre för PRANDIN (51/1228 eller 4 %) än för sulfonylurealäkemedel (13/498 eller 3 %) i kontrollerade kliniska jämförelsestudier.
Sju kontrollerade kliniska prövningar inkluderade PRANDIN kombinationsbehandling med NPH-insulin (n=431), enbart insulinformuleringar (n=388) eller andra kombinationer (sulfonylurea plus NPH-insulin eller PRANDIN 1 mg plus metformin) (n=120). Det förekom sex allvarliga biverkningar av myokardischemi hos patienter som behandlades med PRANDIN 0,5 mg plus NPH-insulin från två studier, och en händelse hos patienter som använde enbart insulinformuleringar från en annan studie [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kombinationsterapi med tiazolidindioner
Hypoglykemi
Under 24-veckors behandlingsstudier med PRANDIN-rosiglitazon eller PRANDIN-pioglitazon kombinationsbehandling (totalt 250 patienter i kombinationsterapi), inträffade hypoglykemi (blodsocker
Perifert ödem och hjärtsvikt
Perifert ödem rapporterades hos 12 av 250 (4,8 %) PRANDIN-tiazolidindion-kombinationspatienter och 3 av 124 (2,4 %) tiazolidindion-monoterapipatienter, utan några fall rapporterade i dessa studier för PRANDIN-monoterapi. Det fanns rapporter hos 2 av 250 patienter (0,8 %) som behandlades med PRANDIN-tiazolidindionbehandling av episoder av ödem med kronisk hjärtsvikt. Båda patienterna hade tidigare kranskärlssjukdom och återhämtade sig efter behandling med diuretika. Inga jämförbara fall i monoterapibehandlingsgrupperna rapporterades.
Viktökning
Genomsnittlig viktökning i samband med kombinations-, PRANDIN- och pioglitazonbehandling var 5,5 kg, 0,3 kg respektive 2,0 kg. Genomsnittlig viktökning associerad med kombinations-, PRANDIN- och rosiglitazonbehandling var 4,5 kg, 1,3 kg respektive 3,3 kg.
Sällsynta biverkningar (
Mindre vanliga biverkningar som observerats i kliniska prövningar inkluderade förhöjda leverenzymer, trombocytopeni, leukopeni och anafylaktoida reaktioner.
Erfarenhet efter marknadsföring
Följande ytterligare biverkningar har identifierats efter användning av PRANDIN efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det i allmänhet inte möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller ett orsakssamband till läkemedelsexponering.
- Alopeci
- Hemolytisk anemi
- Pankreatit
- Stevens-Johnsons syndrom
- Allvarlig leverdysfunktion inklusive gulsot och hepatit
LÄKEMEDELSINTERAKTIONER
Kliniskt viktiga läkemedelsinteraktioner med PRANDIN
Tabell 3 innehåller en lista över läkemedel med kliniskt viktiga läkemedelsinteraktioner när de administreras samtidigt med PRANDIN 1 mg och instruktioner för att förebygga eller hantera dem.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Hypoglykemi
Alla glinider, inklusive PRANDIN 0,5 mg, kan orsaka hypoglykemi [se NEGATIVA REAKTIONER ]. Allvarlig hypoglykemi kan orsaka anfall, kan vara livshotande eller orsaka dödsfall. Hypoglykemi kan försämra koncentrationsförmågan och reaktionstiden; detta kan utsätta en individ och andra för risker i situationer där dessa förmågor är viktiga (t.ex. att köra bil eller använda andra maskiner).
Hypoglykemi kan inträffa plötsligt och symtomen kan skilja sig åt hos varje individ och förändras över tid hos samma individ. Symtomatisk medvetenhet om hypoglykemi kan vara mindre uttalad hos patienter med långvarig diabetes, hos patienter med diabetisk nervsjukdom, hos patienter som använder mediciner som blockerar det sympatiska nervsystemet (t.ex. betablockerare) [se LÄKEMEDELSINTERAKTIONER ], eller hos patienter som upplever återkommande hypoglykemi.
Faktorer som kan öka risken för hypoglykemi inkluderar förändringar i måltidsmönster (t.ex. innehåll av makronäringsämnen), förändringar i nivå av fysisk aktivitet, förändringar av samtidigt administrerad medicin [se LÄKEMEDELSINTERAKTIONER ], och samtidig användning med andra antidiabetika. Patienter med nedsatt njur- eller leverfunktion kan löpa högre risk för hypoglykemi [se Användning i specifika populationer ].
Patienter bör administrera PRANDIN 0,5 mg före måltid och instrueras att hoppa över dosen av PRANDIN om en måltid hoppas över. Hos patienter som upplever hypoglykemi bör dosen av PRANDIN minskas [se DOSERING OCH ADMINISTRERING ]. Patienter och vårdgivare måste utbildas för att känna igen och hantera hypoglykemi. Självkontroll av blodsocker spelar en viktig roll för att förebygga och hantera hypoglykemi. Hos patienter med högre risk för hypoglykemi och patienter som har minskat symtomatisk medvetenhet om hypoglykemi, rekommenderas ökad frekvens av blodsockerövervakning.
Allvarliga kardiovaskulära biverkningar vid samtidig användning med NPH-insulin
sju kontrollerade studier förekom sex allvarliga biverkningar av myokardischemi hos patienter behandlade med PRANDIN 0,5 mg plus NPH-insulin från två studier, och en händelse hos patienter som använde enbart insulinformuleringar från en annan studie [se NEGATIVA REAKTIONER ]. PRANDIN är inte indicerat för användning i kombination med NPH-insulin.
Makrovaskulära resultat
Det har inte gjorts några kliniska studier som har fastställt avgörande bevis för minskning av makrovaskulär risk med PRANDIN.

Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
en 104-veckors karcinogenicitetsstudie på råttor vid doser upp till 120 mg/kg/dag, vilket är cirka 60 gånger klinisk exponering på mg/m2-basis, ökade förekomsten av benigna adenom i sköldkörteln och levern hos hanråttor. Inga tecken på cancerogenicitet hittades hos honråttor. Den högre förekomsten av sköldkörtel- och levertumörer hos råttor av hankön sågs inte vid lägre dos på 30 mg/kg/dag respektive 60 mg/kg/dag (vilket är över 15 respektive 30 gånger klinisk exponering på en mg/m2) grund). I en 104-veckors karcinogenicitetsstudie på möss vid doser upp till 500 mg/kg/dag fann man inga tecken på karcinogenicitet hos möss (vilket är cirka 125 gånger klinisk exponering på mg/m2 basis).
Repaglinid var icke-gentoxiskt i en rad in vivo- och in vitro-studier: bakteriell mutagenes (Ames-test), in vitro framåtcellsmutationsanalys i V79-celler (HGPRT), in vitro-analys av kromosomavvikelser i humana lymfocyter, oplanerad och replikerande DNA-syntes i råttlever och in vivo mikrokärntest på mus och råtta.
I en fertilitetsstudie på råtta administrerades repaglinid till han- och honråttor i doser upp till 300 respektive 80 mg/kg/dag. Inga negativa effekter på fertiliteten observerades (vilka är över 40 gånger klinisk exponering på mg/m2-basis).
Användning i specifika populationer
Graviditet
Risksammanfattning
Begränsade data med användning av PRANDIN och repaglinid hos gravida kvinnor är otillräckliga för att informera om en läkemedelsrelaterad risk för allvarliga fosterskador eller missfall. Det finns risker för modern och fostret i samband med dåligt kontrollerad diabetes under graviditeten [se Kliniska överväganden ].
Repaglidin visade sig inte vara teratogent i djurstudier (råttor och kaniner). Embryotoxicitet, onormal utveckling av extremiteter hos råttfoster observerades hos honråttor som exponerades för höga doser i det sista skedet av graviditeten.
Den uppskattade bakgrundsrisken för allvarliga fosterskador är 6 % till 10 % hos kvinnor med pre-gestationell diabetes med HbA1c >7 och har rapporterats vara så hög som 20 % till 25 % hos kvinnor med HbA1c >10. Den uppskattade bakgrundsrisken för missfall för den indikerade populationen är okänd. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Kliniska överväganden
Sjukdomsrelaterad risk för modern och/eller embryo/foster
Dåligt kontrollerad diabetes under graviditeten ökar moderns risk för diabetisk ketoacidos, havandeskapsförgiftning, spontana aborter, för tidig förlossning, dödfödsel och förlossningskomplikationer. Dåligt kontrollerad diabetes ökar fostrets risk för stora fosterskador, dödfödsel och makrosomirelaterad sjuklighet.
Data
Mänskliga data
Det finns inga adekvata data om utvecklingsriskerna förknippade med användning av PRANDIN 2mg hos gravida kvinnor.
Djurdata
Repaglinid var inte teratogent hos råttor eller kaniner vid doser 40 gånger (råtta) och cirka 0,8 gånger (kanin) klinisk exponering (på mg/m2-basis) under hela graviditeten. Avkommor till råttdamer som exponerats för repaglinid vid 15 gånger klinisk exponering på mg/m2-basis under dag 17 till 22 av dräktigheten och under laktation utvecklade icke-teratogene skelettdeformiteter bestående av förkortning, förtjockning och böjning av överarmsbenet under den postnatala perioden. Denna effekt sågs inte vid doser upp till 2,5 gånger klinisk exponering (på mg/m2-basis) på dag 1 till 22 av graviditeten eller vid högre doser som gavs under dag 1 till 16 av graviditeten.
Laktation
Risksammanfattning
Det finns ingen information om förekomsten av PRANDIN 0,5 mg i bröstmjölk, effekterna på det ammande barnet eller effekterna på mjölkproduktionen. Repaglinid upptäcktes i råttmjölk, men på grund av artspecifika skillnader i laktationsfysiologi kan djurdata inte tillförlitligt förutsäga läkemedelsnivåer i bröstmjölk. Utvecklingen och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av PRANDIN och eventuella negativa effekter på det ammade barnet från PRANDIN eller från underliggande moderns tillstånd.
Kliniska överväganden
Även om det inte är känt om repaglinid utsöndras i bröstmjölk är vissa orala medel kända för att utsöndras via denna väg. Eftersom risken för hypoglykemi hos ammande spädbarn kan finnas, och på grund av effekterna på ammande djur, bör ett beslut fattas om huruvida PRANDIN ska avbrytas hos ammande mödrar eller om mammor ska avbryta amningen. Om PRANDIN sätts ut och om enbart kosten är otillräcklig för att kontrollera blodsockret, bör insulinbehandling övervägas.
Data
I reproduktionsstudier på råttor upptäcktes mätbara nivåer av repaglinid i modersmjölken och sänkta blodsockernivåer observerades hos ungarna. Korsfrämjande studier indikerade att skelettförändringar [se Graviditet ] kunde induceras i kontrollungar som ammades av behandlade moder, även om detta skedde i mindre grad än de ungar som behandlades in utero.
Pediatrisk användning
Säkerhet och effektivitet har inte fastställts hos pediatriska patienter.
Geriatrisk användning
kliniska studier på 24 veckor eller längre var 415 patienter över 65 år och inga patienter var äldre än 75 år. I ettåriga, aktivt kontrollerade studier sågs inga skillnader i effektivitet eller biverkningar mellan dessa försökspersoner och de under 65. Det fanns ingen ökning i frekvens eller svårighetsgrad av hypoglykemi hos äldre försökspersoner, men större känslighet hos vissa äldre individer för PRANDIN 0,5 mg-behandling kan inte uteslutas.
Nedsatt njurfunktion
Farmakokinetiska studier av repaglinid utfördes på patienter med lätt till måttligt nedsatt njurfunktion (CrCl = 40 till 80 ml/min) och gravt nedsatt njurfunktion (CrCl = 20 till 40 ml/min). Initial dosjustering krävs inte hos patienter med mild till måttlig njurfunktion. Patienter med gravt nedsatt njurfunktion bör dock inleda PRANDIN-behandling med dosen 0,5 mg och noggrant titreras [se DOSERING OCH ADMINISTRERING ].
Studier har inte utförts på patienter med kreatininclearance under 20 ml/min eller patienter med njursvikt som kräver hemodialys.
Nedsatt leverfunktion
En enkeldosstudie genomfördes med 12 patienter med kronisk leversjukdom. Patienter med måttlig till allvarlig försämring av leverfunktionen hade högre och mer långvariga serumkoncentrationer. Därför bör PRANDIN 0,5 mg användas med försiktighet till patienter med nedsatt leverfunktion. Längre intervall mellan dosjusteringar kan behövas för att möjliggöra en fullständig bedömning av svaret.
ÖVERDOS
Allvarliga hypoglykemiska reaktioner med koma, kramper eller annan neurologisk funktionsnedsättning kan uppstå och utgöra medicinska nödsituationer som kräver omedelbar sjukhusvistelse. Hypoglykemiska symtom utan medvetslöshet eller neurologiska fynd bör behandlas aggressivt med oralt glukos och justeringar av läkemedelsdosering och/eller måltidsmönster. Noggrann övervakning kan fortsätta tills läkaren är säker på att patienten är utom fara. Patienter bör övervakas noggrant under minst 24 till 48 timmar, eftersom hypoglykemi kan återkomma efter uppenbar klinisk återhämtning. Det finns inga bevis för att PRANDIN är dialyserbart med hjälp av hemodialys.
KONTRAINDIKATIONER
PRANDIN är kontraindicerat hos patienter med:
- Samtidig användning av gemfibrozil [se LÄKEMEDELSINTERAKTIONER ]
- Känd överkänslighet mot repaglinid eller andra inaktiva ingredienser
KLINISK FARMAKOLOGI
Handlingsmekanism
Repaglinid sänker blodsockernivåerna genom att stimulera frisättningen av insulin från bukspottkörteln. Denna verkan är beroende av fungerande beta (ß)-celler i pankreasöarna. Insulinfrisättning är glukosberoende och minskar vid låga glukoskoncentrationer.
Repaglinid stänger ATP-beroende kaliumkanaler i ß-cellmembranet genom att binda vid karakteriserbara ställen. Denna kaliumkanalblockad depolariserar ß-cellen, vilket leder till att kalciumkanalerna öppnas. Det resulterande ökade kalciuminflödet inducerar insulinutsöndring. Jonkanalmekanismen är mycket vävnadsselektiv med låg affinitet för hjärt- och skelettmuskler.
Farmakodynamik
En fyra veckor lång, dubbelblind, placebokontrollerad dos-respons-studie genomfördes på 138 patienter med typ 2-diabetes med doser från 0,25 (ej godkänd dos) till 4 mg intagna med var och en av tre måltider. PRANDIN-behandling resulterade i en dosproportionell glukossänkning över hela dosintervallet. Plasmainsulinnivåerna ökade efter måltider och återgick till baslinjen före nästa måltid. Det mesta av den fastande blodsockersänkande effekten visades inom 1 till 2 veckor.
en dubbelblind, placebokontrollerad, 3-månaders dostitreringsstudie ökade PRANDIN 0,5 mg eller placebodoser för varje patient varje vecka från 0,25 mg (ej godkänd dos) till 0,5, 1 och 2 mg, till ett maximum på 4 mg, tills en fastande plasmaglukosnivå (FPG)
Doseringen av PRANDIN 0,5 mg i förhållande till måltidsrelaterad insulinfrisättning studerades i tre studier inklusive 58 patienter. Glykemisk kontroll upprätthölls under en period då måltiden och doseringsmönstret varierades (2, 3 eller 4 måltider per dag; före måltider x 2, 3 eller 4) jämfört med en period av 3 vanliga måltider och 3 doser per dag ( före måltid x 3). Den blodsockersänkande effekten skilde sig inte när PRANDIN 0,5 mg administrerades i början av en måltid, 15 minuter före eller 30 minuter före måltiden.
Farmakokinetik
De farmakokinetiska parametrarna för repaglinid som erhållits från en endos, crossover-studie på friska försökspersoner och från en multipeldos-, parallell, dosproportionalitetsstudie (0,5, 1, 2 och 4 mg) på patienter med typ 2-diabetes sammanfattas i tabeller 5 och 6. Dessa data indikerar att repaglinid inte ackumulerades i serum. Clearance av oral repaglinid förändrades inte över dosintervallet 0,5 till 4 mg, vilket indikerar ett linjärt samband mellan dos och plasmanivåer av läkemedel.
Absorption
Efter oral administrering absorberas repaglinid fullständigt från mag-tarmkanalen. Efter enstaka och flera orala doser hos friska försökspersoner eller hos patienter uppträder maximala plasmaläkemedelsnivåer (Cmax) inom 1 timme (Tmax). Repaglinid elimineras från blodomloppet med en halveringstid på cirka 1 timme. Den genomsnittliga absoluta biotillgängligheten är 56 %. När repaglinid gavs tillsammans med föda ändrades inte medel-Tmax, men medel-Cmax och AUC (area under tids-/plasmakoncentrationskurvan) minskade med 20 % respektive 12,4 %.
Distribution
Efter intravenös (IV) dosering till friska försökspersoner var distributionsvolymen vid steady-state (Vss) 31 L, och total kroppsclearance (CL) var 38 L/h. Proteinbindning och bindning till humant serumalbumin var större än 98 %.
Metabolism och eliminering
Repaglinid metaboliseras fullständigt genom oxidativ biotransformation och direkt konjugering med glukuronsyra efter antingen en IV eller oral dos. De huvudsakliga metaboliterna är en oxiderad dikarboxylsyra (M2), den aromatiska aminen (M1) och acylglukuroniden (M7). Cytokrom P-450-enzymsystemet, specifikt 2C8 och 3A4, har visat sig vara involverat i N-dealkyleringen av repaglinid till M2 och den ytterligare oxidationen till M1. Metaboliter bidrar inte till den glukossänkande effekten av repaglinid. Inom 96 timmar efter dosering med 14C-repaglinid som en oral enkeldos återfanns cirka 90 % av den radioaktiva märkningen i avföringen och cirka 8 % i urinen. Endast 0,1 % av dosen rensas ut i urinen som modersubstans. Huvudmetaboliten (M2) stod för 60 % av den administrerade dosen. Mindre än 2 % av moderläkemedlet återfanns i avföring. Repaglinid verkar vara ett substrat för aktiv leverupptagstransportör (organiskt anjontransporterande protein OATP1B1).
Variabilitet av exponering
Repaglinid AUC efter flera doser på 0,25 till 4 mg med varje måltid varierar över ett brett intervall. De intraindividuella och interindividuella variationskoefficienterna var 36 % respektive 69 %. AUC över det terapeutiska dosintervallet inkluderade 69 till 1005 ng/ml*timme, men AUC-exponering upp till 5417 ng/mL*timme nåddes i dosökningsstudier utan uppenbara negativa konsekvenser.
Specifika populationer
Geriatrisk
Friska frivilliga behandlades med en kur på 2 mg PRANDIN 0,5 mg före var och en av 3 måltider. Det fanns inga signifikanta skillnader i farmakokinetiken för repaglinid mellan patientgruppen Användning i specifika populationer ].
Kön
En jämförelse av farmakokinetiken hos män och kvinnor visade att AUC över dosintervallet 0,5 mg till 4 mg var 15 % till 70 % högre hos kvinnor med typ 2-diabetes. Denna skillnad återspeglades inte i frekvensen av hypoglykemiska episoder (män: 16 %; kvinnor: 17 %) eller andra biverkningar.
Lopp
Inga farmakokinetiska studier för att bedöma effekterna av ras har utförts, men i en amerikansk 1-årig studie på patienter med typ 2-diabetes var den blodsockersänkande effekten jämförbar mellan kaukasier (n=297) och afroamerikaner (n= 33). I en amerikansk dos-respons-studie fanns det ingen uppenbar skillnad i exponering (AUC) mellan kaukasier (n=74) och latinamerikaner (n=33).
Nedsatt njurfunktion
Endos- och steady-state farmakokinetiken för repaglinid jämfördes mellan patienter med typ 2-diabetes och normal njurfunktion (CrCl > 80 ml/min), lätt till måttligt nedsatt njurfunktion (CrCl = 40 till 80 ml/min) och svår njurfunktion. njurfunktionsnedsättning (CrCl = 20 till 40 ml/min). Både AUC och Cmax för repaglinid var likartade hos patienter med normal och lätt till måttligt nedsatt njurfunktion (medelvärden 56,7 ng/mL*timme mot 57,2 ng/mL*timme respektive 37,5 ng/mL mot 37,7 ng/ml.) Patienter med kraftigt nedsatt njurfunktion hade förhöjda medelvärden för AUC och Cmax (98,0 ng/ml*timme respektive 50,7 ng/ml), men denna studie visade endast en svag korrelation mellan repaglinidnivåer och kreatininclearance.
Nedsatt leverfunktion
En öppen enkeldosstudie utfördes på 12 friska försökspersoner och 12 patienter med kronisk leversjukdom (CLD) klassificerad efter Child-Pugh-skala och koffeinclearance. Patienter med måttligt till allvarligt nedsatt leverfunktion hade högre och mer långvariga serumkoncentrationer av både totalt och obundet repaglinid än friska försökspersoner (AUChealthy: 91,6 ng/ml*timme; AUCCLD-patienter: 368,9 ng/ml*timme; Cmax, friska: 46,7 ng/ml; Cmax, CLD-patienter: 105,4 ng/ml). AUC var statistiskt korrelerad med koffeinclearance. Ingen skillnad i glukosprofiler observerades mellan patientgrupper.
Läkemedelsinteraktioner
Läkemedelsinteraktionsstudier utförda på friska frivilliga visar att PRANDIN 0,5 mg inte hade någon kliniskt relevant effekt på de farmakokinetiska egenskaperna hos digoxin, teofyllin eller warfarin. Samtidig administrering av cimetidin och PRANDIN 1 mg förändrade inte signifikant absorptionen och dispositionen av repaglinid.
Dessutom studerades följande läkemedel hos friska frivilliga med samtidig administrering av PRANDIN.
Kliniska studier
Monoterapiförsök
En dubbelblind, placebokontrollerad studie genomfördes på 362 patienter som behandlades i 24 veckor. HbA1c för de PRANDIN-behandlade grupperna (grupperna 1 och 4 mg kombinerade) vid slutet av studien minskade jämfört med den placebobehandlade gruppen hos behandlingsnaiva patienter och hos patienter som tidigare behandlats med orala hypoglykemiska medel med 2,1 % och 1,7 %, respektive. I denna studie med fasta doser visade patienter som var behandlingsnaiva till oral behandling med hypoglykemiska medel och patienter med ett HbA1c under 8 % vid baslinjen en större blodsockersänkning.
Kombinationsförsök
PRANDIN i kombination med metformin
PRANDIN studerades i kombination med metformin hos 83 patienter som inte var tillfredsställande kontrollerade på enbart träning, kost och metformin. PRANDIN 2 mg-dosen titrerades under 4 till 8 veckor, följt av en 3-månaders underhållsperiod. Kombinationsbehandling med PRANDIN 1 mg och metformin resulterade i statistiskt signifikant förbättring av HbA1c och fasteplasmaglukos (FPG) jämfört med PRANDIN 2 mg eller metformin monoterapi (tabell 8). I denna studie där metformindoseringen hölls konstant visade kombinationsbehandlingen av PRANDIN och metformin dossparande effekter med avseende på PRANDIN. Förbättringen av HbA1c och FPG i kombinationsgruppen uppnåddes vid en lägre daglig PRANDIN 0,5 mg dos än i PRANDIN monoterapigruppen (tabell 8).
PRANDIN 1mg i kombination med pioglitazon
En kombinationsbehandlingsregim av PRANDIN och pioglitazon (N=123) jämfördes med PRANDIN enbart (N=61) och enbart pioglitazon (N=62) i en 24-veckors studie som inkluderade 246 patienter som tidigare behandlats med sulfonylurea eller metformin monoterapi (HbA1c) > 7,0 %). PRANDIN 1 mg-dosen titrerades under de första 12 veckorna, följt av en 12-veckors underhållsperiod. Kombinationsterapi resulterade i statistiskt signifikant förbättring av HbA1c och FPG jämfört med monoterapi (Figur 1). Förändringarna från baslinjen för fullbordare i FPG (mg/dL) respektive HbA1c (%) var: -39,8 mg/dL och -0,1% för PRANDIN, -35,3 mg/dL och -0,1% för pioglitazon och -92,4 mg/ dL och -1,9 % för kombinationen. I denna studie där pioglitazondoseringen hölls konstant visade kombinationsterapigruppen dosbesparande effekter med avseende på PRANDIN (se figur 1 Legend). Förbättringen av HbA1c och FPG i kombinationsgruppen uppnåddes vid en lägre daglig PRANDIN-dos än i PRANDIN monoterapigruppen.
Figur 1: PRANDIN i kombination med pioglitazon: HbA1c-värden
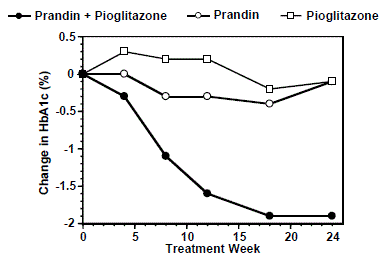
LEGEND
HbA1c-värden per studievecka för patienter som avslutade studien (kombination, N = 101; PRANDIN 1 mg, N = 35, pioglitazon, N = 26). Försökspersoner med FPG över 270 mg/dL drogs ur studien.
Pioglitazondos: fast till 30 mg/dag; PRANDIN 1 mg median slutdos: 6 mg/dag för kombination och 10 mg/dag för monoterapi.
PRANDIN i kombination med rosiglitazon
En kombinationsbehandlingsregim av PRANDIN och rosiglitazon jämfördes med monoterapi med endera medlet ensamt i en 24-veckors studie som inkluderade 252 patienter som tidigare behandlats med sulfonylurea eller metformin (HbA1c > 7,0%). Kombinationsterapi resulterade i statistiskt signifikant förbättring av HbA1c och FPG jämfört med monoterapi (tabell 9 nedan). De glykemiska effekterna av kombinationsbehandlingen var dossparande med avseende på både total daglig PRANDIN 1 mg dos och total daglig dos av rosiglitazon (se Tabell 9 Legend). Förbättringen av HbA1c och FPG i kombinationsterapigruppen uppnåddes med lägre daglig dos av PRANDIN 1 mg och rosiglitazon, jämfört med respektive monoterapigrupp.
PATIENTINFORMATION
Hypoglykemi
Informera patienterna om att PRANDIN 2mg kan orsaka hypoglykemi och instruera patienter och deras vårdgivare om självhanteringsprocedurer inklusive glukosövervakning och hantering av hypoglykemi. Informera patienterna om att deras koncentrations- och reaktionsförmåga kan försämras till följd av hypoglykemi. Hos patienter med högre risk för hypoglykemi och patienter som har minskad symtomatisk medvetenhet om hypoglykemi, rekommenderas ökad frekvens av blodsockerövervakning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Administrering
Instruera patienterna att ta PRANDIN 0,5 mg inom 30 minuter före måltid. Instruera patienterna att hoppa över sin dos av PRANDIN när en måltid hoppas över [se DOSERING OCH ADMINISTRERING ].
Läkemedelsinteraktioner
Diskutera potentiella läkemedelsinteraktioner med patienter och informera dem om potentiella läkemedelsinteraktioner med PRANDIN [se LÄKEMEDELSINTERAKTIONER ].
