Amaryl 1mg, 2mg, 4mg Glimepiride Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Amaryl 1mg och hur används det?
Amaryl 4mg är ett receptbelagt läkemedel som används för att behandla symtom på typ 2-diabetes mellitus. Amaryl 4mg kan användas ensamt eller tillsammans med andra läkemedel.
Amaryl 2mg tillhör en klass av läkemedel som kallas antidiabetika, sulfonureider.
Det är inte känt om Amaryl är säkert och effektivt hos barn.
Vilka är de möjliga biverkningarna av Amaryl?
Amaryl kan orsaka allvarliga biverkningar inklusive:
- blek eller gulnad hud,
- mörkfärgad urin,
- förvirring,
- svaghet och
- feber
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Amaryl inkluderar:
- huvudvärk,
- yrsel,
- svaghet,
- illamående, och
- lågt blodsocker
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Amaryl. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
AMARYL är en oral sulfonylurea som innehåller den aktiva ingrediensen glimepirid. Kemiskt identifieras glimepirid som 1-[[p-[2-(3-etyl-4-metyl-2-oxo-3-pyrrolin-1-karboxamido) etyl]fenyl]sulfonyl]-3-(trans-4- metylcyklohexyl)urea (C24H34N4O5S) med en molekylvikt av 490,62. Glimepirid är ett vitt till gulvitt, kristallint, luktfritt till praktiskt taget luktfritt pulver och är praktiskt taget olösligt i vatten. Strukturformeln är:
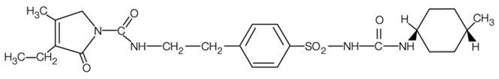
AMARYL tabletter innehåller den aktiva substansen glimepirid och följande inaktiva ingredienser: laktos (fri), natriumstärkelseglykolat, povidon, mikrokristallin cellulosa och magnesiumstearat. Dessutom innehåller AMARYL 1 mg tabletter Ferrioxidröd, AMARYL 2 mg tabletter innehåller Ferric Oxide Yellow och FD&C Blue #2 Aluminium Lake, och AMARYL 4 mg tabletter innehåller FD&C Blue #2 Aluminium Lake.
INDIKATIONER
AMARYL 2mg är indicerat som ett komplement till kost och träning för att förbättra glykemisk kontroll hos vuxna med typ 2-diabetes mellitus [se Kliniska studier ].
Viktiga användningsbegränsningar
AMARYL ska inte användas för behandling av typ 1-diabetes mellitus eller diabetisk ketoacidos, eftersom det inte skulle vara effektivt i dessa sammanhang.
DOSERING OCH ADMINISTRERING
Rekommenderad dosering
AMARYL 1mg ska administreras med frukost eller dagens första huvudmåltid.
Den rekommenderade startdosen av AMARYL är 1 mg eller 2 mg en gång dagligen. Patienter med ökad risk för hypoglykemi (t.ex. äldre eller patienter med nedsatt njurfunktion) bör inledas med 1 mg en gång dagligen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Efter att ha uppnått en daglig dos på 2 mg kan ytterligare dosökningar göras i steg om 1 mg eller 2 mg baserat på patientens glykemiska svar. Uptitrering bör inte ske oftare än var 1-2:e vecka. Ett konservativt titreringsschema rekommenderas för patienter med ökad risk för hypoglykemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Den maximala rekommenderade dosen är 8 mg en gång dagligen.
Patienter som överförs till AMARYL 1 mg från sulfonylureider med längre halveringstid (t.ex. klorpropamid) kan ha överlappande läkemedelseffekt under 1-2 veckor och bör övervakas på lämpligt sätt för hypoglykemi.
När kolesevelam administreras samtidigt med glimepirid reduceras maximal plasmakoncentration och total exponering för glimepirid. Därför bör AMARYL 2 mg administreras minst 4 timmar före behandling med colesevelam.
HUR LEVERERAS
Doseringsformer och styrkor
AMARYL 4mg är formulerad som tabletter av:
- 1 mg (rosa, platt, avlång med skårade sidor i dubbelt halvskär, stämplad med "AMA RYL" på ena sidan)
- 2 mg (grön, platt, avlång med skårade sidor i dubbelsektion, stämplad med "AMA RYL" på ena sidan)
- 4 mg (blått, platt ansikte, avlångt med skårade sidor i dubbelt halvsektion, stämplad med "AMA RYL" på ena sidan)
Förvaring Och Hantering
AMARYL tabletter finns i följande styrkor och förpackningsstorlekar:
1 mg (rosa, platt, avlång med skårade sidor i dubbelt halvsektion, stämplad med "AMA RYL" på ena sidan) i flaskor om 100 ( NDC 0039-0221-10)
2 mg (grön, platt, avlång med skårade sidor i dubbelsektion, tryckt med "AMA RYL" på ena sidan) i flaskor om 100 ( NDC 0039-0222-10)
4 mg (blå, platt, avlång med skårade sidor i dubbelt halvsektion, tryckt med "AMA RYL" på ena sidan) i flaskor om 100 ( NDC 0039-0223-10)
Förvara vid 25°C (77°F); utflykter tillåtna till 20 - 25°C (68 - 77°F) (se USP-kontrollerad rumstemperatur ).
Dispensera i väl tillslutna behållare med säkerhetsförslutningar.
sanofi-aventis US LLC, Bridgewater, NJ 08807, ETT SANOFI-FÖRETAG. Reviderad dec 2016
BIEFFEKTER
Följande allvarliga biverkningar diskuteras mer i detalj nedan och på andra ställen i märkningen:
- Hypoglykemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hemolytisk anemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
I kliniska prövningar var de vanligaste biverkningarna med AMARYL 4 mg hypoglykemi, yrsel, asteni, huvudvärk och illamående.
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Cirka 2 800 patienter med typ 2-diabetes har behandlats med AMARYL 4 mg i de kontrollerade kliniska prövningarna. I dessa prövningar behandlades cirka 1 700 patienter med AMARYL i minst 1 år.
Tabell 1 sammanfattar biverkningar, andra än hypoglykemi, som rapporterades i 11 poolade placebokontrollerade prövningar, oavsett om de anses vara möjliga eller sannolikt relaterade till studiemedicinering. Behandlingslängden varierade från 13 veckor till 12 månader. Termer som rapporteras representerar de som inträffade med en incidens på ≥ 5 % bland AMARYL-behandlade patienter och vanligare än hos patienter som fick placebo.
Hypoglykemi
I en randomiserad, dubbelblind, placebokontrollerad monoterapistudie av 14 veckors varaktighet genomgick patienter som redan behandlades med sulfonylurea en 3-veckors tvättperiod och randomiserades sedan till AMARYL 1 mg, 4 mg, 8 mg eller placebo. Patienter randomiserade till AMARYL 4 mg eller 8 mg genomgick tvångstitrering från en initial dos på 1 mg till dessa slutdoser, allt efter tolerans [se Kliniska studier ]. Den totala förekomsten av möjlig hypoglykemi (definierad av närvaron av minst ett symptom som utredaren trodde kunde vara relaterat till hypoglykemi; en samtidig glukosmätning krävdes inte) var 4 % för AMARYL 1 mg, 17 % för AMARYL 4 mg, 16 % för AMARYL 8 mg och 0 % för placebo. Alla dessa händelser var självbehandlade.
I en randomiserad, dubbelblind, placebokontrollerad monoterapistudie på 22 veckor fick patienterna en startdos på antingen 1 mg AMARYL eller placebo dagligen. Dosen av AMARYL 2 mg titrerades till ett fastemål för plasmaglukos på 90-150 mg/dL. Slutliga dagliga doser av AMARYL 2 mg var 1, 2, 3, 4, 6 eller 8 mg [se Kliniska studier ]. Den totala incidensen av möjlig hypoglykemi (enligt definitionen ovan för 14-veckorsstudien) för AMARYL vs. placebo var 19,7% vs. 3,2%. Alla dessa händelser var självbehandlade.
Viktökning: AMARYL, som alla sulfonylureider, kan orsaka viktökning [se Kliniska studier ].
Allergiska reaktioner: kliniska prövningar inträffade allergiska reaktioner, såsom klåda, erytem, urtikaria och morbilliforma eller makulopapulära utbrott, hos mindre än 1 % av AMARYL-behandlade patienter. Dessa kan försvinna trots fortsatt behandling med AMARYL. Det finns rapporter efter marknadsföring om allvarligare allergiska reaktioner (t.ex. dyspné, hypotoni, chock) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Laboratorietester
Förhöjt serumalaninaminotransferas (ALT): I 11 poolade placebokontrollerade studier med AMARYL utvecklade 1,9 % av AMARYL-behandlade patienter och 0,8 % av placebobehandlade patienter serum-ALAT som var större än 2 gånger den övre gränsen för referensintervallet.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av AMARYL efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
- Allvarliga överkänslighetsreaktioner, inklusive anafylaxi, angioödem och Stevens-Johnsons syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hemolytisk anemi hos patienter med och utan G6PD-brist [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Nedsatt leverfunktion (t.ex. med kolestas och gulsot), samt hepatit, som kan utvecklas till leversvikt.
- Porphyria cutanea tarda, ljuskänslighetsreaktioner och allergisk vaskulit
- Leukopeni, agranulocytos, aplastisk anemi och pancytopeni
- Trombocytopeni (inklusive svåra fall med trombocytantal mindre än 10 000/μL) och trombocytopen purpura
- Leverporfyrireaktioner och disulfiramliknande reaktioner
- Hyponatremi och syndrom av olämplig antidiuretisk hormonsekretion (SIADH), oftast hos patienter som tar andra mediciner eller som har medicinska tillstånd som är kända för att orsaka hyponatremi eller öka frisättningen av antidiuretiskt hormon
- Dysgeusi
- Alopeci
LÄKEMEDELSINTERAKTIONER
Läkemedel som påverkar glukosmetabolismen
Ett antal mediciner påverkar glukosmetabolismen och kan kräva dosjustering av AMARYL 4 mg och särskilt noggrann övervakning för hypoglykemi eller försämrad glykemisk kontroll.
Följande är exempel på mediciner som kan öka den glukossänkande effekten av sulfonylureider inklusive AMARYL 2mg, vilket ökar känsligheten för och/eller intensiteten av hypoglykemi: orala antidiabetiska läkemedel, pramlintidacetat, insulin, angiotensinomvandlande enzym (ACE)-hämmare, H2-receptorantagonister, fibrater, propoxifen, pentoxifyllin, somatostatinanaloger, anabola steroider och androgener, cyklofosfamid, fenyramidol, guanetidin, flukonazol, sulfinpyrazon, tetracykliner, klaritromycin, disopyramid, quinolonet, disopyramid, kinolotin, t.ex. icke-steroida antiinflammatoriska läkemedel, salicylater, sulfonamider, kloramfenikol, kumariner, probenecid och monoaminoxidashämmare. När dessa läkemedel administreras till en patient som får AMARYL, övervaka patienten noga med avseende på hypoglykemi. När dessa läkemedel tas bort från en patient som får AMARYL 2 mg, övervaka patienten noggrant för försämrad glykemisk kontroll.
Följande är exempel på mediciner som kan minska den glukossänkande effekten av sulfonylureider inklusive AMARYL, vilket leder till försämrad glykemisk kontroll: danazol, glukagon, somatropin, proteashämmare, atypiska antipsykotiska läkemedel (t.ex. olanzapin och klozapin), barbiturater, diazoxid, laxativa oxider, , rifampin, tiazider och andra diuretika, kortikosteroider, fenotiaziner, sköldkörtelhormoner, östrogener, orala preventivmedel, fenytoin, nikotinsyra, sympatomimetika (t.ex. epinefrin, albuterol, terbutalin) och isoniazid. När dessa läkemedel administreras till en patient som får AMARYL 2 mg, övervaka patienten noggrant för försämrad glykemisk kontroll. När dessa läkemedel tas bort från en patient som får AMARYL 2 mg, övervaka patienten noggrant med avseende på hypoglykemi.
Betablockerare, klonidin och reserpin kan leda till antingen förstärkning eller försvagning av AMARYLs glukossänkande effekt.
Både akut och kronisk alkoholintag kan potentiera eller försvaga den glukossänkande effekten av AMARYL 1 mg på ett oförutsägbart sätt.
Tecken på hypoglykemi kan vara reducerade eller saknas hos patienter som tar sympatolytiska läkemedel såsom betablockerare, klonidin, guanetidin och reserpin.
Mikonazol
En potentiell interaktion mellan oral mikonazol och sulfonylureider som leder till allvarlig hypoglykemi har rapporterats. Huruvida denna interaktion även förekommer med andra doseringsformer av mikonazol är inte känt.
Cytokrom P450 2C9 Interaktioner
Det kan finnas en interaktion mellan glimepirid och hämmare (t.ex. flukonazol) och inducerare (t.ex. rifampin) av cytokrom P450 2C9. Flukonazol kan hämma metabolismen av glimepirid, vilket kan orsaka ökade plasmakoncentrationer av glimepirid, vilket kan leda till hypoglykemi. Rifampin kan inducera metabolismen av glimepirid, vilket kan orsaka minskade plasmakoncentrationer av glimepirid, vilket kan leda till försämrad glykemisk kontroll.
Samtidig administrering av Colesevelam
Kolesevelam kan minska den maximala plasmakoncentrationen och den totala exponeringen av glimepirid när de två administreras samtidigt. Absorptionen minskar dock inte när glimepirid administreras 4 timmar före kolesevelam. Därför ska AMARYL administreras minst 4 timmar före colesevelam.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Hypoglykemi
Alla sulfonylureider, inklusive AMARYL, kan orsaka allvarlig hypoglykemi [se NEGATIVA REAKTIONER ]. Patientens koncentrations- och reaktionsförmåga kan försämras till följd av hypoglykemi. Dessa funktionsnedsättningar kan utgöra en risk i situationer där dessa förmågor är särskilt viktiga, såsom att köra bil eller använda andra maskiner. Allvarlig hypoglykemi kan leda till medvetslöshet eller kramper och kan leda till tillfällig eller permanent försämring av hjärnans funktion eller dödsfall.
Patienter måste utbildas för att känna igen och hantera hypoglykemi. Var försiktig när du påbörjar och ökar dosen av AMARYL 2 mg hos patienter som kan vara predisponerade för hypoglykemi (t.ex. äldre, patienter med nedsatt njurfunktion, patienter på andra antidiabetiska läkemedel). Försvagade eller undernärda patienter och de med nedsatt binjure, hypofys eller leverfunktion är särskilt mottagliga för den hypoglykemiska effekten av glukossänkande mediciner. Hypoglykemi är också mer sannolikt att inträffa när kaloriintaget är bristfälligt, efter hård eller långvarig träning eller när alkohol intas.
Tidiga varningssymtom på hypoglykemi kan vara olika eller mindre uttalade hos patienter med autonom neuropati, äldre och hos patienter som tar beta-adrenerga blockerande mediciner eller andra sympatolytiska medel. Dessa situationer kan resultera i allvarlig hypoglykemi innan patienten är medveten om hypoglykemin.
Överkänslighetsreaktioner
Det har förekommit rapporter om överkänslighetsreaktioner efter marknadsföring hos patienter som behandlats med AMARYL, inklusive allvarliga reaktioner som anafylaxi, angioödem och Stevens-Johnsons syndrom. Om en överkänslighetsreaktion misstänks, avbryt AMARYL omedelbart, bedöm andra potentiella orsaker till reaktionen och inled alternativ behandling för diabetes.
Hemolytisk anemi
Sulfonylurea kan orsaka hemolytisk anemi hos patienter med glukos-6-fosfatdehydrogenas (G6PD)-brist. Eftersom AMARYL 4mg är en sulfonylurea, var försiktig hos patienter med G6PD-brist och överväg användningen av ett icke-sulfonylurea-alternativ. Det finns också rapporter om hemolytisk anemi efter marknadsföring hos patienter som får AMARYL 1 mg som inte hade känd G6PD-brist [se NEGATIVA REAKTIONER ].
Ökad risk för kardiovaskulär dödlighet med sulfonureider
Administrering av orala hypoglykemiska läkemedel har rapporterats vara associerad med ökad kardiovaskulär mortalitet jämfört med behandling med enbart diet eller diet plus insulin. Denna varning är baserad på studien utförd av University Group Diabetes Program (UGDP), en långsiktig, prospektiv klinisk prövning utformad för att utvärdera effektiviteten av glukossänkande läkemedel för att förebygga eller fördröja vaskulära komplikationer hos patienter med icke-insulinberoende diabetes. Studien involverade 823 patienter som slumpmässigt tilldelades en av fyra behandlingsgrupper. UGDP rapporterade att patienter som behandlats i 5 till 8 år med diet plus en fast dos tolbutamid (1,5 gram per dag) hade en kardiovaskulär mortalitet cirka 2-½ gånger patienter som behandlas med enbart diet. En signifikant ökning av den totala dödligheten observerades inte, men användningen av tolbutamid avbröts baserat på ökningen av kardiovaskulär mortalitet, vilket begränsar möjligheten för studien att visa en ökning av den totala dödligheten. Trots kontroverser om tolkningen av dessa resultat ger resultaten av UGDP-studien en adekvat grund för denna varning. Patienten bör informeras om de potentiella riskerna och fördelarna med AMARYL 4 mg och om alternativa behandlingssätt. Även om endast ett läkemedel i sulfonylurea-klassen (tolbutamid) inkluderades i denna studie, är det klokt ur säkerhetssynpunkt att överväga att denna varning även kan gälla andra orala hypoglykemiska läkemedel i denna klass, med tanke på deras nära likheter i form av verkan och kemisk struktur.
Makrovaskulära resultat
Det har inte gjorts några kliniska studier som har fastställt avgörande bevis för minskning av makrovaskulär risk med AMARYL eller något annat antidiabetiskt läkemedel.
Icke-klinisk toxikologi
Karcinogenes, mutagenes och försämring av fertilitet
Studier på råttor i doser på upp till 5000 miljondelar (ppm) i helfoder (cirka 340 gånger den maximala rekommenderade humandosen, baserat på yta) under 30 månader visade inga tecken på cancer. Hos möss resulterade administrering av glimepirid i 24 månader i en ökning av benignt pankreasadenombildning som var dosrelaterad och ansågs vara resultatet av kronisk pankreastimulering. Ingen adenombildning hos möss observerades vid en dos av 320 ppm i helfoder, eller 46-54 mg/kg kroppsvikt/dag. Detta är cirka 35 gånger den maximala rekommenderade dosen för människor på 8 mg en gång dagligen baserat på yta.
Glimepirid var icke-mutagen i en rad mutagenicitetsstudier in vitro och in vivo (Ames-test, somatisk cellmutation, kromosomavvikelse, oplanerad DNA-syntes och mikrokärntest på mus).
Det fanns ingen effekt av glimepirid på hanmöss fertilitet hos djur exponerade upp till 2 500 mg/kg kroppsvikt (> 1 700 gånger den maximala rekommenderade humana dosen baserat på yta). Glimepirid hade ingen effekt på fertiliteten hos han- och honråttor som administrerades upp till 4 000 mg/kg kroppsvikt (cirka 4 000 gånger den maximala rekommenderade dosen för människa baserat på ytan).
Användning i specifika populationer
Graviditet
Graviditetskategori C
Det finns inga adekvata och välkontrollerade studier av AMARYL 2mg på gravida kvinnor. I djurstudier fanns ingen ökning av medfödda anomalier, men en ökning av fosterdödsfall inträffade hos råttor och kaniner vid glimepiriddoser 50 gånger (råttor) och 0,1 gånger (kaniner) den maximala rekommenderade dosen för människor (baserat på kroppsyta). Denna fostertoxicitet, som endast observeras vid doser som inducerar maternell hypoglykemi, tros vara direkt relaterad till den farmakologiska (hypoglykemiska) effekten av glimepirid och har på liknande sätt noterats med andra sulfonylureider. AMARYL ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret. Eftersom data tyder på att onormalt blodsocker under graviditet är associerat med en högre förekomst av medfödda avvikelser, bör diabetesbehandling under graviditeten bibehålla blodsockret så nära det normala som möjligt.
Icke-ratogena effekter
Långvarig allvarlig hypoglykemi (4 till 10 dagar) har rapporterats hos nyfödda födda till mödrar som fått en sulfonylurea vid tidpunkten för förlossningen.
Ammande mödrar
Det är inte känt om AMARYL 1 mg utsöndras i modersmjölk. Under pre- och postnatala studier på råttor fanns signifikanta koncentrationer av glimepirid i bröstmjölk och serum från ungarna. Avkommor till råttor som exponerats för höga nivåer av glimepirid under dräktighet och amning utvecklade skelettdeformiteter bestående av förkortning, förtjockning och böjning av humerus under den postnatala perioden. Dessa skelettdeformationer fastställdes vara resultatet av amning från mödrar som exponerats för glimepirid. Baserat på dessa djurdata och risken för hypoglykemi hos ett ammande spädbarn, bör ett beslut fattas om man ska avbryta amningen eller avbryta behandlingen med AMARYL 2 mg, med hänsyn tagen till betydelsen av AMARYL för modern.
Pediatrisk användning
Farmakokinetiken, effekten och säkerheten för AMARYL 4 mg har utvärderats hos pediatriska patienter med typ 2-diabetes enligt beskrivningen nedan. AMARYL 4mg rekommenderas inte till pediatriska patienter på grund av dess negativa effekter på kroppsvikt och hypoglykemi.
Farmakokinetiken för en engångsdos på 1 mg AMARYL utvärderades hos 30 patienter med typ 2-diabetes (man = 7; kvinnor = 23) mellan 10 och 17 år. Medelvärdet (± SD) AUC (339±203 ng·timme/mL), Cmax (102±48 ng/ml) och t½ (3,1±1,7 timmar) för glimepirid var jämförbara med historiska data från vuxna (AUC(0-sista) ) 315±96 ng·timme/ml, Cmax 103±34 ng/ml och t½ 5,3±4,1 timmar).
Säkerheten och effekten av AMARYL hos pediatriska patienter utvärderades i en enkelblind, 24-veckors studie som randomiserade 272 patienter (8-17 år) med typ 2-diabetes till AMARYL (n=135) eller metformin (n=137) ). Både behandlingsnaiva patienter (de som endast behandlats med diet och motion i minst 2 veckor före randomisering) och tidigare behandlade patienter (de som tidigare behandlats eller för närvarande behandlats med andra orala antidiabetiska läkemedel i minst 3 månader) var berättigade att delta. Patienter som fick orala antidiabetika vid tidpunkten för studiestart avbröt dessa mediciner före randomisering utan en tvättperiod. AMARYL initierades med 1 mg och titrerades sedan upp till 2, 4 eller 8 mg (genomsnittlig sista dos 4 mg) till och med vecka 12, med inriktning på ett självövervakat blodsocker vid fastande fingerstick
Efter 24 veckor var den totala genomsnittliga behandlingsskillnaden i HbA1c mellan AMARYL 4 mg och metformin 0,2 %, vilket gynnar metformin (95 % konfidensintervall -0,3 % till +0,6 %). Baserat på dessa resultat uppfyllde studien inte sitt primära mål att visa en liknande minskning av HbA1c med AMARYL 4 mg jämfört med metformin.
Profilen av biverkningar hos pediatriska patienter som behandlats med AMARYL 2 mg liknade den som observerats hos vuxna [se NEGATIVA REAKTIONER ].
Hypoglykemiska händelser dokumenterade av blodsockervärden
Geriatrisk användning
kliniska prövningar med AMARYL 2 mg var 1053 av 3491 patienter (30%) > 65 år. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa patienter och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
Det fanns inga signifikanta skillnader i glimepirids farmakokinetik mellan patienter med typ 2-diabetes ≤ 65 år (n=49) och de > 65 år (n=42) [se KLINISK FARMAKOLOGI ].
Glimepirid utsöndras huvudsakligen via njurarna. Äldre patienter är mer benägna att ha nedsatt njurfunktion. Dessutom kan hypoglykemi vara svår att känna igen hos äldre [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Var försiktig när du påbörjar AMARYL och ökar dosen av AMARYL 1 mg i denna patientpopulation.
Nedsatt njurfunktion
För att minimera risken för hypoglykemi är den rekommenderade startdosen av AMARYL 1 mg dagligen för alla patienter med typ 2-diabetes och nedsatt njurfunktion [se DOSERING OCH ADMINISTRERING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
En titreringsstudie med flera doser utfördes på 16 patienter med typ 2-diabetes och nedsatt njurfunktion med doser från 1 mg till 8 mg dagligen under 3 månader. Baslinje kreatininclearance varierade från 10-60 ml/min. Farmakokinetiken för AMARYL utvärderades i titreringsstudien med flera doser och resultaten överensstämde med de som observerades hos patienter som inkluderades i en endosstudie. I båda studierna ökade det relativa totala clearance av AMARYL när njurfunktionen var nedsatt. Båda studierna visade också att elimineringen av de två huvudmetaboliterna minskade hos patienter med nedsatt njurfunktion [se KLINISK FARMAKOLOGI ].
ÖVERDOS
En överdosering av AMARYL 2 mg, som med andra sulfonylureider, kan ge allvarlig hypoglykemi. Milda episoder av hypoglykemi kan behandlas med oralt glukos. Allvarliga hypoglykemiska reaktioner utgör medicinska nödsituationer som kräver omedelbar behandling. Allvarlig hypoglykemi med koma, kramper eller neurologisk funktionsnedsättning kan behandlas med glukagon eller intravenöst glukos. Fortsatt observation och ytterligare kolhydratintag kan vara nödvändigt eftersom hypoglykemi kan återkomma efter uppenbar klinisk återhämtning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
KONTRAINDIKATIONER
AMARYL är kontraindicerat hos patienter med en anamnes på en överkänslighetsreaktion mot:
- Glimepirid eller någon av produktens ingredienser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sulfonamidderivat: Patienter som har utvecklat en allergisk reaktion mot sulfonamidderivat kan utveckla en allergisk reaktion mot AMARYL. Använd inte AMARYL 4 mg till patienter som tidigare haft en allergisk reaktion mot sulfonamidderivat.
Rapporterade överkänslighetsreaktioner inkluderar hudutslag med eller utan klåda samt allvarligare reaktioner (t.ex. anafylaxi, angioödem, Stevens-Johnsons syndrom, dyspné) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
KLINISK FARMAKOLOGI
Handlingsmekanism
Glimepirid sänker främst blodsockret genom att stimulera frisättningen av insulin från pankreas betaceller. Sulfonylurea binder till sulfonylureareceptorn i bukspottkörtelns betacellplasmamembran, vilket leder till stängning av den ATP-känsliga kaliumkanalen, vilket stimulerar frisättningen av insulin.
Farmakodynamik
Hos friska försökspersoner var tiden för att nå maximal effekt (minsta blodsockerkoncentrationer) cirka 2-3 timmar efter orala engångsdoser av AMARYL. Effekterna av AMARYL på HbA1c, fasteplasmaglukos och postprandial glukos har utvärderats i kliniska prövningar [se Kliniska studier ].
Farmakokinetik
Absorption
Studier med enstaka orala doser av glimepirid hos friska försökspersoner och med flera orala doser hos patienter med typ 2-diabetes visade maximala läkemedelskoncentrationer (Cmax) 2 till 3 timmar efter dosering. När glimepirid gavs med måltid minskade medel-Cmax och AUC (area under kurvan) med 8 % respektive 9 %.
Glimepirid ackumuleras inte i serum efter upprepad dosering. Farmakokinetiken för glimepirid skiljer sig inte mellan friska försökspersoner och patienter med typ 2-diabetes. Clearance av glimepirid efter oral administrering förändras inte över dosintervallet 1 mg till 8 mg, vilket indikerar linjär farmakokinetik.
Hos friska försökspersoner var de intra- och interindividuella variationerna av glimepirids farmakokinetiska parametrar 15-23% respektive 24-29%.
Distribution
Efter intravenös dosering till friska försökspersoner var distributionsvolymen (Vd) 8,8 l (113 ml/kg) och total kroppsclearance (CL) var 47,8 ml/min. Proteinbindningen var större än 99,5 %.
Ämnesomsättning
Glimepirid metaboliseras fullständigt genom oxidativ biotransformation efter antingen en intravenös eller oral dos. De huvudsakliga metaboliterna är cyklohexylhydroximetylderivatet (M1) och karboxylderivatet (M2). Cytokrom P450 2C9 är involverad i biotransformationen av glimepirid till M1. M1 metaboliseras vidare till M2 av ett eller flera cytosoliska enzymer. M2 är inaktiv. Hos djur har M1 ungefär en tredjedel av glimepirids farmakologiska aktivitet, men det är oklart om M1 resulterar i kliniskt betydelsefulla effekter på blodsocker hos människor.
Exkretion
När 14C-glimepirid gavs oralt till 3 friska manliga försökspersoner återfanns cirka 60 % av den totala radioaktiviteten i urinen på 7 dagar. M1 och M2 stod för 80-90 % av den radioaktivitet som återfanns i urinen. Förhållandet mellan M1 och M2 i urinen var ungefär 3:2 hos två försökspersoner och 4:1 hos en försöksperson. Ungefär 40 % av den totala radioaktiviteten återfanns i avföring. M1 och M2 stod för cirka 70 % (förhållandet mellan M1 och M2 var 1:3) av radioaktiviteten som återfanns i feces. Inget moderläkemedel återfanns från urin eller avföring. Efter intravenös dosering till patienter observerades ingen signifikant gallutsöndring av glimepirid eller dess M1-metabolit.
Geriatriska patienter
En jämförelse av glimepirids farmakokinetik hos patienter med typ 2-diabetes ≤ 65 år och patienter > 65 år utvärderades i en flerdosstudie med AMARYL 6 mg dagligen. Det fanns inga signifikanta skillnader i glimepirids farmakokinetik mellan de två åldersgrupperna. Medel-AUC vid steady state för de äldre patienterna var cirka 13 % lägre än för de yngre patienterna; det genomsnittliga viktjusterade clearance för de äldre patienterna var cirka 11 % högre än det för de yngre patienterna.
Kön
Det fanns inga skillnader mellan män och kvinnor i farmakokinetiken för glimepirid när justering gjordes för skillnader i kroppsvikt.
Lopp
Inga studier har utförts för att bedöma effekterna av ras på glimepirids farmakokinetik, men i placebokontrollerade studier med AMARYL 2 mg på patienter med typ 2-diabetes var minskningen av HbA jämförbar hos kaukasier (n = 536), svarta (n = 63) , och latinamerikaner (n = 63).
Nedsatt njurfunktion
En öppen enkeldosstudie AMARYL 3 mg administrerades till patienter med mild, måttlig och svår njurfunktionsnedsättning, beräknat med kreatininclearance (CLcr): Grupp I bestod av 5 patienter med lätt nedsatt njurfunktion (CLcr > 50 ml/min. ), grupp II bestod av 3 patienter med måttligt nedsatt njurfunktion (CLcr = 20-50 ml/min) och grupp III bestod av 7 patienter med gravt nedsatt njurfunktion (CLcr
Nedsatt leverfunktion
Det är okänt om det finns en effekt av nedsatt leverfunktion på farmakokinetiken för AMARYL 1 mg eftersom farmakokinetiken för AMARYL 1 mg inte har utvärderats tillräckligt hos patienter med nedsatt leverfunktion.
Överviktiga patienter
Farmakokinetiken för glimepirid och dess metaboliter mättes i en enkeldosstudie med 28 patienter med typ 2-diabetes som antingen hade normal kroppsvikt eller var sjukligt feta. Medan tmax, clearance och distributionsvolym för glimepirid hos sjukligt överviktiga patienter liknade dem i normalviktsgruppen, hade de sjukligt feta lägre Cmax och AUC än normal kroppsvikt. Medelvärdena för Cmax, AUC0-24, AUC0-∞ för glimepirid hos normala vs. sjukligt överviktiga patienter var 547 ± 218 ng/ml mot 410 ± 124 ng/ml, 3210 ± 1030 timmar·ng/ml vs. ± 1810 timmar. timmar·ng/ml och 4000 ± 1320 timmar·ng/ml respektive 3280 ± 1360 timmar·ng/ml.
Läkemedelsinteraktioner
Aspirin: en randomiserad, dubbelblind, tvåperioders crossover-studie fick friska försökspersoner antingen placebo eller aspirin 1 gram tre gånger dagligen under en total behandlingsperiod på 5 dagar. På dag 4 av varje studieperiod administrerades en engångsdos på 1 mg AMARYL 4 mg. AMARYL 4 mg-doserna separerades av en 14-dagars uttvättningsperiod. Samtidig administrering av acetylsalicylsyra och AMARYL 4 mg resulterade i en 34 % minskning av den genomsnittliga AUC för glimepirid och en minskning med 4 % i den genomsnittliga Cmax för glimepirid.
Colesevelam: Samtidig administrering av kolesevelam och glimepirid resulterade i minskningar av glimepirid AUC0-∞ och Cmax med 18 % respektive 8 %. När glimepirid administrerades 4 timmar före kolesevelam, var det ingen signifikant förändring i glimepirid AUC0-∞ och Cmax, -6% respektive 3% [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ].
Cimetidin och Ranitidin: en randomiserad, öppen 3-vägs crossover-studie fick friska försökspersoner antingen en enstaka 4 mg dos av AMARYL enbart, AMARYL med ranitidin (150 mg två gånger dagligen i 4 dagar; AMARYL 2 mg administrerades på dag 3) eller AMARYL 2 mg med cimetidin (800 mg dagligen i 4 dagar; AMARYL administrerades på dag 3). Samtidig administrering av cimetidin eller ranitidin med en oral engångsdos på 4 mg AMARYL 4 mg förändrade inte signifikant absorptionen och dispositionen av glimepirid.
Propranolol: en randomiserad, dubbelblind, tvåperioders crossover-studie, gavs friska försökspersoner antingen placebo eller propranolol 40 mg tre gånger dagligen under en total behandlingsperiod på 5 dagar. På dag 4 eller varje studieperiod administrerades en engångsdos på 2 mg AMARYL 4 mg. AMARYL 4 mg-doserna separerades av en 14-dagars uttvättningsperiod. Samtidig administrering av propranolol och AMARYL 1 mg ökade signifikant glimepirid Cmax, AUC och T½ med 23 %, 22 % respektive 15 % och minskade glimepirid CL/f med 18 %. Återvinningen av M1 och M2 från urin förändrades inte.
Warfarin: en öppen tvåvägs crossover-studie fick friska försökspersoner 4 mg AMARYL 2 mg dagligen i 10 dagar. Enstaka 25 mg doser av warfarin administrerades 6 dagar före start av AMARYL och på dag 4 av AMARYL administrering. Samtidig administrering av AMARYL förändrade inte farmakokinetiken för R- och S-warfarin-enantiomerer. Inga förändringar observerades i warfarins plasmaproteinbindning. AMARYL 1 mg resulterade i en statistiskt signifikant minskning av det farmakodynamiska svaret på warfarin. Minskningarna av medelarea under protrombintidskurvan (PT) och maximala PT-värden under AMARYL-behandling var 3,3 % respektive 9,9 % och är osannolikt kliniskt relevanta.
Kliniska studier
Monoterapi
Totalt 304 patienter med typ 2-diabetes som redan behandlats med sulfonylureaterapi deltog i en 14-veckors, multicenter, randomiserad, dubbelblind, placebokontrollerad studie som utvärderade säkerheten och effekten av AMARYL 1 mg monoterapi. Patienterna avbröt sin sulfonylureabehandling och gick sedan in i en 3-veckors placebo-tvättningsperiod följt av randomisering i 1 av 4 behandlingsgrupper: placebo (n=74), AMARYL 1 mg (n=78), AMARYL 4 mg (n=76) och AMARYL 8 mg (n=76). Alla patienter randomiserade till AMARYL 4 mg började med 1 mg dagligen. Patienter som randomiserades till AMARYL 4 mg eller 8 mg hade blindat, påtvingad titrering av AMARYL 2 mg dosen med veckovisa intervall, först till 4 mg och sedan till 8 mg, så länge dosen tolererades, tills den randomiserade dosen nåddes. Patienter som randomiserades till 4 mg-dosen nådde den tilldelade dosen vid vecka 2. Patienter som randomiserades till 8 mg-dosen nådde den tilldelade dosen vid vecka 3. När den randomiserade dosnivån nåtts, skulle patienterna bibehållas vid den dosen fram till vecka 14. Ungefär 66 % av de placebobehandlade patienterna fullföljde studien jämfört med 81 % av patienterna som behandlades med glimepirid 1 mg och 92 % av patienterna som behandlades med glimepirid 4 mg eller 8 mg. Jämfört med placebo gav behandling med AMARYL 1 mg, 4 mg och 8 mg dagligen statistiskt signifikanta förbättringar av HbA1c jämfört med placebo (tabell 3).
Totalt 249 patienter som var behandlingsnaiva eller som tidigare fått begränsad behandling med antidiabetisk terapi randomiserades till att få 22 veckors behandling med antingen AMARYL (n=123) eller placebo (n=126) i ett multicenter, randomiserat , dubbelblind, placebokontrollerad dostitreringsstudie. Startdosen av AMARYL var 1 mg dagligen och titrerades uppåt eller nedåt med 2-veckors intervall till ett mål FPG på 90-150 mg/dL. Blodsockernivåer för både FPG och PPG analyserades i laboratoriet. Efter 10 veckors dosjustering bibehölls patienterna vid sin optimala dos (1, 2, 3, 4, 6 eller 8 mg) under de återstående 12 veckorna av studien. Behandling med AMARYL 2 mg gav statistiskt signifikanta förbättringar av HbA1c och FPG jämfört med placebo (tabell 4).
PATIENTINFORMATION
Informera patienter om vikten av att följa kostinstruktioner, av ett regelbundet träningsprogram och av regelbundna tester av blodsocker.
Informera patienterna om de potentiella biverkningarna av AMARYL 1mg inklusive hypoglykemi och viktökning.
Förklara symtom och behandling av hypoglykemi samt tillstånd som predisponerar för hypoglykemi. Patienterna ska informeras om att koncentrations- och reaktionsförmågan kan försämras till följd av hypoglykemi. Detta kan utgöra en risk i situationer där dessa förmågor är särskilt viktiga, såsom att köra bil eller använda andra maskiner.
Patienter med diabetes bör rådas att informera sin vårdgivare om de är gravida, överväger graviditet, ammar eller överväger att amma.
