Glucovance 400/2.50mg, 500/5mg Metformin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Glucovance 2,50 mg och hur används det?
Glucovance 400mg är ett receptbelagt läkemedel som används för att behandla symtom på typ 2-diabetes mellitus. Glucovance kan användas ensamt eller tillsammans med andra läkemedel.
Glucovance tillhör en klass av läkemedel som kallas antidiabetika, sulfonureider/biguanider.
Det är inte känt om Glucovance 2,50 mg är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Glucovance 400mg?
Glucovance kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- svullnad,
- snabb viktökning,
- andnöd,
- extrem svaghet,
- suddig syn,
- svettas,
- problem med att prata,
- skakningar,
- magont,
- förvirring,
- anfall,
- ovanlig muskelsmärta,
- problem att andas,
- magont,
- kräkningar,
- oregelbunden hjärtfrekvens,
- yrsel,
- känns kallt,
- svaghet och
- trötthet
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Glucovance inkluderar:
- lågt blodsocker,
- illamående,
- diarre,
- orolig mage, och
- huvudvärk
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Glucovance. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
GLUCOVANCE® (Glyburide och Metformin HCl) tabletter innehåller 2 orala antihyperglykemiska läkemedel som används vid behandling av typ 2-diabetes, glyburid och metforminhydroklorid.
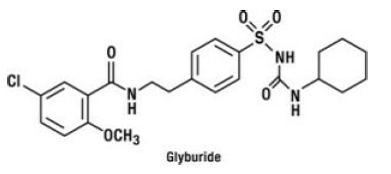
Glyburid är ett oralt antihyperglykemiskt läkemedel av sulfonylureaklassen. Det kemiska namnet för glyburid är 1-[[p-[2-(5-klor-o-anisamido)etyl]fenyl]sulfonyl]-3-cyklohexylurea. Glyburid är en vit till benvit kristallin förening med molekylformeln C23H28ClN3O5S och en molekylvikt på 494,01. Glyburiden som används i GLUCOVANCE 5mg har en partikelstorleksfördelning på 25 % understorleksvärde högst 6 μm, 50 % understorleksvärde högst 7 till 10 μm och 75 % understorleksvärde inte mer än 21 μm. Strukturformeln visas nedan.
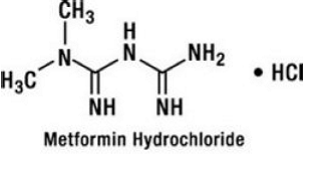
Metforminhydroklorid är ett oralt antihyperglykemiskt läkemedel som används vid behandling av typ 2-diabetes. Metforminhydroklorid (N,N-dimetylimidodikarbonimiddiamidmonohydroklorid) är inte kemiskt eller farmakologiskt relaterat till sulfonylureor, tiazolidindioner eller α-glukosidashämmare. Det är en vit till benvit kristallin förening med molekylformeln C4H12ClN5 (monohydroklorid) och en molekylvikt på 165,63. Metforminhydroklorid är fritt lösligt i vatten och är praktiskt taget olösligt i aceton, eter och kloroform. pKa för metformin är 12,4. pH för en 1% vattenlösning av metforminhydroklorid är 6,68. Strukturformeln är som visas:
GLUCOVANCE 500 mg finns för oral administrering i tabletter som innehåller 1,25 mg glyburid med 250 mg metforminhydroklorid, 2,5 mg glyburid med 500 mg metforminhydroklorid och 5 mg glyburid med 500 mg metforminhydroklorid. Dessutom innehåller varje tablett följande inaktiva ingredienser: mikrokristallin cellulosa, povidon, kroskarmellosnatrium och magnesiumstearat. Tabletterna är filmdragerade, vilket ger färgdifferentiering.
INDIKATIONER
GLUCOVANCE (Glyburide och Metformin HCl) tabletter är indicerat som ett komplement till kost och träning för att förbättra den glykemiska kontrollen hos vuxna med typ 2-diabetes mellitus.
DOSERING OCH ADMINISTRERING
allmänna överväganden
Doseringen av GLUCOVANCE måste individualiseras utifrån både effektivitet och tolerans utan att den maximala rekommenderade dagliga dosen på 20 mg glyburid/2000 mg metformin överskrids. GLUCOVANCE ska ges i samband med måltider och bör inledas med en låg dos, med gradvis dosökning enligt beskrivningen nedan, för att undvika hypoglykemi (till stor del på grund av glyburid), minska GI-biverkningar (till stor del på grund av metformin) och möjliggöra bestämning av den minsta effektiva dosen för adekvat kontroll av blodsockret för den enskilda patienten.
Med initial behandling och under dostitrering bör lämplig blodsockerövervakning användas för att fastställa det terapeutiska svaret på GLUCOVANCE 2,50 mg och för att identifiera den minsta effektiva dosen för patienten. Därefter bör HbA1c mätas med cirka 3 månaders intervall för att bedöma behandlingens effektivitet. Det terapeutiska målet för alla patienter med typ 2-diabetes är att minska FPG, PPG och HbA1c till normalt eller så nära normalt som möjligt. Helst bör svaret på behandlingen utvärderas med HbA (glykosylerat hemoglobin), vilket är en bättre indikator på långvarig glykemisk kontroll än FPG enbart.
Inga studier har utförts som specifikt undersöker säkerheten och effekten av att byta till GLUCOVANCE 400 mg-behandling hos patienter som samtidigt tar glyburid (eller annan sulfonylurea) plus metformin. Förändringar i glykemisk kontroll kan inträffa hos sådana patienter, med antingen hyperglykemi eller hypoglykemi möjlig. Alla förändringar i behandling av typ 2-diabetes bör utföras med försiktighet och lämplig övervakning.
GLUCOVANCE hos patienter med otillräcklig glykemisk kontroll vid kost och träning
Rekommenderad startdos: 1,25 mg/250 mg en eller två gånger dagligen i samband med måltid.
För patienter med typ 2-diabetes vars hyperglykemi inte kan hanteras på ett tillfredsställande sätt med enbart diet och träning, är den rekommenderade startdosen av GLUCOVANCE 400 mg 1,25 mg/250 mg en gång dagligen med en måltid. Som initial behandling hos patienter med HbA1c > 9 % eller en FPG > 200 mg/dL kan en startdos av GLUCOVANCE 1,25 mg/250 mg två gånger dagligen användas tillsammans med morgon- och kvällsmåltider. Dosökningar bör göras i steg om 1,25 mg/250 mg per dag varannan vecka upp till den minsta effektiva dos som krävs för att uppnå adekvat kontroll av blodsockret. I kliniska prövningar av GLUCOVANCE som initial behandling fanns det ingen erfarenhet av totala dagliga doser > 10 mg/2000 mg per dag. GLUCOVANCE 5 mg/500 mg ska inte användas som initial behandling på grund av ökad risk för hypoglykemi.
GLUCOVANCE 500mg Användning hos patienter med otillräcklig glykemisk kontroll på en sulfonureid och/eller metformin
Rekommenderad startdos: 2,5 mg/500 mg eller 5 mg/500 mg två gånger dagligen i samband med måltid.
För patienter som inte är tillräckligt kontrollerade med antingen glyburid (eller annan sulfonureid) eller enbart metformin, är den rekommenderade startdosen av GLUCOVANCE 2,5 mg/500 mg eller 5 mg/500 mg två gånger dagligen med morgon- och kvällsmål. För att undvika hypoglykemi bör startdosen av GLUCOVANCE 2,50 mg inte överstiga de dagliga doser av glyburid eller metformin som redan tas. Den dagliga dosen bör titreras i steg om högst 5 mg/500 mg upp till den minsta effektiva dosen för att uppnå adekvat kontroll av blodsockret eller till en maximal dos på 20 mg/2000 mg per dag.
För patienter som tidigare behandlats med kombinationsbehandling av glyburid (eller annan sulfonylurea) plus metformin, om byte till GLUCOVANCE, bör startdosen inte överstiga den dagliga dosen av glyburid (eller motsvarande dos av en annan sulfonylurea) och metformin som redan tas. Patienter bör övervakas noggrant med avseende på tecken och symtom på hypoglykemi efter ett sådant byte och dosen av GLUCOVANCE bör titreras enligt beskrivningen ovan för att uppnå adekvat kontroll av blodsockret.
Tillsats av tiazolidindioner till GLUCOVANCE terapi
För patienter som inte är tillräckligt kontrollerade på GLUCOVANCE kan en tiazolidindion läggas till GLUCOVANCE 400 mg-behandling. När en tiazolidindion läggs till GLUCOVANCE-behandlingen kan den aktuella dosen av GLUCOVANCE 500 mg fortsätta och tiazolidindion initieras med den rekommenderade startdosen. För patienter som behöver ytterligare glykemisk kontroll kan dosen av tiazolidindion ökas baserat på dess rekommenderade titreringsschema. Den ökade glykemiska kontrollen som kan uppnås med GLUCOVANCE plus en tiazolidindion kan öka risken för hypoglykemi när som helst på dygnet. Hos patienter som utvecklar hypoglykemi när de får GLUCOVANCE 5 mg och en tiazolidindion, bör man överväga att minska dosen av glyburidkomponenten i GLUCOVANCE. Som kliniskt motiverat bör justering av doserna av de andra komponenterna i den antidiabetiska regimen också övervägas.
Patienter som får Colesevelam
När kolesevelam administreras samtidigt med glyburid minskar maximal plasmakoncentration och total exponering för glyburid. Därför bör GLUCOVANCE administreras minst 4 timmar före behandling med colesevelam.
Specifika patientpopulationer
GLUCOVANCE rekommenderas inte för användning under graviditet. Initial- och underhållsdoseringen av GLUCOVANCE bör vara konservativ hos patienter med hög ålder, på grund av risken för nedsatt njurfunktion i denna population. All dosjustering kräver en noggrann bedömning av njurfunktionen. I allmänhet bör äldre, försvagade och undernärda patienter inte titreras till maximal dos av GLUCOVANCE för att undvika risken för hypoglykemi. Övervakning av njurfunktionen är nödvändig för att hjälpa till att förebygga metforminassocierad laktacidos, särskilt hos äldre. (Ser VARNINGAR .)
HUR LEVERERAS
GLUCOVANCE® (Glyburide och Metformin HCl) tabletter
GLUCOVANCE 1,25 mg/250 mg tablett är en blekgul, kapselformad, bikonvex, filmdragerad tablett med fasade kanter med " BMS " präglad på ena sidan och " 6072 ” präglad på motsatt sida.
GLUCOVANCE 2,5 mg/500 mg tabletten är en ljusorange, kapselformad, bikonvex, filmdragerad tablett med fasade kanter med " BMS " präglad på ena sidan och " 6073 ” präglad på motsatt sida.
GLUCOVANCE 5 mg/500 mg tablett är en gul, kapselformad, bikonvex, filmdragerad tablett med fasade kanter med " BMS " präglad på ena sidan och " 6074 ” präglad på motsatt sida.
Lagring
Förvara vid temperaturer upp till 25°C (77°F). [Ser USP-kontrollerad rumstemperatur .]
Dispensera i ljuståliga behållare.
Distribueras av: Bristol-Myers Squibb Company, Princeton, NJ 08543 USA 1158884A7. Rev okt 2013
BIEFFEKTER
GLUCOVANCE
dubbelblinda kliniska prövningar som involverade GLUCOVANCE 2,50 mg som initial behandling eller som andrahandsbehandling, fick totalt 642 patienter GLUCOVANCE 2,50 mg, 312 fick metforminbehandling, 324 fick glyburidbehandling och 161 fick placebo. Andelen patienter som rapporterade händelser och typer av biverkningar som rapporterats i kliniska prövningar av GLUCOVANCE (alla styrkor) som initial terapi och andrahandsbehandling listas i Tabell 6.
I en kontrollerad klinisk prövning av rosiglitazon kontra placebo hos patienter behandlade med GLUCOVANCE (n=365), fick 181 patienter GLUCOVANCE 5 mg med rosiglitazon och 184 fick GLUCOVANCE med placebo.
Ödem rapporterades hos 7,7 % (14/181) av patienterna som behandlades med rosiglitazon jämfört med 2,2 % (4/184) av patienterna som behandlades med placebo. En genomsnittlig viktökning på 3 kg observerades hos rosiglitazonbehandlade patienter.
Disulfiramliknande reaktioner har mycket sällan rapporterats hos patienter som behandlats med glyburidtabletter.
Hypoglykemi
kontrollerade kliniska prövningar av GLUCOVANCE 5 mg förekom inga hypoglykemiska episoder som krävde medicinsk intervention och/eller farmakologisk behandling; alla händelser hanterades av patienterna. Incidensen av rapporterade symtom på hypoglykemi (såsom yrsel, skakningar, svettning och hunger) i den inledande behandlingsstudien med GLUCOVANCE 2,50 mg sammanfattas i tabell 7. Frekvensen av hypoglykemiska symtom hos patienter som behandlas med GLUCOVANCE 1,25 mg/250 mg var högst hos patienter med ett HbA1c-värde 8 %. För patienter med ett HbA1c-värde på mellan 8 % och 11 % behandlade med GLUCOVANCE 2,5 mg/500 mg som initial behandling, var frekvensen av hypoglykemiska symtom 30 % till 35 %. Som andrahandsbehandling hos patienter som inte var tillräckligt kontrollerade med enbart sulfonylurea upplevde cirka 6,8 % av alla patienter som behandlades med GLUCOVANCE 2,50 mg hypoglykemiska symtom. När rosiglitazon lades till GLUCOVANCE 2,50 mg-behandling rapporterade 22 % av patienterna 1 eller fler fingersticksglukosmätningar ≤ 50 mg/dL jämfört med 3,3 % av placebobehandlade patienter. Alla hypoglykemiska händelser hanterades av patienterna och endast 1 patient avbröt behandlingen på grund av hypoglykemi. (Ser FÖRSIKTIGHETSÅTGÄRDER : Allmän : Tillägg av tiazolidindioner till GLUCOVANCE Therapy .)
Gastrointestinala reaktioner
Incidensen av gastrointestinala (GI) biverkningar (diarré, illamående/kräkningar och buksmärtor) i den initiala behandlingsstudien sammanfattas i Tabell 7. I alla GLUCOVANCE 500 mg-studier var gastrointestinala symtom de vanligaste biverkningarna med GLUCOVANCE 400 mg och var oftare vid högre dosnivåer.
I kontrollerade studier avbröt
I rapporter efter marknadsföring kan kolestatisk gulsot och hepatit förekomma i sällsynta fall, vilket kan utvecklas till leversvikt; GLUCOVANCE 5mg ska avbrytas om detta inträffar.
LÄKEMEDELSINTERAKTIONER
GLUCOVANCE
Vissa läkemedel tenderar att producera hyperglykemi och kan leda till förlust av blodsockerkontrollen. Dessa läkemedel inkluderar tiazider och andra diuretika, kortikosteroider, fenotiaziner, sköldkörtelprodukter, östrogener, orala preventivmedel, fenytoin, nikotinsyra, sympatomimetika, kalciumkanalblockerande läkemedel och isoniazid. När sådana läkemedel administreras till en patient som får GLUCOVANCE 400 mg, ska patienten observeras noga med avseende på förlust av blodsockerkontrollen. När sådana läkemedel tas ut från en patient som får GLUCOVANCE, ska patienten observeras noggrant med avseende på hypoglykemi. Metformin är försumbart bundet till plasmaproteiner och är därför mindre benäget att interagera med starkt proteinbundna läkemedel såsom salicylater, sulfonamider, kloramfenikol och probenecid jämfört med sulfonylureider, som i hög grad är bundna till serumproteiner.
Glyburide
Den hypoglykemiska effekten av sulfonylureider kan förstärkas av vissa läkemedel, inklusive icke-steroida antiinflammatoriska medel och andra läkemedel som är starkt proteinbundna, salicylater, sulfonamider, kloramfenikol, probenecid, kumariner, monoaminoxidashämmare och beta-adrenerga blockerande medel. När sådana läkemedel ges till en patient som får GLUCOVANCE, ska patienten observeras noggrant med avseende på hypoglykemi. När sådana läkemedel tas ut från en patient som får GLUCOVANCE 2,50 mg, ska patienten observeras noggrant med avseende på förlust av blodsockerkontrollen.
En ökad risk för förhöjda leverenzymer observerades hos patienter som fick glyburid samtidigt med bosentan. Därför är samtidig administrering av GLUCOVANCE och bosentan kontraindicerat.
En möjlig interaktion mellan glyburid och ciprofloxacin, ett fluorokinolonantibiotikum, har rapporterats, vilket resulterar i en förstärkning av den hypoglykemiska effekten av glyburid. Mekanismen för denna interaktion är inte känd.
En potentiell interaktion mellan oralt mikonazol och orala hypoglykemiska medel som leder till allvarlig hypoglykemi har rapporterats. Det är inte känt om denna interaktion även inträffar med de intravenösa, topikala eller vaginala preparaten av mikonazol.
Kolesevelam: Samtidig administrering av kolesevelam och glyburid resulterade i minskningar av glyburid AUC och Cmax med 32 % respektive 47 %. Minskningarna av glyburid AUC och Cmax var 20 % respektive 15 % vid administrering 1 timme innan, och ändrades inte signifikant (-7 % respektive 4 %) vid administrering 4 timmar före colesevelam.
Metforminhydroklorid
Furosemid
En endosstudie av metformin-furosemid läkemedelsinteraktion på friska försökspersoner visade att farmakokinetiska parametrar för båda föreningarna påverkades av samtidig administrering. Furosemid ökade metformins plasma och blod Cmax med 22 % och blodets AUC med 15 %, utan någon signifikant förändring av metformins renal clearance. När det administrerades med metformin var Cmax och AUC för furosemid 31 % respektive 12 % lägre än när det administrerades ensamt, och den terminala halveringstiden minskade med 32 %, utan någon signifikant förändring i furosemid renalt clearance. Ingen information finns tillgänglig om interaktionen mellan metformin och furosemid vid kronisk samtidig administrering.
Nifedipin
En endosstudie av metformin-nifedipin läkemedelsinteraktion på normala friska frivilliga visade att samtidig administrering av nifedipin ökade plasmametformin Cmax och AUC med 20 % respektive 9 % och ökade mängden som utsöndras i urinen. Tmax och halveringstid påverkades inte. Nifedipin verkar förbättra absorptionen av metformin. Metformin hade minimal effekt på nifedipin.
Katjoniska droger
Katjoniska läkemedel (t.ex. amilorid, digoxin, morfin, prokainamid, kinidin, kinin, ranitidin, triamteren, trimetoprim eller vankomycin) som elimineras genom renal tubulär sekretion har teoretiskt sett potential för interaktion med metformin genom att konkurrera om vanliga renala tubulära transportsystem. Sådan interaktion mellan metformin och oralt cimetidin har observerats hos normala friska frivilliga i både engångs- och multipeldosstudier med metformin-cimetidinläkemedelsinteraktioner, med en 60 % ökning av maximala plasma- och helblodskoncentrationer av metformin och en 40 % ökning av plasma och AUC för metformin i helblod. Det fanns ingen förändring i eliminationshalveringstid i singeldosstudien. Metformin hade ingen effekt på cimetidins farmakokinetik. Även om sådana interaktioner förblir teoretiska (förutom cimetidin), rekommenderas noggrann patientövervakning och dosjustering av GLUCOVANCE och/eller det störande läkemedlet till patienter som tar katjoniska läkemedel som utsöndras via det proximala njurtubulära sekretoriska systemet.
Övrig
Hos friska frivilliga påverkades inte farmakokinetiken för metformin och propranolol och metformin och ibuprofen vid samtidig administrering i endosinteraktionsstudier.
VARNINGAR
Metforminhydroklorid
Mjölksyra
Laktacidos är en sällsynt, men allvarlig, metabolisk komplikation som kan uppstå på grund av metforminackumulering under behandling med GLUCOVANCE (Glyburide och Metformin HCl) tabletter; när det inträffar är det dödligt i cirka 50 % av fallen. Laktacidos kan också förekomma i samband med ett antal patofysiologiska tillstånd, inklusive diabetes mellitus, och närhelst det finns betydande vävnadshyperfusion och hypoxemi. Laktatacidos kännetecknas av förhöjda laktatnivåer i blodet (> 5 mmol/L), sänkt blod-pH, elektrolytrubbningar med ökat anjongap och ett ökat laktat/pyruvat-förhållande. När metformin är inblandad som orsak till laktacidos, hittas vanligtvis plasmanivåer av metformin > 5 μg/ml.
Den rapporterade incidensen av laktacidos hos patienter som får metforminhydroklorid är mycket låg (cirka 0,03 fall/1 000 patientår, med cirka 0,015 dödliga fall/1 000 patientår). Under mer än 20 000 patientår exponering för metformin i kliniska prövningar fanns inga rapporter om laktacidos. Rapporterade fall har förekommit främst hos diabetespatienter med signifikant njurinsufficiens, inklusive både inneboende njursjukdom och renal hypoperfusion, ofta i samband med flera samtidiga medicinska/kirurgiska problem och flera samtidiga medicineringar. Patienter med kronisk hjärtsvikt som kräver farmakologisk behandling, särskilt de med instabil eller akut kronisk hjärtsvikt som löper risk för hypoperfusion och hypoxemi, löper ökad risk för laktacidos. Risken för laktacidos ökar med graden av nedsatt njurfunktion och patientens ålder. Risken för laktacidos kan därför minskas avsevärt genom regelbunden övervakning av njurfunktionen hos patienter som tar metformin och genom användning av den minsta effektiva dosen av metformin. I synnerhet bör behandling av äldre åtföljas av noggrann övervakning av njurfunktionen. Behandling med GLUCOVANCE 2,50 mg ska inte inledas hos patienter ≥ 80 år om inte mätning av kreatininclearance visar att njurfunktionen inte är nedsatt, eftersom dessa patienter är mer mottagliga för att utveckla laktacidos. Dessutom ska GLUCOVANCE omedelbart avbrytas i närvaro av något tillstånd associerat med hypoxemi, uttorkning eller sepsis. Eftersom nedsatt leverfunktion avsevärt kan begränsa förmågan att rensa laktat, bör GLUCOVANCE i allmänhet undvikas hos patienter med kliniska eller laboratoriemässiga tecken på leversjukdom. Patienter bör varnas mot överdrivet alkoholintag, antingen akut eller kronisk, när de tar GLUCOVANCE 2,50 mg, eftersom alkohol potentierar effekterna av metforminhydroklorid på laktatmetabolismen. Dessutom bör GLUCOVANCE 5 mg tillfälligt avbrytas före en intravaskulär radiokontraststudie och för alla kirurgiska ingrepp (se även FÖRSIKTIGHETSÅTGÄRDER).
Uppkomsten av laktacidos är ofta subtil och åtföljs endast av ospecifika symtom såsom sjukdomskänsla, myalgi, andnöd, ökad somnolens och ospecifik bukbesvär. Det kan vara associerad hypotermi, hypotoni och resistenta bradyarytmier med mer uttalad acidos. Patienten och patientens läkare måste vara medvetna om den möjliga betydelsen av sådana symtom och patienten bör instrueras att omedelbart meddela läkaren om de inträffar (se även FÖRSIKTIGHETSÅTGÄRDER). GLUCOVANCE 500 mg ska dras ut tills situationen är klarlagd. Serumelektrolyter, ketoner, blodsocker, och om indikerat, blodets pH, laktatnivåer och till och med blodmetforminnivåer kan vara användbara. När en patient väl har stabiliserats på någon dosnivå av GLUCOVANCE är det osannolikt att gastrointestinala symtom, som är vanliga under inledning av behandling med metformin, är läkemedelsrelaterade. Senare uppkomst av gastrointestinala symtom kan bero på laktacidos eller annan allvarlig sjukdom.
Nivåer av fastande venöst plasmalaktat över den övre normalgränsen men mindre än 5 mmol/L hos patienter som tar GLUCOVANCE indikerar inte nödvändigtvis förestående laktacidos och kan förklaras av andra mekanismer, såsom dåligt kontrollerad diabetes eller fetma, kraftig fysisk aktivitet, eller tekniska problem i s riklig hantering. (Se även FÖRSIKTIGHETSÅTGÄRDER.)
Laktacidos bör misstänkas hos alla diabetespatienter med metabolisk acidos som saknar tecken på ketoacidos (ketonuri och ketonemi).
Laktacidos är en medicinsk nödsituation som måste behandlas på sjukhus. Hos en patient med laktacidos som tar GLUCOVANCE 500 mg ska läkemedlet avbrytas omedelbart och allmänna stödåtgärder omedelbart sättas in. Eftersom metforminhydroklorid är dialyserbart (med ett clearance på upp till 170 ml/min under goda hemodynamiska förhållanden), rekommenderas snabb hemodialys för att korrigera acidosen och avlägsna det ackumulerade metforminet. Sådan hantering resulterar ofta i omedelbar återhämtning av symtom och återhämtning. (Se även KONTRAINDIKATIONER och FÖRSIKTIGHETSÅTGÄRDER.)
SÄRSKILD VARNING OM ÖKAD RISK FÖR Hjärt- och kärldödlighet
Administrering av orala hypoglykemiska läkemedel har rapporterats vara associerad med ökad kardiovaskulär mortalitet jämfört med behandling med enbart diet eller diet plus insulin. Denna varning är baserad på studien utförd av University Group Diabetes Program (UGDP), en långsiktig prospektiv klinisk prövning utformad för att utvärdera effektiviteten av glukossänkande läkemedel för att förebygga eller fördröja vaskulära komplikationer hos patienter med icke-insulinberoende diabetes. Studien involverade 823 patienter som slumpmässigt tilldelades 1 av 4 behandlingsgrupper (Diabetes 19 (Suppl. 2):747-830, 1970).
UGDP rapporterade att patienter som behandlats i 5 till 8 år med diet plus en fast dos tolbutamid (1,5 g per dag) hade en kardiovaskulär dödlighet som var ungefär 2½ gånger högre än för patienter som behandlades med enbart diet. En signifikant ökning av den totala dödligheten observerades inte, men användningen av tolbutamid avbröts baserat på ökningen av kardiovaskulär mortalitet, vilket begränsar möjligheten för studien att visa en ökning av den totala dödligheten. Trots kontroverser angående tolkningen av dessa resultat ger resultaten av UGDP-studien en adekvat bas för denna varning. Patienten bör informeras om de potentiella riskerna och fördelarna med glyburid och om alternativa behandlingssätt.
Även om endast ett läkemedel i sulfonylureaklassen (tolbutamid) inkluderades i denna studie, är det klokt ur säkerhetssynpunkt att överväga att denna varning även kan gälla andra hypoglykemiska läkemedel i denna klass, med tanke på deras nära likheter i verkningssätt. och kemisk struktur.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Makrovaskulära resultat
Det har inte gjorts några kliniska studier som har fastställt avgörande bevis för minskning av makrovaskulär risk med GLUCOVANCE 5 mg eller något annat antidiabetiskt läkemedel.
GLUCOVANCE
Hypoglykemi
GLUCOVANCE 400mg kan ge hypoglykemi eller hypoglykemiska symtom, därför är korrekt patientval, dosering och instruktioner viktiga för att undvika potentiella hypoglykemiska episoder. Risken för hypoglykemi ökar när kaloriintaget är bristfälligt, när ansträngande träning inte kompenseras av kaloritillskott eller vid samtidig användning med andra glukossänkande medel eller etanol. Njur- eller leverinsufficiens kan orsaka förhöjda läkemedelsnivåer av både glyburid och metforminhydroklorid, och leverinsufficiens kan också minska glukoneogen kapacitet, vilket båda ökar risken för hypoglykemiska reaktioner. Äldre, försvagade eller undernärda patienter och de med binjure- eller hypofysinsufficiens eller alkoholförgiftning är särskilt mottagliga för hypoglykemiska effekter. Hypoglykemi kan vara svår att känna igen hos äldre och personer som tar beta-adrenerga blockerande läkemedel.
Glyburide
Hemolytisk anemi
Behandling av patienter med glukos-6-fosfatdehydrogenas (G6PD)-brist med sulfonylureamedel kan leda till hemolytisk anemi. Eftersom GLUCOVANCE 400mg tillhör klassen av sulfonylureamedel, bör försiktighet iakttas hos patienter med G6PD-brist och ett icke-sulfonylureaalternativ bör övervägas. I rapporter efter marknadsföring har hemolytisk anemi också rapporterats hos patienter som inte hade känd G6PD-brist.
Metforminhydroklorid
Övervakning av njurfunktion
Det är känt att metformin utsöndras till stor del via njurarna, och risken för metforminackumulering och laktacidos ökar med graden av försämrad njurfunktion. Patienter med serumkreatininnivåer över den övre normalgränsen för deras ålder bör därför inte få GLUCOVANCE. Hos patienter med hög ålder bör GLUCOVANCE 400 mg noggrant titreras för att fastställa den lägsta dosen för adekvat glykemisk effekt, eftersom åldrande är förknippat med nedsatt njurfunktion. Hos äldre patienter, särskilt de ≥ 80 år, bör njurfunktionen övervakas regelbundet och i allmänhet bör GLUCOVANCE 2,50 mg inte titreras till maximal dos (se VARNINGAR och DOSERING OCH ADMINISTRERING ). Innan behandling med GLUCOVANCE 2,50 mg påbörjas och minst en gång per år därefter, bör njurfunktionen utvärderas och verifieras som normal. Hos patienter hos vilka utveckling av njurdysfunktion förväntas, bör njurfunktionen utvärderas oftare och GLUCOVANCE sättas ut om tecken på nedsatt njurfunktion föreligger.
Användning av samtidig medicinering som kan påverka njurfunktionen eller metformindisposition
Samtidig medicinering som kan påverka njurfunktionen eller resultera i signifikant hemodynamisk förändring eller kan störa dispositionen av metformin, såsom katjoniska läkemedel som elimineras genom renal tubulär sekretion (se LÄKEMEDELSINTERAKTIONER ), bör användas med försiktighet.
Radiologiska studier som involverar användning av intravaskulära joderade kontrastmaterial (till exempel intravenös urogram, intravenös kolangiografi, angiografi och datortomografi (CT) med intravaskulära kontrastmaterial)
Intravaskulära kontraststudier med joderade material kan leda till akut förändring av njurfunktionen och har associerats med laktacidos hos patienter som får metformin (se KONTRAINDIKATIONER ). Hos patienter där en sådan studie är planerad bör därför GLUCOVANCE 400 mg avbrytas tillfälligt vid tidpunkten för eller före ingreppet, och avbrytas i 48 timmar efter ingreppet och återupptas först efter att njurfunktionen har omvärderats och visat sig vara vanligt.
Hypoxiska tillstånd
Kardiovaskulär kollaps (chock) oavsett orsak, akut kongestiv hjärtsvikt, akut hjärtinfarkt och andra tillstånd som kännetecknas av hypoxemi har associerats med laktacidos och kan också orsaka prerenal azotemi. När sådana händelser inträffar hos patienter som behandlas med GLUCOVANCE 2,50 mg, ska läkemedlet avbrytas omedelbart.
Kirurgiska ingrepp
Behandlingen med GLUCOVANCE 400 mg bör tillfälligt avbrytas för alla kirurgiska ingrepp (förutom mindre ingrepp som inte är förknippade med begränsat intag av mat och vätskor) och bör inte återupptas förrän patientens orala intag har återupptagits och njurfunktionen har utvärderats som normalt.
Alkoholintag
Alkohol är känt för att potentiera effekten av metformin på laktatmetabolismen. Patienter bör därför varnas för överdrivet alkoholintag, akut eller kronisk, medan de får GLUCOVANCE. På grund av dess effekt på leverns glukoneogena kapacitet kan alkohol också öka risken för hypoglykemi.
Nedsatt leverfunktion
Eftersom nedsatt leverfunktion har associerats med vissa fall av laktacidos, bör GLUCOVANCE 500 mg i allmänhet undvikas hos patienter med kliniska eller laboratoriemässiga tecken på leversjukdom.
Vitamin B12 nivåer
kontrollerade kliniska prövningar med metformin av 29 veckors varaktighet observerades en minskning till subnormala nivåer av tidigare normala serumvitamin B12, utan kliniska manifestationer, hos cirka 7 % av patienterna. En sådan minskning, möjligen på grund av störning av B12-absorptionen från B12-intrinsic factor-komplexet, är dock mycket sällan förknippad med anemi och tycks vara snabbt reversibel med avbrytande av metformin eller vitamin B-tillskott. Mätning av hematologiska parametrar på årsbasis rekommenderas till patienter på metformin och alla uppenbara avvikelser bör utredas och hanteras på lämpligt sätt (se FÖRSIKTIGHETSÅTGÄRDER : Laboratorietester ).
Vissa individer (de med otillräckligt vitamin B12 eller kalciumintag eller absorption) verkar vara predisponerade för att utveckla subnormala vitamin B12-nivåer. Hos dessa patienter kan rutinmätningar av vitamin B12 i serum med 2 till 3 års intervall vara användbara.
Förändring i klinisk status hos patienter med tidigare kontrollerad typ 2-diabetes
En patient med typ 2-diabetes tidigare välkontrollerad på metformin och som utvecklar laboratorieavvikelser eller klinisk sjukdom (särskilt vag och dåligt definierad sjukdom) bör utvärderas omedelbart för tecken på ketoacidos eller laktacidos. Utvärdering bör inkludera serumelektrolyter och ketoner, blodsocker och, om indicerat, blodets pH, laktat, pyruvat och metforminnivåer. Om acidos av någon av formerna inträffar måste GLUCOVANCE stoppas omedelbart och andra lämpliga korrigerande åtgärder vidtas (se även VARNINGAR ).
Tillsats av tiazolidindioner till GLUCOVANCE 500 mg terapi
Hypoglykemi
Patienter som får GLUCOVANCE 2,50 mg i kombination med en tiazolidindion kan löpa risk för hypoglykemi.
Viktökning
Viktökning sågs med tillägg av rosiglitazon till GLUCOVANCE 5 mg, liknande den som rapporterats för enbart tiazolidindionbehandling.
Levereffekter
När en tiazolidindion används i kombination med GLUCOVANCE 2,50 mg, bör periodisk övervakning av leverfunktionstester utföras i enlighet med de märkta rekommendationerna för tiazolidindion.
Information för patienter
GLUCOVANCE
Patienterna bör informeras om de potentiella riskerna och fördelarna med GLUCOVANCE 500 mg och alternativa behandlingssätt. De bör också informeras om vikten av att följa kostråden; ett regelbundet träningsprogram; och regelbunden testning av blodglukos, glykosylerat hemoglobin, njurfunktion och hematologiska parametrar.
Riskerna för laktacidos i samband med metforminbehandling, dess symtom och tillstånd som predisponerar för dess utveckling, som anges i avsnitten VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER, bör förklaras för patienterna. Patienter bör rådas att omedelbart avbryta behandlingen med GLUCOVANCE och omedelbart meddela sin läkare om oförklarlig hyperventilering, myalgi, sjukdomskänsla, ovanlig somnolens eller andra ospecifika symtom uppstår. När en patient väl har stabiliserats på någon dosnivå av GLUCOVANCE är det osannolikt att gastrointestinala symtom, som är vanliga under inledning av metforminbehandling, är läkemedelsrelaterade. Senare uppkomst av gastrointestinala symtom kan bero på laktacidos eller annan allvarlig sjukdom.
Riskerna för hypoglykemi, dess symtom och behandling samt tillstånd som predisponerar för dess utveckling bör förklaras för patienter och ansvariga familjemedlemmar.
Patienter bör rådas mot överdrivet alkoholintag, antingen akut eller kronisk, medan de får GLUCOVANCE. (Ser PATIENTINFORMATION tryckt Nedan.)
Laboratorietester
Periodiska mätningar av fasteblodsocker (FBG) och HbA1c bör utföras för att övervaka terapeutiskt svar.
Initial och periodisk övervakning av hematologiska parametrar (t.ex. hemoglobin/hematokrit och röda blodkroppsindex) och njurfunktion (serumkreatinin) bör utföras, åtminstone på årsbasis. Medan megaloblastisk anemi sällan har setts vid metforminbehandling, bör vitamin B12-brist uteslutas om detta misstänks.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Inga djurstudier har utförts med de kombinerade produkterna i GLUCOVANCE. Följande data är baserade på fynd i studier utförda med de enskilda produkterna.
Glyburide
Studier på råttor med enbart glyburid i doser upp till 300 mg/kg/dag (ungefär 145 gånger den maximala rekommenderade dagliga dosen [MRHD] på 20 mg för glyburidkomponenten i GLUCOVANCE 5 mg baserat på jämförelser av kroppsyta) under 18 månader avslöjade inga cancerframkallande effekter. I en 2-årig onkogenicitetsstudie av glyburid hos möss fanns inga tecken på behandlingsrelaterade tumörer.
Det fanns inga tecken på mutagen potential för enbart glyburid i följande in vitro-tester: Salmonella-mikrosomtest (Ames-test) och i DNA-skada/alkalisk elueringsanalysen.
Metforminhydroklorid
Långtidsstudier av karcinogenicitet utfördes med enbart metformin på råttor (doseringstid på 104 veckor) och möss (doseringstid på 91 veckor) i doser upp till och inklusive 900 mg/kg/dag respektive 1500 mg/kg/dag. Dessa doser är båda cirka 4 gånger MRHD-dosen på 2000 mg av metforminkomponenten i GLUCOVANCE 400 mg baserat på jämförelser av kroppsytan. Inga tecken på karcinogenicitet med enbart metformin hittades hos varken hanmöss eller honmöss. På liknande sätt observerades ingen tumörframkallande potential med enbart metformin hos hanråttor. Det fanns dock en ökad incidens av benigna stromala livmoderpolyper hos honråttor som behandlats med enbart 900 mg/kg/dag av metformin.
Det fanns inga tecken på en mutagen potential för enbart metformin i följande in vitro-tester: Ames-test (S. typhimurium), genmutationstest (muslymfomceller) eller kromosomavvikelsetest (humana lymfocyter). Resultaten i in vivo-musmikronkärntestet var också negativa.
Fertiliteten hos han- eller honråttor påverkades inte av enbart metformin när det administrerades i doser så höga som 600 mg/kg/dag, vilket är cirka 3 gånger MRHD-dosen av metforminkomponenten i GLUCOVANCE 400 mg baserat på jämförelser av kroppsytan.
Graviditet
Teratogena effekter
Graviditetskategori B
Färsk information tyder starkt på att onormala blodsockernivåer under graviditet är associerade med en högre förekomst av medfödda avvikelser. De flesta experter rekommenderar att insulin används under graviditeten för att hålla blodsockret så nära det normala som möjligt. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör GLUCOVANCE 400 mg inte användas under graviditet om det inte är absolut nödvändigt. (Se nedan.)

Det finns inga adekvata och välkontrollerade studier på gravida kvinnor med GLUCOVANCE eller dess individuella komponenter. Inga djurstudier har utförts med de kombinerade produkterna i GLUCOVANCE. Följande data är baserade på fynd i studier utförda med de enskilda produkterna.
Glyburide
Reproduktionsstudier utfördes på råttor och kaniner i doser upp till 500 gånger MRHD-dosen på 20 mg av glyburidkomponenten i GLUCOVANCE 500 mg baserat på jämförelser av kroppsytan och visade inga tecken på nedsatt fertilitet eller skada på fostret på grund av glyburid.
Metforminhydroklorid
Enbart metformin var inte teratogent hos råttor eller kaniner vid doser upp till 600 mg/kg/dag. Detta motsvarar en exponering på cirka 2 och 6 gånger MRHD-dosen på 2000 mg av metforminkomponenten i GLUCOVANCE 500 mg baserat på jämförelser av kroppsytan för råttor respektive kaniner. Bestämning av fosterkoncentrationer visade en partiell placentabarriär mot metformin.
Icke-ratogena effekter
Långvarig allvarlig hypoglykemi (4-10 dagar) har rapporterats hos nyfödda födda av mödrar som fick ett sulfonylurealäkemedel vid tidpunkten för förlossningen. Detta har rapporterats oftare vid användning av medel med förlängd halveringstid. Det rekommenderas inte att GLUCOVANCE 400 mg används under graviditet. Men om det används ska GLUCOVANCE avbrytas minst 2 veckor före det förväntade leveransdatumet. (Ser Graviditet : Teratogena effekter : Graviditetskategori B .)
Ammande mödrar
Även om det inte är känt om glyburid utsöndras i modersmjölk, är vissa sulfonureider kända för att utsöndras i modersmjölk. Studier på digivande råttor visar att metformin utsöndras i mjölk och når nivåer som är jämförbara med dem i plasma. Liknande studier har inte utförts på ammande mödrar. Eftersom risken för hypoglykemi hos ammande spädbarn kan finnas, bör ett beslut fattas om att avbryta amningen eller att avbryta GLUCOVANCE, med hänsyn till läkemedlets betydelse för modern. Om GLUCOVANCE sätts ut och om enbart diet är otillräckligt för att kontrollera blodsockret, bör insulinbehandling övervägas.
Pediatrisk användning
Säkerheten och effekten av GLUCOVANCE 500 mg utvärderades i en aktivt kontrollerad, dubbelblind, 26-veckors randomiserad studie som omfattade totalt 167 pediatriska patienter (från 9-16 år) med typ 2-diabetes. GLUCOVANCE 500 mg visades inte statistiskt vara överlägsen vare sig metformin eller glyburid med avseende på att minska HbA1c från baslinjen (se tabell 5). Inga oväntade säkerhetsfynd associerades med GLUCOVANCE 2,50 mg i denna studie.
Geriatrisk användning
Av de 642 patienter som fick GLUCOVANCE i dubbelblinda kliniska studier var 23,8 % 65 år och äldre medan 2,8 % var 75 år och äldre. Av de 1302 patienter som fick GLUCOVANCE 500 mg i öppna kliniska studier var 20,7 % 65 år och äldre medan 2,5 % var 75 år och äldre. Inga övergripande skillnader i effektivitet eller säkerhet observerades mellan dessa patienter och yngre patienter, och annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
Det är känt att metforminhydroklorid utsöndras till stor del via njurarna och eftersom risken för allvarliga biverkningar av läkemedlet är större hos patienter med nedsatt njurfunktion, ska GLUCOVANCE 500 mg endast användas till patienter med normal njurfunktion (se KONTRAINDIKATIONER , VARNINGAR , och KLINISK FARMAKOLOGI : Farmakokinetik ). Eftersom åldrande är förknippat med nedsatt njurfunktion bör GLUCOVANCE 5 mg användas med försiktighet när åldern ökar. Försiktighet bör iakttas vid val av dos och bör baseras på noggrann och regelbunden övervakning av njurfunktionen. I allmänhet bör äldre patienter inte titreras till maximal dos av GLUCOVANCE (se även VARNINGAR och DOSERING OCH ADMINISTRERING ).
ÖVERDOS
Glyburide
Överdosering av sulfonylureider, inklusive glyburidtabletter, kan ge hypoglykemi. Milda hypoglykemiska symtom, utan medvetslöshet eller neurologiska fynd, bör behandlas aggressivt med oralt glukos och justeringar av läkemedelsdosering och/eller måltidsmönster. Noggrann övervakning bör fortsätta tills läkaren är säker på att patienten är utom fara. Allvarliga hypoglykemiska reaktioner med koma, kramper eller annan neurologisk funktionsnedsättning förekommer sällan, men utgör medicinska nödsituationer som kräver omedelbar sjukhusvistelse. Om hypoglykemisk koma diagnostiseras eller misstänks, bör patienten ges en snabb intravenös injektion av koncentrerad (50 %) glukoslösning. Detta bör följas av en kontinuerlig infusion av en mer utspädd (10 %) glukoslösning med en hastighet som håller blodsockret på en nivå över 100 mg/dL. Patienter bör övervakas noggrant under minst 24 till 48 timmar, eftersom hypoglykemi kan återkomma efter uppenbar klinisk återhämtning.
Metforminhydroklorid
Överdosering av metforminhydroklorid har inträffat, inklusive intag av mängder > 50 g. Hypoglykemi rapporterades i cirka 10 % av fallen, men inget orsakssamband med metforminhydroklorid har fastställts. Laktacidos har rapporterats i cirka 32 % av fallen med överdosering av metformin (se VARNINGAR ). Metformin är dialyserbart med ett clearance på upp till 170 ml/min under goda hemodynamiska förhållanden. Därför kan hemodialys vara användbart för att avlägsna ackumulerat läkemedel från patienter där man misstänker överdosering av metformin.
KONTRAINDIKATIONER
GLUCOVANCE 2,50 mg är kontraindicerat till patienter med:
GLUCOVANCE 500 mg ska tillfälligt avbrytas hos patienter som genomgår radiologiska studier som involverar intravaskulär administrering av joderade kontrastmaterial, eftersom användning av sådana produkter kan resultera i akut förändring av njurfunktionen. (Se även FÖRSIKTIGHETSÅTGÄRDER .)
KLINISK FARMAKOLOGI
Handlingsmekanism
GLUCOVANCE kombinerar glyburid och metforminhydroklorid, 2 antihyperglykemiska medel med komplementära verkningsmekanismer, för att förbättra den glykemiska kontrollen hos patienter med typ 2-diabetes.
Glyburid tycks sänka blodsockret akut genom att stimulera frisättningen av insulin från bukspottkörteln, en effekt som är beroende av fungerande betaceller i pankreasöarna. Mekanismen genom vilken glyburid sänker blodsockret vid långtidsadministrering har inte klarlagts. Vid kronisk administrering till patienter med typ 2-diabetes kvarstår den blodsockersänkande effekten trots en gradvis minskning av insulinutsöndringssvaret på läkemedlet. Extrapankreatiska effekter kan vara involverade i verkningsmekanismen för orala sulfonylurea hypoglykemiska läkemedel.
Metforminhydroklorid är ett antihyperglykemiskt medel som förbättrar glukostoleransen hos patienter med typ 2-diabetes, vilket sänker både basal och postprandial plasmaglukos. Metforminhydroklorid minskar leverns glukosproduktion, minskar intestinal absorption av glukos och förbättrar insulinkänsligheten genom att öka perifert glukosupptag och utnyttjande.
Farmakokinetik
Absorption och biotillgänglighet
GLUCOVANCE
biotillgänglighetsstudier av GLUCOVANCE 2,5 mg/500 mg och 5 mg/500 mg var medelarean under kurvan för plasmakoncentration kontra tid (AUC) för glyburidkomponenten 18 % respektive 7 % större än för Micronase® märke av glyburid administrerat samtidigt med metformin. Glyburidkomponenten i GLUCOVANCE är därför inte bioekvivalent med Micronase®. Metforminkomponenten i GLUCOVANCE 400 mg är bioekvivalent med metformin som administreras samtidigt med glyburid.
Efter administrering av en enstaka GLUCOVANCE 5 mg/500 mg tablett med antingen en 20 % glukoslösning eller en 20 % glukoslösning med mat, fanns det ingen effekt av mat på Cmax och en relativt liten effekt av mat på AUC för glyburiden komponent. Tmax för glyburidkomponenten förkortades från 7,5 timmar till 2,75 timmar med mat jämfört med samma tablettstyrka administrerad fastande med en 20 % glukoslösning. Den kliniska betydelsen av ett tidigare Tmax för glyburid efter mat är inte känd. Effekten av mat på farmakokinetiken för metforminkomponenten var obestämd.
Glyburide
Enkeldosstudier med Micronase®-tabletter på normala försökspersoner visar signifikant absorption av glyburid inom 1 timme, maximala läkemedelsnivåer efter cirka 4 timmar och låga men detekterbara nivåer efter 24 timmar. Genomsnittliga serumnivåer av glyburid, som reflekteras av områden under serumkoncentration-tid-kurvan, ökar i proportion till motsvarande dosökningar. Bioekvivalens har inte fastställts mellan GLUCOVANCE 500 mg och glyburidprodukter med en ingrediens.
Metforminhydroklorid
Den absoluta biotillgängligheten för en 500 mg metforminhydrokloridtablett som ges under fasta är cirka 50 % till 60 %. Studier med enstaka orala doser av metformintabletter på 500 mg och 1500 mg och 850 mg till 2550 mg, tyder på att det finns en bristande dosproportionalitet med ökande doser, vilket beror på minskad absorption snarare än en förändring i eliminering. Mat minskar omfattningen av och fördröjer absorptionen av metformin något, vilket visas av cirka 40 % lägre toppkoncentration och 25 % lägre AUC i plasma och en 35-minuters förlängning av tiden till maximal plasmakoncentration efter administrering av en enstaka 850 mg tablett metformin med mat, jämfört med samma tablettstyrka administrerad fasta. Den kliniska relevansen av dessa minskningar är okänd.
Distribution
Glyburide
Sulfonylurea-läkemedel är i hög grad bundna till serumproteiner. Förskjutning från proteinbindningsställen av andra läkemedel kan leda till förstärkt hypoglykemisk verkan. In vitro är proteinbindningen som uppvisas av glyburid övervägande nonjonisk, medan den för andra sulfonylureider (klorpropamid, tolbutamid, tolazamid) övervägande är jonisk. Sura läkemedel, såsom fenylbutazon, warfarin och salicylater, tränger bort de jonbindande sulfonylureorna från serumproteiner i mycket större utsträckning än den icke-joniska bindande glyburiden. Det har inte visats att denna skillnad i proteinbindning resulterar i färre läkemedelsinteraktioner med glyburidtabletter vid klinisk användning.
Metforminhydroklorid
Den skenbara distributionsvolymen (V/F) av metformin efter orala engångsdoser på 850 mg var i genomsnitt 654±358 L. Metformin är försumbart bundet till plasmaproteiner. Metformin delas upp i erytrocyter, troligen som en funktion av tiden. Vid vanliga kliniska doser och doseringsscheman av metformin uppnås steady state plasmakoncentrationer av metformin inom 24 till 48 timmar och är i allmänhet
Metabolism och eliminering
Glyburide
Minskningen av glyburid i serumet hos normala friska individer är bifasisk; den terminala halveringstiden är cirka 10 timmar. Den huvudsakliga metaboliten av glyburid är 4-trans-hydroxiderivatet. En andra metabolit, 3-cis-hydroxiderivatet, förekommer också. Dessa metaboliter bidrar förmodligen inte till någon signifikant hypoglykemisk verkan hos människor eftersom de endast är svagt aktiva (1/400 respektive 1/40 som aktiva som glyburid) hos kaniner. Glyburid utsöndras som metaboliter i gallan och urinen, cirka 50 % per väg. Denna dubbla utsöndringsväg skiljer sig kvalitativt från den för andra sulfonylureider, som utsöndras huvudsakligen i urinen.
Metforminhydroklorid
Intravenösa singeldosstudier på normala försökspersoner visar att metformin utsöndras oförändrat i urinen och inte genomgår levermetabolism (inga metaboliter har identifierats hos människor) eller gallvägar. Njurclearance (se tabell 1) är cirka 3,5 gånger högre än kreatininclearance, vilket indikerar att tubulär sekretion är den huvudsakliga elimineringsvägen för metformin. Efter oral administrering elimineras cirka 90 % av det absorberade läkemedlet via njurarna inom de första 24 timmarna, med en plasmaelimineringshalveringstid på cirka 6,2 timmar. I blod är eliminationshalveringstiden cirka 17,6 timmar, vilket tyder på att erytrocytmassan kan vara ett distributionskompartment.
Särskilda populationer
Patienter med typ 2-diabetes
Flerdosstudier med glyburid på patienter med typ 2-diabetes visar kurvor för läkemedelsnivåkoncentration-tid som liknar endosstudier, vilket tyder på att ingen ansamling av läkemedel i vävnadsdepåer finns.
närvaro av normal njurfunktion finns det inga skillnader mellan enkel- eller flerdosfarmakokinetik av metformin mellan patienter med typ 2-diabetes och normala försökspersoner (se tabell 1), och det finns inte heller någon ackumulering av metformin i någon av grupperna vid vanliga kliniska doser.
Leverinsufficiens
Inga farmakokinetiska studier har utförts på patienter med leverinsufficiens för vare sig glyburid eller metformin.
Njurinsufficiens
Ingen information finns tillgänglig om farmakokinetiken för glyburid hos patienter med njurinsufficiens.
Hos patienter med nedsatt njurfunktion (baserat på kreatininclearance) förlängs plasma- och blodhalveringstiden för metformin och njurclearancen minskar i proportion till minskningen av kreatininclearance (se tabell 1; se även VARNINGAR ).
Geriatri
Det finns ingen information om farmakokinetiken för glyburid hos äldre patienter.
Begränsade data från kontrollerade farmakokinetiska studier av metformin på friska äldre försökspersoner tyder på att totalt plasmaclearance minskar, halveringstiden förlängs och Cmax ökar, jämfört med friska unga försökspersoner. Av dessa data framgår det att förändringen i metformins farmakokinetik med åldrande främst förklaras av en förändring i njurfunktionen (se tabell 1). Metforminbehandling ska inte påbörjas hos patienter ≥ 80 år om inte mätning av kreatininclearance visar att njurfunktionen inte är nedsatt.
Pediatrik
Efter administrering av en enstaka oral GLUCOPHAGE® (metforminhydroklorid) 500 mg tablett med mat, skilde sig geometriskt genomsnittligt Cmax och AUC för metformin med
Efter administrering av en enstaka oral GLUCOVANCE tablett med mat skilde sig dosnormaliserade geometriska medelvärden för glyburid C och AUC hos pediatriska patienter med typ 2-diabetes (11-16 års ålder, n=28, medelkroppsvikt på 97 kg)
Kön
Det finns ingen information om effekten av kön på farmakokinetiken för glyburid.
Metformins farmakokinetiska parametrar skilde sig inte signifikant hos patienter med eller utan typ 2-diabetes när de analyserades enligt kön (män=19, kvinnor=16). På liknande sätt, i kontrollerade kliniska studier på patienter med typ 2-diabetes, var den antihyperglykemiska effekten av metformin jämförbar hos män och kvinnor.
Lopp
Ingen information finns tillgänglig om rasskillnader i farmakokinetiken för glyburid.
Inga studier av metformins farmakokinetiska parametrar enligt ras har utförts. I kontrollerade kliniska studier av metformin hos patienter med typ 2-diabetes var den antihyperglykemiska effekten jämförbar hos vita (n=249), svarta (n=51) och latinamerikaner (n=24).
Kliniska studier
Patienter med otillräcklig glykemisk kontroll på enbart diet och träning
I en 20-veckors, dubbelblind, multicenter amerikansk klinisk prövning, totalt 806 läkemedelsnaiva patienter med typ 2-diabetes, vars hyperglykemi inte kontrollerades tillräckligt med enbart kost och träning (baslinje fasteplasmaglukos [FPG]
Behandling med GLUCOVANCE resulterade i signifikant större minskning av HbA och postprandial plasmaglukos (PPG) jämfört med glyburid, metformin eller placebo. Behandling med GLUCOVANCE resulterade också i en större minskning av FPG jämfört med glyburid, metformin eller placebo, men skillnaderna mellan glyburid och metformin nådde inte statistisk signifikans.
Förändringar i lipidprofilen i samband med behandling med GLUCOVANCE 2,50 mg liknade de som sågs med glyburid, metformin och placebo.
Den dubbelblinda, placebokontrollerade studien som beskrivs ovan begränsade inskrivningen till patienter med HbA1c
Patienter med otillräcklig glykemisk kontroll på enbart sulfonureid
en 16-veckors, dubbelblind, aktivt kontrollerad klinisk prövning i USA, var totalt 639 patienter med typ 2-diabetes inte tillräckligt kontrollerade (genomsnittlig baslinje HbA1c 9,5 %, genomsnittlig baslinje FPG 213 mg/dL) medan de behandlades med minst hälften av den maximala dosen av en sulfonylurea (t.ex. glyburid 10 mg, glipizid 20 mg) randomiserades för att få glyburid (fast dos, 20 mg), metformin (500 mg), GLUCOVANCE 2,5 mg/500 mg eller GLUCOVANCE 5 mg /500 mg. Doserna av metformin och GLUCOVANCE titrerades till maximalt 4 tabletter dagligen efter behov för att uppnå FPG
Efter 16 veckor fanns det ingen signifikant förändring i medel-HbA hos patienter som randomiserades till glyburid- eller metforminbehandling. Behandling med GLUCOVANCE 2,50 mg i doser upp till 20 mg/2 000 mg per dag resulterade i signifikant sänkning av HbA , FPG och PPG från baslinjen jämfört med enbart glyburid eller metformin.
Tillsats av tiazolidindioner till GLUCOVANCE 400 mg terapi
en 24-veckors, dubbelblind, multicenter amerikansk klinisk prövning byttes patienter med typ 2-diabetes som inte var tillräckligt kontrollerade på aktuell oral antihyperglykemisk behandling (antingen monoterapi eller kombinationsterapi) först över till öppen GLUCOVANCE 2,5 mg/500 mg tabletter och titrerades till en maximal daglig dos på 10 mg/2000 mg. Totalt 365 patienter otillräckligt kontrollerade (HbA1c > 7,0 % och ≤ 10 %) efter 10 till 12 veckor av en daglig GLUCOVANCE 500 mg dos på minst 7,5 mg/1 500 mg randomiserades till att få tilläggsbehandling en gång dagligen med rosiglitazon 4 mg eller placebo . Efter 8 veckor ökades rosiglitazondosen till maximalt 8 mg dagligen efter behov för att nå ett målmedelvärde för daglig glukos på 126 mg/dL eller HbA1c
För patienter som inte uppnådde adekvat glykemisk kontroll med GLUCOVANCE 400 mg, resulterade tillägg av rosiglitazon, jämfört med placebo, i en signifikant sänkning av HbA och FPG.
PATIENTINFORMATION
GLUCOVANCE® (glyburid och metformin HCl) Tabletter
VARNING: Ett litet antal personer som har tagit metforminhydroklorid har utvecklat ett allvarligt tillstånd som kallas laktacidos. Riktigt fungerande njurar behövs för att förhindra laktacidos. De flesta personer med njurproblem ska inte ta GLUCOVANCE. (Se fråga nr 9-13.)
Q1. Varför behöver jag ta GLUCOVANCE 5mg?
Din läkare har ordinerat GLUCOVANCE 500 mg för att behandla din typ 2-diabetes. Detta är också känt som icke-insulinberoende diabetes mellitus.
Q2. Vad är typ 2-diabetes?
Personer med diabetes kan inte göra tillräckligt med insulin och/eller svara normalt på det insulin som deras kropp gör. När detta händer byggs socker (glukos) upp i blodet. Detta kan leda till allvarliga medicinska problem, inklusive njurskador, amputationer och blindhet. Diabetes är också nära kopplat till hjärtsjukdomar. Huvudmålet med att behandla diabetes är att sänka ditt blodsocker till en normal nivå.
Q3. Varför är det viktigt att kontrollera typ 2-diabetes?
Huvudmålet med att behandla diabetes är att sänka ditt blodsocker till en normal nivå. Studier har visat att god kontroll av blodsockret kan förebygga eller fördröja komplikationer, såsom hjärtsjukdomar, njursjukdomar eller blindhet.
Q4. Hur kontrolleras vanligtvis typ 2-diabetes?
Högt blodsocker kan sänkas genom kost och motion, ett antal orala mediciner och insulininjektioner. Innan du tar GLUCOVANCE 2,50 mg bör du först försöka kontrollera din diabetes genom träning och viktminskning. Även om du tar GLUCOVANCE bör du fortfarande träna och följa den kost som rekommenderas för din diabetes.
F5. Fungerar GLUCOVANCE 400mg annorlunda än andra glukoskontrollerande mediciner?
Ja det gör det. GLUCOVANCE 400mg kombinerar 2 glukossänkande läkemedel, glyburid och metformin. Dessa två läkemedel arbetar tillsammans för att förbättra de olika metabola defekter som finns vid typ 2-diabetes. Glyburid sänker blodsockret främst genom att få mer av kroppens eget insulin att frigöras, och metformin sänker blodsockret, delvis genom att hjälpa din kropp att använda ditt eget insulin mer effektivt. Tillsammans är de effektiva för att hjälpa dig att uppnå bättre glukoskontroll.
F6. Vad händer om mitt blodsocker fortfarande är för högt?
När blodsockret inte kan sänkas tillräckligt med GLUCOVANCE kan din läkare ordinera injicerbart insulin eller vidta andra åtgärder för att kontrollera din diabetes.
Q7. Kan GLUCOVANCE 400mg orsaka biverkningar?
GLUCOVANCE 2,50 mg, som alla blodsockersänkande mediciner, kan orsaka biverkningar hos vissa patienter. De flesta av dessa biverkningar är mindre. Det finns dock också allvarliga, men sällsynta, biverkningar relaterade till GLUCOVANCE (se Q9-Q13).
F8. Vilka är de vanligaste biverkningarna av GLUCOVANCE 500 mg?
De vanligaste biverkningarna av GLUCOVANCE 5mg är vanligtvis mindre sådana som diarré, illamående och magbesvär. Om dessa biverkningar uppstår inträffar de vanligtvis under de första veckorna av behandlingen. Att ta din GLUCOVANCE med måltider kan bidra till att minska dessa biverkningar.
Mer sällan kan symtom på hypoglykemi (lågt blodsocker), såsom yrsel, yrsel, skakighet eller hunger förekomma. Risken för hypoglykemiska symtom ökar när måltider hoppar över, för mycket alkohol konsumeras eller tung träning sker utan tillräckligt med mat. Att följa din läkares råd kan hjälpa dig att undvika dessa symtom.
F9. Finns det några allvarliga biverkningar som GLUCOVANCE kan orsaka?
Personer som har ett tillstånd som kallas glukos-6-fosfatdehydrogenas-brist (G6PD) och som tar GLUCOVANCE kan utveckla hemolytisk anemi (snabb nedbrytning av röda blodkroppar). G6PD-brist förekommer vanligtvis i familjer. Tala om för din läkare om du eller någon i din familj har diagnostiserats med G6PD-brist innan du börjar ta GLUCOVANCE.
GLUCOVANCE orsakar sällan allvarliga biverkningar. Den allvarligaste biverkningen som GLUCOVANCE 2,50 mg kan orsaka kallas laktacidos.
Q10. Vad är mjölksyra och kan det hända mig?
Mjölksyraacidos orsakas av en ansamling av mjölksyra i blodet. Laktacidos associerad med metformin är sällsynt och har förekommit mest hos personer vars njurar inte fungerade normalt. Laktacidos har rapporterats hos cirka 1 av 33 000 patienter som tagit metformin under loppet av ett år. Även om det är sällsynt, om laktacidos inträffar, kan det vara dödligt i upp till hälften av fallen.
Det är också viktigt att din lever fungerar normalt när du tar GLUCOVANCE. Din lever hjälper till att ta bort mjölksyra från ditt blodomlopp.
Din läkare kommer att övervaka din diabetes och kan ta blodprov på dig då och då för att säkerställa att dina njurar och din lever fungerar normalt.
Det finns inga bevis för att GLUCOVANCE orsakar skador på njurar eller lever.
Q11. Finns det andra riskfaktorer för laktacidos?
Din risk att utveckla laktacidos av att ta GLUCOVANCE 400 mg är mycket låg så länge dina njurar och lever är friska. Vissa faktorer kan dock öka din risk eftersom de kan påverka njur- och leverfunktionen. Du bör diskutera din risk med din läkare.
Du ska inte ta GLUCOVANCE 400 mg om:
- Du har kroniska njur- eller leverproblem
- Du har kronisk hjärtsvikt som behandlas med mediciner, t.ex. digoxin (Lanoxin®) eller furosemid (Lasix®)
- Du dricker överdrivet mycket alkohol (hela tiden eller kortvarigt "binge"-drickande)
- Du är allvarligt uttorkad (har förlorat en stor mängd kroppsvätskor)
- Du kommer att ha vissa röntgenprocedurer med injicerbara kontrastmedel
- Du ska opereras
- Du utvecklar ett allvarligt tillstånd, såsom hjärtinfarkt, allvarlig infektion eller stroke
- Du är ≥ 80 år och har INTE låtit testa din njurfunktion
Q12. Vilka är symtomen på laktacidos?
Några av symtomen inkluderar: att känna sig mycket svag, trött eller obekväm; ovanlig muskelsmärta; problem att andas; ovanligt eller oväntat magbesvär; känns kallt; känsla av yrsel eller yrsel; eller plötsligt utveckla en långsam eller oregelbunden hjärtrytm.
Om du märker dessa symtom, eller om ditt medicinska tillstånd plötsligt har förändrats, sluta ta GLUCOVANCE tabletter och kontakta din läkare omedelbart. Laktacidos är en medicinsk nödsituation som måste behandlas på sjukhus.
F13. Vad behöver min läkare veta för att minska risken för laktacidos?
Tala om för din läkare om du har en sjukdom som leder till svåra kräkningar, diarré och/eller feber, eller om ditt vätskeintag minskar avsevärt. Dessa situationer kan leda till allvarlig uttorkning, och det kan vara nödvändigt att tillfälligt sluta ta GLUCOVANCE 400 mg.
Du bör meddela din läkare om du ska genomgå någon operation eller specialiserade röntgeningrepp som kräver injektion av kontrastmedel. GLUCOVANCE 2,50 mg-behandling måste avbrytas tillfälligt i sådana fall.
Q14. Kan jag ta GLUCOVANCE 500mg tillsammans med andra mediciner?
Påminn din läkare om att du tar GLUCOVANCE 2,50 mg när något nytt läkemedel ordineras eller en förändring görs i hur du tar ett läkemedel som redan har ordinerats. GLUCOVANCE 400mg kan störa hur vissa läkemedel fungerar och vissa läkemedel kan störa effekten av GLUCOVANCE.
Ta inte GLUCOVANCE om du tar bosentan som används för pulmonell arteriell hypertension (PAH), vilket är högt blodtryck i lungornas kärl.
F15. Vad händer om jag blir gravid medan jag tar GLUCOVANCE 400mg?
Tala om för din läkare om du planerar att bli gravid eller har blivit gravid. Som med andra orala glukoskontrollmediciner ska du inte ta GLUCOVANCE under graviditet.
Vanligtvis kommer din läkare att ordinera insulin när du är gravid. Som med alla läkemedel bör du och din läkare diskutera användningen av GLUCOVANCE 5 mg om du ammar ett barn.
F16. Hur tar jag GLUCOVANCE?
Din läkare kommer att tala om för dig hur många GLUCOVANCE tabletter du ska ta och hur ofta. Detta bör också skrivas ut på etiketten på ditt recept. Du kommer förmodligen att börja med en låg dos av GLUCOVANCE 400 mg och din dos kommer att ökas gradvis tills ditt blodsocker är under kontroll.
Q17. Var kan jag få mer information om GLUCOVANCE 400mg?
Denna bipacksedel är en sammanfattning av den viktigaste informationen om GLUCOVANCE. Om du har några frågor eller problem bör du prata med din läkare eller annan vårdgivare om typ 2-diabetes samt GLUCOVANCE och dess biverkningar. Det finns också en bipacksedel (bipacksedel) skriven för vårdpersonal som din apotekare kan låta dig läsa.
