Actos 15mg, 30mg Pioglitazone Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Actos och hur används det?
Actos 15mg är ett receptbelagt läkemedel som används för att behandla symtom på typ 2-diabetes mellitus. Actos kan användas ensamt eller tillsammans med andra läkemedel.
Actos är ett läkemedel mot diabetes, tiazolidindioner.
Det är inte känt om Actos 15mg är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Actos 15mg?
Actos kan orsaka allvarliga biverkningar inklusive:
- andnöd (särskilt när man lägger sig),
- ovanlig trötthet,
- svullnad,
- snabb viktökning,
- rosa eller röd urin,
- smärtsam eller svår urinering,
- ny eller förvärrad urinering,
- synförändringar och
- plötslig, ovanlig smärta i handen, armen eller foten
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Actos inkluderar:
- huvudvärk,
- muskelvärk och
- förkylningssymtom (täppt näsa, smärta i bihålorna, nysningar, halsont)
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
Dessa är inte alla möjliga biverkningar av Actos. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
HJÄRTSVIKT
- Tiazolidindioner, inklusive ACTOS 15 mg, orsakar eller förvärrar hjärtsvikt hos vissa patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Efter insättande av ACTOS 30 mg och efter dosökningar, övervaka patienterna noggrant med avseende på tecken och symtom på hjärtsvikt (t.ex. överdriven, snabb viktökning, dyspné och/eller ödem). Om hjärtsvikt utvecklas ska det hanteras enligt gällande standarder för vård och utsättning eller dosreduktion av ACTOS 15 mg måste övervägas.
- ACTOS rekommenderas inte till patienter med symtomatisk hjärtsvikt.
- Initiering av ACTOS hos patienter med etablerad New York Heart Association (NYHA) klass III eller IV hjärtsvikt är kontraindicerat [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
BESKRIVNING
ACTOS tabletter är en tiazolidindion och en agonist för peroxisomproliferatoraktiverad receptor (PPAR) gamma som innehåller ett oralt antidiabetiskt läkemedel: pioglitazon.
Pioglitazon [(±)-5-[[4-[2-(5-etyl-2-pyridinyl)etoxi]fenyl]metyl]-2,4-]tiazolidindionmonohydroklorid innehåller ett asymmetriskt kol, och föreningen syntetiseras och används som den racemiska blandningen. De två enantiomererna av pioglitazon omvandlas in vivo. Inga skillnader hittades i den farmakologiska aktiviteten mellan de två enantiomererna. Strukturformeln är som visas:
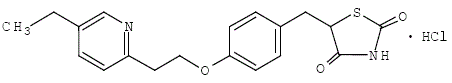
Pioglitazonhydroklorid är ett luktfritt vitt kristallint pulver som har en molekylformel på C19H20N2O3S•HCl och en molekylvikt på 392,90 dalton. Det är lösligt i N,Ndimetylformamid, något lösligt i vattenfri etanol, mycket svagt lösligt i aceton och acetonitril, praktiskt taget olösligt i vatten och olösligt i eter.
ACTOS är tillgänglig som en tablett för oral administrering innehållande 15 mg, 30 mg eller 45 mg pioglitazon (som bas) formulerad med följande hjälpämnen: laktos 30 mg monohydrat NF, hydroxipropylcellulosa NF, karboximetylcellulosa kalcium NF och magnesiumstearat NF.
INDIKATIONER
Monoterapi och kombinationsterapi
ACTOS 30mg är indicerat som ett komplement till kost och träning för att förbättra glykemisk kontroll hos vuxna med typ 2-diabetes mellitus i flera kliniska miljöer [se Kliniska studier ].
Viktiga användningsbegränsningar
ACTOS 15mg utövar sin antihyperglykemiska effekt endast i närvaro av endogent insulin. ACTOS 30mg ska inte användas för att behandla typ 1-diabetes eller diabetisk ketoacidos, eftersom det inte skulle vara effektivt i dessa miljöer.
Var försiktig hos patienter med leversjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
DOSERING OCH ADMINISTRERING
Rekommendationer för alla patienter
ACTOS 15 mg ska tas en gång dagligen och kan tas utan hänsyn till måltider.
Den rekommenderade startdosen för patienter utan kronisk hjärtsvikt är 15 mg eller 30 mg en gång dagligen.
Den rekommenderade startdosen för patienter med kronisk hjärtsvikt (NYHA klass I eller II) är 15 mg en gång dagligen.
Dosen kan titreras i steg om 15 mg upp till maximalt 45 mg en gång dagligen baserat på glykemiskt svar som bestäms av HbA1c.
Efter påbörjad behandling med ACTOS 30 mg eller med dosökning, övervaka patienter noggrant för biverkningar relaterade till vätskeretention såsom viktökning, ödem och tecken och symtom på kronisk hjärtsvikt [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Levertester (serumalanin och aspartataminotransferaser, alkaliskt fosfatas och totalt bilirubin) bör tas innan ACTOS påbörjas. Rutinmässig periodisk övervakning av levertester under behandling med ACTOS 30 mg rekommenderas inte till patienter utan leversjukdom. Patienter som har avvikelser i leverprover innan ACTOS påbörjas eller som visar sig ha onormala leverprover medan de tar ACTOS bör hanteras enligt beskrivningen under Varningar och försiktighetsåtgärder [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och KLINISK FARMAKOLOGI ].
Samtidig användning med en insulinsekretagog eller insulin
Om hypoglykemi inträffar hos en patient som samtidigt administreras ACTOS 30 mg och en insulinsekretagog (t.ex. sulfonylurea), bör dosen av insulinsekretagogan minskas.
Om hypoglykemi inträffar hos en patient som samtidigt administreras ACTOS 30 mg och insulin, bör insulindosen minskas med 10 % till 25 %. Ytterligare justeringar av insulindosen bör individualiseras baserat på glykemiskt svar.
Samtidig användning med starka CYP2C8-hämmare
Samtidig administrering av ACTOS 30 mg och gemfibrozil, en stark CYP2C8-hämmare, ökar pioglitazonexponeringen ungefär tre gånger. Därför är den maximala rekommenderade dosen av ACTOS 15 mg dagligen när den används i kombination med gemfibrozil eller andra starka CYP2C8-hämmare [se LÄKEMEDELSINTERAKTIONER och KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
Rund tablett innehåller pioglitazon enligt följande:
- 15 mg: Vit till benvit, präglad med "ACTOS" på ena sidan och "15" på den andra
- 30 mg: Vit till benvit, präglad med "ACTOS" på ena sidan och "30" på den andra
- 45 mg: Vit till benvit, präglad med "ACTOS" på ena sidan och "45" på den andra
Förvaring Och Hantering
ACTOS finns i 15 mg, 30 mg och 45 mg tabletter enligt följande:
15 mg tablett : Vit till benvit, rund, konvex tablett utan skåror med ”ACTOS” på ena sidan och ”15” på den andra, tillgänglig i:
NDC 64764-151-04 Flaskor med 30 st NDC 64764-151-05 Flaskor med 90 st NDC 64764-151-06 Flaskor à 500 st
30 mg tablett Vit till benvit, rund, platt tablett utan skåror med "ACTOS" på ena sidan och "30" på den andra, tillgänglig i:
NDC 64764-301-14 Flaskor med 30 st NDC 64764-301-15 Flaskor med 90 st NDC 64764-301-16 Flaskor med 500 st
45 mg tablett : Vit till benvit, rund, platt tablett utan skåror med "ACTOS" på ena sidan och "45" på den andra, tillgänglig i:
NDC 64764-451-24 Flaskor med 30 st NDC 64764-451-25 Flaskor med 90 st NDC 64764-451-26 Flaskor med 500 st
Lagring
Förvara vid 25°C (77°F); utflykter tillåtna till 15-30°C (59-86°F) [se USP-kontrollerad rumstemperatur]. Förvara behållaren väl tillsluten och skydda mot ljus, fukt och fukt.
Distribuerat av: Takeda Pharmaceuticals America, Inc. Deerfield, IL 60015. Reviderad: Dec 2017
BIEFFEKTER
Följande allvarliga biverkningar diskuteras på andra ställen i märkningen:
- Kongestiv hjärtsvikt [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Ödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Frakturer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Över 8 500 patienter med typ 2-diabetes har behandlats med ACTOS i randomiserade, dubbelblinda, kontrollerade kliniska prövningar, inklusive 2 605 patienter med typ 2-diabetes och makrovaskulär sjukdom som behandlats med ACTOS 30 mg i den kliniska prövningen av PROactive. I dessa studier har över 6 000 patienter behandlats med ACTOS i sex månader eller längre, över 4 500 patienter har behandlats med ACTOS 15 mg under ett år eller längre, och över 3 000 patienter har behandlats med ACTOS i minst två år.
sex poolade 16- till 26-veckors placebokontrollerad monoterapi och 16- till 24-veckors tilläggskombinationsterapistudier var incidensen av utsättningar på grund av biverkningar 4,5 % för patienter behandlade med ACTOS 30 mg och 5,8 % för jämförelse- behandlade patienter. De vanligaste biverkningarna som ledde till utsättning var relaterade till otillräcklig glykemisk kontroll, även om incidensen av dessa händelser var lägre (1,5 %) med ACTOS 30 mg än med placebo (3,0 %).
I PROactive-studien var incidensen av utsättningar på grund av biverkningar 9,0 % för patienter behandlade med ACTOS 30 mg och 7,7 % för placebobehandlade patienter. Kongestiv hjärtsvikt var den vanligaste allvarliga biverkningen som ledde till abstinens hos 1,3 % av patienterna som behandlades med ACTOS 30 mg och 0,6 % av patienterna som behandlades med placebo.
Vanliga biverkningar: 16- till 26-veckors monoterapiförsök
En sammanfattning av incidensen och typen av vanliga biverkningar som rapporterats i tre poolade 16 till 26-veckors placebokontrollerade monoterapistudier av ACTOS finns i tabell 1. Termer som rapporteras representerar de som inträffade med en incidens på >5 % och vanligare. hos patienter som behandlades med ACTOS 15 mg än hos patienter som fick placebo. Inga av dessa biverkningar var relaterade till ACTOS-dosen.
Vanliga biverkningar: 16- till 24-veckors tilläggskombinationsterapiförsök
En sammanfattning av den totala incidensen och typerna av vanliga biverkningar som rapporterats i prövningar av ACTOS-tillägg till sulfonylurea finns i tabell 2. Termer som rapporteras representerar de som inträffade med en incidens på >5 % och vanligare med den högsta testade dos ACTOS.
En sammanfattning av den totala incidensen och typerna av vanliga biverkningar som rapporterats i prövningar av ACTOS 30 mg tillägg till metformin finns i Tabell 3. Termer som rapporteras representerar de som inträffade med en incidens på >5 % och vanligare med den högsta testad dos av ACTOS.
Tabell 4 sammanfattar incidensen och typerna av vanliga biverkningar som rapporterats i försök med ACTOS-tillägg till insulin. Termer som rapporteras representerar de som inträffade med en incidens på >5 % och vanligare med den högsta testade dosen av ACTOS.
En sammanfattning av den totala incidensen och typerna av vanliga biverkningar som rapporterats i PROactive-studien finns i tabell 5. Termer som rapporteras representerar de som inträffade med en incidens på >5 % och vanligare hos patienter som behandlas med ACTOS än hos patienter som fått placebo.
Hjärtsvikt
En sammanfattning av förekomsten av biverkningar relaterade till kongestiv hjärtsvikt finns i tabell 6 för 16- till 24-veckors tilläggsstudier till sulfonylurea, för 16- till 24-veckors tillägg till insulinprövningar, och för 16- till 24-veckors tillägg till metforminstudier. Ingen av händelserna var dödlig.
Patienter med typ 2-diabetes och NYHA klass II eller tidig klass III hjärtsvikt randomiserades till att få 24 veckors dubbelblind behandling med antingen ACTOS 30 mg i dagliga doser på 30 mg till 45 mg (n=262) eller glyburid i dagliga doser av 10 mg till 15 mg (n=256). En sammanfattning av förekomsten av biverkningar relaterade till kongestiv hjärtsvikt som rapporterats i denna studie finns i Tabell 7.
Händelser med kronisk hjärtsvikt som ledde till sjukhusvistelse som inträffade under PROactive-studien sammanfattas i tabell 8.
Kardiovaskulär säkerhet
PROactive-studien randomiserades 5238 patienter med typ 2-diabetes och en historia av makrovaskulär sjukdom till ACTOS (N=2605), tvångstitrerad upp till 45 mg dagligen eller placebo (N=2633) utöver standardvård. Nästan alla patienter (95%) fick kardiovaskulära läkemedel (betablockerare, ACE-hämmare, angiotensin II-receptorblockerare, kalciumkanalblockerare, nitrater, diuretika, aspirin, statiner och fibrater). Vid baslinjen hade patienterna en medelålder på 62 år, en genomsnittlig varaktighet av diabetes på 9,5 år och en genomsnittlig HbA1c på 8,1 %. Genomsnittlig uppföljningslängd var 34,5 månader. Det primära syftet med denna studie var att undersöka effekten av ACTOS på mortalitet och makrovaskulär morbiditet hos patienter med typ 2-diabetes mellitus som löpte hög risk för makrovaskulära händelser. Den primära effektvariabeln var tiden till den första förekomsten av någon händelse i ett kardiovaskulärt sammansatt effektmått som inkluderade dödlighet av alla orsaker, icke-fatal hjärtinfarkt (MI) inklusive tyst hjärtinfarkt, stroke, akut kranskärlssyndrom, hjärtintervention inklusive kransartärbypasstransplantation eller perkutan intervention, större benamputation ovanför fotleden och bypassoperation eller revaskularisering i benet. Totalt 514 (19,7 %) patienter behandlade med ACTOS 15 mg och 572 (21,7 %) placebobehandlade patienter upplevde minst en händelse från den primära sammansatta endpointen (hazard ratio 0,90; 95 % konfidensintervall: 0,80, 1,02; p=0,10 ).
Även om det inte fanns någon statistiskt signifikant skillnad mellan ACTOS och placebo för den treåriga incidensen av en första händelse inom denna sammansättning, fanns det ingen ökning av mortalitet eller totala makrovaskulära händelser med ACTOS. Antalet första händelser och totala enskilda händelser som bidrar till den primära sammansatta endpointen visas i Tabell 9.
Viktökning
Dosrelaterad viktökning uppstår när ACTOS 30 mg används ensamt eller i kombination med andra antidiabetiska läkemedel. Mekanismen för viktökning är oklar men involverar troligen en kombination av vätskeretention och fettansamling.
Tabell 10 och 11 sammanfattar förändringarna i kroppsvikt med ACTOS och placebo i 16- till 26-veckors randomiserade, dubbelblinda monoterapi- och 16- till 24-veckors kombinationsterapistudier och i PROactive-studien.
Ödem
Ödem som orsakas av att ta ACTOS är reversibelt när ACTOS sätts ut. Ödemet kräver vanligtvis inte sjukhusvistelse om det inte finns samexisterande hjärtsvikt. En sammanfattning av frekvensen och typerna av ödembiverkningar som inträffar i kliniska undersökningar av ACTOS 30 mg finns i Tabell 12.
Levereffekter
Det har hittills inte funnits några bevis för inducerad levertoxicitet med ACTOS i databasen för ACTOS kontrollerade kliniska prövningar. En randomiserad, dubbelblind 3-årig studie som jämförde ACTOS 15 mg med glyburid som tillägg till metformin och insulinterapi var speciellt utformad för att utvärdera incidensen av serum-ALAT-höjningar till mer än tre gånger den övre gränsen för referensintervallet, uppmätt varje gång åtta veckor under de första 48 veckorna av försöket och därefter var 12:e vecka. Totalt 3/1051 (0,3 %) patienter som behandlades med ACTOS och 9/1046 (0,9 %) patienter som behandlades med glyburid utvecklade ALAT-värden större än tre gånger den övre gränsen för referensintervallet. Ingen av patienterna som behandlats med ACTOS i ACTOS kontrollerade kliniska prövningsdatabasen har hittills haft en serum-ALAT som är större än tre gånger den övre gränsen för referensintervallet och en motsvarande total bilirubin som är större än två gånger den övre gränsen för referensintervallet, en kombination som förutsäger risken för allvarlig läkemedelsinducerad leverskada.
Hypoglykemi
I de kliniska prövningarna med ACTOS 15 mg rapporterades biverkningar av hypoglykemi baserat på utredarnas kliniska bedömning och krävde ingen bekräftelse med fingersticksglukostest.
I den 16 veckor långa tilläggsstudien till sulfonylurea var incidensen av rapporterad hypoglykemi 3,7 % med ACTOS 30 mg och 0,5 % med placebo. I den 16 veckor långa tilläggsstudien till insulin var incidensen av rapporterad hypoglykemi 7,9 % med ACTOS 15 mg, 15,4 % med ACTOS 30 mg och 4,8 % med placebo.
Incidensen av rapporterad hypoglykemi var högre med ACTOS 45 mg jämfört med ACTOS 30 mg i både den 24 veckor långa tilläggsstudien till sulfonylurea (15,7 % mot 13,4 %) och i den 24 veckor långa tilläggsstudien till insulin (47,8) % mot 43,5 %).
Tre patienter i dessa fyra studier lades in på sjukhus på grund av hypoglykemi. Alla tre patienterna fick ACTOS 30 mg (0,9 %) i den 24 veckor långa tilläggsstudien till insulin. Ytterligare 14 patienter rapporterade allvarlig hypoglykemi (definierad som att orsaka avsevärd störning av patientens vanliga aktiviteter) som inte krävde sjukhusvistelse. Dessa patienter fick ACTOS 45 mg i kombination med sulfonylurea (n=2) eller ACTOS 30 mg eller 45 mg i kombination med insulin (n=12).
Tumörer i urinblåsan
Tumörer observerades i urinblåsan hos råttor av hankön i den tvååriga karcinogenicitetsstudien [se Icke-klinisk toxikologi ]. Under den treåriga kliniska prövningen med PROactive diagnostiserades 14 patienter av 2605 (0,54%) randomiserade till ACTOS och 5 av 2633 (0,19%) randomiserade till placebo med cancer i urinblåsan. Efter att ha exkluderat patienter hos vilka exponeringen för studieläkemedlet var mindre än ett år vid tidpunkten för diagnos av blåscancer, fanns det 6 (0,23 %) fall på ACTOS 15 mg och två (0,08 %) fall på placebo. Efter avslutad studie observerades en stor delmängd av patienter i upp till 10 ytterligare år, med liten extra exponering för ACTOS. Under de 13 åren av både PROaktiv och observationell uppföljning skilde sig inte förekomsten av blåscancer mellan patienter randomiserade till ACTOS eller placebo (HR =1,00; 95 % KI: 0,59-1,72) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Laboratorieavvikelser
Hematologiska effekter
ACTOS 15 mg kan orsaka minskningar av hemoglobin och hematokrit. I placebokontrollerade monoterapistudier sjönk genomsnittliga hemoglobinvärden med 2 % till 4 % hos patienter som behandlades med ACTOS jämfört med en genomsnittlig förändring av hemoglobin på -1 % till +1 % hos placebobehandlade patienter. Dessa förändringar inträffade främst inom de första 4 till 12 veckorna av behandlingen och förblev relativt konstanta därefter. Dessa förändringar kan vara relaterade till ökad plasmavolym associerad med ACTOS 30 mg-behandling och är sannolikt inte associerade med några kliniskt signifikanta hematologiska effekter.
Kreatinfosfokinas
Under protokollspecificerad mätning av serumkreatinfosfokinas (CPK) i ACTOS 15 mg kliniska prövningar noterades en isolerad höjning av CPK till mer än 10 gånger den övre gränsen för referensintervallet hos nio (0,2 %) patienter behandlade med ACTOS (värden av 2150 till 11400 IE/L) och hos inga jämförelsebehandlade patienter. Sex av dessa nio patienter fortsatte att få ACTOS 15 mg, två patienter noterades ha CPK-förhöjningen den sista dagen av doseringen och en patient avbröt behandlingen med ACTOS på grund av förhöjningen. Dessa förhöjningar försvann utan några uppenbara kliniska följdsjukdomar. Relationen mellan dessa händelser och ACTOS 30 mg-behandling är okänd.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av ACTOS efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det i allmänhet inte möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
- Nyuppkomna eller förvärrade diabetiska makulaödem med minskad synskärpa [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Fatal och icke-dödlig leversvikt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Rapporter om kronisk hjärtsvikt efter marknadsföring har rapporterats hos patienter som behandlats med ACTOS, både med och utan tidigare känd hjärtsjukdom och både med och utan samtidig administrering av insulin.
Efter marknadsföring har det förekommit rapporter om ovanligt snabba viktökningar och ökningar utöver vad som vanligtvis observerats i kliniska prövningar. Patienter som upplever sådana ökningar bör utvärderas med avseende på vätskeansamling och volymrelaterade händelser såsom kraftigt ödem och kronisk hjärtsvikt [se LÅDA VARNING och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
LÄKEMEDELSINTERAKTIONER
Starka CYP2C8-hämmare
En hämmare av CYP2C8 (t.ex. gemfibrozil) ökar signifikant exponeringen (arean under serumkoncentration-tidskurvan eller AUC) och halveringstiden (t½) för pioglitazon. Därför är den maximala rekommenderade dosen av ACTOS 15 mg dagligen om den används i kombination med gemfibrozil eller andra starka CYP2C8-hämmare [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
CYP2C8-inducerare
En inducerare av CYP2C8 (t.ex. rifampin) kan signifikant minska exponeringen (AUC) av pioglitazon. Därför, om en inducerare av CYP2C8 startas eller stoppas under behandling med ACTOS 30 mg, kan förändringar i diabetesbehandlingen behövas baserat på kliniskt svar utan att överskrida den maximala rekommenderade dagliga dosen på 45 mg för ACTOS [se KLINISK FARMAKOLOGI ].
Topiramat
En minskning av exponeringen av pioglitazon och dess aktiva metaboliter noterades vid samtidig administrering av pioglitazon och topiramat [se KLINISK FARMAKOLOGI ]. Den kliniska relevansen av denna minskning är okänd; När ACTOS och topiramat används samtidigt, övervaka patienterna för adekvat glykemisk kontroll.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Hjärtsvikt
ACTOS 15 mg, liksom andra tiazolidindioner, kan orsaka dosrelaterad vätskeretention när det används ensamt eller i kombination med andra antidiabetiska läkemedel och är vanligast när ACTOS 30 mg används i kombination med insulin. Vätskeretention kan leda till eller förvärra hjärtsvikt. Patienter bör observeras för tecken och symtom på kronisk hjärtsvikt. Om kongestiv hjärtsvikt utvecklas ska det hanteras enligt gällande standarder för vård och utsättning eller dosreduktion av ACTOS måste övervägas [se LÅDA VARNING , KONTRAINDIKATIONER , och NEGATIVA REAKTIONER ].
Hypoglykemi
Patienter som får ACTOS i kombination med insulin eller andra antidiabetiska läkemedel (särskilt insulinsekretagoger såsom sulfonylureider) kan löpa risk för hypoglykemi. En minskning av dosen av den samtidiga antidiabetiska medicinen kan vara nödvändig för att minska risken för hypoglykemi [se DOSERING OCH ADMINISTRERING ].
Levereffekter
Det har förekommit rapporter om dödlig och icke-dödlig leversvikt efter godkännandet för försäljning hos patienter som tar ACTOS 15 mg, även om rapporterna innehåller otillräcklig information som krävs för att fastställa den sannolika orsaken. Det har hittills inte funnits några bevis för läkemedelsinducerad levertoxicitet i databasen ACTOS 30 mg kontrollerade kliniska prövningar [se NEGATIVA REAKTIONER ].
Patienter med typ 2-diabetes kan ha fettleversjukdom eller hjärtsjukdom med episodisk kronisk hjärtsvikt, som båda kan orsaka avvikelser i leverprover, och de kan också ha andra former av leversjukdom, av vilka många kan behandlas eller hanteras. Därför rekommenderas att skaffa en levertestpanel (serumalaninaminotransferas [ALT], aspartataminotransferas [AST], alkaliskt fosfatas och totalt bilirubin) och utvärdera patienten innan behandling med ACTOS påbörjas. Hos patienter med onormala leverprov bör ACTOS 15 mg inledas med försiktighet.
Mät leverprover omedelbart hos patienter som rapporterar symtom som kan tyda på leverskada, inklusive trötthet, anorexi, obehag i övre högra delen av buken, mörk urin eller gulsot. I detta kliniska sammanhang, om patienten visar sig ha onormala levertester (ALT större än 3 gånger den övre gränsen för referensintervallet), bör behandlingen med ACTOS 15 mg avbrytas och utredning göras för att fastställa den sannolika orsaken. ACTOS ska inte återupptas hos dessa patienter utan en annan förklaring till avvikelserna i leverprovet.
Patienter som har serum-ALAT större än tre gånger referensintervallet med totalt serumbilirubin större än två gånger referensintervallet utan alternativa etiologier löper risk för allvarlig läkemedelsinducerad leverskada och bör inte återupptas med ACTOS. För patienter med mindre förhöjda serum-ALAT eller bilirubin och med en alternativ trolig orsak kan behandling med ACTOS användas med försiktighet.
Tumörer i urinblåsan
Tumörer observerades i urinblåsan hos råttor av hankön i den tvååriga karcinogenicitetsstudien [se Icke-klinisk toxikologi ]. Under den treåriga kliniska prövningen med PROactive diagnostiserades dessutom 14 patienter av 2605 (0,54 %) randomiserade till ACTOS 15 mg och 5 av 2 633 (0,19 %) randomiserade till placebo med blåscancer. Efter att ha exkluderat patienter hos vilka exponeringen för studieläkemedlet var mindre än ett år vid tidpunkten för diagnos av blåscancer, fanns det 6 (0,23 %) fall på ACTOS 30 mg och två (0,08 %) fall på placebo. Efter avslutad studie observerades en stor delmängd av patienter i upp till 10 ytterligare år, med liten extra exponering för ACTOS. Under de 13 åren av både PROaktiv och observationsuppföljning skilde förekomsten av blåscancer inte mellan patienter randomiserade till ACTOS 30 mg eller placebo (HR = 1,00; [95 % KI: 0,59-1,72]).
Fynden angående risken för blåscancer hos patienter som exponerats för ACTOS varierar mellan observationsstudier; vissa fann inte en ökad risk för blåscancer i samband med ACTOS 30 mg, medan andra gjorde det.
En stor prospektiv 10-årig observationskohortstudie utförd i USA fann ingen statistiskt signifikant ökning av risken för blåscancer hos diabetespatienter som någonsin exponerats för ACTOS, jämfört med de som aldrig exponerats för ACTOS (HR =1,06 [95 % CI 0,89-1,26) ]).
En retrospektiv kohortstudie utförd med data från Storbritannien fann ett statistiskt signifikant samband mellan någonsin exponering för ACTOS och blåscancer (HR: 1,63; [95 % KI: 1,22-2,19]).
Samband mellan kumulativ dos eller kumulativ varaktighet av exponering för ACTOS 15 mg och blåscancer upptäcktes inte i vissa studier inklusive den 10-åriga observationsstudien i USA, men i andra. Inkonsekventa fynd och begränsningar som är inneboende i dessa och andra studier utesluter avgörande tolkningar av observationsdata.
ACTOS kan vara associerat med en ökad risk för urinblåstumörer. Det finns otillräckliga data för att avgöra om pioglitazon är en tumörpromotor för urinblåstumörer.
Följaktligen bör ACTOS inte användas till patienter med aktiv blåscancer och fördelarna med glykemisk kontroll kontra okända risker för cancerrecidiv med ACTOS bör övervägas hos patienter med tidigare cancer i urinblåsan.
Ödem
I kontrollerade kliniska prövningar rapporterades ödem oftare hos patienter behandlade med ACTOS 30 mg än hos placebobehandlade patienter och är dosrelaterat [se NEGATIVA REAKTIONER ]. Efter marknadsföring har rapporter om nya eller förvärrade ödem mottagits.
ACTOS 15 mg ska användas med försiktighet till patienter med ödem. Eftersom tiazolidindioner, inklusive ACTOS, kan orsaka vätskeretention, vilket kan förvärra eller leda till kronisk hjärtsvikt, bör ACTOS 30 mg användas med försiktighet till patienter med risk för kronisk hjärtsvikt. Patienter som behandlas med ACTOS bör övervakas med avseende på tecken och symtom på kronisk hjärtsvikt [se LÅDA VARNING , Hjärtsvikt och PATIENTINFORMATION ].
Frakturer
PROactive (den prospektiva Pioglitazon Clinical Trial in Macrovascular Events) randomiserades 5238 patienter med typ 2-diabetes och en historia av makrovaskulär sjukdom till ACTOS (N=2605), tvångstitrerade upp till 45 mg dagligen eller placebo (N=2633) utöver standardvården. Under en genomsnittlig uppföljning på 34,5 månader var incidensen av benfraktur hos kvinnor 5,1 % (44/870) för ACTOS 30 mg jämfört med 2,5 % (23/905) för placebo. Denna skillnad noterades efter det första behandlingsåret och kvarstod under studiens gång. Majoriteten av frakturerna som observerades hos kvinnliga patienter var icke-vertebrala frakturer inklusive nedre extremiteter och distala övre extremiteter. Ingen ökning av incidensen av frakturer observerades hos män som behandlades med ACTOS (1,7 %) jämfört med placebo (2,1 %). Risken för frakturer bör beaktas i vården av patienter, särskilt kvinnliga patienter, som behandlas med ACTOS och uppmärksamhet bör ägnas åt att bedöma och bibehålla benhälsan enligt gällande vårdstandarder.
Makulaödem
Makulaödem har rapporterats efter marknadsföring hos diabetespatienter som tog ACTOS eller annan tiazolidindion. Vissa patienter uppvisade dimsyn eller nedsatt synskärpa, men andra diagnostiserades vid rutinmässig oftalmologisk undersökning.
De flesta patienter hade perifert ödem vid den tidpunkt då makulaödem diagnostiserades. Vissa patienter hade en förbättring av deras makulaödem efter utsättning av tiazolidindion.
Patienter med diabetes bör genomgå regelbundna ögonundersökningar av en ögonläkare enligt gällande vårdstandarder. Patienter med diabetes som rapporterar visuella symtom bör omedelbart remitteras till en ögonläkare, oavsett patientens underliggande mediciner eller andra fysiska fynd [se NEGATIVA REAKTIONER ].
Makrovaskulära resultat
Det har inte gjorts några kliniska studier som visar avgörande bevis för minskning av makrovaskulär risk med ACTOS.
Information om patientrådgivning
Se FDA-godkänd patientmärkning ( PATIENTINFORMATION ).
- Det är viktigt att instruera patienterna att följa kostråden och att regelbundet testa blodsocker och glykosylerat hemoglobin. Under perioder av stress som feber, trauma, infektion eller operation kan läkemedelskraven ändras och patienterna bör påminnas om att omedelbart söka medicinsk rådgivning.
- Patienter som upplever en ovanligt snabb viktökning eller ödem eller som utvecklar andfåddhet eller andra symtom på hjärtsvikt under behandling med ACTOS bör omedelbart rapportera dessa symtom till en läkare.
- Berätta för patienterna att omedelbart sluta ta ACTOS och omedelbart söka läkare om det finns oförklarligt illamående, kräkningar, buksmärtor, trötthet, anorexi eller mörk urin eftersom dessa symtom kan bero på levertoxicitet.
- Be patienterna att omedelbart rapportera tecken på makroskopisk hematuri eller andra symtom som dysuri eller brådskande urinering som utvecklas eller ökar under behandlingen eftersom dessa kan bero på cancer i urinblåsan.
- Berätta för patienterna att ta ACTOS 15 mg en gång dagligen. ACTOS 15 mg kan tas med eller utan måltider. Om en dos glöms bort en dag ska dosen inte fördubblas följande dag.
- Vid användning av kombinationsbehandling med insulin eller andra antidiabetiska läkemedel bör riskerna för hypoglykemi, dess symtom och behandling samt tillstånd som predisponerar för dess utveckling förklaras för patienter och deras familjemedlemmar.
- Informera kvinnliga patienter om att behandling med ACTOS 30 mg, liksom andra tiazolidindioner, kan resultera i en oavsiktlig graviditet hos vissa premenopausala anovulatoriska kvinnor på grund av dess effekt på ägglossningen [se Användning i specifika populationer ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
En tvåårig karcinogenicitetsstudie utfördes på han- och honråttor vid orala doser upp till 63 mg/kg (ungefär 14 gånger den maximala rekommenderade orala dosen för människor på 45 mg baserat på mg/m2). Läkemedelsinducerade tumörer observerades inte i något organ förutom urinblåsan hos hanråttor. Benigna och/eller maligna övergångscellsneoplasmer observerades hos hanråttor vid 4 mg/kg/dag och högre (ungefär lika med den maximala rekommenderade orala dosen för människor baserat på mg/m2). Urinstenar med efterföljande irritation och hyperplasi postulerades som mekanismen för blåstumörer som observerats hos hanråttor. En tvåårig mekanistisk studie på råttor av hankön som använde försurning i kosten för att minska bildningen av tandstenar avslutades 2009. Försurningen av kosten minskade men avskaffade inte de hyperplastiska förändringarna i urinblåsan. Närvaron av tandsten förvärrade det hyperplastiska svaret på pioglitazon men ansågs inte vara den primära orsaken till de hyperplastiska förändringarna.
Relevansen för människor av blåsfynd hos hanråttan kan inte uteslutas.
En tvåårig karcinogenicitetsstudie utfördes också på möss av hankön och honor vid orala doser upp till 100 mg/kg/dag (ungefär 11 gånger den maximala rekommenderade orala dosen för människor baserat på mg/m2). Inga läkemedelsinducerade tumörer observerades i något organ.
Pioglitazonhydroklorid var inte mutagent i en rad genetiska toxikologiska studier, inklusive Ames bakteriell analys, en mutationsanalys för däggdjursceller framåt (CHO/HPRT och AS52/XPRT), en in vitro cytogenetisk analys med CHL-celler, en oplanerad DNA-syntesanalys och en mikrokärnanalys in vivo.
Inga negativa effekter på fertiliteten observerades hos han- och honråttor vid orala doser upp till 40 mg/kg pioglitazonhydroklorid dagligen före och under parning och dräktighet (ungefär nio gånger den maximala rekommenderade orala dosen för människor baserat på mg/m2).
Användning i specifika populationer
Graviditet
Risksammanfattning
Begränsade data med ACTOS hos gravida kvinnor är inte tillräckliga för att fastställa en läkemedelsrelaterad risk för allvarliga fosterskador eller missfall. Det finns risker för modern och fostret i samband med dåligt kontrollerad diabetes under graviditeten [se Kliniska överväganden ].
I reproduktionsstudier på djur observerades inga negativa utvecklingseffekter när pioglitazon administrerades till dräktiga råttor och kaniner under organogenesen vid exponeringar upp till 5 respektive 35 gånger den kliniska dosen 45 mg, baserat på kroppsyta [se Data ].
Den uppskattade bakgrundsrisken för stora fosterskador är 6-10 % hos kvinnor med pre-gestationell diabetes med HbA1c >7 och har rapporterats vara så hög som 20-25 % hos kvinnor med HbA1c >10. Den uppskattade bakgrundsrisken för missfall för den indikerade populationen är okänd. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2-4% respektive 15-20%.
Kliniska överväganden
Sjukdomsrelaterad risk för modern och/eller embryo/foster
Dåligt kontrollerad diabetes under graviditeten ökar moderns risk för diabetisk ketoacidos, havandeskapsförgiftning, spontana aborter, för tidig förlossning, dödfödsel och förlossningskomplikationer. Dåligt kontrollerad diabetes ökar fostrets risk för stora fosterskador, dödfödsel och makrosomirelaterad sjuklighet.
Data
Djurdata
Pioglitazon administrerat till dräktiga råttor under organogenes orsakade inte negativa utvecklingseffekter vid en dos på 20 mg/kg (~5 gånger den kliniska dosen på 45 mg), men fördröjde förlossningen och minskade embryofetal livsduglighet vid 40 och 80 mg/kg, eller ≥ 9 gånger den 45 mg kliniska dosen, efter kroppsyta. Hos dräktiga kaniner som administrerades pioglitazon under organogenes observerades inga negativa utvecklingseffekter vid 80 mg/kg (~35 gånger den kliniska dosen på 45 mg), men minskad embryofetal livsduglighet vid 160 mg/kg, eller ~69 gånger den kliniska dosen på 45 mg dos, efter kroppsyta. När dräktiga råttor fick pioglitazon under sen dräktighet och laktation, inträffade försenad utveckling efter födseln, tillskriven minskad kroppsvikt, hos avkomma vid moderns doser på 10 mg/kg och över eller ≥2 gånger den kliniska dosen 45 mg, efter kroppsyta.
Laktation
Risksammanfattning
Det finns ingen information om förekomsten av pioglitazon i bröstmjölk, effekterna på det ammade barnet eller effekterna på mjölkproduktionen. Pioglitazon finns i råttmjölk; men på grund av artspecifika skillnader i amningsfysiologi kan djurdata inte tillförlitligt förutsäga läkemedelsnivåer i bröstmjölk. Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av ACTOS 15 mg och eventuella negativa effekter på det ammade barnet från ACTOS 30 mg eller från det underliggande moderns tillståndet.
Kvinnor Och Hanar Av Reproduktionspotential
Diskutera risken för oavsiktlig graviditet med premenopausala kvinnor eftersom behandling med ACTOS, liksom andra tiazolidindioner, kan resultera i ägglossning hos vissa anovulatoriska kvinnor.
Pediatrisk användning
Säkerhet och effektivitet för ACTOS hos pediatriska patienter har inte fastställts.
ACTOS 15 mg rekommenderas inte för användning till pediatriska patienter baserat på biverkningar som observerats hos vuxna, inklusive vätskeretention och kongestiv hjärtsvikt, frakturer och urinblåstumörer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Geriatrisk användning
Totalt 92 patienter (15,2 %) som behandlades med ACTOS i de tre poolade 16- till 26-veckors dubbelblinda, placebokontrollerade monoterapistudierna var ≥65 år och två patienter (0,3%) var ≥75 år. I de två poolade 16- till 24-veckors tilläggsstudier till sulfonylurea var 201 patienter (18,7 %) behandlade med ACTOS 30 mg ≥65 år och 19 (1,8%) var ≥75 år. I de två poolade 16- till 24-veckors tilläggsstudier till metformin var 155 patienter (15,5 %) som behandlades med ACTOS ≥65 år och 19 (1,9%) var ≥75 år. I de två poolade 16- till 24-veckors tilläggsstudier till insulin var 272 patienter (25,4%) som behandlades med ACTOS ≥65 år och 22 (2,1%) var ≥75 år.
I PROactive var 1068 patienter (41,0%) som behandlades med ACTOS ≥65 år och 42 (1,6%) var ≥75 år.
farmakokinetiska studier med pioglitazon observerades inga signifikanta skillnader i farmakokinetiska parametrar mellan äldre och yngre patienter [se KLINISK FARMAKOLOGI ].
Även om kliniska erfarenheter inte har identifierat skillnader i effektivitet och säkerhet mellan äldre (≥65 år) och yngre patienter, begränsas dessa slutsatser av små provstorlekar för patienter ≥75 år gamla.
ÖVERDOS
Under kontrollerade kliniska prövningar rapporterades ett fall av överdosering med ACTOS 30 mg. En manlig patient tog 120 mg per dag i fyra dagar, sedan 180 mg per dag i sju dagar. Patienten förnekade några kliniska symtom under denna period.
I händelse av överdosering bör lämplig understödjande behandling initieras i enlighet med patientens kliniska tecken och symtom.
KONTRAINDIKATIONER
- Initiering hos patienter med etablerad NYHA klass III eller IV hjärtsvikt [se LÅDA VARNING ].
- Används till patienter med känd överkänslighet mot pioglitazon eller någon annan komponent i ACTOS.
KLINISK FARMAKOLOGI
Handlingsmekanism
ACTOS 15mg är en tiazolidindion som är beroende av närvaron av insulin för dess verkningsmekanism. ACTOS minskar insulinresistens i periferin och i levern, vilket resulterar i ökat insulinberoende glukosavfall och minskad glukosproduktion i levern. Pioglitazon är inte en insulinsekretagog. Pioglitazon är en agonist för peroxisomproliferatoraktiverad receptor-gamma (PPAR?). PPAR-receptorer finns i vävnader som är viktiga för insulinverkan, såsom fettvävnad, skelettmuskulatur och lever. Aktivering av PPAR? Nukleära receptorer modulerar transkriptionen av ett antal insulinkänsliga gener involverade i kontrollen av glukos- och lipidmetabolism.
djurmodeller av diabetes minskar pioglitazon hyperglykemi, hyperinsulinemi och hypertriglyceridemi som är karakteristisk för insulinresistenta tillstånd som typ 2-diabetes. De metabola förändringar som produceras av pioglitazon resulterar i ökad reaktionsförmåga hos insulinberoende vävnader och observeras i ett flertal djurmodeller av insulinresistens.
Eftersom pioglitazon förstärker effekterna av cirkulerande insulin (genom att minska insulinresistens), sänker det inte blodsockret i djurmodeller som saknar endogent insulin.
Farmakodynamik
Kliniska studier visar att ACTOS 15 mg förbättrar insulinkänsligheten hos insulinresistenta patienter. ACTOS förbättrar cellulär känslighet för insulin, ökar insulinberoende glukosavfall och förbättrar leverns känslighet för insulin. Hos patienter med typ 2-diabetes resulterar den minskade insulinresistensen som produceras av ACTOS i lägre plasmaglukoskoncentrationer, lägre plasmainsulinkoncentrationer och lägre HbA1c-värden. I kontrollerade kliniska prövningar hade ACTOS en additiv effekt på glykemisk kontroll när den användes i kombination med en sulfonylurea, metformin eller insulin [se Kliniska studier ].
Patienter med lipidavvikelser inkluderades i kliniska prövningar med ACTOS. Totalt sett hade patienter som behandlades med ACTOS 15 mg genomsnittliga minskningar av serumtriglycerider, genomsnittliga ökningar av HDL-kolesterol och inga konsekventa medelförändringar i LDL och totalt kolesterol. Det finns inga avgörande bevis för makrovaskulär nytta med ACTOS [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och NEGATIVA REAKTIONER ].
en 26-veckors, placebokontrollerad, dosvarierande monoterapistudie, minskade genomsnittliga serumtriglycerider i dosgrupperna 15 mg, 30 mg och 45 mg ACTOS 15 mg jämfört med en genomsnittlig ökning i placebogruppen. Genomsnittligt HDL-kolesterol ökade i större utsträckning hos patienter som behandlades med ACTOS 30 mg än hos placebobehandlade patienter. Det fanns inga konsekventa skillnader för LDL och totalt kolesterol hos patienter som behandlades med ACTOS jämfört med placebo (se tabell 14).
I de två andra monoterapistudierna (16 veckor och 24 veckor) och i kombinationsterapistudier med sulfonylurea (16 veckor och 24 veckor), metformin (16 veckor och 24 veckor) eller insulin (16 veckor och 24 veckor), var resultaten generellt sett överensstämmer med uppgifterna ovan.
Farmakokinetik
Efter administrering en gång dagligen av ACTOS 15 mg uppnås steady-state serumkoncentrationer av både pioglitazon och dess huvudsakliga aktiva metaboliter, M-III (ketoderivat av pioglitazon) och M-IV (hydroxylderivat av pioglitazon), inom sju dagar. Vid steady-state når M-III och M-IV serumkoncentrationer lika med eller högre än pioglitazon. Vid steady-state, hos både friska frivilliga och patienter med typ 2-diabetes, utgör pioglitazon cirka 30 % till 50 % av de maximala totala serumkoncentrationerna av pioglitazon (pioglitazon plus aktiva metaboliter) och 20 % till 25 % av den totala AUC.
Cmax, AUC och dalkoncentrationer i serum (Cmin) för pioglitazon och M-III och M-IV ökade proportionellt med administrerade doser på 15 mg och 30 mg per dag.
Absorption
Efter oral administrering av pioglitazon var Tmax för pioglitazon inom två timmar. Mat fördröjer Tmax till tre till fyra timmar men förändrar inte graden av absorption (AUC).
Distribution
Den genomsnittliga skenbara distributionsvolymen (Vd/F) för pioglitazon efter administrering av engångsdos är 0,63 ± 0,41 (medelvärde ± SD) L/kg kroppsvikt. Pioglitazon är i hög grad proteinbundet (>99%) i humant serum, främst till serumalbumin. Pioglitazon binder även till andra serumproteiner, men med lägre affinitet. M-III och M-IV är också i hög grad bundna (>98%) till serumalbumin.
Ämnesomsättning
Pioglitazon metaboliseras i stor utsträckning genom hydroxylering och oxidation; metaboliterna omvandlas också delvis till glukuronid- eller sulfatkonjugat. Metaboliterna M-III och M-IV är de huvudsakliga cirkulerande aktiva metaboliterna hos människor.
In vitro-data visar att flera CYP-isoformer är involverade i metabolismen av pioglitazon, vilka inkluderar CYP2C8 och, i mindre grad, CYP3A4 med ytterligare bidrag från en mängd andra isoformer inklusive den huvudsakligen extrahepatiska CYP1A1. In vivo-studie av pioglitazon i kombination med gemfibrozil, en stark CYP2C8-hämmare, visade att pioglitazon är ett CYP2C8-substrat [se DOSERING OCH ADMINISTRERING och LÄKEMEDELSINTERAKTIONER ]. Urinära 6β-hydroxikortisol/kortisol-förhållanden uppmätt hos patienter behandlade med ACTOS 30 mg visade att pioglitazon inte är en stark CYP3A4-enzyminducerare.
Utsöndring och eliminering
Efter oral administrering återfinns cirka 15 % till 30 % av pioglitazondosen i urinen. Renal eliminering av pioglitazon är försumbar, och läkemedlet utsöndras främst som metaboliter och deras konjugat. Det antas att det mesta av den orala dosen utsöndras i gallan antingen oförändrad eller som metaboliter och elimineras i avföringen.
Den genomsnittliga halveringstiden i serum (t1/2) för pioglitazon och dess metaboliter (M-III och M-IV) varierar från tre till sju timmar respektive 16 till 24 timmar. Pioglitazon har en skenbar clearance, CL/F, beräknad till fem till sju L/h.
Nedsatt njurfunktion
Elimineringshalveringstiden i serum för pioglitazon, M-III och M-IV förblir oförändrad hos patienter med måttligt (kreatininclearance [CLcr] 30 till 50 ml/min) och allvarligt (CLcr
Nedsatt leverfunktion
Jämfört med friska kontroller har försökspersoner med nedsatt leverfunktion (Child-Turcotte-Pugh Grade B/C) en cirka 45 % minskning av pioglitazon och totalt pioglitazon (pioglitazon, M-III och M-IV) medel-Cmax men ingen förändring i medelvärdet för AUC. Därför krävs ingen dosjustering hos patienter med nedsatt leverfunktion.
Det finns rapporter om leversvikt efter marknadsföring med ACTOS och kliniska prövningar har generellt uteslutit patienter med serum-ALAT >2,5 gånger den övre gränsen för referensintervallet. Var försiktig hos patienter med leversjukdom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Geriatriska patienter
Hos friska äldre försökspersoner skilde sig inte Cmax för pioglitazon signifikant, men AUC-värdena var cirka 21 % högre än de som uppnåddes hos yngre försökspersoner. Den genomsnittliga t1/2 för pioglitazon var också förlängd hos äldre försökspersoner (cirka tio timmar) jämfört med yngre försökspersoner (cirka sju timmar). Dessa förändringar var inte av en omfattning som skulle anses vara kliniskt relevanta.
Pediatriska patienter
Säkerhet och effekt av pioglitazon hos pediatriska patienter har inte fastställts. ACTOS 15 mg rekommenderas inte för användning till pediatriska patienter [se Användning i specifika populationer ].
Kön
De genomsnittliga Cmax- och AUC-värdena för pioglitazon ökade med 20 % till 60 % hos kvinnor jämfört med män. I kontrollerade kliniska prövningar var HbA1c-minskningar från baslinjen generellt sett större för kvinnor än för män (genomsnittlig skillnad i HbA1c 0,5%). Eftersom behandlingen bör individualiseras för varje patient för att uppnå glykemisk kontroll, rekommenderas ingen dosjustering baserat på enbart kön.
Etnicitet
Farmakokinetiska data från olika etniska grupper är inte tillgängliga.
Läkemedelsinteraktioner
Djurtoxikologi och/eller farmakologi
Hjärtförstoring har observerats hos möss (100 mg/kg), råttor (4 mg/kg och över) och hundar (3 mg/kg) som behandlats oralt med pioglitazonhydroklorid (ungefär 11, 1 och 2 gånger det maximala rekommenderade orala orala värdet för människor dos för möss, råttor respektive hundar, baserat på mg/m2). I en ettårig råttstudie inträffade läkemedelsrelaterad tidig död på grund av uppenbar hjärtdysfunktion vid en oral dos på 160 mg/kg/dag (ungefär 35 gånger den maximala rekommenderade orala dosen för människor baserat på mg/m2). Hjärtförstoring sågs i en 13-veckors studie på apor vid orala doser på 8,9 mg/kg och högre (ungefär fyra gånger den maximala rekommenderade orala dosen för människor baserat på mg/m2), men inte i en 52-veckors studie vid orala doser upp till 32 mg/kg (ungefär 13 gånger den maximala rekommenderade orala dosen för människor baserat på mg/m2).
Kliniska studier
Monoterapi
Tre randomiserade, dubbelblinda, placebokontrollerade studier med varaktigheter från 16 till 26 veckor genomfördes för att utvärdera användningen av ACTOS som monoterapi hos patienter med typ 2-diabetes. Dessa studier undersökte ACTOS 15 mg i doser upp till 45 mg eller placebo en gång dagligen hos totalt 865 patienter.
I en 26-veckors dosvarierande monoterapistudie randomiserades 408 patienter med typ 2-diabetes till att få 7,5 mg, 15 mg, 30 mg eller 45 mg ACTOS eller placebo en gång dagligen. Behandling med något tidigare antidiabetiskt medel avbröts åtta veckor före den dubbelblinda perioden. Behandling med 15 mg, 30 mg och 45 mg ACTOS 30 mg gav statistiskt signifikanta förbättringar av HbA1c och fasteplasmaglukos (FPG) vid endpoint jämfört med placebo (se figur 1, tabell 17).
Figur 1 visar tidsförloppet för förändringar i HbA1c i denna 26-veckorsstudie.
Figur 1. Genomsnittlig förändring från baslinjen för HbA1c i en 26-veckors placebokontrollerad dosstudie (observerade värden)
en 24-veckors placebokontrollerad monoterapistudie randomiserades 260 patienter med typ 2-diabetes till en av två tvångstitrerade ACTOS-behandlingsgrupper eller en skentitrerad placebogrupp. Behandling med något tidigare antidiabetiskt medel avbröts sex veckor före den dubbelblinda perioden. I en behandlingsgrupp med ACTOS 15 mg fick patienterna en initial dos på 7,5 mg en gång dagligen. Efter fyra veckor ökades dosen till 15 mg en gång dagligen och efter ytterligare fyra veckor ökades dosen till 30 mg en gång dagligen under resten av prövningen (16 veckor). I den andra ACTOS-behandlingsgruppen fick patienterna en initial dos på 15 mg en gång dagligen och titrerades till 30 mg en gång dagligen och 45 mg en gång dagligen på liknande sätt. Behandling med ACTOS 15 mg, som beskrivits, gav statistiskt signifikanta förbättringar av HbA1c och FPG vid endpoint jämfört med placebo (se tabell 18).
en 16-veckors monoterapistudie randomiserades 197 patienter med typ 2-diabetes till behandling med 30 mg ACTOS eller placebo en gång dagligen. Behandling med något tidigare antidiabetiskt medel avbröts sex veckor före den dubbelblinda perioden. Behandling med 30 mg ACTOS gav statistiskt signifikanta förbättringar av HbA1c och FPG vid endpoint jämfört med placebo (se tabell 19).
Kombinationsterapi
Tre 16 veckor långa, randomiserade, dubbelblinda, placebokontrollerade kliniska studier genomfördes för att utvärdera effekterna av ACTOS (15 mg och/eller 30 mg) på glykemisk kontroll hos patienter med typ 2-diabetes som var otillräckligt kontrollerade (HbA1c ≥8) %) trots nuvarande behandling med en sulfonylurea, metformin eller insulin. Dessutom genomfördes tre 24-veckors randomiserade, dubbelblinda kliniska prövningar för att utvärdera effekterna av ACTOS 30 mg kontra ACTOS 45 mg på glykemisk kontroll hos patienter med typ 2-diabetes som var otillräckligt kontrollerade (HbA1c ≥8%) trots nuvarande behandling med en sulfonylurea, metformin eller insulin. Tidigare diabetesbehandling kan ha varit monoterapi eller kombinationsbehandling.
Tillägg till sulfonureidprövningar
Två kliniska prövningar utfördes med ACTOS i kombination med en sulfonylurea. Båda studierna inkluderade patienter med typ 2-diabetes på valfri dos av en sulfonylurea, antingen ensam eller i kombination med ett annat antidiabetiskt medel. Alla andra antidiabetika drogs ut minst tre veckor innan studiebehandlingen påbörjades.
I den första studien randomiserades 560 patienter till att få 15 mg eller 30 mg ACTOS 30 mg eller placebo en gång dagligen i 16 veckor utöver sin nuvarande sulfonylurea-kur. Behandling med ACTOS som tillägg till sulfonylurea gav statistiskt signifikanta förbättringar av HbA1c och FPG vid endpoint jämfört med placebo-tillägg till sulfonylurea (se tabell 20).
den andra studien randomiserades 702 patienter till att få 30 mg eller 45 mg ACTOS en gång dagligen i 24 veckor utöver sin nuvarande sulfonylureabehandling. Den genomsnittliga minskningen från baslinjen vid vecka 24 i HbA1c var 1,6 % för 30 mg-dosen och 1,7 % för 45 mg-dosen (se tabell 21). Den genomsnittliga minskningen från baslinjen vid vecka 24 i FPG var 52 mg/dL för 30 mg dosen och 56 mg/dL för 45 mg dosen.
Den terapeutiska effekten av ACTOS i kombination med sulfonylurea observerades hos patienter oavsett sulfonylureiddosen.
Tillägg till metforminförsök
Två kliniska prövningar utfördes med ACTOS 30 mg i kombination med metformin. Båda studierna inkluderade patienter med typ 2-diabetes på valfri dos av metformin, antingen ensamt eller i kombination med ett annat antidiabetiskt medel. Alla andra antidiabetika drogs ut minst tre veckor innan studiebehandlingen påbörjades.
den första studien randomiserades 328 patienter till att få antingen 30 mg ACTOS eller placebo en gång dagligen i 16 veckor utöver sin nuvarande metforminbehandling. Behandling med ACTOS 30 mg som tillägg till metformin gav statistiskt signifikanta förbättringar av HbA1c och FPG vid endpoint jämfört med placebo-tillägg till metformin (se tabell 22).
I den andra studien randomiserades 827 patienter till att få antingen 30 mg eller 45 mg ACTOS 30 mg en gång dagligen i 24 veckor utöver sin nuvarande metforminkur. Den genomsnittliga minskningen från baslinjen vid vecka 24 i HbA1c var 0,8 % för 30 mg-dosen och 1,0 % för 45 mg-dosen (se tabell 23). Den genomsnittliga minskningen från baslinjen vid vecka 24 i FPG var 38 mg/dL för 30 mg dosen och 51 mg/dL för 45 mg dosen.
Den terapeutiska effekten av ACTOS i kombination med metformin observerades hos patienter oavsett metformindosen.
Tillägg till insulinförsök
Två kliniska prövningar utfördes med ACTOS 15 mg i kombination med insulin. Båda studierna inkluderade patienter med typ 2-diabetes på insulin, antingen ensamt eller i kombination med ett annat antidiabetiskt medel. Alla andra antidiabetika drogs ut innan studiebehandlingen påbörjades. I den första studien randomiserades 566 patienter till att få antingen 15 mg eller 30 mg ACTOS 15 mg eller placebo en gång dagligen i 16 veckor utöver sin insulinkur. Behandling med ACTOS 30 mg som tillägg till insulin gav statistiskt signifikanta förbättringar av HbA1c och FPG vid endpoint jämfört med placebotillägg till insulin (se tabell 24). Den genomsnittliga dagliga insulindosen vid baslinjen i varje behandlingsgrupp var cirka 70 enheter. Majoriteten av patienterna (75 % totalt, 86 % behandlade med placebo, 77 % behandlade med ACTOS 15 mg och 61 % behandlade med ACTOS 30 mg) hade ingen förändring i sin dagliga insulindos från baslinjen till det sista studiebesöket. Den genomsnittliga förändringen från baslinjen i daglig insulindos (inklusive patienter utan insulindosändringar) var -3 enheter hos patienterna som behandlades med ACTOS 15 mg, -8 enheter hos patienterna som behandlades med ACTOS 30 mg och -1 enheter hos patienterna behandlas med placebo.
den andra studien randomiserades 690 patienter som fick en median på 60 enheter insulin per dag till att få antingen 30 mg eller 45 mg ACTOS en gång dagligen i 24 veckor utöver sin nuvarande insulinregim. Den genomsnittliga minskningen från baslinjen vid vecka 24 i HbA1c var 1,2 % för 30 mg-dosen och 1,5 % för 45 mg-dosen. Den genomsnittliga minskningen från baslinjen vid vecka 24 i FPG var 32 mg/dL för 30 mg-dosen och 46 mg/dL för 45 mg-dosen (se tabell 25). Den genomsnittliga dagliga insulindosen vid baslinjen i båda behandlingsgrupperna var cirka 70 enheter. Majoriteten av patienterna (55 % totalt, 58 % behandlade med ACTOS 30 mg och 52 % behandlade med ACTOS 45 mg) hade ingen förändring i sin dagliga insulindos från baslinjen till det sista studiebesöket. Den genomsnittliga förändringen från baslinjen i daglig insulindos (inklusive patienter utan insulindosändringar) var -5 enheter hos patienterna som behandlades med ACTOS 30 mg och -8 enheter hos patienterna som behandlades med ACTOS 45 mg.
Den terapeutiska effekten av ACTOS i kombination med insulin observerades hos patienter oavsett insulindos.
PATIENTINFORMATION
ACTOS (ak-TOS) (pioglitazon) Tabletter
Läs denna medicineringsguide noggrant innan du börjar ta ACTOS 15mg och varje gång du får en påfyllning. Det kan komma ny information. Denna information ersätter inte att prata med din läkare om ditt medicinska tillstånd eller din behandling. Om du har några frågor om ACTOS, fråga din läkare eller apotekspersonal.
Vilken är den viktigaste informationen jag borde veta om ACTOS?
ACTOS kan orsaka allvarliga biverkningar, inklusive ny eller värre hjärtsvikt.
- ACTOS 15mg kan få din kropp att behålla extra vätska (vätskeretention), vilket leder till svullnad (ödem) och viktökning. Extra kroppsvätska kan göra vissa hjärtproblem värre eller leda till hjärtsvikt. Hjärtsvikt betyder att ditt hjärta inte pumpar blod tillräckligt bra
- Ta inte ACTOS om du har allvarlig hjärtsvikt
- Om du har hjärtsvikt med symtom (såsom andnöd eller svullnad), även om dessa symtom inte är allvarliga, kanske ACTOS inte är rätt för dig
Ring din läkare omedelbart om du har något av följande:
- svullnad eller vätskeretention, särskilt i anklarna eller benen
- andnöd eller andningssvårigheter, särskilt när du ligger ner
- en ovanligt snabb viktökning
- ovanlig trötthet
ACTOS kan ha andra allvarliga biverkningar. Se "Vilka är de möjliga biverkningarna av ACTOS?"
Vad är ACTOS?
ACTOS 15mg är ett receptbelagt läkemedel som används tillsammans med kost och träning för att förbättra blodsockerkontrollen (glukos) hos vuxna med typ 2-diabetes. ACTOS är ett diabetesläkemedel som kallas pioglitazon som kan tas ensamt eller tillsammans med andra diabetesläkemedel.
Det är inte känt om ACTOS är säkert och effektivt för barn under 18 år. ACTOS rekommenderas inte för användning till barn.
ACTOS är inte för personer med typ 1-diabetes.
ACTOS 30mg är inte för personer med diabetisk ketoacidos (ökade ketoner i ditt blod eller urin).
Vem bör inte ta ACTOS?
Se "Vad är den viktigaste informationen jag borde veta om ACTOS 15mg?"
Ta inte ACTOS 15 mg om du:
- har allvarlig hjärtsvikt
- är allergiska mot någon av ingredienserna i ACTOS. Se slutet av denna medicinguide för en komplett lista över ingredienser i ACTOS
Tala med din läkare innan du tar ACTOS om du har något av dessa tillstånd.
Vad ska jag berätta för min läkare innan jag tar ACTOS 30mg?
Innan du tar ACTOS, berätta för din läkare om du:
- har hjärtsvikt
- har typ 1 (”juvenil”) diabetes eller haft diabetisk ketoacidos
- har en typ av diabetisk ögonsjukdom som orsakar svullnad i bakre delen av ögat (makulaödem)
- har leverproblem
- har eller har haft cancer i urinblåsan
- är gravid eller planerar att bli gravid. Det är inte känt om ACTOS 15 mg kan skada ditt ofödda barn. Tala med din läkare om du är gravid eller planerar att bli gravid om det bästa sättet att kontrollera dina blodsockernivåer när du är gravid
- är en premenopausal kvinna (före "livsförändringen") som inte har mens regelbundet eller alls. ACTOS 30mg kan öka din chans att bli gravid. Tala med din läkare om val av preventivmedel när du tar ACTOS. Tala genast om för din läkare om du blir gravid medan du tar ACTOS
- ammar eller planerar att amma. Det är inte känt om ACTOS går över i din mjölk och om det kan skada ditt barn. Tala med din läkare om det bästa sättet att kontrollera dina blodsockernivåer när du ammar
Berätta för din läkare om alla läkemedel du tar inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
ACTOS 30mg och några av dina andra läkemedel kan påverka varandra. Du kan behöva ändra din dos av ACTOS 15 mg eller vissa andra läkemedel.
Vet vilka mediciner du tar. Håll en lista över dina läkemedel och visa den för din läkare och apotekspersonal innan du börjar med ett nytt läkemedel. De kommer att tala om för dig om det är okej att ta ACTOS 15 mg tillsammans med andra läkemedel.
Hur ska jag ta ACTOS 15mg?
- Ta ACTOS 15 mg precis som din läkare säger åt dig att ta det
- Din läkare kan ändra din dos av ACTOS. Ändra inte din ACTOS-dos om inte din läkare säger åt dig att göra det
- ACTOS kan förskrivas ensamt eller tillsammans med andra diabetesläkemedel. Detta beror på hur väl ditt blodsocker kontrolleras
- Ta ACTOS 15 mg en gång varje dag, med eller utan mat
- Om du missar en dos av ACTOS 15 mg, ta din nästa dos enligt ordination om inte din läkare säger något annat till dig. Ta inte två doser på en gång nästa dag
- Om du tar för mycket ACTOS, ring din läkare eller gå till närmaste akutmottagning direkt
- Om din kropp är stressad såsom feber, infektion, olycka eller operation kan dosen av dina diabetesläkemedel behöva ändras. Ring din läkare direkt
- Fortsätt med dina kost- och träningsprogram och testa ditt blodsocker regelbundet medan du tar ACTOS
- Din läkare bör göra vissa blodprov innan du börjar och medan du tar ACTOS
- Din läkare bör också göra hemoglobin A1C-test för att kontrollera hur väl ditt blodsocker kontrolleras med ACTOS
- Din läkare bör kontrollera dina ögon regelbundet medan du tar ACTOS
Vilka är de möjliga biverkningarna av ACTOS?
ACTOS kan orsaka allvarliga biverkningar inklusive:
- Se "Vad är den viktigaste informationen jag borde veta om ACTOS?"
- lågt blodsocker (hypoglykemi). Detta kan hända om du hoppar över måltider, om du också använder ett annat läkemedel som sänker blodsockret eller om du har vissa medicinska problem. Yrsel, yrsel, skakningar eller hunger kan inträffa om ditt blodsocker är för lågt. Ring din läkare om låga blodsockernivåer är ett problem för dig
- leverproblem. Ring din läkare omedelbart om du har:
- illamående eller kräkningar
- magont
- ovanlig eller oförklarlig trötthet
- aptitlöshet
- mörk urin
- gulfärgning av din hud eller det vita i dina ögon
- Blåscancer. Det kan finnas en ökad risk att få blåscancer när du tar ACTOS. Du ska inte ta ACTOS 15 mg om du får behandling för cancer i urinblåsan. Berätta omedelbart för din läkare om du har något av följande symtom på blåscancer:
- blod eller en röd färg i urinen
- ett ökat behov av att kissa
- smärta när du kissar
- brutna ben (frakturer). Vanligtvis i handen, överarmen eller foten hos kvinnor. Tala med din läkare för råd om hur du håller dina ben friska.
- diabetisk ögonsjukdom med svullnad i bakre delen av ögat (makulaödem). Tala genast om för din läkare om du har några förändringar i din syn. Din läkare bör kontrollera dina ögon regelbundet
- frisättning av ett ägg från en äggstock hos en kvinna (ägglossning) som leder till graviditet. Ägglossning kan inträffa när premenopausala kvinnor som inte har regelbunden menstruation tar ACTOS. Detta kan öka din chans att bli gravid
- förkylningsliknande symtom (övre luftvägsinfektion)
- huvudvärk
- bihåleinflammation
- träningsvärk
- öm hals
De vanligaste biverkningarna av ACTOS inkluderar:
Tala om för din läkare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla biverkningar av ACTOS. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara ACTOS 15mg?
- Förvara ACTOS 15 mg vid 68°F till 77°F (20°C till 25°C). Förvara ACTOS i originalförpackningen och skydda mot ljus
- Förvara ACTOS-flaskan väl tillsluten och håll tabletterna torra
- Förvara ACTOS och alla läkemedel utom räckhåll för barn
Allmän information om säker och effektiv användning av ACTOS
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte ACTOS för ett tillstånd som det inte ordinerats för. Ge inte ACTOS till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna medicinguide sammanfattar den viktigaste informationen om ACTOS. Om du vill ha mer information, prata med din läkare. Du kan fråga din läkare eller apotekspersonal om information om ACTOS som är skriven för vårdpersonal. För mer information, gå till www.actos.com eller ring 1-877-825-3327.
Vilka är ingredienserna i ACTOS 15mg?
Aktiv ingrediens: pioglitazon Inaktiv ingrediens: laktos 15mge monohydrat, hydroxipropylcellulosa, karboximetylcellulosa kalcium och magnesiumstearat
Denna medicineringsguide har godkänts av US Food and Drug Administration.
