Zofran 4mg, 8mg Ondansetron Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Zofran och hur används det?
Zofran 4mg är ett receptbelagt läkemedel som används som profylax och för att behandla symtom på illamående och kräkningar på grund av vissa mediciner eller postoperativt. Zofran 8mg kan användas ensamt eller tillsammans med andra läkemedel.
Zofran tillhör en klass av läkemedel som kallas antiemetika, selektiv 5-HT3-antagonist.
Det är inte känt om Zofran 4mg är säkert och effektivt för barn yngre än 1 månad.
Vilka är de möjliga biverkningarna av Zofran?
Zofran kan orsaka allvarliga biverkningar inklusive:
- svår förstoppning,
- magont,
- uppblåsthet,
- huvudvärk med bröstsmärtor och svår yrsel,
- svimning,
- snabba eller bultande hjärtslag,
- gulfärgning av huden eller ögonen (gulsot)
- suddig syn,
- tillfällig synförlust,
- agitation,
- hallucinationer,
- feber,
- snabb hjärtfrekvens,
- överaktiva reflexer,
- illamående,
- kräkningar,
- diarre,
- förlust av koordination, och
- svimning
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Zofran inkluderar:
- diarre,
- förstoppning,
- dåsighet och
- trött känsla
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Zofran. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
Den aktiva ingrediensen i ZOFRAN 4 mg tabletter och ZOFRAN oral lösning är ondansetronhydroklorid som dihydrat, den racemiska formen av ondansetron och ett selektivt blockerande medel av typen serotonin 5-HT3-receptor. Kemiskt är det (±) 1, 2, 3, 9-tetrahydro-9-metyl-3-[(2-metyl-1H-imidazol-1-yl)metyl]-4H-karbazol-4-on, monohydroklorid, dihydrat . Den har följande strukturformel:
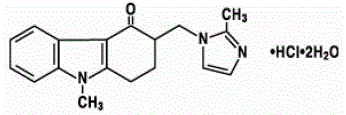
Den empiriska formeln är C18H19N3O·HCl·2H2O, vilket representerar en molekylvikt på 365,9.
Ondansetronhydrokloriddihydrat är ett vitt till benvitt pulver som är lösligt i vatten och normal koksaltlösning.
Den aktiva ingrediensen i ZOFRAN 4mg ODT oralt sönderfallande tabletter är ondansetronbas, den racemiska formen av ondansetron och ett selektivt blockerande medel av typen serotonin 5-HT3-receptor. Kemiskt är det (±) 1,2,3,9tetrahydro-9-metyl-3-[(2-metyl-lH-imidazol-l-yl)metyl]-4H-karbazol-4-on. Den har följande strukturformel:
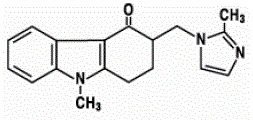
Den empiriska formeln är C18H19N3O som representerar en molekylvikt på 293,4.
Varje 4 mg ZOFRAN 8 mg tablett för oral administrering innehåller ondansetronhydrokloriddihydrat motsvarande 4 mg ondansetron. Varje 8 mg ZOFRAN 8 mg tablett för oral administrering innehåller ondansetronhydrokloriddihydrat motsvarande 8 mg ondansetron. Varje tablett innehåller också de inaktiva ingredienserna hypromellos, gul järnoxid (endast 8 mg tablett), laktos, magnesiumstearat, mikrokristallin cellulosa, förgelatinerad stärkelse, triacetin och titandioxid.
Varje 4 mg ZOFRAN 8 mg ODT oralt sönderfallande tablett för oral administrering innehåller 4 mg ondansetronbas. Varje 8 mg ZOFRAN 4 mg ODT oralt sönderfallande tablett för oral administrering innehåller 8 mg ondansetronbas. Varje ZOFRAN ODT-tablett innehåller också de inaktiva ingredienserna aspartam, gelatin, mannitol, metylparabennatrium, propylparabennatrium och jordgubbssmak. ZOFRAN ODT tabletter är en frystorkad, oralt administrerad formulering av ondansetron som sönderfaller på tungan och inte kräver vatten för att underlätta upplösning eller sväljning.
Varje 5 ml ZOFRAN oral lösning innehåller 5 mg ondansetronhydrokloriddihydrat motsvarande 4 mg ondansetron. ZOFRAN 8mg oral lösning innehåller de inaktiva ingredienserna vattenfri citronsyra, renat vatten, natriumbensoat, natriumcitrat, sorbitol och jordgubbsarom.
INDIKATIONER
ZOFRAN är indicerat för att förebygga illamående och kräkningar i samband med:
- starkt emetogen cancerkemoterapi, inklusive cisplatin högre än eller lika med 50 mg/m²
- initiala och upprepade kurser av måttligt emetogen cancerkemoterapi
- strålbehandling hos patienter som får antingen total kroppsbestrålning, enstaka högdosfraktioner till buken eller dagliga fraktioner till buken
ZOFRAN är också indicerat för att förebygga postoperativt illamående och/eller kräkningar.
DOSERING OCH ADMINISTRERING
Dosering
De rekommenderade doseringsregimerna för vuxna och pediatriska patienter beskrivs i tabell 1 respektive tabell 2. Motsvarande doser av ZOFRAN tabletter, ZOFRAN ODT® oralt sönderfallande tabletter och ZOFRAN oral lösning kan användas omväxlande.
Dosering vid nedsatt leverfunktion
Hos patienter med gravt nedsatt leverfunktion (Child-Pugh-poäng på 10 eller högre), överskrid inte en total daglig dos på 8 mg [se Användning i specifika populationer , KLINISK FARMAKOLOGI ].
Administreringsinstruktioner för ZOFRAN ODT oralt sönderfallande tabletter
Försök inte trycka ZOFRAN ODT oralt sönderfallande tabletter genom foliebaksidan. Med torra händer, TA BORT foliebaksidan av 1 blisterförpackning och ta försiktigt bort tabletten. Placera OMEDELBART ZOFRAN 4mg ODT oralt sönderfallande tablett ovanpå tungan där den kommer att lösas upp på några sekunder och svälj sedan med saliv. Administrering med vätska är inte nödvändig.
HUR LEVERERAS
Doseringsformer och styrkor
ZOFRAN tabletter är ovala, filmdragerade tabletter märkta med ”Zofran” på ena sidan och finns i följande styrkor:
- 4 mg - vit tablett med "4" ingraverat på andra sidan.
- 8 mg - gul tablett med "8" ingraverat på andra sidan.
ZOFRAN ODT oralt sönderfallande tabletter är vita, runda och plankonvexa tabletter tillgängliga i följande styrkor:
- 4 mg - präglad med "Z4" på ena sidan.
- 8 mg - präglad med "Z8" på ena sidan.
ZOFRAN 4 mg oral lösning 4 mg/5 ml, är en klar, färglös till ljusgul vätska med en karakteristisk jordgubbsdoft tillgänglig i en 50 ml flaska.
Förvaring Och Hantering
ZOFRAN Tabletter
4 mg (ondansetronhydrokloriddihydrat motsvarande 4 mg ondansetron), är vita, ovala, filmdragerade tabletter märkta med ”Zofran” på ena sidan och ”4” på den andra i burkar med 30 tabletter (NDC 0078-0675-15) ).
Förvara mellan 2°C och 30°C (36°F och 86°F). Skydda från ljus. Dispensera i tät, ljusbeständig behållare enligt definitionen i USP.
8 mg (ondansetronhydrokloriddihydrat motsvarande 8 mg ondansetron), är gula, ovala, filmdragerade tabletter märkta med ”Zofran” på ena sidan och ”8” på den andra i burkar med 30 tabletter (NDC 0078-0676-15) ).
Förvara mellan 2°C och 30°C (36°F och 86°F). Skydda från ljus. Dispensera i tät, ljusbeständig behållare enligt definitionen i USP.
ZOFRAN 8mg ODT oralt sönderfallande tabletter
4 mg (som 4 mg ondansetronbas) är vita, runda och plankonvexa tabletter präglade med "Z4" på ena sidan i endosförpackningar om 30 tabletter (NDC 0078-0679-19).
mg (som 8 mg ondansetronbas) är vita, runda och plankonvexa tabletter präglade med "Z8" på ena sidan i endosförpackningar om 30 tabletter (NDC 0078-0680-19).
Förvara mellan 2°C och 30°C (36°F och 86°F).
ZOFRAN 4mg oral lösning
en klar, färglös till ljusgul vätska med en karakteristisk jordgubbsdoft, innehåller 5 mg ondansetronhydrokloriddihydrat motsvarande 4 mg ondansetron per 5 ml i bärnstensfärgade glasflaskor på 50 ml med barnsäkra förslutningar (NDC 0078-0677-22) .
Förvaras upprätt mellan 15°C och 30°C (59°F och 86°F). Skydda från ljus. Förvara flaskor upprätt i kartonger.
Distribuerat av: Novartis Pharmaceuticals Corporation East Hanover, New Jersey 07936. Reviderad: apr 2021
BIEFFEKTER
Följande kliniskt signifikanta biverkningar beskrivs på andra ställen i märkningen:
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- QT-förlängning [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Serotonergt syndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Maskering av progressiv ileus och gastrisk distention [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i praktiken.
Följande biverkningar har rapporterats i kliniska prövningar av patienter som behandlats med ondansetron, den aktiva substansen i ZOFRAN. Ett orsakssamband till behandling med ZOFRAN var i många fall oklart.
Förebyggande av illamående och kräkningar orsakade av kemoterapi
De vanligaste biverkningarna rapporterade hos mer än eller lika med 4 % av 300 vuxna som fick en engångsdos på 24 mg ZOFRAN 4 mg oralt i 2 studier för att förebygga illamående och kräkningar i samband med starkt emetogen kemoterapi (cisplatin större än eller lika med 50 mg /m²) var: huvudvärk (11 %) och diarré (4 %).
De vanligaste biverkningarna rapporterade i 4 studier på vuxna för att förebygga illamående och kräkningar i samband med måttligt emetogen kemoterapi (främst cyklofosfamidbaserade regimer) visas i Tabell 3.
Mindre vanliga biverkningar
Centrala nervsystemet
Extrapyramidala reaktioner (mindre än 1 % av patienterna).
Lever
Värdena för aspartattransaminas (AST) och/eller alanintransaminas (ALAT) överskred två gånger den övre normalgränsen hos cirka 1 % till 2 % av 723 patienter som fick ZOFRAN 8 mg och cyklofosfamidbaserad kemoterapi i amerikanska kliniska prövningar. Ökningen var övergående och verkade inte vara relaterade till dos eller behandlingslängd. Vid upprepad exponering inträffade liknande övergående höjningar av transaminasvärden i vissa behandlingar, men symtomatisk leversjukdom förekom inte. Rollen av cancerkemoterapi i dessa biokemiska förändringar är oklar.
Leversvikt och dödsfall har rapporterats hos cancerpatienter som samtidigt får mediciner, inklusive potentiellt hepatotoxisk cytotoxisk kemoterapi och antibiotika. Etiologin för leversvikten är oklar.
Integumentär
Utslag (ungefär 1 % av patienterna).
Annat (mindre än 2 %)
Anafylaxi, bronkospasm, takykardi, angina, hypokalemi, elektrokardiografiska förändringar, vaskulära ocklusiva händelser och grand mal-anfall. Förutom bronkospasm och anafylaxi är sambandet med ZOFRAN 4mg oklar.
Förebyggande av strålningsinducerad illamående och kräkningar
De vanligaste biverkningarna (större än eller lika med 2%) som rapporterades hos patienter som fick ZOFRAN och samtidig strålbehandling liknade de som rapporterades hos patienter som fick ZOFRAN och samtidig kemoterapi och var huvudvärk, förstoppning och diarré.
Förebyggande av postoperativt illamående och kräkningar
De vanligaste biverkningarna som rapporterats hos vuxna i försök(er) för att förebygga postoperativt illamående och kräkningar visas i tabell 4. I dessa försök(er) fick patienterna samtidigt flera perioperativa och postoperativa läkemedel i båda behandlingsgrupperna.
en crossover-studie med 25 försökspersoner rapporterades huvudvärk hos 6 försökspersoner som fick ZOFRAN 8 mg ODT oralt sönderfallande tablett med vatten (24 %) jämfört med 2 försökspersoner som fick ZOFRAN 8 mg ODT oralt sönderfallande tablett utan vatten (8 %).
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av ondansetron efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Kardiovaskulär
Arytmier (inklusive ventrikulär och supraventrikulär takykardi, prematura ventrikulära kontraktioner och förmaksflimmer), bradykardi, elektrokardiografiska förändringar (inklusive andra gradens hjärtblock, QT/QTc-intervallförlängning och ST-segmentdepression), hjärtklappning och synkope. I sällsynta fall och främst med intravenös ondansetron har övergående EKG-förändringar, inklusive förlängning av QT-intervallet, rapporterats.
Allmän
Spolning
Sällsynta fall av överkänslighetsreaktioner, ibland allvarliga (t.ex. anafylaktiska reaktioner, angioödem, bronkospasm, andnöd, hypotoni, larynxödem, stridor) har också rapporterats. Laryngospasm, chock och hjärtstillestånd har inträffat under allergiska reaktioner hos patienter som får injicerbart ondansetron.
Lever och gallvägar
Leverenzymavvikelser.
Nedre andningsorganen
Hicka.
Neurologi
Oculogyric kris, uppträder ensam, såväl som med andra dystoniska reaktioner.
Hud
Urtikaria, Stevens-Johnsons syndrom och toxisk epidermal nekrolys.
Ögonstörningar
Fall av övergående blindhet, främst under intravenös administrering, har rapporterats. Dessa fall av övergående blindhet rapporterades försvinna inom några minuter upp till 48 timmar.
LÄKEMEDELSINTERAKTIONER
Serotonerga läkemedel
Serotonergt syndrom (inklusive förändrad mental status, autonom instabilitet och neuromuskulära symtom) har beskrivits efter samtidig användning av 5-HT3-receptorantagonister och andra serotonerga läkemedel, inklusive SSRI och SNRI. Övervaka uppkomsten av serotonergt syndrom. Om symtom uppstår, avbryt behandlingen med ZOFRAN 4 mg och påbörja stödjande behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Läkemedel som påverkar cytokrom P-450 enzymer
Ondansetron verkar inte i sig inducera eller hämma det cytokrom P-450 läkemedelsmetaboliserande enzymsystemet i levern [se KLINISK FARMAKOLOGI ]. Eftersom ondansetron metaboliseras av hepatiska cytokrom P450 läkemedelsmetaboliserande enzymer (CYP3A4, CYP2D6, CYP1A2), kan inducerare eller hämmare av dessa enzymer förändra clearance och, därmed, halveringstiden för ondansetron. Hos patienter som behandlats med potenta inducerare av CYP3A4 (dvs fenytoin, karbamazepin och rifampin) ökade clearance av ondansetron signifikant och blodkoncentrationerna av ondansetron minskade. Baserat på tillgängliga data rekommenderas dock ingen dosjustering för ZOFRAN 8 mg för patienter som använder dessa läkemedel [se KLINISK FARMAKOLOGI ].
Tramadol
Även om ingen farmakokinetisk läkemedelsinteraktion mellan ondansetron och tramadol har observerats, tyder data från 2 små studier på att ZOFRAN 8 mg kan öka patientkontrollerad administrering av tramadol när det används tillsammans. Övervaka patienter för att säkerställa adekvat smärtkontroll när ondansetron administreras med tramadol.
Kemoterapi
Karmustin, etoposid och cisplatin påverkar inte farmakokinetiken för ondansetron.
en crossover-studie på 76 pediatriska patienter ökade intravenöst ondansetron inte de systemiska koncentrationerna av högdos metotrexat.
Alfentanil Och Atracurium
ZOFRAN 4mg förändrar inte de andningsdepressiva effekterna som produceras av alfentanil eller graden av neuromuskulär blockad som produceras av atracurium. Interaktioner med allmänna eller lokalanestetika har inte studerats.
Narkotikamissbruk och beroende
Djurstudier har visat att ondansetron inte diskrimineras som ett bensodiazepin och inte heller ersätter det bensodiazepiner i direkta beroendestudier.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Överkänslighetsreaktioner
Överkänslighetsreaktioner, inklusive anafylaxi och bronkospasm, har rapporterats hos patienter som har uppvisat överkänslighet mot andra selektiva 5-HT3-receptorantagonister. Om överkänslighetsreaktioner uppstår, avbryt användningen av ZOFRAN; behandla omedelbart enligt standardvård och övervaka tills tecken och symtom försvinner [se KONTRAINDIKATIONER ].
QT-förlängning
Elektrokardiogramförändringar (EKG) inklusive förlängning av QT-intervallet har setts hos patienter som får ondansetron. Dessutom har fall av Torsade de Pointes efter marknadsföring rapporterats hos patienter som använder ZOFRAN. Undvik ZOFRAN 8mg hos patienter med medfött långt QT-syndrom. EKG-övervakning rekommenderas till patienter med elektrolytavvikelser (t.ex. hypokalemi eller hypomagnesemi), kongestiv hjärtsvikt, bradyarytmier eller patienter som tar andra läkemedel som leder till QT-förlängning [se KLINISK FARMAKOLOGI ].
Serotonin syndrom
Utvecklingen av serotonergt syndrom har rapporterats med enbart 5-HT3-receptorantagonister. De flesta rapporter har associerats med samtidig användning av serotonerga läkemedel (t.ex. selektiva serotoninåterupptagshämmare (SSRI), serotonin- och noradrenalinåterupptagshämmare (SNRI), monoaminoxidashämmare, mirtazapin, fentanyl, litium, tramadol och intravenöst). Några av de rapporterade fallen var dödliga. Serotonergt syndrom som uppträder vid överdosering av enbart ZOFRAN 4 mg har också rapporterats. Majoriteten av rapporterna om serotonergt syndrom relaterade till användning av 5-HT3-receptorantagonister inträffade på en vårdavdelning efter anestesi eller ett infusionscenter.
Symtom associerade med serotonergt syndrom kan inkludera följande kombination av tecken och symtom: mentala statusförändringar (t.ex. agitation, hallucinationer, delirium och koma), autonom instabilitet (t.ex. takykardi, labilt blodtryck, yrsel, diafores, rodnad, hypertermi) neuromuskulära symtom (t.ex. tremor, stelhet, myoklonus, hyperreflexi, inkoordination), kramper, med eller utan gastrointestinala symtom (t.ex. illamående, kräkningar, diarré). Patienter bör övervakas med avseende på uppkomsten av serotonergt syndrom, särskilt vid samtidig användning av ZOFRAN 4 mg och andra serotonerga läkemedel. Om symtom på serotonergt syndrom uppstår, avbryt behandlingen med ZOFRAN och påbörja stödjande behandling. Patienter bör informeras om den ökade risken för serotonergt syndrom, särskilt om ZOFRAN används samtidigt med andra serotonerga läkemedel [se LÄKEMEDELSINTERAKTIONER , ÖVERDOSERING ].
Maskering av progressiv ileus och gastrisk utvidgning
Användning av ZOFRAN hos patienter efter bukkirurgi eller hos patienter med illamående och kräkningar orsakade av kemoterapi kan maskera en progressiv ileus och/eller gastrisk utvidgning. Övervaka för minskad tarmaktivitet, särskilt hos patienter med riskfaktorer för gastrointestinala obstruktion.
ZOFRAN 8mg är inte ett läkemedel som stimulerar mag- eller tarmperistaltiken. Det ska inte användas istället för nasogastrisk sug.
Fenylketonuri
Patienter med fenylketonuri bör informeras om att ZOFRAN ODT oralt sönderfallande tabletter innehåller fenylalanin (en komponent i aspartam). Varje 4-mg och 8-mg oralt sönderfallande tablett innehåller mindre än 0,03 mg fenylalanin.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Karcinogena effekter sågs inte i 2-åriga studier på råttor och möss med orala ondansetrondoser upp till 10 mg/kg per dag respektive 30 mg/kg per dag (ungefär 4 och 6 gånger den maximala rekommenderade orala dosen för människor på 24 mg per dag, baserat på kroppsyta).
Ondansetron var inte mutagen i standardtester för mutagenicitet.
Oral administrering av ondansetron upp till 15 mg/kg per dag (cirka 6 gånger den maximala rekommenderade orala dosen för människor på 24 mg per dag, baserat på kroppsyta) påverkade inte fertiliteten eller den allmänna reproduktionsförmågan hos han- och honråttor.
Användning i specifika populationer
Graviditet
Risksammanfattning
Publicerade epidemiologiska studier om sambandet mellan användning av ondansetron och större fosterskador har rapporterat inkonsekventa fynd och har viktiga metodologiska begränsningar som utesluter slutsatser om säkerheten vid användning av ondansetron under graviditet (se Data ). Tillgängliga eftermarknadsföringsdata har inte identifierat en läkemedelsrelaterad risk för missfall eller ogynnsamma resultat hos modern. Reproduktionsstudier på råttor och kaniner visade inga tecken på skada på fostret när ondansetron administrerades under organogenesen med cirka 6 respektive 24 gånger den maximala rekommenderade orala dosen för människor på 24 mg/dag, baserat på kroppsyta, respektive (se Data ).
Bakgrundsrisken för stora fosterskador och missfall för den indikerade populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, missfall eller andra negativa resultat. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Data
Mänskliga data
Tillgängliga data om användning av ondansetron hos gravida kvinnor från flera publicerade epidemiologiska studier utesluter en bedömning av en läkemedelsrelaterad risk för ogynnsamma fosterutfall på grund av viktiga metodologiska begränsningar, inklusive osäkerheten om huruvida kvinnor som fyllde ut ett recept faktiskt tog medicinen, den samtidiga användningen av andra mediciner eller behandlingar, recall bias och andra ojusterade konfounders.
Ondansetronexponering in utero har inte associerats med övergripande allvarliga medfödda missbildningar i aggregerade analyser. En stor retrospektiv kohortstudie undersökte 1970 kvinnor som fick ett recept på ondansetron under graviditeten och rapporterade inget samband mellan exponering för ondansetron och allvarliga medfödda missbildningar, missfall, dödfödsel, för tidig förlossning, spädbarn med låg födelsevikt eller spädbarn som är små för graviditetsåldern.
Två stora retrospektiva kohortstudier och en fallkontrollstudie har bedömt ondansetronexponering under första trimestern och risk för kardiovaskulära defekter med inkonsekventa fynd. Relativa risker (RR) varierade från 0,97 (95 % KI 0,86 till 1,10) till 1,62 (95 % KI 1,04, 2,54). En undergruppsanalys i en av kohortstudierna observerade att ondansetron var specifikt associerat med hjärtseptumdefekter (RR 2,05, 95 % CI 1,19, 3,28); detta samband bekräftades dock inte i andra studier.
Flera studier har bedömt ondansetron och risken för munspalt med inkonsekventa fynd. En retrospektiv kohortstudie av 1,8 miljoner graviditeter i den amerikanska Medicaid-databasen visade en ökad risk för munspalt bland 88 467 graviditeter där oral ondansetron ordinerades under första trimestern (RR 1,24, 95 % CI 1,03, 1,48), men inget sådant samband fanns rapporterats med intravenös ondansetron i 23 866 graviditeter (RR 0,95, 95 % KI 0,63, 1,43). I undergruppen kvinnor som fick båda administreringsformerna var RR 1,07 (95 % KI 0,59, 1,93). Två fall-kontrollstudier, med hjälp av data från program för övervakning av fosterskador, rapporterade motstridiga samband mellan moderns användning av ondansetron och isolerad gomspalt (OR 1,6 [95 % KI 1,1, 2,3] och 0,5 [95 % KI 0,3, 1,0]). Det är okänt om ondansetronexponering in utero i fall av gomspalt inträffade under tiden för gomspalten (gommen bildas mellan 6:e och 9:e graviditetsveckan).
Djurdata
studier på embryo-fosterutveckling på råttor och kaniner fick dräktiga djur orala doser av ondansetron upp till 15 mg/kg/dag respektive 30 mg/kg/dag under organogenesperioden. Med undantag för en lätt minskning av moderns viktökning hos kaniner, fanns det inga signifikanta effekter av ondansetron på moderns djur eller utvecklingen av avkomman. Vid doser på 15 mg/kg/dag hos råttor och 30 mg/kg/dag hos kaniner, var moderns exponeringsmarginal cirka 6 respektive 24 gånger den maximala rekommenderade orala dosen för människor på 24 mg/dag, baserat på kroppsyta. .
en pre- och postnatal utvecklingstoxicitetsstudie fick gravida råttor orala doser av ondansetron upp till 15 mg/kg/dag från dag 17 av dräktigheten till kull Dag 21. Med undantag för en liten minskning av moderns kroppsviktsökning fanns det inga effekter på de dräktiga råttorna och den pre- och postnatala utvecklingen av deras avkomma, inklusive reproduktionsförmågan hos den parade F1-generationen. Vid en dos på 15 mg/kg/dag hos råttor var mödrarnas exponeringsmarginal cirka 6 gånger den maximala rekommenderade orala dosen för människor på 24 mg/dag, baserat på kroppsyta.
Laktation
Risksammanfattning
Det är inte känt om ondansetron finns i modersmjölk. Det finns inga data om effekterna av ZOFRAN 8 mg på det ammade barnet eller effekterna på mjölkproduktionen. Det har dock visats att ondansetron finns i mjölken hos råttor. När ett läkemedel finns i djurmjölk är det troligt att läkemedlet kommer att finnas i bröstmjölk.
De utvecklingsmässiga och hälsomässiga fördelarna med amning bör beaktas tillsammans med moderns kliniska behov av ZOFRAN 4 mg och eventuella negativa effekter på det ammade barnet från ZOFRAN eller från det underliggande moderns tillståndet.
Pediatrisk användning
Säkerheten och effektiviteten av oralt administrerat ZOFRAN har fastställts hos pediatriska patienter 4 år och äldre för att förebygga illamående och kräkningar i samband med måttligt emetogen cancerkemoterapi. Användning av ZOFRAN 4 mg i dessa åldersgrupper stöds av bevis från adekvata och välkontrollerade studier av ZOFRAN på vuxna med ytterligare data från 3 öppna, okontrollerade, icke-amerikanska studier på 182 pediatriska patienter i åldern 4 till 18 år med cancer som fick en mängd olika cisplatin- eller noncisplatin-kurer [se DOSERING OCH ADMINISTRERING , Kliniska studier ].
Ytterligare information om användning av ondansetron hos pediatriska patienter finns i ZOFRAN Injection förskrivningsinformation.
Säkerheten och effektiviteten av oralt administrerad ZOFRAN 4 mg har inte fastställts hos pediatriska patienter för:
- förebyggande av illamående och kräkningar i samband med starkt emetogen cancerkemoterapi
- förebyggande av illamående och kräkningar i samband med strålbehandling
- förebyggande av postoperativt illamående och/eller kräkningar
Geriatrisk användning
Av det totala antalet försökspersoner som inkluderades i cancerkemoterapi-inducerad och postoperativ illamående och kräkningar i USA- och utlandskontrollerade kliniska prövningar, för vilka det fanns subgruppsanalyser, var 938 (19%) i åldern 65 år och äldre.
Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan försökspersoner 65 år och äldre och yngre försökspersoner. En minskning av clearance och ökad eliminationshalveringstid sågs hos patienter äldre än 75 år jämfört med yngre försökspersoner [se KLINISK FARMAKOLOGI ]. Det fanns ett otillräckligt antal patienter äldre än 75 år och äldre i de kliniska prövningarna för att tillåta slutsatser om säkerhet eller effekt i denna åldersgrupp. Andra rapporterade kliniska erfarenheter har inte identifierat skillnader i svar mellan äldre och yngre patienter, men större känslighet hos vissa äldre individer kan inte uteslutas. Ingen dosjustering behövs hos äldre patienter.
Nedsatt leverfunktion
Ingen dosjustering behövs hos patienter med lätt eller måttligt nedsatt leverfunktion.
Hos patienter med gravt nedsatt leverfunktion minskar clearance och den skenbara distributionsvolymen ökar, vilket resulterar i en signifikant ökning av halveringstiden för ondansetron. Överskrid därför inte en total daglig dos på 8 mg hos patienter med gravt nedsatt leverfunktion (Child-Pugh-poäng på 10 eller högre) [se DOSERING OCH ADMINISTRERING , KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
Ingen dosjustering rekommenderas för patienter med någon grad av nedsatt njurfunktion (lindrig, måttlig eller svår). Det finns ingen erfarenhet utöver den första dagen administrering av ondansetron [se KLINISK FARMAKOLOGI ].
ÖVERDOS
Det finns ingen specifik motgift mot överdosering av ondansetron. Patienter bör hanteras med lämplig stödbehandling.
Utöver de biverkningar som anges ovan har följande biverkningar beskrivits vid överdosering av ondansetron: ”Plötslig blindhet” (amauros) av 2 till 3 minuters varaktighet plus svår förstoppning inträffade hos en patient som fick 72 mg ondansetron intravenöst som engångsdos. Hypotension (och svimning) inträffade hos en patient som tog 48 mg ZOFRAN-tabletter. Efter infusion av 32 mg under endast en 4-minutersperiod observerades en vasovagal episod med övergående andra gradens hjärtblock. I alla fall försvann biverkningarna helt.
Pediatriska fall som överensstämmer med serotonergt syndrom har rapporterats efter oavsiktliga orala överdoser av ondansetron (överstigande beräknat intag av 5 mg per kg) hos små barn. Rapporterade symtom inkluderade somnolens, agitation, takykardi, takypné, hypertoni, rodnad, mydriasis, diafores, myokloniska rörelser, horisontell nystagmus, hyperreflexi och anfall. Patienterna behövde stödjande vård, inklusive intubation i vissa fall, med fullständig återhämtning utan följdsjukdomar inom 1 till 2 dagar.
KONTRAINDIKATIONER
ZOFRAN är kontraindicerat hos patienter:
- känd för att ha överkänslighet (t.ex. anafylaxi) mot ondansetron eller någon av beståndsdelarna i formuleringen [se NEGATIVA REAKTIONER ]
- får samtidigt apomorfin på grund av risken för djup hypotoni och medvetslöshet
KLINISK FARMAKOLOGI
Handlingsmekanism
Ondansetron är en selektiv 5-HT3-receptorantagonist. Även om dess verkningsmekanism inte har karakteriserats fullt ut, är ondansetron inte en dopaminreceptorantagonist. Serotoninreceptorer av 5-HT3-typ finns både perifert på vagala nervterminaler och centralt i kemoreceptorns triggerzon i area postrema. Det är inte säkert om ondansetrons antiemetiska verkan förmedlas centralt, perifert eller på båda platserna. Cytotoxisk kemoterapi verkar dock vara associerad med frisättning av serotonin från enterokromaffincellerna i tunntarmen. Hos människor ökar urinutsöndringen av 5-hydroxiindolättiksyra (5-HIAA) efter administrering av cisplatin parallellt med uppkomsten av kräkningar. Det frisatta serotoninet kan stimulera de vagala afferenterna genom 5-HT3-receptorerna och initiera kräkningsreflexen.
Farmakodynamik
Hos friska försökspersoner hade enstaka intravenösa doser på 0,15 mg/kg ondansetron ingen effekt på esofagusmotilitet, gastrisk motilitet, lägre esofagussfinktertryck eller tunntarmspassagetid. Flerdagars administrering av ondansetron har visat sig bromsa kolontransit hos friska försökspersoner. Ondansetron har ingen effekt på plasmaprolaktinkoncentrationerna.
Hjärtets elektrofysiologi
Förlängning av QTc-intervallet studerades i en dubbelblind, enkel-intravenös dos, placebo- och positivt kontrollerad, crossover-studie på 58 friska försökspersoner. Den maximala medelskillnaden (95 % övre konfidensgräns) i QTcF från placebo efter baslinjekorrigering var 19,5 (21,8) millisekunder och 5,6 (7,4) millisekunder efter 15 minuters intravenösa infusioner av 32 mg respektive 8 mg ondansetroninjektion. Ett signifikant samband mellan exponering och respons identifierades mellan ondansetronkoncentration och ΔΔQTcF. Med hjälp av det etablerade exponerings-responssambandet hade 24 mg infunderat intravenöst under 15 minuter ett genomsnittligt förutsagt (95 % övre prediktionsintervall) ΔΔQTcF på 14,0 (16,3) millisekunder. Däremot hade 16 mg infunderat intravenöst under 15 minuter med användning av samma modell ett genomsnittligt förutsagt (95 % övre prediktionsintervall) ΔΔQTcF på 9,1 (11,2) millisekunder. I denna studie förlängde inte 8 mg-dosen infunderad under 15 minuter QT-intervallet i någon kliniskt relevant utsträckning.
Farmakokinetik
Absorption
Ondansetron absorberas från mag-tarmkanalen och genomgår viss first-pass metabolism. Den genomsnittliga biotillgängligheten hos friska försökspersoner, efter administrering av en enstaka 8 mg tablett, är cirka 56 %.
Systemisk exponering för ondansetron ökar inte proportionellt mot dosen. Arean under curve (AUC) från en 16 mg tablett var 24 % större än förutspått från en 8 mg tablettdos. Detta kan återspegla en viss minskning av first-pass-metabolismen vid högre orala doser.
Mateffekter
Biotillgängligheten förbättras också något av närvaron av mat.
Distribution
Plasmaproteinbindningen av ondansetron mätt in vitro var 70 % till 76 % över koncentrationsintervallet 10 till 500 ng/ml. Cirkulerande läkemedel distribueras också till erytrocyter.
Eliminering
Metabolism och utsöndring
Ondansetron metaboliseras i stor utsträckning hos människor, varvid cirka 5 % av en radiomärkt dos återvinns som modersubstans från urinen. Metaboliterna observeras i urinen. Den primära metaboliska vägen är hydroxylering på indolringen följt av efterföljande glukuronid- eller sulfatkonjugering.
In vitro metabolismstudier har visat att ondansetron är ett substrat för humana hepatiska cytokrom P-450-enzymer, inklusive CYP1A2, CYP2D6 och CYP3A4. När det gäller den totala ondansetronomsättningen spelade CYP3A4 den dominerande rollen. På grund av mångfalden av metaboliska enzymer som kan metabolisera ondansetron, är det troligt att hämning eller förlust av ett enzym (t.ex. genetisk brist på CYP2D6) kommer att kompenseras av andra och kan resultera i liten förändring i den totala hastigheten för eliminering av ondansetron.
Även om vissa icke-konjugerade metaboliter har farmakologisk aktivitet, återfinns dessa inte i plasma vid koncentrationer som sannolikt bidrar signifikant till den biologiska aktiviteten av ondansetron.
Specifika populationer
Ålder: Geriatrisk befolkning
En minskning av clearance och ökad eliminationshalveringstid ses hos patienter äldre än 75 år jämfört med yngre försökspersoner [se Användning i specifika populationer ].
Sex
Könsskillnader visades i dispositionen av ondansetron givet som engångsdos. Omfattningen och absorptionshastigheten är större hos kvinnor än hos män. Långsammare clearance hos kvinnor, en mindre skenbar distributionsvolym (justerat för vikt) och högre absolut biotillgänglighet resulterade i högre plasmakoncentrationer av ondansetron. Dessa högre plasmakoncentrationer kan delvis förklaras av skillnader i kroppsvikt mellan män och kvinnor. Det är inte känt om dessa könsrelaterade skillnader var kliniskt viktiga. Mer detaljerad farmakokinetisk information finns i tabellerna 5 och 6.
Nedsatt njurfunktion
Nedsatt njurfunktion förväntas inte signifikant påverka det totala clearance av ondansetron eftersom njurclearance endast representerar 5 % av det totala clearance. Det genomsnittliga plasmaclearancen av ondansetron minskade dock med cirka 50 % hos patienter med gravt nedsatt njurfunktion (kreatininclearance mindre än 30 ml/min). Minskningen av clearance var variabel och inte förenlig med en ökning av halveringstiden [se Användning i specifika populationer ].
Nedsatt leverfunktion
Hos patienter med lätt till måttligt nedsatt leverfunktion reduceras clearance två gånger och medelhalveringstiden ökas till 11,6 timmar jämfört med 5,7 timmar hos friska försökspersoner. Hos patienter med gravt nedsatt leverfunktion (Child-Pugh-poäng på 10 eller högre), reduceras clearance 2- till 3-faldigt och den skenbara distributionsvolymen ökar med en resulterande ökning av halveringstiden till 20 timmar [se DOSERING OCH ADMINISTRERING , Användning i specifika populationer ].
Läkemedelsinteraktionsstudier
CYP 3A4-inducerare
Eliminering av ondansetron kan påverkas av cytokrom P-450-inducerare. I en farmakokinetisk studie med 16 epileptiska patienter som bibehölls kroniskt på CYP3A4-inducerare, karbamazepin eller fenytoin, observerades en minskning av AUC, Cmax och t½ för ondansetron. Detta resulterade i en signifikant ökning av clearance av ondansetron. Denna ökning anses dock inte vara kliniskt relevant [se LÄKEMEDELSINTERAKTIONER ].
Kemoterapeutiska medel
Karmustin, etoposid och cisplatin påverkar inte farmakokinetiken för ondansetron [se LÄKEMEDELSINTERAKTIONER ].
Antacida
Samtidig administrering av antacida förändrar inte absorptionen av ondansetron.
Kliniska studier
Förebyggande av illamående och kräkningar orsakade av kemoterapi
Mycket emetogen kemoterapi
2 randomiserade, dubbelblinda monoterapistudier var en engångsdos på 24 mg av ZOFRAN överlägsen en relevant historisk placebokontroll för att förebygga illamående och kräkningar i samband med starkt emetogen cancerkemoterapi, inklusive cisplatin högre än eller lika med 50 mg/m². Steroidadministrering uteslöts från dessa kliniska prövningar. Mer än 90 % av patienterna som fick en cisplatindos större än eller lika med 50 mg/m² i den historiska placebojämföraren upplevde kräkningar i frånvaro av antiemetisk behandling.
den första studien jämfördes orala doser av ondansetron 24 mg som engångsdos, 8 mg var 8:e timme för 2 doser och 32 mg som engångsdos hos 357 vuxna cancerpatienter som fick kemoterapiregimer innehållande cisplatin större än eller lika med 50 mg/m² . Den första eller singeldosen administrerades 30 minuter före kemoterapi. Totalt 66 % av patienterna i gruppen ondansetron 24 mg en gång dagligen, 55 % i gruppen ondansetron 8 mg två gånger dagligen och 55 % i gruppen ondansetron 32 mg en gång dagligen fullföljde 24-timmars provperioden med 0 emetiska episoder och inga räddningsantiemetiska läkemedel, den primära effektmåttet. Var och en av de tre behandlingsgrupperna visade sig vara statistiskt signifikant överlägsen en historisk placebokontroll.
samma studie upplevde 56 % av patienterna som fick en engångsdos på 24 mg ondansetron inget illamående under den 24 timmar långa försöksperioden, jämfört med 36 % av patienterna i gruppen som fick oral ondansetron 8 mg två gånger om dagen ( P = 0,001) och 50 % i den orala gruppen ondansetron 32 mg en gång om dagen. Dosregimer av ZOFRAN 8 mg två gånger dagligen och 32 mg en gång dagligen rekommenderas inte för att förebygga illamående och kräkningar i samband med starkt emetogen kemoterapi [se DOSERING OCH ADMINISTRERING ].
I en andra studie bekräftades effekten av en oral engångsdos på 24 mg ZOFRAN 4 mg för att förebygga illamående och kräkningar i samband med starkt emetogen cancerkemoterapi, inklusive cisplatin större än eller lika med 50 mg/m².
Måttligt emetogen kemoterapi
En randomiserad, placebokontrollerad, dubbelblind studie genomfördes i USA på 67 patienter som fick en cyklofosfamidbaserad kemoterapiregim innehållande doxorubicin. Den första dosen på 8 mg ZOFRAN 8 mg administrerades 30 minuter före starten av kemoterapin, med en efterföljande dos 8 timmar efter den första dosen, följt av 8 mg ZOFRAN 8 mg två gånger dagligen i 2 dagar efter avslutad kemoterapi. var betydligt effektivare än placebo för att förhindra kräkningar. Behandlingssvaret baserades på det totala antalet emetiska episoder under den tre dagar långa försöksperioden. Resultaten av detta försök sammanfattas i tabell 7.
en dubbelblind amerikansk studie med 336 patienter som fick en cyklofosfamidbaserad kemoterapiregim innehållande antingen metotrexat eller doxorubicin, var ZOFRAN 8 mg administrerat två gånger dagligen lika effektivt som ZOFRAN 8 mg administrerat 3 gånger om dagen för att förebygga illamående och kräkningar. ZOFRAN 8 mg tre gånger dagligen är inte en rekommenderad regim för behandling av måttligt emetogen kemoterapi [se DOSERING OCH ADMINISTRERING ].
Behandlingssvaret baserades på det totala antalet emetiska episoder under den tre dagar långa försöksperioden. Se tabell 8 för detaljer om de studerade doseringsregimerna och resultaten av denna studie.
Ombehandling
I enarmsstudier återbehandlades 148 patienter som fick cyklofosfamidbaserad kemoterapi med ZOFRAN 8 mg tre gånger dagligen under efterföljande kemoterapi för totalt 396 ombehandlingskurer. Inga emetiska episoder inträffade i 314 (79 %) av återbehandlingskurerna, och endast 1 till 2 emetiska episoder inträffade i 43 (11 %) av återbehandlingskurserna.
Pediatriska prövningar
Tre öppna, enarmade, icke-amerikanska studier har utförts med 182 pediatriska patienter i åldern 4 till 18 år med cancer som fick en mängd olika cisplatin- eller noncisplatin-kurer. Den initiala dosen av ZOFRAN 4 mg injektion varierade från 0,04 till 0,87 mg per kg (total dos på 2,16 mg till 12 mg) följt av administrering av orala doser av ZOFRAN 4 mg från 4 till 24 mg dagligen i 3 dagar. I dessa studier hade 58 % av de 170 utvärderbara patienterna ett fullständigt svar (inga kräkningsepisoder) på dag 1. I 2 studier var svarsfrekvensen på ZOFRAN 4 mg tre gånger dagligen hos patienter yngre än 12 år liknande den med ZOFRAN 8 mg tre gånger dagligen hos patienter 12 till 18 år. Förebyggandet av kräkningar hos dessa pediatriska patienter var i stort sett detsamma som för vuxna.
Strålningsinducerad illamående och kräkningar
Total kroppsbestrålning
en randomiserad, placebokontrollerad, dubbelblind studie med 20 patienter, var 8 mg ZOFRAN administrerat 1,5 timmar före varje fraktion av strålbehandling under 4 dagar signifikant effektivare än placebo för att förhindra kräkningar inducerade av strålning från hela kroppen. Total kroppsbestrålning bestod av 11 fraktioner (120 cGy per fraktion) under 4 dagar för totalt 1 320 cGy. Patienterna fick 3 fraktioner under 3 dagar, sedan 2 fraktioner på dag 4.
Enstaka högdosfraktionsstrålbehandling
en aktivt kontrollerad, dubbelblind studie med 105 patienter som fick engångs strålbehandling med hög dos (800 till 1 000 cGy) över en främre eller bakre fältstorlek på större än eller lika med 80 cm² till buken, var ZOFRAN 4 mg signifikant effektivare än metoklopramid med avseende på fullständig kontroll av emes (0 emetiska episoder). Patienterna fick den första dosen av ZOFRAN (8 mg) eller metoklopramid (10 mg) 1 till 2 timmar före strålbehandling. Om strålbehandling gavs på morgonen gavs 8 mg ZOFRAN 8 mg eller 10 mg metoklopramid sent på eftermiddagen och upprepades igen före sänggåendet. Om strålbehandling gavs på eftermiddagen tog patienterna 8 mg ZOFRAN 4 mg eller 10 mg metoklopramid endast en gång före sänggåendet. Patienterna fortsatte med doserna av oral medicin tre gånger dagligen i tre dagar.
Daglig fraktionerad strålbehandling
en aktivt kontrollerad, dubbelblind studie med 135 patienter som fick en 1- till 4-veckors kur av fraktionerad strålbehandling (180 cGy-doser) över en fältstorlek större än eller lika med 100 cm² till buken, var ZOFRAN 4 mg signifikant effektivare än proklorperazin med avseende på fullständig kontroll av emesis (0 emetiska episoder). Patienterna fick den första dosen av ZOFRAN (8 mg) eller proklorperazin (10 mg) 1 till 2 timmar före den första dagliga strålbehandlingsfraktionen, med efterföljande 8 mg doser ungefär var 8:e timme varje dag för strålbehandling.
Postoperativt illamående och kräkningar
2 placebokontrollerade, dubbelblinda prövningar (en utförd i USA och den andra utanför USA) på 865 kvinnor som genomgick kirurgiska ingrepp inom slutenvården, gavs ZOFRAN 16 mg som engångsdos eller placebo en timme före induktionen av allmän balanserad anestesi (barbiturat, opioid, dikväveoxid, neuromuskulär blockad och kompletterande isofluran eller enfluran), ZOFRAN-tabletter var signifikant effektivare än placebo för att förebygga postoperativt illamående och kräkningar.
Inga försök har utförts på män.
PATIENTINFORMATION
QT-förlängning
Informera patienterna om att ZOFRAN kan orsaka allvarliga hjärtarytmier, såsom QT-förlängning. Instruera patienterna att omedelbart berätta för sin vårdgivare om de upplever en förändring i sin hjärtfrekvens, om de känner sig yr i huvudet eller om de har en synkopal episod [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Överkänslighetsreaktioner
Informera patienterna om att ZOFRAN 4 mg kan orsaka överkänslighetsreaktioner, vissa så allvarliga som anafylaxi och bronkospasm. Instruera patienterna att omedelbart rapportera alla tecken och symtom på överkänslighetsreaktioner, inklusive feber, frossa, hudutslag eller andningsproblem till sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Maskering av progressiv ileus och gastrisk utvidgning
Informera patienter efter bukkirurgi eller de som har illamående och kräkningar orsakat av kemoterapi att ZOFRAN 4mg kan maskera tecken och symtom på tarmobstruktion. Instruera patienterna att omedelbart rapportera alla tecken eller symtom som överensstämmer med en potentiell tarmobstruktion till sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Läkemedelsinteraktioner
- Instruera patienten att rapportera användningen av alla mediciner, särskilt apomorfin, till sin vårdgivare. Samtidig användning av apomorfin och ZOFRAN kan orsaka ett signifikant blodtrycksfall och medvetslöshet.
- Informera patienter om risken för serotonergt syndrom vid samtidig användning av ZOFRAN 8 mg och ett annat serotonergt medel, såsom mediciner för att behandla depression och migrän. Rekommendera patienter att omedelbart söka läkarvård om följande symtom uppstår: förändringar i mental status, autonom instabilitet, neuromuskulära symtom med eller utan gastrointestinala symtom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Administrering av ZOFRAN 4mg ODT oralt sönderfallande tabletter
Instruera patienter att inte ta bort ZOFRAN 4 mg ODT oralt sönderfallande tabletter från blisterförpackningen förrän strax före dosering.
- Försök inte trycka ZOFRAN 8mg ODT oralt sönderfallande tabletter genom foliebaksidan.
- Med torra händer, dra av foliebaksidan av 1 blisterförpackning och ta försiktigt bort tabletten.
- Placera omedelbart ZOFRAN ODT oralt sönderfallande tablett ovanpå tungan där den kommer att lösas upp på några sekunder och svälj sedan med saliv.
- Administrering med vätska är inte nödvändig.
- Avdragbara illustrerade klistermärken är fästa på produktkartongen som kan förses med receptet för att säkerställa korrekt användning och hantering av produkten.
