Casodex 50mg Bicalutamide Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Casodex och hur används det?
Casodex är ett receptbelagt läkemedel som används för att behandla symtom på prostatacancer. Casodex 50mg kan användas ensamt eller tillsammans med andra läkemedel.
Casodex 50mg tillhör en klass av läkemedel som kallas Antineoplastics, Antiandrogen; CYP3A4-hämmare, måttlig.
Det är inte känt om Casodex är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Casodex?
Casodex kan orsaka allvarliga biverkningar inklusive:
- bröstsmärtor eller svullnad,
- blod i urinen,
- feber,
- frossa,
- plötslig bröstsmärta eller obehag,
- väsande andning,
- rethosta,
- andnöd,
- blek hud,
- yrsel,
- snabb hjärtfrekvens,
- koncentrationssvårigheter,
- illamående,
- ont i övre magen,
- känner mig trött,
- aptitlöshet,
- mörk urin,
- lerfärgad avföring,
- gulfärgning av huden eller ögonen (gulsot),
- ökad törst,
- ökad urinering,
- hunger,
- torr mun,
- fruktig andedräkt lukt,
- dåsighet,
- torr hud,
- dimsyn och
- viktminskning
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Casodex 50mg inkluderar:
- värmevallningar,
- smärta i ryggen,
- bäckensmärta,
- buksmärtor,
- svullnad i dina händer, vrister eller fötter,
- ökad nattlig urinering,
- svaghet,
- yrsel,
- illamående,
- diarré och
- förstoppning
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Casodex. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
CASODEX® (bicalutamid) tabletter innehåller 50 mg bicalutamid, en icke-steroid androgenreceptorhämmare utan annan känd endokrin aktivitet. Det kemiska namnet är propanamid, N [4-cyano-3-(trifluormetyl)fenyl]-3-[(4-fluorfenyl)sulfonyl]-2-hydroxi-2-metyl-,(+-). De strukturella och empiriska formlerna är:
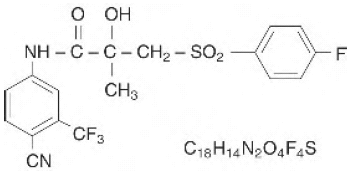
Bicalutamid har en molekylvikt på 430,37. pKa' är cirka 12. Bicalutamid är ett fint vitt till benvitt pulver som är praktiskt taget olösligt i vatten vid 37°C (5 mg per 1000 ml), lätt lösligt i kloroform och absolut etanol, svårlösligt i metanol och lösligt i aceton och tetrahydrofuran.
CASODEX är ett racemat vars antiandrogena aktivitet nästan uteslutande uppvisas av R-enantiomeren av bicalutamid; S-enantiomeren är väsentligen inaktiv.
De inaktiva ingredienserna i CASODEX 50 mg tabletter är laktos, magnesiumstearat, hypromellos, polyetylenglykol, polyvidon, natriumstärkelseglykolat och titandioxid.
INDIKATIONER
CASODEX 50 mg dagligen är indicerat för användning i kombinationsterapi med en luteiniserande hormonfrisättande hormon (LHRH)-analog för behandling av stadium D2 metastatisk prostatakarcinom.
CASODEX 150 mg dagligen är inte godkänt för användning ensam eller tillsammans med andra behandlingar [se Kliniska studier ].
DOSERING OCH ADMINISTRERING
Rekommenderad dos och schema
Den rekommenderade dosen för CASODEX 50 mg-behandling i kombination med en LHRH-analog är en 50 mg tablett en gång dagligen (morgon eller kväll), med eller utan mat. Det rekommenderas att CASODEX 50 mg tas vid samma tidpunkt varje dag. Behandling med CASODEX bör påbörjas samtidigt som behandling med en LHRH-analog. Om en dos av CASODEX 50 mg glöms bort, ta nästa dos vid den schemalagda tiden. Ta inte den missade dosen och dubbla inte nästa dos.
Dosjustering vid nedsatt njurfunktion
Ingen dosjustering är nödvändig för patienter med nedsatt njurfunktion [se Användning i specifika populationer ].
Dosjustering vid nedsatt leverfunktion
Ingen dosjustering är nödvändig för patienter med lätt till måttligt nedsatt leverfunktion. Hos patienter med gravt nedsatt leverfunktion (n=4), även om halveringstiden (5,9 och 10,4 dagar för normala respektive nedsatta patienter) ökade med 76 %, för den aktiva enantiomeren av bicalutamid, är ingen dosjustering nödvändig [ ser Användning i specifika populationer ].
HUR LEVERERAS
Doseringsformer och styrka
CASODEX® (bicalutamid) 50 mg tabletter för oral administrering.
Vita, filmdragerade tabletter (identifierade på ena sidan med "CDX50" och på baksidan med "CASODEX-logotypen") levereras i endosflaskor med 30 tabletter (0310-0705-30).
Förvaring Och Hantering
Förvara i kontrollerad rumstemperatur, 20°-25°C (68°-77°F).
Tillverkad för: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Reviderad: mars 2017.
BIEFFEKTER
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Erfarenhet av kliniska prövningar
Hos patienter med avancerad prostatacancer som behandlats med CASODEX 50 mg i kombination med en LHRH-analog var den vanligaste biverkningen värmevallningar (53 %).
I den multicenter, dubbelblinda, kontrollerade kliniska studien som jämförde CASODEX 50 mg en gång dagligen med flutamid 250 mg tre gånger om dagen, var och en i kombination med en LHRH-analog, följande biverkningar med en incidens på 5 % eller mer, oavsett av kausalitet, har rapporterats.
Andra biverkningar (större än eller lika med 2 %, men mindre än 5 %) rapporterade i CASODEX-LHRH-analogbehandlingsgruppen listas nedan per kroppssystem och är i ordning efter minskande frekvens inom varje kroppssystem oavsett orsakssamband.
Kroppen som helhet: Neoplasma; Nacksmärta; Feber; Frossa; Sepsis; Bråck; Cysta
Kardiovaskulär: Angina pectoris; Hjärtsvikt; Myokardinfarkt; Hjärtstopp; Kranskärlssjukdom; Synkope
Matsmältningskanalen: Melena; Rektal blödning; Torr mun; dysfagi; Gastrointestinala störningar; Parodontal abscess; Gastrointestinala karcinom
Metaboliskt och näringsmässigt: Ödem; BUN ökade; Kreatinin ökar; Uttorkning; Gikt; Hyperkolesteremi
Muskuloskeletala: Muskelvärk; Benkramper
Nervös: hypertoni; Förvirring; Sömnighet; Minskad libido; neuropati; Nervositet
Andningsvägar: Lungsjukdom; Astma; Epistaxis; Bihåleinflammation
Hud och bihang: Torr hud; Alopeci; Klåda; Bältros; Hudkarcinom; Hudstörning
Särskilda sinnen: Katarakt specificerad
Urogenital: Dysuri; Urinaryrgency; Hydronefros; Urinvägsstörning
Onormala laboratorietestvärden:
Laboratorieavvikelser inklusive: förhöjd ASAT, ALAT, bilirubin, BUN och kreatinin; och minskat antal hemoglobin och vita blodkroppar, har rapporterats hos patienter behandlade med både CASODEX-LHRH-analog och flutamid-LHRH-analog.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av CASODEX efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Andningsstörningar: Interstitiell lungsjukdom (vissa dödlig) inklusive interstitiell pneumonit och lungfibros, oftast vid doser högre än 50 mg.
Hud och subkutan vävnad: Ljuskänslighet
LÄKEMEDELSINTERAKTIONER
Kliniska studier har inte visat några läkemedelsinteraktioner mellan bicalutamid och LHRH-analoger (goserelin eller leuprolid). Det finns inga bevis för att bicalutamid inducerar leverenzymer.
In vitro-studier har visat att R-bicalutamid är en hämmare av CYP 3A4 med mindre hämmande effekter på CYP 2C9, 2C19 och 2D6 aktivitet. Kliniska studier har visat att med samtidig administrering av CASODEX kan medelnivåerna av midazolam (ett CYP 3A4-substrat) ökas 1,5 gånger (för Cmax) och 1,9 gånger (för AUC). Därför bör försiktighet iakttas när CASODEX 50 mg administreras samtidigt med CYP 3A4-substrat.
In vitro proteinbindningsstudier har visat att bicalutamid kan ersätta kumarinantikoagulanter från bindningsställen. Protrombintider bör övervakas noggrant hos patienter som redan får kumarinantikoagulantia och som påbörjas med CASODEX 50 mg och justering av antikoagulantiadosen kan vara nödvändig.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Hepatit
Fall av dödsfall eller sjukhusvistelse på grund av allvarlig leverskada (leversvikt) har rapporterats efter marknadsföring i samband med användning av CASODEX. Hepatotoxicitet i dessa rapporter inträffade vanligtvis inom de första tre till fyra månaderna av behandlingen. Hepatit eller markant ökning av leverenzymer som ledde till utsättning av läkemedel förekom hos cirka 1 % av CASODEX-patienterna i kontrollerade kliniska prövningar.
Serumtransaminasnivåer bör mätas innan behandling med CASODEX påbörjas, med regelbundna intervall under de första fyra månaderna av behandlingen och periodiskt därefter. Om kliniska symtom eller tecken som tyder på leverdysfunktion uppträder (t.ex. illamående, kräkningar, buksmärtor, trötthet, anorexi, "influensaliknande" symtom, mörk urin, gulsot eller ömhet i den övre högra kvadranten), serumtransaminaser, särskilt serum ALT, bör mätas omedelbart. Om en patient någon gång har gulsot, eller om deras ALAT stiger över två gånger den övre normalgränsen, ska CASODEX omedelbart avbrytas med noggrann uppföljning av leverfunktionen.
Gynekomasti Och Bröstsmärta
I kliniska prövningar med CASODEX 150 mg som ett enda medel för prostatacancer har gynekomasti och bröstsmärtor rapporterats hos upp till 38 % respektive 39 % av patienterna.
Glukostolerans
En minskning av glukostolerans har observerats hos män som fått LHRH-agonister. Detta kan visa sig som diabetes eller förlust av glykemisk kontroll hos personer med redan existerande diabetes. Man bör därför överväga att övervaka blodsockret hos patienter som får CASODEX 50 mg i kombination med LHRH-agonister.
Laboratorietester
Regelbundna bedömningar av serum prostataspecifikt antigen (PSA) kan vara till hjälp för att övervaka patientens svar. Om PSA-nivåerna stiger under behandling med CASODEX 50 mg, bör patienten utvärderas för klinisk progression. För patienter som har objektiv progression av sjukdomen tillsammans med förhöjd PSA kan en behandlingsfri period av antiandrogen, samtidigt som LHRH-analogen fortsätter, övervägas.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( PATIENTINFORMATION ).
Dos och schema
Informera patienterna om att behandling med CASODEX 50 mg och LHRH-analogen ska påbörjas samtidigt och att de inte ska avbryta eller sluta ta dessa mediciner utan att rådfråga sin vårdgivare [se DOSERING OCH ADMINISTRERING ].
Hepatit
Informera patienterna om att CASODEX kan orsaka hepatit, vilket kan resultera i leversvikt och dödsfall. Informera patienter om att leverfunktionstester bör övervakas regelbundet under behandlingen och att rapportera tecken och symtom på hepatit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Glukostolerans
Informera patienter om att diabetes eller förlust av glykemisk kontroll hos patienter med redan existerande diabetes har rapporterats under behandling med LHRH-agonister. Man bör därför överväga att övervaka blodsockret hos patienter som får CASODEX i kombination med LHRH-agonister [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sömnighet
Under behandling med CASODEX har somnolens rapporterats. Rekommendera patienter som upplever detta symptom att iaktta försiktighet när de kör bil eller använder maskiner [se NEGATIVA REAKTIONER ].
Ljuskänslighet
Informera patienterna om att fall av ljuskänslighet har rapporterats under behandling med CASODEX och att de bör undvika direkt exponering för starkt solljus eller UV-ljus. Man bör överväga användningen av solskyddsmedel [se NEGATIVA REAKTIONER ].
Preventivmedel och fertilitet
Rådgör manliga patienter med kvinnliga partners med reproduktionspotential att använda effektiv preventivmedel under behandlingen och i 130 dagar efter den sista dosen av CASODEX 50 mg-behandling. Informera manliga patienter att CASODEX kan försämra fertiliteten [se Användning i specifika populationer ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Tvååriga orala karcinogenicitetsstudier utfördes på både han- och honråttor och möss i doser på 5, 15 eller 75 mg/kg/dag av bicalutamid. En mängd olika tumörmålorganeffekter identifierades och tillskrevs antiandrogeniciteten hos bicalutamid, nämligen testikulära benigna interstitiella (Leydig) celltumörer hos hanråttor vid alla dosnivåer (steady-state plasmakoncentrationen med 5 mg/kg/dag dosen är cirka 0,7 gånger den mänskliga exponeringen vid den rekommenderade dosen) och uterint adenokarcinom hos honråttor vid 75 mg/kg/dag (ungefär 1,5 gånger den mänskliga exponeringen vid den rekommenderade dosen). Det finns inga tecken på Leydig-cellshyperplasi hos patienter; livmodertumörer är inte relevanta för den indikerade patientpopulationen.
En liten ökning av förekomsten av hepatocellulärt karcinom hos möss av hankön som fått 75 mg/kg/dag av bicalutamid (ungefär 4 gånger den mänskliga exponeringen vid den rekommenderade dosen) och en ökad förekomst av benigna sköldkörtelfollikulära celladenom hos råttor som fått 5 mg/kg /dag (ungefär 0,7 gånger den mänskliga exponeringen vid den rekommenderade dosen) och högre registrerades. Dessa neoplastiska förändringar var progressioner av icke-neoplastiska förändringar relaterade till leverenzyminduktion som observerats i djurtoxicitetsstudier. Enzyminduktion har inte observerats efter administrering av bicalutamid hos människa. Det fanns inga tumörframkallande effekter som tydde på genotoxisk karcinogenes.
En omfattande mängd genotoxicitetstester både in vitro och in vivo (jästgenomvandling, Ames, E. coli, CHO/HGPRT, cytogenetiska cytogenetiska lymfocyter hos människa, musmikronkärna och cytogenetiska tester i benmärg hos råtta) har visat att bicalutamid inte har genotoxisk aktivitet .
toxikologiska studier med upprepad dosering har atrofi av seminiferösa tubuli i testiklarna observerats för alla undersökta arter, vilket är en förutspådd klasseffekt med antiandrogener. I 6- och 12-månadersstudien på råtta sågs testikelatrofi vid ungefär 2 gånger den mänskliga exponeringen vid den rekommenderade dosen. I den 12 månader långa hundstudien sågs incidensen av testikelatrofi vid cirka 7 gånger den mänskliga exponeringen vid den rekommenderade dosen. Hos hanråttor som administrerades 250 mg/kg/dag (ungefär 2 gånger mänsklig exponering vid den rekommenderade dosen), ökade precoitalintervallet och tiden till framgångsrik parning i den första parningen, men inga effekter på fertiliteten efter framgångsrik parning sågs. Dessa effekter upphävdes 7 veckor efter slutet av en 11-veckors doseringsperiod.
Råttor av honkön doserade med 1, 10 och 250 mg/kg/dag (mindre än 2 gånger den mänskliga exponeringen vid den rekommenderade dosen) hade ökad oregelbundenhet i brunstcykeln men det fanns ingen effekt på fertiliteten.
en peri- och postnatal utvecklingsstudie hade kvinnliga avkommor till råttor som fick doser på 10 mg/kg/dag (ungefär 0,7 gånger den mänskliga exponeringen vid den rekommenderade kliniska dosen) och högre minskade dräktighetsfrekvenser. Administrering av bicalutamid till gravida kvinnor resulterade i feminisering av den manliga avkomman, vilket ledde till hypospadi vid doser på 10 mg/kg/dag (ungefär 0,7 gånger den mänskliga exponeringen vid den rekommenderade dosen) och högre. Drabbade manliga avkommor var också impotenta.
Användning i specifika populationer
Graviditet
Risksammanfattning
CASODEX är kontraindicerat för användning till gravida kvinnor eftersom det kan orsaka fosterskador. CASODEX 50mg är inte indicerat för användning till kvinnor. Det finns inga humandata om användning av CASODEX 50 mg hos gravida kvinnor. I reproduktionsstudier på djur orsakade oral administrering av bicalutamid till dräktiga råttor under organogenesen onormal utveckling av reproduktionsorgan hos hanfoster vid exponeringar som var ungefär 0,7 till 2 gånger den mänskliga exponeringen vid den rekommenderade dosen (se Data ).
Data
Djurdata
en embryo-fosterutvecklingsstudie på dräktiga råttor som doserats under organogenesperioden från dräktighetsdagarna 6-15, hade foster av hankön minskat anogenitalt avstånd vid doser på 10 mg/kg/dag och högre (ungefär 0,7 till 2 gånger den mänskliga exponeringen vid rekommenderad dos).
I en pre- och postnatal utvecklingsstudie doserades honråttor från dräktighetsdag 7-16 och fick skräpa ner och fostra sin avkomma till avvänjning . Manliga avkommor till råttor som fick doser på 10 mg/kg/dag (ungefär 0,7 gånger den mänskliga exponeringen vid den rekommenderade dosen) och över, observerades ha minskat anogenitalt avstånd.
en peri- och postnatal utvecklingsstudie doserades honråttor från dräktighetsdag 16 till laktationsdag 22 och fick skräpa och fostra sin avkomma till avvänjning. Överlevnad och vikt hos avkommor under laktation reducerades för kullar från maternala råttor som fick doser på 250 mg/kg/dag (ungefär 2 gånger den mänskliga exponeringen vid den rekommenderade dosen). Manliga avkommor till råttor som fick doser på 10 mg/kg/dag (ungefär 0,7 gånger den mänskliga exponeringen vid den rekommenderade dosen) och över, observerades ha minskat anogenitalt avstånd, mindre sekundära könsorgan, kryptorkism och hypospadi vilket resulterade i oförmåga att para sig. och impregnera sina kvinnliga partners. Kvinnliga avkommor till råttor som fick doser på 10 mg/kg/dag (ungefär 0,7 gånger den mänskliga exponeringen vid den rekommenderade dosen) och högre hade minskade dräktighetsfrekvenser.
Laktation
Risksammanfattning
CASODEX 50mg är inte indicerat för användning hos gravida kvinnor. Det finns ingen tillgänglig information om förekomsten av bicalutamid i bröstmjölk, eller om effekterna på det ammade barnet eller på mjölkproduktionen. Bicalutamid har påvisats i råttmjölk.
Kvinnor Och Hanar Av Reproduktionspotential
Preventivmedel
Män
Antiandrogenterapi kan orsaka morfologiska förändringar i spermier [se Icke-klinisk toxikologi ]. Baserat på resultat i reproduktionsstudier på djur och dess verkningsmekanism, råd manliga patienter med kvinnliga partners med reproduktionspotential att använda effektiv preventivmetod under behandlingen och i 130 dagar efter den sista dosen av CASODEX [se Graviditet och KLINISK FARMAKOLOGI ].
Infertilitet
Män

Baserat på djurstudier kan CASODEX 50 mg leda till hämning av spermatogenes och kan försämra fertiliteten hos män med reproduktionspotential. Långtidseffekterna av CASODEX 50 mg på manlig fertilitet har inte studerats [se Icke-klinisk toxikologi ].
Pediatrisk användning
Säkerheten och effektiviteten av CASODEX 50 mg hos pediatriska patienter har inte fastställts.
CASODEX (bicalutamid) munsönderfallande tablett studerades i kombination med ARIMIDEX (anastrozol) munsönderfallande tablett i en öppen, icke-jämförande multicenterstudie som utvärderade effekten och säkerheten av denna kombinationsbehandling under 12 månader vid behandling av gonadotropinoberoende tidig pubertet hos pojkar med familjär manlig begränsad tidig pubertet, även känd som testotoxicos. Patienter inkluderades i studien om de hade en utgångsålder ≥2 år och en diagnos av testotoxicos baserad på kliniska kännetecken av progressiv tidig pubertet, symmetrisk testikelförstoring, framskriden benålder, pubertala nivåer av serumtestosteron, prepubertala mönster av gonadotropinsekretion efter en GnRH-stimuleringstest och frånvaro av andra kliniska och biokemiska orsaker till testosteronöverskott. Tretton av de 14 inskrivna patienterna fullföljde 12 månaders kombinationsbehandling (en patient gick förlorad för uppföljning). Om central brådmogen pubertet (CPP) utvecklades skulle en LHRH-analog läggas till. Fyra patienter diagnostiserades med CPP under den 12-månadersstudien och fick LHRH-analogbehandling och ytterligare 2 patienter diagnostiserades i slutet av de 12 månaderna och fick behandling därefter. Medel ± SD karakteristika vid baslinjen var följande: kronologisk ålder: 3,9±1,9 år; benålder 8,8±2,5; benålder/kronologisk åldersförhållande: 2,06±0,51; tillväxthastighet (cm/år): 10,81±4,22; tillväxthastighet standardavvikelsepoäng (SDS): 0,41±1,36.
Startdosen CASODEX var 12,5 mg. CASODEX titrerades hos varje patient tills steady-state R-bicalutamid (den aktiva isomeren av bicalutamid) dalplasmakoncentrationen nådde 5-15 mcg/ml, vilket är intervallet för terapeutiska koncentrationer som uppnås hos vuxna med prostatacancer efter administrering av den nuvarande godkänd CASODEX dos på 50 mg. Den dagliga startdosen av anastrozol var 0,5 mg. Anastrozol titrerades oberoende av varje patient tills det vid steady-state nådde en serumkoncentration av östradiol på
Studiens primära effektanalys var att bedöma förändringen i tillväxthastighet efter 12 månaders behandling, i förhållande till tillväxthastigheten under ≥6 månader innan studien påbörjades. Förstudietillväxthastigheter erhölls retrospektivt. Det fanns inga statistiska bevis för att tillväxthastigheten minskade under behandlingen. Under CASODEX/ARIMIDEX-behandling minskade medeltillväxthastigheten (cm/år) med 1,6 cm/år, 95 % KI (-4,7 till 1,5) p=0,28; medeltillväxthastigheten SDS minskade med 0,1 SD, 95 % KI (–1,2 till 1,0) p=0,88. Tabell 2 visar beskrivande data för tillväxthastigheter för den totala populationen och för undergrupper definierade av historia av tidigare behandling för testotoxicos med ketokonazol, spironolakton, anastrozol eller andra aromatashämmare.
Totala testosteronkoncentrationer ökade med i genomsnitt 5 mmol/L under de 12 månaderna av behandling från ett baseline-medelvärde på 10 mmol/L. Estradiolkoncentrationerna var på eller under kvantifieringsnivån (9,81 pmol/L) för 11 av 12 patienter efter 12 månaders behandling. Sex av de 12 patienterna påbörjade behandling med en östradiolkoncentration under kvantifieringsnivån.
Det förekom inga dödsfall, allvarliga biverkningar eller avbrott på grund av biverkningar under studien. Av de 14 patienter som exponerades för studiebehandling upplevde 13 (92,9%) minst en biverkning. De vanligast rapporterade (>3 patienter) biverkningarna var gynekomasti (7/14, 50 %), central tidig pubertet (6/14, 43 %), kräkningar (5/14, 36 %), huvudvärk (3/14, 21 %), pyrexi (3/14, 21 %) och övre luftvägsinfektion (3/14, 21 %). Biverkningar som av utredarna ansågs vara möjliga relaterade till bicalutamid inkluderade gynekomasti (6/14, 43 %), central tidig pubertet (2/14, 14 %), ömhet i brösten (2/14, 14 %), bröstsmärtor (1/14, 7 %), asteni (1/14, 7 %), ökat alaninaminotransferas [ALT] (1/14, 7 %), ökat aspartataminotransferas [AST] (1/14, 7 %) och muskel- och skelettsmärtor i bröstet (1 /14, 7 %). Huvudvärk var den enda biverkning som utredarna ansåg vara möjligen relaterad till anastrozol. För patienten som utvecklade förhöjt ALAT och ASAT var förhöjningen
Geriatrisk användning
två studier på patienter som gavs 50 eller 150 mg dagligen har inget signifikant samband mellan ålder och steady-state nivåer av total bicalutamid eller den aktiva R-enantiomeren visats.
Nedsatt leverfunktion
CASODEX ska användas med försiktighet till patienter med måttligt till gravt nedsatt leverfunktion. CASODEX metaboliseras i stor utsträckning av levern. Begränsade data från patienter med gravt nedsatt leverfunktion tyder på att utsöndringen av CASODEX kan försenas och kan leda till ytterligare ackumulering. Periodiska leverfunktionstester bör övervägas för patienter med nedsatt leverfunktion under långtidsbehandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Ingen kliniskt signifikant skillnad i farmakokinetiken för någon av enantiomererna av bicalutamid noterades hos patienter med mild till måttlig leversjukdom jämfört med friska kontroller. Halveringstiden för R-enantiomeren ökade dock med cirka 76 % (5,9 och 10,4 dagar för normala respektive nedsatta patienter) hos patienter med allvarlig leversjukdom (n=4).
Nedsatt njurfunktion
Nedsatt njurfunktion (mätt som kreatininclearance) hade ingen signifikant effekt på elimineringen av total bicalutamid eller den aktiva R-enantiomeren.
ÖVERDOS
Långtidsstudier har utförts med doser upp till 200 mg CASODEX 50 mg dagligen och dessa doser har tolererats väl. En engångsdos av CASODEX 50 mg som resulterar i symtom på en överdos som anses vara livshotande har inte fastställts.
Det finns inget specifikt motgift; behandling av en överdos bör vara symtomatisk.
Vid hantering av en överdos med CASODEX 50 mg kan kräkningar framkallas om patienten är alert. Man bör komma ihåg att i denna patientpopulation kan flera läkemedel ha tagits. Dialys kommer sannolikt inte att vara till hjälp eftersom CASODEX är starkt proteinbundet och metaboliseras i stor utsträckning. Allmän stödjande vård, inklusive frekvent övervakning av vitala tecken och noggrann observation av patienten, är indicerat.
KONTRAINDIKATIONER
Casodex är kontraindicerat i:
Överkänslighet
CASODEX 50mg är kontraindicerat för alla patienter som har visat en överkänslighetsreaktion mot läkemedlet eller någon av tablettens komponenter. Överkänslighetsreaktioner inklusive angioneurotiskt ödem och urtikaria har rapporterats.
Kvinnor
CASODEX 50mg har ingen indikation för kvinnor och bör inte användas i denna population.
Graviditet
CASODEX 50mg kan orsaka fosterskador när det administreras till en gravid kvinna [se Användning i specifika populationer ].
KLINISK FARMAKOLOGI
Handlingsmekanism
CASODEX 50mg är en icke-steroid androgenreceptorhämmare. Det hämmar konkurrenskraftigt verkan av androgener genom att binda till cytosol androgenreceptorer i målvävnaden. Prostatakarcinom är känt för att vara androgenkänsligt och svarar på behandling som motverkar effekten av androgen och/eller tar bort androgenkällan.
När CASODEX 50mg kombineras med LHRH-analogterapi, påverkas inte hämningen av serumtestosteron som induceras av LHRH-analogen. I kliniska prövningar med CASODEX som ett enda medel för prostatacancer har dock en ökning av serumtestosteron och östradiol noterats.
Hos en undergrupp av patienter som har behandlats med CASODEX och en LHRH-agonist, och som avbryter behandlingen med CASODEX 50 mg på grund av progressiv avancerad prostatacancer, kan en minskning av prostataspecifikt antigen (PSA) och/eller klinisk förbättring (fenomenet med antiandrogenabstinenser) vara observerade.
Farmakokinetik
Absorption
Bicalutamid absorberas väl efter oral administrering, även om den absoluta biotillgängligheten är okänd. Samtidig administrering av bicalutamid med mat har ingen kliniskt signifikant effekt på absorptionshastigheten eller graden av absorption.
Distribution
Bicalutamid är starkt proteinbundet (96%) [se LÄKEMEDELSINTERAKTIONER ].
Metabolism/Eliminering
Bicalutamid genomgår stereospecifik metabolism. Den S (inaktiva) isomeren metaboliseras primärt genom glukuronidering. Den R (aktiva) isomeren genomgår också glukuronidering men oxideras huvudsakligen till en inaktiv metabolit följt av glukuronidering. Både moder- och metaboliten glukuronider elimineras i urin och avföring. S-enantiomeren rensas snabbt i förhållande till R-enantiomeren, varvid R-enantiomeren står för cirka 99 % av de totala steady-state plasmanivåerna.
Farmakokinetiken för den aktiva enantiomeren av CASODEX 50 mg hos normala män och patienter med prostatacancer presenteras i Tabell 3.
Kliniska studier
CASODEX 50 mg dagligen i kombination med en LHRH-A
en multicenter, dubbelblind, kontrollerad klinisk prövning randomiserades 813 patienter med tidigare obehandlad avancerad prostatacancer till att få CASODEX 50 mg en gång dagligen (404 patienter) eller flutamid 250 mg (409 patienter) tre gånger om dagen, var och en i kombination med LHRH-analoger (antingen goserelinacetatimplantat eller leuprolidacetatdepå).
I en analys som utfördes efter att en medianuppföljning på 160 veckor uppnåtts, hade 213 (52,7 %) patienter som behandlats med CASODEX-LHRH analog terapi och 235 (57,5 %) patienter som behandlats med flutamid-LHRH analog terapi dött. Det fanns ingen signifikant skillnad i överlevnad mellan behandlingsgrupperna (se figur 1). Hazard ratio för tid till död (överlevnad) var 0,87 (95 % konfidensintervall 0,72 till 1,05).
Figur 1 - Kaplan-Meier-sannolikheten för död för båda antiandrogenbehandlingsgrupperna. 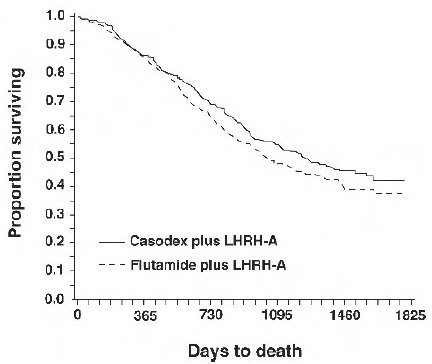
Det fanns ingen signifikant skillnad i tid till objektiv tumörprogression mellan behandlingsgrupperna (se figur 2). Objektiv tumörprogression definierades som uppkomsten av eventuella benmetastaser eller försämring av befintliga benmetastaser vid benskanning som kan tillskrivas metastaserande sjukdom, eller en ökning med 25 % eller mer av eventuella existerande mätbara extraskelettmetastaser. Riskkvoten för tid till progression av CASODEX plus LHRH-analog till den för flutamid plus LHRH-analog var 0,93 (95 % konfidensintervall, 0,79 till 1,10).
Figur 2 - Kaplan-Meier-kurva för tid till progression för båda antiandrogenbehandlingsgrupperna. 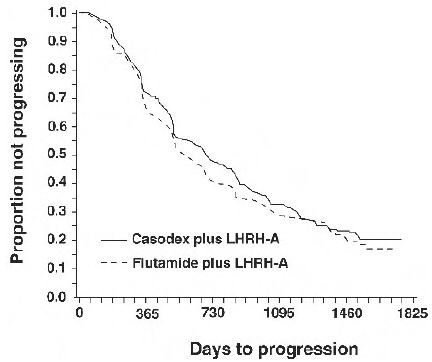
Livskvalitet utvärderades med patientenkäter på egen hand om smärta, social funktion, känslomässigt välbefinnande, vitalitet, aktivitetsbegränsning, sänghandikapp, allmän hälsa, fysisk kapacitet, allmänna symtom och behandlingsrelaterade symtom. Bedömning av frågeformulären för livskvalitet indikerade inte konsekventa signifikanta skillnader mellan de två behandlingsgrupperna.
Säkerhetsdata från kliniska studier med CASODEX 150 mg
CASODEX 150 mg är inte godkänt för användning vare sig ensamt eller tillsammans med andra behandlingar.
Två identiska multicenter, randomiserade, öppna studier som jämförde CASODEX 150 mg daglig monoterapi med kastrering utfördes på patienter som hade lokalt avancerad (T3-4, NX, M0) eller metastaserad (M1) prostatacancer.
Monoterapi – M1 Grupp
CASODEX 150 mg dagligen är inte godkänd för användning hos patienter med M1 cancer i prostata. Baserat på en interimsanalys av de två prövningarna för överlevnad, rekommenderade Data Safety Monitoring Board att CASODEX-behandlingen skulle avbrytas hos M1-patienterna eftersom risken för död var 25 % (HR 1,25, 95 % CI 0,87 till 1,81) och 31 % ( HR 1,31, 95 % CI 0,97 till 1,77) högre i den CASODEX 50 mg-behandlade gruppen jämfört med den i den kastrerade gruppen.
Lokalt avancerad (T3-4, NX, M0) grupp
CASODEX 150 mg dagligen är inte godkänd för användning hos patienter med lokalt avancerad (T3-4, NX, M0) cancer i prostata. Efter avbrytande av alla M1-patienter fortsatte prövningarna med T3-4, NX, M0-patienter tills studien avslutades. I den större studien (N=352) var risken för död 25 % (HR 1,25, 95 % CI 0,92 till 1,71) högre i CASODEX-gruppen och i den mindre studien (N=140) var risken för död 36 % (HR 0,64, 95 % CI, 0,39 till 1,03) lägre i gruppen CASODEX 50 mg.
Utöver ovanstående två studier finns det tre andra pågående kliniska studier som ger ytterligare säkerhetsinformation för CASODEX 150 mg, en dos som inte är godkänd för användning. Dessa är tre multicenter, randomiserade, dubbelblinda, parallella gruppstudier som jämför CASODEX 150 mg daglig monoterapi (adjuvans till tidigare behandling eller under vaksam väntan) med placebo, för död eller tid till sjukdomsprogression, i en population på 8113 patienter med lokaliserad eller lokalt avancerad prostatacancer.
CASODEX 150 mg dagligen är inte godkänd för användning som terapi för patienter med lokaliserad prostatacancer som är kandidater för vaksam väntan. Data från en planerad undergruppsanalys av två av dessa prövningar på 1627 patienter med lokaliserad prostatacancer som var under vaksam väntan, avslöjade en trend mot minskad överlevnad i CASODEX-armen efter en medianuppföljning på 7,4 år. Det var 294 (37,7 %) dödsfall hos de CASODEX-behandlade patienterna jämfört med 279 (32,9 %) dödsfall i de placebobehandlade patienterna (lokaliserad vaksam väntande grupp) för en riskkvot på 1,16 (95 % KI 0,99 till 1,37).
PATIENTINFORMATION
CASODEX® [cas–o–dex] (bicalutamid) Tablett
Läs denna patientinformation innan du börjar ta CASODEX 50 mg och varje gång du får påfyllning. Det kan komma ny information. Denna broschyr ersätter inte att prata med din vårdgivare om ditt medicinska tillstånd eller din behandling.
Vad är CASODEX 50mg?
CASODEX är ett receptbelagt läkemedel som kallas androgenreceptorhämmare, som används i kombination med luteiniserande hormonfrisättande hormon (LHRH) för att behandla metastaserande prostatacancer i stadium D2.
CASODEX är inte avsett för kvinnor.
Det är inte känt om CASODEX är säkert och effektivt för barn.
Vem bör inte ta CASODEX 50mg?
Ta inte CASODEX 50 mg om du:
- är en kvinna.
- är gravid eller kan bli gravid. CASODEX kan skada ditt ofödda barn.
- är allergiska mot något av innehållsämnena i CASODEX. Se slutet av denna bipacksedel för en komplett lista över ingredienser i CASODEX. Få medicinsk hjälp omedelbart om du får något av följande symtom på en allergisk reaktion: klåda, nässelfeber (upphöjda knölar), svullnad av ansikte, läppar eller tunga, problem med att andas eller svälja.
Vad ska jag berätta för min vårdgivare innan jag tar CASODEX?
Innan du tar CASODEX 50mg, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har leverproblem.
- ta ett läkemedel för att tunna ut ditt blod. Fråga din vårdgivare eller apotekspersonal om du inte är säker på om din medicin är blodförtunnande.
- har diabetes (dålig blodsockerkontroll har rapporterats hos personer som tar CASODEX i kombination med LHRH-läkemedel).
- har en partner som är gravid eller kan bli gravid. Du bör använda effektiva preventivmetoder medan du tar CASODEX 50 mg och i 130 dagar efter att du avslutat CASODEX. Tala med din läkare om du har några frågor om preventivmedel.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott. CASODEX 50mg och andra läkemedel kan påverka varandra och orsaka biverkningar. CASODEX kan påverka hur andra läkemedel fungerar, och andra läkemedel kan påverka hur CASODEX 50 mg fungerar.
Vet vilka mediciner du tar. Håll en lista över dina mediciner med dig för att visa dina vårdgivare när du får ett nytt läkemedel.
Hur ska jag ta CASODEX 50mg?
- Ta CASODEX exakt som din läkare säger åt dig att ta det.
- Ta CASODEX vid samma tidpunkt varje dag.
- Din behandling med CASODEX 50 mg bör starta samtidigt som din behandling med LHRH-läkemedlet.
- Om du missar en dos, ta inte en extra dos, ta nästa dos vid din vanliga tidpunkt. Ta inte 2 doser samtidigt.
- CASODEX 50 mg kan tas med eller utan mat.
- Om du tar för mycket CASODEX, ring din vårdgivare eller Giftinformationscentralen eller gå till närmaste akutmottagning direkt.
- Sluta inte ta CASODEX om inte din läkare säger till dig det.
- Din vårdgivare kan ta blodprov medan du tar CASODEX.
- Din prostatacancer kan förvärras när du tar CASODEX i kombination med LHRH-läkemedel.
Regelbunden övervakning av din prostatacancer med din vårdgivare är viktig för att avgöra om din sjukdom är värre.
Vad ska jag undvika när jag tar CASODEX 50mg?
Kör inte bil, använd inte maskiner eller gör andra farliga aktiviteter förrän du vet hur CASODEX påverkar dig.
Vissa personer har haft hudens känslighet för solljus när de tagit CASODEX. Du bör undvika solljus eller sollampor och solarier och överväga att använda solskyddsmedel medan du behandlas med CASODEX.
Vilka är de möjliga biverkningarna av CASODEX 50mg?
CASODEX kan orsaka allvarliga biverkningar, inklusive:
- Leverproblem, inklusive leversvikt som kan behöva behandlas på sjukhus eller som kan leda till döden. Din läkare bör ta blodprover för att kontrollera din leverfunktion före och under behandlingen med CASODEX. Berätta omedelbart för din vårdgivare om du får något av dessa symtom på leverproblem under behandlingen:
- gulfärgning av hud och ögon (gulsot)
- mörk urin
- höger övre magsmärta
- illamående
- kräkningar
- trötthet
- aptitlöshet
- frossa
- feber
- Andningssvårigheter med eller utan hosta eller feber. Vissa personer som tar CASODEX 50 mg får en inflammation i lungorna som kallas interstitiell lungsjukdom.
- En allergisk reaktion. Symtom på en allergisk reaktion inkluderar: klåda i huden, nässelfeber (upphöjda knölar), svullnad av ansikte, läppar, tunga, svalg eller problem med att svälja.
- Bröstförstoring (gynekomasti) och bröstsmärtor.
- Dålig blodsockerkontroll kan inträffa hos personer som tar CASODEX 50 mg i kombination med LHRH-läkemedel. Din vårdgivare kan kontrollera ditt blodsocker under behandlingen med CASODEX 50 mg.
De vanligaste biverkningarna av CASODEX 50mg inkluderar:
- värmevallningar eller korta perioder av värmekänsla och svettning
- smärta i hela kroppen i ryggen, bäckenet, magen
- känner sig svag
- förstoppning
- infektion
- illamående
- svullnad i vrister, ben eller fötter
- diarre
- blod i urinen
- vakna från sömnen för att kissa på natten
- en minskning av röda blodkroppar (anemi)
- känner sig yr
Berätta för din vårdgivare om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av CASODEX. För mer information, fråga din vårdgivare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Hur ska jag förvara CASODEX?
Förvara CASODEX i rumstemperatur mellan 68°F till 77°F (20°C till 25°C).
Förvara CASODEX 50mg och alla läkemedel utom räckhåll för barn.
Allmän information om säker och effektiv användning av CASODEX.
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte CASODEX för ett tillstånd som det inte har ordinerats för. Ge inte CASODEX 50 mg till andra personer, även om de har samma symtom som du har. Det kan skada dem.
Denna patientinformationsbroschyr sammanfattar den viktigaste informationen om CASODEX. Om du vill ha mer information om CASODEX, prata med din vårdgivare. Du kan fråga din vårdgivare eller apotekspersonal om information om CASODEX som är skriven för vårdpersonal. För mer information gå till www.CASODEX.com eller ring 1-800-236-9933.
Vilka är ingredienserna i CASODEX 50mg?
Aktiv beståndsdel: bikalutamid.
Inaktiva Ingredienser: laktos, magnesiumstearat, hypromellos, polyetylenglykol, polyvidon, natriumstärkelseglykolat, titandioxid.
Denna patientinformation har godkänts av US Food and Drug Administration.
