Leukeran 2mg, 5mg Chlorambucil Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Leukeran 5mg och hur används det?
Leukeran 5mg är ett receptbelagt läkemedel som används för att behandla symptomen på kronisk lymfatisk (lymfocytisk) leukemi och Hodgkins lymfom. Leukeran 5mg kan användas ensamt eller tillsammans med andra läkemedel.
Leukeran 5mg tillhör en klass av läkemedel som kallas antineoplastiska, alkylerande.
Det är inte känt om Leukeran är säkert och effektivt hos barn.
Vilka är de möjliga biverkningarna av Leukeran?
Leukeran kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- anfall,
- ovanlig massa eller klump,
- svåra kräkningar eller diarré,
- ny eller förvärrad hosta,
- lätt att få blåmärken,
- ovanlig blödning (näsa, mun, slida eller ändtarm),
- lila eller röda spetsiga fläckar under huden,
- illamående,
- ont i övre magen,
- klåda,
- trötthet,
- aptitlöshet,
- mörk urin,
- lerfärgad avföring,
- gulfärgning av huden eller ögonen (gulsot),
- feber,
- svullna tandkött,
- smärtsamma munsår,
- smärta vid sväljning,
- hudsår,
- symtom för förkylning eller influensa,
- hosta,
- problem att andas,
- öm hals,
- hudsmärta och
- ett rött eller lila hudutslag som sprider sig (särskilt i ansiktet eller överkroppen) och orsakar blåsor och fjällning
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Leukeran inkluderar:
- feber,
- blödning och
- influensasymptom
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Leukeran. För mer information, fråga din läkare eller apotekspersonal.
VARNING
LEUKERAN (klorambucil) kan allvarligt undertrycka benmärgsfunktionen. Klorambucil är ett cancerframkallande ämne hos människor. Klorambucil är troligen mutagent och teratogent hos människor. Klorambucil producerar mänsklig infertilitet (se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ).
BESKRIVNING
LEUKERAN (klorambucil) syntetiserades först av Everett et al. Det är ett bifunktionellt alkyleringsmedel av typen kvävesenap som har visat sig vara aktivt mot utvalda humana neoplastiska sjukdomar. Klorambucil är kemiskt känt som 4-[bis(2-kloretyl)amino]bensenbutansyra och har följande strukturformel:
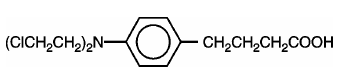
Klorambucil hydrolyserar i vatten och har ett pKa på 5,8.
LEUKERAN (klorambucil) finns i tablettform för oral administrering. Varje filmdragerad tablett innehåller 2 mg klorambucil och de inaktiva ingredienserna kolloidal kiseldioxid, hypromellos, laktos (vattenfri), makrogol/PEG 400, mikrokristallin cellulosa, röd järnoxid, stearinsyra, titandioxid och gul järnoxid.
INDIKATIONER
LEUKERAN (klorambucil) är indicerat för behandling av kronisk lymfatisk (lymfocytisk) leukemi, maligna lymfom inklusive lymfosarkom, jättefollikulärt lymfom och Hodgkins sjukdom. Det är inte botande vid någon av dessa sjukdomar men kan ge kliniskt användbar palliation.
DOSERING OCH ADMINISTRERING
Den vanliga orala dosen är 0,1 till 0,2 mg/kg kroppsvikt dagligen i 3 till 6 veckor efter behov. Detta uppgår vanligtvis till 4 till 10 mg per dag för den genomsnittliga patienten. Hela dagliga dosen kan ges på en gång. Dessa doser är avsedda för initiering av terapi eller för korta behandlingskurer. Dosen måste justeras noggrant efter patientens svar och måste minskas så snart det sker ett abrupt fall i antalet vita blodkroppar. Patienter med Hodgkins sjukdom kräver vanligtvis 0,2 mg/kg dagligen, medan patienter med andra lymfom eller kronisk lymfatisk leukemi vanligtvis endast behöver 0,1 mg/kg dagligen. När lymfocytisk infiltration av benmärgen förekommer, eller när benmärgen är hypoplastisk, bör den dagliga dosen inte överstiga 0,1 mg/kg (cirka 6 mg för genomsnittspatienten).
Alternativa scheman för behandling av kronisk lymfatisk leukemi med användning av intermittenta, varannan vecka eller en gång i månaden pulsdoser av klorambucil har rapporterats. Intermittenta scheman för klorambucil börjar med en initial enkeldos på 0,4 mg/kg. Doserna ökas i allmänhet med 0,1 mg/kg tills kontroll av lymfocytos eller toxicitet observeras. Efterföljande doser modifieras för att ge mild hematologisk toxicitet. Det anses att svarsfrekvensen för kronisk lymfatisk leukemi på schemat för administrering av klorambucil varannan vecka eller en gång i månaden är liknande eller bättre som den som tidigare rapporterats vid daglig administrering och att den hematologiska toxiciteten var mindre än eller lika med den som påträffades i studier med daglig klorambucil. .
Strålning och cellgifter gör benmärgen mer sårbar för skador, och klorambucil bör användas med särskild försiktighet inom 4 veckor efter en hel kur med strålbehandling eller kemoterapi. Små doser av palliativ strålning över isolerade härdar på avstånd från benmärgen kommer dock vanligtvis inte att sänka antalet neutrofiler och trombocyter. I dessa fall kan klorambucil ges i den vanliga dosen.
Det anses för närvarande att korta behandlingskurer är säkrare än kontinuerlig underhållsbehandling, även om båda metoderna har varit effektiva. Det måste inses att kontinuerlig terapi kan ge sken av "underhåll" hos patienter som faktiskt är i remission och inte har något omedelbart behov av ytterligare läkemedel. Om underhållsdosering används bör den inte överstiga 0,1 mg/kg dagligen och kan mycket väl vara så låg som 0,03 mg/kg dagligen. En typisk underhållsdos är 2 mg till 4 mg dagligen, eller mindre, beroende på status för blodvärdena. Det kan därför vara önskvärt att dra ut läkemedlet efter att maximal kontroll har uppnåtts, eftersom intermittent behandling som återupptas vid tidpunkten för återfall kan vara lika effektiv som kontinuerlig behandling.
Rutiner för korrekt hantering och kassering av läkemedel mot cancer bör användas. Flera riktlinjer i detta ämne har publicerats.1-4 Det finns ingen allmän enighet om att alla de procedurer som rekommenderas i riktlinjerna är nödvändiga eller lämpliga.
Särskilda populationer
Nedsatt leverfunktion
Patienter med nedsatt leverfunktion bör övervakas noggrant med avseende på toxicitet. Eftersom klorambucil huvudsakligen metaboliseras i levern, kan dosreduktion övervägas hos patienter med nedsatt leverfunktion när de behandlas med LEUKERAN. Det finns dock otillräckliga data från patienter med nedsatt leverfunktion för att ge en specifik doseringsrekommendation.
HUR LEVERERAS
LEUKERAN levereras som bruna, filmdragerade, runda, bikonvexa tabletter innehållande 2 mg klorambucil i bärnstensfärgade glasflaskor med barnsäker förslutning. Ena sidan är graverad med "GX EG3" och den andra sidan är graverad med ett "L."
Flaska med 25 ( NDC 76388-635-25)
Förvaras i kylskåp, 2° till 8°C (36° till 46°F).
REFERENSER
1. NIOSH Alert: Förhindrar yrkesmässig exponering för antineoplastiska och andra farliga läkemedel i hälsovårdsmiljöer. 2004. US Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH) publikation nr 2004-165.
2. OSHA Technical Manual, TED 1-0.15A, Avsnitt VI: Kapitel 2. Kontroll av yrkesexponering för farliga droger. OSHA, 1999. http://www.osha.gov/dts/osta/otm/otm_vi/otm_vi_2.html
3. American Society of Health-System Pharmacists. ASHP:s riktlinjer för hantering av farliga läkemedel. Am J Health-Syst Pharm. (2006) 63:1172-1193.
4. Polovich, M., White, JM, & Kelleher, LO (red.) 2005. Chemotherapy and biotherapy guidelines and rekommendations for practice (2nd. ed.) Pittsburgh, PA: Oncology Nursing Society.
Tillverkad av: Excella GmbH & Co. KG, Feucht, Tyskland. Reviderad: mars 2017
BIEFFEKTER
För att rapportera MISSTÄNKTA BIVERKNINGAR, kontakta Aspen Global Inc. avgiftsfritt på 1-855-800-8165 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
Hematologiska
Den vanligaste biverkningen är benmärgsdämpning, anemi, leukopeni, neutropeni, trombocytopeni eller pancytopeni. Även om benmärgssuppression ofta förekommer, är det vanligtvis reversibelt om klorambucilen dras ut tillräckligt tidigt. Däremot har irreversibel benmärgssvikt rapporterats.
Gastrointestinala
Gastrointestinala störningar som illamående och kräkningar, diarré och munsår förekommer sällan.
CNS
Skakningar, muskelryckningar, myokloni, förvirring, agitation, ataxi, slappa pareser och hallucinationer har rapporterats som sällsynta biverkningar för klorambucil som försvinner vid utsättande av läkemedlet. Sällsynta, fokala och/eller generaliserade anfall har rapporterats förekomma hos både barn och vuxna vid både terapeutiska dagliga doser och pulsdoseringsregimer och vid akut överdosering (se FÖRSIKTIGHETSÅTGÄRDER : Allmän ).
Dermatologiskt
Allergiska reaktioner såsom urtikaria och angioneurotiskt ödem har rapporterats efter initial eller efterföljande dosering. Hudöverkänslighet (inklusive sällsynta rapporter om hudutslag som utvecklats till erythema multiforme, toxisk epidermal nekrolys och Stevens-Johnsons syndrom) har rapporterats (se VARNINGAR ).
Diverse
Andra rapporterade biverkningar inkluderar: lungfibros, levertoxicitet och gulsot, läkemedelsfeber, perifer neuropati, interstitiell pneumoni, steril cystit, infertilitet, leukemi och sekundära maligniteter (se VARNINGAR ).

LÄKEMEDELSINTERAKTIONER
Det finns inga kända läkemedels-/läkemedelsinteraktioner med klorambucil.
VARNINGAR
På grund av dess karcinogena egenskaper bör klorambucil inte ges till patienter med andra tillstånd än kronisk lymfatisk leukemi eller maligna lymfom. Kramper, infertilitet, leukemi och sekundära maligniteter har observerats när klorambucil användes vid behandling av maligna och icke-maligna sjukdomar.
Det finns många rapporter om akut leukemi hos patienter med både maligna och icke-maligna sjukdomar efter behandling med klorambucil. I många fall fick dessa patienter även andra kemoterapeutiska medel eller någon form av strålbehandling. Det är inte möjligt att kvantifiera risken för klorambucil-induktion av leukemi eller karcinom hos människor. Utvärdering av publicerade rapporter om leukemi hos patienter som har fått klorambucil (och andra alkylerande medel) tyder på att risken för leukemogenes ökar med både långvarig behandling och stora kumulativa doser. Det har dock visat sig omöjligt att definiera en kumulativ dos under vilken det inte finns någon risk för induktion av sekundär malignitet. De potentiella fördelarna med klorambucilbehandling måste vägas individuellt mot den möjliga risken för induktion av en sekundär malignitet.
Klorambucil har visat sig orsaka kromatid- eller kromosomskada hos människor. Både reversibel och permanent sterilitet har observerats hos båda könen som fått klorambucil.
En hög incidens av sterilitet har dokumenterats när klorambucil administreras till prepubertala och pubertala män. Långvarig eller permanent azoospermi har också observerats hos vuxna män. Medan de flesta rapporter om gonadal dysfunktion sekundärt till klorambucil har relaterat till män, är induktionen av amenorré hos kvinnor med alkyleringsmedel väl dokumenterad och klorambucil kan producera amenorré. Obduktionsstudier av äggstockarna från kvinnor med malignt lymfom som behandlats med kombinationskemoterapi inklusive klorambucil har visat varierande grad av fibros, vaskulit och utarmning av primordiala folliklar.
Sällsynta fall av hudutslag som utvecklas till erythema multiforme, toxisk epidermal nekrolys eller Stevens-Johnsons syndrom har rapporterats. Klorambucil bör avbrytas omedelbart hos patienter som utvecklar hudreaktioner.
Graviditet
Graviditetskategori D
Klorambucil kan orsaka fosterskador när det ges till en gravid kvinna. Unilateral renal agenesis har observerats hos 2 avkommor vars mödrar fick klorambucil under den första trimestern. Urogenitala missbildningar, inklusive frånvaro av njure, hittades hos foster till råttor som fick klorambucil. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Om detta läkemedel används under graviditet, eller om patienten blir gravid medan du tar detta läkemedel, bör patienten informeras om den potentiella faran för fostret. Kvinnor i fertil ålder bör rådas att undvika att bli gravida.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Många patienter utvecklar en långsamt progressiv lymfopeni under behandlingen. Antalet lymfocyter återgår vanligtvis snabbt till normala nivåer efter avslutad läkemedelsbehandling. De flesta patienter har viss neutropeni efter den tredje behandlingens vecka och detta kan fortsätta i upp till 10 dagar efter den sista dosen. Därefter återgår neutrofilantalet vanligtvis snabbt till det normala. Allvarlig neutropeni verkar vara relaterad till doseringen och förekommer vanligtvis endast hos patienter som har fått en total dos på 6,5 mg/kg eller mer i en behandlingskur med kontinuerlig dosering. Ungefär en fjärdedel av alla patienter som får det kontinuerliga doseringsschemat och en tredjedel av de som får denna dos inom 8 veckor eller mindre kan förväntas utveckla svår neutropeni.
Även om det inte är nödvändigt att avbryta behandlingen med klorambucil vid det första tecknet på ett fall i antalet neutrofiler, måste man komma ihåg att fallet kan fortsätta i 10 dagar efter den sista dosen, och att när den totala dosen närmar sig 6,5 mg/kg, finns det risk för att orsaka irreversibla benmärgsskador. Dosen av klorambucil bör minskas om antalet leukocyter eller trombocyter faller under normala värden och bör avbrytas vid svårare depression.
Klorambucil bör inte ges i fulla doser före 4 veckor efter en hel kur med strålbehandling eller kemoterapi på grund av benmärgens sårbarhet för skador under dessa tillstånd. Om antalet leukocyter eller trombocyter före behandlingen är sänkt på grund av benmärgssjukdomsprocessen innan behandlingen påbörjas, bör behandlingen inledas med en reducerad dos.
Ihållande låga neutrofiler och trombocytantal eller perifer lymfocytos tyder på benmärgsinfiltration. Om det bekräftas genom benmärgsundersökning bör den dagliga dosen av klorambucil inte överstiga 0,1 mg/kg. Klorambucil verkar vara relativt fritt från gastrointestinala biverkningar eller andra bevis på toxicitet förutom den benmärgsdämpande effekten. Hos människor kan orala enstaka doser på 20 mg eller mer orsaka illamående och kräkningar.
Barn med nefrotiskt syndrom och patienter som får höga pulsdoser av klorambucil kan ha en ökad risk för anfall. Som med alla potentiellt epileptogena läkemedel bör försiktighet iakttas vid administrering av klorambucil till patienter med anamnes på krampanfall eller huvudtrauma, eller som får andra potentiellt epileptogena läkemedel.
Administrering av levande vacciner till patienter med nedsatt immunförsvar bör undvikas.
Laboratorietester
Patienter måste följas noggrant för att undvika livshotande skador på benmärgen under behandlingen. En veckovis undersökning av blodet bör göras för att fastställa hemoglobinnivåer, totala och differentiella leukocytantal och kvantitativa trombocytantal. Under de första 3 till 6 veckorna av behandlingen rekommenderas det också att räkna vita blodkroppar 3 eller 4 dagar efter varje veckas fullständiga blodräkning. Galton et al har föreslagit att det för att följa patienter är till hjälp att plotta blodvärdena på ett diagram samtidigt som kroppsvikt, temperatur, mjältstorlek etc. registreras. Det anses farligt att låta en patient gå mer än 2 veckor utan hematologisk och klinisk undersökning under behandlingen.
Karcinogenes, Mutagenes, Nedsatt fertilitet
Ser VARNINGAR avsnitt för information om karcinogenes, mutagenes och nedsatt fertilitet.
Graviditet
Teratogena effekter
Graviditetskategori D
Ser VARNINGAR sektion.
Ammande mödrar
Det är inte känt om detta läkemedel utsöndras i modersmjölk. Eftersom många läkemedel utsöndras i bröstmjölk och på grund av risken för allvarliga biverkningar hos ammande spädbarn från klorambucil, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern.
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Kliniska studier av klorambucil inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
Användning hos patienter med nedsatt njurfunktion
Effekten av nedsatt njurfunktion på eliminering av klorambucil har inte studerats formellt. Den renala elimineringen av oförändrad klorambucil och dess huvudsakliga aktiva metaboliter, fenylättiksyrasenap, representerar mindre än 1 % av den administrerade dosen. Dessutom krävdes ingen dosjustering hos 2 dialyspatienter på klorambucil. Nedsatt njurfunktion förväntas därför inte påverka elimineringen av klorambucil signifikant.
Användning hos patienter med nedsatt leverfunktion
Inga formella studier har utförts på patienter med nedsatt leverfunktion. Eftersom klorambucil huvudsakligen metaboliseras i levern, bör patienter med nedsatt leverfunktion övervakas noggrant med avseende på toxicitet och dosreduktion kan övervägas hos patienter med nedsatt leverfunktion när de behandlas med LEUKERAN (se DOSERING OCH ADMINISTRERING ).
ÖVERDOS
Reversibel pancytopeni var det huvudsakliga fyndet av oavsiktliga överdoser av klorambucil. Neurologisk toxicitet som sträcker sig från upprört beteende och ataxi till flera grand mal-anfall har också förekommit. Eftersom det inte finns någon känd motgift bör blodbilden övervakas noggrant och allmänna stödjande åtgärder vidtas, tillsammans med lämpliga blodtransfusioner, vid behov. Klorambucil är inte dialyserbart.
Orala LD50 enkeldoser till möss är 123 mg/kg. Hos råttor ger en intraperitoneal engångsdos på 12,5 mg/kg klorambucil typiska kväve-senapseffekter; dessa inkluderar atrofi av tarmslemhinnan och lymfoida vävnader, svår lymfopeni som blir maximal på 4 dagar, anemi och trombocytopeni. Efter denna dos börjar djuren återhämta sig inom 3 dagar och verkar normala efter cirka en vecka, även om benmärgen kanske inte blir helt normal på cirka 3 veckor. En intraperitoneal dos på 18,5 mg/kg dödar cirka 50 % av råttorna med utveckling av kramper. Så mycket som 50 mg/kg har getts oralt till råttor som engångsdos, med återhämtning. En sådan dos orsakar bradykardi, överdriven salivutsöndring, hematuri, kramper och respiratorisk dysfunktion.
KONTRAINDIKATIONER
Klorambucil bör inte användas till patienter vars sjukdom har visat en tidigare resistens mot medlet. Patienter som har visat överkänslighet mot klorambucil ska inte ges läkemedlet. Det kan finnas korsöverkänslighet (hudutslag) mellan klorambucil och andra alkylerande medel.
KLINISK FARMAKOLOGI
Handlingsmekanism
Klorambucil, ett aromatiskt kvävesenapsderivat, är ett alkyleringsmedel. Klorambucil interfererar med DNA-replikation och inducerar cellulär apoptos via ackumulering av cytosolisk p53 och efterföljande aktivering av Bax, en apoptospromotor.
Farmakokinetik
en studie med 12 patienter som fick orala engångsdoser på 0,2 mg/kg LEUKERAN 5 mg, var den genomsnittliga dosjusterade (±SD) plasmaklorambucil Cmax 492 ± 160 ng/ml, AUC var 883 ± 329 ng.h/mL , var den genomsnittliga eliminationshalveringstiden (t½) 1,3 ± 0,5 timmar och Tmax var 0,83 ± 0,53 timmar. För huvudmetaboliten, fenylättiksyrasenap (PAAM), var den genomsnittliga dosjusterade (± SD) plasma-Cmax 306 ± 73 ng/ml, AUC var 1204 ± 285 ng.h/mL, genomsnittlig t½ var 1,8 ± 0,4 timmar och Tmax var 1,9 ± 0,7 timmar.
Efter orala engångsdoser på 0,6 till 1,2 mg/kg nås maximala plasmanivåer av klorambucil (Cmax) inom 1 timme och den terminala halveringstiden (t ) för moderläkemedlet uppskattas till 1,5 timmar.
Absorption
Klorambucil absorberas snabbt och fullständigt (>70%) från mag-tarmkanalen. I överensstämmelse med den snabba, förutsägbara absorptionen av klorambucil har den interindividuella variationen i plasmafarmakokinetiken för klorambucil visats vara relativt liten efter orala doser på mellan 15 och 70 mg (2-faldig intrapatient-variabilitet och en 2- till 4-faldig variation interpatientvariabilitet i AUC). Absorptionen av klorambucil minskar när det tas efter mat. I en studie med tio patienter ökade födointaget median-Tmax med 2 gånger och minskade de dosjusterade Cmax- och AUC-värdena med 55 % respektive 20 %.
Distribution
Den skenbara distributionsvolymen var i genomsnitt 0,31 l/kg efter en oral engångsdos på 0,2 mg/kg av klorambucil hos 11 cancerpatienter med kronisk lymfatisk leukemi.
Klorambucil och dess metaboliter är i hög grad bundna till plasma- och vävnadsproteiner. In vitro är klorambucil till 99 % bundet till plasmaproteiner, speciellt albumin. Cerebrospinalvätskenivåer av klorambucil har inte fastställts.
Ämnesomsättning
Klorambucil metaboliseras i stor utsträckning i levern främst till fenylättiksyrasenap, som har antineoplastisk aktivitet. Klorambucil och dess huvudmetabolit genomgår oxidativ nedbrytning till monohydroxi- och dihydroxiderivat.
Exkretion
Efter en engångsdos av radiomärkt klorambucil (14C) uppträder cirka 20 % till 60 % av radioaktiviteten i urinen efter 24 timmar. Återigen är mindre än 1 % av urinradioaktiviteten i form av klorambucil eller fenylättiksyrasenap.
PATIENTINFORMATION
Patienterna bör informeras om att de huvudsakliga toxiciteterna av klorambucil är relaterade till överkänslighet, läkemedelsfeber, myelosuppression, levertoxicitet, infertilitet, kramper, gastrointestinal toxicitet och sekundära maligniteter. Patienter ska aldrig tillåtas ta läkemedlet utan medicinsk övervakning och bör rådfråga sin läkare om de upplever hudutslag, blödningar, feber, gulsot, ihållande hosta, kramper, illamående, kräkningar, amenorré eller ovanliga klumpar/massor. Kvinnor i fertil ålder bör rådas att undvika att bli gravida.
