Hydrea 500mg Hydroxyurea Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Hydrea 500mg och hur används det?
Hydrea (hydroxiurea) är ett antineoplastiskt (anti-cancer) medel som används för att behandla melanom, resistent kronisk myelocytisk leukemi och återkommande, metastaserande eller inoperabel karcinom i äggstockarna och primära skivepitelcancer (epidermoid) i huvud och hals. Hydrea finns i generisk form.
Vilka är biverkningarna av Hydrea?
Vanliga biverkningar av Hydrea inkluderar:
- illamående,
- kräkningar,
- orolig mage,
- diarre,
- förstoppning,
- hudförändringar som skalning eller missfärgning,
- influensaliknande symtom,
- håravfall,
- utslag,
- huvudvärk,
- yrsel,
- dåsighet, eller
- viktökning.
Allvarliga biverkningar av Hydrea inkluderar:
- anemi,
- myelosuppression och
- leukemi.
BESKRIVNING
HYDREA (hydroxiureakapslar, USP) är en antimetabolit tillgänglig för oral användning som kapslar innehållande 500 mg hydroxiurea. Inaktiva ingredienser inkluderar citronsyra, färgämnen (D&C Yellow No. 10, FD&C Blue No. 1, FD&C Red No. 40 och D&C Red No. 28), gelatin, laktos, magnesiumstearat, natriumfosfat och titandioxid.
Hydroxyurea är ett vitt till benvitt kristallint pulver. Det är hygroskopiskt och fritt lösligt i vatten, men praktiskt taget olösligt i alkohol. Den empiriska formeln är CH4N2O2 och den har en molekylvikt på 76,05. Dess strukturformel är:
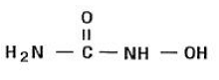
INDIKATIONER
HYDREA 500mg är indicerat för behandling av:
- Resistent kronisk myeloid leukemi.
- Lokalt avancerade skivepitelcancer i huvud och hals (exklusive läppen) i kombination med kemoradiation.
DOSERING OCH ADMINISTRERING
Doseringsinformation
HYDREA används ensamt eller tillsammans med andra antitumörmedel eller strålbehandling för att behandla neoplastiska sjukdomar. Individualisera behandlingen baserat på tumörtyp, sjukdomstillstånd, svar på behandling, patientriskfaktorer och aktuella kliniska praxisstandarder.
Basera all dosering på patientens faktiska eller idealvikt, beroende på vilken som är lägre.
HYDREA är ett cellgifter. Följ tillämpliga särskilda hanterings- och kasseringsprocedurer [se REFERENSER ].
Svälj HYDREA kapslar hela. Öppna, bryt eller tugga INTE kapslar eftersom HYDREA är ett cellgifter.
Profylaktisk administrering av folsyra rekommenderas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Övervaka blodvärden minst en gång i veckan under behandling med HYDREA 500 mg. Allvarlig anemi måste korrigeras innan behandling med HYDREA påbörjas.
Dosändringar för toxicitet
Övervaka följande och minska dosen eller avbryt HYDREA 500mg i enlighet med detta:
- Myelosuppression [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Kutan vaskulit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Överväg dosändringar för andra toxiciteter.
Dosjusteringar för nedsatt njurfunktion
Minska dosen av HYDREA med 50 % hos patienter med uppmätt kreatininclearance på mindre än 60 ml/min eller med njursjukdom i slutstadiet (ESRD) [se Användning i specifika populationer och KLINISK FARMAKOLOGI ].
Noggrann övervakning av hematologiska parametrar rekommenderas hos dessa patienter.
HUR LEVERERAS
Doseringsformer och styrkor
Kapslar
500 mg ogenomskinlig grön lock och ogenomskinlig rosa kropp präglad med "HYDREA" och "830".
Förvaring Och Hantering
HYDREA® (hydroxiureakapslar, USP) levereras som 500 mg kapslar i HDPE-flaskor med ett säkerhetsskruvlock av plast. Varje flaska innehåller 100 kapslar.
Kepsen är ogenomskinlig grön och kroppen är ogenomskinlig rosa. Kapslarna är märkta på båda sektionerna med "HYDREA" och "830" i svart bläck ( NDC 0003-0830-50).
Lagring
Förvara vid 20-25°C (68-77°F); utflykter tillåtna till 15°C-30°C (59°F-86°F) [se USP Controlled RoomTemperature]. Förvara tätt stängd.
Hantering och kassering
HYDREA 500mg är ett cellgifter. Följ tillämpliga särskilda hanterings- och kasseringsprocedurer [se REFERENSER ].
För att minska risken för kontakt, råd vårdgivare att bära engångshandskar vid hantering av HYDREA eller flaskor som innehåller HYDREA. Tvätta händerna med tvål och vatten före och efter kontakt med flaskan eller kapslarna vid hantering av HYDREA. Öppna inte HYDREA 500 mg kapslar. Undvik exponering för krossade eller öppnade kapslar. Om kontakt med krossade eller öppnade kapslar uppstår på huden, tvätta det drabbade området omedelbart och noggrant med tvål och vatten. Om kontakt med krossade eller öppnade kapslar uppstår på ögat/ögonen, ska det drabbade området spolas noggrant med vatten eller isotoniskt ögonsköljmedel avsett för detta ändamål i minst 15 minuter. Om pulvret från kapseln spills, torka omedelbart upp det med en fuktig engångshandduk och kassera i en stängd behållare, såsom en plastpåse; likaså de tomma kapslarna. Spillområdena ska sedan rengöras tre gånger med en rengöringsmedelslösning följt av rent vatten. Håll medicinen borta från barn och husdjur. Kontakta din läkare för instruktioner om hur du kasserar föråldrade kapslar.
REFERENSER
OSHA. http://www.osha.gov/SLTC/hazardousdrugs/index.html.
Tillverkad för: Bristol-Myers Squibb Company Princeton, New Jersey 08543 USA. Reviderad: Dec 2020
BIEFFEKTER
Följande kliniskt signifikanta biverkningar beskrivs i detalj i andra märkningsavsnitt:
- Myelosuppression [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Maligniteter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Vaskulitiska toxiciteter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Risker med samtidig användning av antiretrovirala läkemedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Strålningsåterkallelse [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Makrocytos [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Lungtoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av HYDREA efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens.
- Reproduktionssystemet och bröststörningar: azoospermi och oligospermi
- Gastrointestinala störningar: stomatit, illamående, kräkningar, diarré och förstoppning
- Metabolism och näringsstörningar: anorexi, tumörlyssyndrom
- Hud och subkutan vävnad: makulopapulära utslag, hudsår, kutan lupus erythematosus, dermatomyosit-liknande hudförändringar, perifert och ansiktserytem, hyperpigmentering, hyperpigmentering av naglar, atrofi av hud och naglar, fjällning, violetta papler och alopeci
- Njur- och urinvägssjukdomar: dysuri, förhöjda nivåer av serumurinsyra, blodkarbamidkväve (BUN) och kreatininnivåer
- Störningar i nervsystemet: huvudvärk, yrsel, dåsighet, desorientering, hallucinationer och kramper
- Allmänna störningar: feber, frossa, sjukdomskänsla, ödem och asteni
- Lever och gallvägar: förhöjning av leverenzymer, kolestas och hepatit
- Andningsstörningar: diffusa lunginfiltrat, dyspné och lungfibros, interstitiell lungsjukdom, pneumonit, alveolit, allergisk alveolit och hosta
- Immunstörningar: systemisk lupus erythematosus
- Överkänslighet: Läkemedelsinducerad feber (pyrexi) (>39°C, >102°F) som kräver sjukhusvistelse har rapporterats samtidigt med gastrointestinala, pulmonella, muskuloskeletala, hepatobiliära, dermatologiska eller kardiovaskulära manifestationer. Debut inträffade vanligtvis inom 6 veckor efter start och försvann efter utsättande av hydroxiurea. Vid ny administrering återkom feber normalt inom 24 timmar.
Biverkningar som observerats vid kombinerad hydroxiurea och strålbehandling liknar de som rapporterats vid användning av hydroxiurea eller enbart strålbehandling. Dessa effekter inkluderar främst benmärgsdepression (anemi och leukopeni), magirritation och mukosit. Nästan alla patienter som får en adekvat kur av kombinerad hydroxiurea och strålbehandling kommer att uppvisa samtidig leukopeni. Trombocytdepression (
LÄKEMEDELSINTERAKTIONER
Ökad toxicitet vid samtidig användning av antiretrovirala läkemedel
Pankreatit
Hos patienter med HIV-infektion under behandling med hydroxiurea och didanosin, med eller utan stavudin, har fatal och icke-dödlig pankreatit inträffat. Hydroxyurea är inte indicerat för behandling av HIV-infektion; men om patienter med HIV-infektion behandlas med hydroxiurea, och i synnerhet i kombination med didanosin och/eller stavudin, rekommenderas noggrann övervakning av tecken och symtom på pankreatit. Avbryt permanent behandling med hydroxiurea hos patienter som utvecklar tecken och symtom på pankreatit.
Hepatotoxicitet
Hepatotoxicitet och leversvikt som leder till dödsfall har rapporterats under övervakning efter marknadsföring hos patienter med HIV-infektion som behandlats med hydroxiurea och andra antiretrovirala läkemedel. Fatala leverhändelser rapporterades oftast hos patienter som behandlades med kombinationen hydroxiurea, didanosin och stavudin. Undvik denna kombination.
Perifer neuropati
Perifer neuropati, som i vissa fall var allvarlig, har rapporterats hos patienter med HIV-infektion som fått hydroxiurea i kombination med antiretrovirala läkemedel, inklusive didanosin, med eller utan stavudin.
Laboratorietestinterferens
Interferens med urinsyra-, urea- eller mjölksyraanalyser
Studier har visat att det finns en analytisk interferens av hydroxiurea med enzymerna (ureas, urikas och laktatdehydrogenas) som används vid bestämning av urea, urinsyra och mjölksyra, vilket ger falskt förhöjda resultat av dessa hos patienter som behandlas med hydroxiurea.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Myelosuppression
Hydroxyurea orsakar allvarlig myelosuppression. Behandling med hydroxiurea ska inte påbörjas om benmärgsfunktionen är markant försvagad. Benmärgssuppression kan förekomma, och leukopeni är i allmänhet dess första och vanligaste manifestation. Trombocytopeni och anemi förekommer mer sällan och ses sällan utan föregående leukopeni. Benmärgsdepression är mer sannolikt hos patienter som tidigare har fått strålbehandling eller cytotoxiska cancerkemoterapeutiska medel; använd hydroxiurea försiktigt hos sådana patienter.
Utvärdera hematologisk status före och under behandling med HYDREA. Ge stödjande vård och ändra dosen eller avbryt HYDREA vid behov. Återhämtning från myelosuppression är vanligtvis snabb när behandlingen avbryts.
Maligniteter
Hydroxyurea är ett cancerframkallande ämne hos människor. Hos patienter som får långvarig hydroxiurea för myeloproliferativa störningar har sekundär leukemi rapporterats. Hudcancer har också rapporterats hos patienter som får långvarig hydroxiurea. Ge råd om skydd mot solexponering och övervaka utvecklingen av sekundära maligniteter.
Embryo-fetal toxicitet
Baserat på verkningsmekanismen och fynd hos djur kan HYDREA 500 mg orsaka fosterskada när det administreras till en gravid kvinna. Hydroxyurea var embryotoxiskt och teratogent hos råttor och kaniner vid doser 0,8 gånger respektive 0,3 gånger den maximala rekommenderade dagliga dosen för människor på mg/m2-basis. Informera gravida kvinnor om den potentiella risken för ett foster [se Användning i specifika populationer ].
Informera kvinnor med reproduktionspotential att använda effektiva preventivmedel under och efter behandling med HYDREA 500 mg i minst 6 månader efter behandlingen. Informera män med reproduktionspotential att använda effektiva preventivmedel under och efter behandling med HYDREA 500 mg i minst 1 år efter behandlingen [se Användning i specifika populationer ].
Vaskulitiska toxiciteter
Kutan vaskulitisk toxicitet, inklusive vaskulitiska ulcerationer och gangren, har förekommit hos patienter med myeloproliferativa störningar under behandling med hydroxiurea. Dessa vaskulitiska toxiciteter rapporterades oftast hos patienter med en historia av, eller som för närvarande får, interferonbehandling. Om kutana vaskulitiska sår uppstår, sätt in behandling och avbryt HYDREA.
Levande vaccinationer
Undvik användning av levande vaccin till patienter som tar HYDREA. Samtidig användning av HYDREA och ett levande virusvaccin kan förstärka replikationen av viruset och/eller kan öka vaccinets biverkning eftersom normala försvarsmekanismer kan hämmas av HYDREA. Vaccination med levande vaccin hos en patient som får HYDREA 500 mg kan resultera i allvarlig infektion. Patientens antikroppssvar på vacciner kan minska. Överväg samråd med en specialist.
Risker med samtidig användning av antiretrovirala läkemedel
Pankreatit, hepatotoxicitet och perifer neuropati har inträffat när hydroxiurea administrerats samtidigt med antiretrovirala läkemedel, inklusive didanosin och stavudin [se LÄKEMEDELSINTERAKTIONER ].
Strålningsåterkallelse
Patienter som har fått strålbehandling tidigare kan ha en förvärring av erytem efter bestrålning. Övervaka huderytem hos patienter som tidigare fått strålning och hantera symtomatiskt.
Makrocytos
HYDREA 500mg kan orsaka makrocytos, som är självbegränsande, och som ofta ses tidigt i behandlingsförloppet. Den morfologiska förändringen liknar perniciös anemi, men är inte relaterad till vitamin B12 eller folsyrabrist. Detta kan maskera diagnosen perniciös anemi. Profylaktisk administrering av folsyra rekommenderas.
Lungtoxicitet
Interstitiell lungsjukdom inklusive lungfibros, lunginfiltration, pneumonit och alveolit/allergisk alveolit (inklusive dödliga fall) har rapporterats hos patienter som behandlats för myeloproliferativ neoplasm. Övervaka patienter som utvecklar pyrexi, hosta, dyspné eller andra luftvägssymtom ofta, undersök och behandla omedelbart. Avbryt behandlingen med HYDREA 500 mg och hantera med kortikosteroider [se NEGATIVA REAKTIONER ].
Laboratorietestinterferens
Interferens med urinsyra-, urea- eller mjölksyraanalyser är möjlig, vilket ger falskt förhöjda resultat av dessa hos patienter som behandlas med hydroxiurea [se LÄKEMEDELSINTERAKTIONER ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Konventionella långtidsstudier för att utvärdera den karcinogena potentialen hos hydroxiurea har inte utförts. Emellertid ökade intraperitoneal administrering av 125 till 250 mg/kg hydroxiurea (cirka 0,6-1,2 gånger den maximala rekommenderade orala dagliga dosen för människor på mg/m2-basis) tre gånger i veckan under 6 månader till honråttor incidensen av brösttumörer hos råttor som överlevde till 18 månader jämfört med kontroll. Hydroxyurea är mutagent in vitro för bakterier, svampar, protozoer och däggdjursceller. Hydroxyurea är klastogent in vitro (hamsterceller, humana lymfoblaster) och in vivo (SCE-analys på gnagare, mus mikrokärnanalys). Hydroxyurea orsakar omvandlingen av gnagarembryoceller till en tumörframkallande fenotyp.
Hydroxyurea administrerad till hanråttor med 60 mg/kg/dag (cirka 0,3 gånger den maximala rekommenderade dagliga dosen för människor på mg/m2-basis) gav testikelatrofi, minskade spermatogenesen och minskade signifikant deras förmåga att impregnera honor.
Användning i specifika populationer
Graviditet
Risksammanfattning
HYDREA kan orsaka fosterskada baserat på resultat från djurstudier och läkemedlets verkningsmekanism [se KLINISK FARMAKOLOGI ]. Det finns inga data för användning av HYDREA hos gravida kvinnor för att informera om en läkemedelsrelaterad risk. I reproduktionsstudier på djur gav administrering av hydroxiurea till dräktiga råttor och kaniner under organogenesen embryotoxiska och teratogena effekter vid doser 0,8 gånger respektive 0,3 gånger den maximala rekommenderade dagliga dosen för människor på mg/m2-basis (se Data ). Informera kvinnor om den potentiella risken för ett foster och att undvika att bli gravid medan de behandlas med HYDREA.
I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2%–4% respektive 15%–20%.
Data
Djurdata
Hydroxyurea har visat sig vara en potent teratogen i en mängd olika djurmodeller, inklusive möss, hamstrar, katter, miniatyrsvin, hundar och apor i doser inom 1 gånger den humana dosen som ges på mg/m2-basis. Hydroxyurea är embryotoxiskt och orsakar fostermissbildningar (delvis förbenade kranialben, frånvaro av ögonhålor, hydrocefali, tvådelade bröstben, saknade ländkotor) vid 180 mg/kg/dag (cirka 0,8 gånger den maximala rekommenderade dagliga dosen för människor på mg/m2-basis) hos råttor och vid 30 mg/kg/dag (cirka 0,3 gånger den maximala rekommenderade dagliga dosen för människor på mg/m2-basis) hos kaniner. Embryotoxicitet kännetecknades av minskad fosterlivsduglighet, minskade levande kullstorlekar och utvecklingsförseningar. Hydroxyurea passerar placentan. Engångsdoser på ≥375 mg/kg (cirka 1,7 gånger den maximala rekommenderade dagliga dosen för människor på mg/m2-basis) till råttor orsakade tillväxthämning och försämrad inlärningsförmåga.
Laktation
Risksammanfattning
Hydroxyurea utsöndras i modersmjölk. På grund av risken för allvarliga biverkningar hos ett ammat spädbarn från hydroxiurea, inklusive karcinogenicitet, ska du avbryta amningen under behandling med HYDREA.
Kvinnor Och Hanar Av Reproduktionspotential
Graviditetstest
Verifiera graviditetsstatus för kvinnor med reproduktionspotential innan HYDREA-behandling påbörjas.
Preventivmedel
Kvinnor
HYDREA kan orsaka fosterskador när det administreras till en gravid kvinna [se Graviditet ]. Informera kvinnor med reproduktionspotential att använda effektiva preventivmedel under och efter behandling med HYDREA i minst 6 månader efter behandlingen. Rekommendera kvinnor att omedelbart rapportera graviditet.
Män
HYDREA 500mg kan skada spermier och testikelvävnad, vilket kan resultera i möjliga genetiska avvikelser. Män med kvinnliga sexuella partners av reproduktionspotential bör använda effektiva preventivmedel under och efter behandling med HYDREA 500 mg i minst 1 år efter behandlingen [se Icke-klinisk toxikologi ].
Infertilitet
Män
Baserat på fynd hos djur och människor kan manlig fertilitet äventyras av behandling med HYDREA. Azoospermi eller oligospermi, ibland reversibel, har observerats hos män. Informera manliga patienter om möjligheten till spermakonservering innan behandlingen påbörjas [se NEGATIVA REAKTIONER och Icke-klinisk toxikologi ].
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Äldre patienter kan vara mer känsliga för effekterna av hydroxiurea och kan behöva en lägre dosregim. Hydroxyurea utsöndras via njurarna, och risken för biverkningar av detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen [se DOSERING OCH ADMINISTRERING ].
Nedsatt njurfunktion
Exponeringen för hydroxiurea är högre hos patienter med kreatininclearance på mindre än 60 ml/min eller hos patienter med njursjukdom i slutstadiet (ESRD). Minska dosen och övervaka noggrant de hematologiska parametrarna när HYDREA 500 mg ska administreras till dessa patienter [se DOSERING OCH ADMINISTRERING och KLINISK FARMAKOLOGI ].
Nedsatt leverfunktion
Det finns inga data som stöder specifik vägledning för dosjustering hos patienter med nedsatt leverfunktion. Noggrann övervakning av hematologiska parametrar rekommenderas hos dessa patienter.
ÖVERDOS
Akut mukokutan toxicitet har rapporterats hos patienter som får hydroxiurea i doser flera gånger den terapeutiska dosen. Ömhet, violett erytem, ödem på handflator och fotsulor följt av fjällning av händer och fötter, allvarlig generaliserad hyperpigmentering av huden och stomatit har också observerats.
KONTRAINDIKATIONER
HYDREA 500mg är kontraindicerat hos patienter som har visat en tidigare överkänslighet mot hydroxiurea eller någon annan komponent i formuleringen.
KLINISK FARMAKOLOGI
Handlingsmekanism
Den exakta mekanismen genom vilken hydroxiurea producerar sina antineoplastiska effekter kan för närvarande inte beskrivas. Rapporterna från olika studier av vävnadsodling på råttor och människor ger dock stöd till hypotesen att hydroxiurea orsakar en omedelbar hämning av DNA-syntesen genom att fungera som en ribonukleotidreduktashämmare, utan att störa syntesen av ribonukleinsyra eller protein. Denna hypotes förklarar varför hydroxiurea under vissa förhållanden kan inducera teratogena effekter.
Tre verkningsmekanismer har postulerats för ökad effektivitet av samtidig användning av hydroxiureaterapi med bestrålning på skivepitelcancer (epidermoid) i huvud och hals. In vitro-studier som använder kinesiska hamsterceller tyder på att hydroxiurea (1) är dödligt för normalt radioresistenta S-celler och (2) håller andra celler i cellcykeln i G1- eller pre-DNA-syntesstadiet där de är mest mottagliga för effekter av bestrålning. Den tredje verkningsmekanismen har teoretiserats på basis av in vitro-studier av HeLa-celler. Det verkar som att hydroxiurea, genom hämning av DNA-syntes, hindrar den normala reparationsprocessen av celler som skadats men inte dödats av bestrålning, och därigenom minskar deras överlevnadsgrad; RNA- och proteinsynteser har inte visat någon förändring.
Farmakokinetik
Absorption
Efter oral administrering av HYDREA når hydroxiurea maximala plasmakoncentrationer inom 1 till 4 timmar. Genomsnittliga maximala plasmakoncentrationer och AUC ökar mer än proportionellt med ökning av dosen.
Det finns inga data om effekten av mat på absorptionen av hydroxiurea.
Distribution
Hydroxyurea distribueras i hela kroppen med en distributionsvolym som är ungefär lika med det totala kroppsvattnet.
Hydroxyurea koncentreras i leukocyter och erytrocyter.
Ämnesomsättning
Upp till 60 % av en oral dos omvandlas genom mättad levermetabolism och en mindre nedbrytningsväg av ureas som finns i tarmbakterier.
Exkretion
Hos patienter med sicklecellanemi var den genomsnittliga kumulativa urinåtervinningen av hydroxiurea cirka 40 % av den administrerade dosen.
Specifika populationer
Nedsatt njurfunktion
Effekten av nedsatt njurfunktion på farmakokinetiken för hydroxiurea bedömdes hos vuxna patienter med sicklecellssjukdom och nedsatt njurfunktion. Patienter med normal njurfunktion (kreatininclearance [CrCl] >80 mL/min), mild (CrCl 50-80 mL/min), måttlig (CrCl = 30-60 ml/min). Minska dosen av HYDREA 500 mg när det ges till patienter med kreatininclearance på DOSERING OCH ADMINISTRERING och Användning i specifika populationer ].
PATIENTINFORMATION
- Det finns risk för myelosuppression. Övervakning av blodvärden varje vecka under hela behandlingen bör betonas för patienter som tar HYDREA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]. Rekommendera patienter att omedelbart rapportera tecken och symtom på infektion eller blödning.
- Informera patienter om att det finns risk för kutan vaskulitisk toxicitet och sekundära maligniteter inklusive leukemi och hudcancer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Informera kvinnor om reproduktionspotential om den potentiella risken för ett foster och att informera sin vårdgivare om en känd eller misstänkt graviditet. Rekommendera kvinnor och män med reproduktionspotential att använda preventivmedel under och efter behandling med HYDREA [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
- Rekommendera patienter att informera sin vårdgivare om de har fått eller planerar att få vaccinationer medan de tar HYDREA 500 mg eftersom detta kan resultera i en allvarlig infektion [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Rekommendera kvinnor att avbryta amningen under behandling med HYDREA [se Användning i specifika populationer ].
- Patienter med HIV-infektion bör kontakta sin läkare för tecken och symtom på pankreatit, leverhändelser och perifer neuropati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Erytem efter bestrålning kan förekomma hos patienter som har fått tidigare strålbehandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- Informera patienter om symtom på potentiell lungtoxicitet och instruera dem att omedelbart söka läkarvård i händelse av pyrexi, hosta, dyspné eller andra andningssymtom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
