Suprax 100mg, 200mg Cefixime Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Suprax 200mg och hur används det?
Suprax (cefixim) för oral suspension är ett cefalosporinantibiotikum som används för att behandla många olika typer av infektioner orsakade av bakterier.
Vilka är biverkningarna av Suprax?
Vanliga biverkningar av Suprax 100mg inkluderar:
- magbesvär/värk,
- diarre,
- illamående,
- förstoppning,
- aptitlöshet,
- gas,
- huvudvärk,
- yrsel,
- ångest,
- dåsighet,
- ökad nattlig urinering,
- rinnande näsa,
- öm hals,
- hosta, eller
- vaginal klåda eller flytningar.
Tala om för din läkare om du upplever sällsynta men mycket allvarliga biverkningar av Suprax 200mg inklusive:
- svår mag- eller buksmärta,
- ihållande illamående eller kräkningar,
- gulnande ögon eller hud,
- mörk urin,
- ovanlig trötthet,
- nya tecken på infektion (t.ex. ihållande ont i halsen, feber),
- lätta blåmärken eller blödningar,
- förändring i mängden urin, eller
- mentala/humörförändringar (som förvirring).
BESKRIVNING
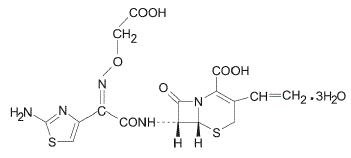
Cefixime är ett semisyntetiskt antibakteriellt cefalosporin för oral administrering. Kemiskt är det (6R,7R)-7-[2-(2-amino-4-tiazolyl)glyoxylamido]-8-oxo-3-vinyl-5-tia-1-azabicyklo [4.2.0] okt-2 -en-2-karboxylsyra, 72-(Z)-[O-(karboximetyl)oxim]trihydrat.
Molekylvikt = 507,50 som trihydrat. Kemisk formel är C16H15N5O7S2.3H2O
Strukturformeln för cefixim är:
- Inaktiva ingredienser som ingår i SUPRAX® (cefixim) 400 mg tabletter USP är: dibasiskt kalciumfosfat, hypromellos, laktosmonohydrat, magnesiumstearat, mikrokristallin cellulosa, polyetylenglykol, förgelatinerad stärkelse, titandioxid och triacetin.
- Inaktiva ingredienser som ingår i SUPRAX® (cefixim) 400 mg kapslar är: kolloidal kiseldioxid, krospovidon, lågsubstituerad hydroxipropylcellulosa, magnesiumstearat och mannitol. Kapselskalet innehåller följande inaktiva ingredienser: svart järnoxid, röd järnoxid, gelatin, kaliumhydroxid, propylenglykol, schellack, natriumlaurylsulfat och titandioxid.
- Inaktiva ingredienser som ingår i SUPRAX® (cefixim) 100 mg eller 150 mg eller 200 mg tuggtabletter är: aspartam, kolloidal kiseldioxid, krospovidon, FD&C Red # 40 Aluminium Lake, lågsubstituerad hydroxipropylcellulosa, magnesiumstearat, smaksatt, mannitol och tutti frutti smak.
- Inaktiva ingredienser som ingår i SUPRAX® (cefixim) pulver för oral suspension USP är: kolloidal kiseldioxid, natriumbensoat, jordgubbsarom, sukralos (endast i 500 mg/5 ml styrka), sackaros och xantangummi.
INDIKATIONER
Okomplicerade urinvägsinfektioner
SUPRAX är indicerat för behandling av vuxna och pediatriska patienter som är sex månader eller äldre med okomplicerade urinvägsinfektioner orsakade av känsliga isolat av Escherichia coli och Proteus mirabilis.
Otitis media
SUPRAX är indicerat för behandling av vuxna och pediatriska patienter som är sex månader eller äldre med öroninflammation orsakad av känsliga isolat av Haemophilus influenzae, Moraxella catarrhalis och Streptococcus pyogenes. (Effektiviteten för Streptococcus pyogenes i detta organsystem studerades i färre än 10 infektioner.)
Notera
För patienter med otitis media orsakad av Streptococcus pneumoniae var det totala svaret cirka 10 % lägre för cefixim än för jämförelsemedlet [se Kliniska studier ].
Faryngit och tonsillit
SUPRAX är indicerat för behandling av vuxna och pediatriska patienter som är sex månader eller äldremed faryngit och tonsillit orsakad av känsliga isolat av Streptococcus pyogenes. (Notera: Penicillin är det vanliga läkemedlet vid behandling av Streptococcus pyogenes-infektioner. SUPRAX är i allmänhet effektivt för att utrota Streptococcus pyogenes från nasofarynx, men data som fastställer effektiviteten av SUPRAX 100mg vid efterföljande förebyggande av reumatisk feber är inte tillgängligt.)
Akuta exacerbationer av kronisk bronkit
SUPRAX 200mg är indicerat för behandling av vuxna och pediatriska patienter som är sex månader eller äldre med akuta exacerbationer av kronisk bronkit orsakad av känsliga isolat av Streptococcus pneumoniae och Haemophilus influenzae.
Okomplicerad gonorré (cervikal/urethral)
SUPRAX 100mg är indicerat för behandling av vuxna och pediatriska patienter som är sex månader eller äldre med okomplicerad gonorré (cervikal/urethral) orsakad av känsliga isolat av Neisseria gonorrhoeae (penicillinas- och icke-penicillinasproducerande isolat).
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos SUPRAX 100mg och andra antibakteriella läkemedel, ska SUPRAX 100mg endast användas för att behandla infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antimikrobiell behandling. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
Vuxna
Den rekommenderade dosen av cefixim är 400 mg dagligen. Detta kan ges som en 400 mg tablett eller kapsel dagligen eller 400 mg tabletten kan delas och ges som en halv tablett var 12:e timme. För behandling av okomplicerade cervikala/uretrale gonokockinfektioner rekommenderas en oral engångsdos på 400 mg. Kapseln och tabletten kan administreras utan hänsyn till mat.
Vid behandling av infektioner orsakade av Streptococcus pyogenes bör en terapeutisk dos av cefixim administreras i minst 10 dagar.
Pediatriska patienter (6 månader eller äldre)
Den rekommenderade dosen är 8 mg/kg/dag av suspensionen. Detta kan administreras som en enstaka daglig dos eller kan ges i två uppdelade doser, som 4 mg/kg var 12:e timme.
Notera
En föreslagen dos har bestämts för varje pediatriskt viktområde. Se tabell 1. Se till att alla beställningar som anger en dos i milliliter inkluderar en koncentration, eftersom SUPRAX för oral suspension finns tillgänglig i tre olika koncentrationer (100 mg/5 ml, 200 mg/5 ml och 500 mg/5 ml).
Barn som väger mer än 45 kg eller äldre än 12 år bör behandlas med den rekommenderade vuxendosen. SUPRAX (cefixim) tuggtabletter måste tuggas eller krossas innan de sväljs.
Otitis media ska behandlas med tuggtabletter eller suspension. Kliniska prövningar av otitis media utfördes med tuggtabletterna eller suspensionen, och tuggtabletterna eller suspensionen resulterar i högre toppnivåer i blodet än tabletten när de administreras i samma dos.
Därför ska tabletten eller kapseln inte ersätta tuggtabletter eller suspension vid behandling av otitis media [se KLINISK FARMAKOLOGI ].
Vid behandling av infektioner orsakade av Streptococcus pyogenes bör en terapeutisk dos av cefixim administreras i minst 10 dagar.
Nedsatt njurfunktion
SUPRAX 200 mg kan administreras i närvaro av nedsatt njurfunktion. Normal dos och schema kan användas hos patienter med kreatininclearance på 60 ml/min eller mer. Se tabell 2 för dosjusteringar för vuxna med nedsatt njurfunktion. Varken hemodialys eller peritonealdialys avlägsnar betydande mängder läkemedel från kroppen.
Rekonstitution Anvisningar för oral suspension
Efter beredning kan suspensionen förvaras i 14 dagar, antingen i rumstemperatur eller i kyl, utan betydande förlust av styrka. Förvara tätt stängd. Skaka väl innan användning. Kassera oanvänd del efter 14 dagar.
HUR LEVERERAS
Doseringsformer och styrkor
SUPRAX finns tillgängligt för oral administrering i följande doseringsformer och styrkor:
- Filmdragerade tabletter ger 400 mg cefixim som trihydrat. Dessa är vita till benvita, filmdragerade, kapselformade tabletter med fasade kanter och en delad skåra på varje sida. Tabletten är präglad med ”SUPRAX” på ena sidan och ”LUPIN” på den andra sidan.
- Kapslar ger 400 mg cefixim som trihydrat. Dessa är kapslar i storlek "00EL" med rosa ogenomskinlig lock och rosa ogenomskinlig stomme med "LU" på locket och "U43" på stommen i svart bläck. Kapslar innehåller vitt till gulvitt granulärt pulver.
- Tuggtabletter ger antingen 100 mg eller 150 mg eller 200 mg cefixim som trihydrat. 100 mg tabletten är rosa, rund tablett, präglad med "SUPRAX 100" på ena sidan och "LUPIN" på andra sidan. 150 mg tabletten är rosa, rund tablett, präglad med "SUPRAX 150" på ena sidan och "LUPIN" på andra sidan. 200 mg tabletten är rosa, rund tablett, präglad med "SUPRAX 200" på ena sidan och "LUPIN" på andra sidan.
- Pulver till oral suspension ger, när det rekonstitueras, antingen 100 mg/5 ml eller 200 mg/5 ml eller 500 mg/5 ml cefixim som trihydrat. För 100 mg/5 ml och 200 mg/5 ml har pulvret en benvit till svagt gul färg och är jordgubbssmak. För 500 mg/5 ml har pulvret en benvit till krämfärgad färg och är jordgubbssmak.
Förvaring Och Hantering
SUPRAX® är tillgängligt för oral administrering i följande doseringsformer, styrkor och förpackningar som anges i tabellen nedan:
Tillverkad av: Lupine Limited Mandideep 462 046 Indien. Reviderad: mars 2018.
BIEFFEKTER
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
De vanligaste biverkningarna i amerikanska prövningar av tablettformuleringen var gastrointestinala händelser, som rapporterades hos 30 % av vuxna patienter antingen två gånger dagligen eller en gång dagligen. Fem procent (5%) av patienterna i de amerikanska kliniska prövningarna avbröt behandlingen på grund av läkemedelsrelaterade biverkningar. Individuella biverkningar inkluderade diarré 16 %, lös eller frekvent avföring 6 %, buksmärtor 3 %, illamående 7 %, dyspepsi 3 % och flatulens 4 %. Incidensen av gastrointestinala biverkningar, inklusive diarré och lös avföring, hos pediatriska patienter som fick suspensionen var jämförbar med incidensen hos vuxna patienter som fick tabletter.
Erfarenhet efter marknadsföring
Följande biverkningar har rapporterats efter användning av cefixim efter godkännande. Incidensen var mindre än 1 av 50 (mindre än 2%).
Gastrointestinala
Flera fall av dokumenterad pseudomembranös kolit identifierades i kliniska prövningar. Symtom på pseudomembranös kolit kan uppträda under eller efter behandlingen.
Överkänslighetsreaktioner
Anafylaktiska/anafylaktoida reaktioner (inklusive chock och dödsfall), hudutslag, urtikaria, läkemedelsfeber, klåda, angioödem och ansiktsödem. Erythema multiforme, Stevens-Johnsons syndrom och serumsjukeliknande reaktioner har rapporterats.
Lever
snabba förhöjningar av SGPT, SGOT, alkaliskt fosfatas, hepatit, gulsot.
Njur
Övergående förhöjningar av BUN eller kreatinin, akut njursvikt.
Centrala nervsystemet
Huvudvärk, yrsel, kramper.
Hemiska och lymfatiska systemet
Övergående trombocytopeni, leukopeni, neutropeni, förlängning av protrombintid, förhöjd LDH, pancytopeni, agranulocytos och eosinofili.
Onormala laboratorietester
Hyperbilirubinemi.
Andra biverkningar
Genital pruritus, vaginit, candidiasis, giftig epidermal nekrolys.
Biverkningar rapporterade för läkemedel av cefalosporinklass
Allergiska reaktioner, superinfektion, njurdysfunktion, toxisk nefropati, leverdysfunktion inklusive kolestas, aplastisk anemi, hemolytisk anemi, blödning och kolit.
Flera cefalosporiner har varit inblandade i att utlösa anfall, särskilt hos patienter med nedsatt njurfunktion när dosen inte reducerats [se DOSERING OCH ADMINISTRERING ser ÖVERDOS ]. Om anfall i samband med läkemedelsbehandling uppstår ska läkemedlet avbrytas. Antikonvulsiv behandling kan ges om det är kliniskt indicerat.
LÄKEMEDELSINTERAKTIONER
Karbamazepin
Förhöjda karbamazepinnivåer har rapporterats efter marknadsföring när cefixim administreras samtidigt. Läkemedelsövervakning kan vara till hjälp för att upptäcka förändringar i plasmakoncentrationer av karbamazepin.
Warfarin och antikoagulantia
Ökad protrombintid, med eller utan klinisk blödning, har rapporterats när cefixim administreras samtidigt.
Interaktioner med läkemedel/laboratorietest
En falsk-positiv reaktion för ketoner i urinen kan uppstå med tester med nitroprussid men inte med de som använder nitroferricyanid.
Administrering av cefixim kan resultera i en falsk-positiv reaktion för glukos i urinen med Clinitest®, Benedicts lösning eller Fehlings lösning. Det rekommenderas att glukostester baserade på enzymatiska glukosoxidasreaktioner (som Clinistix® eller TesTape®) används. Ett falskt positivt direkt Coombs-test har rapporterats under behandling med andra cefalosporiner; därför bör det inses att ett positivt Coombs-test kan bero på drogen.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Överkänslighetsreaktioner
Anafylaktiska/anafylaktoida reaktioner (inklusive chock och dödsfall) har rapporterats vid användning av cefixim.
Innan behandling med SUPRAX sätts in bör noggrann utredning göras för att fastställa om patienten tidigare har haft överkänslighetsreaktioner mot cefalosporiner, penicilliner eller andra läkemedel. Om denna produkt ska ges till penicillinkänsliga patienter bör försiktighet iakttas eftersom korsöverkänslighet mellan betalaktamantibakteriella läkemedel har dokumenterats tydligt och kan förekomma hos upp till 10 % av patienterna med penicillinallergi i anamnesen. Om en allergisk reaktion mot SUPRAX 100mg uppstår, avbryt behandlingen.
Clostridium Difficile-associerad diarré
Clostridium difficile associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive SUPRAX 200 mg, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande isolat av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter användning av antibakteriella läkemedel. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibakteriella läkemedelsanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibakteriell läkemedelsbehandling av C. difficile och kirurgisk utvärdering bör inledas som kliniskt indicerat.
Dosjustering vid nedsatt njurfunktion
Dosen av SUPRAX 100 mg bör justeras till patienter med nedsatt njurfunktion samt de som genomgår kontinuerlig ambulatorisk peritonealdialys (CAPD) och hemodialys (HD). Patienter i dialys bör övervakas noggrant [se DOSERING OCH ADMINISTRERING ].
Koagulationseffekter
Cefalosporiner, inklusive SUPRAX 200 mg, kan vara associerade med en minskning av protrombinaktiviteten. De som löper risk inkluderar patienter med nedsatt njur- eller leverfunktion, eller dåligt näringstillstånd, såväl som patienter som får en utdragen kur av antimikrobiell terapi, och patienter som tidigare stabiliserats på antikoagulantia. Protrombintiden bör övervakas hos patienter i riskzonen och exogent vitamin K administreras enligt indikation.
Utveckling av läkemedelsresistenta bakterier
Att förskriva SUPRAX (cefixim) i frånvaro av en bevisad eller starkt misstänkt bakterieinfektion kommer sannolikt inte att ge patienten någon nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Risk hos patienter med fenylketonuri
Fenylalanin kan vara skadligt för patienter med fenylketonuri (PKU). SUPRAX 200 mg tuggtabletter innehåller aspartam, en källa till fenylalanin. Varje styrka på 100 mg, 150 mg och 200 mg innehåller 3,3 mg, 5 mg respektive 6,7 mg fenylalanin. Innan du förskriver SUPRAX tuggtabletter till en patient med PKU, överväg den kombinerade dagliga mängden fenylalanin från alla källor, inklusive SUPRAX 200 mg tuggtabletter.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Livstidsstudier på djur för att utvärdera cancerframkallande potential har inte utförts. Cefixim orsakade inte punktmutationer i bakterier eller däggdjursceller, DNA-skador eller kromosomskador in vitro och uppvisade inte klastogen potential in vivo i mikrokärntestet hos mus. Hos råttor påverkades inte fertiliteten och reproduktionsförmågan av cefixim vid doser upp till 25 gånger den terapeutiska dosen för vuxna.
Användning i specifika populationer
Graviditet
Graviditetskategori B
Reproduktionsstudier har utförts på möss och råttor i doser upp till 40 gånger den mänskliga dosen och har inte visat några tecken på skada på fostret på grund av cefixim. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Arbete och leverans
Cefixime har inte studerats för användning under förlossning och förlossning. Behandling bör endast ges om det är tydligt nödvändigt.
Ammande mödrar
Det är inte känt om cefixim utsöndras i modersmjölk. Man bör överväga att tillfälligt avbryta amningen under behandling med detta läkemedel.
Pediatrisk användning
Säkerhet och effektivitet för cefixim hos barn yngre än sex månader har inte fastställts. Incidensen av gastrointestinala biverkningar, inklusive diarré och lös avföring, hos de pediatriska patienterna som fick suspensionen var jämförbar med incidensen hos vuxna patienter som fick tabletter.
Geriatrisk användning
Kliniska studier inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. En farmakokinetisk studie på äldre upptäckte skillnader i farmakokinetiska parametrar [se KLINISK FARMAKOLOGI ]. Dessa skillnader var små och indikerar inget behov av dosjustering av läkemedlet hos äldre.
Nedsatt njurfunktion
Dosen av cefixim bör justeras hos patienter med nedsatt njurfunktion samt de som genomgår kontinuerlig ambulatorisk peritonealdialys (CAPD) och hemodialys (HD). Patienter i dialys bör övervakas noggrant [se DOSERING OCH ADMINISTRERING ].
ÖVERDOS
Magsköljning kan vara indicerat; annars finns inget specifikt motgift. Cefixim avlägsnas inte i betydande mängder från cirkulationen genom hemodialys eller peritonealdialys. Biverkningar hos ett litet antal friska vuxna frivilliga som fick engångsdoser på upp till 2 g cefixim skilde sig inte från profilen hos patienter som behandlades med de rekommenderade doserna.
KONTRAINDIKATIONER
Suprax (cefixim) är kontraindicerat hos patienter med känd allergi mot cefixim eller andra cefalosporiner.
KLINISK FARMAKOLOGI
Handlingsmekanism
Cefixim är ett semisyntetiskt cefalosporin antibakteriellt läkemedel [se Mikrobiologi ].
Farmakokinetik
SUPRAX 200 mg tuggtabletter är bioekvivalenta med oral suspension.
SUPRAX 200 mg tabletter och suspension, som ges oralt, absorberas till cirka 40 % till 50 % oavsett om de administreras med eller utan mat; dock ökar tiden till maximal absorption med cirka 0,8 timmar när det administreras tillsammans med mat. En enstaka 200 mg tablett av cefixim ger en genomsnittlig maximal serumkoncentration på cirka 2 mcg/ml (intervall 1 till 4 mcg/ml); en enstaka 400 mg tablett ger en genomsnittlig toppkoncentration på cirka 3,7 mcg/ml (intervall 1,3 till 7,7 mcg/ml). Den orala suspensionen ger genomsnittliga toppkoncentrationer som är cirka 25 % till 50 % högre än tabletterna, när den testas på normala vuxna frivilliga. Tvåhundra och 400 mg doser av oral suspension ger genomsnittliga toppkoncentrationer på 3 mcg/ml (intervall 1 till 4,5 mcg/ml) respektive 4,6 mcg/ml (intervall 1,9 till 7,7 mcg/ml), när de testas på normala vuxna frivilliga. . Ytan under kurvan för tid kontra koncentration (AUC) är cirka 10 % till 25 % större med den orala suspensionen än med tabletten efter doser på 100 till 400 mg, vid testning på normala vuxna frivilliga. Denna ökade absorption bör beaktas om den orala suspensionen ska ersätta tabletten. På grund av bristen på bioekvivalens bör tabletter inte ersätta oral suspension vid behandling av otitis media [se DOSERING OCH ADMINISTRERING ]. Cross-over-studier av tablett kontra suspension har inte utförts på barn.
400 mg kapseln är bioekvivalent med 400 mg tabletten under fasta. Mat minskar dock absorptionen efter administrering av kapseln med cirka 15 % baserat på AUC och 25 % baserat på Cmax.
Maximala serumkoncentrationer inträffar mellan 2 och 6 timmar efter oral administrering av en enstaka 200 mg tablett, en enstaka 400 mg tablett eller 400 mg cefiximsuspension. Maximala serumkoncentrationer inträffar mellan 2 och 5 timmar efter en enstaka administrering av 200 mg suspension. Maximala serumkoncentrationer inträffar mellan 3 och 8 timmar efter oral administrering av en enstaka 400 mg kapsel.
Distribution
Serumproteinbindningen är koncentrationsoberoende med en bunden fraktion på cirka 65 %. I en multipeldosstudie utförd med en forskningsformulering som är mindre biotillgänglig än tabletten eller suspensionen, var det liten ansamling av läkemedel i serum eller urin efter dosering i 14 dagar. Adekvata data om CSF-nivåer av cefixim är inte tillgängliga.
Metabolism och utsöndring
Det finns inga tecken på metabolism av cefixim in vivo. Cirka 50 % av den absorberade dosen utsöndras oförändrad i urinen inom 24 timmar. I djurstudier noterades att cefixim också utsöndras i gallan i över 10 % av den administrerade dosen. Serumhalveringstiden för cefixim hos friska försökspersoner är oberoende av doseringsform och är i genomsnitt 3 till 4 timmar men kan variera upp till 9 timmar hos vissa normala frivilliga.
Särskilda populationer
Geriatri
Genomsnittliga AUC vid steady state hos äldre patienter är cirka 40 % högre än genomsnittliga AUC hos andra friska vuxna. Skillnader i de farmakokinetiska parametrarna mellan 12 unga och 12 äldre försökspersoner som fick 400 mg cefixim en gång dagligen i 5 dagar sammanfattas enligt följande:
Dessa ökningar var dock inte kliniskt signifikanta [se DOSERING OCH ADMINISTRERING ].
Nedsatt njurfunktion
Hos patienter med måttligt nedsatt njurfunktion (20 till 40 ml/min kreatininclearance) förlängs den genomsnittliga halveringstiden för cefixim till 6,4 timmar. Vid gravt nedsatt njurfunktion (5 till 20 ml/min kreatininclearance) ökade halveringstiden till i genomsnitt 11,5 timmar. Läkemedlet elimineras inte signifikant från blodet genom hemodialys eller peritonealdialys. En studie visade dock att med doser på 400 mg har patienter som genomgår hemodialys liknande blodprofiler som patienter med kreatininclearance på 21 till 60 ml/min.
Mikrobiologi
Handlingsmekanism
Som med andra cefalosporiner är den bakteriedödande effekten av cefixim ett resultat av hämning av cellväggssyntesen. Cefixim är stabilt i närvaro av vissa beta-laktamasenzymer. Som ett resultat kan vissa organismer som är resistenta mot penicilliner och vissa cefalosporiner på grund av förekomsten av betalaktamaser vara mottagliga för cefixim.
Motstånd
Resistens mot cefixim i isolat av Haemophilus influenzae och Neisseria gonorrhoeae är oftast associerad med förändringar i penicillinbindande proteiner (PBP). Cefixim kan ha begränsad aktivitet mot Enterobacteriaceae som producerar beta-laktamaser med utökat spektrum (ESBL). Pseudomonas-arter, Enterococcus-arter, stammar av grupp D-streptokocker, Listeria monocytogenes, de flesta stammar av stafylokocker (inklusive meticillinresistenta stammar), de flesta stammar av Enterobacter-arter, de flesta stammar av Bacteroides fragilis-arter och de flesta stammarna av Clotostridium-arter.
Antimikrobiell aktivitet
Cefixim har visat sig vara aktivt mot de flesta isolat av följande mikroorganismer, både in vitro och vid kliniska infektioner [se INDIKATIONER ].
Grampositiva bakterier
Streptococcus pneumoniae Streptococcus pyogenes
Gramnegativa bakterier
Escherichia coli Haemophilus influenzae Moraxella catarrhalis Neisseria gonorrhoeae Proteus mirabilis
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Minst 90 procent av följande bakterier uppvisar en in vitro minimal hämmande koncentration (MIC) som är mindre än eller lika med den mottagliga brytpunkten för cefixim mot isolat av liknande släkte eller organismgrupp. Effekten av cefixim vid behandling av kliniska infektioner orsakade av dessa bakterier har dock inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Grampositiva bakterier
Streptococcus agalactiae
Gramnegativa bakterier
Citrobacter amalonaticus Citrobacter diversus Haemophilus parainfluenzae Klebsiella oxytoca Klebsiella pneumoniae Pasteurella multocida Proteus vulgaris Providencia arter Salmonella arter Serratia marcescens Shigella arter
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder som erkänns av FDA för detta läkemedel, se: https://www.fda.gov/STIC.
Kliniska studier
Jämförande kliniska prövningar av otitis media utfördes på nästan 400 barn i åldrarna 6 månader till 10 år. Streptococcus pneumoniae isolerades från 47 % av patienterna, Haemophilus influenzae från 34 %, Moraxella catarrhalis från 15 % och S. pyogenes från 4 %.
Den totala svarsfrekvensen för Streptococcus pneumoniae på cefixim var cirka 10 % lägre och den för Haemophilus influenzae eller Moraxella catarrhalis cirka 7 % högre (12 % när beta-laktamaspositiva isolat av H. influenzae ingår) än svarsfrekvensen för dessa organismer på de aktiva kontrollläkemedlen.
dessa studier randomiserades patienterna och behandlades med antingen cefixim i dosregimer på 4 mg/kg två gånger dagligen eller 8 mg/kg en gång dagligen, eller med en jämförelsepreparat. Sextionio till 70 % av patienterna i varje grupp hade upphörande av tecken och symtom på otitis media när de utvärderades 2 till 4 veckor efter behandling, men ihållande utgjutning hittades hos 15 % av patienterna. Vid utvärdering efter avslutad behandling ansågs 17 % av patienterna som fick cefixim och 14 % av patienterna som fick effektiva jämförande läkemedel (18 % inklusive de patienter som hade Haemophilus influenzae resistenta mot kontrollläkemedlet och som fick det antibakteriella kontrollläkemedlet) behandlingsmisslyckanden. Vid 2 till 4 veckors uppföljning hade totalt 30 %-31 % av patienterna tecken på antingen behandlingssvikt eller återkommande sjukdom.
Bakteriologiskt utfall av otitis media två till fyra veckor efter terapi baserat på upprepad mellanörat
PATIENTINFORMATION
Informera patienter om att antibakteriella läkemedel, inklusive cefixim, endast ska användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När cefixim förskrivs för att behandla en bakteriell infektion, bör patienterna få veta att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela terapiförloppet kan: (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier utvecklar resistens och inte kommer att kunna behandlas med cefixim för oral suspension eller cefiximtuggtabletter eller andra antibakteriella läkemedel i framtiden.
Informera patienter med fenylketonuri att SUPRAX 200 mg tuggtabletter innehåller aspartam, en källa till fenylalanin enligt följande: Varje SUPRAX tuggtablett innehåller 3,3 mg, 5 mg och 6,7 mg fenylalanin per 100 mg respektive 200 mg styrka.
Informera patienter om att diarré är ett vanligt problem som orsakas av antibakteriella läkemedel som vanligtvis upphör när det antibakteriella läkemedlet avbryts. Ibland kan patienter efter påbörjad behandling med antibakteriella läkemedel utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av det antibakteriella läkemedlet. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
