Asacol 400mg Mesalamine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Asacol 400mg och hur används det?
Asacol är ett receptbelagt läkemedel som används för att behandla symptomen på ulcerös kolit. Asacol 400mg kan användas ensamt eller tillsammans med andra läkemedel.
Asacol tillhör en klass av läkemedel som kallas 5-aminosalicylsyraderivat.
Det är inte känt om Asacol 400mg är säkert och effektivt för barn yngre än 5 år.
Vilka är de möjliga biverkningarna av Asacol 400mg?
Asacol kan orsaka allvarliga biverkningar inklusive:
- svåra magsmärtor,
- kramp i magen,
- blodig diarré,
- feber,
- huvudvärk,
- hudutslag,
- blodig eller tjäraktig avföring,
- hosta blod,
- kräks som ser ut som kaffesump,
- lite eller ingen urinering,
- smärtsam eller svår urinering,
- svullnad i dina fötter eller vrister,
- känner mig trött,
- andnöd,
- aptitlöshet,
- ont i övre magen,
- lätta blåmärken eller blödningar,
- mörk urin,
- lerfärgade pallar, och
- gulfärgning av huden eller ögonen (gulsot)
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Asacol inkluderar:
- illamående,
- kräkningar,
- magont,
- diarre,
- dålig matsmältning,
- gas,
- huvudvärk,
- utslag, och
- onormala leverfunktionstester
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Asacol. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
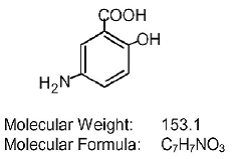
Varje Asacol (mesalamin) tablett med fördröjd frisättning för oral administrering innehåller 400 mg mesalamin, ett aminosalicylat. Asacol (mesalamin) tabletter med fördröjd frisättning innehåller akrylbaserat harts, Eudragit S (metakrylsyrasampolymer typ B, NF), som löses upp vid pH 7 eller högre och frisätter mesalamin i den terminala ileum och därefter för topikal antiinflammatorisk verkan i tjocktarmen . Mesalamin (även kallad 5-aminosalicylsyra eller 5-ASA) har det kemiska namnet 5-amino-2-hydroxibensoesyra. Dess strukturformel är:
Inaktiva Ingredienser: Varje tablett innehåller kolloidal kiseldioxid, dibutylftalat, ätbart svart bläck, järnoxidrött, järnoxidgult, laktosmonohydrat, magnesiumstearat, metakrylsyrasampolymer B (Eudragit S), polyetylenglykol, povidon, natriumstärkelseglykolat och talk.
INDIKATIONER
Behandling av mild till måttligt aktiv ulcerös kolit
Asacol® (mesalamin) tabletter med fördröjd frisättning är indicerade för behandling av mild till måttligt aktiv ulcerös kolit hos patienter 5 år och äldre.
Underhåll av remission av ulcerös kolit hos vuxna
Asacol (mesalamin) tabletter med fördröjd frisättning är indicerade för upprätthållande av remission av ulcerös kolit hos vuxna. Säkerheten och effektiviteten av Asacol för upprätthållande av remission av ulcerös kolit hos pediatriska patienter har inte fastställts.
DOSERING OCH ADMINISTRERING
Dosering för behandling av mild till måttligt aktiv ulcerös kolit
Vuxna
För vuxna är den rekommenderade dosen av Asacol 400 mg två 400 mg tabletter som ska tas tre gånger dagligen med eller utan mat (total daglig dos på 2,4 gram), under en varaktighet av 6 veckor [se Kliniska studier ].
Pediatrik
För pediatriska patienter är den rekommenderade totala dagliga dosen av Asacol viktbaserad (upp till maximalt 2,4 gram/dag) (se tabell 1). Asacol 400 mg tabletter ska tas två gånger dagligen med eller utan mat i 6 veckor [se Kliniska studier ].
Dosering för underhåll av remission av ulcerös kolit hos vuxna
För vuxna är den rekommenderade dosen av Asacol 1,6 gram dagligen, i uppdelade doser, med eller utan mat [se Kliniska studier ].
Viktiga administrationsinstruktioner
Svälj Asacol tabletter hela. Skär inte, bryt eller tugga inte tabletterna.
Två Asacol 400 mg tabletter har inte visats vara bioekvivalenta med en Asacol® HD (mesalamin) tablett på 800 mg med fördröjd frisättning och bör inte användas omväxlande.
Testning före administrering av Asacol 400mg
Utvärdera njurfunktionen innan behandling med Asacol påbörjas [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
HUR LEVERERAS
Doseringsformer och styrkor
Asacol (mesalamin) tabletter med fördröjd frisättning: 400 mg (rödbruna, kapselformade och märkta med "0752 DR" i svart).
Förvaring Och Hantering
Asacol (mesalamin) tabletter med fördröjd frisättning finns som rödbruna, kapselformade tabletter innehållande 400 mg mesalamin och märkta med ”0752 DR” i svart.
NDC 0430-0752-27 Flaska med 180 tabletter
Förvara vid 20° till 25° C (68° till 77° F); utflykter tillåtna 15° till 30° C (59° till 86° F) [Se USP-kontrollerad rumstemperatur ].
Tillverkad av: Warner Chilcott Deutschland GmbH D-64331 Weiterstadt Tyskland. Marknadsförs av: Warner Chilcott (USA), LLC Rockaway, NJ 07866. Reviderad: okt 2013
BIEFFEKTER
De allvarligaste biverkningarna som setts i Asacol kliniska prövningar eller med andra produkter som innehåller mesalamin eller metaboliseras till mesalamin är:
- Nedsatt njurfunktion, inklusive njursvikt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Akut intoleranssyndrom [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Överkänslighetsreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Leversvikt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Totalt har Asacol 400 mg tabletter utvärderats hos 2 690 patienter med ulcerös kolit i kontrollerade och öppna prövningar. Biverkningar som presenteras i följande avsnitt kan förekomma oavsett behandlingslängd och liknande reaktioner har rapporterats i kort- och långtidsstudier och efter marknadsföring.
Kliniska studier som stöder användningen av Asacol 400 mg för behandling av lätt till måttligt aktiv ulcerös kolit inkluderade två 6-veckors placebokontrollerade, randomiserade, dubbelblinda studier på vuxna med lätt till måttligt aktiv ulcerös kolit (studier 1 och 2) och en 6 veckors, randomiserad, dubbelblind studie av 2 dosnivåer hos barn med lätt till måttligt aktiv ulcerös kolit. Kliniska studier som stöder användningen av Asacol 400 mg tabletter för att upprätthålla remission av ulcerös kolit inkluderade en 6 månader lång, randomiserad, dubbelblind, placebokontrollerad, multicenterstudie och fyra aktivt kontrollerade underhållsstudier som jämförde Asacol 400 mg tabletter med sulfasalazin . Asacol 400 mg har utvärderats hos 427 vuxna och 82 barn med ulcerös kolit i dessa kontrollerade studier.
Behandling av mild till måttligt aktiv ulcerös kolit hos vuxna
två 6-veckors placebokontrollerade kliniska studier (Studier 1 och 2) med 245 patienter, varav 155 randomiserades till Asacol [se Kliniska studier ], 3,2 procent av de Asacol-behandlade patienterna avbröt behandlingen på grund av biverkningar jämfört med 2,2 procent av de placebobehandlade patienterna. Medelåldern för patienterna i studie 1 var 42 år och 48 procent av patienterna var män. Medelåldern för patienterna i studie 2 var 42 år och 59 procent av patienterna var män. Biverkningar som leder till utsättning av Asacol inkluderade (var och en hos en patient): diarré och kolitutbrott; yrsel, illamående, ledvärk och huvudvärk; utslag, letargi och förstoppning; muntorrhet, sjukdomskänsla, obehag i nedre delen av ryggen, lätt desorientering, lätt matsmältningsbesvär och kramper; huvudvärk, illamående, värk, kräkningar, muskelkramper, täppt huvud, täppta öron och feber.
Biverkningar hos patienter som behandlats med Asacol som uppträder med en frekvens på minst 2 procent och i en frekvens som är högre än placebo i 6 veckors, dubbelblinda, placebokontrollerade studier (studierna 1 och 2) listas i tabell 2 nedan.
Behandling av lätt till måttligt aktiv ulcerös kolit hos pediatriska patienter 5 till 17 år gamla
En randomiserad, dubbelblind, 6-veckors studie av 2 dosnivåer av Asacol (studie 3) utfördes på 82 pediatriska patienter i åldern 5 till 17 år med mild till måttligt aktiv ulcerös kolit. Alla patienter delades in efter kroppsviktskategori (17 till mindre än 33 kg, 33 till mindre än 54 kg och 54 till 90 kg) och tilldelades slumpmässigt att få en låg dos (1,2, 2,0 och 2,4 g/dag för respektive kroppsviktskategori) eller en hög dos (2,0, 3,6 och 4,8 g/dag).
Den höga dosen är inte en godkänd dos eftersom den inte visade sig vara effektivare än den godkända dosen [se DOSERING OCH ADMINISTRERING och Kliniska studier ].
Varaktigheten av exponeringen för mesalamin bland de 82 patienterna i studien varierade från 12 till 50 dagar (genomsnitt av 40 dagar i varje dosgrupp). Majoriteten (88 procent) av patienterna i varje grupp behandlades i mer än 5 veckor. Tabell 3 ger en sammanfattning av de specifika rapporterade biverkningarna (AR).
Tolv procent av patienterna i lågdosgruppen och 5 procent av patienterna i högdosgruppen hade allvarliga biverkningar (AR). Ulcerös kolit rapporterades som en allvarlig AR i en patient i varje grupp. Andra allvarliga bihåleinflammationer bestod av bihåleinflammation, buksmärtor, minskat kroppsmassaindex, adenovirusinfektion, blodig diarré, skleroserande kolangit och pankreatit hos en patient vardera i lågdosgruppen och anemi och synkope hos en patient vardera i högdosgruppen.
Sju patienter drogs ur studien på grund av AR: 5 (12 procent) i lågdosgruppen (ulcerös kolit, adenovirusinfektion, skleroserande kolangit, pankreatit) och 2 (5 procent) i högdosgruppen (ökat amylas och ökat lipas smärta i övre delen av buken).
Generellt sett liknade karaktären och svårighetsgraden av reaktioner i den pediatriska populationen de som rapporterats i vuxna populationer av patienter med ulcerös kolit.
Upprätthållande av remission av ulcerös kolit hos vuxna
I en 6-månaders placebokontrollerad underhållsstudie som involverade 264 patienter (studie 4), varav 177 randomiserades till Asacol, avbröt sex (3,4 procent) av patienterna som använde Asacol behandlingen på grund av biverkningar, jämfört med fyra (4,6 procent) av patienter som använder placebo [se Kliniska studier ]. Medelåldern för patienterna i studie 4 var 42 år och 55 procent av patienterna var män. Biverkningar som ledde till studieabstinens hos patienter som använder Asacol inkluderade (var och en hos en patient): ångest; huvudvärk; klåda; minskad libido; Reumatoid artrit; och stomatit och asteni.
Utöver de reaktioner som anges i tabell 2 inträffade följande biverkningar hos patienter som använde Asacol med en frekvens på 2 procent eller mer i studie 4: bukförstoring, gastroenterit, gastrointestinala blödningar, infektion, ledsjukdom, migrän, nervositet, parestesi, rektal störning, rektal blödning, avföringsavvikelser, tenesmus, urinfrekvens, vasodilatation och synavvikelser.
Hos 3342 patienter i okontrollerade kliniska studier inträffade följande biverkningar med en frekvens av 5 procent eller mer och verkade öka i frekvens med ökande dos: asteni, feber, influensasyndrom, smärta, buksmärta, ryggsmärta, flatulens, gastrointestinala blödningar artralgi och rinit.
Erfarenhet efter marknadsföring
Utöver de biverkningar som rapporterats ovan i kliniska prövningar som involverar Asacol, har de biverkningar som listas nedan identifierats efter användning av Asacol 400mg och andra mesalamininnehållande produkter. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Kroppen som helhet: Nacksmärta, ansiktsödem, ödem, lupusliknande syndrom, drogfeber.
Kardiovaskulär: Perikardit, myokardit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Gastrointestinala: Anorexi, pankreatit, gastrit, ökad aptit, kolecystit, muntorrhet, munsår, perforerat magsår blodig diarré.
Hematologiska: Agranulocytos aplastisk anemi, trombocytopeni, eosinofili, leukopeni, anemi, lymfadenopati.
Muskuloskeletala: Gikt.
Nervös: Depression, somnolens, emotionell labilitet, hyperestesi, svindel, förvirring, tremor, perifer neuropati, transversell myelit, Guillain-Barrés syndrom.
Njur: Njursvikt, interstitiell nefrit, minimal förändringsnefropati [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Andningsorgan/lung: Eosinofil lunginflammation, interstitiell pneumonit, astmaexacerbation, pleurit.
Hud: Alopeci, psoriasis, pyoderma gangrenosus, torr hud, erythema nodosum, urtikaria.
Särskilda sinnen: Ögonsmärta, smakperversion, dimsyn, tinnitus.
Urogenital: Dysuri, urinbrist, hematuri, epididymit, menorragi, reversibel oligospermi.
Laboratorieavvikelser: Förhöjd AST (SGOT) eller ALAT (SGPT), förhöjt alkaliskt fosfatas, förhöjt GGT, förhöjt LDH, förhöjt bilirubin, förhöjt serumkreatinin och BUN.

LÄKEMEDELSINTERAKTIONER
Inga formella läkemedelsinteraktionsstudier har utförts med Asacol 400mg med andra läkemedel. Följande interaktioner mellan produkter som innehåller mesalamin och andra läkemedel har dock rapporterats.
Nefrotoxiska medel, inklusive icke-steroida antiinflammatoriska läkemedel
Samtidig användning av mesalamin och kända nefrotoxiska medel, inklusive icke-steroida antiinflammatoriska läkemedel (NSAID) kan öka risken för njurreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Azatioprin eller 6-merkaptopurin
Samtidig användning av mesalamin och azatioprin eller 6-merkaptopurin kan öka risken för blodsjukdomar.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Nedsatt njurfunktion
Nedsatt njurfunktion, inklusive nefropati med minimal förändring, akut och kronisk interstitiell nefrit och njursvikt, har rapporterats hos patienter som tar produkter som Asacol 400 mg som innehåller mesalamin eller omvandlas till mesalamin.
Det rekommenderas att patienter utvärderar njurfunktionen innan Asacol 400 mg påbörjas och regelbundet under behandlingen.
Förskrivare bör noggrant utvärdera riskerna och fördelarna med att använda Asacol till patienter med känd njurfunktionsnedsättning eller tidigare njursjukdom [se LÄKEMEDELSINTERAKTIONER och Icke-klinisk toxikologi ].
Mesalamin-inducerat akut intoleranssyndrom
Mesalamin har associerats med ett akut intoleranssyndrom som kan vara svårt att skilja från en exacerbation av ulcerös kolit. Även om den exakta frekvensen av förekomsten inte har fastställts, har den förekommit i 3 procent av kontrollerade kliniska prövningar av mesalamin eller sulfasalazin. Symtomen inkluderar kramper, buksmärtor, blodig diarré och ibland feber, huvudvärk och utslag. Observera patienterna noga för försämring av dessa symtom under behandling. Om akut intoleranssyndrom misstänks, avbryt behandlingen med Asacol omedelbart.
Överkänslighetsreaktioner
Vissa patienter som har upplevt en överkänslighetsreaktion mot sulfasalazin kan få en liknande reaktion som Asacol 400 mg eller andra föreningar som innehåller eller omvandlas till mesalamin.
Mesalamininducerade hjärtöverkänslighetsreaktioner (myokardit och perikardit) har rapporterats med Asacol och andra mesalaminläkemedel. Försiktighet bör iakttas vid förskrivning av detta läkemedel till patienter med tillstånd som predisponerar dem för utveckling av myokardit eller perikardit.
Leversvikt
Det har rapporterats om leversvikt hos patienter med redan existerande leversjukdom som har fått mesalamin. Försiktighet bör iakttas vid administrering av Asacol till patienter med leversjukdom.
Långvarig magretention hos patienter med övre gastrointestinala obstruktion
Organisk eller funktionell obstruktion i den övre mag-tarmkanalen kan orsaka förlängd magretention av Asacol 400mg vilket skulle fördröja frisättningen av mesalamin i tjocktarmen.
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Mesalamin var inte cancerframkallande vid dietdoser på upp till 480 mg/kg/dag hos råttor och 2000 mg/kg/dag hos möss, vilket är cirka 2,9 och 6,1 gånger den maximala rekommenderade underhållsdosen av Asacol 400 mg på 1,6 g/dag eller 26,7 mg/kg/dag, baserat på 60 kg kroppsvikt, respektive baserat på kroppsyta.
Mutagenes
Mesalamin var negativ i Ames-analysen för mutagenes, negativ för induktion av systerkromatidutbyten (SCE) och kromosomavvikelser i äggstocksceller från kinesisk hamster in vitro, och negativ för induktion av mikrokärnor (MN) i polykromatiska erytrocyter av benmärg hos mus.
Nedsatt fertilitet
Mesalamin, vid orala doser upp till 480 mg/kg/dag (cirka 1,9 gånger den rekommenderade humana behandlingsdosen på basis av kroppsyta), visade sig inte ha någon effekt på fertilitet eller reproduktionsförmåga hos han- och honråttor.
Användning i specifika populationer
Graviditet
Graviditetskategori C
Risksammanfattning
Det finns inga adekvata och välkontrollerade studier av Asacol 400 mg användning hos gravida kvinnor. Begränsade publicerade humandata om mesalamin visar ingen ökning av den totala frekvensen av medfödda missbildningar. Vissa data visar en ökad frekvens av för tidig födsel, dödfödsel och låg födelsevikt; emellertid är dessa negativa graviditetsutfall också associerade med aktiv inflammatorisk tarmsjukdom. Vidare har alla graviditeter, oavsett läkemedelsexponering, en bakgrundsfrekvens på 2 till 4 procent för stora missbildningar och 15 till 20 procent för graviditetsbortfall. Inga tecken på fosterskada observerades i reproduktionsstudier på djur av mesalamin på råttor och kaniner vid orala doser cirka 1,9 gånger (råtta) och 3,9 gånger (kanin) den rekommenderade dosen för människor. Dibutylftalat (DBP) är dock en inaktiv ingrediens i Asacols magsaftresistenta beläggning, och i djurstudier på råttor vid doser högre än 190 gånger den mänskliga dosen baserat på kroppsyta, var moderns DBP associerat med yttre missbildningar och skelettmissbildningar och negativa effekter på det manliga reproduktionssystemet. Asacol 400 mg ska endast användas under graviditet om den potentiella nyttan överväger den potentiella risken för fostret.
Mänskliga data
Mesalamin passerar moderkakan. I prospektiva och retrospektiva studier av över 600 kvinnor som exponerats för mesalamin under graviditet, var den observerade frekvensen av medfödda missbildningar inte högre än bakgrundsfrekvensen i den allmänna befolkningen. Vissa data visar en ökad frekvens av för tidig födsel, dödfödsel och låg födelsevikt, men det är oklart om detta berodde på underliggande moderns sjukdom, läkemedelsexponering eller bådadera, eftersom aktiv inflammatorisk tarmsjukdom också är associerad med negativa graviditetsresultat.
Djurdata
Reproduktionsstudier med mesalamin utfördes under organogenes på råttor och kaniner vid orala doser upp till 480 mg/kg/dag. Det fanns inga tecken på nedsatt fertilitet eller skada på fostret. Dessa mesalamindoser var cirka 1,9 gånger (råtta) och 3,9 gånger (kanin) den rekommenderade dosen för människor, baserat på kroppsyta.
Dibutylftalat (DBP) är en inaktiv ingrediens i Asacols enterobeläggning. Människans dagliga intag av DBP från den maximala rekommenderade dosen av Asacol-tabletter är cirka 21 mg. Publicerade rapporter om råttor visar att hanråttavkommor som exponerats in utero för DBP (större än eller lika med 100 mg/kg/dag, cirka 39 gånger den mänskliga dosen baserat på kroppsyta), uppvisar avvikelser i reproduktionssystemet som är förenliga med störningar av androgenberoende utveckling. Den kliniska betydelsen av detta fynd hos råttor är okänd. Vid högre doser (större än eller lika med 500 mg/kg/dag, cirka 194 gånger den mänskliga dosen baserat på kroppsyta), minskade ytterligare effekter, inklusive kryptorchidism, hypospadi, atrofi eller agenesi av könstillbehör, testikelskada, dagligen. spermieproduktion, permanent retention av bröstvårtor och minskat anogenitalt avstånd noteras. Kvinnliga avkommor är opåverkade. Höga doser av DBP, administrerade till gravida råttor var associerad med ökad förekomst av utvecklingsavvikelser, såsom gomspalt (större än eller lika med 630 mg/kg/dag, cirka 244 gånger den mänskliga dosen, baserat på kroppsyta) och skelett abnormiteter (större än eller lika med 750 mg/kg/dag, cirka 290 gånger den mänskliga dosen baserat på kroppsyta) hos avkomman.
Ammande mödrar
Mesalamin och dess N-acetylmetabolit finns i bröstmjölk. I publicerade amningsstudier varierade maternal mesalamindoser från olika orala och rektala formuleringar och produkter från 500 mg till 3 g dagligen. Koncentrationen av mesalamin i mjölk varierade från icke-detekterbar till 0,11 mg/L. Koncentrationen av N-acetyl-5-aminosalicylsyrametaboliten varierade från 5 till 18,1 mg/L. Baserat på dessa koncentrationer är uppskattade dagliga doser för ett spädbarn som endast ammas 0 till 0,017 mg/kg/dag av mesalamin och 0,75 till 2,72 mg/kg/dag av N-acetyl-5-aminosalicylsyra.
Dibutylftalat (DBP), en inaktiv ingrediens i enterodrageringen av Asacol 400 mg tabletter, och dess primära metabolit monobutylftalat (MBP) utsöndras i bröstmjölk. Den kliniska betydelsen av detta har inte fastställts.
Utvecklings- och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av Asacol 400 mg och eventuella negativa effekter på det ammade barnet från läkemedlet eller från det underliggande moderns tillståndet. Iaktta försiktighet när Asacol 400 mg ges till en ammande kvinna.
Pediatrisk användning
Säkerheten och effektiviteten av Asacol 400 mg hos pediatriska patienter 5 till 17 år för behandling av lätt till måttligt aktiv ulcerös kolit har fastställts under en 6-veckorsperiod. Användning av Asacol i dessa åldersgrupper stöds av bevis från adekvata och välkontrollerade studier av Asacol 400 mg på vuxna och en enda studie på pediatriska patienter [se NEGATIVA REAKTIONER , KLINISK FARMAKOLOGI och Kliniska studier ].
Asacol 400 mg studerades i en randomiserad, dubbelblind, 6-veckors behandlingsstudie med parallellgrupp av två dosnivåer av Asacol 400 mg hos 82 pediatriska patienter i åldern 5 till 17 år med mild till måttligt aktiv ulcerös kolit. Alla patienter delades in efter viktkategori (17 till mindre än 33 kg, 33 till mindre än 54 kg och 54 till 90 kg) och tilldelades slumpmässigt en låg dos (1,2, 2,0 och 2,4 g/dag för respektive vikt) kategori) eller en hög dos (2,0, 3,6 och 4,8 g/dag). Baslinje- och screeningbesök följdes av en behandlingsperiod på 6 veckor [se DOSERING OCH ADMINISTRERING ]. Den höga dosen var inte effektivare än den låga dosen och är inte en godkänd dos [se Kliniska studier ].
Säkerheten och effekten av Asacol hos pediatriska patienter under 5 år har inte fastställts. Säkerheten och effektiviteten av Asacol vid upprätthållande av remission av ulcerös kolit hos pediatriska patienter har inte fastställts.
Geriatrisk användning
Kliniska studier av Asacol inkluderade inte tillräckligt många försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Annan rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion och samtidig sjukdom eller annan läkemedelsbehandling hos äldre patienter beaktas vid förskrivning av Asacol. Rapporter från okontrollerade kliniska studier och rapporteringssystem efter marknadsföring tyder på en högre förekomst av bloddyskrasier, det vill säga agranulocytos, neutropeni, pancytopeni, hos patienter som får Asacol och som är 65 år eller äldre. Försiktighet bör iakttas för att noggrant övervaka antalet blodkroppar under behandling med Asacol.
Nedsatt njurfunktion
Mesalamin är känt för att utsöndras till stor del via njurarna, och risken för toxiska reaktioner på detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör försiktighet iakttas när denna läkemedelsbehandling förskrivs. Det rekommenderas att alla patienter gör en utvärdering av njurfunktionen innan behandlingen med Asacol påbörjas och regelbundet under behandlingen med Asacol [se DOSERING OCH ADMINISTRERING , VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
ÖVERDOS
Det finns ingen specifik motgift mot överdosering av mesalamin och behandling för misstänkt akut allvarlig toxicitet med Asacol bör vara symtomatisk och stödjande. Detta kan inkludera förhindrande av ytterligare absorption i mag-tarmkanalen, korrigering av vätskeelektrolytbalans och underhåll av adekvat njurfunktion. Asacol 400mg är en pH-beroende produkt med fördröjd frisättning och denna faktor bör beaktas vid behandling av en misstänkt överdos.
KONTRAINDIKATIONER
Asacol är kontraindicerat hos patienter med känd överkänslighet mot salicylater eller aminosalicylater eller mot något av ingredienserna i Asacol [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , NEGATIVA REAKTIONER , och BESKRIVNING ].
ASACOL (mesalamin) tabletter med fördröjd frisättning, för oral användning
KLINISK FARMAKOLOGI
Handlingsmekanism
Verkningsmekanismen för mesalamin är okänd, men verkar vara aktuell snarare än systemisk. Slemhinneproduktion av arakidonsyrametaboliter, både genom cyklooxygenasvägarna, det vill säga prostanoider, och genom lipoxygenasvägarna, det vill säga leukotriener och hydroxieikosatetraensyror, ökar hos patienter med kronisk ulcerös kolit, och det är möjligt att mesalamin minskar inflammationen blockerar cyklooxygenas och hämmar prostaglandinproduktionen i tjocktarmen.
Farmakokinetik
Absorption
Ungefär 28 procent av mesalamin i Asacol 400mg tabletter absorberas efter oralt intag. Absorptionen av mesalamin är liknande hos fastande och matade personer. T max för mesalamin och dess metabolit är vanligtvis försenat, vilket återspeglar den fördröjda frisättningen, och varierar från 4 till 16 timmar.
Ämnesomsättning
Den absorberade mesalaminen acetyleras snabbt i tarmslemhinnan och i levern till N-acetyl-5aminosalicylsyra.
Exkretion
Absorberad mesalamin utsöndras huvudsakligen via njurarna som N-acetyl-5-aminosalicylsyra. Oabsorberat mesalamin utsöndras i avföring.
Efter intravenös administrering rapporteras eliminationshalveringstiden för mesalamin vara cirka 40 minuter. Efter oral dosering är de terminala t½-värdena för mesalamin och N-acetyl-5-aminosalicylsyra vanligtvis cirka 12 timmar, men varierar från 2 till 15 timmar. Det finns en stor variation mellan individer och intra-individer i plasmakoncentrationerna av mesalamin och N-acetyl-5aminosalicylsyra och i deras halveringstider för eliminering efter administrering av Asacol.
Specifika populationer
Pediatriska patienter
I en dosvarierande farmakokinetisk studie som utvärderade 30, 60 och 90 mg/kg/dag doser av Asacol 400 mg administrerat två gånger dagligen under fyra veckor, varierade medelvärdena Cavg för mesalamin hos pediatriska ulcerös kolitpatienter från cirka 400 ng/ml till 2100 ng /ml baserat på data från alla dosnivåer.
en studie på pediatriska ulcerös kolitpatienter (studie 3) var medelplasmakoncentrationerna av mesalamin (baserat på glesa provtagningar) 820 till 988 ng/ml vid låg dosnivå (det vill säga 1,2, 2,0 eller 2,4 g/dag baserat på kroppsviktsskikt på 17 till mer än 33 kg, 33 till mindre än 54 kg respektive 54 till mindre än 90 kg).
Djurtoxikologi och/eller farmakologi
I djurstudier (råttor, möss, hundar) var njuren det huvudsakliga organet för toxicitet. (I det följande baseras jämförelser av djurdosering med rekommenderad humandosering på kroppsyta och en dos på 2,4 g/dag för en person på 60 kg.)
Mesalamin orsakar njurpapillär nekros hos råttor vid engångsdoser på cirka 750 mg/kg till 1000 mg/kg (ungefär 3 till 4 gånger den rekommenderade dosen för människa baserat på kroppsyta). Doser på 170 och 360 mg/kg/dag (cirka 0,7 och 1,5 gånger den rekommenderade humana dosen baserat på kroppsyta) som gavs till råttor under sex månader gav papillär nekros, papillärt ödem, tubulär degeneration, tubulär mineralisering och urotelial hyperplasi.
Hos möss gav orala doser av 4000 mg/kg/dag mesalamin (cirka 8 gånger den rekommenderade dosen för människor baserat på kroppsyta) under tre månader tubulär nefros, multifokal/diffus tubulo-interstitiell inflammation och multifokal/diffus papillär nekros.
Hos hundar resulterade engångsdoser om 6000 mg (ungefär 8 gånger den rekommenderade dosen för människor baserat på kroppsyta) av mesalamintabletter med fördröjd frisättning i njurpapillär nekros men var inte dödlig. Njurförändringar har inträffat hos hundar som fått kronisk administrering av mesalamin i doser på 80 mg/kg/dag (1,1 gånger den rekommenderade dosen för människor baserat på kroppsyta).
Kliniska studier
Behandling av mild till måttligt aktiv ulcerös kolit
Vuxna
Två placebokontrollerade studier (studierna 1 och 2) har visat effekten av Asacol tabletter hos patienter med lätt till måttligt aktiv ulcerös kolit.
en randomiserad, dubbelblind multicenterstudie med 158 patienter (studie 1) jämfördes Asacol-doser på 1,6 g/dag och 2,4 g/dag under 6 veckor med placebo. Poängsystemet för bestämning av behandlingseffektivitet inkluderade bedömning av avföringsfrekvens, rektal blödning, sigmoidoskopiska fynd, patientens funktionsbedömning och läkares globala bedömning. Vid dosen 2,4 g/dag visade 21 av 43 (49 procent) patienter som använde Asacol-tabletter en förbättring av sigmoidoskopiskt utseende av tarmen jämfört med 12 av 44 (27 procent) patienter som använde placebo (p = 0,048). Dessutom visade signifikant fler patienter i gruppen Asacol tabletter 2,4 g/dag förbättring av rektal blödning och avföringsfrekvens. Dosen på 1,6 g/dag gav inte konsekventa bevis på effektivitet.
en andra randomiserad, dubbelblind, placebokontrollerad klinisk prövning på 6 veckor på 87 patienter (studie 2), resulterade Asacol-tabletter, i en dos på 4,8 g/dag, under 6 veckor, i sigmoidoskopisk förbättring hos 28 av 38 (74 procent) patienter jämfört med 10 av 38 (26 procent) placebopatienter (p mindre än 0,001). Dessutom visade fler patienter i gruppen Asacol 400 mg tabletter 4,8 g/dag än placebogruppen förbättring av de övergripande symtomen.
Dosen på 4,8 g/dag är inte en godkänd dos för behandling av lätt till måttligt aktiv ulcerös kolit.
Pediatrik
Säkerheten och effektiviteten av Asacol 400 mg hos pediatriska patienter i åldern 5 till 17 år för behandling av lätt till måttligt aktiv ulcerös kolit stöds av bevis från adekvata och välkontrollerade studier av Asacol 400 mg på vuxna och en enda studie på pediatriska patienter.
En randomiserad, dubbelblind, 6-veckors studie av 2 dosnivåer av Asacol (studie 3) utfördes på 82 pediatriska patienter i åldern 5 till 17 år med mild eller måttligt aktiv ulcerös kolit. Alla patienter delades in efter viktkategori (17 till mindre än 33 kg, 33 till mindre än 54 kg och 54 till 90 kg) och tilldelades slumpmässigt en låg dos (1,2, 2,0 och 2,4 g/dag för respektive vikt) kategori) eller en hög dos (2,0, 3,6 och 4,8 g/dag). Doser administrerades var 12:e timme.
Andelen patienter som uppnådde framgång baserat på Truncated Mayo Score (TM-Mayo) (baserat på avföringsfrekvensen och rektal blödningssubscore av Mayo Score) och baserat på Pediatric Ulcerative Colitis Activity Index (PUCAI) (som inkluderade bedömning av buksmärtor, rektal blödning, avföringskonsistens och frekvens, närvaro av nattlig tarmrörelse och aktivitetsnivå) mättes efter 6 veckors behandling. Framgång baserad på TM-Mayo definierades som antingen partiell respons (förbättring från baslinjen i avföringsfrekvens eller rektal blödningssubpoäng utan försämring i den andra) eller fullständig respons (både avföringsfrekvens och rektalblödningssubpoäng lika med 0). Framgång baserad på PUCAI definierades som antingen partiell respons (PUCAI-reduktion på större än eller lika med 20 poäng från baslinje till vecka 6 med poäng för vecka 6 större än eller lika med 10) eller fullständig respons (PUCAI mindre än 10 vid vecka 6).
Det fanns 41 patienter i lågdosgruppen och 41 patienter i högdosgruppen som fick minst en dos Asacol; 36 patienter i varje dosgrupp fullföljde studien. Patienter ansågs misslyckade med behandlingen om de inte nådde framgång eller hoppade av på grund av biverkningar eller bristande effekt.
Vid vecka 6 uppnådde 73,2 procent av patienterna i lågdosgruppen och 70,0 procent av patienterna i högdosgruppen framgång baserat på TM-Mayo; 34,1 procent av patienterna i lågdosgruppen och 42,5 procent av patienterna i högdosgruppen uppnådde fullständigt svar. Vid vecka 6 uppnådde 56,1 procent av patienterna i lågdosgruppen och 55,0 procent av patienterna i högdosgruppen framgång baserat på PUCAI; 46,3 procent av patienterna i lågdosgruppen och 42,5 procent av patienterna i högdosgruppen uppnådde fullständigt svar.
Den höga dosen var inte effektivare än den låga dosen och är inte en godkänd dos [se DOSERING OCH ADMINISTRERING ].
Underhåll av remission av ulcerös kolit hos vuxna
En 6 månader lång, randomiserad, dubbelblind, placebokontrollerad, multicenterstudie (studie 4) involverade 264 patienter som behandlades med Asacol 400 mg tabletter 0,8 g/dag (n = 90), 1,6 g/dag (n = 87) , eller placebo (n = 87). I 0,8 g/dag-armen doserades patienterna två gånger dagligen; i 1,6 g/dag-armen doserades patienterna fyra gånger dagligen. Andelen patienter som behandlades med 0,8 g/dag som bibehöll endoskopisk remission var inte statistiskt signifikant jämfört med placebo. Andelen patienter som använde Asacol tabletter 1,6 g/dag som bibehöll endoskopisk remission av ulcerös kolit var hos 61 av 87 (70,1 procent) jämfört med 42 av 87 (48,3 procent) av placebopatienterna (p = 0,005).
En samlad effektanalys av 4 underhållsstudier jämförde Asacol 400 mg tabletter, i doser på 0,8 g/dag till 2,8 g/dag, i uppdelade doser från två gånger dagligen till fyra gånger per dag, med sulfasalazin, i doser på 2 g/dag till 4 g/dag. Behandlingsframgång sågs hos 59 av 98 (59 procent) patienter som använde Asacol-tabletter och 70 av 102 (69 procent) av patienterna som använde sulfasalazin, en icke-signifikant skillnad.
PATIENTINFORMATION
- Instruera patienterna att svälja Asacol-tabletterna hela, var noga med att inte bryta, skära eller tugga tabletterna, eftersom beläggningen är en viktig del av formuleringen med fördröjd frisättning.
- Informera patienterna om att om de byter från en tidigare oral mesalaminbehandling till Asacol bör de avbryta sin tidigare orala mesalaminbehandling och följa doseringsinstruktionerna för Asacol. Informera patienterna om att de inte ska ersätta två Asacol 400 mg tabletter med en Asacol 400mg HD 800 mg tablett [se DOSERING OCH ADMINISTRERING ].
- Informera patienter om att intakta, delvis intakta och/eller tablettskal har rapporterats i avföringen. Instruera patienterna att kontakta sin läkare om detta inträffar upprepade gånger.
- Instruera patienterna att skydda Asacol 400 mg tabletter från fukt. Instruera patienterna att stänga behållaren tätt och att lämna kvar eventuella torkmedelspåsar i flaskan tillsammans med tabletterna.
- Informera kvinnor som är gravida, ammar eller är i fertil ålder att Asacol 400mg innehåller dibutylftalat, som var associerat med missbildningar och negativa effekter på det manliga reproduktionssystemet i djurstudier. Dibutylftalat utsöndras i modersmjölk.
