Furadantin 100mg Nitrofurantoin Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Furadantin 100mg och hur används det?
Furadantin (nitrofurantoin oral suspension) är ett antibiotikum som används för att behandla urinvägsinfektioner. Furadantin finns i generisk form.
Vilka är biverkningarna av Furadantin?
Vanliga biverkningar av Furadantin inkluderar:
- illamående,
- kräkningar,
- aptitlöshet,
- orolig mage,
- diarre,
- huvudvärk,
- yrsel,
- dåsighet,
- rostfärgad eller brunaktig urin, eller
- vaginal klåda eller flytningar.
Tala om för din läkare om du har sällsynta men mycket allvarliga biverkningar av Furadantin inklusive:
- ögonsmärta,
- synförändringar,
- mentala/humörsförändringar,
- ihållande eller svår huvudvärk,
- nya tecken på infektion (t.ex. feber, ihållande ont i halsen), eller
- lätta blåmärken eller blödningar.
BESKRIVNING
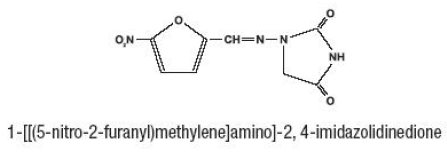
Furadantin (nitrofurantoin), en syntetisk kemikalie, är en stabil, gul, kristallin förening. Furadantin är ett antibakteriellt medel för specifika urinvägsinfektioner. Furadantin finns i 25 mg/5 ml flytande suspension för oral administrering.
Inaktiva Ingredienser
Furadantin Oral Suspension innehåller karboximetylcellulosanatrium, citronsyra, smakämnen, glycerin, magnesiumaluminiumsilikat, metylparaben, propylparaben, renat vatten, natriumcitrat och sorbitol.
INDIKATIONER
Furadantin är specifikt indicerat för behandling av urinvägsinfektioner på grund av känsliga stammar av Escherichia coli, enterokocker, Staphylococcus aureus och vissa känsliga stammar av Klebsiella- och Enterobacter-arter.
Nitrofurantoin är inte indicerat för behandling av pyelonefrit eller perinefri böld.
Nitrofurantoiner saknar den bredare vävnadsfördelningen av andra terapeutiska medel som är godkända för urinvägsinfektioner. Följaktligen många patienter som behandlas med Furadantin är predisponerade för ihållande eller återuppträdande av bakteriuri. Urinprover för odlings- och känslighetstestning bör tas före och efter avslutad behandling. Om ihållande eller återuppträdande av bakteriuri inträffar efter behandling med Furadantin , bör andra terapeutiska medel med bredare vävnadsfördelning väljas. När man överväger användningen av Furadantin , bör lägre utrotningshastigheter balanseras mot den ökade potentialen för systemisk toxicitet och för utveckling av antimikrobiell resistens när medel med bredare vävnadsfördelning används.
DOSERING OCH ADMINISTRERING
Furadantin bör ges tillsammans med mat för att förbättra läkemedelsabsorptionen och, hos vissa patienter, toleransen.
Vuxna
50-100 mg fyra gånger om dagen - den lägre dosnivån rekommenderas för okomplicerade urinvägsinfektioner.
Pediatriska patienter
5-7 mg/kg kroppsvikt per 24 timmar, givet i fyra uppdelade doser (kontraindicerat under en månads ålder).
Följande tabell är baserad på en medelvikt i varje intervall som får 5 till 6 mg/kg kroppsvikt per 24 timmar, givet i fyra uppdelade doser. Den kan användas för att beräkna en genomsnittlig dos av Furadantin Oral suspension (25 mg/5 ml) för pediatriska patienter.
Behandlingen ska fortsätta i en vecka eller i minst 3 dagar efter att urinen är steril. Fortsatt infektion indikerar behov av omvärdering.
För långvarig suppressiv behandling hos vuxna kan en minskning av dosen till 50-100 mg vid sänggåendet vara tillräcklig. För långvarig suppressiv terapi hos pediatriska patienter kan doser så låga som 1 mg/kg per 24 timmar, givet i en engångsdos eller i två uppdelade doser, vara adekvata. SER AVSNITT VARNINGAR ANGÅENDE RISKER FÖRENADE MED LÅNGVARIG TERAPI .
HUR LEVERERAS
Furadantin Oral suspension finns tillgänglig i:
NDC 70199-006-32 PET bärnstensfärgad flaska på 230 ml
Undvik exponering för starkt ljus som kan göra läkemedlet mörkare. Det är stabilt vid förvaring mellan 20°-25°C (68°-77°F); utflykter tillåtna till 15°-30°C (59°-86°F) [Se USP-kontrollerad rumstemperatur ]. Skydda mot frysning. Skaka kraftigt. Fördela i tät, ljusbeständig plast (PET) eller glasbehållare.
Använd inom 30 dagar.
Förvara utom räckhåll för barn.
Tillverkad för: Casper Pharma LLC, East Brunswick NJ 08816. Reviderad: Dec 2020
BIEFFEKTER
Andningsorgan
KRONISKA, SUBAKUTA ELLER AKUTA LUNNGÖVERKÄNSLIGHETSREAKTIONER KAN FÖRKOMMA.
KRONISKA LUNGREAKTIONER KAN ALLMÄNT HOS PATIENTER SOM HAR FÅTT KONTINUERLIG BEHANDLING I SEX MÅNADER ELLER LÄNGE. ISLAGSMÅL, DYSPNÉ VID ANVÄNDNING, HOSTA OCH FÖRÄNDRAD LUNNGFUNKTION ÄR VANLIGA MANIFESTATIONER SOM KAN FÖRKOMMA SMIDIGT. RADIOLOGISKA OCH HISTOLOGISKA FYND AV DIFFULL INTERSTITIELL PNEUMONIT ELLER FIBROS, ELLER BÅDA, ÄR OCKSÅ VANLIGA MANIFESTATIONER AV DEN KRONISKA LUNGREAKTIONEN. FEBER ÄR sällan framträdande.
ALLVARLIGHETEN PÅ KRONISKA LUNGREAKTIONER OCH DERAS UPPLÖSNINGSGRAD VISAS ATT HA RELATERADE TILL TERAPIENS LÅNGD EFTER DET FÖRSTA KLINISKA TECKNEN VISAS. LUNNGFUNKTIONEN KAN FÖRSKRÄVAS PERMANENT, ÄVEN EFTER AVBROTT AV BEHANDLING. RISKEN ÄR STÖRRE NÄR KRONISKA LUNGREAKTIONER INTE UPPTÄCKS TIDIGT.
Vid subakuta lungreaktioner förekommer feber och eosinofili mindre ofta än i den akuta formen. Efter avslutad behandling kan återhämtningen ta flera månader. Om symtomen inte upptäcks som läkemedelsrelaterade och nitrofurantoinbehandlingen inte avbryts, kan symtomen bli allvarligare.
Akuta lungreaktioner manifesteras vanligen av feber, frossa, hosta, bröstsmärtor, dyspné, lunginfiltration med konsolidering av pleurautgjutning på röntgen och eosinofili.
Akuta reaktioner inträffar vanligtvis inom den första veckan av behandlingen och är reversibla när behandlingen avbryts. Upplösningen är ofta dramatisk. (ser VARNINGAR )
Förändringar i EKG (t.ex. icke-specifika ST/T-vågsförändringar, grenblock) har rapporterats i samband med lungreaktioner.
Cyanos har rapporterats i sällsynta fall.
Lever
Leverreaktioner, inklusive hepatit, kolestatisk gulsot, kronisk aktiv hepatit och hepatisk neuros, förekommer sällan. (ser VARNINGAR )
Neurologisk
Perifer neuropati, som kan bli allvarlig eller irreversibel, har inträffat. Dödsfall har rapporterats. Tillstånd som nedsatt njurfunktion (kreatininclearance under 60 ml per minut eller kliniskt signifikant förhöjt serumkreatinin), anemi, diabetes mellitus, elektrolytobalans, vitamin B-brist och försvagande sjukdomar kan öka risken för perifer neuropati (se VARNINGAR )
Asteni, svindel, nystagmus, yrsel, huvudvärk och dåsighet har också rapporterats vid användning av nitrofurantoin.
Benign intrakraniell hypertoni (pseudotumor cerebri), förvirring, depression, optikusneurit och psykotiska reaktioner har rapporterats i sällsynta fall. Utbuktande fontaneller, som ett tecken på benign intrakraniell hypertoni hos spädbarn, har rapporterats i sällsynta fall.
Dermatologiskt
Exfoliativ dermatit och erythema multiforme (inklusive Stevens-Johnsons syndrom) har rapporterats i sällsynta fall. Övergående alopeci har också rapporterats.
Allergisk
Ett lupusliknande syndrom associerat med pulmonella reaktioner på nitrofurantoin har rapporterats. Även angioödem; makulopapulära, erytematösa eller eksemösa utbrott; klåda; urtikaria; anafylaxi; artralgi; muskelvärk; drogfeber; och vaskulit (ibland förknippad med lungreaktioner) har rapporterats. Överkänslighetsreaktioner är de vanligaste spontant rapporterade biverkningarna i världsomfattande erfarenheter efter marknadsföring av nitrofurantoinformuleringar.
Gastrointestinala
Illamående, kräkningar och anorexi förekommer oftast. Buksmärtor och diarré är mindre vanliga gastrointestinala reaktioner. Dessa dosrelaterade reaktioner kan minimeras genom att minska dosen. Sialadenit och pankreatit har rapporterats. Det har förekommit sporadiska rapporter om pseudomembranös kolit vid användning av nitrofurantoin. Symtom på pseudomembranös kolit kan uppträda under eller efter antimikrobiell behandling. (ser VARNINGAR )
Hematologiska
Cyanos sekundär till methemoglobinemi har rapporterats i sällsynta fall.
Diverse
Som med andra antimikrobiella medel kan superinfektioner orsakade av resistenta organismer, t.ex. Pseudomonas-arter eller Candida-arter, förekomma. Det finns sporadiska rapporter om Clostridium difficile superinfektioner, eller pseudomembranös kolit, med användning av nitrofurantoin.
Laboratoriebiverkningar
Följande laboratoriebiverkningar har rapporterats vid användning av nitrofurantoin; ökad ASAT (SGOT), ökad ALAT (SGPT), minskat hemoglobin, ökat serumfosfor, eosinofili, glukos-6-fosfatdehydrogenasbristanemi (se VARNINGAR ), agranulocytos, leukopeni, granulocytopeni, hemolytisk anemi, trombocytopeni, megaloblastisk anemi. I de flesta fall försvann dessa hematologiska avvikelser efter avslutad behandling. Aplastisk anemi har rapporterats i sällsynta fall.
För att rapportera MISSTÄNKTA BIVERKNINGAR, kontakta Casper Pharma LLC. på 1-844-5-CASPER (1-844-522-7737) eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
LÄKEMEDELSINTERAKTIONER
Antacida som innehåller magnesiumtrisilikat, när de administreras samtidigt med nitrofurantoin, minskar både hastigheten och omfattningen av absorptionen. Mekanismen för denna interaktion är troligen adsorption av nitrofurantoin på ytan av magnesiumtrisilikat.
Urikosuriska läkemedel, såsom probenecid och sulfinpyrazon, kan hämma renal tubulär sekretion av nitrofurantoin. Den resulterande ökningen av nitrofurantoinserumnivåer kan öka toxiciteten, och de minskade urinnivåerna kan minska dess effektivitet som antibakteriellt medel i urinvägarna.
Läkemedels-/laboratorietestinteraktioner
Som ett resultat av närvaron av nitrofurantoin kan en falsk-positiv reaktion för glukos i urinen uppstå. Detta har observerats med Benedicts och Fehlings lösningar men inte med det enzymatiska glukostestet.
VARNINGAR
Lungreaktioner
AKUTA, SUBAKUTA ELLER KRONISKA LUNGREAKTIONER HAR OBSERVERATS HOS PATIENTER BEHANDLADE MED NITROFURANTOIN. OM DESSA REAKTIONER UPPFÖR BÖR FURADANTIN 100mg AVSLUTAS OCH LÄMPLIGA ÅTGÄRDER VIDTA. RAPPORTER HAR citerat lungreaktioner som en bidragande dödsorsak.
KRONISKA LUNGREAKTIONER (Diffus INTERSTITIELL PNEUMONIT ELLER LUNGFIBROS, ELLER BÅDA) KAN UTVECKLAS SMIDIGT. DESSA REAKTIONER FÖREKOMMER SÄLLAN OCH ALLMÄNT HOS PATIENTER SOM GÅR TERAPI I SEX MÅNADER ELLER LÄNGE. NÄRA ÖVERVAKNING AV LUNNGILLSTÅNDET HOS PATIENTER SOM GÅR LÅNGTIDSBEHANDLING GARANTERAS OCH KRÄVER ATT FÖRDELARNA MED TERAPI VÄGAS MOT POTENTIELLA RISKER. (se ANDNINGSREAKTIONER.)
Hepatotoxicitet
Leverreaktioner, inklusive hepatit, kolestatisk gulsot, kronisk aktiv hepatit och levernekros förekommer sällan. Dödsfall har rapporterats. Uppkomsten av kronisk aktiv hepatit kan vara smygande och patienter bör övervakas regelbundet för förändringar i biokemiska tester som skulle indikera leverskada. Om hepatit uppstår ska läkemedlet omedelbart sättas ut och lämpliga åtgärder vidtas.
Neuropati
Perifer neuropati, som kan bli allvarlig eller irreversibel, har inträffat. Dödsfall har rapporterats. Tillstånd som nedsatt njurfunktion (kreatininclearance under 60 ml per minut eller kliniskt signifikant förhöjt serumkreatinin), anemi, diabetes mellitus, elektrolytobalans, vitamin B-brist och försvagande sjukdom kan öka förekomsten av perifer neuropati. Patienter som får långtidsbehandling bör övervakas regelbundet med avseende på förändringar i njurfunktionen.
Optikusneurit har rapporterats i sällsynta fall efter marknadsföring av nitrofurantoinformuleringar.
Hemolytisk anemi
Fall av hemolytisk anemi av typen primakinkänslighet har inducerats av nitrofurantoin. Hemolys verkar vara kopplat till en glukos-6-fosfatdehydrogenasbrist i de röda blodkropparna hos de drabbade patienterna. Denna brist finns hos 10 procent av svarta och en liten andel av etniska grupper med ursprung i Medelhavet och nära öst. Hemolys är en indikation för att avbryta behandlingen Furadantin hemolys upphör när läkemedlet dras tillbaka.
Clostridium Difficile-associerad diarré
Clostridium difficile associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive Furadantin Oral suspension, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann medicinsk historia är nödvändig eftersom CDAD har rapporterats inträffa mer än två månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör sättas in efter klinisk indikation.
FÖRSIKTIGHETSÅTGÄRDER
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Nitrofurantoin var inte cancerframkallande när det gavs till Holtzman-honråttor i 44,5 veckor eller till Sprague-Dawley-honråttor i 75 veckor. Två kroniska bioanalyser av gnagare med användning av Sprague-Dawley-hanråttor och honråttor och två kroniska bioanalyser på schweiziska möss och BDF1-möss visade inga tecken på cancerogenicitet.
Nitrofurantoin visade bevis på karcinogen aktivitet hos B6C3F1-möss av honkön, vilket framgår av ökad förekomst av tubulära adenom, godartade blandade tumörer och granulosacelltumörer i äggstocken. Hos F344/N-råttor av hankön förelåg en ökad förekomst av ovanliga tubulära njurcellsneoplasmer, osteosarkom i benet och neoplasmer i subkutan vävnad. I en studie som involverade subkutan administrering av 75 mg/kg nitrofurantoin till gravida honmöss, observerades lungpapillära adenom av okänd betydelse i F1-generationen.
Nitrofurantoin har visat sig inducera punktmutationer i vissa stammar av Salmonella typhimurium och framåtmutationer på L5178Y muslymfomceller. Nitrofurantoin inducerade ökat antal systerkromatidutbyten och kromosomavvikelser i äggstocksceller från kinesisk hamster men inte i mänskliga celler i kultur. Resultaten av den könsbundna recessiva letala analysen i Drosophila var negativa efter administrering av nitrofurantoin genom utfodring eller genom injektion. Nitrofurantoin inducerade inte ärftlig mutation i de undersökta gnagarmodellerna.
Betydelsen av karcinogenicitet och mutagenicitet i förhållande till den terapeutiska användningen av nitrofurantoin hos människor är okänd.
Administrering av höga doser nitrofurantoin till råttor orsakar tillfälligt spermatogen stopp; detta är reversibelt vid utsättande av läkemedlet. Doser på 10 mg/kg/dag eller mer hos friska män kan, i vissa oförutsägbara fall, ge ett lätt till måttligt spermatogen stopp med en minskning av antalet spermier.
Graviditet
Teratogena effekter
Flera reproduktionsstudier har utförts på kaniner och råttor i doser upp till sex gånger den mänskliga dosen och har inte visat några tecken på försämrad fertilitet eller skada på fostret på grund av nitrofurantoin. I en enda publicerad studie utförd på möss med 68 gånger den mänskliga dosen (baserat på mg/kg administrerat till moderdjuret), observerades tillväxthämning och en låg förekomst av mindre och vanliga missbildningar. Men vid 25 gånger den humana dosen observerades inga fostermissbildningar; relevansen av dessa fynd för människor är osäker. Det finns dock inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Icke-teratogene effekter
Nitrofurantoin har i en publicerad transplacental karcinogenicitetsstudie visats inducera lungpapillära adenom hos F1-generationens möss vid doser 19 gånger den mänskliga dosen på mg/kg-basis. Förhållandet mellan detta fynd och potentiell human karcinogenes är för närvarande okänd. På grund av osäkerheten om de mänskliga implikationerna av dessa djurdata, bör detta läkemedel endast användas under graviditet om det verkligen behövs.
Arbete och leverans
Ser KONTRAINDIKATIONER .
Ammande mödrar
Nitrofurantoin har påvisats i human bröstmjölk i spårmängder. På grund av risken för allvarliga biverkningar från nitrofurantoin hos ammande spädbarn under en månads ålder, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern. (ser KONTRAINDIKATIONER )
Pediatrisk användning
Säkerhet och effektivitet av Furadantin hos nyfödda under en månads ålder har inte fastställts. (ser KONTRAINDIKATIONER )
ÖVERDOS
Enstaka incidenter av akut överdosering av Furadantin har inte resulterat i några specifika symtom förutom kräkningar. Induktion av kräkning rekommenderas. Det finns ingen specifik motgift, men ett högt vätskeintag bör upprätthållas för att främja urinutsöndring av läkemedlet. Det är dialyserbart.
KONTRAINDIKATIONER
Anuri, oliguri eller signifikant försämring av njurfunktionen (kreatininclearance under 60 ml per minut eller kliniskt signifikant förhöjt serumkreatinin) är kontraindikationer. Behandling av denna typ av patienter medför en ökad risk för toxicitet på grund av försämrad utsöndring av läkemedlet.
På grund av risken för hemolytisk anemi på grund av omogna erytrocytenzymsystem (glutationinstabilitet), är läkemedlet kontraindicerat hos gravida patienter vid termin (38-42 veckors graviditet), under förlossningen och förlossningen, eller när förlossningen är nära förestående. Av samma anledning är läkemedlet kontraindicerat hos nyfödda under en månads ålder.
Furadantin är kontraindicerat hos patienter med tidigare kolestatisk gulsot/leverdysfunktion i samband med nitrofurantoin. Furadantin är också kontraindicerat för patienter med känd överkänslighet mot nitrofurantoin.
KLINISK FARMAKOLOGI
Oralt administrerat Furadantin absorberas lätt och utsöndras snabbt i urinen. Blodkoncentrationerna vid terapeutisk dosering är vanligtvis låga. Det är mycket lösligt i urin, vilket kan ge en brun färg.
Efter en dosregim på 100 mg qid i 7 dagar, var den genomsnittliga urinläkemedelsåtervinningen (0-24 timmar) dag 1 och dag 7 42,7 % och 43,6 %.
Till skillnad från många läkemedel kan närvaron av mat eller medel som fördröjer magtömningen öka biotillgängligheten av Furadantin , förmodligen genom att tillåta bättre upplösning i magsaft.
Mikrobiologi
Verkningssätt
Nitrofurantoin reduceras av ett brett spektrum av enzymer inklusive bakteriella flavoproteiner till reaktiva intermediärer som är skadliga för makromolekyler som DNA och proteiner.
Korsmotstånd
Även om korsresistens med andra antimikrobiella medel kan förekomma, har korsresistens med sulfonamider inte observerats.
Interaktion med andra antimikrobiella medel
Antagonism har visats in vitro mellan nitrofurantoin och kinolonantimikrobiella medel. Nitrofurantoin, i form av nitrofurantoin oral suspension, har visat sig vara aktivt mot de flesta av följande bakterier både in vitro och vid kliniska infektioner: (Se INDIKATIONER OCH ANVÄNDNING ).
Gram-positiva aerober
Staphylococcus aureus Enterococcus arter
Gram-negativa aerober
Escherichia coli
OBS: Vissa stammar av Enterobacter-arter och Klebsiella-arter är resistenta mot nitrofurantoin.
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Nitrofurantoin uppvisar aktivitet in vitro mot följande bakterier; dock har säkerheten och effektiviteten för nitrofurantoin vid behandling av kliniska infektioner på grund av dessa bakterier inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Gram-positiva aerober
Koagulasnegativa stafylokocker (inklusive Staphylococcus epidermidis och Staphylococcus saprophyticus) Streptococcus agalactiaeViridans gruppstreptokocker
Gram-negativa aerober
Citrobacter koseriCitrobacter freundiiKlebsiella oxytoca
Nitrofurantoin är inte aktivt mot de flesta stammar av Proteus-arter eller Serratia-arter. Det har ingen aktivitet mot Pseudomonas-arter.
Känslighetstestning
För specifik information om tolkningskriterier för känslighetstest och tillhörande testmetoder och kvalitetskontrollstandarder erkända av FDA för detta läkemedel, se: http://www.fda.gov/STIC.
PATIENTINFORMATION
Patienter bör rådas att ta Furadantin med mat för att ytterligare öka toleransen och förbättra läkemedelsabsorptionen. Patienterna bör instrueras att slutföra hela terapiförloppet; de bör dock rådas att kontakta sin läkare om några ovanliga symtom skulle uppstå under behandlingen.
Diarré är ett vanligt problem som orsakas av antibiotika som vanligtvis upphör när antibiotikan avbryts. Ibland kan patienter efter påbörjad behandling med antibiotika utveckla vattnig och blodig avföring (med eller utan magkramper och feber) även så sent som två eller fler månader efter att ha tagit den sista dosen av antibiotikan. Om detta inträffar ska patienter kontakta sin läkare så snart som möjligt.
Patienter bör rådas att inte använda antacida preparat som innehåller magnesiumtrisilikat medan de tar Furadantin .
