Ceftin 250mg, 500mg, 125mg Cefuroxime Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Ceftin 500mg och hur används det?
Ceftin 500mg är ett receptbelagt läkemedel som används för att behandla symtom på bakteriella infektioner. Ceftin kan användas ensamt eller tillsammans med andra läkemedel.
Ceftin 250mg är ett cefalosporinantibiotikum.
Det är inte känt om Ceftin är säkert och effektivt för barn under 3 månaders ålder.
Vilka är de möjliga biverkningarna av Ceftin?
Ceftin 250mg kan orsaka allvarliga biverkningar inklusive:
- svåra magsmärtor,
- diarré (med eller utan blod),
- gulfärgning av hud eller ögon,
- hudutslag,
- blåmärken,
- svår stickningar eller domningar,
- anfall (kramper),
- svår eller smärtsam urinering,
- svullnad i dina fötter, vrister, ansikte eller tunga,
- trötthet,
- andnöd,
- feber,
- öm hals,
- brännande i dina ögon,
- hudsmärta med röda eller lila utslag,
- hudblåsor och peeling
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Ceftin inkluderar:
- diarre,
- illamående,
- kräkningar,
- ovanlig eller obehaglig smak i munnen,
- blöjutslag hos ett spädbarn,
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Ceftin. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
BESKRIVNING
CEFTIN 500 mg tabletter och CEFTIN för oral suspension innehåller cefuroxim som cefuroximaxetil. CEFTIN är ett semisyntetiskt antibakteriellt cefalosporinläkemedel för oral administrering.
Det kemiska namnet på cefuroximaxetil (1-(acetyloxi)etylester av cefuroxim) är (RS)-1-hydroxietyl (6R,7R)-7-[2-(2-furyl)glyoxyl-amido]-3-(hydroximetyl )-8-oxo-5-tia-l-azabicyklo[4.2.0]-okt-2-en-2-karboxylat, 72-(Z)-(O-metyl-oxim), 1-acetat-3-karbamat. Dess molekylformel är C20H22N4O10S, och den har en molekylvikt på 510,48.
Cefuroximaxetil är i amorf form och har följande strukturformel:
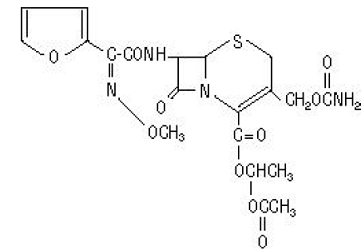
Tabletterna är filmdragerade och innehåller motsvarande 250 eller 500 mg cefuroxim som cefuroximaxetil. Tabletter innehåller de inaktiva ingredienserna kolloidal kiseldioxid, kroskarmellosnatrium, hydrerad vegetabilisk olja, hypromellos, metylparaben, mikrokristallin cellulosa, propylenglykol, propylparaben, natriumbensoat, natriumlaurylsulfat och titandioxid.
Oral suspension, när den rekonstitueras med vatten, ger motsvarande 125 mg eller 250 mg cefuroxim (som cefuroximaxetil) per 5 ml. Oral suspension innehåller de inaktiva ingredienserna acesulfamkalium, aspartam, povidon K30, stearinsyra, sackaros, tutti-frutti-arom och xantangummi.
INDIKATIONER
Faryngit/Tonsillit
CEFTIN 125 mg tabletter är indicerade för behandling av vuxna patienter och pediatriska patienter (13 år och äldre) med mild till måttlig faryngit/tonsillit orsakad av känsliga stammar av Streptococcus pyogenes.
CEFTIN 500 mg för oral suspension är indicerat för behandling av pediatriska patienter i åldern 3 månader till 12 år med mild till måttlig faryngit/tonsillit orsakad av känsliga stammar av Streptococcus pyogenes.
Användningsbegränsningar
- Effekten av CEFTIN för att förebygga reumatisk feber har inte fastställts i kliniska prövningar.
- Effekten av CEFTIN 125 mg vid behandling av penicillinresistenta stammar av Streptococcus pyogenes har inte visats i kliniska prövningar.
Akut bakteriell otitis media
CEFTIN 125 mg tabletter är indicerade för behandling av pediatriska patienter (som kan svälja tabletter hela) med akut bakteriell otitis media orsakad av känsliga stammar av Streptococcus pneumoniae, Haemophilus influenzae (inklusive β-lactamase-producerande stammar catamase-producerande), Moraxella-producerande stammar (cllacarinmase). -producerande stammar), eller Streptococcus pyogenes.
CEFTIN för oral suspension är indicerat för behandling av pediatriska patienter i åldern 3 månader till 12 år med akut bakteriell otitis media orsakad av mottagliga stammar av Streptococcus pneumoniae, Haemophilus influenzae (inklusive β-laktamasproducerande stammar), Moraxella catarrudtaising -producerande stammar), eller Streptococcus pyogenes.
Akut bakteriell maxillär bihåleinflammation
CEFTIN tabletter är indicerade för behandling av vuxna och pediatriska patienter (13 år och äldre) med mild till måttlig akut bakteriell maxillär bihåleinflammation orsakad av känsliga stammar av Streptococcus pneumoniae eller Haemophilus influenzae (endast icke-β-laktamasproducerande stammar).
CEFTIN 250 mg för oral suspension är indicerat för behandling av pediatriska patienter i åldern 3 månader till 12 år med mild till måttlig akut bakteriell maxillär bihåleinflammation orsakad av känsliga stammar av Streptococcus pneumoniae eller Haemophilus influenzae (endast icke-β-producerande laktamase-stammar) .
Användningsbegränsningar
Effektiviteten av CEFTIN för sinusinfektioner orsakade av β-laktamasproducerande Haemophilus influenzae eller Moraxella catarrhalis hos patienter med akut bakteriell maxillär bihåleinflammation fastställdes inte på grund av otillräckligt antal av dessa isolat i de kliniska prövningarna [se Kliniska studier ].
Akuta bakteriella exacerbationer av kronisk bronkit
CEFTIN tabletter är indicerade för behandling av vuxna patienter och pediatriska patienter (13 år och äldre) med mild till måttlig akut bakteriell exacerbation av kronisk bronkit orsakad av känsliga stammar av Streptococcus pneumoniae, Haemophilus influenzae (β-negativa stammar), eller Haemophilus para influenzae (β-laktamas-negativa stammar).
Okomplicerade hud- och hudstrukturinfektioner
CEFTIN 250 mg tabletter är indicerade för behandling av vuxna patienter och pediatriska patienter (13 år och äldre) med okomplicerade hud- och hudstrukturinfektioner orsakade av känsliga stammar av Staphylococcus aureus (inklusive β-laktamasproducerande stammar) eller Streptococcus pyogenes.
Okomplicerade urinvägsinfektioner
CEFTIN 500 mg tabletter är indicerade för behandling av vuxna patienter och pediatriska patienter (13 år och äldre) med okomplicerade urinvägsinfektioner orsakade av känsliga stammar av Escherichia coli eller Klebsiella pneumoniae.
Okomplicerad gonorré
CEFTIN-tabletter är indicerade för behandling av vuxna patienter och pediatriska patienter (13 år och äldre) med okomplicerad gonorré, urethral och endocervikal, orsakad av penicillinasproducerande och icke-penicillinasproducerande känsliga stammar av Neisseria gonorrhoeae i kvinnlig, recirkulerad gonorrhoeae och uncomrheatal gonorrheae, okomplicerad kvinnlig gonor. , orsakad av icke-penicillinasproducerande känsliga stammar av Neisseria gonorrhoeae.
Tidig borrelia (erythema migrans)
CEFTIN tabletter är indicerade för behandling av vuxna patienter och pediatriska patienter (13 år och äldre) med tidig borrelia (erythema migrans) orsakad av känsliga stammar av Borrelia burgdorferi.
Svinkoppor
CEFTIN 250 mg för oral suspension är indicerat för behandling av pediatriska patienter i åldern 3 månader till 12 år med impetigo orsakad av känsliga stammar av Staphylococcus aureus (inklusive Plactamas-producerande stammar) eller Streptococcus pyogenes.
Användande
För att minska utvecklingen av läkemedelsresistenta bakterier och bibehålla effektiviteten hos CEFTIN och andra antibakteriella läkemedel, ska CEFTIN 500mg endast användas för att behandla eller förebygga infektioner som bevisligen eller starkt misstänks vara orsakade av känsliga bakterier. När information om odling och känslighet finns tillgänglig bör de övervägas vid val eller modifiering av antibakteriell terapi. I avsaknad av sådana data kan lokal epidemiologi och känslighetsmönster bidra till det empiriska valet av terapi.
DOSERING OCH ADMINISTRERING
Viktiga administrationsinstruktioner
- CEFTIN tabletter och CEFTIN för oral suspension är inte bioekvivalenta och är därför inte utbytbara på milligram-per-milligram-basis [se KLINISK FARMAKOLOGI ].
- Administrera CEFTIN tabletter eller oral suspension enligt beskrivningen i lämpliga doseringsriktlinjer [se Dosering för CEFTIN 500mg tabletter, Dosering för CEFTIN 250mg för oral suspension och Beredning och administrering av CEFTIN 125 mg för oral suspension ].
- Administrera CEFTIN 500 mg tabletter med eller utan mat.
- Administrera CEFTIN 500mg för oral suspension med mat.
- Pediatriska patienter (i åldern 13 år och äldre) som inte kan svälja CEFTIN 125 mg tabletter hela bör få CEFTIN som oral suspension eftersom tabletten har en stark, ihållande bitter smak när den krossas [se Dosering för CEFTIN tabletter ].
Dosering för CEFTIN 500mg tabletter
Administrera CEFTIN 250 mg tabletter enligt beskrivningen i doseringstabellen nedan med eller utan mat.
Dosering för CEFTIN för oral suspension
Administrera CEFTIN för oral suspension enligt beskrivningen i doseringstabellen nedan med mat.
Beredning och administrering av CEFTIN för oral suspension
Förbered en suspension vid tidpunkten för dispensering enligt följande:
- Skaka den orala suspensionen väl före varje användning.
- Sätt tillbaka locket ordentligt efter varje öppning.
- Förvara den rekonstituerade suspensionen kyld mellan 2° och 8°C (36° och 46°F).
- Kassera den rekonstituerade suspensionen efter 10 dagar.
Dosering hos patienter med nedsatt njurfunktion
En justering av dosintervallet krävs för patienter vars kreatininclearance är mindre än 30 ml/min, enligt listan i Tabell 4 nedan, eftersom cefuroxim elimineras primärt via njurarna [se KLINISK FARMAKOLOGI ].
HUR LEVERERAS
Doseringsformer och styrkor
CEFTIN tabletter är vita, kapselformade, filmdragerade tabletter tillgängliga i följande styrkor:
- 250 mg cefuroxim (som cefuroximaxetil) med "GX ES7" ingraverad på ena sidan och blank på andra sidan.
- 500 mg cefuroxim (som cefuroximaxetil) med "GX EG2" ingraverad på ena sidan och blank på andra sidan.
CEFTIN för oral suspension tillhandahålls som torrt, vitt till benvitt pulver med tutti-frutti-smak. När den rekonstitueras enligt anvisningarna ger suspensionen motsvarande 125 mg eller 250 mg cefuroxim (som cefuroximaxetil) per 5 ml.
Förvaring Och Hantering
CEFTIN tabletter, 250 mg cefuroxim (som cefuroximaxetil), är vita, kapselformade, filmdragerade tabletter märkta med "GX ES7" på ena sidan och tomma på andra sidan enligt följande: 20 tabletter/flaska NDC 0173-0387-00
CEFTIN tabletter, 500 mg cefuroxim (som cefuroximaxetil), är vita, kapselformade, filmdragerade tabletter märkta med "GX EG2" på ena sidan och tomma på andra sidan enligt följande: 20 tabletter/flaska NDC 0173-0394-00
Förvara tabletterna mellan 15° och 30°C (59° och 86°F). Sätt tillbaka locket ordentligt efter varje öppning.
CEFTIN 500mg för oral suspension tillhandahålls som torrt, vitt till benvitt pulver med tutti-frutti-smak. När den rekonstitueras enligt anvisningarna ger suspensionen motsvarande 125 mg eller 250 mg cefuroxim (som cefuroximaxetil) per 5 ml. Den levereras i bärnstensfärgade glasflaskor enligt följande:
125 mg/5 ml
100 ml suspension NDC 0173-0740-00
250 mg/5 ml
50 ml suspension NDC 0173-0741-10 100-ml suspension NDC 0173-0741-00
Före beredning, förvara torrt pulver mellan 2° och 30°C (36° och 86°F).
Efter beredning, förvara suspensionen omedelbart kyld mellan 2° och 8°C (36° och 46°F). KASSA EFTER 10 DAGAR.
GlaxoSmithKline, Research Triangle Park, NC 27709. Reviderad: okt 2017
BIEFFEKTER
Följande allvarliga och i övrigt viktiga biverkningar beskrivs mer i detalj i avsnittet Varningar och försiktighetsåtgärder på etiketten:
Anafylaktiska reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar utförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte frekvensen som observerats i praktiken.
Tabletter
Flerdosdoseringsregimer med 7 till 10 dagars längd
kliniska prövningar med flera doser behandlades 912 försökspersoner med CEFTIN (125 till 500 mg två gånger dagligen). Det noteras att 125 mg två gånger dagligen inte är en godkänd dos. Tjugo (2,2 %) försökspersoner avbröt medicineringen på grund av biverkningar. Sjutton (85 %) av de 20 försökspersonerna som avbröt behandlingen gjorde det på grund av gastrointestinala störningar, inklusive diarré, illamående, kräkningar och buksmärtor. Andelen försökspersoner som behandlades med CEFTIN som avbröt studieläkemedlet på grund av biverkningar var liknande vid dagliga doser på 1 000, 500 och 250 mg (2,3 %, 2,1 % respektive 2,2 %). Incidensen av gastrointestinala biverkningar ökade dock med de högre rekommenderade doserna.
Biverkningarna i Tabell 5 är för försökspersoner (n = 912) som behandlats med CEFTIN 250 mg i kliniska prövningar med flera doser.
Följande biverkningar inträffade hos mindre än 1 % men mer än 0,1 % av försökspersonerna (n = 912) som behandlades med CEFTIN i kliniska prövningar med flera doser.
Immunsystemets störningar Nässelutslag, svullen tunga.
Metabolism och näringsstörningar : Anorexi.
Störningar i nervsystemet : Huvudvärk.
Hjärtsjukdomar : Bröstsmärta.
Andningsstörningar : Andnöd.
Gastrointestinala störningar : Buksmärtor, magkramper, gasbildning, matsmältningsbesvär, munsår.
Hud och subkutan vävnad : Utslag, klåda.
Njur- och urinvägsstörningar : Dysuri.
Reproduktionssystemet och bröststörningar : Vaginit, vulvarklåda.
Allmänna störningar och villkor för administrationsplatsen : Frossa, sömnighet, törst.
Utredningar : Positivt Coombs test.
Tidig borrelia med 20-dagarsregimen
Två multicenterstudier bedömde CEFTIN 500 mg två gånger dagligen i 20 dagar. De vanligaste läkemedelsrelaterade biverkningarna var diarré (10,6 %), Jarisch-Herxheimer-reaktion (5,6 %) och vaginit (5,4 %). Andra biverkningar inträffade med frekvenser jämförbara med de som rapporterats vid 7 till 10 dagars dosering.
Endosregimen för okomplicerad gonorré
I kliniska prövningar med en engångsdos på 1 000 mg CEFTIN 250 mg, behandlades 1 061 försökspersoner för okomplicerad gonorré. Biverkningarna i tabell 6 var för försökspersoner som behandlats med en engångsdos på 1 000 mg CEFTIN i kliniska prövningar i USA.
Följande biverkningar inträffade hos mindre än 1 % men mer än 0,1 % av försökspersonerna (n = 1 061) som behandlades med en engångsdos av CEFTIN 1 000 mg för okomplicerad gonorré i amerikanska kliniska prövningar.
Infektioner och angrepp : Vaginal candidiasis.
Störningar i nervsystemet : Huvudvärk, yrsel, somnolens.
Hjärtsjukdomar : Täthet/smärta i bröstet, takykardi.
Gastrointestinala störningar : Buksmärtor, dyspepsi.
Hud och subkutan vävnad : Erytem, hudutslag, klåda.
Muskuloskeletala och bindvävssjukdomar : Muskelkramper, muskelstelhet, muskelspasmer i nacken, reaktion av lockjaw-typ.
Njur- och urinvägsstörningar : Blödning/smärta i urinröret, njursmärta.
Reproduktionssystemet och bröststörningar : Vaginal klåda, flytningar.
Oral suspension
I kliniska prövningar med multipla doser av CEFTIN 250 mg, behandlades pediatriska försökspersoner (96,7 % var yngre än 12 år) med CEFTIN (20 till 30 mg/kg/dag uppdelat två gånger dagligen upp till en maximal dos på 500 eller 1 000 mg/dag, respektive). Elva (1,2 %) amerikanska försökspersoner avbröt medicineringen på grund av biverkningar. Utsättningarna var främst för gastrointestinala störningar, vanligtvis diarré eller kräkningar. Tretton (1,4 %) amerikanska pediatriska försökspersoner avbröt behandlingen på grund av smak och/eller problem med läkemedelsadministration.
Biverkningarna i Tabell 7 är för amerikanska försökspersoner (n = 931) som behandlats med CEFTIN i kliniska prövningar med flera doser.
Följande biverkningar inträffade hos mindre än 1 % men mer än 0,1 % av amerikanska försökspersoner (n = 931) som behandlades med CEFTIN för oral suspension i kliniska prövningar med flera doser.
Infektioner och angrepp : Gastrointestinal infektion, candidiasis, virussjukdom, övre luftvägsinfektion, bihåleinflammation, urinvägsinfektion.
Blod- och lymfsystemet : Eosinofili.
Psykiatriska störningar : Hyperaktivitet, irriterat beteende.
Gastrointestinala störningar : Buksmärtor, flatulens, ptyalism.
Hud och subkutan vävnad : Utslag.
Muskuloskeletala och bindvävssjukdomar : Ledsvullnad, artralgi.
Reproduktionssystemet och bröststörningar : Vaginal irritation.
Allmänna störningar och villkor för administrationsplatsen : Hosta, feber.
Utredningar : Förhöjda leverenzymer, positivt Coombs test.
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av CEFTIN efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Blod- och lymfsystemet
Hemolytisk anemi, leukopeni, pancytopeni, trombocytopeni.
Gastrointestinala störningar
Pseudomembranös kolit [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Lever och gallvägar
Nedsatt leverfunktion inklusive hepatit och kolestas, gulsot.
Immunsystemets störningar
Anafylaxi, serumsjukeliknande reaktion.
Utredningar
Ökad protrombintid.
Störningar i nervsystemet
Kramper, encefalopati.
Njur- och urinvägsstörningar
Renal dysfunktion.
Hud och subkutan vävnad
Angioödem, erythema multiforme, Stevens-Johnsons syndrom, toxisk epidermal nekrolys, urtikaria.
LÄKEMEDELSINTERAKTIONER
Orala preventivmedel
Cefuroximaxetil kan påverka tarmfloran, vilket leder till lägre östrogenreabsorption och minskad effekt av kombinerade orala östrogen/progesteron-preventivmedel. Ge patienterna råd att överväga alternativa kompletterande (icke-hormonella) preventivmedel under behandlingen.
Läkemedel som minskar surheten i magen
Läkemedel som minskar surheten i magsäcken kan resultera i en lägre biotillgänglighet av CEFTIN jämfört med administrering i fastande tillstånd. Administrering av läkemedel som minskar surheten i magsäcken kan motverka födoeffekten av ökad absorption av CEFTIN 250 mg vid administrering i postprandialt tillstånd. Administrera CEFTIN minst 1 timme före eller 2 timmar efter administrering av kortverkande antacida. Histamin-2 (H2)-antagonister och protonpumpshämmare bör undvikas.
Probenecid
Samtidig administrering av probenecid och cefuroximaxetil-tabletter ökar serumkoncentrationerna av cefuroxim [se KLINISK FARMAKOLOGI ]. Samtidig administrering av probenecid och cefuroximaxetil rekommenderas inte.
Interaktioner med läkemedel/laboratorietest
En falsk-positiv reaktion för glukos i urinen kan uppstå med kopparreduktionstester (t.ex. Benedicts eller Fehlings lösning), men inte med enzymbaserade tester för glykosuri. Eftersom ett falskt negativt resultat kan uppstå i ferricyanidtestet, rekommenderas att antingen glukosoxidas- eller hexokinasmetoden används för att bestämma blod-/plasmaglukosnivåer hos patienter som får cefuroximaxetil. Närvaron av cefuroxim stör inte analysen av serum- och urinkreatinin med den alkaliska pikratmetoden.
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Anafylaktiska reaktioner
Allvarliga och ibland dödliga överkänslighetsreaktioner (anafylaktiska) har rapporterats hos patienter på β-laktamantibakteriella medel. Dessa reaktioner är mer benägna att inträffa hos individer med en historia av β-laktamöverkänslighet och/eller en historia av känslighet för flera allergener. Det har rapporterats om personer med penicillinöverkänslighet i anamnesen som har upplevt allvarliga reaktioner när de behandlats med cefalosporiner. CEFTIN 500mg är kontraindicerat hos patienter med känd överkänslighet mot CEFTIN eller andra β-laktam antibakteriella läkemedel [se KONTRAINDIKATIONER ]. Innan du påbörjar behandling med CEFTIN, fråga om tidigare överkänslighetsreaktioner mot penicilliner, cefalosporiner eller andra allergener. Om en allergisk reaktion uppstår, avbryt behandlingen med CEFTIN och inled lämplig behandling.
Clostridium Difficile-associerad diarré
Clostridium difficile-associerad diarré (CDAD) har rapporterats vid användning av nästan alla antibakteriella medel, inklusive CEFTIN, och kan variera i svårighetsgrad från mild diarré till fatal kolit. Behandling med antibakteriella medel förändrar den normala floran i tjocktarmen vilket leder till överväxt av C. difficile.
C. difficile producerar toxiner A och B som bidrar till utvecklingen av CDAD. Hypertoxinproducerande stammar av C. difficile orsakar ökad sjuklighet och mortalitet, eftersom dessa infektioner kan vara motståndskraftiga mot antimikrobiell terapi och kan kräva kolektomi. CDAD måste övervägas hos alla patienter som får diarré efter antibiotikaanvändning. Noggrann anamnes är nödvändig eftersom CDAD har rapporterats inträffa mer än 2 månader efter administrering av antibakteriella medel.
Om CDAD misstänks eller bekräftas kan pågående antibiotikaanvändning som inte är riktad mot C. difficile behöva avbrytas. Lämplig vätske- och elektrolythantering, proteintillskott, antibiotikabehandling av C. difficile och kirurgisk utvärdering bör sättas in efter klinisk indikation.
Potential för mikrobiell överväxt
Möjligheten för superinfektioner med svamp- eller bakteriepatogener bör övervägas under behandlingen.
Utveckling av läkemedelsresistenta bakterier
Att förskriva CEFTIN antingen i avsaknad av en bevisad eller starkt misstänkt bakterieinfektion eller en profylaktisk indikation kommer sannolikt inte att ge patienten någon nytta och ökar risken för utveckling av läkemedelsresistenta bakterier.
Fenylketonuri
CEFTIN 125 mg för oral suspension 125 mg/5 ml innehåller fenylalanin 11,8 mg per 5 ml (1 tesked) beredd suspension. CEFTIN 250 mg för oral suspension 250 mg/5 ml innehåller fenylalanin 25,2 mg per 5 ml (1 tesked) beredd suspension.
Interferens med glukostester
Ett falskt positivt resultat för glukos i urinen kan uppstå med kopparreduktionstester, och ett falskt negativt resultat för blod-/plasmaglukos kan uppstå med ferricyanidtest hos patienter som får CEFTIN [se LÄKEMEDELSINTERAKTIONER ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Även om livstidsstudier på djur inte har utförts för att utvärdera cancerframkallande potential, hittades ingen mutagen aktivitet för cefuroximaxetil i ett antal bakteriella mutationstester. Positiva resultat erhölls i en in vitro kromosomavvikelseanalys; negativa resultat hittades i ett mikrokärntest in vivo vid doser upp till 1,5 g/kg. Reproduktionsstudier på råttor vid doser upp till 1 000 mg/kg/dag (9 gånger den rekommenderade maximala humana dosen baserat på kroppsyta) har inte visat någon försämring av fertiliteten.
Användning i specifika populationer
Graviditet
Graviditetskategori B. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Eftersom reproduktionsstudier på djur inte alltid förutsäger mänskligt svar, bör CEFTIN endast användas under graviditet om det verkligen behövs.
Reproduktionsstudier har utförts på möss i doser upp till 3 200 mg/kg/dag (14 gånger den rekommenderade maximala dosen för människor baserat på kroppsyta) och på råttor i doser upp till 1 000 mg/kg/dag (9 gånger den rekommenderade maximala dosen) human dos baserad på kroppsyta) och har inte visat några tecken på nedsatt fertilitet eller skada på fostret på grund av cefuroximaxetil.
Ammande mödrar
Eftersom cefuroxim utsöndras i modersmjölk, bör försiktighet iakttas när CEFTIN 500 mg administreras till en ammande kvinna.
Pediatrisk användning
Säkerheten och effektiviteten av CEFTIN 250 mg har fastställts för pediatriska patienter i åldern 3 månader till 12 år för akut bakteriell maxillär bihåleinflammation baserat på dess godkännande hos vuxna. Användning av CEFTIN hos pediatriska patienter stöds av farmakokinetiska data och säkerhetsdata hos vuxna och pediatriska patienter, och av kliniska och mikrobiologiska data från adekvata och välkontrollerade prövningar av behandling av akut bakteriell maxillär bihåleinflammation hos vuxna och av akut otitis media med effusion i pediatriska patienter. Det stöds också av övervakning av biverkningar efter marknadsföring. [Ser INDIKATIONER OCH ANVÄNDNING , DOSERING OCH ADMINISTRERING , NEGATIVA REAKTIONER , KLINISK FARMAKOLOGI ]
Geriatrisk användning
Av det totala antalet försökspersoner som fick CEFTIN 250 mg i 20 kliniska prövningar var 375 65 år och äldre medan 151 var 75 år och äldre. Inga övergripande skillnader i säkerhet eller effektivitet observerades mellan dessa försökspersoner och yngre vuxna försökspersoner. Rapporterad klinisk erfarenhet har inte identifierat skillnader i svar mellan äldre och yngre vuxna patienter, men större känslighet hos vissa äldre individer kan inte uteslutas.
Cefuroxim utsöndras till stor del via njurarna och risken för biverkningar kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen.
Nedsatt njurfunktion
En minskning av dosen av CEFTIN 125 mg rekommenderas för vuxna patienter med gravt nedsatt njurfunktion (kreatininclearance DOSERING OCH ADMINISTRERING , KLINISK FARMAKOLOGI ].
ÖVERDOS
Överdosering av cefalosporiner kan orsaka cerebral irritation som leder till kramper eller encefalopati. Serumnivåer av cefuroxim kan sänkas genom hemodialys och peritonealdialys.
KONTRAINDIKATIONER
CEFTIN är kontraindicerat hos patienter med känd överkänslighet (t.ex. anafylaxi) mot CEFTIN eller andra antibakteriella β-laktamläkemedel (t.ex. penicilliner och cefalosporiner).
KLINISK FARMAKOLOGI
Handlingsmekanism
CEFTIN 250mg är ett antibakteriellt läkemedel [se Mikrobiologi ].
Farmakokinetik
Absorption
Efter oral administrering absorberas cefuroximaxetil från mag-tarmkanalen och hydrolyseras snabbt av ospecifika esteraser i tarmslemhinnan och blodet till cefuroxim. Serumfarmakokinetiska parametrar för cefuroxim efter administrering av CEFTIN 250 mg tabletter till vuxna visas i Tabell 8.
Mat effekt
Absorptionen av tabletten är större när den tas efter mat (absolut biotillgänglighet ökar från 37 % till 52 %). Trots denna skillnad i absorption var de kliniska och bakteriologiska svaren hos försökspersonerna oberoende av födointag vid tidpunkten för tablettadministrering i 2 försök där detta bedömdes.
Alla farmakokinetiska och kliniska effektivitets- och säkerhetsprövningar på pediatriska försökspersoner som använde suspensionsformuleringen utfördes i mattillstånd. Det finns inga tillgängliga data om absorptionskinetiken för suspensionsformuleringen när den administreras till fastande pediatriska patienter.
Brist på bioekvivalens
Oral suspension var inte bioekvivalent med tabletter när den testades på friska vuxna. Tablett- och oral suspensionsformuleringarna är INTE utbytbara på milligram-permilligram-basis. Ytan under kurvan för suspensionen var i genomsnitt 91 % av den för tabletten, och toppplasmakoncentrationen för suspensionen var i genomsnitt 71 % av toppplasmakoncentrationen för tabletterna. Därför fastställdes säkerheten och effektiviteten för både tabletterna och orala suspensionsformuleringar i separata kliniska prövningar.
Distribution
Cefuroxim fördelas i de extracellulära vätskorna. Cirka 50 % av serumcefuroxim är bundet till protein.
Ämnesomsättning
Axitildelen metaboliseras till acetaldehyd och ättiksyra.
Exkretion
Cefuroxim utsöndras oförändrat i urinen; hos vuxna återfinns cirka 50 % av den administrerade dosen i urinen inom 12 timmar. Farmakokinetiken för cefuroxim hos pediatriska försökspersoner har inte studerats. Tills ytterligare data finns tillgängliga bör den renala elimineringen av cefuroximaxetil som fastställts hos vuxna inte extrapoleras till pediatriska försökspersoner.
Specifika populationer
Nedsatt njurfunktion
I en studie med 28 vuxna med normal njurfunktion eller gravt nedsatt njurfunktion (kreatininclearance DOSERING OCH ADMINISTRERING ].
Pediatriska patienter
Serumfarmakokinetiska parametrar för cefuroxim hos pediatriska försökspersoner som administrerats CEFTIN för oral suspension visas i Tabell 9.
Geriatriska patienter
en studie med 20 äldre försökspersoner (medelålder = 83,9 år) med ett genomsnittligt kreatininclearance på 34,9 ml/min, förlängdes den genomsnittliga halveringstiden för serumeliminering till 3,5 timmar; men trots den lägre elimineringen av cefuroxim hos geriatriska patienter är dosjustering baserad på ålder inte nödvändig [se Användning i specifika populationer ].
Läkemedelsinteraktioner
Samtidig administrering av probenecid med cefuroximaxetil-tabletter ökar cefuroximytan under kurvan för serumkoncentration kontra tid och maximal serumkoncentration med 50 % respektive 21 %.
Mikrobiologi
Handlingsmekanism
Cefuroximaxetil är ett bakteriedödande medel som verkar genom att hämma syntesen av bakteriell cellvägg. Cefuroximaxetil har aktivitet i närvaro av vissa β-laktamaser, både penicillinaser och cefalosporinaser, av gramnegativa och grampositiva bakterier.
Motståndsmekanism
Resistens mot cefuroximaxetil sker främst genom hydrolys av β-laktamas, förändring av penicillinbindande proteiner (PBP), minskad permeabilitet och närvaron av bakteriella effluxpumpar.
Mottagligheten för cefuroximaxetil kommer att variera med geografi och tid; lokal känslighetsdata bör konsulteras, om tillgänglig. Beta-laktamasnegativa, ampicillinresistenta (BLNAR) isolat av H. influenzae bör anses vara resistenta mot cefuroximaxetil.
Cefuroximaxetil har visat sig vara aktivt mot de flesta isolat av följande bakterier, både in vitro och vid kliniska infektioner [se INDIKATIONER OCH ANVÄNDNING ]:
Gram-positiva bakterier
Staphylococcus aureus (endast meticillinkänsliga isolat) Streptococcus pneumoniae Streptococcus pyogenes
Gram-negativa bakterier
Escherichia colia Klebsiella pneumoniaea Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis Neisseria gonorrhoeae a Isolat som producerar mest utvidgat spektrum av β-laktamas (ESBL) och karbapenemas-producerande isolat är resistenta mot acefuroxime. Spirochetes Borrelia Burgdorferi
Följande in vitro-data finns tillgängliga, men deras kliniska betydelse är okänd. Minst 90 procent av följande mikroorganismer uppvisar en in vitro minsta hämmande koncentration (MIC) mindre än eller lika med den känsliga brytpunkten för cefuroximaxetil på 1 mcg/ml. Effekten av cefuroximaxetil vid behandling av kliniska infektioner på grund av dessa mikroorganismer har dock inte fastställts i adekvata och välkontrollerade kliniska prövningar.
Gram-positiva bakterier
Staphylococcus epidermidis (endast meticillinkänsliga isolat) Staphylococcus saprophyticus (endast meticillinkänsliga isolat) Streptococcus agalactiae
Gram-negativa bakterier
Morganella morganii Proteus inconstans Proteus mirabilis Providencia rettgeri Anaeroba bakterier Peptococcus niger
Testmetoder för känslighet
När det är tillgängligt ska det kliniska mikrobiologiska laboratoriet tillhandahålla läkaren resultaten av in vitro-känslighetstester för antimikrobiella läkemedel som används på lokala sjukhus och övningsområden som periodiska rapporter som beskriver känslighetsprofilen för nosokomiala och samhällsförvärvade patogener. Dessa rapporter bör hjälpa läkaren att välja ett antibakteriellt läkemedel för behandling.
Spädningstekniker
Kvantitativa metoder används för att bestämma antimikrobiella MIC. Dessa MIC ger reproducerbara uppskattningar av bakteriers känslighet för antimikrobiella föreningar. MIC-värdena bör bestämmas med en standardiserad testmetod (buljong eller agar).1, 2 MIC-värdena ska tolkas enligt kriterierna i Tabell 10.2,3
Diffusionstekniker
Kvantitativa metoder som kräver mätning av zondiametrar ger också reproducerbara uppskattningar av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken ger en uppskattning av bakteriers mottaglighet för antimikrobiella föreningar. Zonstorleken bör bestämmas med en standardiserad testmetod.4 Denna procedur använder pappersskivor impregnerade med 30 mcg cefuroximaxetil för att testa mikroorganismers känslighet för cefuroximaxetil. Tolkningskriterierna för diskdiffusion finns i Tabell 10.3
Stafylokockers känslighet för cefuroxim kan härledas från att endast testa penicillin och antingen cefoxitin eller oxacillin.
Mottaglighet för Streptococcus pyogenes kan härledas från att testa penicillin.3
En rapport om "känslig" indikerar att det antimikrobiella läkemedlet sannolikt kommer att hämma tillväxten av patogenen om det antimikrobiella läkemedlet når den koncentration som vanligtvis kan uppnås på infektionsplatsen. En rapport med "Intermediate" indikerar att resultatet bör anses tvetydigt, och om mikroorganismen inte är fullt mottaglig för alternativa, kliniskt genomförbara läkemedel, bör testet upprepas. Denna kategori innebär möjlig klinisk tillämpbarhet på kroppsställen där läkemedlet är fysiologiskt koncentrerat eller i situationer där en hög dos av läkemedel kan användas. Denna kategori ger också en buffertzon som förhindrar att små okontrollerade tekniska faktorer orsakar stora tolkningsskillnader. En rapport om "resistent" indikerar att det antimikrobiella läkemedlet sannolikt inte kommer att hämma tillväxten av patogenen om det antimikrobiella läkemedlet når de koncentrationer som vanligtvis kan uppnås på infektionsplatsen; annan terapi bör väljas.
Kvalitetskontroll
Standardiserade förfaranden för känslighetstest kräver användning av laboratoriekontroller för att övervaka och säkerställa noggrannheten och precisionen hos förråd och reagenser som används i analysen, och teknikerna för den individ som utför testet.1,2,4 QC-intervallen för MIC och diskdiffusion testning med 30-mcg-skivan finns i Tabell 11.3
Kliniska studier
Akut bakteriell maxillär bihåleinflammation
En adekvat och välkontrollerad studie utfördes på försökspersoner med akut bakteriell maxillär bihåleinflammation. I detta försök hade varje försöksperson en maxillär sinusaspirat uppsamlad genom sinuspunktion innan behandlingen inleddes för presumtiv akut bakteriell bihåleinflammation. Alla försökspersoner hade radiografiska och kliniska tecken på akut maxillär bihåleinflammation. I studien var den kliniska effektiviteten av CEFTIN vid behandling av akut maxillär bihåleinflammation jämförbar med ett oralt antimikrobiellt medel innehållande en specifik β-laktamasinhibitor. Mikrobiologiska data visade dock att CEFTIN är effektivt vid behandling av akut bakteriell maxillär bihåleinflammation endast på grund av Streptococcus pneumoniae eller icke-β-laktamasproducerande Haemophilus influenzae. Otillräckligt antal β-laktamasproducerande Haemophilus influenzae och Moraxella catarrhalis-isolat erhölls i denna studie för att adekvat utvärdera effektiviteten av CEFTIN vid behandling av akut bakteriell maxillär bihåleinflammation på grund av dessa 2 organismer.
Denna studie randomiserade 317 vuxna försökspersoner, 132 försökspersoner i USA och 185 försökspersoner i Sydamerika. Tabell 12 visar resultaten av avsikt-att-behandling-analysen.
I denna prövning och i en stödjande prövning av maxillär punktering hade 15 utvärderbara försökspersoner icke-β-laktamasproducerande Haemophilus influenzae som den identifierade patogenen. Av dessa hade 67 % (10/15) denna patogen utrotad. Arton (18) utvärderbara försökspersoner hade Streptococcus pneumoniae som den identifierade patogenen. Av dessa hade 83 % (15/18) denna patogen utrotad.
Tidig borrelia
Två adekvata och välkontrollerade studier utfördes på försökspersoner med tidig borrelia. Alla försökspersoner presenterades med läkardokumenterad erythema migrans, med eller utan systemiska manifestationer av infektion. Patienter bedömdes 1 månad efter behandling med avseende på framgång vid behandling av tidig borrelia (del I) och 1 år efter behandling med avseende på framgång med att förhindra progression till följderna av sen borrelia (del II).
Totalt 355 vuxna försökspersoner (181 behandlade med cefuroximaxetil och 174 behandlade med doxycyklin) randomiserades i de två studierna, med diagnos av tidig borrelia bekräftad hos 79 % (281/355). Den kliniska diagnosen av tidig borrelia hos dessa patienter validerades genom 1) blindad expertläsning av fotografier, när sådana finns tillgängliga, av hudskadan erythema migrans förbehandling och 2) serologisk bekräftelse (med hjälp av enzymkopplad immunosorbentanalys [ELISA] och immunoblotanalys ["Western" blöt]) av närvaron av antikroppar specifika mot Borrelia burgdorferi, det etiologiska medlet för borrelia. Effektdata i Tabell 13 är specifika för denna "validerade" patientundergrupp, medan säkerhetsdata nedan återspeglar hela patientpopulationen för de två prövningarna. Kliniska data för evaluerbara försökspersoner i den "validerade" patientundergruppen visas i Tabell 13.
CEFTIN och doxycyklin var effektiva för att förebygga utvecklingen av följdsjukdomar av sen borrelia.
Medan incidensen av läkemedelsrelaterade gastrointestinala biverkningar var likartad i de två behandlingsgrupperna (cefuroximaxetil - 13 %; doxycyklin - 11 %), var förekomsten av läkemedelsrelaterad diarré högre i cefuroximaxetilarmen jämfört med doxycyklinarmen (11) % mot 3 % respektive).
REFERENSER
1. Clinical and Laboratory Standards Institute (CLSI). Metoder för utspädning Antimikrobiella känslighetstester för bakterier som växer aerobt; Godkänd standard - tionde upplagan. 2015. CLSI-dokument M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Metoder för antimikrobiell utspädning och testning av diskkänslighet för sällan isolerade eller kräsna bakterier: Godkända riktlinjer - andra upplagan. 2010. CLSI-dokument M45-A2, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiell känslighetstestning; Tjugofemte informationstillägget. 2015. CLSI-dokument M100- S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Clinical and Laboratory Standards Institute (CLSI). Prestandastandarder för antimikrobiella diskdiffusionskänslighetstest; Godkänd standard - tolfte upplagan. 2015. CLSI-dokument M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
PATIENTINFORMATION
Allergiska reaktioner
Informera patienterna om att CEFTIN är ett cefalosporin som kan orsaka allergiska reaktioner hos vissa individer [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Clostridium Difficile-associerad diarré
Informera patienterna om att diarré är ett vanligt problem som orsakas av antibakteriella medel, och att det vanligtvis slutar när det antibakteriella medlet avbryts. Ibland kan patienter efter påbörjad behandling med antibakteriella medel utveckla vattnig och blodig avföring (med eller utan magkramper och feber) till och med så sent som 2 eller fler månader efter att ha tagit sin sista dos av det antibakteriella medlet. Om detta inträffar, råd patienterna att kontakta sin läkare så snart som möjligt.
Fenylketonuri
Informera patienter och vårdgivare att CEFTIN 125mg för oral suspension innehåller fenylalanin (en komponent i aspartam) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Krossande tabletter
Instruera patienterna att svälja tabletten hel utan att krossa tabletten. Patienter som inte kan svälja tabletten hel ska få oral suspension.
Oral suspension
Instruera patienterna att skaka den orala suspensionen väl före varje användning, förvara i kylskåp och kassera efter 10 dagar. Den orala suspensionen ska tas tillsammans med mat.
Läkemedelsresistens
Informera patienterna om att antibakteriella läkemedel, inklusive CEFTIN, endast bör användas för att behandla bakterieinfektioner. De behandlar inte virusinfektioner (t.ex. förkylning). När CEFTIN 250mg ordineras för att behandla en bakteriell infektion, informera patienterna om att även om det är vanligt att må bättre tidigt under behandlingen, bör läkemedlet tas exakt enligt anvisningarna. Att hoppa över doser eller inte fullfölja hela behandlingsförloppet kan: (1) minska effektiviteten av den omedelbara behandlingen och (2) öka sannolikheten för att bakterier kommer att utveckla resistens och inte kommer att kunna behandlas med CEFTIN 500mg eller andra antibakteriella läkemedel i framtiden .
