Behandling vid cancer: Nolvadex 10mg, 20mg Tamoxifen Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Nolvadex och hur används det?
Nolvadex 10mg är ett receptbelagt läkemedel som används för att behandla symtomen på bröstcancer. Nolvadex kan användas ensamt eller tillsammans med andra läkemedel.
Nolvadex 20mg tillhör en klass av läkemedel som kallas antineoplastiska, östrogenreceptorantagonister.
Det är inte känt om Nolvadex 20mg är säkert och effektivt hos barn.
Vilka är de möjliga biverkningarna av Nolvadex 20mg?
Nolvadex kan orsaka allvarliga biverkningar inklusive:
- synförändringar,
- ögonsmärta,
- lätta blåmärken eller blödningar,
- humörförändringar,
- svullnad av anklar eller fötter, och
- ovanlig trötthet
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Nolvadex inkluderar:
- värmevallningar,
- spolning,
- förändringar i menstruationer,
- illamående,
- kramper i benen,
- magkrämpor,
- skelettsmärta,
- träningsvärk,
- hosta,
- svullnad,
- Trötthet,
- hårtunnande,
- huvudvärk,
- depression och
- förlust av sexuell förmåga/intresse (hos män)
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Nolvadex. För mer information, fråga din läkare eller apotekspersonal.
VARNING
För kvinnor med ductal carcinoma in situ (DCIS) och kvinnor med hög risk för bröstcancer: Allvarliga och livshotande händelser associerade med NOLVADEX (tamoxifencitrat) i riskreducerande miljö (kvinnor med hög risk för cancer och kvinnor med DCIS) inkluderar uterusmaligniteter, stroke och lungemboli. Incidensfrekvensen för dessa händelser uppskattades från NSABP P-1-studien (se KLINISK FARMAKOLOGI-Kliniska studier - Minskning av incidensen av bröstcancer hos högriskkvinnor ). Maligniteter i livmodern består av både endometrieadenokarcinom (incidensgrad per 1 000 kvinnoår på 2,20 för NOLVADEX (tamoxifencitrat) mot 0,71 för placebo) och uterin sarkom (incidensgrad per 1 000 kvinnoår på 0,4tam för NOLVADEX0,17tam för 0,17 tamoxifen för placebo) placebo)*. För stroke var incidensen per 1 000 kvinnoår 1,43 för NOLVADEX (tamoxifencitrat) jämfört med 1,00 för placebo**. För lungemboli var incidensen per 1 000 kvinnoår 0,75 för NOLVADEX (tamoxifencitrat) jämfört med 0,25 för placebo**.
Några av stroke, lungemboli och livmodermaligniteter var dödliga.
Vårdgivare bör diskutera de potentiella fördelarna kontra de potentiella riskerna med dessa allvarliga händelser med kvinnor med hög risk för bröstcancer och kvinnor med DCIS som överväger NOLVADEX (tamoxifencitrat) för att minska risken att utveckla bröstcancer.
Fördelarna med NOLVADEX (tamoxifencitrat) uppväger riskerna hos kvinnor som redan diagnostiserats med bröstcancer.
REFERENSER
*Uppdaterade långtidsuppföljningsdata (medianlängd för uppföljning är 6,9 år) från NSABP P-1-studie. Ser VARNINGAR: Effekter på uterus-endometriecancer och livmodersarkom .
**Se Tabell 3 under KLINISK FARMAKOLOGI-Kliniska studier .
BESKRIVNING
NOLVADEX® (tamoxifencitrat) tabletter, en icke-steroid antiöstrogen, är för oral administrering. NOLVADEX (tamoxifencitrat) tabletter finns tillgängliga som:
10 mg tabletter
Varje tablett innehåller 15,2 mg tamoxifencitrat vilket motsvarar 10 mg tamoxifen.
20 mg tabletter
Varje tablett innehåller 30,4 mg tamoxifencitrat vilket motsvarar 20 mg tamoxifen.
Inaktiva ingredienser: karboximetylcellulosakalcium, magnesiumstearat, mannitol och stärkelse.
Kemiskt sett är NOLVADEX (tamoxifencitrat) trans-isomeren av ett trifenyletylenderivat. Det kemiska namnet är (Z)2-[4-(1,2-difenyl-1-butenyl)fenoxi]-N,N-dimetyletanamin 2-hydroxi-1,2,3-propantetrikarboxylat (1:1). De strukturella och empiriska formlerna är:
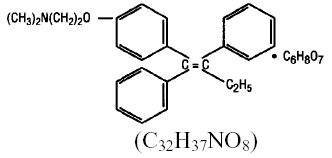
Tamoxifencitrat har en molekylvikt på 563,62, pKa' är 8,85, jämviktslösligheten i vatten vid 37°C är 0,5 mg/ml och i 0,02 N HCl vid 37°C är den 0,2 mg/ml.
INDIKATIONER
Metastaserad bröstcancer
NOLVADEX (tamoxifencitrat) är effektivt vid behandling av metastaserad bröstcancer hos kvinnor och män. Hos premenopausala kvinnor med metastaserad bröstcancer är NOLVADEX (tamoxifencitrat) ett alternativ till ooforektomi eller ovariebestrålning. Tillgängliga bevis tyder på att patienter vars tumörer är östrogenreceptorpositiva är mer benägna att dra nytta av NOLVADEX (tamoxifencitrat)-behandling.
Adjuvansbehandling av bröstcancer
NOLVADEX (tamoxifencitrat) är indicerat för behandling av nodpositiv bröstcancer hos kvinnor efter total mastektomi eller segmentell mastektomi, axillär dissektion och bröstbestrålning. I vissa NOLVADEX (tamoxifencitrat) adjuvansstudier har den största fördelen hittills varit i undergruppen med fyra eller fler positiva axillära noder.
NOLVADEX (tamoxifencitrat) är indicerat för behandling av axillär node-negativ bröstcancer hos kvinnor efter total mastektomi eller segmentell mastektomi, axillär dissektion och bröstbestrålning.
Östrogen- och progesteronreceptorvärdena kan hjälpa till att förutsäga om adjuvant NOLVADEX-behandling (tamoxifencitrat) sannolikt kommer att vara fördelaktig.
NOLVADEX (tamoxifencitrat) minskar förekomsten av kontralateral bröstcancer hos patienter som får adjuvant NOLVADEX (tamoxifencitrat) behandling för bröstcancer.
Ductal Carcinoma in Situ (DCIS)
Hos kvinnor med DCIS, efter bröstkirurgi och strålning, är NOLVADEX (tamoxifencitrat) indicerat för att minska risken för invasiv bröstcancer (se LÅDA VARNING i början av etiketten). Beslutet om behandling med NOLVADEX (tamoxifencitrat) för att minska incidensen av bröstcancer bör baseras på en individuell bedömning av fördelarna och riskerna med NOLVADEX (tamoxifencitrat)-behandling.
Aktuella data från kliniska prövningar stödjer fem års adjuvant NOLVADEX-behandling (tamoxifencitrat) för patienter med bröstcancer.
Minskad incidens av bröstcancer hos högriskkvinnor
NOLVADEX (tamoxifencitrat) är indicerat för att minska förekomsten av bröstcancer hos kvinnor med hög risk för bröstcancer. Denna effekt visades i en studie av 5 års planerad varaktighet med en medianuppföljning på 4,2 år. Tjugofem procent av deltagarna fick droger i 5 år. De långsiktiga effekterna är inte kända. I denna studie sågs ingen påverkan av tamoxifen på total eller bröstcancerrelaterad dödlighet (se LÅDA VARNING i början av etiketten).
NOLVADEX (tamoxifencitrat) är endast indicerat för högriskkvinnor. "Hög risk" definieras som kvinnor som är minst 35 år gamla med en 5-års förväntad risk för bröstcancer ≥ 1,67 %, beräknat med Gail-modellen.
Exempel på kombinationer av faktorer som förutsäger en 5-årsrisk ≥ 1,67 % är:
Ålder 35 eller äldre och någon av följande kombinationer av faktorer:
- En släkting i första graden med en historia av bröstcancer, 2 eller fler godartade biopsier och en historia av en bröstbiopsi som visar atypisk hyperplasi; eller
- Minst 2 första gradens släktingar med en historia av bröstcancer och en personlig historia av minst en bröstbiopsi; eller
- LCIS
Ålder 40 eller äldre och någon av följande kombinationer av faktorer:
- En släkting i första graden med en historia av bröstcancer, 2 eller fler godartade biopsier, ålder vid första levande födseln 25 eller äldre, och ålder vid menarche 11 eller yngre; eller
- Minst 2 första gradens släktingar med en historia av bröstcancer och ålder vid första levande födseln 19 eller yngre; eller
- En släkting i första graden med en historia av bröstcancer och en personlig historia av en bröstbiopsi som visar atypisk hyperplasi.
Ålder 45 eller äldre och någon av följande kombinationer av faktorer:
- Minst 2 första gradens släktingar med en historia av bröstcancer och ålder vid första levande födseln 24 eller yngre; eller
- En släkting i första graden med en historia av bröstcancer med en personlig historia av en godartad bröstbiopsi, ålder vid menarche 11 eller mindre och ålder vid första levande födsel 20 eller mer.
Ålder 50 eller äldre och någon av följande kombinationer av faktorer:
- Minst 2 första gradens släktingar med en historia av bröstcancer; eller
- Historik av en bröstbiopsi som visar atypisk hyperplasi och ålder vid första levande födsel 30 eller äldre och ålder vid menarche 11 eller mindre; eller
- Anamnes på minst två bröstbiopsier med en historia av atypisk hyperplasi och ålder vid första levande födsel 30 eller mer.
Ålder 55 eller äldre och någon av följande kombinationer av faktorer:
- En släkting i första graden med en historia av bröstcancer med en personlig historia av en godartad bröstbiopsi och ålder vid menarche 11 eller mindre; eller
- Anamnes på minst 2 bröstbiopsier med en historia av atypisk hyperplasi och ålder vid första levande födsel 20 eller äldre.
Ålder 60 eller äldre och:
- 5-års förväntad risk för bröstcancer ≥ 1,67 %, beräknat med Gail-modellen.
För kvinnor vars riskfaktorer inte beskrivs i ovanstående exempel är Gail-modellen nödvändig för att uppskatta den absoluta risken för bröstcancer. Hälso- och sjukvårdspersonal kan få ett verktyg för riskbedömning av Gail Model genom att ringa 1-800-544-2007.
Det finns otillräckliga data tillgängliga angående effekten av NOLVADEX (tamoxifencitrat) på bröstcancerincidensen hos kvinnor med ärftliga mutationer (BRCA1, BRCA2) för att kunna ge specifika rekommendationer om effektiviteten av NOLVADEX (tamoxifencitrat) hos dessa patienter.
Efter en bedömning av risken för att utveckla bröstcancer bör beslutet om behandling med NOLVADEX (tamoxifencitrat) för att minska incidensen av bröstcancer baseras på en individuell bedömning av fördelarna och riskerna med NOLVADEX (tamoxifencitrat)-behandling. I NSABP P-1-studien sänkte NOLVADEX-behandlingen (tamoxifencitrat) risken för att utveckla bröstcancer under uppföljningsperioden av studien, men eliminerade inte risken för bröstcancer (se tabell 3 i KLINISK FARMAKOLOGI ).
DOSERING OCH ADMINISTRERING
För patienter med bröstcancer är den rekommenderade dagliga dosen 20-40 mg. Doser större än 20 mg per dag bör ges i uppdelade doser (morgon och kväll).
tre adjuvansstudier med enstaka medel på kvinnor administrerades en 10 mg NOLVADEX (tamoxifencitrat) tablett två (ECOG och NATO) eller tre (Toronto) gånger om dagen i två år. I NSABP B-14 adjuvansstudie på kvinnor med nodnegativ bröstcancer gavs en 10 mg NOLVADEX (tamoxifencitrat) tablett två gånger dagligen i minst 5 år. Resultaten av B-14-studien tyder på att fortsatt behandling efter fem år inte ger ytterligare fördelar (se KLINISK FARMAKOLOGI ). I EBCTCG-översikten 1995 var minskningen av återfall och dödlighet större i de studier som använde tamoxifen i cirka 5 år än i de som använde tamoxifen under en kortare behandlingsperiod. Det fanns inget som tydde på att doser större än 20 mg per dag var effektivare. Aktuella data från kliniska prövningar stödjer 5 års adjuvant NOLVADEX (tamoxifencitrat) behandling för patienter med bröstcancer.
Ductal Carcinoma in Situ (DCIS)
Den rekommenderade dosen är NOLVADEX (tamoxifencitrat) 20 mg dagligen i 5 år.
Minskad incidens av bröstcancer hos högriskkvinnor
Den rekommenderade dosen är NOLVADEX (tamoxifencitrat) 20 mg dagligen i 5 år. Det finns inga data som stödjer användningen av NOLVADEX (tamoxifencitrat) annat än under 5 år (se KLINISK FARMAKOLOGI-Kliniska studier - Minskning av incidensen av bröstcancer hos högriskkvinnor ).
HUR LEVERERAS
10 mg tabletter innehållande tamoxifen som citrat i en mängd motsvarande 10 mg tamoxifen (rund, bikonvex, odragerad, vit tablett identifierad med NOLVADEX (tamoxifencitrat) 600 präglad på ena sidan och en cameo präglad på den andra sidan) levereras i flaskor med 60 st. tabletter. NDC 0310-0600-60.
20 mg tabletter innehållande tamoxifen som citrat i en mängd motsvarande 20 mg tamoxifen (rund, bikonvex, odragerad, vit tablett identifierad med NOLVADEX (tamoxifencitrat) 604 präglad på ena sidan och en cameo präglad på den andra sidan) levereras i flaskor med 30 st. tabletter. NDC 0310-0604-30.
Förvara vid kontrollerad rumstemperatur, 20-25°C (68-77°F) [se USP]. Fördela i en väl tillsluten, ljusbeständig behållare.
*Coumadin® är ett registrerat varumärke som tillhör Bristol-Myers Squibb Pharmaceuticals. Alla andra varumärken tillhör AstraZeneca-gruppen, AstraZeneca Pharmaceuticals LP Wilmington, Delaware 19850-5437. Rev 09-27-05. FDA revisionsdatum: 3/9/2006
BIEFFEKTER
Biverkningar av NOLVADEX (tamoxifencitrat) är relativt milda och sällan allvarliga nog för att kräva att behandlingen avbryts hos bröstcancerpatienter.
Fortsatta kliniska studier har resulterat i ytterligare information som bättre indikerar förekomsten av biverkningar med NOLVADEX (tamoxifencitrat) jämfört med placebo.
Metastaserad bröstcancer
Ökad skelett- och tumörsmärta och även lokal sjukdomsutbrott har inträffat, vilket ibland är förknippat med ett bra tumörsvar. Patienter med ökad skelettsmärta kan behöva ytterligare analgetika. Patienter med mjukdelssjukdom kan ha plötsliga ökningar i storleken på befintliga lesioner, ibland förknippade med markant erytem i och kring lesionerna och/eller utveckling av nya lesioner. När de uppstår, ses bensmärtan eller sjukdomsutbrottet kort efter start av NOLVADEX (tamoxifencitrat) och avtar i allmänhet snabbt.
Hos patienter som behandlas med NOLVADEX (tamoxifencitrat) för metastaserande bröstcancer är den vanligaste biverkningen av NOLVADEX (tamoxifencitrat) värmevallningar.
Andra biverkningar som ses sällan är hyperkalcemi, perifert ödem, avsmak för mat, klåda, depression, yrsel, yrsel, huvudvärk, håravfall och/eller partiellt håravfall och vaginal torrhet.
Premenopausala kvinnor
Följande tabell sammanfattar förekomsten av biverkningar som rapporterats med en frekvens på 2 % eller mer från kliniska prövningar (Ingle, Pritchard, Buchanan) som jämförde NOLVADEX (tamoxifencitrat)-behandling med ovarieablation hos premenopausala patienter med metastaserad bröstcancer.
Manlig bröstcancer
NOLVADEX (tamoxifencitrat) tolereras väl hos män med bröstcancer. Rapporter från litteraturen och fallrapporter tyder på att säkerhetsprofilen för NOLVADEX (tamoxifencitrat) hos män liknar den som ses hos kvinnor. Förlust av libido och impotens har resulterat i att tamoxifenbehandlingen avbryts hos manliga patienter. Hos oligosperma män som behandlats med tamoxifen var nivåerna av LH, FSH, testosteron och östrogen också förhöjda. Inga signifikanta kliniska förändringar rapporterades.
Adjuvant bröstcancer
NSABP B-14-studien randomiserades kvinnor med axillär node-negativ bröstcancer till 5 års NOLVADEX (tamoxifencitrat) 20 mg/dag eller placebo efter primär kirurgi. De rapporterade biverkningarna är tabellerade nedan (genomsnittlig uppföljning på cirka 6,8 år) och visar biverkningar vanligare med NOLVADEX (tamoxifencitrat) än med placebo. Incidensen av värmevallningar (64 % vs. 48 %), flytningar från slidan (30 % vs. 15 %) och oregelbunden mens (25 % vs. 19 %) var högre med NOLVADEX (tamoxifencitrat) jämfört med placebo. Alla andra biverkningar inträffade med liknande frekvens i de två behandlingsgrupperna, med undantag för trombotiska händelser; en högre incidens sågs hos NOLVADEX (tamoxifencitrat)-behandlade patienter (under 5 år, 1,7 % jämfört med 0,4 %). Två av patienterna som behandlades med NOLVADEX (tamoxifencitrat) och som hade trombotiska händelser dog.
Eastern Cooperative Oncology Group (ECOG) adjuvant bröstcancerstudie, administrerades NOLVADEX (tamoxifencitrat) eller placebo i 2 år till kvinnor efter mastektomi. Jämfört med placebo visade NOLVADEX (tamoxifencitrat) en signifikant högre incidens av värmevallningar (19 % mot 8 % för placebo). Incidensen av alla andra biverkningar var likartad i de två behandlingsgrupperna med undantag för trombocytopeni där incidensen för NOLVADEX (tamoxifencitrat) var 10 % mot 3 % för placebo, en observation av statistisk signifikans på gränsen.
andra adjuvansstudier, Toronto och NOLVADEX (tamoxifencitrat) Adjuvant Trial Organisation (NATO), fick kvinnor antingen NOLVADEX (tamoxifencitrat) eller ingen behandling. I Toronto-studien observerades värmevallningar hos 29 % av patienterna för NOLVADEX (tamoxifencitrat) jämfört med 1 % i den obehandlade gruppen. I Nato-studien rapporterades värmevallningar och vaginal blödning hos 2,8 % respektive 2,0 % av kvinnorna för NOLVADEX (tamoxifencitrat) jämfört med 0,2 % för var och en i den obehandlade gruppen.
Anastrozol Adjuvant Trial - Studie av anastrozol jämfört med NOLVADEX (tamoxifencitrat) för adjuvant behandling av tidig bröstcancer (ser KLINISK FARMAKOLOGI - kliniska studier).
Vid en medianuppföljning på 33 månader visade kombinationen av anastrozol och NOLVADEX (tamoxifencitrat) ingen effektfördel jämfört med NOLVADEX-behandling (tamoxifencitrat) som gavs ensamt hos alla patienter såväl som i den hormonreceptorpositiva subpopulationen. Denna behandlingsarm avbröts från försöket. Mediandurationen av adjuvant behandling för säkerhetsutvärdering var 59,8 månader och 59,6 månader för patienter som fick anastrozol 1 mg respektive NOLVADEX (tamoxifencitrat) 20 mg.
Biverkningar som inträffar med en incidens på minst 5 % i endera behandlingsgruppen under behandlingen eller inom 14 dagar efter avslutad behandling presenteras i följande tabell.
Biverkningar som inträffar med en incidens på minst 5 % i endera behandlingsgruppen under behandlingen eller inom 14 dagar efter avslutad behandling
Vissa biverkningar och kombinationer av biverkningar specificerades prospektivt för analys, baserat på de kända farmakologiska egenskaperna och biverkningsprofilerna för de två läkemedlen (se följande tabell).
Antal (%) patienter med förspecificerad biverkning i anastrozol-adjuvansstudien1
Patienter som fick anastrozol hade en ökning av ledbesvär (inklusive artrit, artros och artralgi) jämfört med patienter som fick NOLVADEX (tamoxifencitrat). Patienter som fick anastrozol hade en ökning av incidensen av alla frakturer (särskilt frakturer i ryggraden, höften och handleden) [315 (10%)] jämfört med patienter som fick NOLVADEX (tamoxifencitrat) [209 (7%)]. Patienter som fick anastrozol hade en minskning av värmevallningar, vaginal blödning, vaginal flytning, endometriecancer, venösa tromboemboliska händelser och ischemiska cerebrovaskulära händelser jämfört med patienter som fick NOLVADEX (tamoxifencitrat).
Patienter som fick NOLVADEX (tamoxifencitrat) hade en minskning av hyperkolesterolemi (108 [3,5 %) jämfört med patienter som fick anastrozol (278 [9 %)). Angina pectoris rapporterades hos 71 [2,3 %] patienter i anastrozol-armen och 51 [1,6 %] patienter i NOLVADEX-armen (tamoxifencitrat); hjärtinfarkt rapporterades hos 37 [1,2 %] patienter i anastrozol-armen och hos 34 [1,1 %] patienter i NOLVADEX-armen (tamoxifencitrat).
Resultat från den adjuvanta bensubstudien, vid 12 och 24 månader, visade att patienter som fick anastrozol hade en genomsnittlig minskning av både ländryggen och total höftbensmineraldensitet (BMD) jämfört med baslinjen. Patienter som fick NOLVADEX (tamoxifencitrat) hade en genomsnittlig ökning av både ländryggen och total BMD i höften jämfört med baslinjen.
Ductal Carcinoma in Situ (DCIS)
Typen och frekvensen av biverkningar i NSABP B-24-studien överensstämde med de som observerades i andra adjuvansstudier som utfördes med NOLVADEX (tamoxifencitrat).
Minskad incidens av bröstcancer hos högriskkvinnor
NSABP P-1-studien var det en ökning av fem allvarliga biverkningar i gruppen NOLVADEX (tamoxifencitrat): endometriecancer (33 fall i gruppen NOLVADEX (tamoxifencitrat) jämfört med 14 i placebogruppen); lungemboli (18 fall i gruppen NOLVADEX (tamoxifencitrat) mot 6 i placebogruppen); djup ventrombos (30 fall i gruppen NOLVADEX (tamoxifencitrat) mot 19 i placebogruppen); stroke (34 fall i gruppen NOLVADEX (tamoxifencitrat) jämfört med 24 i placebogruppen); kataraktbildning (540 fall i gruppen NOLVADEX (tamoxifencitrat) jämfört med 483 i placebogruppen) och kataraktkirurgi (101 fall i gruppen NOLVADEX (tamoxifencitrat) mot 63 i placebogruppen) (se VARNINGAR och tabell 3 in KLINISK FARMAKOLOGI ).
Följande tabell visar de biverkningar som observerats i NSABP P-1 per behandlingsarm. Endast biverkningar som är vanligare med NOLVADEX (tamoxifencitrat) än placebo visas.
NSABP P-1-studien drog 15,0 % och 9,7 % av deltagarna som fick NOLVADEX (tamoxifencitrat) respektive placebobehandling ur prövningen av medicinska skäl. Följande är de medicinska skälen för att avbryta behandlingen med NOLVADEX (tamoxifencitrat) respektive placebo: Värmevallningar (3,1 % mot 1,5 %) och vaginal flytning (0,5 % vs. 0,1 %).
I NSABP P-1-studien avbröt 8,7 % och 9,6 % av deltagarna som fick NOLVADEX (tamoxifencitrat) respektive placeboterapi av icke-medicinska skäl.
NSABP P-1-studien inträffade värmevallningar oavsett svårighetsgrad hos 68 % av kvinnorna som fick placebo och hos 80 % av kvinnorna på NOLVADEX (tamoxifencitrat). Allvarliga värmevallningar förekom hos 28 % av kvinnorna som fick placebo och 45 % av kvinnorna som fick NOLVADEX (tamoxifencitrat). Vaginal flytning förekom hos 35 % och 55 % av kvinnorna som fick placebo respektive NOLVADEX (tamoxifencitrat); och var svår hos 4,5 % respektive 12,3 %. Det fanns ingen skillnad i förekomsten av vaginal blödning mellan behandlingsarmarna.
Pediatriska patienter - McCune-Albrights syndrom
Genomsnittlig livmodervolym ökade efter 6 månaders behandling och fördubblades i slutet av den ettåriga studien. Ett orsakssamband har inte fastställts; dock har en ökning av incidensen av endometrieadenokarcinom och livmodersarkom noterats hos vuxna behandlade med NOLVADEX (se LÅDA VARNING ), rekommenderas fortsatt övervakning av McCune-Albright-patienter som behandlats med NOLVADEX (tamoxifencitrat) för långtidseffekter. Säkerheten och effekten av NOLVADEX (tamoxifencitrat) för flickor i åldern två till 10 år med McCune-Albrights syndrom och tidig pubertet har inte studerats efter ett års behandling. Långtidseffekterna av NOLVADEX (tamoxifencitrat)-behandling på flickor har inte fastställts.
Erfarenhet efter marknadsföring
Mindre frekvent rapporterade biverkningar är vaginal blödning, vaginal flytning, menstruationsrubbningar, hudutslag och huvudvärk. Vanligtvis har dessa inte varit av tillräcklig svårighetsgrad för att kräva dosreduktion eller avbrytande av behandlingen. Mycket sällsynta rapporter om erythema multiforme, Stevens-Johnsons syndrom, bullös pemfigoid, interstitiell pneumonit och sällsynta rapporter om överkänslighetsreaktioner inklusive angioödem har rapporterats vid behandling med NOLVADEX (tamoxifencitrat). I några av dessa fall var tiden till debut mer än ett år. I sällsynta fall kan förhöjda serumtriglyceridnivåer, i vissa fall med pankreatit, vara associerade med användning av NOLVADEX (tamoxifencitrat) (se FÖRSIKTIGHETSÅTGÄRDER- Interaktioner med läkemedel/laboratorietester sektion).
LÄKEMEDELSINTERAKTIONER
När NOLVADEX (tamoxifencitrat) används i kombination med antikoagulantia av kumarintyp kan en signifikant ökning av den antikoagulerande effekten uppstå. Om sådan samtidig administrering förekommer rekommenderas noggrann övervakning av patientens protrombintid.
I NSABP P-1-studien var kvinnor som behövde antikoagulantia av kumarintyp av någon anledning inte kvalificerade för att delta i studien (se KONTRAINDIKATIONER ).
Det finns en ökad risk för tromboemboliska händelser när cytotoxiska medel används i kombination med NOLVADEX (tamoxifencitrat).
Tamoxifen minskade plasmakoncentrationerna av letrozol med 37 %. Effekten av tamoxifen på metabolism och utsöndring av andra antineoplastiska läkemedel, såsom cyklofosfamid och andra läkemedel som kräver blandade oxidaser för aktivering, är inte känd. Plasmakoncentrationer av tamoxifen och N-desmetyltamoxifen har visats minska vid samtidig administrering med rifampin eller aminoglutetimid. Induktion av CYP3A4-medierad metabolism anses vara den mekanism genom vilken dessa minskningar sker; andra CYP3A4-inducerande medel har inte studerats för att bekräfta denna effekt.
En patient som fick NOLVADEX (tamoxifencitrat) med fenobarbital samtidigt uppvisade en steady state serumnivå av tamoxifen som var lägre än den som observerades för andra patienter (dvs. 26 ng/ml mot medelvärde på 122 ng/ml). Den kliniska betydelsen av detta fynd är dock inte känd. Rifampin inducerade metabolismen av tamoxifen och minskade signifikant plasmakoncentrationerna av tamoxifen hos 10 patienter. Aminoglutetimid minskar plasmakoncentrationerna av tamoxifen och N-desmetyltamoxifen. Medroxiprogesteron minskar plasmakoncentrationerna av N-desmetyl, men inte tamoxifen.
Samtidig bromokriptinbehandling har visat sig höja serumtamoxifen och N-desmetyltamoxifen.
Baserat på kliniska och farmakokinetiska resultat från anastrozol-adjuvansstudien, bör NOLVADEX (tamoxifencitrat) inte administreras tillsammans med anastrozol (se KLINISK FARMAKOLOGI - Läkemedelsinteraktioner sektion).
Interaktioner med läkemedel/laboratorietester
Under övervakning efter marknadsföring rapporterades T4-förhöjningar för ett fåtal postmenopausala patienter, vilket kan förklaras av ökningar av sköldkörtelbindande globulin. Dessa förhöjningar åtföljdes inte av klinisk hypertyreos.
Variationer i det karyopyknotiska indexet på vaginala utstryk och olika grader av östrogeneffekt på cellprov har sällan setts hos postmenopausala patienter som fått NOLVADEX (tamoxifencitrat).
Efter marknadsföringen av NOLVADEX (tamoxifencitrat) har sällsynta fall av hyperlipidemier rapporterats. Periodisk övervakning av plasmatriglycerider och kolesterol kan vara indicerat hos patienter med redan existerande hyperlipidemier (se BIVERKNINGAR-Erfarenhet efter marknadsföring sektion).
VARNINGAR
Effekter hos patienter med metastaserad bröstcancer
Liksom med annan additiv hormonbehandling (östrogener och androgener) har hyperkalcemi rapporterats hos vissa bröstcancerpatienter med skelettmetastaser inom några veckor efter påbörjad behandling med NOLVADEX (tamoxifencitrat). Om hyperkalcemi inträffar ska lämpliga åtgärder vidtas och, om det är allvarligt, bör NOLVADEX (tamoxifencitrat) sättas ut.
Effekter på livmoder-endometriecancer och livmodersarkom
En ökad incidens av uterina maligniteter har rapporterats i samband med behandling med NOLVADEX (tamoxifencitrat). Den underliggande mekanismen är okänd, men kan vara relaterad till den östrogenliknande effekten av NOLVADEX (tamoxifencitrat). De flesta uterina maligniteter som ses i samband med NOLVADEX (tamoxifencitrat) klassificeras som adenokarcinom i endometrium. Men sällsynta livmodersarkom, inklusive maligna blandade mulleriantumörer (MMMT), har också rapporterats. Uterin sarkom är i allmänhet associerad med ett högre FIGO-stadium (III/IV) vid diagnos, sämre prognos och kortare överlevnad. Uterin sarkom har rapporterats förekomma oftare bland långtidsanvändare (≥ 2 år) av NOLVADEX (tamoxifencitrat) än icke-användare. Vissa av livmodermaligniteterna (endometriekarcinom eller livmodersarkom) har varit dödliga.
NSABP P-1-studien, bland deltagare randomiserade till NOLVADEX (tamoxifencitrat) var det en statistiskt signifikant ökning av incidensen av endometriecancer (33 fall av invasiv endometriecancer, jämfört med 14 fall bland deltagare randomiserade till placebo (RR=2,48) , 95 % CI: 1,27-4,92). De 33 fallen hos deltagare som fick NOLVADEX (tamoxifencitrat) var FIGO-stadium I, inklusive 20 IA, 12 IB och 1 IC endometrieadenokarcinom. Hos deltagare som randomiserades till placebo, var Stage I FIGO (8 IA och 5 IB) och 1 var FIGO Steg IV. Fem kvinnor på NOLVADEX (tamoxifencitrat) och 1 på placebo fick postoperativ strålbehandling utöver kirurgi. Denna ökning observerades främst bland kvinnor som var minst 50 år vid tidpunkt för randomisering (26 fall av invasiv endometriecancer, jämfört med 6 fall bland deltagare randomiserade till placebo (RR=4,50, 95 % KI: 1,78-13,16). Bland kvinnor ≤ 49 år vid tidpunkten för randomiseringen fanns det 7 fall av i nvasiv endometriecancer, jämfört med 8 fall bland deltagare randomiserade till placebo (RR=0,94, 95 % KI: 0,28-2,89). Om ålder vid tidpunkten för diagnosen beaktas, fanns det 4 fall av endometriecancer bland deltagarna ≤ 49 randomiserade till NOLVADEX (tamoxifencitrat) jämfört med 2 bland deltagarna randomiserade till placebo (RR=2,21, 95 % KI: 0,4-12,0). För kvinnor ≥ 50 vid tidpunkten för diagnosen fanns det 29 fall bland deltagarna randomiserade till NOLVADEX (tamoxifencitrat) jämfört med 12 bland kvinnor på placebo (RR=2,5, 95 % KI: 1,3-4,9). Riskkvoterna var likartade i de två grupperna, även om färre händelser inträffade hos yngre kvinnor. De flesta (29 av 33 fall i gruppen NOLVADEX (tamoxifencitrat)) endometriecancer diagnostiserades hos symtomatiska kvinnor, även om 5 av 33 fall i gruppen NOLVADEX (tamoxifencitrat) inträffade hos asymtomatiska kvinnor. Bland kvinnor som fick NOLVADEX (tamoxifencitrat) uppträdde händelserna mellan 1 och 61 månader (genomsnitt=32 månader) från behandlingens början.
en uppdaterad granskning av långtidsdata (medianlängden för total uppföljning är 6,9 år, inklusive blindad uppföljning) på 8 306 kvinnor med en intakt livmoder vid randomisering i NSABP P-1 riskreduceringsstudien, visar incidensen av båda adenokarcinom och sällsynta livmodersarkom ökade hos kvinnor som tog NOLVADEX (tamoxifencitrat). Under blind uppföljning fanns det 36 fall av FIGO stadium I endometrieadenokarcinom (22 var FIGO stadium IA, 13 IB och 1 IC) hos kvinnor som fick NOLVADEX (tamoxifencitrat) och 15 fall hos kvinnor som fick placebo [14 var FIGO-stadiet I (9 IA och 5 IB), och 1 fall var FIGO Steg IV]. Av de patienter som fick NOLVADEX (tamoxifencitrat) och som utvecklade endometriecancer fick en med cancer i stadium IA och 4 med cancer i stadium IB strålbehandling. I placebogruppen fick en patient med cancer i FIGO stadium 1B strålbehandling och patienten med cancer i FIGO stadium IVB fick kemoterapi och hormonbehandling. Under total uppföljning rapporterades endometrieadenokarcinom hos 53 kvinnor randomiserade till NOLVADEX (tamoxifencitrat) (30 fall av FIGO steg IA, 20 var steg IB, 1 var steg IC och 2 var steg IIIC), och 17 kvinnor randomiserade till placebo (9 fall var FIGO steg IA, 6 var steg IB, 1 var steg IIIC och 1 var steg IVB) (incidens per 1 000 kvinnoår på 2,20 respektive 0,71). Vissa patienter fick postoperativ strålbehandling utöver operation. Uterusarkom rapporterades hos 4 kvinnor randomiserade till NOLVADEX (tamoxifencitrat) (1 var FIGO IA, 1 var FIGO IB, 1 var FIGO IIA och 1 var FIGO IIIC) och en patient randomiserades till placebo (FIGO 1A); incidens per 1 000 kvinnoår på 0,17 respektive 0,04. Av patienterna randomiserade till NOLVADEX (tamoxifencitrat) var FIGO IA- och IB-fallen MMMT respektive sarkom; FIGO II var en MMMT; och FIGO III var ett sarkom; och den ena patienten som randomiserades till placebo hade en MMMT. En liknande ökad incidens av endometrieadenokarcinom och livmodersarkom observerades bland kvinnor som fick NOLVADEX (tamoxifencitrat) i fem andra NSABP-studier.
Varje patient som får eller som tidigare har fått NOLVADEX (tamoxifencitrat) som rapporterar onormal vaginal blödning bör utvärderas omedelbart. Patienter som får eller tidigare har fått NOLVADEX (tamoxifencitrat) bör genomgå årliga gynekologiska undersökningar och de bör omedelbart informera sina läkare om de upplever några onormala gynekologiska symtom, t.ex. menstruationsrubbningar, onormal vaginal blödning, förändringar i vaginal flytning eller bäckensmärta eller tryck.
I P-1-studien förändrade inte endometrieprovtagningen upptäcktsfrekvensen för endometriecancer jämfört med kvinnor som inte genomgick endometrieprovtagning (0,6 % med provtagning, 0,5 % utan provtagning) för kvinnor med en intakt livmoder. Det finns inga data som tyder på att rutinmässig endometrieprovtagning hos asymtomatiska kvinnor som tar NOLVADEX (tamoxifencitrat) för att minska förekomsten av bröstcancer skulle vara fördelaktigt.
Icke-maligna effekter på livmodern
En ökad incidens av endometrieförändringar inklusive hyperplasi och polyper har rapporterats i samband med behandling med NOLVADEX (tamoxifencitrat). Förekomsten och mönstret av denna ökning tyder på att den underliggande mekanismen är relaterad till de östrogena egenskaperna hos NOLVADEX (tamoxifencitrat).
Det har förekommit några rapporter om endometrios och myom hos kvinnor som fått NOLVADEX (tamoxifencitrat). Den underliggande mekanismen kan bero på den partiella östrogena effekten av NOLVADEX (tamoxifencitrat). Ovariella cystor har också observerats hos ett litet antal premenopausala patienter med avancerad bröstcancer som har behandlats med NOLVADEX (tamoxifencitrat).
NOLVADEX (tamoxifencitrat) har rapporterats orsaka oregelbunden menstruation eller amenorré.
Tromboemboliska effekter av NOLVADEX (tamoxifencitrat)
Det finns tecken på en ökad förekomst av tromboemboliska händelser, inklusive djup ventrombos och lungemboli, under behandling med NOLVADEX (tamoxifencitrat). När NOLVADEX (tamoxifencitrat) administreras samtidigt med kemoterapi kan det finnas en ytterligare ökning av förekomsten av tromboemboliska effekter. För behandling av bröstcancer bör riskerna och fördelarna med NOLVADEX (tamoxifencitrat) noggrant övervägas hos kvinnor med en historia av tromboemboliska händelser. I en liten delstudie (N=81) av NSABP P-1-studien verkade det inte finnas någon fördel med att screena kvinnor för faktor V Leiden och protrombinmutationer G20210A som ett sätt att identifiera de som kanske inte är lämpliga kandidater för NOLVADEX (tamoxifen) citrat) terapi.
Data från NSABP P-1-studien visar att deltagare som fick NOLVADEX (tamoxifencitrat) utan en historia av lungemboli (PE) hade en statistiskt signifikant ökning av lungemboli (18-NOLVADEX (tamoxifencitrat), 6-placebo, RR=3,01 95 % CI: 1,15-9,27). Tre av lungembolierna, alla i NOLVADEX-armen (tamoxifencitrat), var dödliga. 87 procent av fallen av lungemboli inträffade hos kvinnor som var minst 50 år gamla vid randomisering. Bland kvinnor som fick NOLVADEX (tamoxifencitrat) uppträdde händelserna mellan 2 och 60 månader (genomsnitt=27 månader) från behandlingens början.
samma population sågs en icke-statistiskt signifikant ökning av djup ventrombos (DVT) i gruppen NOLVADEX (tamoxifencitrat) (30-NOLVADEX (tamoxifencitrat), 19-placebo; RR=1,59, 95 % KI: 0,86 -2,98). Samma ökning av relativ risk sågs hos kvinnor ≤ 49 och hos kvinnor ≥ 50, även om färre händelser inträffade hos yngre kvinnor. Kvinnor med tromboemboliska händelser löpte risk för en andra relaterad händelse (7 av 25 kvinnor på placebo, 5 av 48 kvinnor på NOLVADEX (tamoxifencitrat)) och löpte risk för komplikationer av händelsen och dess behandling (0/25 på placebo, 4/48 på NOLVADEX (tamoxifencitrat) ). Bland kvinnor som fick NOLVADEX (tamoxifencitrat) inträffade djup ventromboshändelser mellan 2 och 57 månader (genomsnitt=19 månader) från behandlingens början.
Det fanns en icke-statistiskt signifikant ökning av stroke bland patienter randomiserade till NOLVADEX (tamoxifencitrat) (24-Placebo; 34-NOLVADEX (tamoxifencitrat); RR=1,42; 95 % CI 0,82-2,51). Sex av de 24 stroke i placebogruppen ansågs ha hemorragiskt ursprung och 10 av de 34 stroke i gruppen NOLVADEX (tamoxifencitrat) kategoriserades som hemorragiska. Sjutton av de 34 stroke i gruppen NOLVADEX (tamoxifencitrat) ansågs vara ocklusiva och 7 ansågs vara av okänd etiologi. Fjorton av de 24 stroke på placeboarmen rapporterades vara ocklusiva och 4 av okänd etiologi. Bland dessa stroke var 3 stroke i placebogruppen och 4 stroke i gruppen NOLVADEX (tamoxifencitrat) dödliga. Åttioåtta procent av stroke inträffade hos kvinnor som var minst 50 år gamla vid tidpunkten för randomiseringen. Bland kvinnor som fick NOLVADEX (tamoxifencitrat) inträffade händelserna mellan 1 och 63 månader (genomsnitt=30 månader) från behandlingens början.
Effekter på levern: Levercancer
I den svenska studien med adjuvans NOLVADEX (tamoxifencitrat) 40 mg/dag i 2-5 år har 3 fall av levercancer rapporterats i den NOLVADEX (tamoxifencitrat)-behandlade gruppen kontra 1 fall i observationsgruppen (se FÖRSIKTIGHETSÅTGÄRDER- Carcinogenes ). I andra kliniska prövningar som utvärderar NOLVADEX (tamoxifencitrat) har inga fall av levercancer rapporterats hittills.
Ett fall av levercancer rapporterades i NSABP P-1 hos en deltagare som randomiserats till NOLVADEX (tamoxifencitrat).
Effekter på levern: Icke-maligna effekter
NOLVADEX (tamoxifencitrat) har associerats med förändringar i leverenzymnivåer och i sällsynta fall ett spektrum av allvarligare leveravvikelser inklusive fettlever, kolestas, hepatit och levernekros. Några av dessa allvarliga fall omfattade dödsfall. I de flesta rapporterade fall är förhållandet till NOLVADEX (tamoxifencitrat) osäkert. Det har dock rapporterats några positiva re- och dechallenges.
I NSABP P-1-studien observerades få grad 3-4 förändringar i leverfunktionen (SGOT, SGPT, bilirubin, alkaliskt fosfatas) (10 på placebo och 6 på NOLVADEX (tamoxifencitrat)). Serumlipider uppsamlades inte systematiskt.
Andra cancerformer
Ett antal andra primära tumörer, som förekommer på andra ställen än endometriet, har rapporterats efter behandling av bröstcancer med NOLVADEX (tamoxifencitrat) i kliniska prövningar. Data från NSABP B-14- och P-1-studierna visar ingen ökning av andra (icke-uterin) cancerformer bland patienter som får NOLVADEX (tamoxifencitrat). Huruvida en ökad risk för andra (icke-uterin) cancerformer är associerad med NOLVADEX (tamoxifencitrat) är fortfarande osäkert och utvärderas fortfarande.
Effekter på ögat
Okulära störningar, inklusive förändringar i hornhinnan, försämrad färgseende, trombos i retinal ven och retinopati har rapporterats hos patienter som fått NOLVADEX (tamoxifencitrat). En ökad incidens av grå starr och behov av kataraktkirurgi har rapporterats hos patienter som får NOLVADEX (tamoxifencitrat).
NSABP P-1-studien var en ökad risk för borderline signifikans av att utveckla grå starr bland de kvinnor utan grå starr vid baslinjen (540-NOLVADEX (tamoxifencitrat); 483-placebo; RR=1,13, 95 % CI: 1,00-1,28) observerade. Bland dessa samma kvinnor var NOLVADEX (tamoxifencitrat) associerat med en ökad risk att genomgå kataraktoperation (101-NOLVADEX (tamoxifencitrat); 63-placebo; RR=1,62, 95 % CI 1,18-2,22) (se tabell 3 i KLINISK FARMAKOLOGI ). Bland alla kvinnor i studien (med eller utan grå starr vid utgångsläget) var NOLVADEX (tamoxifencitrat) associerat med en ökad risk att genomgå kataraktoperation (201-NOLVADEX (tamoxifencitrat); 129-placebo; RR=1,58, 95 % CI 1,26-1,97). Synundersökningar krävdes inte under studien. Inga andra slutsatser kan dras beträffande ögonhändelser utan katarakt.
Graviditetskategori D
NOLVADEX (tamoxifencitrat) kan orsaka fosterskador när det ges till en gravid kvinna. Kvinnor bör rådas att inte bli gravida medan de tar NOLVADEX (tamoxifencitrat) eller inom 2 månader efter att ha avslutat NOLVADEX (tamoxifencitrat) och bör använda barriär- eller icke-hormonella preventivmedel om de är sexuellt aktiva. Tamoxifen orsakar inte infertilitet, även i närvaro av oregelbunden menstruation. Effekter på reproduktionsfunktioner förväntas från läkemedlets antiöstrogena egenskaper. I reproduktionsstudier på råttor vid dosnivåer lika med eller under humandosen sågs icke-teratogene utvecklingsskelettförändringar som visade sig reversibla. Dessutom, i fertilitetsstudier på råttor och i teratologiska studier på kaniner med doser på eller lägre än de som används hos människor, observerades en lägre incidens av embryoimplantation och en högre incidens av fosterdöd eller försenad tillväxt i livmodern, med långsammare inlärningsbeteende hos vissa råttungar jämfört med historiska kontroller. Flera dräktiga silkesapor doserades med 10 mg/kg/dag (cirka 2 gånger den dagliga maximala rekommenderade humandosen på mg/m²-basis) under organogenesen eller under den sista halvan av graviditeten. Inga deformationer sågs och även om dosen var tillräckligt hög för att avbryta dräktigheten hos vissa djur, visade de som bibehöll dräktigheten inga tecken på teratogena missbildningar.
gnagarmodeller av fostrets reproduktionskanalutveckling orsakade tamoxifen (vid doser 0,002 till 2,4 gånger den dagliga maximala rekommenderade humana dosen på mg/m²-basis) förändringar hos båda könen som liknar dem som orsakas av östradiol, etynylestradiol och dietylstilbestrol. Även om den kliniska relevansen av dessa förändringar är okänd, liknar vissa av dessa förändringar, särskilt vaginal adenos, de som ses hos unga kvinnor som exponerats för dietylstilbestrol in utero och som har en risk på 1 av 1000 att utveckla klarcelligt adenokarcinom av slidan eller livmoderhalsen. Hittills har exponering för tamoxifen i livmodern inte visats orsaka vaginal adenos, eller klarcelligt adenokarcinom i slidan eller livmoderhalsen, hos unga kvinnor. Men endast ett litet antal unga kvinnor har exponerats för tamoxifen in utero, och ett mindre antal har följts tillräckligt länge (till 15-20 års ålder) för att avgöra om vaginal eller cervikal neoplasi kan uppstå som ett resultat av denna exponering.
Det finns inga adekvata och välkontrollerade prövningar av tamoxifen på gravida kvinnor. Det har förekommit ett litet antal rapporter om vaginal blödning, spontana aborter, fosterskador och fosterdöd hos gravida kvinnor. Om detta läkemedel används under graviditet, eller om patienten blir gravid medan du tar detta läkemedel, eller inom cirka två månader efter avslutad behandling, ska patienten informeras om de potentiella riskerna för fostret inklusive den potentiella långsiktiga risken för en DES- som syndrom.
Minskad incidens av bröstcancer hos högriskkvinnor - Graviditetskategori D
För sexuellt aktiva kvinnor i fertil ålder bör NOLVADEX (tamoxifencitrat)-behandling påbörjas under menstruation. Hos kvinnor med oregelbunden menstruation räcker det med ett negativt B-HCG omedelbart innan behandlingen påbörjas (se FÖRSIKTIGHETSÅTGÄRDER-INFORMATION FÖR PATIENTER - Minskad incidens av bröstcancer hos högriskkvinnor ).
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Minskning av trombocytantalet, vanligtvis till 50 000-100 000/mm³, sällan lägre, har ibland rapporterats hos patienter som tar NOLVADEX (tamoxifencitrat) för bröstcancer. Hos patienter med signifikant trombocytopeni har sällsynta hemorragiska episoder inträffat, men det är osäkert om dessa episoder beror på NOLVADEX (tamoxifencitrat)-behandling. Leukopeni har observerats, ibland i samband med anemi och/eller trombocytopeni. Det har förekommit sällsynta rapporter om neutropeni och pancytopeni hos patienter som fått NOLVADEX (tamoxifencitrat); detta kan ibland vara allvarligt.
I NSABP P-1-studien upplevde 6 kvinnor på NOLVADEX (tamoxifencitrat) och 2 på placebo grad 3-4 fall i trombocytantalet (≤ 50 000/mm³).
Information till patienter
Patienterna bör instrueras att läsa Läkemedelsguide tillhandahålls enligt lag när NOLVADEX 10mg dispenseras. Den fullständiga texten till Läkemedelsguide återges i slutet av detta dokument.
Minskning av invasiv bröstcancer och DCIS hos kvinnor med DCIS
Kvinnor med DCIS behandlade med lumpektomi och strålbehandling som överväger NOLVADEX (tamoxifencitrat) för att minska förekomsten av en andra bröstcancerhändelse bör bedöma riskerna och fördelarna med behandlingen, eftersom behandling med NOLVADEX (tamoxifencitrat) minskade förekomsten av invasiv bröstcancer. cancer, men har inte visats påverka överlevnaden (se tabell 1 i KLINISK FARMAKOLOGI ).
Minskad incidens av bröstcancer hos högriskkvinnor
Kvinnor som löper hög risk för bröstcancer kan överväga att ta NOLVADEX (tamoxifencitrat)-behandling för att minska förekomsten av bröstcancer. Huruvida fördelarna med behandlingen anses uppväga riskerna beror på kvinnans personliga hälsohistoria och på hur hon väger fördelarna och riskerna. NOLVADEX (tamoxifencitrat)-behandling för att minska förekomsten av bröstcancer kanske därför inte är lämplig för alla kvinnor med hög risk för bröstcancer. Kvinnor som överväger behandling med NOLVADEX (tamoxifencitrat) bör rådfråga sin läkare för en bedömning av de potentiella fördelarna och riskerna innan behandlingen påbörjas för att minska förekomsten av bröstcancer (se tabell 3 i KLINISK FARMAKOLOGI ). Kvinnor bör förstå att NOLVADEX (tamoxifencitrat) minskar förekomsten av bröstcancer, men kanske inte eliminerar risken. NOLVADEX (tamoxifencitrat) minskade förekomsten av små östrogenreceptorpositiva tumörer, men förändrade inte förekomsten av östrogenreceptornegativa tumörer eller större tumörer. Hos kvinnor med bröstcancer som löper hög risk att utveckla en andra bröstcancer, minskade behandling med cirka 5 års NOLVADEX (tamoxifencitrat) den årliga incidensen av en andra bröstcancer med cirka 50 %.
Kvinnor som är gravida eller planerar att bli gravida ska inte ta NOLVADEX (tamoxifencitrat) för att minska risken för bröstcancer. Effektiva icke-hormonella preventivmedel måste användas av alla premenopausala kvinnor som tar NOLVADEX (tamoxifencitrat) och i cirka två månader efter avslutad behandling om de är sexuellt aktiva. Tamoxifen orsakar inte infertilitet, även i närvaro av oregelbunden menstruation. För sexuellt aktiva kvinnor i fertil ålder bör NOLVADEX (tamoxifencitrat)-behandling påbörjas under menstruation. Hos kvinnor med oregelbunden menstruation räcker det med ett negativt B-HCG omedelbart innan behandlingen påbörjas (se VARNINGAR - Graviditetskategori D ).
Två europeiska försök med tamoxifen för att minska risken för bröstcancer genomfördes och visade ingen skillnad i antalet bröstcancerfall mellan tamoxifen- och placeboarmarna. Dessa studier hade försöksdesign som skilde sig från NSABP P-1, var mindre än NSABP P-1 och inkluderade kvinnor med en lägre risk för bröstcancer än de i P-1.
Övervakning under NOLVADEX (tamoxifencitrat) terapi
Kvinnor som tar eller tidigare har tagit NOLVADEX (tamoxifencitrat) ska instrueras att omedelbart söka läkarvård för nya bröstklumpar, vaginal blödning, gynekologiska symtom (menstruella oregelbundenheter, förändringar i vaginal flytning eller bäckensmärta eller tryck), symtom på bensvullnad eller ömhet, oförklarlig andnöd eller förändringar i synen. Kvinnor bör informera alla vårdgivare, oavsett orsaken till utvärderingen, att de tar NOLVADEX (tamoxifencitrat).
Kvinnor som tar NOLVADEX (tamoxifencitrat) för att minska förekomsten av bröstcancer bör genomgå en bröstundersökning, ett mammografi och en gynekologisk undersökning innan behandlingen påbörjas. Dessa studier bör upprepas med regelbundna intervall under behandlingen, i enlighet med god medicinsk praxis. Kvinnor som tar NOLVADEX (tamoxifencitrat) som adjuvant bröstcancerbehandling bör följa samma övervakningsprocedurer som för kvinnor som tar NOLVADEX (tamoxifencitrat) för att minska förekomsten av bröstcancer. Kvinnor som tar NOLVADEX (tamoxifencitrat) som behandling för metastaserad bröstcancer bör granska denna övervakningsplan med sin vårdgivare och välja lämpliga metoder och utvärderingsschema.
Laboratorietester
Periodiska fullständiga blodvärden, inklusive trombocytantal, och periodiska leverfunktionstester bör tas.
Under ATAC-studien rapporterades fler patienter som fick anastrozol ha ett förhöjt serumkolesterol jämfört med patienter som fick NOLVADEX (tamoxifencitrat) (9 % respektive 3,5 %).
Carcinogenes
En konventionell karcinogenesstudie på råttor i doser på 5, 20 och 35 mg/kg/dag (ungefär en, tre och sju gånger den dagliga maximala rekommenderade humandosen på mg/m²-basis) administrerad genom oral sondmatning i upp till 2 år ) avslöjade en signifikant ökning av hepatocellulärt karcinom vid alla doser. Incidensen av dessa tumörer var signifikant högre bland råttor som fick 20 eller 35 mg/kg/dag (69 %) jämfört med de som fick 5 mg/kg/dag (14 %). I en separat studie fick råttor tamoxifen i dosen 45 mg/kg/dag (ungefär nio gånger den dagliga maximala rekommenderade dosen för människa på mg/m²-basis); hepatocellulär neoplasi uppvisades efter 3 till 6 månader.
Granulosacellsäggstockstumörer och interstitialcellstestikulära tumörer observerades i två separata musstudier. Mössen administrerades de trans- och racemiska formerna av tamoxifen i 13 till 15 månader i doser på 5, 20 och 50 mg/kg/dag (ungefär hälften, två och fem gånger den dagliga rekommenderade dosen för människor på en mg/m² grund).
Mutagenes
Ingen genotoxisk potential hittades i ett konventionellt batteri av in vivo och in vitro tester med pro- och eukaryota testsystem med läkemedelsmetaboliserande system. Emellertid observerades ökade nivåer av DNA-addukter genom 32P efter-märkning i DNA från råttlever och odlade humana lymfocyter. Tamoxifen har också visat sig öka nivåerna av mikronukleusbildning in vitro i human lymfoblastoidcellinje (MCL-5). Baserat på dessa fynd är tamoxifen genotoxiskt i gnagare och mänskliga MCL-5-celler.
Nedsatt fertilitet
Tamoxifen orsakade försämring av fertilitet och befruktning hos honråttor vid doser på 0,04 mg/kg/dag (cirka 0,01 gånger den dagliga maximala rekommenderade humandosen på mg/m²-basis) när det doserades i två veckor före parning till och med dag 7 av graviditeten . Vid denna dos reducerades fertilitets- och reproduktionsindex markant med total fosterdödlighet. Fosterdödligheten ökade också vid doser på 0,16 mg/kg/dag (cirka 0,03 gånger den dagliga maximala rekommenderade humana dosen på mg/m²-basis) när honråttor doserades från dag 7-17 av dräktigheten. Tamoxifen orsakade abort, för tidig förlossning och fosterdöd hos kaniner som fick doser lika med eller större än 0,125 mg/kg/dag (cirka 0,05 gånger den dagliga maximala rekommenderade dosen för människa på mg/m²-basis). Det fanns inga teratogena förändringar hos varken råttor eller kaniner.
Graviditetskategori D
Ser VARNINGAR .
Ammande mödrar
Tamoxifen har rapporterats hämma amning. Två placebokontrollerade studier på över 150 kvinnor har visat att tamoxifen signifikant hämmar tidig mjölkproduktion efter förlossningen. I båda studierna administrerades tamoxifen inom 24 timmar efter leverans i mellan 5 och 18 dagar. Effekten av tamoxifen på etablerad mjölkproduktion är inte känd.
Det finns inga data som visar huruvida tamoxifen utsöndras i modersmjölk. Om det utsöndras finns det inga data om effekterna av tamoxifen i bröstmjölk på ammade spädbarn eller ammade djur. Direkt neonatal exponering av tamoxifen för möss och råttor (inte via bröstmjölk) gav emellertid 1) reproduktionsorgansskador hos hongnagare (liknande de som ses hos människor efter intrauterin exponering för dietylstilbestrol) och 2) funktionella defekter i fortplantningsorganen hos hanar. gnagare såsom testikelatrofi och stopp av spermatogenes.
Det är inte känt om NOLVADEX (tamoxifencitrat) utsöndras i modersmjölk. På grund av risken för allvarliga biverkningar hos ammande spädbarn från NOLVADEX (tamoxifencitrat), bör kvinnor som tar NOLVADEX (tamoxifencitrat) inte amma.
Minskad incidens av bröstcancer hos högriskkvinnor med DCIS
Det är inte känt om NOLVADEX (tamoxifencitrat) utsöndras i modersmjölk. På grund av risken för allvarliga biverkningar hos ammande spädbarn från NOLVADEX (tamoxifencitrat), bör kvinnor som tar NOLVADEX (tamoxifencitrat) inte amma.
Pediatrisk användning
Säkerheten och effekten av NOLVADEX (tamoxifencitrat) för flickor i åldern två till 10 år med McCune-Albrights syndrom och tidig pubertet har inte studerats efter ett års behandling. Långtidseffekterna av NOLVADEX (tamoxifencitrat)-behandling för flickor har inte fastställts. Hos vuxna som behandlats med NOLVADEX (tamoxifencitrat) har en ökning av incidensen av livmodermaligniteter, stroke och lungemboli noterats (se LÅDA VARNING , och KLINISK FARMAKOLOGI-Kliniska studier-McCune-Albrights syndrom underavsnitt).
Geriatrisk användning
NSABP P-1-studien var andelen kvinnor som var minst 65 år 16 %. Kvinnor över 70 år stod för 6 % av deltagarna. En minskning av incidensen av bröstcancer sågs bland deltagare i var och en av undergrupperna: Totalt 28 och 10 invasiva bröstcancersjukdomar sågs bland deltagare 65 år och äldre i placebo- respektive NOLVADEX-gruppen (tamoxifencitrat). För alla andra resultat återspeglar resultaten i denna delmängd de resultat som observerats i undergruppen kvinnor som är minst 50 år gamla. Inga övergripande skillnader i tolerabilitet observerades mellan äldre och yngre patienter (se KLINISK FARMAKOLOGI - Kliniska studier - Minskning av incidensen av bröstcancer hos högriskkvinnor sektion).
NSABP B-24-studien var andelen kvinnor som var minst 65 år 23 %. Kvinnor över 70 år stod för 10 % av deltagarna. Totalt sågs 14 och 12 invasiva bröstcancerformer bland deltagarna 65 år och äldre i placebo- respektive NOLVADEX-gruppen (tamoxifencitrat). Denna delmängd är för liten för att dra några slutsatser om effektivitet. För alla andra effektmått var resultaten i denna delmängd jämförbara med de för yngre kvinnor som deltog i denna studie. Inga övergripande skillnader i tolerabilitet observerades mellan äldre och yngre patienter.
ÖVERDOS
Tecken som observerats vid de högsta doserna efter studier för att fastställa LD50 hos djur var andningssvårigheter och kramper.
Akut överdosering hos människor har inte rapporterats. I en studie av patienter med avancerad metastaserande cancer som specifikt fastställde den maximalt tolererade dosen av NOLVADEX (tamoxifencitrat) vid utvärdering av användningen av mycket höga doser för att vända multidrogresistens, noterades akut neurotoxicitet som manifesterades av tremor, hyperreflexi, ostadig gång och yrsel. Dessa symtom uppträdde inom 3-5 dagar efter påbörjad NOLVADEX (tamoxifencitrat) och försvann inom 2-5 dagar efter avslutad behandling. Ingen permanent neurologisk toxicitet noterades. En patient fick ett anfall flera dagar efter att NOLVADEX (tamoxifencitrat) avbröts och neurotoxiska symtom hade försvunnit. Orsakssambandet mellan krampanfall och NOLVADEX-behandling (tamoxifencitrat) är okänt. Doserna som gavs till dessa patienter var alla större än 400 mg/m² laddningsdos, följt av underhållsdoser på 150 mg/m² NOLVADEX (tamoxifencitrat) två gånger dagligen.
samma studie noterades förlängning av QT-intervallet på elektrokardiogrammet när patienterna fick doser högre än 250 mg/m² laddningsdos, följt av underhållsdoser på 80 mg/m² NOLVADEX (tamoxifencitrat) två gånger om dagen. För en kvinna med en kroppsyta på 1,5 m² var den minsta laddningsdos och underhållsdos som gavs vid vilka neurologiska symtom och QT-förändringar inträffade minst 6 gånger högre i förhållande till den maximala rekommenderade dosen.
Ingen specifik behandling för överdosering är känd; Behandlingen måste vara symtomatisk.
KONTRAINDIKATIONER
NOLVADEX (tamoxifencitrat) är kontraindicerat hos patienter med känd överkänslighet mot läkemedlet eller något av dess ingredienser.
Minskad incidens av bröstcancer hos högriskkvinnor och kvinnor med DCIS
NOLVADEX (tamoxifencitrat) är kontraindicerat för kvinnor som kräver samtidig antikoagulantiabehandling av kumarintyp eller till kvinnor med en historia av djup ventrombos eller lungemboli.
KLINISK FARMAKOLOGI
NOLVADEX (tamoxifencitrat) är ett icke-steroidt medel som har visat potenta antiöstrogena egenskaper i djurförsökssystem. De antiöstrogena effekterna kan vara relaterade till dess förmåga att konkurrera med östrogen om bindningsställen i målvävnader såsom bröst. Tamoxifen hämmar induktionen av bröstcancer hos råtta inducerat av dimetylbensantracen (DMBA) och orsakar regression av redan etablerade DMBA-inducerade tumörer. I denna råttmodell verkar tamoxifen utöva sina antitumöreffekter genom att binda östrogenreceptorerna.
I cytosoler som härrör från humana bröstadenokarcinom konkurrerar tamoxifen med östradiol om östrogenreceptorprotein.
Absorption och distribution
Efter en oral engångsdos på 20 mg tamoxifen inträffade en genomsnittlig maximal plasmakoncentration på 40 ng/ml (intervall 35 till 45 ng/ml) cirka 5 timmar efter dosering. Nedgången i plasmakoncentrationer av tamoxifen är bifasisk med en terminal halveringstid på cirka 5 till 7 dagar. Den genomsnittliga maximala plasmakoncentrationen av N-desmetyltamoxifen är 15 ng/ml (intervall 10 till 20 ng/ml). Kronisk administrering av 10 mg tamoxifen två gånger dagligen i 3 månader till patienter resulterar i genomsnittliga steady-state plasmakoncentrationer på 120 ng/ml (intervall 67-183 ng/ml) för tamoxifen och 336 ng/ml (intervall 148-654 ng/ mL) för N-desmetyltamoxifen. De genomsnittliga steady-state plasmakoncentrationerna av tamoxifen och N-desmetyltamoxifen efter administrering av 20 mg tamoxifen en gång dagligen i 3 månader är 122 ng/ml (intervall 71-183 ng/ml) och 353 ng/ml (intervall 152-706 ng /ml) respektive. Efter påbörjad behandling uppnås steady state-koncentrationer för tamoxifen inom cirka 4 veckor och steady-state-koncentrationer för N-desmetyltamoxifen uppnås inom cirka 8 veckor, vilket tyder på en halveringstid på cirka 14 dagar för denna metabolit. I en steady-state, crossover-studie av 10 mg NOLVADEX (tamoxifencitrat) tabletter som gavs två gånger dagligen jämfört med en 20 mg NOLVADEX (tamoxifencitrat) tablett en gång dagligen, var 20 mg NOLVADEX (tamoxifencitrat)-tabletten bioekvivalent med de 10 mg NOLVADEX (tamoxifencitrat) tabletter.
Ämnesomsättning
Tamoxifen metaboliseras i stor utsträckning efter oral administrering. N-desmetyltamoxifen är den huvudsakliga metaboliten som finns i patienternas plasma. Den biologiska aktiviteten hos N-desmetyltamoxifen verkar likna den hos tamoxifen. 4-Hydroxytamoxifen och ett primärt alkoholderivat i sidokedjan av tamoxifen har identifierats som mindre metaboliter i plasma. Tamoxifen är ett substrat för cytokrom P-450 3A, 2C9 och 2D6 och en hämmare av P-glykoprotein.
Exkretion
Studier på kvinnor som fått 20 mg 14C-tamoxifen har visat att cirka 65 % av den administrerade dosen utsöndrades från kroppen under en period av 2 veckor med fekal utsöndring som den primära elimineringsvägen. Läkemedlet utsöndras huvudsakligen som polära konjugat, med oförändrade läkemedel och okonjugerade metaboliter som står för mindre än 30 % av den totala fekala radioaktiviteten.
Särskilda populationer
Effekterna av ålder, kön och ras på farmakokinetiken för tamoxifen har inte fastställts. Effekterna av nedsatt leverfunktion på tamoxifens metabolism och farmakokinetik har inte fastställts.
Pediatriska patienter
Farmakokinetiken för tamoxifen och N-desmetyltamoxifen karakteriserades med hjälp av en populationsfarmakokinetisk analys med glesa prover per patient från 27 kvinnliga pediatriska patienter i åldern 2 till 10 år inkluderade i en studie utformad för att utvärdera säkerheten, effekten och farmakokinetiken för NOLVADEX (tamoxifen) citrat) vid behandling av McCune-Albrights syndrom. Riktiga data från två farmakokinetiska prövningar av tamoxifencitrat där 59 postmenopausala kvinnor med bröstcancer slutförde studierna inkluderades i analysen för att fastställa den strukturella farmakokinetiska modellen för tamoxifen. En enfacksmodell gav den bästa passformen till data.
Hos pediatriska patienter var en genomsnittlig steady state maximal plasmakoncentration (Css, max) och AUC på 187 ng/mL respektive 4110 ng tim/ml, och Css, max inträffade cirka 8 timmar efter dosering. Clearance (CL/F) som justerad kroppsvikt hos kvinnliga pediatriska patienter var cirka 2,3 gånger högre än hos kvinnliga bröstcancerpatienter. I den yngsta kohorten av kvinnliga pediatriska patienter (2-6 åringar) var CL/F 2,6 gånger högre; i den äldsta kohorten (7-10,9 åringar) var CL/F cirka 1,9 gånger högre. Exponeringen för N-desmetyltamoxifen var jämförbar mellan pediatriska och vuxna patienter. Säkerheten och effekten av NOLVADEX (tamoxifencitrat) för flickor i åldern två till 10 år med McCune-Albrights syndrom och tidig pubertet har inte studerats efter ett års behandling. Långtidseffekterna av NOLVADEX (tamoxifencitrat)-behandling på flickor har inte fastställts. Hos vuxna som behandlats med NOLVADEX (tamoxifencitrat) har en ökning av incidensen av uterina maligniteter, stroke och lungemboli noterats (se LÅDA VARNING ).
Läkemedelsinteraktioner
In vitro-studier visade att erytromycin, cyklosporin, nifedipin och diltiazem kompetitivt hämmade bildningen av N-desmetyltamoxifen med skenbar K1 på 20, 1, 45 respektive 30 µM. Den kliniska betydelsen av dessa in vitro-studier är okänd.
Tamoxifen minskade plasmakoncentrationen av letrozol med 37 % när dessa läkemedel administrerades samtidigt. Rifampin, en cytokrom P-450 3A4-inducerare, minskade tamoxifens AUC och Cmax med 86 % respektive 55 %. Aminoglutetimid minskar plasmakoncentrationerna av tamoxifen och N-desmetyltamoxifen. Medroxiprogesteron minskar plasmakoncentrationerna av N-desmetyl, men inte tamoxifen.
studien med anastrozol-adjuvans minskade samtidig administrering av anastrozol och NOLVADEX (tamoxifencitrat) hos bröstcancerpatienter anastrozolplasmakoncentrationen med 27 % jämfört med de som uppnåddes med enbart anastrozol; Samtidig administrering påverkade dock inte farmakokinetiken för tamoxifen eller N-desmetyltamoxifen (se FÖRSIKTIGHETSÅTGÄRDER -DROG INTERAKTIONER ). NOLVADEX (tamoxifencitrat) ska inte administreras samtidigt med anastrozol.
Kliniska studier
Metastaserad bröstcancer
Premenopausala kvinnor (NOLVADEX (tamoxifencitrat) vs. ablation)
Tre prospektiva, randomiserade studier (Ingle, Pritchard, Buchanan) jämförde NOLVADEX (tamoxifencitrat) med ovarieablation (ooforektomi eller ovariebestrålning) hos premenopausala kvinnor med avancerad bröstcancer. Även om den objektiva svarsfrekvensen, tiden till behandlingsmisslyckande och överlevnad var likartade med båda behandlingarna, förhindrade den begränsade patienttillväxten en demonstration av likvärdighet. I en översiktsanalys av överlevnadsdata från de tre studierna var riskkvoten för död (NOLVADEX (tamoxifencitrat)/ovarieablation) 1,00 med tvåsidiga 95 % konfidensintervall på 0,73 till 1,37. Förhöjda serum- och plasmaöstrogener har observerats hos premenopausala kvinnor som fått NOLVADEX (tamoxifencitrat), men data från de randomiserade studierna tyder inte på en negativ effekt av denna ökning. Ett begränsat antal premenopausala patienter med sjukdomsprogression under NOLVADEX (tamoxifencitrat)-behandling svarade på efterföljande ovarieablation.
Manlig bröstcancer
Publicerade resultat från 122 patienter (119 evaluerbara) och fallrapporter från 16 patienter (13 evaluerbara) behandlade med NOLVADEX (tamoxifencitrat) har visat att NOLVADEX (tamoxifencitrat) är effektivt för palliativ behandling av manlig bröstcancer. Sextiosex av dessa 132 utvärderbara patienter svarade på NOLVADEX (tamoxifencitrat) som utgör en objektiv svarsfrekvens på 50 %.
Adjuvant bröstcancer
Översikt
Early Breast Cancer Trialists' Collaborative Group (EBCTCG) genomförde världsomspännande översikter av systemisk adjuvant terapi för tidig bröstcancer 1985, 1990 och igen 1995. 1998 rapporterades 10-åriga resultatdata för 36 689 kvinnor i 5 slumpmässiga försök adjuvans NOLVADEX (tamoxifencitrat) med doser på 20-40 mg/dag i 1-5+ år. Tjugofem procent av patienterna fick 1 års eller mindre provbehandling, 52 % fick 2 år och 23 % fick cirka 5 år. Fyrtioåtta procent av tumörerna var östrogenreceptor (ER) positiva (> 10 fmol/mg), 21 % var ER dåliga (
Bland kvinnor med ER-positiv eller okänd bröstcancer och positiva noder som fick cirka 5 års behandling var den totala överlevnaden efter 10 år 61,4 % för NOLVADEX (tamoxifencitrat) jämfört med 50,5 % för kontroll (logrank 2p
Effekten av den schemalagda varaktigheten av tamoxifen kan beskrivas enligt följande. Hos kvinnor med ER-positiv eller okänd bröstcancer som fick NOLVADEX (tamoxifencitrat) under 1 år eller mindre, 2 år eller cirka 5 år, var den proportionella minskningen av dödligheten 12 %, 17 % respektive 26 % (trend signifikant vid 2p
Nyttan är mindre tydlig för kvinnor med ER dålig bröstcancer där den proportionella minskningen av återfall var 10 % (2p = 0,007) för alla varaktigheter tillsammans, eller 9 % (2p = 0,02) om kontralaterala bröstcancer exkluderas. Motsvarande minskning av dödligheten var 6 % (NS). Effekterna av cirka 5 års NOLVADEX (tamoxifencitrat) på återfall och dödlighet var likartade oavsett ålder och samtidig kemoterapi. Det fanns inget som tydde på att doser större än 20 mg per dag var effektivare.
Anastrozol Adjuvant ATAC Trial - Studie av Anastrozol jämfört med NOLVADEX (tamoxifencitrat) för adjuvant behandling av tidig bröstcancer - En anastrozol-adjuvansstudie genomfördes på 9366 postmenopausala kvinnor med operabel bröstcancer som randomiserades till att få adjuvant behandling med antingen anastrozol 1 mg dagligen, NOLVADEX (tamoxifencitrat) 20 mg dagligen, eller en kombination av dessa två behandlingar under fem år eller tills det återkommer. av sjukdomen. Vid en medianuppföljning på 33 månader visade kombinationen av anastrozol och NOLVADEX (tamoxifencitrat) ingen effektfördel jämfört med NOLVADEX (tamoxifencitrat) enbart behandling hos alla patienter såväl som i den hormonreceptorpositiva subpopulationen. Denna behandlingsarm avbröts från försöket. Vänligen hänvisa till KLINISK FARMAKOLOGI-Specialpopulationer-Droge-läkemedelsinteraktioner , FÖRSIKTIGHETSÅTGÄRDER-Laboratorietester , FÖRSIKTIGHETSÅTGÄRDER - Läkemedelsinteraktioner och NEGATIVA REAKTIONER avsnitt för säkerhetsinformation från detta försök. Se den fullständiga förskrivningsinformationen för ARIMIDEX® (anastrozol) 1 mg tabletter för ytterligare information om denna studie.
Patienter i de två monoterapiarmarna i ATAC-studien behandlades i median 60 månader (5 år) och följdes i median 68 månader. Sjukdomsfri överlevnad i den intention-to-treat-populationen förbättrades statistiskt signifikant [Hazard Ratio (HR) = 0,87, 95 % CI: 0,78, 0,97, p=0,0127] i anastrazol-armen jämfört med NOLVADEX (tamoxifencitrat)-armen .
Nod Positiv - Individuella studier
Två studier (Hubay och NSABP B-09) visade en förbättrad sjukdomsfri överlevnad efter radikal eller modifierad radikal mastektomi hos postmenopausala kvinnor eller kvinnor 50 år eller äldre med kirurgiskt botad bröstcancer med positiva axillära noder när NOLVADEX (tamoxifencitrat) var läggs till adjuvant cytotoxisk kemoterapi. I Hubay-studien tillsattes NOLVADEX (tamoxifencitrat) till "lequo;lågdos" CMF (cyklofosfamid, metotrexat och fluorouracil). I NSABP B-09-studien tillsattes NOLVADEX (tamoxifencitrat) till melfalan [L-fenylalaninsap (P)] och fluorouracil (F).
Hubay-studien var det mer sannolikt att patienter med en positiv (mer än 3 fmol) östrogenreceptor gynnades. I NSABP B-09-studien på kvinnor i åldrarna 50-59 år var det bara kvinnor med både östrogen- och progesteronreceptornivåer på 10 fmol eller mer som klart gynnades, medan det fanns en icke-statistiskt signifikant trend mot negativ effekt hos kvinnor med både östrogen- och progesteronreceptornivåer mindre än 10 fmol. Hos kvinnor i åldern 60-70 år fanns en trend mot en gynnsam effekt av NOLVADEX (tamoxifencitrat) utan något tydligt samband med östrogen- eller progesteronreceptorstatus.
Tre prospektiva studier (ECOG-1178, Toronto, NATO) med användning av NOLVADEX (tamoxifencitrat) adjuvans som ett enda medel visade en förbättrad sjukdomsfri överlevnad efter total mastektomi och axillär dissektion för postmenopausala kvinnor med positiva axillära noder jämfört med placebo/ingen behandlingskontroller . NATO-studien visade också en övergripande överlevnadsfördel.
Nod Negativ - Individuella studier
NSABP B-14, en prospektiv, dubbelblind, randomiserad studie, jämförde NOLVADEX (tamoxifencitrat) med placebo hos kvinnor med axillär nodnegativ, östrogenreceptorpositiv (≥ 10 fmol/mg cytosolprotein) bröstcancer (som adjuvant terapi) , efter total mastektomi och axillär dissektion, eller segmentell resektion
PATIENTINFORMATION
LÄKEMEDELSGUIDE
NOLVADEX (tamoxifencitrat) ® (NOLE-vah-dex) Tabletter Generiskt namn: tamoxifen (ta-MOX-I-fen)
Skrivet för kvinnor som använder NOLVADEX (tamoxifencitrat) för att minska sin höga chans att få bröstcancer eller som har ductal carcinoma in situ (DCIS)
Denna medicinguide diskuterar endast användningen av NOLVADEX (tamoxifencitrat) för att minska risken för att få bröstcancer hos kvinnor med hög risk och hos kvinnor som behandlas för DCIS.
Personer som tar NOLVADEX (tamoxifencitrat) att behandla Bröstcancer har andra fördelar och andra beslut att fatta än högriskkvinnor eller kvinnor med ductal carcinoma in situ (DCIS) som tar NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer. Om du redan har bröstcancer, prata med din läkare om hur fördelarna med att behandla bröstcancer med NOLVADEX (tamoxifencitrat) kan jämföras med riskerna som beskrivs i detta dokument.
Varför ska jag läsa denna medicinguide?
Den här guiden har information som hjälper dig att bestämma om du ska använda NOLVADEX (tamoxifencitrat) för att minska din chans att få bröstcancer.
Du och din läkare bör prata om huruvida den möjliga fördelen med NOLVADEX (tamoxifencitrat) för att minska din höga chans att få bröstcancer är större än de möjliga riskerna. Din läkare har ett speciellt datorprogram eller handhållen miniräknare för att berätta om du tillhör högriskgruppen. Om du har DCIS och har behandlats med kirurgi och strålbehandling, kan din läkare ordinera NOLVADEX (tamoxifencitrat) för att minska din chans att få invasiv (spridande) bröstcancer.
Läs denna guide noggrant innan du börjar med NOLVADEX (tamoxifencitrat). Det är viktigt att läsa informationen du får varje gång du får mer medicin. Det kan vara något nytt. Den här guiden berättar inte allt om NOLVADEX (tamoxifencitrat) och gör det inte ersätta att prata med din läkare.
Endast du och din läkare kan avgöra om NOLVADEX (tamoxifencitrat) är rätt för dig.
Vilken är den viktigaste informationen jag bör veta om att använda NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer?
NOLVADEX (tamoxifencitrat) är ett receptbelagt läkemedel som är som östrogen (kvinnligt hormon) på vissa sätt och annorlunda på andra sätt. I bröstet kan NOLVADEX (tamoxifencitrat) blockera östrogens effekter. Eftersom det gör detta kan NOLVADEX (tamoxifencitrat) blockera tillväxten av bröstcancer som behöver östrogen för att växa (cancer som är östrogen- eller progesteronreceptorpositiv).
NOLVADEX (tamoxifencitrat) kan minska risken att få bröstcancer hos kvinnor med en högre chans än normalt att få bröstcancer under de kommande fem åren (högriskkvinnor) och kvinnor med DCIS.
Eftersom högriskkvinnor ännu inte har cancer, är det viktigt att noga fundera över om den möjliga nyttan av NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer är större än dess möjliga risker.
Denna medicineringsguide går igenom riskerna och fördelarna med att använda NOLVADEX (tamoxifencitrat) för att minska risken för att få bröstcancer hos högriskkvinnor och kvinnor med DCIS. Det gör den här guiden inte diskutera de särskilda förmånerna och besluten för personer som redan har bröstcancer.
Varför använder kvinnor och män NOLVADEX (tamoxifencitrat)?
NOLVADEX (tamoxifencitrat) har mer än en användning. NOLVADEX (tamoxifencitrat) används:
för att minska chansen att få bröstcancer hos kvinnor med en högre chans än normalt att få bröstcancer under de kommande 5 åren (högriskkvinnor)
för att minska chansen av att få invasiv (spridning) bröstcancer hos kvinnor som genomgått operation och strålning för ductal carcinoma in situ (DCIS). DCIS betyder att cancern bara finns i mjölkkanalerna.
att behandla bröstcancer hos kvinnor efter att de avslutat tidig behandling. Tidig behandling kan innefatta kirurgi, strålning och kemoterapi. NOLVADEX (tamoxifencitrat) kan förhindra att cancern sprids till andra delar av kroppen. Det kan också minska kvinnans chans att få en ny bröstcancer. hos kvinnor och män,
att behandla bröstcancer som har spridit sig till andra delar av kroppen (metastaserande bröstcancer).
Den här guiden talar bara om att använda NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer (#1 och #2 ovan).
Vilka är fördelarna med NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer hos kvinnor med hög risk och hos kvinnor som behandlas för DCIS?
En stor amerikansk studie tittade på högriskkvinnor och jämförde de som tog NOLVADEX (tamoxifencitrat) i 5 år med andra som tog ett piller utan NOLVADEX (tamoxifencitrat) (placebo). Högriskkvinnor definierades som kvinnor som har 1,7 % eller större chans att få bröstcancer under de kommande 5 åren, baserat på ett speciellt datorprogram. I den här studien:
- Av 1 000 högriskkvinnor som tog placebo , varje år fick cirka 7 bröstcancer.
- Av 1 000 högriskkvinnor som tog NOLVADEX (tamoxifencitrat) , varje år fick cirka 4 bröstcancer.
Studien visade att högriskkvinnor som tog NOLVADEX (tamoxifencitrat) i genomsnitt minskade sina chanser att få bröstcancer med 44 %, från 7 av 1 000 till 4 av 1 000.
En annan amerikansk studie tittade på kvinnor med DCIS och jämförde de som tog NOLVADEX (tamoxifencitrat) i 5 år med andra som tog placebo. I den här studien:
- Av 1 000 kvinnor med DCIS som fick placebo varje år fick cirka 17 bröstcancer.
- Av 1 000 kvinnor med DCIS som tog NOLVADEX (tamoxifencitrat) , varje år fick cirka 10 bröstcancer.
Studien visade att kvinnor med DCIS som tog NOLVADEX (tamoxifencitrat) i genomsnitt sänkte sina chanser att få invasiv (spridning) bröstcancer med 43 %, från 17 av 1 000 till 10 av 1 000.
Dessa studier betyder inte att ta NOLVADEX (tamoxifencitrat) kommer att minska din personliga chans att få bröstcancer. Vi vet inte vad fördelarna kommer att vara för en kvinna som tar NOLVADEX (tamoxifencitrat) för att minska sin chans att få bröstcancer.
Vilka är riskerna med NOLVADEX (tamoxifencitrat)?
I studierna som beskrivs under "Vilka är fördelarna med NOLVADEX (tamoxifencitrat)?", fick högriskkvinnorna som tog NOLVADEX (tamoxifencitrat) vissa biverkningar i högre grad än de som fick placebo.
Vissa av dessa biverkningar kan orsaka dödsfall.
I en studie, på kvinnor som fortfarande hade sin livmoder
- Av varje 1 000 kvinnor som fick placebo fick en varje år livmoderslemhinnan (cancer i livmoderns slemhinna) och ingen fick livmodersarkom (cancer i livmoderns kropp).
- Av varje 1 000 kvinnor som tog NOLVADEX (tamoxifencitrat) fick 2 varje år livmodercancer och färre än 1 fick livmodersarkom.
Dessa resultat visar att i genomsnitt i högriskkvinnor som fortfarande hade sin livmoder , NOLVADEX (tamoxifencitrat) fördubblade chansen att få endometriecancer från 1 av 1 000 till 2 av 1 000, och det ökade chansen att få livmodersarkom. Detta betyder inte att intag av NOLVADEX (tamoxifencitrat) kommer att fördubbla din personliga chans att få endometriecancer eller öka din chans att få livmodersarkom. Vi vet inte vad denna risk kommer att vara för en kvinna. Risken är annorlunda för kvinnor som inte längre har sin livmoder.
För alla kvinnor i denna studie ökade att ta NOLVADEX (tamoxifencitrat) risken för att få en blodpropp i lungorna eller venerna, eller att få en stroke. I vissa fall dog kvinnor av dessa effekter.
NOLVADEX (tamoxifencitrat) ökade risken att få grå starr (grumling av ögats lins) eller behöva operation för grå starr. (Se "Vilka är de möjliga biverkningarna av NOLVADEX (tamoxifencitrat)?" för mer information om biverkningar.)
Vad vet vi inte om att ta NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer?
Vi vet inte
- om NOLVADEX (tamoxifencitrat) minskar risken att få bröstcancer hos kvinnor som har onormala bröstcancergener (BRCA1 och BRCA2)
- om att ta NOLVADEX (tamoxifencitrat) i 5 år minskar antalet bröstcancer som en kvinna kommer att få under sin livstid eller om det bara försenar vissa bröstcancerfall
- om NOLVADEX (tamoxifencitrat) hjälper en kvinna att leva längre
- effekterna av att ta NOLVADEX (tamoxifencitrat) med hormonersättningsterapi (HRT), p-piller eller androgener (manliga hormoner)
- fördelarna med att ta NOLVADEX (tamoxifencitrat) om du är yngre än 35 år
Studier görs för att lära sig mer om de långsiktiga fördelarna och riskerna med att använda NOLVADEX (tamoxifencitrat) för att minska risken att få bröstcancer.
Vilka är de möjliga biverkningarna av NOLVADEX (tamoxifencitrat)?
Den vanligaste biverkningen av NOLVADEX (tamoxifencitrat) är värmevallningar. Detta är inte ett tecken på ett allvarligt problem.
Den näst vanligaste biverkningen är flytningar från slidan. Om flytningen är blodig kan det vara ett tecken på ett allvarligt problem. [Se "Förändringar i slemhinnan (endometrium) eller livmoderns kropp" nedan.]
Mindre vanliga men allvarliga biverkningar av NOLVADEX (tamoxifencitrat) listas nedan. Dessa kan inträffa när som helst. Ring din läkare omedelbart om du har några tecken på biverkningar som anges nedan:
- Förändringar i slemhinnan (endometrium) eller livmoderns kropp. Dessa förändringar kan innebära att allvarliga problem börjar, inklusive cancer i livmodern. Tecken på förändringar i livmodern är:
- Vaginal blödning eller blodig flytning som kan vara rostig eller brun. Du bör ringa din läkare även om endast en liten blödning inträffar.
- Förändring i din månatliga blödning, till exempel i mängden eller tidpunkten för blödning eller ökad koagulering.
- Smärta eller tryck i bäckenet (under naveln).
- Blodproppar i dina vener eller lungor. Dessa kan orsaka allvarliga problem, inklusive dödsfall. Du kan få proppar upp till 2-3 månader efter att du slutat ta NOLVADEX (tamoxifencitrat). Tecken på blodproppar är:
- plötslig bröstsmärta, andnöd, upphostning av blod
- smärta, ömhet eller svullnad i ena eller båda dina ben
- Stroke. Stroke kan orsaka allvarliga medicinska problem, inklusive dödsfall. Tecken på stroke är:
- plötslig svaghet, stickningar eller domningar i ansiktet, armen eller benet, särskilt på ena sidan av kroppen
- plötslig förvirring, problem med att tala eller förstå
- plötsliga problem med att se på ett eller båda ögonen
- plötsliga problem med att gå, yrsel, förlust av balans eller koordination
- plötslig svår huvudvärk utan känd orsak
- Grå starr eller ökad chans att behöva operation för grå starr. Tecknet på dessa problem är långsam suddig syn.
- Leverproblem, inklusive gulsot. Tecken på leverproblem inkluderar brist på aptit och gulfärgning av huden eller ögonvitorna.
Dessa är inte alla möjliga biverkningar av NOLVADEX (tamoxifencitrat). För en fullständig lista, fråga din läkare eller apotekspersonal.
Vem bör inte ta NOLVADEX (tamoxifencitrat)?
Ta inte NOLVADEX (tamoxifencitrat) av någon anledning om du
- Är gravid eller planerar att bli gravid medan du tar NOLVADEX (tamoxifencitrat) eller under 2 månader efter att du slutat ta NOLVADEX (tamoxifencitrat). NOLVADEX (tamoxifencitrat) kan skada ditt ofödda barn. Det tar cirka 2 månader att ta bort NOLVADEX (tamoxifencitrat) från din kropp. För att vara säker på att du inte är gravid kan du börja ta NOLVADEX (tamoxifencitrat) medan du har din menstruation. Eller så kan du ta ett graviditetstest för att vara säker på att du inte är gravid innan du börjar.
- Ammar. Vi vet inte om NOLVADEX (tamoxifencitrat) kan passera genom din mjölk och skada ditt barn.
- Har haft en allergisk reaktion mot NOLVADEX (tamoxifencitrat) eller tamoxifen (det andra namnet för NOLVADEX (tamoxifencitrat) ), eller någon av dess inaktiva ingredienser.
Om du blir gravid medan du tar NOLVADEX (tamoxifencitrat), sluta ta det omedelbart och kontakta din läkare. NOLVADEX (tamoxifencitrat) kan skada ditt ofödda barn. Ta inte NOLVADEX (tamoxifencitrat) för att minska din chans att få bröstcancer om
- Du har någonsin haft en blodpropp som behövde medicinsk behandling.
- Du tar läkemedel för att tunna ut ditt blod, som warfarin (även kallat Coumadin®*).
- Din förmåga att röra dig är begränsad under större delen av dina vakna timmar.
- Du löper risk för blodproppar. Din läkare kan tala om för dig om du löper hög risk för blodproppar.
- Du har inte en högre chans än normalt att få bröstcancer. Din läkare kan tala om för dig om du är en högriskkvinna.
Hur ska jag ta NOLVADEX (tamoxifencitrat)?
- Svälj tabletten/tabletterna hela med vatten eller annan alkoholfri vätska. Du kan ta NOLVADEX (tamoxifencitrat) med eller utan mat. Ta din medicin varje dag. Det kan vara lättare att komma ihåg om du tar det vid samma tidpunkt varje dag.
- Om du glömmer en dos, ta den när du kommer ihåg, ta sedan nästa dos som vanligt. Om det nästan är dags för nästa dos eller om du kommer ihåg nästa dos, ta inte extra tabletter för att kompensera för den missade dosen.
- Ta NOLVADEX (tamoxifencitrat) i 5 år, om inte din läkare säger något annat.
Vad ska jag undvika när jag tar NOLVADEX (tamoxifencitrat)?
- Bli inte gravid medan du tar NOLVADEX (tamoxifencitrat) eller under 2 månader efter att du slutat. NOLVADEX (tamoxifencitrat) kan stoppa hormonella preventivmetoder från att fungera. Hormonella metoder inkluderar p-piller, plåster, injektioner, ringar och implantat. Därför, medan du tar NOLVADEX (tamoxifencitrat), använda preventivmedel som inte använder hormoner, såsom kondomer, diafragma med spermiedödande medel eller vanligt spiral. Om du blir gravid, sluta ta NOLVADEX (tamoxifencitrat) omedelbart och ring din läkare.
- Amma inte. Vi vet inte om NOLVADEX (tamoxifencitrat) kan passera genom din mjölk och om det kan skada barnet.
Vad ska jag göra när jag tar NOLVADEX (tamoxifencitrat)?
- Gör regelbundna gynekologiska kontroller ("kvinnliga undersökningar"), bröstundersökningar och mammografi. Din läkare kommer att berätta hur ofta. Dessa kommer att kontrollera efter tecken på bröstcancer och cancer i livmoderslemhinnan (livmoderslemhinnan). Eftersom NOLVADEX (tamoxifencitrat) inte förhindrar all bröstcancer, och du kan få andra typer av cancer, behöver du dessa undersökningar för att hitta cancer så tidigt som möjligt.
- Eftersom NOLVADEX (tamoxifencitrat) kan orsaka allvarliga biverkningar, var noga med din kropp. Tecken du bör leta efter finns listade i "Vilka är de möjliga biverkningarna av NOLVADEX (tamoxifencitrat)?"
- Berätta för alla läkare att du ser att du tar NOLVADEX (tamoxifencitrat).
- Tala genast om för din läkare om du har några nya bröstklumpar.
Allmän information om säker och effektiv användning av NOLVADEX (tamoxifencitrat)
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Din läkare har ordinerat NOLVADEX (tamoxifencitrat) endast till dig. Ge det inte till andra människor, även om de har ett liknande tillstånd, eftersom det kan skada dem. Använd det inte för ett tillstånd som det inte var ordinerat för.
Denna medicinguide är en sammanfattning av information om NOLVADEX (tamoxifencitrat) för kvinnor som använder NOLVADEX (tamoxifencitrat) för att minska sin höga chans att få bröstcancer eller som har DCIS. Om du vill ha mer information om NOLVADEX (tamoxifencitrat), fråga din läkare eller apotekspersonal. De kan ge dig information om NOLVADEX (tamoxifencitrat) som är skriven för vårdpersonal. För mer information om NOLVADEX (tamoxifencitrat) eller bröstcancer, besök www.NOLVADEX (tamoxifencitrat) .com eller ring 1-800-236-9933.
Ingredienser: tamoxifencitrat, karboximetylcellulosakalcium, magnesiumstearat, mannitol och stärkelse.
Denna medicineringsguide har godkänts av US Food and Drug Administration
