Neoral 25mg, 100mg Cyclosporine Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Neoral 25mg och hur används det?
Neoral 25mg är ett receptbelagt läkemedel som används som profylax för att förhindra organavstötning efter transplantation och för att behandla symtom på reumatoid artrit och psoriasis. Neoral kan användas ensamt eller tillsammans med andra läkemedel.
Neoral tillhör en klass av läkemedel som kallas DMARD, immunmodulatorer; Immunsuppressiva medel; Calcineurin-hämmare.
Det är inte känt om Neoral 25 mg är säkert och effektivt för barn.
Vilka är de möjliga biverkningarna av Neoral?
Neoral kan orsaka allvarliga biverkningar inklusive:
- nässelfeber,
- svårt att andas,
- svullnad av ansikte, läppar, tunga eller svalg,
- problem med tal, tanke, syn eller muskelrörelser,
- beslag,
- svår huvudvärk,
- suddig syn,
- dunkar i nacken eller öronen,
- blek hud,
- lätt att få blåmärken,
- ovanlig blödning,
- illamående,
- svaghet,
- pirrande känsla,
- bröstsmärta,
- oregelbundna hjärtslag,
- förlust av rörelse,
- lite eller ingen urinering,
- svullnad i dina fötter eller vrister,
- känner mig trött,
- andnöd,
- aptitlöshet,
- magsmärtor (övre högra sidan),
- gulfärgning av huden eller ögonen,
- feber,
- frossa,
- influensa symptom,
- munsår,
- hudsår,
- ont i halsen, och
- hosta
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Neoral inkluderar:
- skakningar eller skakningar,
- acne,
- ökad tillväxt av hår i ansiktet eller på kroppen,
- förhöjt blodtryck,
- illamående,
- diarré och
- svullna eller smärtsamma tandkött
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Neoral. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
Endast läkare med erfarenhet av behandling av systemisk immunsuppressiv terapi för den indikerade sjukdomen bör förskriva Neoral®. Vid doser som används vid transplantation av fasta organ bör endast läkare med erfarenhet av immunsuppressiv terapi och behandling av organtransplanterade mottagare förskriva Neoral®. Patienter som får läkemedlet bör hanteras i lokaler utrustade och bemannade med adekvata laboratorie- och stödjande medicinska resurser. Den läkare som ansvarar för underhållsbehandlingen bör ha fullständig information som krävs för uppföljning av patienten. Neoral®, ett systemiskt immunsuppressivt medel, kan öka känsligheten för infektion och utveckling av neoplasi. Hos njur-, lever- och hjärttransplanterade patienter kan Neoral® administreras tillsammans med andra immunsuppressiva medel. Ökad känslighet för infektion och möjlig utveckling av lymfom och andra neoplasmer kan vara resultatet av den ökade graden av immunsuppression hos transplanterade patienter.
Neoral® Soft Gelatin Capsules (ciklosporinkapslar, USP) MODIFIED och Neoral® Oral Solution (ciklosporin oral lösning, USP) MODIFIED har ökad biotillgänglighet jämfört med Sandimmune® Soft Gelatin Capsules (ciklosporinkapslar, USP) och Sandimmune® oral lösning (ciklosporin oral lösning) lösning, USP). Neoral® och Sandimmune® är inte bioekvivalenta och kan inte användas omväxlande utan överinseende av läkare. För en given dalkoncentration kommer ciklosporinexponeringen att vara större med Neoral® än med Sandimmune®. Om en patient som får exceptionellt höga doser av Sandimmune® konverteras till Neoral®, bör särskild försiktighet iakttas. Cyklosporinkoncentrationer i blodet bör övervakas hos patienter med transplantation och reumatoid artrit som tar Neoral® för att undvika toxicitet på grund av höga koncentrationer. Dosjusteringar bör göras hos transplanterade patienter för att minimera eventuell organavstötning på grund av låga koncentrationer. Jämförelse av blodkoncentrationer i den publicerade litteraturen med blodkoncentrationer erhållna med nuvarande analyser måste göras med detaljerad kunskap om de använda analysmetoderna.
För psoriasispatienter (se även VARNINGAR I RUTA ovan)
Psoriasispatienter som tidigare behandlats med PUVA och i mindre utsträckning metotrexat eller andra immunsuppressiva medel, UVB, stenkolstjära eller strålbehandling löper en ökad risk att utveckla hudmaligniteter när de tar Neoral®.
Cyklosporin, den aktiva ingrediensen i Neoral®, i rekommenderade doser, kan orsaka systemisk hypertoni och nefrotoxicitet. Risken ökar med ökande dos och varaktighet av ciklosporinbehandling. Njurdysfunktion, inklusive strukturell njurskada, är en potentiell konsekvens av ciklosporin, och därför måste njurfunktionen övervakas under behandlingen.
BESKRIVNING
Neoral® är en oral formulering av ciklosporin som omedelbart bildar en mikroemulsion i en vattenhaltig miljö.
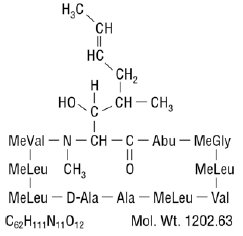
Cyklosporin, den aktiva beståndsdelen i Neoral®, är ett immunsuppressivt medel av cyklisk polypeptid bestående av 11 aminosyror. Den produceras som en metabolit av svamparten Beauveria nivea.
Kemiskt betecknas cyklosporin som [R-[R*,R*-(E)]]-cyklisk-(L-alanyl-D-alanyl-N-metyl-L-leucylN-metyl-L-leucyl-N-metyl -L-valyl-3-hydroxi-N,4-dimetyl-L-2-amino-6-oktenoyl-L-a-aminobutyryl-N-metylglycyl-N-metyl-L-leucyl-L-valyl-N-metyl -L-leucyl).
Neoral® Soft Gelatin Capsules (ciklosporinkapslar, USP) MODIFIED finns i styrkorna 25 mg och 100 mg.
Varje 25 mg kapsel innehåller:
ciklosporin………………………………25 mg alkohol, USP dehydrerad................................11,9 % volym/volym (9,5 % vikt/volym)
Varje 100 mg kapsel innehåller:
ciklosporin…………………………………...100 mg alkohol, USP dehydrerad.........................11.9 % v/v (9,5 % vikt/vol.)
Inaktiva Ingredienser: Majsolja-mono-di-triglycerider, polyoxyl 40 hydrerad ricinolja NF, DL-αtokoferol USP, gelatin NF, glycerol, svart järnoxid, propylenglykol USP, titandioxid USP, karmin och andra ingredienser.
Neoral® oral lösning (ciklosporin oral lösning, USP) MODIFIED finns i 50 ml flaskor.
Varje ml innehåller:
ciklosporin………………………………………..100 mg/ml alkohol, USP dehydrerad................ ...........11,9 % v/v (9,5 % vikt/vol.)
Inaktiva Ingredienser: Majsolja-mono-di-triglycerider, polyoxyl 40 hydrerad ricinolja NF, DL-α tokoferol USP, propylenglykol USP.
Den kemiska strukturen av ciklosporin (även känd som cyklosporin A) är:
INDIKATIONER
Transplantation av njure, lever och hjärta
Neoral 25 mg är indicerat för profylax av organavstötning vid allogena njur-, lever- och hjärttransplantationer. Neoral 100 mg har använts i kombination med azatioprin och kortikosteroider.
Reumatoid artrit
Neoral är indicerat för behandling av patienter med svår aktiv reumatoid artrit där sjukdomen inte har svarat tillräckligt på metotrexat. Neoral kan användas i kombination med metotrexat hos patienter med reumatoid artrit som inte svarar tillräckligt på enbart metotrexat.
Psoriasis
Neoral är indicerat för behandling av vuxna, icke-immunkomprometterade patienter med svår (dvs omfattande och/eller invalidiserande), motsträvig, plackpsoriasis som inte har svarat på minst en systemisk behandling (t.ex. PUVA, retinoider eller metotrexat) eller i patienter för vilka andra systemiska behandlingar är kontraindicerade eller inte kan tolereras.
Även om rebound sällan inträffar, kommer de flesta patienter att uppleva återfall med Neoral 100 mg som med andra terapier när behandlingen avslutas.
DOSERING OCH ADMINISTRERING
Neoral 25 mg mjuka gelatinkapslar (ciklosporinkapslar, USP) MODIFIERAD och Neoral oral lösning (ciklosporin oral lösning, USP) MODIFIERA D
Neoral har ökad biotillgänglighet jämfört med Sandimmune. Neoral 25mg och Sandimmune är inte bioekvivalenta och kan inte användas omväxlande utan läkares övervakning.
Den dagliga dosen av Neoral 100 mg ska alltid ges i två uppdelade doser (BID). Det rekommenderas att Neoral administreras enligt ett konsekvent schema med avseende på tid på dagen och förhållande till måltider. Grapefrukt och grapefruktjuice påverkar ämnesomsättningen, vilket ökar blodkoncentrationen av ciklosporin, bör därför undvikas.
Specifika populationer
Nedsatt njurfunktion vid njur-, lever- och hjärttransplantation
Cyklosporin genomgår minimal njureliminering och dess farmakokinetik tycks inte vara signifikant förändrad hos patienter med njursjukdom i slutstadiet som får rutinbehandlingar för hemodialys (se KLINISK FARMAKOLOGI ). Men på grund av dess nefrotoxiska potential (se VARNINGAR ), noggrann övervakning av njurfunktionen rekommenderas; Doseringen av ciklosporin bör minskas om det är indicerat (se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER ).
Nedsatt njurfunktion vid reumatoid artrit och psoriasis
Patienter med nedsatt njurfunktion ska inte få ciklosporin (se KONTRAINDIKATIONER , VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER ).
Nedsatt leverfunktion
Clearance av ciklosporin kan reduceras avsevärt hos patienter med svår leversjukdom (se KLINISK FARMAKOLOGI ). Dosreduktion kan vara nödvändig hos patienter med gravt nedsatt leverfunktion för att hålla blodkoncentrationerna inom det rekommenderade målintervallet (se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER ).
Nyligen transplanterade patienter
Den initiala orala dosen av Neoral 25 mg kan ges 4 till 12 timmar före transplantation eller ges postoperativt. Den initiala dosen av Neoral 25 mg varierar beroende på det transplanterade organet och andra immunsuppressiva medel som ingår i det immunsuppressiva protokollet. Hos nytransplanterade patienter är den orala initialdosen av Neoral densamma som den initiala orala dosen av Sandimmune. Föreslagna initialdoser är tillgängliga från resultaten av en undersökning från 1994 av användningen av Sandimmune i amerikanska transplantationscentra. De genomsnittliga ± SD initialdoserna var 9 ± 3 mg/kg/dag för njurtransplanterade patienter (75 centra), 8 ± 4 mg/kg/dag för levertransplanterade patienter (30 centra) och 7 ± 3 mg/kg/dag för hjärttransplanterade patienter (24 centra). Totala dagliga doser delades upp i två lika stora dagliga doser. Neoral-dosen justeras därefter för att uppnå en fördefinierad blodkoncentration av ciklosporin (se Blodkoncentrationsövervakning hos transplantationspatienter Nedan). Om dalkoncentrationer av ciklosporin i blodet används är målintervallet detsamma för Neoral 100 mg som för Sandimmune. Att använda samma dalkoncentrationsmålintervall för Neoral 100 mg som för Sandimmune resulterar i större exponering för ciklosporin när Neoral administreras (se Farmakokinetik, Absorption ). Doseringen bör titreras baserat på kliniska bedömningar av avstötning och tolerabilitet. Lägre Neoral 100 mg doser kan vara tillräckliga som underhållsbehandling.
Tilläggsbehandling med binjurekortikosteroider rekommenderas initialt. Olika avsmalnande doseringsscheman av prednison verkar ge liknande resultat. Ett representativt doseringsschema baserat på patientens vikt började med 2,0 mg/kg/dag under de första 4 dagarna minskade till 1,0 mg/kg/dag med 1 vecka, 0,6 mg/kg/dag med 2 veckor, 0,3 mg/kg/dag efter 1 månad och 0,15 mg/kg/dag efter 2 månader och därefter som underhållsdos. Steroiddoserna kan minskas ytterligare på individuell basis beroende på patientens status och transplantatets funktion. Justeringar av prednisondosen måste göras i enlighet med den kliniska situationen.
Konvertering från Sandimmune till Neoral 25 mg hos transplantationspatienter
Hos transplanterade patienter som övervägs att övergå till Neoral från Sandimmune ska Neoral påbörjas med samma dygnsdos som tidigare använts med Sandimmune (1:1 dosomvandling). Neoral-dosen ska därefter justeras för att uppnå dalkoncentrationen av ciklosporin i blodet före konvertering. Att använda samma dalkoncentrationsmålintervall för Neoral 100 mg som för Sandimmune resulterar i större exponering för ciklosporin när Neoral administreras (se Farmakokinetik, Absorption ). Patienter med misstänkt dålig absorption av Sandimmune kräver olika doseringsstrategier (se Transplantationspatienter med dålig absorption av sandimmun, Nedan). Hos vissa patienter är ökningen av dalkoncentrationen i blodet mer uttalad och kan vara av klinisk betydelse.
Tills dalkoncentrationen i blodet uppnår värdet före konvertering, rekommenderas starkt att dalkoncentrationen av ciklosporin i blodet övervakas var 4:e till 7:e dag efter konvertering till Neoral Dessutom bör kliniska säkerhetsparametrar, såsom serumkreatinin och blodtryck, övervakas varannan vecka under de första två månaderna efter konvertering. Om dalkoncentrationerna i blodet ligger utanför det önskade intervallet och/eller om de kliniska säkerhetsparametrarna förvärras, måste dosen av Neoral 100 mg justeras därefter.
Transplantationspatienter med dålig absorption av Sandimmune
Patienter med lägre än förväntade dalkoncentrationer av ciklosporin i blodet i förhållande till den orala dosen av Sandimmune kan ha dålig eller inkonsekvent absorption av ciklosporin från Sandimmune. Efter konvertering till Neoral tenderar patienter att ha högre ciklosporinkoncentrationer. På grund av den ökade biotillgängligheten av ciklosporin efter konvertering till Neoral, kan dalkoncentrationen av ciklosporin i blodet överstiga målintervallet. Särskild försiktighet bör iakttas när patienter konverterar till Neoral 100 mg vid doser högre än 10 mg/kg/dag. Dosen av Neoral bör titreras individuellt baserat på dalkoncentrationer av ciklosporin, tolerabilitet och kliniskt svar. I denna population bör dalkoncentrationen av ciklosporin i blodet mätas oftare, minst två gånger i veckan (dagligen, om initialdosen överstiger 10 mg/kg/dag) tills koncentrationen stabiliseras inom det önskade intervallet.
Reumatoid artrit
Initialdosen av Neoral är 2,5 mg/kg/dag, intagen två gånger dagligen som en uppdelad (BID) oral dos. Salicylater, NSAID och orala kortikosteroider kan fortsätta (se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ). Effekten börjar vanligtvis mellan 4 och 8 veckor. Om otillräcklig klinisk nytta ses och tolerabiliteten är god (inklusive serumkreatinin mindre än 30 % över baslinjen), kan dosen ökas med 0,5 till 0,75 mg/kg/dag efter 8 veckor och igen efter 12 veckor till maximalt 4 mg /kg/dag. Om ingen fördel ses efter 16 veckors behandling, bör Neoral 25 mg-behandling avbrytas.
Dosminskningar med 25 % till 50 % bör göras när som helst för att kontrollera biverkningar, t.ex. hypertoniförhöjningar i serumkreatinin (30 % över patientens nivå före behandling) eller kliniskt signifikanta laboratorieavvikelser (se VARNINGAR och FÖRSIKTIGHETSÅTGÄRDER ).
Om dosreduktion inte är effektiv för att kontrollera abnormiteter eller om biverkningen eller abnormiteten är allvarlig, ska Neoral 25 mg avbrytas. Samma initialdos och dosintervall ska användas om Neoral 25 mg kombineras med den rekommenderade dosen metotrexat. De flesta patienter kan behandlas med Neoral 25 mg doser på 3 mg/kg/dag eller lägre i kombination med metotrexatdoser på upp till 15 mg/vecka (se KLINISK FARMAKOLOGI , Kliniska tester ).
Det finns begränsade långtidsbehandlingsdata. Återkommande av reumatoid artrit sjukdomsaktivitet är i allmänhet uppenbart inom 4 veckor efter avslutad ciklosporin.
Psoriasis
Initialdosen av Neoral 100 mg bör vara 2,5 mg/kg/dag. Neoral ska tas två gånger dagligen, som en delad oral dos (1,25 mg/kg två gånger dagligen). Patienter bör hållas i den dosen i minst 4 veckor, med undantag för biverkningar. Om signifikant klinisk förbättring inte har inträffat hos patienter vid den tiden, bör patientens dos ökas med 2 veckors intervall. Baserat på patientens svar bör dosökningar med cirka 0,5 mg/kg/dag göras till maximalt 4,0 mg/kg/dag.
Dosminskningar med 25 % till 50 % bör göras när som helst för att kontrollera biverkningar, t.ex. hypertoni, förhöjt serumkreatinin (≥ 25 % över patientens nivå före behandling) eller kliniskt signifikanta laboratorieavvikelser. Om dosreduktion inte är effektiv för att kontrollera abnormiteter, eller om biverkningen eller abnormiteten är allvarlig, ska Neoral 25 mg avbrytas (se Särskild övervakning av psoriasispatienter ).
Patienter visar i allmänhet en viss förbättring av de kliniska manifestationerna av psoriasis inom 2 veckor. Tillfredsställande kontroll och stabilisering av sjukdomen kan ta 12 till 16 veckor att uppnå. Resultaten av en dostitrerad klinisk prövning med Neoral 25 mg indikerar att en förbättring av psoriasis med 75 % eller mer (baserat på PASI) uppnåddes hos 51 % av patienterna efter 8 veckor och hos 79 % av patienterna efter 16 veckor. Behandlingen bör avbrytas om tillfredsställande svar inte kan uppnås efter 6 veckor vid 4 mg/kg/dag eller patientens maximalt tolererade dos. När en patient är tillräckligt kontrollerad och verkar stabil bör dosen av Neoral 25 mg sänkas och patienten behandlas med den lägsta dosen som upprätthåller ett adekvat svar (detta behöver inte nödvändigtvis vara total clearing av patienten). I kliniska prövningar var ciklosporindoser i den nedre delen av det rekommenderade dosintervallet effektiva för att upprätthålla ett tillfredsställande svar hos 60 % av patienterna. Doser under 2,5 mg/kg/dag kan också vara lika effektiva.
Efter avslutad behandling med ciklosporin kommer återfall att inträffa inom cirka 6 veckor (50 % av patienterna) till 16 veckor (75 % av patienterna). Hos majoriteten av patienterna inträffar ingen rebound efter avslutad behandling med ciklosporin. Tretton fall av omvandling av kronisk plackpsoriasis till allvarligare former av psoriasis har rapporterats. Det fanns 9 fall av pustulös och 4 fall av erytrodermisk psoriasis. Långvarig erfarenhet av Neoral hos psoriasispatienter är begränsad och kontinuerlig behandling under längre perioder längre än ett år rekommenderas inte. Alternering med andra behandlingsformer bör övervägas vid långtidsbehandling av patienter med denna livslånga sjukdom.
Neoral 25mg oral lösning (ciklosporin oral lösning, USP) MODIFIERAD - Rekommendationer för administrering
För att göra Neoral 25mg oral lösning (ciklosporin oral lösning, USP) MODIFIED mer välsmakande bör den spädas med apelsin- eller äppeljuice som har rumstemperatur. Patienter bör undvika att byta spädningsmedel ofta. Grapefruktjuice påverkar metabolismen av ciklosporin och bör undvikas. Kombinationen av Neoral lösning med mjölk kan vara obehaglig. Effekten av mjölk på biotillgängligheten av ciklosporin när det administreras som Neoral 100 mg oral lösning har inte utvärderats.
Ta den föreskrivna mängden Neoral 25 mg oral lösning (ciklosporin oral lösning, USP) MODIFIERAD från behållaren med hjälp av den medföljande doseringssprutan, efter att skyddslocket tagits bort, och överför lösningen till ett glas apelsin- eller äppeljuice. Rör om väl och drick på en gång. Låt inte utspädd oral lösning stå innan du dricker. Använd en glasbehållare (ej plast). Skölj glaset med mer spädningsmedel för att säkerställa att den totala dosen förbrukas. Efter användning, torka utsidan av doseringssprutan med en ren handduk och sätt tillbaka skyddskåpan. Skölj inte doseringssprutan med vatten eller andra rengöringsmedel. Om sprutan behöver rengöras måste den vara helt torr innan den återupptas.
Övervakning av blodkoncentration hos transplantationspatienter
Transplantationscentra har funnit att blodkoncentrationsövervakning av ciklosporin är en viktig del av patienthanteringen. Av betydelse för blodkoncentrationsanalys är vilken typ av analys som används, det transplanterade organet och andra immunsuppressiva medel som administreras. Även om inget fast samband har fastställts, kan övervakning av blodkoncentrationen hjälpa till vid den kliniska utvärderingen av avstötning och toxicitet, dosjusteringar och bedömning av överensstämmelse.
Olika analyser har använts för att mäta blodkoncentrationer av ciklosporin. Äldre studier som använder en ospecifik analys citerade ofta koncentrationer som var ungefär dubbelt så höga som de specifika analyserna. Därför måste jämförelser mellan koncentrationer i den publicerade litteraturen och en individuell patientkoncentration med aktuella analyser göras med detaljerad kunskap om de använda analysmetoderna. Aktuella analysresultat är inte heller utbytbara och deras användning bör vägledas av deras godkända märkning. En diskussion av de olika analysmetoderna finns i Annals of Clinical Biochemistry 1994; 31: 420-446. Även om flera analyser och analysmatriser finns tillgängliga, finns det en konsensus om att moderföreningsspecifika analyser korrelerar bäst med kliniska händelser. Av dessa är HPLC standardreferens, men de monoklonala antikroppen RIA och den monoklonala antikroppen FPIA erbjuder känslighet, reproducerbarhet och bekvämlighet. De flesta läkare baserar sin övervakning på dalkoncentrationer av ciklosporin. Applied Pharmacokinetics, Principles of Therapeutic Drug Monitoring (1992) innehåller en bred diskussion om ciklosporins farmakokinetik och läkemedelsövervakningstekniker. Blodkoncentrationsövervakning är inte en ersättning för njurfunktionsövervakning eller vävnadsbiopsier.
HUR LEVERERAS
Neoral® Soft Gelatin Capsules (Cyclosporine Capsules, USP) MODIFIERAD
25 mg
Oval, blågrå stämplad i rött, "Neoral" över "25 mg."
Förpackningar med 30 enhetsdosblister ( NDC 0078-0246-15).
100 mg
Avlång, blågrå stämplad i rött, "NEORAL" över "100 mg."
Förpackningar med 30 enhetsdosblister ( NDC 0078-0248-15).
Förvara Och Dispensera
I den ursprungliga enhetsdosbehållaren vid kontrollerad rumstemperatur 68°F till 77°F (20°C till 25°C).
Neoral® oral lösning (ciklosporin oral lösning, USP) MODIFIERAD
En klar, gul vätska som levereras i 50 ml flaskor innehållande 100 mg/ml ( NDC 0078-0274-22).
Förvara Och Dispensera
originalförpackningen vid kontrollerad rumstemperatur 68°F till 77°F (20° till 25°C). Förvara inte i kylskåp. När det öppnats ska innehållet användas inom två månader. Vid temperaturer under 68°F (20°C) kan lösningen gela; lätt flockning eller bildandet av ett lätt sediment kan också förekomma. Det har ingen påverkan på produktens prestanda eller dosering med den medföljande sprutan. Låt värmas till rumstemperatur 77°F (25°C) för att vända dessa förändringar.
Neoral® Soft Gelatin Capsules (ciklosporinkapslar, USP) MODIFIERAD
Neoral® oral lösning (ciklosporin oral lösning, USP) MODIFIERAD
Distribueras av: Novartis Pharmaceuticals Corporation, East Hanover, New Jersey 07936. Reviderad juni 2021.
BIEFFEKTER
Transplantation av njure, lever och hjärta
De huvudsakliga biverkningarna av cyklosporinterapi är njurdysfunktion, tremor, hirsutism, hypertoni och tandköttshyperplasi.
Hypertoni
Hypertoni, som vanligtvis är mild till måttlig, kan förekomma hos cirka 50 % av patienterna efter njurtransplantation och hos de flesta hjärttransplanterade patienter.
Glomerulär kapillär trombos
Glomerulär kapillär trombos har hittats hos patienter som behandlats med ciklosporin och kan utvecklas till transplantatsvikt. De patologiska förändringarna liknade de som ses vid hemolytiskt-uremiskt syndrom och inkluderade trombos i njurens mikrovaskulatur, med trombocyt-fibrintrombi som blockerar glomerulära kapillärer och afferenta arterioler, mikroangiopatisk hemolytisk anemi, trombocytopeni och nedsatt njurfunktion. Liknande fynd har observerats när andra immunsuppressiva medel har använts efter transplantation.
Hypomagnesemi
Hypomagnesemi har rapporterats hos vissa, men inte alla, patienter som uppvisar kramper under cyklosporinbehandling. Även om studier av magnesiumutarmning hos normala försökspersoner tyder på att hypomagnesemi är associerad med neurologiska störningar, verkar flera faktorer, inklusive hypertoni, högdos metylprednisolon, hypokolesterolemi och nefrotoxicitet associerad med höga plasmakoncentrationer av ciklosporin vara relaterade till de neurologiska manifestationerna av ciklosporintoxicitet.
LÄKEMEDELSINTERAKTIONER
Effekten av läkemedel och andra medel på cyklosporins farmakokinetik och/eller säkerhet
Alla de individuella läkemedel som nämns nedan är väl underbyggda för att interagera med ciklosporin. Dessutom kan samtidig användning av NSAID och ciklosporin, särskilt vid uttorkning, förstärka njurdysfunktion. Försiktighet bör iakttas vid användning av andra läkemedel som är kända för att försämra njurfunktionen (se VARNINGAR , Nefrotoxicitet ).
Läkemedel som kan förstärka nedsatt njurfunktion
Vid samtidig användning av ett läkemedel som kan uppvisa additiv eller synergistisk njurfunktionsnedsättning med ciklosporin, bör noggrann övervakning av njurfunktionen (särskilt serumkreatinin) utföras. Om en signifikant försämring av njurfunktionen inträffar, bör dosen av det samtidigt administrerade läkemedlet minskas eller en alternativ behandling övervägas.
Cyklosporin metaboliseras i stor utsträckning av CYP 3A isoenzymer, i synnerhet CYP3A4, och är ett substrat för multidrug efflux transporter P-glykoprotein. Olika medel är kända för att antingen öka eller minska plasma- eller helblodskoncentrationer av ciklosporin, vanligtvis genom hämning eller induktion av CYP3A4 eller P-glykoproteintransportör eller båda. Föreningar som minskar ciklosporinabsorptionen, såsom orlistat, bör undvikas. Lämplig Neoral 100 mg dosjustering för att uppnå önskade ciklosporinkoncentrationer är avgörande när läkemedel som signifikant förändrar ciklosporinkoncentrationerna används samtidigt (se B övervakning av blodkoncentration ).
1. Läkemedel som ökar koncentrationen av cyklosporin
HIV-proteashämmare
HIV-proteashämmarna (t.ex. indinavir, nelfinavir, ritonavir och saquinavir) är kända för att hämma cytokrom P-450 3A och kan därför potentiellt öka koncentrationerna av ciklosporin, men inga formella studier av interaktionen finns tillgängliga. Försiktighet bör iakttas när dessa läkemedel administreras samtidigt.
Grapefruktjuice
Grapefrukt och grapefruktjuice påverkar ämnesomsättningen, vilket ökar blodkoncentrationerna av ciklosporin, bör därför undvikas.
2. Läkemedel/kosttillskott som minskar koncentrationen av cyklosporin
Bosentan
Samtidig administrering av bosentan (250 till 1000 mg var 12:e timme baserat på tolerabilitet) och ciklosporin (300 mg var 12:e timme under 2 dagar, sedan dosering för att uppnå ett Cmax på 200 till 250 ng/ml) under 7 dagar hos friska försökspersoner resulterade i minskningar av ciklosporin medeldosnormaliserad AUC, Cmax och dalkoncentration på cirka 50 %, 30 % respektive 60 % jämfört med när ciklosporin gavs ensamt (se Effekt av cyklosporin på farmakokinetiken och/eller säkerheten hos andra droger eller medel ). Samtidig administrering av ciklosporin och bosentan bör undvikas.
Boceprevir
Samtidig administrering av boceprevir (800 mg tre gånger dagligen i 7 dagar) och ciklosporin (100 mg engångsdos) till friska försökspersoner resulterade i en ökning av medel-AUC och Cmax för ciklosporin cirka 2,7- respektive 2-faldigt jämfört med när ciklosporin gavs ensam.
Telaprevir
Samtidig administrering av telaprevir (750 mg var 8:e timme i 11 dagar) och ciklosporin (10 mg på dag 8) hos friska försökspersoner resulterade i en ökning av den genomsnittliga dosnormaliserade AUC och Cmax för ciklosporin cirka 4,5- respektive 1,3-faldigt, jämfört med när ciklosporin (100 mg enkeldos) gavs ensamt.
Johannesört
Det har förekommit rapporter om en allvarlig läkemedelsinteraktion mellan ciklosporin och det växtbaserade kosttillskottet johannesört. Denna interaktion har rapporterats ge en markant minskning av blodkoncentrationerna av ciklosporin, vilket resulterar i subterapeutiska nivåer, avstötning av transplanterade organ och förlust av transplantat.
Rifabutin
Rifabutin är känt för att öka metabolismen av andra läkemedel som metaboliseras av cytokrom P-450-systemet. Interaktionen mellan rifabutin och ciklosporin har inte studerats. Försiktighet bör iakttas när dessa två läkemedel administreras samtidigt.
Effekt av cyklosporin på farmakokinetiken och/eller säkerheten hos andra droger eller medel
Cyklosporin är en hämmare av CYP3A4 och av flera läkemedelsutflödestransportörer (t.ex. P-glykoprotein) och kan öka plasmakoncentrationerna av läkemedel som är substrat för CYP3A4, P-glykoprotein eller organiska anjontransportproteiner.
Cyklosporin kan minska clearance av digoxin, kolchicin, prednisolon, HMG-CoA-reduktashämmare (statiner) och aliskiren, bosentan, dabigatran, repaglinid, NSAID, sirolimus, etoposid och andra läkemedel.
Se den fullständiga förskrivningsinformationen för det andra läkemedlet för ytterligare information och specifika rekommendationer. Beslutet om samtidig administrering av ciklosporin med andra läkemedel eller medel bör fattas av vårdgivaren efter en noggrann bedömning av fördelar och risker.
Digoxin
Allvarlig digitalistoxicitet har setts inom några dagar efter start av ciklosporin hos flera patienter som tagit digoxin. Om digoxin används samtidigt med ciklosporin, bör digoxinkoncentrationen i serum övervakas.
Kolchicin
Det finns rapporter om ciklosporins potential att förstärka de toxiska effekterna av kolkicin såsom myopati och neuropati, särskilt hos patienter med nedsatt njurfunktion. Samtidig administrering av ciklosporin och kolchicin resulterar i signifikanta ökningar av kolkicinplasmakoncentrationer. Om kolchicin används samtidigt med ciklosporin, rekommenderas en minskning av dosen av kolchicin.
HMG-CoA-reduktashämmare (statiner)
Litteratur och fall av myotoxicitet efter marknadsföring, inklusive muskelsmärta och muskelsvaghet, myosit och rabdomyolys, har rapporterats vid samtidig administrering av ciklosporin med lovastatin, simvastatin, atorvastatin, pravastatin och i sällsynta fall fluvastatin. Vid samtidig administrering med ciklosporin bör dosen av dessa statiner minskas enligt rekommendationer på etiketten. Statinbehandling måste tillfälligt avbrytas eller avbrytas hos patienter med tecken och symtom på myopati eller de med riskfaktorer som predisponerar för allvarlig njurskada, inklusive njursvikt, sekundärt till rabdomyolys.
Repaglinid
Cyklosporin kan öka plasmakoncentrationerna av repaglinid och därmed öka risken för hypoglykemi. Hos 12 friska manliga försökspersoner som fick två doser av 100 mg ciklosporinkapsel oralt med 12 timmars mellanrum med en engångsdos på 0,25 mg repaglinidtablett (hälften av en 0,5 mg tablett) oralt 13 timmar efter den initiala dosen av ciklosporin, repaglinidets genomsnittliga Cmax och AUC ökades 1,8 gånger (intervall: 0,6 till 3,7 gånger) respektive 2,4 gånger (intervall 1,2 till 5,3 gånger). Noggrann övervakning av blodsockernivån rekommenderas för en patient som tar ciklosporin och repaglinid samtidigt.
Ambrisentan
Samtidig administrering av ambrisentan (5 mg dagligen) och ciklosporin (100 till 150 mg två gånger dagligen initialt, sedan dosering för att uppnå Cmax 150 till 200 ng/ml) i 8 dagar hos friska försökspersoner resulterade i genomsnittliga ökningar av ambrisentans AUC och Cmax med cirka 2- gånger respektive 1,5 gånger jämfört med enbart ambrisentan. Vid samtidig administrering av ambrisentan och ciklosporin bör ambrisentandosen inte titreras till den rekommenderade maximala dagliga dosen
Antracyklin antibiotika
Höga doser av ciklosporin (t.ex. vid intravenös startdos på 16 mg/kg/dag) kan öka exponeringen för antracyklinantibiotika (t.ex. doxorubicin, mitoxantron, daunorubicin) hos cancerpatienter.
Aliskiren
Cyklosporin förändrar farmakokinetiken för aliskiren, ett substrat för P-glykoprotein och CYP3A4. Hos 14 friska försökspersoner som samtidigt fick engångsdoser av ciklosporin (200 mg) och reducerad dos aliskiren (75 mg), ökade medel-Cmax för aliskiren med cirka 2,5-faldigt (90 % KI: 1,96 till 3,17) och medel-AUC med cirka 4,3 gånger (90 % KI: 3,52 till 5,21), jämfört med när dessa patienter fick enbart aliskiren. Samtidig administrering av aliskiren och ciklosporin förlängde medianhalveringstiden för eliminering av aliskiren (26 timmar mot 43 till 45 timmar) och T (0,5 timmar mot 1,5 till 2,0 timmar). Medel-AUC och Cmax för ciklosporin var jämförbara med rapporterade litteraturvärden. Samtidig administrering av ciklosporin och aliskiren hos dessa patienter resulterade också i en ökning av antalet och/eller intensiteten av biverkningar, främst huvudvärk, värmevallningar, illamående, kräkningar och somnolens. Samtidig administrering av ciklosporin och aliskiren rekommenderas inte.
Bosentan
Hos friska försökspersoner resulterade samtidig administrering av bosentan och ciklosporin i tidsberoende genomsnittliga ökningar av dosnormaliserade
dalkoncentrationer av bosentan (dvs cirka 21 gånger dag 1 och 2 gånger dag 8 (steady state)) jämfört med när bosentan gavs ensamt som en engångsdos på dag 1 (se Effekten av läkemedel och andra medel på cyklosporins farmakokinetik och/eller säkerhet ). Samtidig administrering av ciklosporin och bosentan bör undvikas.
Dabigatran
Effekten av ciklosporin på dabigatrankoncentrationer hade inte studerats formellt. Samtidig administrering av dabigatran och ciklosporin kan resultera i ökade plasmakoncentrationer av dabigatran på grund av ciklosporins P-gp-hämmande aktivitet. Samtidig administrering av ciklosporin och dabigatran bör undvikas.
Kaliumsparande diuretika
Cyklosporin ska inte användas tillsammans med kaliumsparande diuretika eftersom hyperkalemi kan uppstå. Försiktighet krävs också när ciklosporin administreras samtidigt med kaliumsparande läkemedel (t.ex. angiotensinomvandlande enzymhämmare, angiotensin II-receptorantagonister), kaliuminnehållande läkemedel samt till patienter på en kaliumrik diet. Kontroll av kaliumnivåerna i dessa situationer är tillrådligt.
Interaktioner med icke-steroida antiinflammatoriska läkemedel (NSAID).
Kliniskt status och serumkreatinin bör övervakas noggrant när ciklosporin används tillsammans med NSAID hos patienter med reumatoid artrit (se VARNINGAR ).
Farmakodynamiska interaktioner har rapporterats förekomma mellan ciklosporin och både naproxen och sulindak, eftersom samtidig användning är förknippad med additiv minskning av njurfunktionen, vilket bestäms av 99mTc-dietylentriaminpentaättiksyra (DTPA) och (p-aminohippursyra) PAH-clearances. Även om samtidig administrering av diklofenak inte påverkar blodkoncentrationerna av ciklosporin, har det associerats med en ungefärlig fördubbling av diklofenakblodkoncentrationerna och enstaka rapporter om reversibla sänkningar av njurfunktionen. Följaktligen bör dosen av diklofenak vara i den nedre delen av det terapeutiska området.
Metotrexatinteraktion
Preliminära data tyder på att när metotrexat och ciklosporin administrerades samtidigt till patienter med reumatoid artrit (N = 20), ökade metotrexatkoncentrationerna (AUC) med cirka 30 % och koncentrationerna (AUCs) av dess metabolit, 7-hydroximetotrexat, minskade med cirka 80 %. Den kliniska betydelsen av denna interaktion är inte känd. Cyklosporinkoncentrationerna verkar inte ha förändrats (N = 6).
Sirolimus
Förhöjningar av serumkreatinin observerades i studier med sirolimus i kombination med fulldos ciklosporin. Denna effekt är ofta reversibel med ciklosporindosreduktion. Samtidig administrering av ciklosporin ökar signifikant blodnivåerna av sirolimus. För att minimera ökningar av sirolimuskoncentrationer rekommenderas att sirolimus ges 4 timmar efter administrering av ciklosporin.
Nifedipin
Frekvent gingival hyperplasi när nifedipin ges samtidigt med ciklosporin har rapporterats. Samtidig användning av nifedipin bör undvikas hos patienter där gingival hyperplasi utvecklas som en biverkning av ciklosporin.
Metylprednisolon
Kramper när höga doser metylprednisolon ges samtidigt med ciklosporin har rapporterats.
Andra immunsuppressiva läkemedel och medel
Psoriasispatienter som får andra immunsuppressiva medel eller strålbehandling (inklusive PUVA och UVB) ska inte få samtidigt ciklosporin på grund av risken för överdriven immunsuppression.
Effekt av cyklosporin på effektiviteten av levande vacciner
Under behandling med ciklosporin kan vaccination vara mindre effektivt. Användning av levande vacciner bör undvikas.
För ytterligare information om cyklosporinläkemedelsinteraktioner vänligen kontakta Novartis Medical Affairs Department på 1-888- NOW-NOVA [1-888-669-6682].
VARNINGAR
(Se även LÅDA VARNING )
Alla patienter
Cyklosporin, den aktiva ingrediensen i Neoral 25mg, kan orsaka nefrotoxicitet och levertoxicitet. Risken ökar med ökande doser av ciklosporin. Njurdysfunktion inklusive strukturell njurskada är en potentiell konsekvens av Neoral 100 mg och därför måste njurfunktionen övervakas under behandlingen. Försiktighet bör iakttas vid användning av ciklosporin med nefrotoxiska läkemedel (ser FÖRSIKTIGHETSÅTGÄRDER ).
Patienter som får Neoral kräver frekvent övervakning av serumkreatinin (se Särskild övervakning under DOSERING OCH ADMINISTRERING ). Äldre patienter bör övervakas med särskild noggrannhet, eftersom minskad njurfunktion också inträffar med åldern. Om patienterna inte övervakas ordentligt och doserna inte justeras korrekt, kan ciklosporinbehandling associeras med uppkomsten av strukturell njurskada och ihållande njurdysfunktion.
En ökning av serumkreatinin och BUN kan inträffa under Neoral-behandling och återspeglar en minskning av den glomerulära filtrationshastigheten. Nedsatt njurfunktion kräver när som helst noggrann övervakning och frekventa dosjusteringar kan vara indicerade. Frekvensen och svårighetsgraden av serumkreatininhöjningar ökar med dosen och varaktigheten av ciklosporinbehandlingen. Dessa förhöjningar kommer sannolikt att bli mer uttalade utan dosreduktion eller avbrytande av behandlingen.
Eftersom Neoral 100 mg inte är bioekvivalent med Sandimmune, kan omvandling från Neoral till Sandimmune med ett förhållande på 1:1 (mg/kg/dag) resultera i lägre blodkoncentrationer av ciklosporin. Konvertering från Neoral till Sandimmune bör göras med ökad övervakning för att undvika risken för underdosering.
Transplantation av njure, lever och hjärta
Nefrotoxicitet
Cyklosporin, den aktiva ingrediensen i Neoral, kan orsaka nefrotoxicitet och levertoxicitet när det används i höga doser. Det är inte ovanligt att serumkreatinin- och BUN-nivåerna är förhöjda under ciklosporinbehandling. Dessa förhöjningar hos njurtransplanterade patienter indikerar inte nödvändigtvis avstötning, och varje patient måste utvärderas fullständigt innan dosjustering påbörjas.
Baserat på Sandimmunes historiska erfarenhet av oral lösning, hade nefrotoxicitet associerad med ciklosporin noterats i 25 % av fallen av njurtransplantationer, 38 % av fallen av hjärttransplantationer och 37 % av fallen av levertransplantationer. Mild nefrotoxicitet noterades i allmänhet 2 till 3 månader efter njurtransplantation och bestod av ett stopp på hösten av de preoperativa förhöjningarna av BUN och kreatinin i intervallet 35 till 45 mg/dL respektive 2,0 till 2,5 mg/dL. Dessa förhöjningar var ofta känsliga för ciklosporindosreduktion.
Mer uppenbar nefrotoxicitet sågs tidigt efter transplantationen och kännetecknades av en snabbt stigande BUN och kreatinin. Eftersom dessa händelser liknar episoder med njuravstötning, måste man vara noga med att skilja mellan dem. Denna form av nefrotoxicitet är vanligtvis känslig för minskning av ciklosporindosen.
Även om specifika diagnostiska kriterier som på ett tillförlitligt sätt skiljer avstötning av njurtransplantat från läkemedelstoxicitet inte har hittats, har ett antal parametrar signifikant associerats med den ena eller den andra. Det bör dock noteras att upp till 20 % av patienterna kan ha samtidig nefrotoxicitet och avstötning.
En form av en cyklosporin-associerad nefropati kännetecknas av seriell försämring av njurfunktionen och morfologiska förändringar i njurarna. Från 5 % till 15 % av transplantationsmottagarna som har fått ciklosporin kommer inte att visa en minskning av stigande serumkreatinin trots en minskning eller utsättning av ciklosporinbehandling. Njurbiopsier från dessa patienter kommer att visa en eller flera av följande förändringar: tubulär vakuolisering, tubulär mikroförkalkning, peritubulär kapillärstockning, arteriolopati och en randig form av interstitiell fibros med tubulär atrofi. Även om ingen av dessa morfologiska förändringar är helt specifik, kräver en diagnos av ciklosporin-associerad strukturell nefrotoxicitet bevis på dessa fynd.
När man överväger utvecklingen av ciklosporin-associerad nefropati är det anmärkningsvärt att flera författare har rapporterat ett samband mellan uppkomsten av interstitiell fibros och högre kumulativa doser eller ihållande höga cirkulerande dalkoncentrationer av ciklosporin. Detta gäller särskilt under de första 6 månaderna efter transplantation när dosen tenderar att vara högst och när, hos njurmottagare, organet verkar vara mest känsligt för de toxiska effekterna av ciklosporin. Bland andra bidragande faktorer till utvecklingen av interstitiell fibros hos dessa patienter är förlängd perfusionstid, varm ischemitid, såväl som episoder av akut toxicitet och akut och kronisk avstötning. Reversibiliteten av interstitiell fibros och dess korrelation till njurfunktionen har ännu inte fastställts. Reversibilitet av arteriolopati har rapporterats efter avslutad ciklosporin eller sänkning av dosen.
Nedsatt njurfunktion kräver när som helst noggrann övervakning och frekventa dosjusteringar kan vara indicerade.
I händelse av allvarlig och oupphörlig avstötning, när räddningsterapi med pulssteroider och monoklonala antikroppar misslyckas med att vända avstötningsepisoden, kan det vara att föredra att byta till alternativ immunsuppressiv behandling istället för att öka Neoral-dosen till för höga blodkoncentrationer.
På grund av risken för additiv eller synergistisk försämring av njurfunktionen, bör försiktighet iakttas vid samtidig administrering av Neoral med andra läkemedel som kan försämra njurfunktionen (se FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ).
Trombotisk mikroangiopati
Ibland har patienter utvecklat ett syndrom av trombocytopeni och mikroangiopatisk hemolytisk anemi som kan resultera i transplantatsvikt. Vaskulopati kan uppstå i frånvaro av avstötning och åtföljs av ivrig konsumtion av blodplättar i transplantatet, vilket visas av Indium 111-märkta blodplättsstudier. Varken patogenesen eller hanteringen av detta syndrom är tydlig. Även om upplösning har inträffat efter minskning eller utsättning av ciklosporin och 1) administrering av streptokinas och heparin eller 2) plasmaferes, verkar detta bero på tidig upptäckt med Indium 111-märkta blodplättsskanningar (se NEGATIVA REAKTIONER ).
Hyperkalemi
Signifikant hyperkalemi (ibland associerad med hyperkloremisk metabol acidos) och hyperurikemi har ibland setts hos enskilda patienter.
Hepatotoxicitet
Fall av hepatotoxicitet och leverskada, inklusive kolestas, gulsot, hepatit och leversvikt, har rapporterats hos patienter som behandlats med ciklosporin. De flesta rapporterna inkluderade patienter med signifikanta samsjukligheter, underliggande tillstånd och andra störande faktorer inklusive infektionskomplikationer och komikationer med hepatotoxisk potential. I vissa fall, främst hos transplanterade patienter, har dödliga utfall rapporterats (se NEGATIVA REAKTIONER , Erfarenhet efter marknadsföring, njur-, lever- och hjärttransplantation ).
Hepatotoxicitet, vanligtvis manifesterad av förhöjda leverenzymer och bilirubin, rapporterades hos patienter som behandlats med ciklosporin i kliniska prövningar: 4 % vid njurtransplantation, 7 % vid hjärttransplantation och 4 % vid levertransplantation. Detta noterades vanligtvis under den första månaden av behandlingen när höga doser av ciklosporin användes. Kemihöjningarna minskade vanligtvis med en minskning av dosen.
Maligniteter
Liksom hos patienter som får andra immunsuppressiva medel löper de patienter som får ciklosporin en ökad risk för utveckling av lymfom och andra maligniteter, särskilt de i huden. Patienter som tar ciklosporin bör varnas för att undvika överdriven exponering för ultraviolett ljus. Den ökade risken verkar relaterad till intensiteten och varaktigheten av immunsuppression snarare än till användningen av specifika medel. På grund av risken för översuppression av immunsystemet som resulterar i ökad risk för infektion eller malignitet, bör en behandlingsregim som innehåller flera immunsuppressiva medel användas med försiktighet. Vissa maligniteter kan vara dödliga. Transplantationspatienter som får ciklosporin löper ökad risk för allvarlig infektion med dödlig utgång.
Allvarliga infektioner
Patienter som får immunsuppressiva medel, inklusive Neoral 100 mg, löper ökad risk att utveckla bakteriella, virus-, svamp- och protozoinfektioner, inklusive opportunistiska infektioner. Dessa infektioner kan leda till allvarliga, inklusive dödliga, utfall (se LÅDA VARNING , och NEGATIVA REAKTIONER ).
Polyomvirusinfektioner
Patienter som får immunsuppressiva medel, inklusive Neoral 100 mg, löper ökad risk för opportunistiska infektioner, inklusive polyomvirusinfektioner. Polyomvirusinfektioner hos transplanterade patienter kan ha allvarliga och ibland dödliga utfall. Dessa inkluderar fall av JC-virusassocierad progressiv multifokal leukoencefalopati (PML) och polyomvirusassocierad nefropati (PVAN), särskilt på grund av BK-virusinfektion, som har observerats hos patienter som får ciklosporin. PVAN är associerat med allvarliga resultat, inklusive försämrad njurfunktion och förlust av njurtransplantat (se NEGATIVA REAKTIONER , Erfarenhet efter marknadsföring, njur-, lever- och hjärttransplantation ). Patientövervakning kan hjälpa till att upptäcka patienter med risk för PVAN.
Fall av PML har rapporterats hos patienter som behandlats med Neoral. PML, som ibland är dödlig, uppträder vanligtvis med hemipares, apati, förvirring, kognitiva brister och ataxi. Riskfaktorer för PML inkluderar behandling med immunsuppressiva terapier och nedsatt immunförsvar. Hos immunsupprimerade patienter bör läkare överväga PML i differentialdiagnosen hos patienter som rapporterar neurologiska symtom och konsultation med en neurolog bör betraktas som kliniskt indicerat.
Man bör överväga att minska den totala immunsuppressionen hos transplanterade patienter som utvecklar PML eller PVAN. Minskad immunsuppression kan dock innebära risk för transplantatet.
Neurotoxicitet
Det har rapporterats om kramper hos vuxna och pediatriska patienter som får ciklosporin, särskilt i kombination med högdos metylprednisolon.
Encefalopati, inklusive posteriort reversibelt encefalopatisyndrom (PRES), har beskrivits både i rapporter efter marknadsföring och i litteraturen. Manifestationer inkluderar nedsatt medvetande, kramper, synstörningar (inklusive blindhet), förlust av motorisk funktion, rörelsestörningar och psykiatriska störningar. I många fall har förändringar i den vita substansen upptäckts med hjälp av avbildningstekniker och patologiska prover. Predisponerande faktorer, såsom hypertoni, hypomagnesemi, hypokolesterolemi, högdos kortikosteroider, höga koncentrationer av ciklosporin i blodet och transplantat-mot-värd-sjukdom, har noterats i många men inte alla av de rapporterade fallen. Förändringarna har i de flesta fall varit reversibla vid utsättning av ciklosporin, och i vissa fall noterades förbättring efter minskning av dosen. Det verkar som om patienter som får levertransplantation är mer mottagliga för encefalopati än de som får njurtransplantation. En annan sällsynt manifestation av ciklosporin-inducerad neurotoxicitet, som förekommer hos transplanterade patienter oftare än vid andra indikationer, är optiskt disködem inklusive papillödem, med möjlig synnedsättning, sekundärt till benign intrakraniell hypertoni.
Försiktighet bör iakttas vid användning av ciklosporin med nefrotoxiska läkemedel (se FÖRSIKTIGHETSÅTGÄRDER ).
Reumatoid artrit
Cyklosporinnefropati upptäcktes i njurbiopsier hos 6 av 60 (10 %) patienter med reumatoid artrit efter den genomsnittliga behandlingstiden på 19 månader. Endast en patient, av dessa 6 patienter, behandlades med en dos ≤ 4 mg/kg/dag. Serumkreatinin förbättrades hos alla utom en patient efter utsättning av ciklosporin. Den "maximala kreatininökningen" verkar vara en faktor för att förutsäga cyklosporinnefropati.
Det finns en potential, liksom med andra immunsuppressiva medel, för en ökning av förekomsten av maligna lymfom med ciklosporin. Det är inte klart om risken med ciklosporin är större än den hos patienter med reumatoid artrit eller hos patienter med reumatoid artrit på cellgiftsbehandling för denna indikation. Fem fall av lymfom upptäcktes: fyra i en undersökning av cirka 2 300 patienter som behandlats med ciklosporin för reumatoid artrit, och ett annat fall av lymfom rapporterades i en klinisk prövning. Även om andra tumörer (12 hudcancerformer, 24 solida tumörer av olika typer och 1 multipelt myelom) också rapporterades i denna undersökning, stödde inte epidemiologiska analyser ett förhållande till ciklosporin annat än för maligna lymfom.
Patienter bör utvärderas noggrant före och under Neoral 25 mg behandling för utveckling av maligniteter. Dessutom kan användning av Neoral 25 mg-terapi tillsammans med andra immunsuppressiva medel inducera en överdriven immunsuppression som är känd för att öka risken för malignitet.
Psoriasis
(Se även LÅDA VARNING för Psoriasis )
Eftersom ciklosporin är ett potent immunsuppressivt medel med ett antal potentiellt allvarliga biverkningar, bör riskerna och fördelarna med att använda Neoral 100 mg övervägas före behandling av patienter med psoriasis. Cyklosporin, den aktiva ingrediensen i Neoral, kan orsaka nefrotoxicitet och hypertoni (se FÖRSIKTIGHETSÅTGÄRDER ) och risken ökar med ökande dos och behandlingslängd. Patienter som kan ha ökad risk, såsom de med onormal njurfunktion, okontrollerad hypertoni eller maligniteter, ska inte få Neoral.
Njurdysfunktion är en potentiell konsekvens av Neoral, därför måste njurfunktionen övervakas under behandlingen.
Patienter som får Neoral 100 mg kräver frekvent övervakning av serumkreatinin (se Särskild övervakning under DOSERING OCH ADMINISTRERING ). Äldre patienter bör övervakas med särskild noggrannhet, eftersom minskad njurfunktion också inträffar med åldern. Om patienter inte övervakas ordentligt och doserna inte är korrekt justerade kan ciklosporinbehandling orsaka strukturell njurskada och ihållande njurfunktion.
En ökning av serumkreatinin och BUN kan förekomma under Neoral 25 mg-behandling och återspeglar en minskning av den glomerulära filtrationshastigheten.
Njurbiopsier från 86 psoriasispatienter behandlade under en genomsnittlig varaktighet på 23 månader med 1,2 till 7,6 mg/kg/dag av ciklosporin visade tecken på cyklosporinnefropati hos 18/86 (21 %) av patienterna. Patologin bestod av renal tubulär atrofi och interstitiell fibros. Vid upprepad biopsi av 13 av dessa patienter som höll på olika doser av ciklosporin under i genomsnitt ytterligare 2 år, steg antalet med cyklosporininducerad nefropati till 26/86 (30%). Majoriteten av patienterna (19/26) fick en dos på ≥ 5,0 mg/kg/dag (den högsta rekommenderade dosen är 4 mg/kg/dag). Patienterna fick också ciklosporin i mer än 15 månader (18/26) och/eller hade en kliniskt signifikant ökning av serumkreatinin i mer än 1 månad (21/26). Kreatininnivåerna återgick till normalt intervall hos 7 av 11 patienter där ciklosporinbehandlingen avbröts.
Det finns en ökad risk för utveckling av hud och lymfoproliferativa maligniteter hos ciklosporinbehandlade psoriasispatienter. Den relativa risken för maligniteter är jämförbar med den som observerats hos psoriasispatienter som behandlats med andra immunsuppressiva medel.
Tumörer rapporterades hos 32 (2,2%) av 1439 psoriasispatienter som behandlades med ciklosporin över hela världen från kliniska prövningar. Ytterligare tumörer har rapporterats hos 7 patienter i ciklosporin efter marknadsföring. Hudmaligniteter rapporterades hos 16 (1,1 %) av dessa patienter; alla utom två av dem hade tidigare fått PUVA-behandling. Metotrexat erhölls av 7 patienter.
UVB och stenkolstjära hade använts av 2 respektive 3 patienter. Sju patienter hade antingen en historia av tidigare hudcancer eller en potentiellt predisponerande lesion förekom före exponering för ciklosporin. Av de 16 patienterna med hudcancer hade 11 patienter 18 skivepitelcancer och 7 patienter hade 10 basalcellscancer.
Det fanns två lymfoproliferativa maligniteter; ett fall av non-Hodgkins lymfom som krävde kemoterapi, och ett fall av mycosis fungoides som gick tillbaka spontant vid utsättande av ciklosporin. Det fanns fyra fall av godartad lymfocytisk infiltration: 3 regresserade spontant vid utsättande av ciklosporin, medan det fjärde gick tillbaka trots att läkemedlet fortsattes. Resten av maligniteterna, 13 fall (0,9%), involverade olika organ.
Patienter bör inte behandlas samtidigt med ciklosporin och PUVA eller UVB, annan strålbehandling eller andra immunsuppressiva medel, på grund av risken för överdriven immunsuppression och den efterföljande risken för maligniteter (ser KONTRAINDIKATIONER ). Patienter bör också varnas för att skydda sig på lämpligt sätt när de är i solen och att undvika överdriven exponering för solen. Patienter bör utvärderas noggrant före och under behandlingen med avseende på förekomsten av maligniteter, med tanke på att maligna lesioner kan döljas av psoriasisplack. Hudskador som inte är typiska för psoriasis bör biopsieras innan behandlingen påbörjas. Patienter ska behandlas med Neoral endast efter fullständig upplösning av misstänkta lesioner, och endast om det inte finns några andra behandlingsalternativ (se Särskild övervakning för psoriasispatienter ).
Särskilda hjälpämnen
Alkohol (etanol)
Alkoholhalten (se BESKRIVNING av Neoral 100 mg bör beaktas när det ges till patienter hos vilka alkoholintag bör undvikas eller minimeras, t.ex. gravida eller ammande kvinnor, till patienter med leversjukdom eller epilepsi, till alkoholiserade patienter eller pediatriska patienter. För en vuxen som väger 70 kg skulle den maximala dagliga orala dosen ge cirka 1 gram alkohol, vilket är cirka 6 % av mängden alkohol i en standarddryck.
FÖRSIKTIGHETSÅTGÄRDER
Allmän
Hypertoni
Cyklosporin är den aktiva ingrediensen i Neoral. Hypertoni är en vanlig biverkning av ciklosporinbehandling som kan kvarstå (se NEGATIVA REAKTIONER och DOSERING OCH ADMINISTRERING för övervakningsrekommendationer). Mild eller måttlig hypertoni förekommer oftare än svår hypertoni och förekomsten minskar med tiden. Hos mottagare av njur-, lever- och hjärttransplantat som behandlats med ciklosporin kan antihypertensiv behandling behövas (se Särskild övervakning av reumatoid artrit och Psoriasispatienter ). Eftersom ciklosporin kan orsaka hyperkalemi bör dock inte kaliumsparande diuretika användas. Även om kalciumantagonister kan vara effektiva medel vid behandling av ciklosporinassocierad hypertoni, kan de störa cyklosporinmetabolismen (se LÄKEMEDELSINTERAKTIONER ).
Vaccination
Under behandling med ciklosporin kan vaccination vara mindre effektivt; och användning av levande försvagade vacciner bör undvikas.
Särskild övervakning av patienter med reumatoid artrit
Innan behandlingen påbörjas bör en noggrann fysisk undersökning, inklusive blodtrycksmätningar (vid minst två tillfällen) och två kreatininnivåer göras för att uppskatta baslinjen. Blodtryck och serumkreatinin bör utvärderas varannan vecka under de första 3 månaderna och sedan varje månad om patienten är stabil. Det är tillrådligt att alltid övervaka serumkreatinin och blodtryck efter en ökning av dosen av icke-steroida antiinflammatoriska läkemedel (NSAID) och efter påbörjad ny NSAID-behandling under Neoral 25 mg-behandling. Om det administreras samtidigt med metotrexat, rekommenderas CBC och leverfunktionstester att övervakas varje månad (se FÖRSIKTIGHETSÅTGÄRDER , Allmänt, högt blodtryck ).
Hos patienter som får ciklosporin bör dosen av Neoral minskas med 25 % till 50 % om hypertoni uppstår. Om hypertoni kvarstår, bör dosen av Neoral 100 mg minskas ytterligare eller blodtrycket kontrolleras med antihypertensiva medel. I de flesta fall har blodtrycket återgått till baslinjen när behandlingen med ciklosporin avbröts.
I placebokontrollerade studier av patienter med reumatoid artrit, förekom systolisk hypertoni (definierad som en förekomst av två systoliska blodtrycksvärden > 140 mmHg) och diastolisk hypertoni (definierad som två diastoliska blodtrycksvärden > 90 mmHg) hos 33 % och 19 % av patienter som behandlas med ciklosporin respektive. Motsvarande placebofrekvens var 22 % och 8 %.
Särskild övervakning för psoriasispatienter
Innan behandlingen påbörjas bör en noggrann dermatologisk och fysisk undersökning, inklusive blodtrycksmätningar (vid minst två tillfällen) utföras. Eftersom Neoral är ett immunsuppressivt medel, bör patienter utvärderas för förekomst av ockult infektion vid sin första fysiska undersökning och för förekomst av tumörer initialt och under hela behandlingen med Neoral. Hudskador som inte är typiska för psoriasis bör biopsieras innan Neoral påbörjas. Patienter med maligna eller premaligna hudförändringar ska endast behandlas med Neoral 100 mg efter lämplig behandling av sådana lesioner och om inget annat behandlingsalternativ finns.
Baslinjelaboratorier bör inkludera serumkreatinin (vid två tillfällen), BUN, CBC, serummagnesium, kalium, urinsyra och lipider.
Risken för ciklosporinnefropati minskar när startdosen är låg (2,5 mg/kg/dag), den maximala dosen inte överstiger 4,0 mg/kg/dag, serumkreatinin övervakas regelbundet medan ciklosporin administreras och dosen av Neoral 25 mg minskas när ökningen av kreatinin är större än eller lika med 25 % över patientens förbehandlingsnivå. Ökningen av kreatinin är i allmänhet reversibel vid snabb minskning av dosen av Neoral eller avbrytande av behandlingen.
Serumkreatinin och BUN bör utvärderas varannan vecka under de första tre månaderna av behandlingen och sedan varje månad om patienten är stabil. Om serumkreatininet är större än eller lika med 25 % över patientens förbehandlingsnivå, bör serumkreatinin upprepas inom två veckor. Om förändringen i serumkreatinin förblir större än eller lika med 25 % över baslinjen, bör Neoral 25 mg minskas med 25 % till 50 %. Jag fet när som helst serumkreatininet ökar med mer än eller lika med 50 % över förbehandlingsnivån, Neoral 25 mg bör minskas med 25 % till 50 %. Neoral bör avbrytas om reversibilitet (inom 25 % av baslinjen) av serumkreatinin inte är möjlig efter två dosändringar. Det är tillrådligt att övervaka serumkreatinin efter en ökning av dosen av icke-steroida antiinflammatoriska läkemedel och efter påbörjad ny icke-steroid antiinflammatorisk behandling under Neoral 25 mg-behandling.
Blodtrycket bör utvärderas varannan vecka under de första tre månaderna av behandlingen och sedan en gång i månaden om patienten är stabil, eller oftare när dosjusteringar görs. Patienter utan tidigare hypertoni i anamnesen innan behandling med Neoral påbörjas, bör få läkemedlet reducerat med 25 % till 50 % om de visar sig ha ihållande hypertoni. Om patienten fortsätter att ha hypertoni trots flera minskningar av Neoral 25 mg, ska Neoral avbrytas. För patienter med behandlad hypertoni, innan behandlingen med Neoral 100 mg påbörjas, bör deras medicinering anpassas för att kontrollera hypertoni under behandling med Neoral. Neoral 100 mg bör avbrytas om en förändring i hypertonihanteringen inte är effektiv eller tolererbar.
CBC, urinsyra, kalium, lipider och magnesium bör också övervakas varannan vecka under de första 3 månaderna av behandlingen och sedan varje månad om patienten är stabil eller oftare när dosjusteringar görs. Neoral 25 mg-dosen bör minskas med 25 % till 50 % för eventuella avvikelser av klinisk oro.
I kontrollerade prövningar av ciklosporin hos psoriasispatienter korrelerade koncentrationerna av ciklosporin i blodet inte bra med vare sig förbättring eller med biverkningar som njurdysfunktion.
Laboratorietester
Hos alla patienter som behandlas med ciklosporin bör njur- och leverfunktioner utvärderas upprepade gånger genom mätning av serumkreatinin, BUN, serumbilirubin och leverenzymer. Serumlipider, magnesium och kalium bör också övervakas.
Cyklosporinkoncentrationer i blodet bör övervakas rutinmässigt hos transplanterade patienter (se DOSERING OCH ADMINISTRERING , Blodkoncentrationsövervakning hos transplantationspatienter ), och övervakas periodiskt hos patienter med reumatoid artrit.
Karcinogenes, mutagenes och försämring av fertilitet
Carcinogenicitetsstudier utfördes på han- och honråttor och möss. I den 78 veckor långa musstudien fann man bevis på en statistiskt signifikant trend för lymfocytiska lymfom hos honor, och förekomsten av hepatocellulära karcinom hos hanar med medeldos översteg signifikant kontrollvärdet. I den 24 månader långa råttstudien översteg pankreasöcelladenomen signifikant kontrollfrekvensen vid låg dosnivå. Doserna som användes i mus- och råttstudierna var 0,01 till 0,16 gånger den kliniska underhållsdosen (6 mg/kg). De hepatocellulära karcinomen och pankreasöcelladenomen var inte dosrelaterade. Publicerade rapporter tyder på att samtidig behandling av hårlösa möss med UV-bestrålning och ciklosporin eller andra immunsuppressiva medel förkortar tiden till hudtumörbildning jämfört med enbart UV-bestrålning.
Cyklosporin var inte mutagent i lämpliga testsystem. Cyklosporin har inte visat sig vara mutagent/genotoxiskt i Ames-testet, V79-HGPRT-testet, mikrokärntestet på möss och kinesiska hamstrar, kromosomavvikelsetesterna i benmärg hos kinesisk hamster, musdominant dödlig analys och DNA-reparationstest i spermier från behandlade möss. En nyligen genomförd studie som analyserade systerkromatidutbytesinduktion (SCE) av cyklosporin med användning av humana lymfocyter in vitro gav indikationer på en positiv effekt (dvs induktion av SCE), vid höga koncentrationer i detta system. I två publicerade forskningsstudier visade kaniner exponerade för ciklosporin in utero (10 mg/kg/dag subkutant) minskat antal nefroner, renal hypertrofi, systemisk hypertoni och progressiv njurinsufficiens upp till 35 veckors ålder. Dräktiga råttor som fick 12 mg/kg/dag av ciklosporin intravenöst (dubbla den rekommenderade humana intravenösa dosen) hade foster med en ökad förekomst av ventrikulär septumdefekt. Dessa fynd har inte visats hos andra arter och deras relevans för människor är okänd.
Ingen försämring av fertiliteten har visats i studier på han- och honråttor.
Vidtfördelad papillomatos av huden observerades efter kronisk behandling av hundar med ciklosporin vid 9 gånger den humana initiala psoriasisbehandlingsdosen på 2,5 mg/kg, där doser uttrycks på basis av kroppsyta. Denna papillomatos visade en spontan regression vid utsättning av ciklosporin.
En ökad förekomst av malignitet är en erkänd komplikation av immunsuppression hos mottagare av organtransplantationer och patienter med reumatoid artrit och psoriasis. De vanligaste formerna av neoplasmer är non-Hodgkins lymfom och hudkarcinom. Risken för maligniteter hos ciklosporinmottagare är högre än hos den normala, friska befolkningen men liknar den hos patienter som får andra immunsuppressiva terapier. Minskning eller avbrytande av immunsuppression kan göra att lesionerna regresserar.
Hos psoriasispatienter på ciklosporin har utveckling av maligniteter, särskilt de i huden, rapporterats (se VARNINGAR ). Hudskador som inte är typiska för psoriasis bör biopsieras innan behandling med ciklosporin påbörjas. Patienter med maligna eller premaligna hudförändringar ska endast behandlas med ciklosporin efter lämplig behandling av sådana lesioner och om inget annat behandlingsalternativ finns.
Graviditet
Djurstudier har visat reproduktionstoxicitet hos råttor och kaniner. Cyklosporin gav inga tecken på mutagena eller teratogena effekter i standardtestsystemen med oral applicering (råttor upp till 17 mg/kg och kaniner upp till 30 mg/kg per dag oralt.) Endast vid dosnivåer som var giftiga för moderdjur sågs biverkningar i reproduktionsstudier på råttor. Cyklosporin har visat sig vara embryo- och fostertoxiskt hos råttor och kaniner efter oral administrering vid maternellt toxiska doser. Fetal toxicitet noterades hos råttor vid 0,8 och kaniner vid 5,4 gånger transplantationsdoserna hos människor på 6,0 mg/kg, där doskorrigeringar baseras på kroppsyta. Cyklosporin var embryo- och fostertoxiskt, vilket indikeras av ökad pre- och postnatal mortalitet och minskad fostervikt tillsammans med relaterad skelettretardation.
Det finns inga adekvata och välkontrollerade studier på gravida kvinnor, därför bör Neoral inte användas under graviditet om inte den potentiella nyttan för modern motiverar den potentiella risken för fostret.
Hos gravida transplanterade som behandlas med immunsuppressiva medel är risken för för tidig födsel ökad. Följande data representerar de rapporterade resultaten av 116 graviditeter hos kvinnor som fick ciklosporin under graviditeten, varav 90 % var transplanterade patienter och de flesta fick ciklosporin under hela graviditetsperioden. De enda konsekventa mönstren av abnormitet var för tidig födsel (gestationsperiod på 28 till 36 veckor) och låg födelsevikt för graviditetsålder. Sexton fosterförluster inträffade. De flesta av graviditeterna (85 av 100) komplicerades av störningar; inklusive havandeskapsförgiftning, eklampsi, för tidig förlossning, abruptio placentae, oligohydramnios, Rh-inkompatibilitet och fosterplacental dysfunktion. Förlossning förekom hos 47 %. Sju missbildningar rapporterades hos 5 livsdugliga spädbarn och i 2 fall av fosterförlust. Tjugoåtta procent av spädbarnen var små för graviditetsåldern. Neonatala komplikationer inträffade hos 27 %. Därför bör riskerna och fördelarna med att använda Neoral under graviditet vägas noggrant.
Ett begränsat antal observationer hos barn som exponerats för ciklosporin in utero är tillgängliga, upp till en ålder av cirka 7 år. Njurfunktionen och blodtrycket hos dessa barn var normalt.
På grund av den möjliga störningen av interaktionen mellan modern och foster, bör risk/nytta-förhållandet med att använda Neoral hos psoriasispatienter under graviditet noggrant vägas med allvarlig övervägande för att avbryta behandlingen med Neoral.
Alkoholhalten i Neoral 100 mg formuleringar bör också beaktas hos gravida kvinnor (se VARNINGAR , Särskilda hjälpämnen ).
Ammande mödrar
Cyklosporin finns i bröstmjölk. På grund av risken för allvarliga biverkningar hos ammande spädbarn från Neoral 100 mg, bör ett beslut fattas om att avbryta amningen eller att avbryta läkemedlet, med hänsyn till läkemedlets betydelse för modern. Neoral innehåller etanol. Etanol kommer att finnas i bröstmjölk i nivåer liknande de som finns i moderns serum och om det finns i bröstmjölk kommer det att absorberas oralt av ett ammande spädbarn (se VARNINGAR ).
Pediatrisk användning
Även om inga adekvata och välkontrollerade studier har slutförts på barn, har transplantationsmottagare så unga som ett års ålder fått Neoral utan några ovanliga biverkningar. Säkerheten och effekten av Neoral-behandling hos barn med juvenil reumatoid artrit eller psoriasis under 18 år har inte fastställts.
Geriatrisk användning
kliniska prövningar med reumatoid artrit med ciklosporin var 17,5 % av patienterna 65 år eller äldre. Dessa patienter var mer benägna att utveckla systolisk hypertoni under behandlingen och mer benägna att visa serumkreatininstegringar ≥ 50 % över baslinjen efter 3 till 4 månaders behandling.
Kliniska studier av Neoral 100 mg på transplanterade och psoriasispatienter inkluderade inte ett tillräckligt antal försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner. Andra rapporterade kliniska erfarenheter har inte identifierat skillnader i svar mellan äldre och yngre patienter. I allmänhet bör dosval för en äldre patient vara försiktigt, vanligtvis med början i den nedre delen av doseringsintervallet, vilket återspeglar den högre frekvensen av nedsatt lever-, njur- eller hjärtfunktion, och av samtidig sjukdom eller annan läkemedelsbehandling.
ÖVERDOS
Det finns en minimal erfarenhet av överdosering av ciklosporin. Påtvingad kräkning och magsköljning kan vara av värde upp till 2 timmar efter administrering av Neoral. Övergående hepatotoxicitet och nefrotoxicitet kan förekomma, vilket bör försvinna efter utsättning av läkemedel. Orala doser av ciklosporin upp till 10 g (cirka 150 mg/kg) har tolererats med relativt små kliniska konsekvenser, såsom kräkningar, dåsighet, huvudvärk, takykardi och, hos ett fåtal patienter, måttligt svår, reversibel nedsättning av njurfunktionen. Emellertid har allvarliga symtom på förgiftning rapporterats efter oavsiktlig parenteral överdosering med ciklosporin hos prematura nyfödda. Allmänna stödåtgärder och symtomatisk behandling bör följas vid alla fall av överdosering. Cyklosporin är inte dialyserbart i någon större utsträckning, och det elimineras inte heller väl genom kolhemoperfusion. Den orala dosen vid vilken hälften av försöksdjuren beräknas dö är 31 gånger, 39 gånger och > 54 gånger den mänskliga underhållsdosen för transplanterade patienter (6 mg/kg; korrigeringar baserade på kroppsyta) hos möss, råttor och kaniner .
KONTRAINDIKATIONER
Allmän
Neoral 100 mg är kontraindicerat för patienter med överkänslighet mot ciklosporin eller mot någon av beståndsdelarna i formuleringen.
Reumatoid artrit
Patienter med reumatoid artrit med onormal njurfunktion, okontrollerad hypertoni eller malignitet ska inte få Neoral.
Psoriasis
Psoriasispatienter som behandlas med Neoral 100 mg ska inte få samtidig PUVA- eller UVB-behandling, metotrexat eller andra immunsuppressiva medel, stenkolstjära eller strålbehandling. Psoriasispatienter med onormal njurfunktion, okontrollerad hypertoni eller maligniteter ska inte få Neoral.
KLINISK FARMAKOLOGI
Cyklosporin är ett potent immunsuppressivt medel som hos djur förlänger överlevnaden av allogena transplantationer som involverar hud, njure, lever, hjärta, bukspottkörtel, benmärg, tunntarm och lungor. Cyklosporin har visat sig undertrycka viss humoral immunitet och i större utsträckning cellmedierade immunreaktioner såsom allotransplantatavstötning, fördröjd överkänslighet, experimentell allergisk encefalomyelit, Freunds adjuvansartrit och transplantat-mot-värdsjukdom hos många djurarter för en mängd olika organ .
Effektiviteten av ciklosporin är ett resultat av specifik och reversibel hämning av immunkompetenta lymfocyter i G0- och G1-fasen av cellcykeln. T-lymfocyter hämmas företrädesvis. T-hjälparcellen är huvudmålet, även om Tsuppressor-cellen också kan vara undertryckt. Cyklosporin hämmar också lymfokinproduktion och -frisättning, inklusive interleukin-2.
Inga effekter på fagocytisk funktion (förändringar i enzymsekretioner, kemotaktisk migration av granulocyter, makrofagmigration, kolclearance in vivo) har påvisats hos djur. Cyklosporin orsakar inte benmärgsdämpning i djurmodeller eller människor.
Farmakokinetik
Cyklosporins immunsuppressiva aktivitet beror främst på moderläkemedlet. Efter oral administrering är absorptionen av ciklosporin ofullständig. Graden av absorption av ciklosporin beror på den individuella patienten, patientpopulationen och formuleringen. Eliminering av ciklosporin sker primärt genom gallan och endast 6 % av dosen (moderläkemedlet och metaboliter) utsöndras i urinen. Fördelningen av ciklosporin från blod är i allmänhet bifasisk, med en terminal halveringstid på cirka 8,4 timmar (intervall 5 till 18 timmar). Efter intravenös administrering är blodclearancen av ciklosporin (analys: HPLC) cirka 5 till 7 ml/min/kg hos vuxna mottagare av njur- eller leverallotransplantat. Blodciklosporinclearance verkar vara något långsammare hos hjärttransplanterade patienter.
Neoral Soft Gelatin Capsules (ciklosporinkapslar, USP) MODIFIED och Neoral Oral Solution (ciklosporin oral lösning, USP) MODIFIED är bioekvivalenta. Neoral 25 mg oral lösning utspädd med apelsinjuice eller äppeljuice är bioekvivalent med Neoral oral lösning utspädd med vatten. Effekten av mjölk på biotillgängligheten av ciklosporin när det administreras som Neoral oral lösning har inte utvärderats.
Relationen mellan administrerad dos och exponering (area under kurvan för koncentration mot tid, AUC) är linjär inom det terapeutiska dosintervallet. Variabiliteten mellan individer (totalt, %CV) av ciklosporinexponering (AUC) när Neoral eller Sandimmune administreras varierar från cirka 20 % till 50 % hos njurtransplanterade patienter. Denna intersubjektvariabilitet bidrar till behovet av individualisering av doseringsregimen för optimal terapi (se DOSERING OCH ADMINISTRERING ).
Variabiliteten för AUC inom individen hos njurtransplanterade mottagare (%CV) var 9 % till 21 % för Neoral och 19 % till 26 % för Sandimmune. I samma studier var variationen i dalkoncentrationer (%CV) inom individen 17 % till 30 % för Neoral och 16 % till 38 % för Sandimmune.
Absorption
Neoral har ökad biotillgänglighet jämfört med Sandimmune. Den absoluta biotillgängligheten av ciklosporin administrerat som Sandimmune är beroende av patientpopulationen, uppskattad till mindre än 10 % hos levertransplanterade patienter och så stor som 89 % hos vissa njurtransplanterade patienter. Den absoluta biotillgängligheten för ciklosporin administrerat som Neoral har inte fastställts hos vuxna. I studier av patienter med njurtransplantation, reumatoid artrit och psoriasis var den genomsnittliga AUC för ciklosporin cirka 20 % till 50 % högre och den maximala ciklosporinkoncentrationen i blodet Cmax var cirka 40 % till 106 % högre efter administrering av Neoral 100 mg jämfört med efter administrering av Sandimmune . Den dosnormaliserade AUC hos de novo levertransplantationspatienter som administrerades Neoral 28 dagar efter transplantationen var 50 % högre och Cmax var 90 % högre än hos de patienter som fick Sandimmune. AUC och Cmax ökar också (neoralt i förhållande till Sandimmune) hos hjärttransplanterade patienter, men data är mycket begränsade. Även om AUC- och Cmax-värdena är högre på Neoral 100 mg jämfört med Sandimmune, är dalkoncentrationerna före dosering (dosnormaliserade) liknande för de två formuleringarna.
Efter oral administrering av Neoral varierade tiden till maximala blodciklosporinkoncentrationer (Tmax) från 1,5 till 2,0 timmar. Administrering av mat med Neoral 25 mg minskar ciklosporinets AUC och Cmax. En fettrik måltid (669 kcal, 45 gram fett) som konsumerades inom en halvtimme före administrering av Neoral 25 mg minskade AUC med 13 % och Cmax med 33 %. Effekterna av en måltid med låg fetthalt (667 kcal, 15 gram fett) var liknande.
Effekten av T-rörsavledning av galla på absorptionen av ciklosporin från Neoral 25 mg undersöktes hos elva de novo levertransplantationspatienter. När patienterna administrerades Neoral med och utan T-rörsavledning av galla, observerades mycket liten skillnad i absorption, mätt som förändringen i maximala ciklosporinkoncentrationer i blodet från värdena före dos med T-röret stängt i förhållande till när det var öppen: 6,9 ± 41 % (intervall 55 % till 68 %).
PatientpopulationDistribution
Cyklosporin distribueras till stor del utanför blodvolymen. Distributionsvolymen vid steady state under intravenös dosering har rapporterats till 3 till 5 l/kg hos mottagare av solida organtransplantationer. I blod är fördelningen koncentrationsberoende. Cirka 33 % till 47 % finns i plasma, 4 % till 9 % i lymfocyter, 5 % till 12 % i granulocyter och 41 % till 58 % i erytrocyter. Vid höga koncentrationer blir bindningskapaciteten hos leukocyter och erytrocyter mättad. I plasma är cirka 90 % bundet till proteiner, främst lipoproteiner. Cyklosporin utsöndras i modersmjölk (se FÖRSIKTIGHETSÅTGÄRDER , Ammande mödrar ).
Ämnesomsättning
Cyklosporin metaboliseras i stor utsträckning av enzymsystemet cytokrom P-450 3A i levern och i mindre grad i mag-tarmkanalen och njurarna. Metabolismen av ciklosporin kan förändras genom samtidig administrering av en mängd olika medel (se FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ). Minst 25 metaboliter har identifierats från mänsklig galla, avföring, blod och urin. Den biologiska aktiviteten hos metaboliterna och deras bidrag till toxicitet är avsevärt mindre än moderföreningens. Huvudmetaboliterna (M1, M9 och M4N) är resultatet av oxidation i positionerna 1-beta, 9-gamma respektive 4-N-demetylerade. Vid steady state efter oral administrering av Sandimmune är medel-AUC för blodkoncentrationer av M1, M9 och M4N cirka 70%, 21% respektive 7,5% av AUC för blodciklosporinkoncentrationer. Baserat på blodkoncentrationsdata från stabila njurtransplanterade patienter (13 patienter som administrerades Neoral och Sandimmune i en crossover-studie) och gallkoncentrationsdata från de novo levertransplantationspatienter (4 administrerade Neoral 100 mg, 3 administrerade Sandimmune), procentandelen av dosen närvarande som M1-, M9- och M4N-metaboliter är liknande när antingen Neoral 25 mg eller Sandimmune administreras.
Exkretion
Endast 0,1 % av en ciklosporindos utsöndras oförändrat i urinen. Eliminationen sker primärt genom gallan och endast 6 % av dosen (moderläkemedlet och metaboliter) utsöndras i urinen. Varken dialys eller njursvikt förändrar ciklosporinclearance signifikant.
Läkemedelsinteraktioner
(Ser FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ) När diklofenak eller metotrexat administrerades samtidigt med ciklosporin till patienter med reumatoid artrit, ökade AUC för diklofenak och metotrexat vardera signifikant (se FÖRSIKTIGHETSÅTGÄRDER , LÄKEMEDELSINTERAKTIONER ). Inga kliniskt signifikanta farmakokinetiska interaktioner inträffade mellan ciklosporin och aspirin, ketoprofen, piroxikam eller indometacin.
Specifika populationer
Nedsatt njurfunktion
en studie utförd på 4 försökspersoner med njursjukdom i slutstadiet (kreatininclearance
Nedsatt leverfunktion
Cyklosporin metaboliseras i stor utsträckning av levern. Eftersom gravt nedsatt leverfunktion kan resultera i signifikant ökad exponering för ciklosporin, kan dosen av ciklosporin behöva minskas hos dessa patienter.
Pediatrisk population
Farmakokinetiska data från pediatriska patienter som administreras Neoral eller Sandimmune är mycket begränsade. Hos 15 njurtransplanterade patienter i åldern 3-16 år var ciklosporin helblodsclearance efter IV administrering av Sandimmune 10,6 ± 3,7 ml/min/kg (analys: Cyclo-trac-specifik RIA). I en studie av 7 njurtransplanterade patienter i åldern 2 till 16 år varierade ciklosporinclearancen från 9,8 till 15,5 ml/min/kg. Hos 9 levertransplantationspatienter i åldern 0,6 till 5,6 år var clearance 9,3 ± 5,4 ml/min/kg (analys: HPLC).
I den pediatriska populationen uppvisar Neoral också en ökad biotillgänglighet jämfört med Sandimmune. Hos 7 lever de novo-transplanterade patienter i åldern 1,4 till 10 år var den absoluta biotillgängligheten för Neoral 43 % (intervall 30 % till 68 %) och för Sandimmune hos samma individer var den absoluta biotillgängligheten 28 % (intervall 17 % till 42 %).
Geriatrisk befolkning
Jämförelse av enkeldosdata från både normala äldre frivilliga (N = 18, medelålder 69 år) och äldre patienter med reumatoid artrit (N = 16, medelålder 68 år) med enkeldosdata hos unga vuxna frivilliga (N = 16, medelålder 26 år) visade ingen signifikant skillnad i de farmakokinetiska parametrarna.
Kliniska tester
Reumatoid artrit
Effektiviteten av Sandimmune och Neoral 100 mg vid behandling av svår reumatoid artrit utvärderades i 5 kliniska studier med totalt 728 ciklosporinbehandlade patienter och 273 placebobehandlade patienter.
En sammanfattning av resultaten presenteras för "responder"-frekvenserna per behandlingsgrupp, där en responder definieras som en patient som har slutfört studien med en 20% förbättring av anbudet och svullna leder och en 20% förbättring i 2 av 4 av forskarens globala, globala patient-, funktionsnedsättnings- och erytrocytsedimentationshastigheter (ESR) för studierna 651 och 652 och 3 av 5 av utredarnas globala, patient globala, funktionsnedsättning, visuell analog smärta och ESR för studierna 2008, 654 och 302.
Studie 651 inkluderade 264 patienter med aktiv reumatoid artrit med minst 20 inblandade leder, som hade misslyckats med minst ett läkemedel mot reumatoid artrit, genom att använda en 3:3:2 randomisering till en av följande tre grupper: (1) ciklosporin doserat vid 2,5 till 5 mg/kg/dag, (2) metotrexat vid 7,5 till 15 mg/vecka, eller (3) placebo. Behandlingstiden var 24 veckor. Den genomsnittliga ciklosporindosen vid det senaste besöket var 3,1 mg/kg/dag. Se diagram nedan.
Studie 652 inkluderade 250 patienter med aktiv RA med > 6 aktiva smärtsamma eller ömma leder som hade misslyckats med minst ett större läkemedel mot RA. Patienterna randomiserades med en 3:3:2 randomisering till 1 av 3 behandlingsarmar: (1) 1,5 till 5 mg/kg/dag ciklosporin, (2) 2,5 till 5 mg/kg/dag cyklosporin och (3) placebo. Behandlingstiden var 16 veckor. Den genomsnittliga ciklosporindosen för grupp 2 vid det senaste besöket var 2,92 mg/kg/dag. Se diagram nedan.
Studie 2008 inkluderade 144 patienter med aktiv RA och > 6 aktiva leder som hade misslyckade behandlingskurer med aspirin och guld eller penicillamin. Patienterna randomiserades till 1 av 2 behandlingsgrupper (1) ciklosporin 2,5 till 5 mg/kg/dag med justeringar efter den första månaden för att uppnå en måltrognivå och (2) placebo. Behandlingstiden var 24 veckor. Den genomsnittliga ciklosporindosen vid det senaste besöket var 3,63 mg/kg/dag. Se diagram nedan.
Studie 654 inkluderade 148 patienter som förblev med aktiva ledvärden på 6 eller mer trots behandling med maximalt tolererade doser metotrexat i minst tre månader. Patienterna fortsatte att ta sin nuvarande dos metotrexat och randomiserades för att dessutom få en av följande mediciner: (1) ciklosporin 2,5 mg/kg/dag med dosökningar på 0,5 mg/kg/dag i vecka 2 och 4 om det fanns inga tecken på toxicitet och ytterligare ökningar med 0,5 mg/kg/dag vid vecka 8 och 16 om en
Studie 302 inkluderade 299 patienter med allvarlig aktiv RA, av vilka 99% inte svarade eller var intoleranta mot minst ett tidigare läkemedel mot RA. Patienterna randomiserades till 1 av 2 behandlingsgrupper (1) Neoral 25 mg och (2) ciklosporin, som båda startades med 2,5 mg/kg/dag och ökade efter 4 veckor för ineffektivitet i steg om 0,5 mg/kg/dag till en maximalt 5 mg/kg/dag och minskade när som helst för toxicitet. Behandlingstiden var 24 veckor. Den genomsnittliga ciklosporindosen vid det senaste besöket var 2,91 mg/kg/dag (intervall: 0,72 till 5,17) för Neoral och 3,27 mg/kg/dag (intervall: 0,73 till 5,68) för ciklosporin. Se diagram nedan.
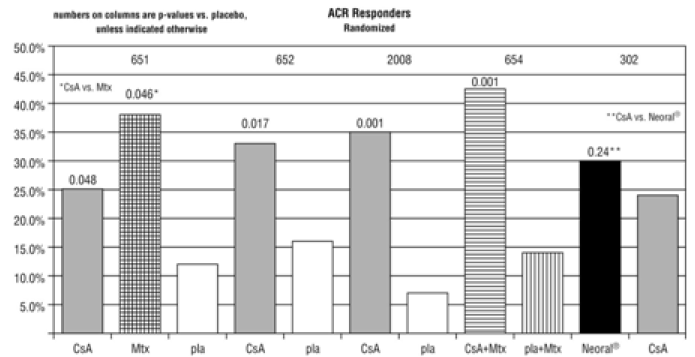
Kliniska studier
I kontrollerade studier var arten, svårighetsgraden och incidensen av de biverkningar som observerades hos 493 transplanterade patienter som behandlades med Neoral jämförbara med de som observerades hos 208 transplanterade patienter som fick Sandimmune i samma studier när dosen av de två läkemedlen justerades. för att uppnå samma dalkoncentrationer av ciklosporin i blodet.
Baserat på den historiska erfarenheten av Sandimmune inträffade följande reaktioner hos 3 % eller fler av 892 patienter involverade i kliniska prövningar av njur-, hjärt- och levertransplantationer.
Bland 705 njurtransplanterade patienter som behandlats med ciklosporin oral lösning (Sandimmune) i kliniska prövningar var orsaken till att behandlingen avbröts njurtoxicitet hos 5,4 %, infektion hos 0,9 %, bristande effekt hos 1,4 %, akut tubulär nekros hos 1,0 %, lymfoproliferativa störningar hos 0,3 %, hypertoni hos 0,3 % och andra orsaker hos 0,7 % av patienterna.
Följande reaktioner inträffade hos 2 % eller mindre av ciklosporinbehandlade patienter: allergiska reaktioner, anemi, anorexi, förvirring, konjunktivit, ödem, feber, sköra fingernaglar, gastrit, hörselnedsättning, hicka, hyperglykemi, migrän (neoral), muskelsmärta, magsår, trombocytopeni, tinnitus.
Följande reaktioner förekom i sällsynta fall: ångest, bröstsmärtor, förstoppning, depression, håravbrott, hematuri, ledsmärta, letargi, munsår, hjärtinfarkt, nattliga svettningar, pankreatit, klåda, sväljsvårigheter, stickningar, blödningar från övre GI, synstörningar, svaghet, viktminskning.
Patienter som får immunsuppressiva terapier, inklusive kurer som innehåller ciklosporin och ciklosporin, löper ökad risk för infektioner (virala, bakteriella, svampar, parasitära). Både generaliserade och lokaliserade infektioner kan förekomma. Redan existerande infektioner kan också förvärras. Dödliga utfall har rapporterats (se VARNINGAR ).
Erfarenhet efter marknadsföring, njur-, lever- och hjärttransplantation
Hepatotoxicitet
Fall av hepatotoxicitet och leverskada, inklusive kolestas, gulsot, hepatit och leversvikt; allvarliga och/eller dödliga utfall har rapporterats (se VARNINGAR , Hepatotoxicitet ).
Ökad risk för infektioner
Fall av JC-virusassocierad progressiv multifokal leukoencefalopati (PML), ibland dödlig; och polyomvirusassocierad nefropati (PVAN), särskilt BK-virus som resulterar i transplantatförlust har rapporterats (se VARNINGAR , Polyomvirusinfektion ).
Huvudvärk, inklusive migrän
Fall av migrän har rapporterats. I vissa fall har patienterna inte kunnat fortsätta med ciklosporin, men det slutliga beslutet om behandlingsavbrott bör fattas av den behandlande läkaren efter en noggrann bedömning av fördelar kontra risker.
Smärta Av Nedre Extremiteter
Enstaka fall av smärta i nedre extremiteter har rapporterats i samband med ciklosporin. Smärta i nedre extremiteter har också noterats som en del av Calcineurin-Inhibitor Induced Pain Syndrome (CIPS) som beskrivs i litteraturen.
Reumatoid artrit
De huvudsakliga biverkningarna som är förknippade med användning av ciklosporin vid reumatoid artrit är nedsatt njurfunktion (se VARNINGAR ), hypertoni (se FÖRSIKTIGHETSÅTGÄRDER ), huvudvärk, gastrointestinala störningar och hirsutism/hypertrikos.
Hos patienter med reumatoid artrit som behandlats i kliniska prövningar inom det rekommenderade dosintervallet, avbröts ciklosporinbehandlingen hos 5,3 % av patienterna på grund av hypertoni och hos 7 % av patienterna på grund av ökat kreatinin. Dessa förändringar är vanligtvis reversibla med snabb dosminskning eller utsättande av läkemedel. Frekvensen och svårighetsgraden av serumkreatininhöjningar ökar med dosen och varaktigheten av ciklosporinbehandlingen. Dessa förhöjningar kommer sannolikt att bli mer uttalade utan dosreduktion eller avbrytande av behandlingen.
Följande biverkningar inträffade i kontrollerade kliniska prövningar:
Dessutom har följande biverkningar rapporterats hos 1 % till
Autonoma nervsystemet: muntorrhet, ökad svettning
Kroppen som helhet: allergi, asteni, värmevallningar, sjukdomskänsla, överdos, procedur NOS*, tumör NOS*, viktminskning, viktökning
Kardiovaskulär: onormala hjärtljud, hjärtsvikt, hjärtinfarkt, perifer ischemi
Centrala och perifera nervsystemet: hypoestesi, neuropati, svindel
Endokrin: struma
Gastrointestinala: förstoppning, dysfagi, enanthem, eruktion, esofagit, magsår, gastrit, gastroenterit, gingival blödning, glossit, magsår, spottkörtelförstoring, tungstörning, tandsjukdom
Infektion: abscess, bakteriell infektion, cellulit, follikulit, svampinfektion, herpes simplex, herpes zoster, njurabscess, moniliasis, tonsillit, virusinfektion
Hematologiska: anemi, näsblod, leukopeni, lymfadenopati
Lever och gallvägar: bilirubinemi
Metaboliskt och näringsmässigt: diabetes mellitus, hyperkalemi, hyperurikemi, hypoglykemi
Muskuloskeletala systemet: artralgi, benfraktur, bursit, ledluxation, myalgi, stelhet, synovial cysta, sensjukdom
Neoplasmer: bröstfibroadenos, karcinom
Psykiatrisk: ångest, förvirring, minskad libido, emotionell labilitet, nedsatt koncentrationsförmåga, ökad libido, nervositet, paroniria, somnolens
Reproduktiv (kvinna): bröstsmärtor, livmoderblödning
Andningssystem: onormala bröstljud, bronkospasm
Hud och bihang: onormal pigmentering, angioödem, dermatit, torr hud, eksem, nagelstörning, klåda, hudstörning, urtikaria
Särskilda sinnen: onormal syn, grå starr, konjunktivit, dövhet, ögonsmärta, smakperversion, tinnitus, vestibulär störning
Urinvägarna: onormal urin, hematuri, ökad BUN, brådskande miktion, natturi, polyuri, pyelonefrit, urininkontinens
*NOS = Ej specificerat på annat sätt
Psoriasis
De huvudsakliga biverkningarna som är förknippade med användning av ciklosporin hos patienter med psoriasis är nedsatt njurfunktion, huvudvärk, hypertoni, hypertriglyceridemi, hirsutism/hypertrikos, parestesi eller hyperestesi, influensaliknande symtom, illamående/kräkningar, diarré, bukbesvär och magbesvär, eller ledvärk.
Hos psoriasispatienter som behandlades i USA-kontrollerade kliniska studier inom det rekommenderade dosintervallet, avbröts ciklosporinbehandlingen hos 1,0 % av patienterna på grund av hypertoni och hos 5,4 % av patienterna på grund av ökat kreatinin. I de flesta fall var dessa förändringar reversibla efter dosreduktion eller utsättning av ciklosporin.
Det har rapporterats ett dödsfall i samband med användningen av ciklosporin vid psoriasis. En 27-årig man utvecklade njurförsämring och fortsatte med ciklosporin. Han hade progressiv njursvikt som ledde till döden.
Frekvensen och svårighetsgraden av serumkreatinin ökar med dosen och varaktigheten av ciklosporinbehandlingen. Dessa förhöjningar kommer sannolikt att bli mer uttalade och kan resultera i irreversibel njurskada utan dosreduktion eller utsättning.
Följande händelser inträffade hos 1 % till mindre än 3 % av psoriasispatienterna som behandlades med ciklosporin:
Kroppen som helhet: feber, vallningar, värmevallningar
Kardiovaskulär: bröstsmärta
Centrala och perifera nervsystemet: ökad aptit, sömnlöshet, yrsel, nervositet, svindel
Gastrointestinala: utspänd buk, förstoppning, tandköttsblödning
Lever och gallvägar: hyperbilirubinemi
Neoplasmer: hudmaligniteter [skivepitelcancer (0,9%) och basalcellscancer (0,4%)]
Retikuloendotelial: blodplätts-, blödnings- och koaguleringsstörningar, röda blodkroppar
Andningsvägar: infektion, viral och annan infektion
Hud och bihang: akne, follikulit, keratos, klåda, utslag, torr hud
Urinvägarna: miktionsfrekvens
Syn: onormal syn
Lätt hypomagnesemi och hyperkalemi kan förekomma men är asymtomatiska. Ökning av urinsyra kan förekomma och giktattacker har sällan rapporterats. En mindre och dosrelaterad hyperbilirubinemi har observerats i frånvaro av hepatocellulär skada. Cyklosporinbehandling kan vara associerad med en måttlig ökning av serumtriglycerider eller kolesterol. Förhöjningar av triglycerider (> 750 mg/dL) förekommer hos cirka 15 % av psoriasispatienterna; förhöjningar av kolesterol (> 300 mg/dL) observeras hos mindre än 3 % av psoriasispatienterna. I allmänhet är dessa laboratorieavvikelser reversibla vid dosreduktion eller utsättande av ciklosporin.
Erfarenhet efter marknadsföring, psoriasis
Fall av transformation till erytrodermisk psoriasis eller generaliserad pustulös psoriasis vid antingen utsättning eller minskning av ciklosporin hos patienter med kronisk plackpsoriasis har rapporterats.
PATIENTINFORMATION
Patienter bör informeras om att varje förändring av ciklosporinformuleringen bör göras med försiktighet och endast under läkares övervakning eftersom det kan resultera i behov av en dosändring.
Patienter bör informeras om nödvändigheten av upprepade laboratorietester medan de får ciklosporin. Patienter bör informeras om de potentiella riskerna under graviditet och informeras om den ökade risken för neoplasi. Patienter bör också informeras om risken för högt blodtryck och nedsatt njurfunktion.
Patienter bör informeras om att vaccination under behandling med ciklosporin kan vara mindre effektivt och användning av levande försvagade vacciner bör undvikas.
Patienter bör ges noggranna doseringsinstruktioner. Neoral oral lösning (ciklosporin oral lösning, USP) MODIFIED bör spädas, helst med apelsin- eller äppeljuice som är i rumstemperatur. Kombinationen av Neoral Oral Solution (ciklosporin oral lösning, USP) MODIFIERAD med mjölk kan vara obehaglig.
Patienter bör rådas att ta Neoral 100 mg enligt ett konsekvent schema med hänsyn till tid på dygnet och förhållande till måltider. Grapefrukt och grapefruktjuice påverkar ämnesomsättningen, vilket ökar blodkoncentrationen av ciklosporin, bör därför undvikas.
