Feldene 10mg, 20mg Piroxicam Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Feldene 20mg och hur används det?
Piroxicam är ett receptbelagt läkemedel som används för att behandla smärta eller inflammation av reumatoid artrit (inklusive juvenil artrit) eller artros. Piroxicam kan användas ensamt eller tillsammans med andra läkemedel.
Piroxicam är ett icke-steroidt antiinflammatoriskt läkemedel (NSAID).
Det är inte känt om Piroxicam är säkert och effektivt hos barn yngre än 12 år.
Vilka är de möjliga biverkningarna av Feldene?
Feldene 10mg kan orsaka allvarliga biverkningar inklusive:
- dunkar i nacken eller öronen,
- dåsighet,
- suddig syn,
- svullnad,
- snabb viktökning,
- andnöd,
- aptitlöshet,
- magont,
- trötthet,
- klåda,
- mörk urin,
- lerfärgade pallar,
- gulfärgning av hud eller ögon (gulsot),
- blodig eller tjäraktig avföring,
- hosta upp blod eller kräks som ser ut som kaffesump,
- lite eller ingen urinering,
- svullnad i dina fötter eller vrister,
- känner sig yr i huvudet,
- kalla händer eller fötter,
- blek hud, och
- svår huvudvärk,
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Feldene inkluderar:
- onormala leverfunktionstester,
- svårt att urinera,
- orolig mage,
- halsbränna,
- aptitlöshet,
- magont,
- illamående,
- kräkningar,
- gas,
- diarre ,
- förstoppning,
- yrsel,
- huvudvärk,
- klåda eller utslag, och
- ringer i öronen,
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Feldene. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
RISK FÖR ALLVARLIGA HJÄRT- OCH Gastrointestinala HÄNDELSER
Kardiovaskulära trombotiska händelser
- Icke-steroida antiinflammatoriska läkemedel (NSAID) orsakar en ökad risk för allvarliga kardiovaskulära trombotiska händelser, inklusive hjärtinfarkt och stroke, som kan vara dödlig. Denna risk kan uppstå tidigt i behandlingen och kan öka med användningstiden. [ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
- FELDENE 20mg är kontraindicerat vid kranskärlsbypassoperationer (CABG) [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Gastrointestinal blödning, sårbildning och perforering
- NSAID orsakar en ökad risk för allvarliga gastrointestinala (GI) biverkningar inklusive blödning, sårbildning och perforering av magen eller tarmarna, vilket kan vara dödligt. Dessa händelser kan inträffa när som helst under användning och utan varningssymptom. Äldre patienter och patienter med tidigare anamnes på magsår och/eller GI-blödning löper större risk för allvarliga GI-händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
BESKRIVNING
FELDENE (piroxicam) kapsel är ett icke-steroidalt antiinflammatoriskt läkemedel, tillgängligt som rödbrun och blå #322 10 mg kapslar och rödbrun #323 20 mg kapslar för oral administrering. Det kemiska namnet är 4-hydroxyl-2-metyl-N-2-pyridinyl-2H-1,2,-bensotiazin-3-karboxamid-1,1-dioxid. Molekylvikten är 331,35. Dess molekylformel är C15H13N3O4S, och den har följande kemiska struktur.
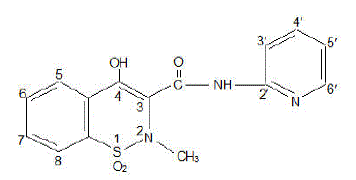
Piroxikam förekommer som ett vitt kristallint fast ämne, svårlösligt i vatten, utspädd syra och de flesta organiska lösningsmedel. Det är lätt lösligt i alkohol och i vattenlösningar. Den uppvisar en svagt sur 4-hydroxiproton (pKa 5,1) och ett svagt basiskt pyridylkväve (pKa 1,8).
De inaktiva ingredienserna i FELDENE 10mg inkluderar: Blue 1, Red 3, laktos, magnesiumstearat, natriumlaurylsulfat, stärkelse.
INDIKATIONER
FELDENE indikeras:
- För lindring av tecken och symtom på artros.
- För lindring av tecken och symtom på reumatoid artrit.
DOSERING OCH ADMINISTRERING
Överväg noga de potentiella fördelarna och riskerna med FELDENE 20mg och andra behandlingsalternativ innan du bestämmer dig för att använda FELDENE. Använd den lägsta effektiva dosen för den kortaste varaktigheten förenlig med individuella patientbehandlingsmål [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Efter att ha observerat svaret på den initiala behandlingen med FELDENE 20 mg, bör dosen och frekvensen justeras för att passa en individuell patients behov.
För lindring av reumatoid artrit och artros är dosen 20 mg oralt en gång om dagen. Om så önskas kan den dagliga dosen delas upp. På grund av den långa halveringstiden för FELDENE uppnås inte steady-state blodnivåer på 7–12 dagar. Därför, även om de terapeutiska effekterna av FELDENE är uppenbara tidigt i behandlingen, finns det en progressiv ökning av svaret under flera veckor och effekten av behandlingen bör inte utvärderas förrän två veckor.
HUR LEVERERAS
Doseringsformer och styrkor
FELDENE (piroxicam) kapslar
10 mg rödbrun och blå #322 20 mg rödbrun #323
Förvaring Och Hantering
FELDENE® (piroxikam) 10 mg kapslar är rödbruna och blå #322, levereras som:
FELDENE® (piroxikam) 20 mg kapslar är rödbrun #323, levereras som:
Lagring
Förvara i rumstemperatur 20°C till 25°C (68°F till 77°F); utflykter tillåtna mellan 15°C till 30°C (59°F till 86°F) [se USP Controlled Room Temperature].
Distribueras av: Pfizer Labs, Division of Pfizer Inc., 235 East 42nd Street, New York, NY 10017. Reviderad: apr 2017.
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Kardiovaskulära trombotiska händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- GI-blödning, sårbildning och perforering [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hypertoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hjärtsvikt och ödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Njurtoxicitet och hyperkalemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anafylaktiska reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarliga hudreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hematologisk toxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Hos patienter som tar FELDENE 10 mg eller andra NSAID, är de vanligaste rapporterade biverkningarna som inträffar hos cirka 1–10 % av patienterna:
Kardiovaskulära systemet: Ödem
Matsmältningssystemet: Anorexi, buksmärtor, förstoppning, diarré, flatulens, illamående, kräkningar
Nervsystem : Yrsel, huvudvärk, yrsel
Hud och bihang: Klåda, utslag
Särskilda sinnen: Tinnitus
Ytterligare negativa upplevelser som rapporteras ibland inkluderar:
Kardiovaskulära systemet: Hjärtklappning
Matsmältningssystemet: Stomatit
Nervsystem: Dåsighet
Särskilda sinnen: Suddig syn
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats efter användning av FELDENE efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Kroppen som helhet: Feber, infektion, sepsis, anafylaktiska reaktioner, aptitförändringar, död, influensaliknande syndrom, smärta (kolik), serumsjuka
Kardiovaskulära systemet: Kongestiv hjärtsvikt, hypertoni, takykardi, synkope, arytmi, exacerbation av angina, hypotoni, hjärtinfarkt, vaskulit
Matsmältningssystemet: Dyspepsi, förhöjda leverenzymer, grov blödning/perforation, halsbränna, sår (mag/duodenal), muntorrhet, esofagit, gastrit, glossit, hematemes, hepatit, gulsot, melena, rektal blödning, utslag, leversvikt, pankreatit
Hemiska och lymfatiska systemet: Anemi, ökad blödningstid, e ckymos, eosinofili, näsblod, leukopeni, purpura, petechial utslag, trombocytopeni, agranulocytos, hemolytisk anemi, aplastisk anemi, lymfadenopati, pancytopeni
Överkänslighet: Positiv ANA
Metaboliskt och näringsmässigt: Viktförändringar, vätskeretention, hyperglykemi, hypoglykemi
Nervsystem: Ångest, asteni, förvirring, depression, drömavvikelser, sömnlöshet, sjukdomskänsla, nervositet, parestesi, somnolens, skakningar, akatisi, kramper, koma, hallucinationer, meningit, humörsvängningar
Andningssystem: Astma, dyspné, andningsdepression, lunginflammation
Hud och bihang: Alopeci, blåmärken, desquamation, erytem, ljuskänslighet, svett, angioödem, giftig epidermal nekros, erythema multiforme, exfoliativ dermatit, onykolys, Stevens Johnsons syndrom, urtikaria, vesikulobullös reaktion
Särskilda sinnen: Konjunktivit, hörselnedsättning, svullna ögon
Urogenitala systemet: onormal njurfunktion, c ystit, dysuri, hematuri, hyperkalemi, interstitiell nefrit, nefrotiskt syndrom, oliguri/polyuri, proteinuri, njursvikt, glomerulonefrit
Reproduktionssystemet och bröststörningar: Kvinnlig fertilitet minskade
LÄKEMEDELSINTERAKTIONER
Se tabell 1 för kliniskt signifikanta läkemedelsinteraktioner med piroxikam.
VARNINGAR
Ingår som en del av "FÖRSIKTIGHETSÅTGÄRDER" Sektion
FÖRSIKTIGHETSÅTGÄRDER
Kardiovaskulära trombotiska händelser
Kliniska prövningar av flera COX-2 selektiva och icke-selektiva NSAID med upp till tre års varaktighet har visat en ökad risk för allvarliga kardiovaskulära (CV) trombotiska händelser, inklusive hjärtinfarkt (MI) och stroke, som kan vara dödlig. Baserat på tillgängliga data är det oklart att risken för CV-trombotiska händelser är liknande för alla NSAID. Den relativa ökningen av allvarliga CV-trombotiska händelser jämfört med baslinjen till följd av NSAID-användning tycks vara liknande hos de med och utan känd CV-sjukdom eller riskfaktorer för CV-sjukdom. Patienter med känd CV-sjukdom eller riskfaktorer hade dock en högre absolut incidens av alltför allvarliga CV-trombotiska händelser, på grund av deras ökade baslinjefrekvens. Vissa observationsstudier fann att denna ökade risk för allvarliga CV-trombotiska händelser började redan under de första veckorna av behandlingen. Ökningen av CV-trombotisk risk har observerats mest konsekvent vid högre doser.
För att minimera den potentiella risken för en negativ CV-händelse hos NSAID-behandlade patienter, använd den lägsta effektiva dosen under kortast möjliga varaktighet. Läkare och patienter bör vara uppmärksamma på utvecklingen av sådana händelser, under hela behandlingsförloppet, även i frånvaro av tidigare CV-symtom. Patienter bör informeras om symtomen på allvarliga CV-händelser och de åtgärder som ska vidtas om de inträffar.
Det finns inga konsekventa bevis för att samtidig användning av aspirin minskar den ökade risken för allvarliga CV-trombotiska händelser i samband med NSAID-användning. Samtidig användning av acetylsalicylsyra och ett NSAID, såsom piroxikam, ökar risken för allvarliga gastrointestinala (GI) händelser [se Gastrointestinal blödning, sårbildning och perforering ].
Status efter kranskärlsbypassoperation (CABG).
Två stora, kontrollerade kliniska prövningar av ett COX-2-selektivt NSAID för behandling av smärta under de första 10–14 dagarna efter CABG-operation fann en ökad incidens av hjärtinfarkt och stroke. NSAID är kontraindicerade vid CABG [se KONTRAINDIKATIONER ].
Patienter efter MI
Observationsstudier utförda i det danska nationella registret har visat att patienter som behandlats med NSAID under perioden efter MI löpte ökad risk för reinfarkt, CV-relaterad död och dödlighet av alla orsaker med början under den första behandlingsveckan. I samma kohort var incidensen av dödsfall under det första året efter MI 20 per 100 personår hos NSAID-behandlade patienter jämfört med 12 per 100 personår hos icke-NSAID-exponerade patienter. Även om den absoluta dödsfrekvensen minskade något efter det första året efter MI, kvarstod den ökade relativa risken för död hos NSAID-användare under åtminstone de kommande fyra åren av uppföljning.
Undvik användningen av FELDENE 10 mg till patienter med nyligen hjärtinfarkt såvida inte fördelarna förväntas uppväga risken för återkommande CV-trombotiska händelser. Om FELDENE används till patienter med nyligen hjärtinfarkt, övervaka patienterna för tecken på hjärtischemi.
Gastrointestinal blödning, sårbildning och perforering
NSAID, inklusive FELDENE, orsakar allvarliga gastrointestinala (GI) biverkningar inklusive inflammation, blödning, sårbildning och perforering av matstrupen, magen, tunntarmen eller tjocktarmen, vilket kan vara dödligt. Dessa allvarliga biverkningar kan inträffa när som helst, med eller utan varningssymtom, hos patienter som behandlas med NSAID. Endast en av fem patienter som utvecklar en allvarlig övre GI-biverkning på NSAID-behandling är symtomatisk. Övre gastrointestinala sår, grov blödning eller perforation orsakad av NSAID förekom hos cirka 1 % av patienterna som behandlades under 3–6 månader och hos cirka 2 %–4 % av patienterna som behandlades under ett år. Men även kortvarig NSAID-behandling är inte utan risk.
Riskfaktorer för GI-blödning, sårbildning och perforering
Patienter med magsår och/eller gastrointestinala blödningar i anamnesen som använde NSAID hade en mer än 10 gånger ökad risk för att utveckla en gastrointestinala blödning jämfört med patienter utan dessa riskfaktorer. Andra faktorer som ökar risken för GI-blödning hos patienter som behandlas med NSAID inkluderar längre varaktighet av NSAID-behandling; samtidig användning av orala kortikosteroider, aspirin, antikoagulantia eller selektiva serotoninåterupptagshämmare (SSRI); rökning; användning av alkohol; äldre ålder; och dåligt allmänt hälsotillstånd. De flesta rapporter om dödliga gastrointestinala händelser efter marknadsföring inträffade hos äldre eller försvagade patienter. Dessutom löper patienter med avancerad leversjukdom och/eller koagulopati en ökad risk för GI-blödning.
Strategier för att minimera GI-riskerna hos NSAID-behandlade patienter
- Använd den lägsta effektiva dosen under kortast möjliga varaktighet.
- Undvik administrering av mer än ett NSAID åt gången.
- Undvik användning till patienter med högre risk om inte fördelarna förväntas uppväga den ökade risken för blödning. För sådana patienter, såväl som de med aktiv GI-blödning, överväg alternativa terapier än NSAID.
- Var uppmärksam på tecken och symtom på magsår och blödning under NSAID-behandling.
- Om en allvarlig GI-biverkning misstänks, initiera omedelbart utvärdering och behandling och avbryt FELDENE tills en allvarlig GI-biverkning är utesluten.
- Vid samtidig användning av lågdos acetylsalicylsyra för hjärtprofylax, övervaka patienterna noggrannare för tecken på GI-blödning [se LÄKEMEDELSINTERAKTIONER ].
Hepatotoxicitet
Förhöjningar av ALAT eller ASAT (tre eller fler gånger den övre normalgränsen [ULN]) har rapporterats hos cirka 1 % av NSAID-behandlade patienter i kliniska prövningar. Dessutom har sällsynta, ibland dödliga, fall av allvarlig leverskada, inklusive fulminant hepatit, levernekros och leversvikt rapporterats.
Förhöjningar av ALAT eller ASAT (mindre än tre gånger ULN) kan förekomma hos upp till 15 % av patienterna som behandlas med NSAID inklusive piroxikam.
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, diarré, klåda, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om kliniska tecken och symtom som överensstämmer med leversjukdom utvecklas, eller om systemiska manifestationer uppstår (t.ex. eosinofili, hudutslag, etc.), avbryt FELDENE omedelbart och utför en klinisk utvärdering av patienten.
Hypertoni
NSAID, inklusive FELDENE, kan leda till nystart av hypertoni eller förvärring av redan existerande hypertoni, vilka båda kan bidra till den ökade incidensen av CV-händelser. Patienter som tar angiotensinomvandlande enzym (ACE)-hämmare, tiaziddiuretika eller loopdiuretika kan ha försämrat svar på dessa behandlingar när de tar NSAID [se LÄKEMEDELSINTERAKTIONER ].
Övervaka blodtrycket (BP) under inledning av NSAID-behandling och under hela behandlingen.
Hjärtsvikt och ödem
Coxib och traditionella NSAID Trialists' Collaboration-metaanalys av randomiserade kontrollerade studier visade en ungefär tvåfaldig ökning av sjukhusinläggningar för hjärtsvikt hos COX-2 selektivt behandlade patienter och icke-selektiva NSAID-behandlade patienter jämfört med placebobehandlade patienter. I en dansk National Register-studie av patienter med hjärtsvikt ökade NSAID-användning risken för hjärtinfarkt, sjukhusvistelse för hjärtsvikt och död.
Dessutom har vätskeretention och ödem observerats hos vissa patienter som behandlats med NSAID. Användning av piroxikam kan dämpa CV-effekterna av flera terapeutiska medel som används för att behandla dessa medicinska tillstånd (t.ex. diuretika, ACE-hämmare eller angiotensinreceptorblockerare [ARB]) [se LÄKEMEDELSINTERAKTIONER ].
Undvik användning av FELDENE 10 mg till patienter med allvarlig hjärtsvikt om inte fördelarna förväntas uppväga risken för förvärrad hjärtsvikt. Om FELDENE används till patienter med allvarlig hjärtsvikt, övervaka patienterna för tecken på förvärrad hjärtsvikt.
Njurtoxicitet och hyperkalemi
Njurtoxicitet
Långvarig administrering av NSAID har resulterat i njurpapillär nekros och annan njurskada.
Njurtoxicitet har också setts hos patienter hos vilka njurprostaglandiner har en kompensatorisk roll i upprätthållandet av njurperfusion. Hos dessa patienter kan administrering av ett NSAID orsaka en dosberoende minskning av prostaglandinbildningen och, i andra hand, i njurblodflödet, vilket kan utlösa tydlig njurdekompensation. Patienter med störst risk för denna reaktion är de med nedsatt njurfunktion, uttorkning, hypovolemi, hjärtsvikt, leverdysfunktion, de som tar diuretika och ACE-hämmare eller ARB och äldre. Avbrytande av NSAID-behandling följs vanligtvis av återhämtning till förbehandlingstillstånd.
Ingen information finns tillgänglig från kontrollerade kliniska studier avseende användning av FELDENE 20 mg hos patienter med avancerad njursjukdom. Njureffekterna av FELDENE 20 mg kan påskynda utvecklingen av njurdysfunktion hos patienter med redan existerande njursjukdom.
Korrekt volymstatus hos dehydrerade eller hypovolemiska patienter innan behandling med FELDENE påbörjas. Övervaka njurfunktionen hos patienter med nedsatt njur- eller leverfunktion, hjärtsvikt, uttorkning eller hypovolemi under användning av FELDENE [se LÄKEMEDELSINTERAKTIONER ]. Undvik användning av FELDENE till patienter med avancerad njursjukdom såvida inte fördelarna förväntas uppväga risken för försämrad njurfunktion. Om FELDENE används till patienter med avancerad njursjukdom, övervaka patienterna för tecken på försämrad njurfunktion.
Hyperkalemi
Ökning av serumkaliumkoncentrationen, inklusive hyperkalemi, har rapporterats vid användning av NSAID, även hos vissa patienter utan nedsatt njurfunktion. Hos patienter med normal njurfunktion har dessa effekter tillskrivits ett tillstånd av hyporeninemisk-hypoaldosteronism.
Anafylaktiska reaktioner
Piroxikam har associerats med anafylaktiska reaktioner hos patienter med och utan känd överkänslighet mot piroxikam och hos patienter med aspirinkänslig astma [se KONTRAINDIKATIONER och Förvärring av astma relaterad till aspirinkänslighet ].
Sök akut hjälp om en anafylaktisk reaktion inträffar.
Förvärring av astma relaterad till aspirinkänslighet
En subpopulation av patienter med astma kan ha aspirinkänslig astma som kan innefatta kronisk rhinosinusit komplicerad av näspolyper; allvarlig, potentiellt dödlig bronkospasm; och/eller intolerans mot aspirin och andra NSAID. Eftersom korsreaktivitet mellan acetylsalicylsyra och andra NSAID har rapporterats hos sådana aspirinkänsliga patienter, är FELDENE 20 mg kontraindicerat hos patienter med denna form av acetylsalicylsyrakänslighet [se KONTRAINDIKATIONER ]. När FELDENE används till patienter med redan existerande astma (utan känd acetylsalicylsyrakänslighet), övervaka patienterna med avseende på förändringar i tecken och symtom på astma.
Allvarliga hudreaktioner
NSAID, inklusive piroxikam, kan orsaka allvarliga hudbiverkningar som exfoliativ dermatit, Stevens-Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN), som kan vara dödlig. Dessa allvarliga händelser kan inträffa utan förvarning. Informera patienterna om tecken och symtom på allvarliga hudreaktioner och att avbryta användningen av FELDENE 10 mg vid första uppkomsten av hudutslag eller andra tecken på överkänslighet. FELDENE 20mg är kontraindicerat hos patienter med tidigare allvarliga hudreaktioner på NSAID [se KONTRAINDIKATIONER ].
För tidig stängning av Fetal Ductus Arteriosus
Piroxikam kan orsaka för tidig stängning av fetal ductus arteriosus. Undvik användning av NSAID, inklusive FELDENE 20 mg, hos gravida kvinnor som börjar vid 30 veckors graviditet (tredje trimestern) [se Användning i specifika populationer ].
Hematologisk toxicitet
Anemi har förekommit hos NSAID-behandlade patienter. Detta kan bero på ockult eller grov blodförlust, vätskeretention eller en ofullständigt beskriven effekt på erytropoes. Om en patient som behandlas med FELDENE har några tecken eller symtom på anemi, övervaka hemoglobin eller hematokrit.
NSAID, inklusive FELDENE, kan öka risken för blödningar. Samorbida tillstånd som koagulationsrubbningar, samtidig användning av warfarin, andra antikoagulantia, trombocythämmande medel (t.ex. aspirin), serotoninåterupptagshämmare (SSRI) och serotonin noradrenalin återupptagshämmare (SNRI) kan öka denna risk. Övervaka dessa patienter för tecken på blödning [se LÄKEMEDELSINTERAKTIONER ].
Maskering av inflammation och feber
Den farmakologiska aktiviteten av FELDENE 10 mg för att minska inflammation, och eventuellt feber, kan minska användbarheten av diagnostiska tecken för att upptäcka infektioner.
Laboratorieövervakning
Eftersom allvarlig GI-blödning, levertoxicitet och njurskada kan uppstå utan varningssymtom eller tecken, överväg att övervaka patienter på långvarig NSAID-behandling med en CBC och en kemiprofil regelbundet [se Gastrointestinal blödning, sår och perforering, levertoxicitet, njurtoxicitet och hyperkalemi ] .
Oftalmologiska effekter
På grund av rapporter om negativa ögonfynd med icke-steroida antiinflammatoriska medel, rekommenderas att patienter som utvecklar synbesvär under behandling med FELDENE genomgår oftalmiska utvärderingar.

Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen ( Läkemedelsguide ) som medföljer varje utskrivet recept. Informera patienter, familjer eller deras vårdgivare om följande information innan behandling med FELDENE påbörjas och med jämna mellanrum under pågående behandling.
Kardiovaskulära trombotiska händelser
Rekommendera patienter att vara uppmärksamma på symtom på kardiovaskulära trombotiska händelser, inklusive bröstsmärtor, andnöd, svaghet eller sluddrigt tal, och att omedelbart rapportera något av dessa symtom till sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Gastrointestinal blödning, sårbildning och perforering
Råda patienter att rapportera symtom på sår och blödningar, inklusive epigastrisk smärta, dyspepsi, melena och hematemes till sin vårdgivare. Vid samtidig användning av lågdos aspirin för hjärtprofylax, informera patienterna om den ökade risken för och tecknen och symtomen på gastrointestinala blödningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hepatotoxicitet
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, klåda, diarré, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om dessa inträffar, instruera patienterna att sluta med FELDENE och omedelbart söka medicinsk behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hjärtsvikt och ödem
Rekommendera patienter att vara uppmärksamma på symtom på kronisk hjärtsvikt inklusive andnöd, oförklarlig viktökning eller ödem och att kontakta sin vårdgivare om sådana symtom uppstår [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anafylaktiska reaktioner
Informera patienterna om tecknen på en anafylaktisk reaktion (t.ex. andningssvårigheter, svullnad i ansikte eller hals). Instruera patienter att söka omedelbar akut hjälp om dessa inträffar [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Allvarliga hudreaktioner
Rekommendera patienter att omedelbart sluta med FELDENE om de utvecklar någon typ av utslag och att kontakta sin vårdgivare så snart som möjligt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kvinnlig fertilitet
Informera kvinnor med reproduktionspotential som önskar graviditet att NSAID, inklusive FELDENE 20 mg, kan vara associerade med en reversibel försening av ägglossningen [se Användning i specifika populationer ].
Fostertoxicitet
Informera gravida kvinnor att undvika användning av FELDENE och andra NSAID från och med 30 veckors graviditet på grund av risken för för tidig stängning av fetal ductus arteriosus [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Undvik samtidig användning av NSAID
Informera patienterna om att samtidig användning av FELDENE med andra NSAID eller salicylater (t.ex. diflunisal, salsalat) inte rekommenderas på grund av den ökade risken för gastrointestinal toxicitet och liten eller ingen ökning av effekt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ]. Varna patienter om att NSAID kan finnas i "receptfria" läkemedel för behandling av förkylningar, feber eller sömnlöshet.
Användning av NSAID och lågdos aspirin
Informera patienterna att inte använda lågdos acetylsalicylsyra samtidigt med FELDENE förrän de pratat med sin vårdgivare [se LÄKEMEDELSINTERAKTIONER ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
Långtidsstudier på djur har inte utförts för att karakterisera den karcinogena potentialen hos piroxikam.
Mutagenes
Piroxikam var inte mutagent i en Ames bakteriell omvänd mutationsanalys, eller i en dominant letal mutationsanalys på möss, och var inte klastogen i en in vivo kromosomavvikelseanalys på möss.
Nedsättning av fertilitet
Reproduktionsstudier där råttor administrerades piroxikam i doser på 2, 5 eller 10 mg/kg/dag (upp till 5 gånger den maximala rekommenderade humandosen [MRHD] på 20 mg baserat på mg/m2 kroppsyta [BSA]) visade ingen försämring av manlig eller kvinnlig fertilitet.
Användning i specifika populationer
Graviditet
Risksammanfattning
Användning av NSAID, inklusive FELDENE 20 mg, under graviditetens tredje trimester ökar risken för för tidig stängning av fetal ductus arteriosus. Undvik användning av NSAID, inklusive FELDENE 10 mg, hos gravida kvinnor med början vid 30 veckors graviditet (tredje trimestern).
Det finns inga adekvata och välkontrollerade studier av FELDENE 20 mg på gravida kvinnor.
Data från observationsstudier angående potentiella embryofetala risker för NSAID-användning hos kvinnor under graviditetens första eller andra trimester är inte övertygande. I den allmänna amerikanska befolkningen har alla kliniskt erkända graviditeter, oavsett läkemedelsexponering, en bakgrundsfrekvens på 2–4 % för allvarliga missbildningar och 15–20 % för graviditetsförlust.
reproduktionsstudier på djur på råttor och kaniner fanns inga tecken på teratogenicitet vid exponeringar upp till 5 respektive 10 gånger MRHD. I råttstudier med piroxikam observerades fostertoxicitet (förlust efter implantation) vid exponeringar 2 gånger MRHD, och försenad förlossning och en ökad incidens av dödfödsel observerades vid doser motsvarande MRHD för piroxikam. Baserat på djurdata har prostaglandiner visat sig ha en viktig roll i endometrievaskulär permeabilitet, blastocystimplantation och decidualisering. I djurstudier resulterade administrering av prostaglandinsynteshämmare såsom piroxikam i ökad förlust före och efter implantation.
Kliniska överväganden
Arbetskraft eller leverans
Det finns inga studier på effekterna av FELDENE under förlossningen eller förlossningen. I djurstudier hämmar NSAID, inklusive piroxikam, prostaglandinsyntesen, orsakar försenad förlossning och ökar förekomsten av dödfödsel.
Data
Djurdata
Dräktiga råttor som administrerades piroxikam med 2, 5 eller 10 mg/kg/dag under organogenesperioden (dräktighetsdagar 6 till 15) visade ökade post-implantationsförluster med 5 och 10 mg/kg/dag av piroxikam (motsvarande 2 och 5 gånger den maximala rekommenderade humandosen [MRHD], på 20 mg respektive, baserat på en mg/m2 kroppsyta [BSA]). Det observerades inga läkemedelsrelaterade utvecklingsavvikelser hos avkomman. Mag-tarmkanalens toxicitet ökade hos dräktiga råttor under den sista trimestern av graviditeten jämfört med icke-gravida råttor eller råttor under tidigare trimestrar av graviditeten. Dräktiga kaniner som administrerades piroxikam med 2, 5 eller 10 mg/kg/dag under organogenesperioden (dräktighetsdagar 7 till 18) visade inga läkemedelsrelaterade utvecklingsavvikelser hos avkomma (upp till 10 gånger MRHD baserat på en mg/m2) BSA).
en pre- och postnatal utvecklingsstudie där gravida råttor administrerades piroxikam i dosen 2, 5 eller 10 mg/kg/dag på dräktighetsdag 15 genom förlossning och avvänjning av avkomma, observerades minskad viktökning och död hos mödrar kl. 10 mg/kg/dag (5 gånger MRHD baserat på en mg/m2 BSA) med början på dräktighetsdag 20. Behandlade moderdjur visade peritonit, sammanväxningar, magblödningar, hemorragisk enterit och döda foster i livmodern. Förlossningen var försenad och det fanns en ökad förekomst av dödfödsel i alla piroxikambehandlade grupper (vid doser motsvarande MRHD). Postnatal utveckling kunde inte bedömas tillförlitligt på grund av frånvaron av mödravård sekundärt till allvarlig maternell toxicitet.
Laktation
Risksammanfattning
Begränsade data från 2 publicerade rapporter som omfattade totalt 6 ammande kvinnor och 2 spädbarn visade att piroxikam utsöndras i modersmjölk i cirka 1 % till 3 % av moderns koncentration. Ingen ackumulering av piroxikam inträffade i mjölk jämfört med den i moderns plasma under behandlingen. Utvecklings- och hälsofördelarna med amning bör beaktas tillsammans med moderns kliniska behov av FELDENE 20 mg och eventuella negativa effekter på det ammade barnet från FELDENE eller från det underliggande moderns tillståndet.
Kvinnor Och Hanar Av Reproduktionspotential
Infertilitet
Kvinnor
Baserat på verkningsmekanismen kan användningen av prostaglandinmedierade NSAID, inklusive FELDENE, fördröja eller förhindra bristning av äggstocksfolliklar, vilket har associerats med reversibel infertilitet hos vissa kvinnor. Publicerade djurstudier har visat att administrering av prostaglandinsynteshämmare har potential att störa prostaglandinmedierad follikelruptur som krävs för ägglossning. Små studier på kvinnor som behandlats med NSAID har också visat en reversibel försening av ägglossningen. Överväg utsättande av NSAID, inklusive FELDENE, hos kvinnor som har svårt att bli gravida eller som genomgår utredning av infertilitet.
Pediatrisk användning
FELDENE 20 mg har inte undersökts hos pediatriska patienter. Säkerheten och effektiviteten för FELDENE 10 mg har inte fastställts.
Geriatrisk användning
Äldre patienter, jämfört med yngre patienter, löper större risk för NSAID-relaterade allvarliga kardiovaskulära, gastrointestinala och/eller renala biverkningar. Om den förväntade fördelen för den äldre patienten uppväger dessa potentiella risker, börja doseringen i den nedre delen av doseringsintervallet och övervaka patienterna för biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
ÖVERDOS
Symtom efter akuta NSAID-överdoser har vanligtvis begränsats till letargi, dåsighet, illamående, kräkningar och epigastrisk smärta, som i allmänhet är reversibla med stödbehandling. Gastrointestinal blödning har inträffat. Hypertoni, akut njursvikt, andningsdepression och koma har förekommit, men var sällsynta [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hantera patienter med symtomatisk och stödjande vård efter en NSAID-överdos. Det finns inga specifika motgift. Överväg kräkning och/eller aktivt kol (60–100 gram hos vuxna, 1–2 gram per kg kroppsvikt hos pediatriska patienter) och/eller osmotisk katartisk hos symtomatiska patienter som ses inom fyra timmar efter intag eller hos patienter med en stor överdosering ( 5 till 10 gånger den rekommenderade dosen).
Den långa plasmahalveringstiden för piroxikam bör beaktas vid behandling av en överdos med piroxikam. Påtvingad diures, alkalinisering av urin, hemodialys eller hemoperfusion kanske inte är användbara på grund av hög proteinbindning.
För ytterligare information om överdoseringsbehandling kontakta en giftkontrollcentral (1-800-222-1222).
KONTRAINDIKATIONER
FELDENE 10 mg är kontraindicerat för följande patienter:
- Känd överkänslighet (t.ex. anafylaktiska reaktioner och allvarliga hudreaktioner) mot piroxikam eller någon del av läkemedelsprodukten [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anamnes med astma, urtikaria eller andra reaktioner av allergisk typ efter att ha tagit acetylsalicylsyra eller andra NSAID. Allvarliga, ibland dödliga, anafylaktiska reaktioner på NSAID har rapporterats hos sådana patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- I samband med kranskärlsbypassoperation (CABG) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
KLINISK FARMAKOLOGI
Handlingsmekanism
Piroxicam har smärtstillande, antiinflammatoriska och febernedsättande egenskaper.
Verkningsmekanismen för FELDENE 20 mg, liksom för andra NSAID, är inte helt klarlagd men involverar hämning av cyklooxygenas (COX-1 och COX-2).
Piroxikam är en potent hämmare av prostaglandinsyntes (PG) in vitro. Piroxikamkoncentrationer som uppnåtts under behandlingen har gett in vivo-effekter. Prostaglandiner sensibiliserar afferenta nerver och potentierar verkan av bradykinin för att inducera smärta i djurmodeller. Prostaglandiner är mediatorer av inflammation. Eftersom piroxikam är en hämmare av prostaglandinsyntes, kan dess verkningsmekanism bero på en minskning av prostaglandiner i perifera vävnader.
Farmakokinetik
Allmänna farmakokinetiska egenskaper
Farmakokinetiken för piroxikam har karakteriserats hos friska försökspersoner, speciella populationer och patienter. Farmakokinetiken för piroxikam är linjär. Proportionell ökning av exponeringen observeras med ökande doser. Den förlängda halveringstiden (50 timmar) resulterar i upprätthållande av relativt stabila plasmakoncentrationer under hela dagen vid doser en gång dagligen och signifikant ackumulering vid upprepad dosering. De flesta patienter uppskattar steady state plasmanivåer inom 7–12 dagar. Högre nivåer, som närmar sig steady state efter två till tre veckor, har observerats hos patienter hos vilka längre plasmahalveringstider av piroxikam förekom.
Absorption
Piroxikam absorberas väl efter oral administrering. Läkemedelsplasmakoncentrationerna är proportionella för 10 och 20 mg doser och toppar vanligtvis inom tre till fem timmar efter administrering. En engångsdos på 20 mg ger vanligtvis maximala plasmanivåer av piroxikam på 1,5 till 2 mcg/ml, medan maximala plasmakoncentrationer av läkemedel, efter upprepad daglig administrering av 20 mg piroxikam, vanligtvis stabiliseras på 3–8 mcg/ml.
Med mat är det en liten fördröjning i hastigheten men inte graden av absorption efter oral administrering. Samtidig administrering av antacida (aluminiumhydroxid eller aluminiumhydroxid med magnesiumhydroxid) har inte visat sig ha någon effekt på plasmanivåerna av oralt administrerat piroxikam.
Distribution
Den skenbara distributionsvolymen för piroxikam är cirka 0,14 l/kg. 99 procent av plasmapiroxikam är bundet till plasmaproteiner. Piroxikam utsöndras i modersmjölk. Förekomsten i bröstmjölk har fastställts under initiala och långvariga tillstånd (52 dagar). Piroxikam förekom i bröstmjölk vid cirka 1 % till 3 % av moderns koncentration. Ingen ackumulering av piroxikam inträffade i mjölk jämfört med den i plasma under behandlingen.
Eliminering
Ämnesomsättning
Metabolism av piroxikam sker genom hydroxylering vid 5-positionen av pyridylsidokedjan och konjugering av denna produkt; genom cyklodehydrering; och genom en sekvens av reaktioner som involverar hydrolys av amidbindningen, dekarboxylering, ringkontraktion och N-demetylering. In vitro-studier indikerar cytokrom P4502C9 (CYP2C9) som det huvudsakliga enzymet involverat i bildningen till 5'-hydroxi-piroxikam, huvudmetaboliten [se Farmakogenomik ]. Biotransformationsprodukterna från piroxikams metabolism har rapporterats inte ha någon antiinflammatorisk aktivitet.
Högre systemisk exponering av piroxikam har noterats hos försökspersoner med CYP2C9-polymorfismer jämfört med individer av normal metaboliseringstyp [se Farmakogenomik ].
Exkretion
Piroxikam och dess biotransformationsprodukter utsöndras i urin och avföring, med ungefär dubbelt så mycket i urinen som i avföring. Cirka 5 % av en FELDENE 10 mg dos utsöndras oförändrad. Plasmahalveringstiden (t½ ) för piroxikam är cirka 50 timmar.
Specifika populationer
Pediatrisk
Piroxikam har inte undersökts hos pediatriska patienter.
Lopp
Farmakokinetiska skillnader på grund av ras har inte identifierats.
Nedsatt leverfunktion
Effekterna av leversjukdom på piroxikams farmakokinetik har inte fastställts. En betydande del av elimineringen av piroxikam sker dock genom levermetabolism. Följaktligen kan patienter med leversjukdom behöva minskade doser av piroxikam jämfört med patienter med normal leverfunktion.
Nedsatt njurfunktion
Piroxikams farmakokinetik har undersökts hos patienter med njurinsufficiens. Studier indikerar att patienter med lätt till måttligt nedsatt njurfunktion kanske inte behöver dosjusteringar. De farmakokinetiska egenskaperna hos piroxikam hos patienter med allvarlig njurinsufficiens eller de som får hemodialys är dock inte kända.
Läkemedelsinteraktionsstudier
Antacida
Samtidig administrering av antacida hade ingen effekt på plasmanivåerna av piroxikam.
Aspirin
När piroxikam administrerades med acetylsalicylsyra reducerades dess proteinbindning, även om clearance av fritt FELDENE 20 mg inte förändrades. Plasmanivåerna av piroxikam minskade till cirka 80 % av deras normala värden när FELDENE administrerades (20 mg/dag) tillsammans med aspirin (3900 mg/dag). Den kliniska betydelsen av denna interaktion är inte känd [se LÄKEMEDELSINTERAKTIONER ].
Farmakogenomik
CYP2C9-aktiviteten är reducerad hos individer med genetiska polymorfismer, såsom CYP2C9*2 och CYP2C9*3 polymorfismer. Begränsade data från två publicerade rapporter visade att försökspersoner med heterozygota CYP2C9*1/*2 (n=9), heterozygota CYP2C9*1/*3 (n=9) och homozygota CYP2C9*3/*3 (n=1) genotyper visade 1,7-, 1,7- respektive 5,3 gånger högre systemiska nivåer av piroxikam än försökspersonerna med CYP2C9*1/*1 (n=17, genotyp av normal metaboliserare) efter administrering av en enstaka oral dos. De genomsnittliga eliminationshalveringstiden för piroxikam för försökspersoner med genotyperna CYP2C9*1/*3 (n=9) och CYP2C9*3/*3 (n=1) var 1,7 och 8,8 gånger högre än försökspersoner med CYP2C9*1 /*1 (n=17). Det uppskattas att frekvensen av genotypen homozygot*3/*3 är 0 % till 1 % i befolkningen i stort; dock har så höga frekvenser som 5,7 % rapporterats i vissa etniska grupper.
Dåliga metaboliserare av CYP2C9-substrat
Hos patienter som är kända eller misstänks vara dåliga CYP2C9-metaboliserare baserat på genotyp eller tidigare historia/erfarenhet av andra CYP2C9-substrat (såsom warfarin och fenytoin) överväg dosreduktion eftersom de kan ha onormalt höga plasmanivåer på grund av minskat metaboliskt clearance.
Kliniska studier
I kontrollerade kliniska prövningar har effektiviteten av FELDENE fastställts för både akuta exacerbationer och långtidsbehandling av reumatoid artrit och artros.
De terapeutiska effekterna av FELDENE 20 mg är uppenbara tidigt i behandlingen av båda sjukdomarna med en progressiv ökning av svaret under flera (8–12) veckor. Effekten ses i termer av smärtlindring och, i förekommande fall, avtagande av inflammation.
Doser på 20 mg/dag FELDENE 20 mg uppvisar en terapeutisk effekt som är jämförbar med terapeutiska doser av acetylsalicylsyra, med en lägre incidens av mindre gastrointestinala effekter och tinnitus.
FELDENE 10 mg har administrerats samtidigt med fasta doser av guld och kortikosteroider. Förekomsten av en "steroidsparande" effekt har hittills inte studerats tillräckligt.
PATIENTINFORMATION
Vilken är den viktigaste informationen jag bör veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?
NSAID kan orsaka allvarliga biverkningar, inklusive:
- Ökad risk för hjärtinfarkt eller stroke som kan leda till döden. Denna risk kan inträffa tidigt i behandlingen och kan öka:
- med ökande doser av NSAID
- med längre användning av NSAID
- Ökad risk för blödningar, sår och revor (perforering) i matstrupen (slangen som leder från munnen till magen), magen och tarmarna:
- när som helst under användning
- utan varningssymtom
- som kan orsaka dödsfall
Risken för att få ett sår eller blödning ökar med:
- tidigare anamnes på magsår, eller blödning från magen eller tarmen vid användning av NSAID
- tar läkemedel som kallas "kortikosteroider", "antikoagulantia", "SSRI" eller "SNRI"
- ökande doser av NSAID
- längre användning av NSAID
- rökning
- dricker alkohol
- äldre ålder
- dålig hälsa
- avancerad leversjukdom
- blödningsproblem
NSAID bör endast användas:
- precis som föreskrivet
- vid lägsta möjliga dos för din behandling
- för den kortaste tiden som behövs
Ta inte NSAID precis före eller efter en hjärtoperation som kallas "kransartär bypassgraft (CABG)."
Undvik att ta NSAID efter en nyligen inträffad hjärtinfarkt, såvida inte din läkare säger åt dig att göra det. Du kan ha en ökad risk för en ny hjärtinfarkt om du tar NSAID-preparat efter en nyligen genomförd hjärtinfarkt
Vad är NSAID?
NSAID används för att behandla smärta och rodnad, svullnad och värme (inflammation) från medicinska tillstånd som olika typer av artrit, mensvärk och andra typer av kortvarig smärta.
Vem bör inte ta NSAID?
Ta inte NSAID:
- om du har haft en astmaanfall, nässelfeber eller annan allergisk reaktion med acetylsalicylsyra eller andra NSAID-preparat.
- precis före eller efter bypassoperation.
Innan du tar NSAID, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har lever- eller njurproblem
- har högt blodtryck
- har astma
- är gravid eller planerar att bli gravid. Tala med din vårdgivare om du funderar på att ta NSAID under graviditeten. Du ska inte ta NSAID efter 29 veckors graviditet
- ammar eller planerar att amma.
Berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda eller receptfria läkemedel, vitaminer eller växtbaserade kosttillskott. NSAID och vissa andra läkemedel kan interagera med varandra och orsaka allvarliga biverkningar. Börja inte ta något nytt läkemedel utan att först prata med din läkare.
Vilka är de möjliga biverkningarna av NSAID?
NSAID kan orsaka allvarliga biverkningar, inklusive:
Se "Vilken är den viktigaste informationen jag bör veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?
- nytt eller värre högt blodtryck
- hjärtsvikt
- leverproblem inklusive leversvikt
- njurproblem inklusive njursvikt
- låga röda blodkroppar (anemi)
- livshotande hudreaktioner
- livshotande allergiska reaktioner
- Andra biverkningar av NSAID inkluderar: magsmärtor, förstoppning, diarré, gaser, halsbränna, illamående, kräkningar och yrsel.
Få akut hjälp omedelbart om du får något av följande symtom:
- andnöd eller andningssvårigheter
- bröstsmärta
- svaghet i en del eller sida av din kropp
- sluddrigt tal
- svullnad i ansikte eller hals
Sluta ta ditt NSAID och ring din vårdgivare omedelbart om du får något av följande symtom:
- illamående
- tröttare eller svagare än vanligt
- diarre
- klåda
- din hud eller ögon ser gula ut
- matsmältningsbesvär eller magsmärtor
- influensaliknande symtom
- spy blod
- det finns blod i din tarmrörelse eller så är det svart och klibbigt som tjära
- ovanlig viktökning
- hudutslag eller blåsor med feber
- svullnad av armar, ben, händer och fötter
Om du tar för mycket av ditt NSAID, ring din vårdgivare eller få medicinsk hjälp omedelbart.
Dessa är inte alla möjliga biverkningar av NSAID. För mer information, fråga din vårdgivare eller apotekspersonal om NSAID.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Annan information om NSAID
- Aspirin är ett NSAID men det ökar inte risken för hjärtinfarkt. Aspirin kan orsaka blödningar i hjärnan, magen och tarmarna. Aspirin kan också orsaka sår i magen och tarmarna.
- Vissa NSAID-preparat säljs i lägre doser utan recept (receptfria). Prata med din vårdgivare innan du använder receptfria NSAIDs i mer än 10 dagar.
Allmän information om säker och effektiv användning av NSAID
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte NSAID för ett tillstånd som det inte ordinerats för. Ge inte NSAID till andra människor, även om de har samma symtom som du har. Det kan skada dem.
Om du vill ha mer information om NSAID, prata med din vårdgivare. Du kan fråga din apotekspersonal eller vårdgivare om information om NSAID som är skriven för vårdpersonal.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
