Naprosyn 250mg, 500mg Naproxen Användning, biverkningar och dosering. Pris i onlineapotek. Generiska läkemedel utan recept.
Vad är Naprosyn 500mg och hur används det?
Naprosyn 250mg är ett receptbelagt läkemedel som används för att behandla symtom på smärta eller inflammation orsakad av artrit, ankyloserande spondylit, tendinit, bursit, gikt eller menstruationsvärk. Naprosyn kan användas ensamt eller tillsammans med andra läkemedel.
Naprosyn 250mg är en icke-steroid antiinflammatorisk medicin (NSAID).
Det är inte känt om Naprosyn är säkert och effektivt hos barn yngre än 2 år.
Vilka är de möjliga biverkningarna av Naprosyn?
Naprosyn kan orsaka allvarliga biverkningar inklusive:
- andnöd,
- svullnad eller snabb viktökning,
- hudutslag eller blåsor,
- blodig eller tjäraktig avföring,
- hosta upp blod eller kräks som ser ut som kaffesump,
- illamående,
- ont i övre magen,
- aptitlöshet,
- mörk urin,
- lerfärgad avföring,
- gulfärgning av huden eller ögonen (gulsot),
- lite eller ingen urinering,
- smärtsam urinering,
- svullnad i dina fötter eller vrister,
- anemi (få röda blodkroppar),
- blek hud,
- trötthet,
- känner sig yr, och
- kalla händer eller fötter
Få medicinsk hjälp omedelbart om du har något av symtomen som anges ovan.
De vanligaste biverkningarna av Naprosyn inkluderar:
- huvudvärk,
- dålig matsmältning,
- halsbränna och
- influensasymptom
Tala om för läkaren om du har någon biverkning som stör dig eller som inte försvinner.
Dessa är inte alla möjliga biverkningar av Naprosyn. För mer information, fråga din läkare eller apotekspersonal.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
VARNING
RISK FÖR ALLVARLIGA HJÄRT- OCH Gastrointestinala HÄNDELSER
Kardiovaskulära trombotiska händelser
- Icke-steroida antiinflammatoriska läkemedel (NSAID) orsakar en ökad risk för allvarliga kardiovaskulära trombotiska händelser, inklusive hjärtinfarkt och stroke, som kan vara dödlig. Denna risk kan uppstå tidigt i behandlingen och kan öka med användningstiden [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
- NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS är kontraindicerade vid kranskärlsbypassoperationer (CABG) [se KONTRAINDIKATIONER, VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
Gastrointestinal blödning, sårbildning och perforering
- NSAID orsakar en ökad risk för allvarliga gastrointestinala (GI) biverkningar inklusive blödning, sårbildning och perforering av magen eller tarmarna, vilket kan vara dödligt. Dessa händelser kan inträffa när som helst under användning och utan varningssymptom. Äldre patienter och patienter med en anamnes på magsår och/eller GI-blödning löper större risk för allvarliga GI-händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER].
BESKRIVNING
NAPROSYN (naproxen) tabletter, EC-NAPROSYN (naproxen) tabletter med fördröjd frisättning och ANAPROX DS (naproxen natrium) tabletter är icke-steroida antiinflammatoriska läkemedel tillgängliga enligt följande: NAPROSYN 250 mg tabletter finns tillgängliga som gula tabletter innehållande 500 mg naproxen för oral administrering .
EC-NAPROSYN tabletter med fördröjd frisättning finns som enterodragerade vita tabletter innehållande 375 mg naproxen eller 500 mg naproxen för oral administrering.
ANAPROX DS tabletter finns tillgängliga som mörkblå tabletter innehållande 550 mg naproxennatrium för oral administrering.
Naproxen är ett propionsyraderivat relaterat till aryättiksyragruppen av icke-steroida antiinflammatoriska läkemedel. De kemiska namnen på naproxen och naproxennatrium är (S)-6-metoxi-a-metyl-2-naftalenättiksyra respektive (S)-6metoxi-a-metyl-2-naftalenättiksyra, natriumsalt. Naproxen har en molekylvikt på 230,26 och en molekylformel på C14H14O3. Naproxennatrium har en molekylvikt på 252,23 och en molekylformel av C14H13NaO3. Naproxen och naproxennatrium har följande strukturer:
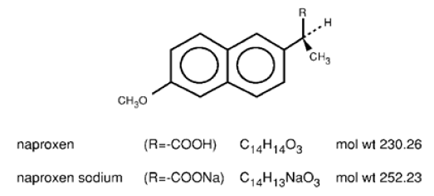
Naproxen är ett luktfritt, vitt till benvitt kristallint ämne. Det är lipidlösligt, praktiskt taget olösligt i vatten vid lågt pH och fritt lösligt i vatten vid högt pH. Oktanol/vattenfördelningskoefficienten för naproxen vid pH 7,4 är 1,6 till 1,8. Naproxennatrium är ett vitt till krämvitt, kristallint fast ämne, fritt lösligt i vatten vid neutralt pH.
De inaktiva ingredienserna i NAPROSYN 250 mg tabletter inkluderar: kroskarmellosnatrium, järnoxider, povidon och magnesiumstearat.
De inaktiva ingredienserna i EC-NAPROSYN tabletter med fördröjd frisättning inkluderar: kroskarmellosnatrium, povidon och magnesiumstearat. Den enteriska beläggningsdispersionen innehåller metakrylsyrasampolymer, talk, trietylcitrat, natriumhydroxid och renat vatten. Trycket på tabletterna är svart bläck. Upplösningen av denna enterodragerade naproxentablett är pH-beroende med snabb upplösning över pH 6. Det finns ingen upplösning under pH 4.
De inaktiva ingredienserna i ANAPROX DS tabletter inkluderar: magnesiumstearat, mikrokristallin cellulosa, povidon och talk. Beläggningssuspensionen kan innehålla hydroxipropylmetylcellulosa 2910, Opaspray K-1-4227, polyetylenglykol 8000 eller Opadry YS-1-4216.
INDIKATIONER
NAPROSYN 500mg tabletter, EC-NAPROSYN 250mg och ANAPROX DS är indikerade för:
lindring av tecken och symtom på:
- Reumatoid artrit
- artros
- ankyloserande spondylit
- Polyartikulär juvenil idiopatisk artrit
NAPROSYN tabletter och ANAPROX DS är också indicerade för:
lindring av tecken och symtom på:
- tendinit
- bursit
- akut gikt
ledningen av:
- smärta
- primär dysmenorré
DOSERING OCH ADMINISTRERING
Allmänna doseringsanvisningar
Överväg noga de potentiella fördelarna och riskerna med NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS och andra behandlingsalternativ innan du bestämmer dig för att använda NAPROSYN 250mg tabletter, EC-NAPROSYN 500mg och ANAPROX DS. Använd den lägsta effektiva dosen för den kortaste varaktigheten som överensstämmer med individuella patientbehandlingsmål [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Efter att ha observerat svaret på initial behandling med NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS, bör dosen och frekvensen justeras för att passa en individuell patients behov.
För att bibehålla integriteten hos den enteriska beläggningen ska EC-NAPROSYN tabletten inte brytas, krossas eller tuggas under intag.
Naproxeninnehållande produkter såsom NAPROSYN 500mg, EC-NAPROSYN 250mg och ANAPROX DS och andra naproxenprodukter ska inte användas samtidigt eftersom de alla cirkulerar i plasman som naproxenanjonen.
Reumatoid artrit, artros och ankyloserande spondylit
De rekommenderade doserna av NAPROSYN 500 mg tabletter, ANAPROX DS och EC-NAPROSYN 250 mg visas i Tabell 1.
Under långtidsadministrering kan dosen av naproxen justeras upp eller ned beroende på patientens kliniska svar. En lägre daglig dos kan räcka för långtidsadministrering.
Morgon- och kvällsdoserna behöver inte vara lika stora och administrering av läkemedlet oftare än två gånger dagligen gör i allmänhet ingen skillnad i svaret.
Hos patienter som tolererar lägre doser väl kan dosen ökas till naproxen 1500 mg/dag under begränsade perioder på upp till 6 månader när en högre nivå av antiinflammatorisk/analgetisk aktivitet krävs. Vid behandling av sådana patienter med naproxen 1500 mg/dag bör läkaren observera tillräckligt med ökade kliniska fördelar för att uppväga den potentiella ökade risken.
Polyartikulär juvenil idiopatisk artrit
Naproxen fast-orala doseringsformer kanske inte tillåter den flexibla dostitrering som behövs hos pediatriska patienter med polyartikulär juvenil idiopatisk artrit. En flytande formulering kan vara mer lämplig för viktbaserad dosering och på grund av behovet av dosflexibilitet hos barn.
Hos pediatriska patienter gav doser på 5 mg/kg/dag plasmanivåer av naproxen liknande de som ses hos vuxna som tar 500 mg naproxen [se KLINISK FARMAKOLOGI ]. Den rekommenderade totala dagliga dosen av naproxen är cirka 10 mg/kg givet i 2 uppdelade doser. Dosering med NAPROSYN tabletter är inte lämplig för barn som väger mindre än 50 kg.
Hantering av smärta, primär dysmenorré och akut tendonit och bursit
Den rekommenderade startdosen av ANAPROX DS (naproxennatrium) tabletter är 550 mg följt av 550 mg var 12:e timme eller 275 mg (halva av en 550 mg tablett) var 6:e till 8:e timme efter behov. Den initiala totala dagliga dosen bör inte överstiga 1375 mg (två och en halv tablett) naproxennatrium. Därefter bör den totala dagliga dosen inte överstiga 1100 mg naproxennatrium. Eftersom natriumsaltet av naproxen absorberas snabbare, rekommenderas ANAPROX DS för hantering av akuta smärtsamma tillstånd när en snabb smärtlindring önskas. NAPROSYN tabletter kan också användas. Den rekommenderade startdosen av NAPROSYN tabletter är 500 mg följt av 250 mg (halva av en 500 mg NAPROSYN tablett) var 6-8:e timme efter behov. Den totala dagliga dosen bör inte överstiga 1250 mg naproxen.
EC-NAPROSYN 250mg rekommenderas inte för initial behandling av akut smärta eftersom absorptionen av naproxen är försenad jämfört med andra naproxeninnehållande produkter [se KLINISK FARMAKOLOGI ].
Akut gikt
Den rekommenderade startdosen är 750 mg (en och en halv tablett) NAPROSYN 250 mg tabletter följt av 250 mg (en halv tablett) var 8:e timme tills attacken har lagt sig. ANAPROX DS kan också användas i en startdos på 825 mg (en och en halv tablett) följt av 275 mg (en halv tablett) var 8:e timme. EC-NAPROSYN rekommenderas inte på grund av fördröjd absorption.
Ej utbytbarhet med andra formuleringar av naproxen
Olika dosstyrkor och formuleringar (t.ex. tabletter, suspension) av naproxen är inte utbytbara. Denna skillnad bör beaktas vid förändring av styrkor eller formuleringar.
HUR LEVERERAS
Doseringsformer och styrkor
NAPROSYN® (naproxen) tabletter: 500 mg: gula, kapselformade, graverade med NPR LE 500 på ena sidan och skårade på den andra.
EC-NAPROSYN® (naproxen) tabletter med fördröjd frisättning: 375 mg: vita, ovala bikonvexa tabletter präglade med NPR EC 375 på ena sidan.
EC-NAPROSYN® (naproxen) tabletter med fördröjd frisättning: 500 mg: vita, avlånga dragerade tabletter präglade med NPR EC 500 på ena sidan.
ANAPROX® DS (naproxennatrium) tabletter: 550 mg: mörkblå, avlång, graverad med NPS 550 på ena sidan och skåra på båda sidor.
Förvaring Och Hantering
NAPROSYN (naproxen) tabletter 500 mg : gula, kapselformade tabletter, graverade med NPR LE 500 på ena sidan och skåra på den andra. Förpackad i ljusbeständiga flaskor om 100 st. Levereras som:
NDC 69437-316-01 100's (flaska)
Förvaras vid 15°C till 30°C (59°F till 86°F) i väl tillslutna behållare; dispensera i ljuståliga behållare.
EC-NAPROSYN (naproxen) tabletter med fördröjd frisättning 375 mg : vita, ovala bikonvexa tabletter präglade med NPR EC 375 på ena sidan. Förpackad i ljusbeständiga flaskor om 100 st. Levereras som:
NDC 69437-415-01 100's (flaska)
500 mg vita, avlånga dragerade tabletter präglade med NPR EC 500 på ena sidan. Förpackad i ljusbeständiga flaskor om 100 st. Levereras som:
NDC 69437-416-01 100's (flaska)
Förvaras vid 15°C till 30°C (59°F till 86°F) i väl tillslutna behållare; dispensera i ljuståliga behållare.
ANAPROX DS (naproxennatrium) Tabletter 550 mg : mörkblå, avlånga tabletter, graverade med NPS 550 på ena sidan och skårade på båda sidor. Förpackad i flaskor om 100. Levereras som:
NDC 69437-203-01 100's (flaska)
Förvaras vid 15° till 30°C (59° till 86°F) i väl tillslutna behållare.
Tillverkad för: Atnahs Pharma, Miles Gray Road, Basildon, Essex, SS14 3FR, Storbritannien. Distribueras av: Canton Laboratories, LLC., Alpharetta, GA 30004-5945, USA. Reviderad: april 2021
BIEFFEKTER
Följande biverkningar diskuteras mer i detalj i andra avsnitt av märkningen:
- Kardiovaskulära trombotiska händelser [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- GI-blödning, sårbildning och perforering [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hepatotoxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hypertoni [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hjärtsvikt och ödem [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Njurtoxicitet och hyperkalemi [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anafylaktiska reaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Allvarliga hudreaktioner [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Hematologisk toxicitet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
Erfarenhet av kliniska prövningar
Eftersom kliniska prövningar genomförs under vitt skilda förhållanden, kan biverkningsfrekvenser som observerats i de kliniska prövningarna av ett läkemedel inte direkt jämföras med frekvenser i kliniska prövningar av ett annat läkemedel och återspeglar kanske inte de frekvenser som observerats i praktiken.
Biverkningar som rapporterats i kontrollerade kliniska prövningar på 960 patienter som behandlats för reumatoid artrit eller artros är listade nedan. I allmänhet rapporterades reaktioner hos patienter som behandlades kroniskt 2 till 10 gånger oftare än de var i korttidsstudier hos de 962 patienter som behandlades för mild till måttlig smärta eller för dysmenorré. De vanligaste besvären som rapporterats gällde mag-tarmkanalen.
En klinisk studie fann att gastrointestinala reaktioner var vanligare och mer allvarliga hos patienter med reumatoid artrit som tar dagliga doser på 1500 mg naproxen jämfört med de som tar 750 mg naproxen.
kontrollerade kliniska prövningar med cirka 80 pediatriska patienter och i välövervakade öppna studier med cirka 400 pediatriska patienter med polyartikulär juvenil idiopatisk artrit som behandlats med naproxen, var förekomsten av utslag och förlängda blödningstider högre, incidensen av gastrointestinala och centrala nervsystemets reaktioner var ungefär desamma och förekomsten av andra reaktioner var lägre hos pediatriska patienter än hos vuxna.
Hos patienter som tog naproxen i kliniska prövningar var de vanligast rapporterade biverkningarna hos cirka 1 % till 10 % av patienterna:
Gastrointestinala (GI) upplevelser, inklusive: halsbränna*, buksmärtor*, illamående*, förstoppning*, diarré, dyspepsi, stomatit
Centrala nervsystemet: huvudvärk*, yrsel*, dåsighet*, yrsel, yrsel
Dermatologiska: klåda (klåda)*, hudutslag*, ekkymos*, svettning, purpura
Särskilda sinnen: tinnitus*, synstörningar, hörselstörningar
Kardiovaskulär: ödem*, hjärtklappning
Allmän: dyspné*, törst
*Förekomst av rapporterad reaktion mellan 3 % och 9 %. De reaktioner som förekommer hos mindre än 3 % av patienterna är omärkta.
Hos patienter som tar NSAID har följande biverkningar också rapporterats hos cirka 1 % till 10 % av patienterna.
Gastrointestinala (GI) upplevelser, inklusive: flatulens, grov blödning/perforering, magsår (mag/duodenal), kräkningar
Allmän: onormal njurfunktion, anemi, förhöjda leverenzymer, ökad blödningstid, utslag
Följande är ytterligare biverkningar som rapporterats hos
Gastrointestinala: pankreatit, kräkningar
Lever och gallvägar: gulsot
Hemisk och lymfatisk: melena, trombocytopeni, agranulocytos
Nervsystem: oförmåga att koncentrera sig
Dermatologiska: hudutslag
Erfarenhet efter marknadsföring
Följande biverkningar har identifierats under användning av naproxen efter godkännande. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller fastställa ett orsakssamband till läkemedelsexponering.
Följande är ytterligare biverkningar som rapporterats hos
Kroppen som helhet: anafylaktoida reaktioner, angioneurotiskt ödem, menstruationsstörningar, pyrexi (frossa och feber)
Kardiovaskulär: kongestiv hjärtsvikt, vaskulit, högt blodtryck, lungödem
Gastrointestinala: inflammation, blödning (ibland dödlig, särskilt hos äldre), sårbildning, perforering och obstruktion av den övre eller nedre mag-tarmkanalen. Esofagit, stomatit, hematemes, kolit, förvärring av inflammatorisk tarmsjukdom (ulcerös kolit, Crohns sjukdom).
Lever och gallvägar: onormala leverfunktionstester, hepatit (vissa fall har varit dödliga)
Hemisk och lymfatisk: eosinofili, leukopeni, granulocytopeni, hemolytisk anemi, aplastisk anemi
Metaboliskt och näringsmässigt: hyperglykemi, hypoglykemi
Nervsystem: depression, drömavvikelser, sömnlöshet, sjukdomskänsla, myalgi, muskelsvaghet, aseptisk meningit, kognitiv dysfunktion, kramper
Andningsvägar: eosinofil pneumonit, astma
Dermatologiska: alopeci, urtikaria, toxisk epidermal nekrolys, erythema multiforme, erythema nodosum, fixerad läkemedelsutbrott, lichen planus, pustulös reaktion, systemisk lupus erythematoser, bullösa reaktioner, inklusive Stevens-Johnsons syndrom, ljuskänslig dermatit, fotosensitivitetsreaktioner, sällsynta hudreaktioner, inklusive tarbling, inklusive (pseudoporfyri) eller epidermolysis bullosa. Om hudbräcklighet, blåsor eller andra symtom som tyder på pseudoporfyri uppträder, ska behandlingen avbrytas och patienten övervakas.
Särskilda sinnen: hörselnedsättning, korneal opacitet, papillit, retrobulbar optikusneurit, papillödem
Urogenital: glomerulär nefrit, hematuri, hyperkalemi, interstitiell nefrit, nefrotiskt syndrom, njursjukdom, njursvikt, njurpapillär nekros, förhöjt serumkreatinin
Reproduktion (hona): infertilitet
Hos patienter som tar NSAID har följande biverkningar också rapporterats hos
Kroppen som helhet: feber, infektion, sepsis, anafylaktiska reaktioner, aptitförändringar, död
Kardiovaskulär: hypertoni, takykardi, synkope, arytmi, hypotoni, hjärtinfarkt
Gastrointestinala: muntorrhet, esofagit, magsår/magsår, gastrit, glossit, utslag
Lever och gallvägar: hepatit, leversvikt
Hemisk och lymfatisk: rektal blödning, lymfadenopati, pancytopeni
Metaboliskt och näringsmässigt: viktförändringar
Nervsystem: ångest, asteni, förvirring, nervositet, parestesi, somnolens, skakningar, kramper, koma, hallucinationer
Andningsvägar: astma, andningsdepression, lunginflammation
Dermatologiska: exfoliativ dermatit
Särskilda sinnen: suddig syn, konjunktivit
Urogenital: cystit, dysuri, oliguri/polyuri, proteinuri
LÄKEMEDELSINTERAKTIONER
Se tabell 1 för kliniskt signifikanta läkemedelsinteraktioner med naproxen.
Interaktioner med läkemedel/laboratorietest
VARNINGAR
Ingår som en del av FÖRSIKTIGHETSÅTGÄRDER sektion.
FÖRSIKTIGHETSÅTGÄRDER
Kardiovaskulära trombotiska händelser
Kliniska prövningar av flera COX-2 selektiva och icke-selektiva NSAID med upp till tre års varaktighet har visat en ökad risk för allvarliga kardiovaskulära (CV) trombotiska händelser, inklusive hjärtinfarkt (MI) och stroke, som kan vara dödlig. Baserat på tillgängliga data är det oklart att risken för CV-trombotiska händelser är liknande för alla NSAID. Den relativa ökningen av allvarliga CV-trombotiska händelser jämfört med baslinjen till följd av NSAID-användning tycks vara liknande hos de med och utan känd CV-sjukdom eller riskfaktorer för CV-sjukdom. Patienter med känd CV-sjukdom eller riskfaktorer hade dock en högre absolut incidens av alltför allvarliga CV-trombotiska händelser, på grund av deras ökade baslinjefrekvens. Vissa observationsstudier fann att denna ökade risk för allvarliga CV-trombotiska händelser började redan under de första veckorna av behandlingen. Ökningen av CV-trombotisk risk har observerats mest konsekvent vid högre doser.
För att minimera den potentiella risken för en negativ CV-händelse hos NSAID-behandlade patienter, använd den lägsta effektiva dosen under kortast möjliga varaktighet. Läkare och patienter bör vara uppmärksamma på utvecklingen av sådana händelser, under hela behandlingsförloppet, även i frånvaro av tidigare CV-symtom. Patienter bör informeras om symtomen på allvarliga CV-händelser och de åtgärder som ska vidtas om de inträffar.
Det finns inga konsekventa bevis för att samtidig användning av aspirin minskar den ökade risken för allvarliga CV-trombotiska händelser i samband med NSAID-användning. Samtidig användning av aspirin och ett NSAID, såsom naproxen, ökar risken för allvarliga gastrointestinala (GI) händelser.
Status efter kranskärlsbypassoperation (CABG).
Två stora, kontrollerade kliniska prövningar av ett COX-2-selektivt NSAID för behandling av smärta under de första 10–14 dagarna efter CABG-operation fann en ökad incidens av hjärtinfarkt och stroke. NSAID är kontraindicerade vid CABG [se KONTRAINDIKATIONER ].
Patienter efter MI
Observationsstudier utförda i det danska nationella registret har visat att patienter som behandlats med NSAID under perioden efter MI löpte ökad risk för reinfarkt, CV-relaterad död och dödlighet av alla orsaker med början under den första behandlingsveckan. I samma kohort var incidensen av dödsfall under det första året efter MI 20 per 100 personår hos NSAID-behandlade patienter jämfört med 12 per 100 personår hos icke-NSAID-exponerade patienter. Även om den absoluta dödsfrekvensen minskade något efter det första året efter MI, kvarstod den ökade relativa risken för död hos NSAID-användare under åtminstone de kommande fyra åren av uppföljning.
Undvik användningen av NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS hos patienter med nyligen hjärtinfarkt såvida inte fördelarna förväntas uppväga risken för återkommande CV-trombotiska händelser. Om NAPROSYN 250 mg tabletter, EC-NAPROSYN och ANAPROX DS används hos patienter med nyligen infekterad hjärtinfarkt, övervaka patienterna med avseende på tecken på hjärtischemi.
Gastrointestinal blödning, sårbildning och perforering
NSAID, inklusive naproxen, orsakar allvarliga gastrointestinala (GI) biverkningar inklusive inflammation, blödning, sårbildning och perforering av matstrupen, magen, tunntarmen eller tjocktarmen, vilket kan vara dödligt. Dessa allvarliga biverkningar kan inträffa när som helst, med eller utan varningssymtom, hos patienter som behandlas med NSAID.
Endast en av fem patienter som utvecklar en allvarlig övre GI-biverkning på NSAID-behandling är symtomatisk. Övre gastrointestinala sår, grov blödning eller perforation orsakad av NSAID förekom hos cirka 1 % av patienterna som behandlades under 3-6 månader och hos cirka 2 %–4 % av patienterna som behandlades under ett år. Men även kortvarig NSAID-behandling är inte utan risk.
Riskfaktorer för GI-blödning, sårbildning och perforering
Patienter med magsår i anamnesen och/eller gastrointestinala blödningar som använde NSAID hade en mer än 10 gånger ökad risk för att utveckla en gastrointestinala blödning jämfört med patienter utan dessa riskfaktorer. Andra faktorer som ökar risken för GI-blödning hos patienter som behandlas med NSAID inkluderar längre varaktighet av NSAID-behandling; samtidig användning av orala kortikosteroider, aspirin, antikoagulantia eller selektiva serotoninåterupptagshämmare (SSRI); rökning; användning av alkohol; äldre ålder; och dåligt allmänt hälsotillstånd. De flesta rapporter om dödliga gastrointestinala händelser efter marknadsföring inträffade hos äldre eller försvagade patienter. Dessutom löper patienter med avancerad leversjukdom och/eller koagulopati en ökad risk för GI-blödning.
Strategier för att minimera GI-riskerna hos NSAID-behandlade patienter
- Använd den lägsta effektiva dosen under kortast möjliga varaktighet.
- Undvik administrering av mer än ett NSAID åt gången.
- Undvik användning till patienter med högre risk om inte fördelarna förväntas uppväga den ökade risken för blödning. För sådana patienter, såväl som de med aktiv GI-blödning, överväg alternativa terapier än NSAID.
- Var uppmärksam på tecken och symtom på magsår och blödning under NSAID-behandling.
- Om en allvarlig GI-biverkning misstänks, initiera omedelbart utvärdering och behandling och avbryt behandlingen med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS tills en allvarlig GI-biverkning är utesluten.
- Vid samtidig användning av lågdos acetylsalicylsyra för hjärtprofylax, övervaka patienterna noggrannare för tecken på GI-blödning [se LÄKEMEDELSINTERAKTIONER ].
Hepatotoxicitet
Förhöjningar av ALAT eller ASAT (tre eller fler gånger den övre normalgränsen [ULN]) har rapporterats hos cirka 1 % av NSAID-behandlade patienter i kliniska prövningar. Dessutom har sällsynta, ibland dödliga, fall av allvarlig leverskada, inklusive fulminant hepatit, levernekros och leversvikt rapporterats.
Förhöjningar av ALAT eller ASAT (mindre än tre gånger ULN) kan förekomma hos upp till 15 % av patienterna som behandlas med NSAID inklusive naproxen.
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, diarré, klåda, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om kliniska tecken och symtom som överensstämmer med leversjukdom utvecklas, eller om systemiska manifestationer uppstår (t.ex. eosinofili, hudutslag, etc.), avbryt behandlingen med NAPROSYN 500 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS omedelbart och utför en klinisk utvärdering av patienten .
Hypertoni
NSAID, inklusive NAPROSYN 250 mg tabletter, EC-NAPROSYN och ANAPROX DS, kan leda till nystart av hypertoni eller förvärring av redan existerande hypertoni, vilka båda kan bidra till den ökade incidensen av CV-händelser. Patienter som tar angiotensinomvandlande enzym (ACE)-hämmare, tiaziddiuretika eller loopdiuretika kan ha försämrat svar på dessa behandlingar när de tar NSAID [se LÄKEMEDELSINTERAKTIONER ].
Övervaka blodtrycket (BP) under inledning av NSAID-behandling och under hela behandlingen.
Hjärtsvikt och ödem
Coxib och traditionella NSAID Trialists' Collaboration-metaanalys av randomiserade kontrollerade studier visade en ungefär tvåfaldig ökning av sjukhusvistelser för hjärtsvikt hos COX-2 selektivt behandlade patienter och icke-selektiva NSAID-behandlade patienter jämfört med placebobehandlade patienter. I en dansk National Register-studie av patienter med hjärtsvikt ökade NSAID-användning risken för hjärtinfarkt, sjukhusvistelse för hjärtsvikt och död.
Dessutom har vätskeretention och ödem observerats hos vissa patienter som behandlats med NSAID. Användning av naproxen kan dämpa CV-effekterna av flera terapeutiska medel som används för att behandla dessa medicinska tillstånd (t.ex. diuretika, ACE-hämmare eller angiotensinreceptorblockerare [ARB]) [se LÄKEMEDELSINTERAKTIONER ].
Undvik användningen av NAPROSYN 250 mg tabletter, EC-NAPROSYN eller ANAPROX DS hos patienter med allvarlig hjärtsvikt om inte fördelarna förväntas uppväga risken för förvärrad hjärtsvikt. Om NAPROSYN 250 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS används till patienter med allvarlig hjärtsvikt, övervaka patienterna för tecken på förvärrad hjärtsvikt.
Eftersom varje ANAPROX DS tablett innehåller 50 mg natrium (ca 2 mEq per varje 500 mg naproxen), bör detta övervägas hos patienter vars totala intag av natrium måste begränsas kraftigt.
Njurtoxicitet och hyperkalemi
Njurtoxicitet
Långvarig administrering av NSAID har resulterat i njurpapillär nekros och annan njurskada.
Njurtoxicitet har också setts hos patienter hos vilka njurprostaglandiner har en kompensatorisk roll i upprätthållandet av njurperfusion. Hos dessa patienter kan administrering av ett NSAID orsaka en dosberoende minskning av prostaglandinbildningen och, i andra hand, i njurblodflödet, vilket kan utlösa tydlig njurdekompensation. Patienter med störst risk för denna reaktion är de med nedsatt njurfunktion, uttorkning, hypovolemi, hjärtsvikt, leverdysfunktion, de som tar diuretika och ACE-hämmare eller ARB och äldre. Avbrytande av NSAID-behandling följs vanligtvis av återhämtning till förbehandlingstillstånd.
Ingen information finns tillgänglig från kontrollerade kliniska studier angående användning av NAPROSYN 500 mg tabletter, EC-NAPROSYN eller ANAPROX DS hos patienter med avancerad njursjukdom. Njureffekterna av NAPROSYN 500 mg tabletter, EC-NAPROSYN eller ANAPROX DS kan påskynda utvecklingen av nedsatt njurfunktion hos patienter med redan existerande njursjukdom.
Korrekt volymstatus hos dehydrerade eller hypovolemiska patienter innan NAPROSYN tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS påbörjas. Övervaka njurfunktionen hos patienter med nedsatt njur- eller leverfunktion, hjärtsvikt, uttorkning eller hypovolemi under användning av NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS [se LÄKEMEDELSINTERAKTIONER ]. Undvik användning av NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg och ANAPROX DS hos patienter med avancerad njursjukdom såvida inte fördelarna förväntas uppväga risken för försämrad njurfunktion. Om NAPROSYN 500 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS används till patienter med avancerad njursjukdom, övervaka patienterna för tecken på försämrad njurfunktion.
Hyperkalemi
Ökning av serumkaliumkoncentrationen, inklusive hyperkalemi, har rapporterats vid användning av NSAID, även hos vissa patienter utan nedsatt njurfunktion. Hos patienter med normal njurfunktion har dessa effekter tillskrivits ett tillstånd av hyporeninemihypoaldosteronism.
Anafylaktiska reaktioner
Naproxen har associerats med anafylaktiska reaktioner hos patienter med och utan känd överkänslighet mot naproxen och hos patienter med aspirinkänslig astma [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Sök akut hjälp om en anafylaktisk reaktion inträffar.
Förvärring av astma relaterad till aspirinkänslighet
En subpopulation av patienter med astma kan ha aspirinkänslig astma som kan innefatta kronisk rhinosinusit komplicerad av näspolyper; allvarlig, potentiellt dödlig bronkospasm; och/eller intolerans mot aspirin och andra NSAID.
Eftersom korsreaktivitet mellan acetylsalicylsyra och andra NSAID har rapporterats hos sådana aspirinkänsliga patienter, är NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg och ANAPROX DS kontraindicerade hos patienter med denna form av aspirinkänslighet [se KONTRAINDIKATIONER ]. När NAPROSYN 250 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS används till patienter med redan existerande astma (utan känd acetylsalicylsyrakänslighet), övervaka patienterna med avseende på förändringar i tecknen och symtomen på astma.
Allvarliga hudreaktioner
NSAID, inklusive naproxen, kan orsaka allvarliga hudbiverkningar som exfoliativ dermatit, Stevens-Johnsons syndrom (SJS) och toxisk epidermal nekrolys (TEN), som kan vara dödlig. Dessa allvarliga händelser kan inträffa utan förvarning. Informera patienter om tecken och symtom på allvarliga hudreaktioner och att avbryta användningen av NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS vid första uppkomsten av hudutslag eller andra tecken på överkänslighet. NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS är kontraindicerade hos patienter med tidigare allvarliga hudreaktioner på NSAID [se KONTRAINDIKATIONER ].
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS)
Läkemedelsreaktion med eosinofili och systemiska symtom (DRESS) har rapporterats hos patienter som tar NSAID såsom NAPROSYN tabletter, EC-NAPROSYN 500 mg och ANAPROX DS. Några av dessa händelser har varit dödliga eller livshotande. DRESS ger vanligtvis, men inte uteslutande, feber, hudutslag, lymfadenopati och/eller svullnad i ansiktet. Andra kliniska manifestationer kan inkludera hepatit, nefrit, hematologiska abnormiteter, myokardit eller myosit. Ibland kan symtom på DRESS likna en akut virusinfektion. Eosinofili är ofta närvarande. Eftersom denna störning är variabel i sin presentation, kan andra organsystem som inte noteras här vara inblandade. Det är viktigt att notera att tidiga manifestationer av överkänslighet, såsom feber eller lymfadenopati, kan förekomma även om utslag inte är uppenbara. Om sådana tecken eller symtom finns, avbryt behandlingen med NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS och utvärdera patienten omedelbart.
Fostertoxicitet
För tidig stängning av Fetal Ductus Arteriosus
Undvik användning av NSAID, inklusive NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS, hos gravida kvinnor vid ungefär 30 veckors graviditet och senare. NSAID, inklusive NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS, ökar risken för för tidig stängning av fetal ductus arteriosus vid ungefär denna graviditetsålder.
Oligohydramnios/neonatal njurfunktionsnedsättning
Användning av NSAID, inklusive NAPROSYN tabletter, EC-NAPROSYN 250mg och ANAPROX DS, vid cirka 20 graviditetsveckor eller senare under graviditeten kan orsaka fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. Dessa negativa utfall ses i genomsnitt efter dagar till veckors behandling, även om oligohydramnios sällan har rapporterats så snart som 48 timmar efter NSAID-start. Oligohydramnios är ofta, men inte alltid, reversibel när behandlingen avbryts. Komplikationer av långvariga oligohydramnios kan till exempel inkludera lemkontrakturer och försenad lungmognad. I vissa fall av nedsatt neonatal njurfunktion efter marknadsföringen krävdes invasiva procedurer såsom utbytestransfusion eller dialys.
Om NSAID-behandling är nödvändig mellan cirka 20 veckor och 30 veckors graviditet, begränsa användningen av NAPROSYN 250 mg tabletter, EC-NAPROSYN 250 mg eller ANAPROX DS till lägsta effektiva dos och kortast möjliga varaktighet. Överväg ultraljudsövervakning av fostervatten om behandlingen med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS sträcker sig längre än 48 timmar. Avbryt behandlingen med NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS om oligohydramnios uppstår och följ upp enligt klinisk praxis [se Användning i specifika populationer ].
Hematologisk toxicitet
Anemi har förekommit hos NSAID-behandlade patienter. Detta kan bero på ockult eller grov blodförlust, vätskeretention eller en ofullständigt beskriven effekt på erytropoes. Om en patient som behandlas med NAPROSYN tabletter, EC-NAPROSYN 500mg eller ANAPROX DS har några tecken eller symtom på anemi, kontrollera hemoglobin eller hematokrit.
NSAID, inklusive NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS, kan öka risken för blödningar. Samorbida tillstånd som koagulationsrubbningar eller samtidig användning av warfarin och andra antikoagulantia, trombocythämmande medel (t.ex. aspirin), serotoninåterupptagshämmare (SSRI) och serotonin noradrenalin återupptagshämmare (SNRI) kan öka denna risk. Övervaka dessa patienter för tecken på blödning [se LÄKEMEDELSINTERAKTIONER ].
Maskering av inflammation och feber
Den farmakologiska aktiviteten hos NAPROSYN tabletter, EC-NAPROSYN 500 mg och ANAPROX DS för att minska inflammation och eventuellt feber, kan minska användbarheten av diagnostiska tecken för att upptäcka infektioner.
Långtidsanvändning och laboratorieövervakning
Eftersom allvarlig GI-blödning, levertoxicitet och njurskada kan uppstå utan varningssymtom eller tecken, överväg att övervaka patienter på långvarig NSAID-behandling med en CBC och en kemiprofil regelbundet [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Patienter med initiala hemoglobinvärden på 10 g eller mindre som ska få långtidsbehandling bör få hemoglobinvärden bestämda regelbundet.
På grund av negativa ögonfynd i djurstudier med läkemedel av denna klass, rekommenderas att oftalmiska studier utförs om någon förändring eller synstörning inträffar.
Information om patientrådgivning
Rekommendera patienten att läsa den FDA-godkända patientmärkningen (läkemedelsguiden) som medföljer varje utskrivet recept. Informera patienter, familjer eller deras vårdgivare om följande information innan behandling med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS påbörjas och med jämna mellanrum under pågående behandling.
Kardiovaskulära trombotiska händelser
Rekommendera patienter att vara uppmärksamma på symtom på kardiovaskulära trombotiska händelser, inklusive bröstsmärtor, andnöd, svaghet eller sluddrigt tal, och att omedelbart rapportera något av dessa symtom till sin vårdgivare [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Gastrointestinal blödning, sårbildning och perforering
Råda patienter att rapportera symtom på sår och blödningar, inklusive epigastrisk smärta, dyspepsi, melena och hematemes till sin vårdgivare. Vid samtidig användning av lågdos aspirin för hjärtprofylax, informera patienterna om den ökade risken för och tecknen och symtomen på gastrointestinala blödningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hepatotoxicitet
Informera patienterna om varningstecken och symtom på levertoxicitet (t.ex. illamående, trötthet, letargi, klåda, diarré, gulsot, ömhet i den övre högra kvadranten och "influensaliknande" symtom). Om dessa inträffar, instruera patienterna att sluta med NAPROSYN 500mg tabletter, EC-NAPROSYN 250mg eller ANAPROX DS och omedelbart söka medicinsk behandling [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hjärtsvikt och ödem
Rekommendera patienter att vara uppmärksamma på symtom på kronisk hjärtsvikt inklusive andnöd, oförklarlig viktökning eller ödem och att kontakta sin vårdgivare om sådana symtom uppstår [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Anafylaktiska reaktioner
Informera patienterna om tecknen på en anafylaktisk reaktion (t.ex. andningssvårigheter, svullnad i ansikte eller hals). Instruera patienter att söka omedelbar akut hjälp om dessa inträffar [se KONTRAINDIKATIONER och VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Allvarliga hudreaktioner, inklusive KLÄNNING
Rekommendera patienter att sluta ta NAPROSYN 250 mg tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS omedelbart om de utvecklar någon typ av utslag eller feber och att kontakta sin vårdgivare så snart som möjligt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Kvinnlig fertilitet
Informera kvinnor med reproduktionspotential som önskar graviditet att NSAID, inklusive NAPROSYN tabletter, ECNAPROSYN 250 mg och ANAPROX DS, kan vara associerade med en reversibel försening av ägglossningen (se Användning i specifika populationer .]
Fostertoxicitet
Informera gravida kvinnor att undvika användning av NAPROSYN 250 mg tabletter, EC-NAPROSYN eller ANAPROX DS och andra NSAID med början vid 30 veckors graviditet på grund av risken för för tidig stängning av fetal ductus arteriosus. Om behandling med NAPROSYN tabletter, EC-NAPROSYN 500mg eller ANAPROX DS behövs för en gravid kvinna mellan ca 20 och 30 veckors graviditet, informera henne om att hon kan behöva övervakas för oligohydramnios, om behandlingen fortsätter längre än 48 timmar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och Användning i specifika populationer ].
Undvik samtidig användning av NSAID
Informera patienterna om att samtidig användning av NAPROSYN tabletter, EC-NAPROSYN 500 mg och ANAPROX DS med andra NSAID eller salicylater (t.ex. diflunisal, salsalat) inte rekommenderas på grund av den ökade risken för gastrointestinal toxicitet och liten eller ingen ökning av effekt [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER och LÄKEMEDELSINTERAKTIONER ]. Varna patienter om att NSAID kan finnas i "receptfria" läkemedel för behandling av förkylningar, feber eller sömnlöshet.
Användning av NSAID och lågdos aspirin
Informera patienterna att inte använda lågdos acetylsalicylsyra samtidigt med NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS tills de pratat med sin vårdgivare [se LÄKEMEDELSINTERAKTIONER ].
Icke-klinisk toxikologi
Karcinogenes, Mutagenes, Nedsatt fertilitet
Carcinogenes
En 2-årig studie utfördes på råttor för att utvärdera naproxens cancerframkallande potential vid råttdoser på 8, 16 och 24 mg/kg/dag (0,05, 0,1 och 0,16 gånger den maximala rekommenderade dagliga dosen för människor [MRHD] på 1500 mg/dag baserat på en jämförelse av kroppsytan). Inga tecken på tumörframkallande egenskaper hittades.
Mutagenes
Naproxen testade positivt i systerkromatidbytesanalysen in vivo för men var inte mutagent i in vitro bakteriell omvänd mutationsanalysen (Ames-testet).
Nedsättning av fertilitet
Hanråttor behandlades med 2, 5, 10 och 20 mg/kg naproxen genom oral sondmatning under 60 dagar före parning och honråttor behandlades med samma doser under 14 dagar före parning och under de första 7 dagarna av graviditeten. Det noterades inga negativa effekter på fertiliteten (upp till 0,13 gånger MRDH baserat på kroppsyta).
Användning i specifika populationer
Graviditet
Risksammanfattning
Användning av NSAID, inklusive NAPROSYN 250 mg tabletter, EC-NAPROSYN och ANAPROX DS, kan orsaka för tidig stängning av fetal ductus arteriosus och fosterns njurdysfunktion vilket leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. På grund av dessa risker, begränsa dosen och varaktigheten av NAPROSYN tabletter, EC-NAPROSYN 500 mg eller ANAPROX DS användning mellan cirka 20 och 30 veckor av graviditeten, och undvik användning av NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS efter cirka 30 veckor graviditet och senare i graviditeten (se Kliniska överväganden , Data ).
För tidig stängning av Fetal Ductus Arteriosus
Användning av NSAID, inklusive NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS, vid ca 30 veckors graviditet eller senare under graviditeten ökar risken för för tidig stängning av fostergången arteriosus.
Oligohydramnios/neonatal njurfunktionsnedsättning
Användning av NSAID vid ungefär 20 veckors graviditet eller senare under graviditeten har associerats med fall av fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning.
Data från observationsstudier angående andra potentiella embryofetala risker med användning av NSAID hos kvinnor under graviditetens första eller andra trimester är inte övertygande. I reproduktionsstudier på djur på råttor, kaniner och möss inga tecken på teratogenicitet eller fosterskada när naproxen administrerades under organogenesperioden i doser 0,13, 0,26 respektive 0,6 gånger den maximala rekommenderade dagliga dosen för människor på 1500 mg/dag [ ser Data ]. Baserat på djurdata har prostaglandiner visat sig ha en viktig roll i endometrievaskulär permeabilitet, blastocystimplantation och decidualisering. I djurstudier resulterade administrering av prostaglandinsynteshämmare såsom naproxen i ökad förlust före och efter implantation. Prostaglandiner har också visat sig ha en viktig roll i fostrets njurutveckling. I publicerade djurstudier har prostaglandinsynteshämmare rapporterats försämra njurutvecklingen när de administreras i kliniskt relevanta doser.
Den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall för den eller de indikerade populationerna är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa utfall. I den allmänna befolkningen i USA är den uppskattade bakgrundsrisken för allvarliga fosterskador och missfall i kliniskt erkända graviditeter 2 % till 4 % respektive 15 % till 20 %.
Kliniska överväganden
Fetala/neonatala biverkningar
För tidig stängning av Fetal Ductus Arteriosus
Undvik användning av NSAID hos kvinnor vid cirka 30 veckors graviditet och senare under graviditeten, eftersom NSAID, inklusive NAPROSYN 500 mg tabletter, EC-NAPROSYN 250 mg och ANAPROX DS, kan orsaka för tidig stängning av fostergången arteriosus (se Data ).
Oligohydramnios/neonatal njurfunktionsnedsättning
Om ett NSAID är nödvändigt vid ungefär 20 veckors graviditet eller senare under graviditeten, begränsa användningen till lägsta effektiva dos och kortast möjliga varaktighet. Om behandlingen med NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS sträcker sig längre än 48 timmar, överväg att övervaka med ultraljud för oligohydramnios. Om oligohydramnios uppstår, avbryt behandlingen med NAPROSYN 250 mg tabletter, ECNAPROSYN 250 mg och ANAPROX DS och följ upp enligt klinisk praxis (se Data ).
Arbetskraft eller leverans
Det finns inga studier på effekterna av NAPROSYN tabletter, EC-NAPROSYN eller ANAPROX DS under förlossning eller förlossning. I djurstudier hämmar NSAID, inklusive naproxen, prostaglandinsyntesen, orsakar försenad förlossning och ökar förekomsten av dödfödsel.
Data
Mänskliga data
Det finns vissa bevis som tyder på att när hämmare av prostaglandinsyntes används för att fördröja för tidig förlossning, finns det en ökad risk för neonatala komplikationer såsom nekrotiserande enterokolit, patent ductus arteriosus och intrakraniell blödning. Naproxenbehandling som ges i slutet av graviditeten för att fördröja förlossningen har associerats med ihållande pulmonell hypertoni, njurdysfunktion och onormala prostaglandin E-nivåer hos för tidigt födda barn. På grund av de kända effekterna av icke-steroida antiinflammatoriska läkemedel på fostrets kardiovaskulära system (stängning av ductus arteriosus), bör användning under graviditet (särskilt från och med 30 veckors graviditet eller tredje trimestern) undvikas.
För tidig stängning av Fetal Ductus Arteriosus
Publicerad litteratur rapporterar att användning av NSAID vid cirka 30 veckors graviditet och senare i graviditeten kan orsaka för tidig stängning av fostergången arteriosus.
Oligohydramnios/neonatal njurfunktionsnedsättning
Publicerade studier och rapporter efter marknadsföring beskriver moderns NSAID-användning vid cirka 20 veckors graviditet eller senare under graviditeten i samband med fosterns njurfunktion som leder till oligohydramnios och i vissa fall neonatal njurfunktionsnedsättning. Dessa negativa utfall ses i genomsnitt efter dagar till veckors behandling, även om oligohydramnios sällan har rapporterats så snart som 48 timmar efter NSAID-start. I många fall, men inte alla, var minskningen av fostervatten övergående och reversibel när läkemedlet upphörde. Det har förekommit ett begränsat antal fallrapporter av maternell NSAID-användning och neonatal njurfunktion utan oligohydramnios, av vilka några var irreversibla. Vissa fall av neonatal njurdysfunktion krävde behandling med invasiva procedurer, såsom utbytestransfusion eller dialys.
Metodologiska begränsningar av dessa eftermarknadsföringsstudier och rapporter inkluderar bristen på en kontrollgrupp; begränsad information om dos, varaktighet och tidpunkt för läkemedelsexponering; och samtidig användning av andra läkemedel. Dessa begränsningar utesluter upprättande av en tillförlitlig uppskattning av risken för ogynnsamma foster- och neonatala utfall vid användning av moders NSAID. Eftersom de publicerade säkerhetsdata om neonatala resultat mestadels involverade prematura spädbarn, är generaliserbarheten av vissa rapporterade risker för fullgångna spädbarn som exponerats för NSAID genom modern användning osäker.
Djurdata
Reproduktionsstudier har utförts på råttor med 20 mg/kg/dag (0,13 gånger den maximala rekommenderade dagliga dosen för människor på 1500 mg/dag baserat på jämförelse av kroppsytan), kaniner med 20 mg/kg/dag (0,26 gånger den maximala rekommenderade dosen) mänsklig daglig dos, baserat på jämförelse av kroppsyta), och möss med 170 mg/kg/dag (0,6 gånger den maximala rekommenderade dagliga dosen för människor baserat på jämförelse av kroppsytan) utan tecken på nedsatt fertilitet eller fosterskada p.g.a. drogen.
Laktation
Risksammanfattning
Naproxenanjonen har hittats i mjölken hos ammande kvinnor i en koncentration motsvarande cirka 1 % av maximal naproxenkoncentration i plasma. Utvecklings- och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av NAPROSYN tabletter, EC-NAPROSYN 500mg eller ANAPROX DS och eventuella negativa effekter på det ammade barnet från NAPROSYN tabletter, EC-NAPROSYN, eller ANAPROX DS eller från det underliggande moderns tillståndet.
Kvinnor Och Hanar Av Reproduktionspotential
Infertilitet
Kvinnor
Baserat på verkningsmekanismen kan användningen av prostaglandinmedierade NSAID, inklusive NAPROSYN tabletter, ECNAPROSYN och ANAPROX DS, fördröja eller förhindra bristning av äggstocksfolliklar, vilket har associerats med reversibel infertilitet hos vissa kvinnor. Publicerade djurstudier har visat att administrering av prostaglandinsynteshämmare har potential att störa prostaglandinmedierad follikelruptur som krävs för ägglossning. Små studier på kvinnor som behandlats med NSAID har också visat en reversibel försening av ägglossningen. Överväg utsättande av NSAID, inklusive NAPROSYN tabletter, EC-NAPROSYN och ANAPROX DS, hos kvinnor som har svårt att bli gravida eller som genomgår utredning av infertilitet.
Pediatrisk användning
Säkerhet och effektivitet hos pediatriska patienter under 2 år har inte fastställts. Pediatriska doseringsrekommendationer för polyartikulär juvenil idiopatisk artrit baseras på välkontrollerade studier [se DOSERING OCH ADMINISTRERING ]. Det finns inga adekvata effektivitets- eller dos-responsdata för andra pediatriska tillstånd, men erfarenheten av polyartikulär juvenil idiopatisk artrit och annan användningserfarenhet har visat att engångsdoser på 2,5 till 5 mg/kg som naproxensuspension, med en total daglig dos som inte överstiger 15 mg/kg/dag, tolereras väl av pediatriska patienter över 2 år.
Geriatrisk användning
Lever- och njurtolerabiliteten av långtidsadministrering av naproxen studerades i två dubbelblinda kliniska prövningar med 586 patienter. Av de studerade patienterna var 98 patienter 65 år och äldre och 10 av de 98 patienterna var 75 år och äldre. NAPROXEN administrerades i doser på 375 mg två gånger dagligen eller 750 mg två gånger dagligen i upp till 6 månader. Övergående avvikelser i laboratorietester som utvärderade lever- och njurfunktion noterades hos vissa patienter, även om det inte noterades några skillnader i förekomsten av onormala värden mellan olika åldersgrupper.
Äldre patienter, jämfört med yngre patienter, löper större risk för NSAID-relaterade allvarliga kardiovaskulära, gastrointestinala och/eller renala biverkningar. Om den förväntade fördelen för den äldre patienten uppväger dessa potentiella risker, börja doseringen i den nedre delen av doseringsintervallet och övervaka patienterna för biverkningar [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Studier indikerar att även om den totala plasmakoncentrationen av naproxen är oförändrad, ökar den obundna plasmafraktionen av naproxen hos äldre. Den kliniska betydelsen av detta fynd är oklar, även om det är möjligt att ökningen av koncentrationen av fritt naproxen kan vara associerad med en ökning av frekvensen av biverkningar per given dos hos vissa äldre patienter. Försiktighet tillråds när höga doser krävs och viss dosjustering kan behövas hos äldre patienter. Som med andra läkemedel som används för äldre är det klokt att använda den lägsta effektiva dosen.
Erfarenhet tyder på att geriatriska patienter kan vara särskilt känsliga för vissa biverkningar av icke-steroida antiinflammatoriska läkemedel. Äldre eller försvagade patienter verkar tolerera magsår eller blödning mindre bra när dessa händelser inträffar. De flesta spontana rapporter om dödliga GI-händelser finns i den geriatriska befolkningen [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Det är känt att naproxen utsöndras till stor del via njurarna, och risken för toxiska reaktioner på detta läkemedel kan vara större hos patienter med nedsatt njurfunktion. Eftersom äldre patienter är mer benägna att ha nedsatt njurfunktion, bör man vara försiktig vid val av dos, och det kan vara användbart att övervaka njurfunktionen [se KLINISK FARMAKOLOGI ]. Geriatriska patienter kan löpa en större risk för utveckling av en form av njurtoxicitet som utlöses av minskad prostaglandinbildning under administrering av icke-steroida antiinflammatoriska läkemedel [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Nedsatt leverfunktion
Försiktighet tillråds när höga doser krävs och viss dosjustering kan behövas hos dessa patienter. Det är klokt att använda den lägsta effektiva dosen [se KLINISK FARMAKOLOGI ].
Nedsatt njurfunktion
Naproxen-innehållande produkter rekommenderas inte för användning till patienter med måttligt till svårt och gravt nedsatt njurfunktion (kreatininclearance VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER , KLINISK FARMAKOLOGI ].
ÖVERDOS
Symtom efter akuta NSAID-överdoseringar har vanligtvis begränsats till slöhet, dåsighet, illamående, kräkningar och epigastrisk smärta, som i allmänhet har varit reversibla med stödbehandling. Gastrointestinal blödning har inträffat. Hypertoni, akut njursvikt, andningsdepression och koma har förekommit, men var sällsynta [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].Eftersom naproxennatrium kan absorberas snabbt, bör höga och tidiga blodnivåer förutses.
Ett fåtal patienter har upplevt kramper, men det är inte klart om dessa var läkemedelsrelaterade eller inte. Det är inte känt vilken dos av drogen som skulle vara livshotande. [ser VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Hantera patienter med symtomatisk och stödjande vård efter en överdosering av NSAID. Det finns inga specifika motgift.
Överväg kräkning och/eller aktivt kol (60 till 100 gram hos vuxna, 1 till 2 gram per kg kroppsvikt hos pediatriska patienter) och/eller osmotisk katartisk hos symtomatiska patienter som ses inom fyra timmar efter intag eller hos patienter med en stor överdosering ( 5 till 10 gånger den rekommenderade dosen). Påtvingad diures, alkalinisering av urin, hemodialys eller hemoperfusion kanske inte är användbara på grund av hög proteinbindning.
För ytterligare information om överdoseringsbehandling kontakta en giftkontrollcentral (1-800-222-1222).
KONTRAINDIKATIONER
NAPROSYN 500 mg tabletter, EC-NAPROSYN och ANAPROX DS är kontraindicerade hos följande patienter:
- Känd överkänslighet (t.ex. anafylaktiska reaktioner och allvarliga hudreaktioner) mot naproxen eller någon del av läkemedelsprodukten [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- Anamnes med astma, urtikaria eller andra reaktioner av allergisk typ efter att ha tagit acetylsalicylsyra eller andra NSAID. Allvarliga, ibland dödliga, anafylaktiska reaktioner på NSAID har rapporterats hos sådana patienter [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
- I samband med kranskärlsbypassoperation (CABG) [se VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ]
KLINISK FARMAKOLOGI
Handlingsmekanism
Naproxen har smärtstillande, antiinflammatoriska och febernedsättande egenskaper. ANAPROX DS (naproxennatrium) har utvecklats som en snabbare absorberad formulering av naproxen för användning som analgetikum.
Verkningsmekanismen för naproxen, liksom andra NSAID, är inte helt klarlagd men involverar hämning av cyklooxygenas (COX-1 och COX-2).
Naproxen är en potent hämmare av prostaglandinsyntes in vitro. Naproxenkoncentrationer som uppnåtts under behandlingen har gett in vivo-effekter. Prostaglandiner sensibiliserar afferenta nerver och potentierar verkan av bradykinin för att inducera smärta i djurmodeller. Prostaglandiner är mediatorer av inflammation. Eftersom naproxen är en hämmare av prostaglandinsyntes, kan dess verkningsmekanism bero på en minskning av prostaglandiner i perifera vävnader.
Farmakodynamik
en studie med friska frivilliga visade 10 dagars samtidig administrering av naproxen 220 mg en gång dagligen med lågdos acetylsalicylsyra med omedelbar frisättning (81 mg) en interaktion med den trombocythämmande aktiviteten hos aspirin mätt som % serumtromboxan B2-hämning efter 24 timmar efter dag 10-dosen [98,7 % (enbart acetylsalicylsyra) mot 93,1 % (naproxen och aspirin)]. Interaktionen observerades även efter utsättning av naproxen på dag 11 (medan aspirindosen fortsatte) men normaliserades till dag 13. I samma studie var interaktionen större när naproxen administrerades 30 minuter före aspirin [98,7% vs 87,7%] och minimal när acetylsalicylsyra administrerades 30 minuter före naproxen [98,7 % vs 95,4 %].
Efter administrering av naproxen 220 mg två gånger dagligen med lågdos acetylsalicylsyra med omedelbar frisättning (första dosen av naproxen gavs 30 minuter före aspirin), var interaktionen minimal 24 timmar efter dos dag 10 [98,7 % vs 95,7 %]. Interaktionen var dock mer framträdande efter utsättning av naproxen (uttvättning) på dag 11 [98,7 % vs 84,3 %] och normaliserades inte helt på dag 13 [98,5 % vs 90,7 %]. [ser LÄKEMEDELSINTERAKTIONER ].
Farmakokinetik
Naproxen och naproxennatrium absorberas snabbt och fullständigt från mag-tarmkanalen med en biotillgänglighet in vivo på 95 %. De olika doseringsformerna av NAPROSYN 250 mg är bioekvivalenta vad gäller absorptionsgrad (AUC) och toppkoncentration (Cmax); dock skiljer sig produkterna åt i deras absorptionsmönster. Dessa skillnader mellan naproxenprodukter är relaterade till både den kemiska formen av naproxen som används och dess formulering. Även med de observerade skillnaderna i absorptionsmönster är eliminationshalveringstiden för naproxen oförändrad för produkter som sträcker sig från 12 till 17 timmar. Steady-state-nivåer av naproxen uppnås inom 4 till 5 dagar, och graden av naproxenackumulering överensstämmer med denna halveringstid. Detta tyder på att skillnaderna i frisättningsmönster endast spelar en försumbar roll för uppnåendet av steady-state plasmanivåer.
Absorption
NAPROSYN Tabletter/ANAPROX DS
Efter administrering av NAPROSYN 500 mg tabletter uppnås maximala plasmanivåer inom 2 till 4 timmar. Efter oral administrering av ANAPROX DS uppnås maximala plasmanivåer inom 1 till 2 timmar. Skillnaden i hastigheter mellan de två produkterna beror på den ökade vattenlösligheten av natriumsaltet av naproxen som används i ANAPROX DS.
EC-NAPROSYN
EC-NAPROSYN är designad med en pH-känslig beläggning för att ge en barriär mot sönderfall i den sura miljön i magen och för att förlora integritet i den mer neutrala miljön i tunntarmen. Den enteriska polymerbeläggningen som valts för EC-NAPROSYN 250 mg löser sig över pH 6. När EC-NAPROSYN gavs till fastande personer uppnåddes maximala plasmanivåer cirka 4 till 6 timmar efter den första dosen (intervall: 2 till 12 timmar). En in vivo-studie på människa med radioaktivt märkta EC-NAPROSYN 250 mg tabletter visade att EC-NAPROSYN löses huvudsakligen i tunntarmen snarare än i magsäcken, så absorptionen av läkemedlet fördröjs tills magsäcken töms.
När EC-NAPROSYN och NAPROSYN 500 mg tabletter gavs till fastande personer (n=24) i en crossover-studie efter 1 veckas dosering, observerades skillnader i tid till maximala plasmanivåer (Tmax), men det fanns inga skillnader i total absorption som mätt med Cmax och AUC:
Antacida effekter
När EC-NAPROSYN 250 mg gavs som en engångsdos med antacida (54 mEq buffrande kapacitet) var toppplasmanivåerna av naproxen oförändrade, men tiden till topp reducerades (medelvärde Tmax fastade 5,6 timmar, medel Tmax med antacida 5 timmar) , även om det inte är väsentligt [se LÄKEMEDELSINTERAKTIONER ].
Mateffekter
När EC-NAPROSYN 500 mg gavs som engångsdos tillsammans med mat, uppnåddes maximala plasmanivåer hos de flesta försökspersoner inom cirka 12 timmar (intervall: 4 till 24 timmar). Uppehållstid i tunntarmen fram till sönderfall var oberoende av födointag. Närvaron av föda förlängde tiden tabletterna låg kvar i magsäcken, tiden till första detekterbara naproxennivåerna i serum och tiden till maximala naproxennivåer (Tmax), men påverkade inte maximala naproxennivåer (Cmax).
Distribution
Naproxen har en distributionsvolym på 0,16 l/kg. Vid terapeutiska nivåer är naproxen mer än 99 % albuminbundet. Vid doser av naproxen som är större än 500 mg/dag är det mindre än proportionell ökning av plasmanivåerna på grund av en ökning av clearance orsakad av mättnad av plasmaproteinbindning vid högre doser (genomsnittlig dal Css 36,5, 49,2 och 56,4 mg/L med 500, 1000 och 1500 mg dagliga doser av naproxen, respektive). Naproxenanjonen har hittats i mjölken hos ammande kvinnor i en koncentration motsvarande cirka 1 % av maximal naproxenkoncentration i plasma [se Användning i specifika populationer ].
Eliminering
Ämnesomsättning
Naproxen metaboliseras i stor utsträckning i levern till 6-0-desmetylnaproxen, och både förälder och metaboliter inducerar inte metaboliserande enzymer. Både naproxen och 6-0-desmetylnaproxen metaboliseras vidare till sina respektive acylglukuronidkonjugerade metaboliter.
Exkretion
Clearance av naproxen är 0,13 ml/min/kg. Ungefär 95 % av naproxenet från alla doser utsöndras i urinen, främst som naproxen ( VARNINGAR OCH FÖRSIKTIGHETSÅTGÄRDER ].
Specifika populationer
Pediatrisk
Hos pediatriska patienter i åldern 5 till 16 år med artrit, plasmanivåer av naproxen efter en 5 mg/kg engångsdos av naproxensuspension [se DOSERING OCH ADMINISTRERING visade sig vara liknande de som finns hos normala vuxna efter en dos på 500 mg. Den terminala halveringstiden verkar vara liknande hos pediatriska och vuxna patienter. Farmakokinetiska studier av naproxen har inte utförts på pediatriska patienter yngre än 5 år. Farmakokinetiska parametrar verkar vara liknande efter administrering av naproxensuspension eller tabletter till pediatriska patienter.
Geriatrisk
Studier indikerar att även om den totala plasmakoncentrationen av naproxen är oförändrad, ökar den obundna plasmafraktionen av naproxen hos äldre, även om den obundna fraktionen är
Nedsatt leverfunktion
Naproxens farmakokinetik har inte fastställts hos patienter med leverinsufficiens.
Kronisk alkoholisk leversjukdom och troligen andra sjukdomar med minskade eller onormala plasmaproteiner (albumin) minskar den totala plasmakoncentrationen av naproxen, men plasmakoncentrationen av obundet naproxen ökar.
Nedsatt njurfunktion
Naproxens farmakokinetik har inte fastställts hos patienter med njurinsufficiens. Med tanke på att naproxen, dess metaboliter och konjugat primärt utsöndras via njurarna, finns det en potential för naproxenmetaboliter att ackumuleras i närvaro av njurinsufficiens. Eliminationen av naproxen minskar hos patienter med gravt nedsatt njurfunktion.
Läkemedelsinteraktionsstudier
Aspirin
När NSAID administrerades med acetylsalicylsyra reducerades proteinbindningen av NSAID, även om clearance av fritt NSAID inte förändrades. Den kliniska betydelsen av denna interaktion är inte känd. Se tabell 1 för kliniskt signifikanta läkemedelsinteraktioner mellan NSAID och acetylsalicylsyra [se LÄKEMEDELSINTERAKTIONER ].
Kliniska studier
Naproxen har studerats hos patienter med reumatoid artrit, artros, polyartikulär juvenil idiopatisk artrit, ankyloserande spondylit, tendinit och bursit samt akut gikt. Förbättring hos patienter som behandlats för reumatoid artrit visades genom en minskning av ledsvullnad, en minskning av varaktigheten av morgonstelhet, en minskning av sjukdomsaktiviteten som bedömts av både utredaren och patienten, och genom ökad rörlighet som visades genom en minskning av gångtiden . Generellt sett har svaret på naproxen inte visat sig vara beroende av ålder, kön, svårighetsgrad eller varaktighet av reumatoid artrit.
Hos patienter med artros har den terapeutiska effekten av naproxen visats genom en minskning av ledsmärta eller ömhet, ett ökat rörelseomfång i knälederna, ökad rörlighet som visas genom en minskning av gångtiden och förbättring av förmågan att utföra aktiviteter av det dagliga livet försämrats av sjukdomen.
en klinisk prövning som jämförde standardformuleringar av naproxen 375 mg två gånger om dagen (750 mg per dag) mot 750 mg två gånger om dagen (1500 mg/dag), avslutade 9 patienter i 750 mg-gruppen i förtid på grund av biverkningar. Nitton patienter i 1500 mg-gruppen avslutade i förtid på grund av biverkningar. De flesta av dessa biverkningar var gastrointestinala händelser.
I kliniska studier på patienter med reumatoid artrit, artros och polyartikulär juvenil idiopatisk artrit har naproxen visats vara jämförbar med acetylsalicylsyra och indometacin när det gäller att kontrollera ovannämnda mått på sjukdomsaktivitet, men frekvensen och svårighetsgraden av de mildare gastrointestinala biverkningarna (nausebiverkningar). , dyspepsi, halsbränna) och biverkningar på nervsystemet (tinnitus, yrsel, yrsel) var mindre hos naproxenbehandlade patienter än hos de som behandlades med aspirin eller indometacin.
Hos patienter med ankyloserande spondylit har naproxen visat sig minska nattsmärta, morgonstelhet och smärta i vila. I dubbelblinda studier visades läkemedlet vara lika effektivt som aspirin, men med färre biverkningar.
Hos patienter med akut gikt visades ett gynnsamt svar på naproxen genom att signifikant eliminera inflammatoriska förändringar (t.ex. minskning av svullnad, värme) inom 24 till 48 timmar, samt genom lindring av smärta och ömhet.
Naproxen har studerats hos patienter med mild till måttlig smärta sekundär till postoperativ, ortopedisk, postpartum episiotomi och livmoderkontraktionssmärta och dysmenorré. Smärtlindring kan börja inom 1 timme hos patienter som tar naproxen och inom 30 minuter hos patienter som tar naproxennatrium. Analgetisk effekt visades genom sådana åtgärder som minskning av smärtintensitetspoäng, ökning av smärtlindringspoäng, minskning av antalet patienter som behövde ytterligare smärtstillande medicinering och fördröjning i tid till remedicinering. Den smärtstillande effekten har visat sig vara i upp till 12 timmar.
Naproxen kan användas säkert i kombination med guldsalter och/eller kortikosteroider; I kontrollerade kliniska prövningar verkade det dock inte ge någon större förbättring jämfört med enbart kortikosteroider, när det lades till regimen för patienter som fick kortikosteroider. Huruvida naproxen har en "steroidbesparande" effekt har inte studerats tillräckligt. När naproxen lades till behandlingen för patienter som fick guldsalter, resulterade naproxen i en större förbättring. Dess användning i kombination med salicylater rekommenderas inte eftersom det finns bevis för att acetylsalicylsyra ökar utsöndringshastigheten av naproxen och data är otillräckliga för att visa att naproxen och acetylsalicylsyra ger större förbättring jämfört med den som uppnås med enbart acetylsalicylsyra. Dessutom, som med andra NSAID, kan kombinationen resultera i högre frekvens av biverkningar än vad som visats för endera produkten ensam.
51Cr blodförlust- och gastroskopistudier med normala frivilliga har daglig administrering av 1000 mg naproxen som 1000 mg NAPROSYN (naproxen) eller 1100 mg ANAPROX DS (naproxennatrium) visat sig orsaka statistiskt signifikant mindre magblödning än 3250 mg aspirin.
Tre 6-veckors, dubbelblinda, multicenterstudier med EC-NAPROSYN (naproxen) (375 eller 500 mg två gånger om dagen, n=385) och NAPROSYN (375 eller 500 mg två gånger om dagen, n=279) genomfördes för att jämföra EC -NAPROSYN med NAPROSYN, inklusive 355 patienter med reumatoid artrit och artros som nyligen haft NSAID-relaterade GI-symtom. Dessa studier visade att EC-NAPROSYN och NAPROSYN 500 mg inte visade några signifikanta skillnader i effekt eller säkerhet och hade liknande prevalens av mindre gastrointestinala besvär. Enskilda patienter kan dock hitta en formulering att föredra framför den andra.
Femhundrafemtiotre patienter fick EC-NAPROSYN under långvariga öppna prövningar (medelbehandlingslängden var 159 dagar). Frekvensen för kliniskt diagnostiserade magsår och gastrointestinala blödningar liknade vad som historiskt har rapporterats för långvarig användning av NSAID.
PATIENTINFORMATION
Läkemedelsguide för icke-steroida antiinflammatoriska läkemedel (NSAID)
Vilken är den viktigaste informationen jag borde veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?
NSAID kan orsaka allvarliga biverkningar, inklusive:
- Ökad risk för hjärtinfarkt eller stroke som kan leda till döden. Denna risk kan inträffa tidigt i behandlingen och kan öka:
- med ökande doser av NSAID
- med längre användning av NSAID
Ta inte NSAID precis före eller efter en hjärtoperation som kallas "kransartär bypassgraft (CABG)."
Undvik att ta NSAID efter en nyligen inträffad hjärtinfarkt, såvida inte din läkare säger åt dig att göra det. Du kan ha en ökad risk för en ny hjärtinfarkt om du tar NSAID-preparat efter en nyligen genomförd hjärtinfarkt.
- Ökad risk för blödningar, sår och revor (perforering) i matstrupen (rör som leder från munnen till magen), mage och tarmar:
- när som helst under användning
- utan varningssymtom
- som kan orsaka dödsfall
Risken för att få ett sår eller blödning ökar med:
- tidigare anamnes på magsår, eller blödning från magen eller tarmen vid användning av NSAID
- tar läkemedel som kallas "kortikosteroider", "antikoagulantia", "SSRI" eller "SNRI"
- ökande doser av NSAID
- längre användning av NSAID
- rökning
- dricker alkohol
- äldre ålder
- dålig hälsa
- avancerad leversjukdom
- blödningsproblem
NSAID bör endast användas:
- precis som föreskrivet
- vid lägsta möjliga dos för din behandling
- för den kortaste tiden som behövs
Vad är NSAID?
NSAID används för att behandla smärta och rodnad, svullnad och värme (inflammation) från medicinska tillstånd som olika typer av artrit, mensvärk och andra typer av kortvarig smärta.
Vem bör inte ta NSAID?
Ta inte NSAID:
- om du har haft en astmaanfall, nässelfeber eller annan allergisk reaktion med acetylsalicylsyra eller andra NSAID-preparat.
- precis före eller efter bypassoperation.
Innan du tar NSAID, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
- har lever- eller njurproblem
- har högt blodtryck
- har astma
- är gravid eller planerar att bli gravid. Om du tar NSAID vid ungefär 20 veckors graviditet eller senare kan det skada ditt ofödda barn. Om du behöver ta NSAID i mer än 2 dagar när du är mellan 20 och 30 veckor av graviditeten, kan din läkare behöva övervaka mängden vätska i livmodern runt ditt barn. Du ska inte ta NSAID efter cirka 30 veckors graviditet.
- ammar eller planerar att amma.
Berätta för din vårdgivare om alla mediciner du tar, inklusive receptbelagda eller receptfria läkemedel, vitaminer eller växtbaserade kosttillskott. NSAID och vissa andra läkemedel kan interagera med varandra och orsaka allvarliga biverkningar. Börja inte ta något nytt läkemedel utan att först prata med din läkare.
Vilka är de möjliga biverkningarna av NSAID?
NSAID kan orsaka allvarliga biverkningar, inklusive:
Se "Vad är den viktigaste informationen jag borde veta om läkemedel som kallas icke-steroida antiinflammatoriska läkemedel (NSAID)?"
- nytt eller värre högt blodtryck
- hjärtsvikt
- leverproblem inklusive leversvikt
- njurproblem inklusive njursvikt
- låga röda blodkroppar (anemi)
- livshotande hudreaktioner
- livshotande allergiska reaktioner
Andra biverkningar av NSAID inkluderar: magsmärtor, förstoppning, diarré, gaser, halsbränna, illamående, kräkningar och yrsel. Få akut hjälp omedelbart om du får något av följande symtom:
- andnöd eller andningssvårigheter
- bröstsmärta
- svaghet i en del eller sida av din kropp
- sluddrigt tal
- svullnad i ansikte eller hals
Sluta ta ditt NSAID och ring din vårdgivare omedelbart om du får något av följande symtom:
- illamående
- tröttare eller svagare än vanligt
- diarre
- klåda
- din hud eller ögon ser gula ut
- matsmältningsbesvär eller magsmärtor
- influensaliknande symtom
- spy blod
- det finns blod i din tarmrörelse eller så är det svart och klibbigt som tjära
- ovanlig viktökning
- hudutslag eller blåsor med feber
- svullnad av armar, ben, händer och fötter
Om du tar för mycket av ditt NSAID, ring din vårdgivare eller få medicinsk hjälp omedelbart.
Dessa är inte alla möjliga biverkningar av NSAID. För mer information, fråga din vårdgivare eller apotekspersonal om NSAID.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
Annan information om NSAID
- Aspirin är ett NSAID men det ökar inte risken för hjärtinfarkt. Aspirin kan orsaka blödningar i hjärnan, magen och tarmarna. Aspirin kan också orsaka sår i magen och tarmarna.
- Vissa NSAID-preparat säljs i lägre doser utan recept (receptfria). Prata med din vårdgivare innan du använder receptfria NSAIDs i mer än 10 dagar.
Allmän information om säker och effektiv användning av NSAID
Läkemedel skrivs ibland ut för andra ändamål än de som anges i en läkemedelsguide. Använd inte NSAID för ett tillstånd som det inte ordinerats för. Ge inte NSAID till andra människor, även om de har samma symtom som du har. Det kan skada dem.
Om du vill ha mer information om NSAID, prata med din vårdgivare. Du kan fråga din apotekspersonal eller vårdgivare om information om NSAID som är skriven för vårdpersonal.
Denna medicineringsguide har godkänts av US Food and Drug Administration.
